Синдром позвоночной артерии. / Статьи / «Авиценна» в Волгограде
16/11/20
Синдром позвоночной артерии.
Синдром позвоночной артерии – это целый комплекс симптомов, которые возникают при нарушении кровотока по позвоночным артериям.
Разберемся почему это может произойти. Для понимания стоит вспомнить анатомию. Кровоснабжение головного мозга осуществляется парными сосудами общей сонной и позвоночной артериями. Диаметр общей сонной артерии в два раза больше диаметра позвоночной . Очевидно, что основной кровоток головного мозга обеспечивается общей сонной артерией и его нарушение приводит к серьезным сосудистым катастрофам, в частности к инфаркту мозга. Вклад позвоночной артерии в обеспечение кровоснабжения головного мозга более «скромный», но, несмотря на это, именно патология позвоночной артерии чаще всего заставляет пациентов обращаться к врачу с жалобами. Позвоночные артерии берут свое начало от подключичных артерий в грудной полости и проходят к головному мозгу через канал, образованный поперечными отростками шейных позвонков .
Кровоснабжает позвоночная артерия продолговатый мозг, шейный отдел спинного мозга и мозжечок. Эти отделы отвечают за координацию, равновесие, мышечный тонус, регуляцию сосудистого тонуса, дыхания и обмена веществ, и иннервацию верхних конечностей .
Несмотря на то, что по данным литературы наиболее частая причина поражения позвоночной артерии это атросклероз, в последние годы все чаще диагностируется синдром позвоночной артерии у лиц, не достигших периода атеросклеротических изменений в сосудах.
Увеличилась частота обнаружения особенностей анатомического строения, аномалии хода, патологических изгибов или врожденной узости просвета сосуда, так называемой гипоплазии.
Важной, и не всегда устранимой причиной может стать компрессия сосуда извне.
 Чаще всего это связано с остеохондрозом шейного отдела позвоночника, травмами, аномалиями строения позвонков , сколиозом.
Чаще всего это связано с остеохондрозом шейного отдела позвоночника, травмами, аномалиями строения позвонков , сколиозом.В случае сочетания нескольких факторов, риск развития синдрома позвоночной артерии выше.
Все основные симптомы связаны с недостатком кровоснабжения соответствующих областей нервной системы . Характерно, что симптомы зависят от движений головы и как правило усиливаются при длительном вынужденном положении головы или резких поворотах и наклонах. Частой жалобой является головная боль ноющего или пульсирующего характера в области затылка и висков . Очень характерной жалобой является головокружение. Оно описывается пациентами по разному, от легкой неустойчивости при ходьбе, до ощущения вращения тела, сопровождается потемнением в глазах и шумом в ушах. Шум в ушах ( тиннитус) может быть и самостоятельным симптомом, независимым от наличия головокружения.
 Именно поэтому, обе позвоночные артерии объединены между собой базилярной артерией. И в случае нарушения кровотока по одной позвоночной артерии компенсация обеспечивается парной артерией. Несмотря на это, бывают ситуации, когда этот механизм оказывается недостаточным и происходит стойкое нарушение кровообращения. Симптомы в этом случае носят не приходящий характер, а становятся постоянными и влияют на качество жизни и здоровье. В случае острого возникшего нарушения кровотока по артериям, система компенсации не срабатывает и может развиваться инфаркт ( ишемический инсульт) в кровоснабжаемой области.
Именно поэтому, обе позвоночные артерии объединены между собой базилярной артерией. И в случае нарушения кровотока по одной позвоночной артерии компенсация обеспечивается парной артерией. Несмотря на это, бывают ситуации, когда этот механизм оказывается недостаточным и происходит стойкое нарушение кровообращения. Симптомы в этом случае носят не приходящий характер, а становятся постоянными и влияют на качество жизни и здоровье. В случае острого возникшего нарушения кровотока по артериям, система компенсации не срабатывает и может развиваться инфаркт ( ишемический инсульт) в кровоснабжаемой области. Нарушение кровоснабжения в бассейне позвоночных артерий сопровождается и вегетативныеми проявлениями – чувство жара, потливость, гипергидроз ладоней ( влажные руки) который часто сопровождается жалобой на холодные ладони.
Диагностика данного синдрома на сегодняшний день не представляет больших технических трудностей. Ультразвуковое дуплексное сканирование позволяет не только увидеть ход сосуда, вовремя диагностировать аномалии строения, но и оценить скорость кровотока внутри просвета сосуда, наличие холестериновых бляшек и степень их стабильности, а соответственно оценить риск инсульта.
 По результатам ультразвукового исследования можно предположить наличие компрессии на сосуды извне, например при остеохондрозе, и вовремя провести дополнительные исследования- ренгенографию или МРТ , КТ шейного отдела позвоночника.
По результатам ультразвукового исследования можно предположить наличие компрессии на сосуды извне, например при остеохондрозе, и вовремя провести дополнительные исследования- ренгенографию или МРТ , КТ шейного отдела позвоночника.К лечению данного синдрома нужно подходить комплексно. Первое это устранить причины на которые мы можем повлиять- лечение остеохондроза , коррекция осанки. В этой ситуации все зависит от дисциплины и настойчивости пациента. В случае аномального строения сосуда или патологической извитости необходима помощь сосудистых хирургов. В целом, задача медикаментозного лечения состоит в том, что бы улучшить кровоток по сосудам и повысить устойчивость тканей к недостатку питания. Универсальных схем лечения не существует. Врач подбирает терапию исходя из симптомов, причин, вызвавших развитие данного синдрома, а так же возраста, сопутствующей патологии и даже рода деятельности пациента.
 В современном мире мы почти все проводим большое количество времени за компьютерами, нагружая шейный отдел. Делайте паузы, занимайтесь физкультурой, проявляйте заботу о себе!
В современном мире мы почти все проводим большое количество времени за компьютерами, нагружая шейный отдел. Делайте паузы, занимайтесь физкультурой, проявляйте заботу о себе!С уважением, Сарычева Татьяна
Особенности строения сосудов головного мозга у лиц, умерших от разрыва аневризмы мозговых артерий | Трушель
1. Габашвили В. М., Прохорова Э. С., Шакаришвили Р. Р. Эпилептические припадки при сосудистых заболеваниях головного мозга. Тбилиси: Мецниереба; 1986: 337.
2. Гузева В. И. Эпилепсия и неэпилептические пароксизмальные состояния у детей. М.: ООО Мед. информ. агентство; 2007: 568.
3. Куртусунов Б. Т. Структурные преобразования вертебро-базилярной системы в процессе старения. Журнал теоретической и практической медицины.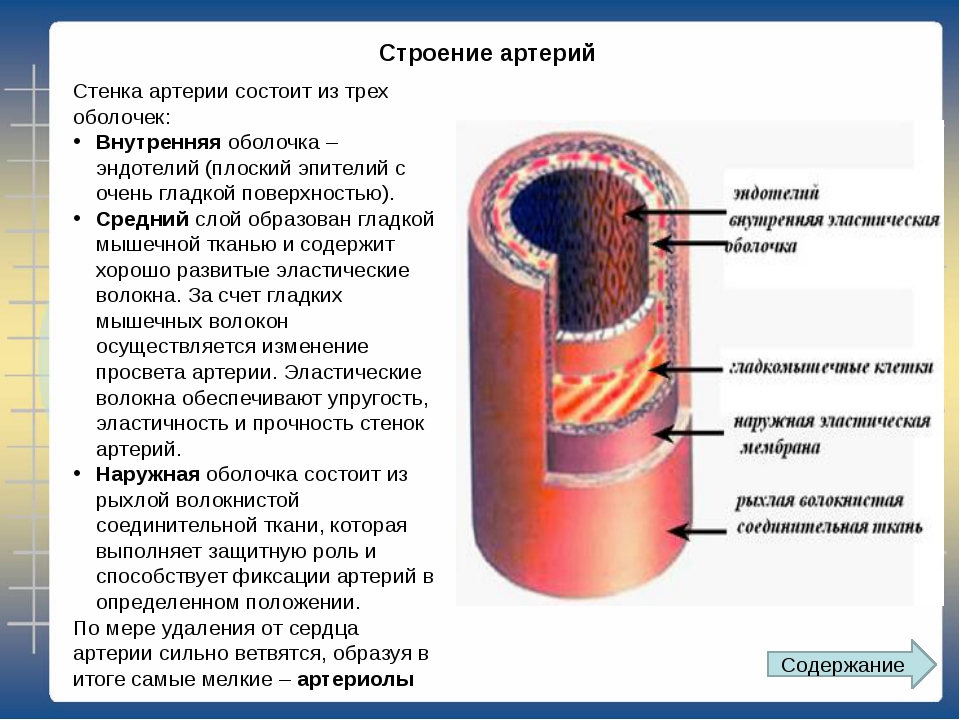 2010; 8: 140–141.
2010; 8: 140–141.
5. Маркин С. П., Горбунов A. B. Частота задней трифуркации внутренней сонной артерии у больных цереброваскулярными заболеваниями. IX Всероссийский съезд неврологов. Ярославль; 2006: 439.
6. Сидорович Р. Р., Сельский М. С., Пархач Л. П., Змачинская О. Л. Современные подходы к диагностике, профилактике и лечению сосудистого спазма при аневризматическом субарахноидальном кровоизлиянии. Актуальные проблемы неврологии и нейрохирургии: сб. науч. тр. Минск. 2014; 17: 200–209.
7. Трушель Н. А.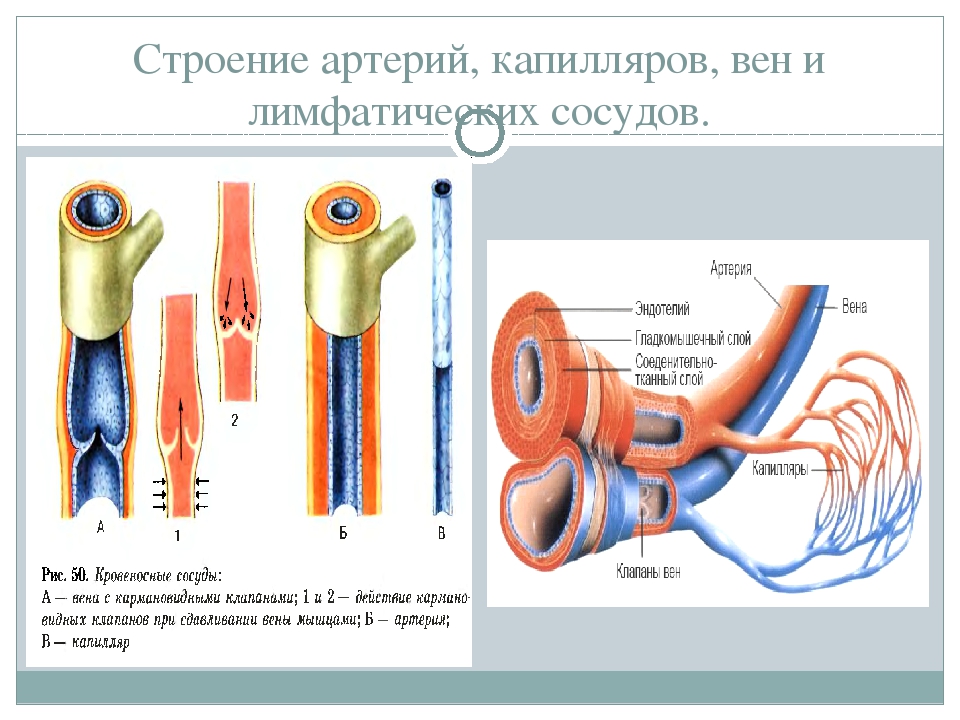 , Пивченко П. Г. Роль морфологического и гемодинамического факторов в атерогенезе сосудов виллизиева круга. Минск: БГМУ; 2013: 180.
, Пивченко П. Г. Роль морфологического и гемодинамического факторов в атерогенезе сосудов виллизиева круга. Минск: БГМУ; 2013: 180.
8. Фомкина О. А. Морфология внутричерепных частей позвоночных, базилярных и задних мозговых артерий у взрослых людей различного возраста и пола : автореф. дис. … канд. мед. наук. Волгоград; 2006: 31.
9. Цвибель В. Д., Пеллерито Д. С.Ультразвуковое исследование сосудов. М.: Видар; 2008: 646.
10. Acilan C., Serhatli M., Kacar O., Adiguzel Z., Tuncer A., Hayran M., Baysal K. Smooth muscle cells isolated from thoracic aortic aneurysms exhibit increased genomic damage, but similar tendency for apoptosis. DNA Cell Biol. 2012; 31(10): 1523–1534.
11. Bisaria K.
12. Cassot F., Vergeur V., Bossuet P., Hillen B., Zagzoule M., Marc-Vergnes J. P. Effects of anterior communicating artery diameter on cerebral hemodynamics in internal carotid artery disease. A model study. Circulation. 1995; 92(10): 3122– 3131.
13. Chen X. L., Zhang Q., Zhao R., Medford R. M. Superoxide h3O2, and iron are required for TNFalpha-induced MCP-1 gene expression in endothelial cells role of Rac1 and NADPH oxidase. Am J Physiol Heart Circ Physiol. 2004; 286(3). h2001– h2007.
14. Juric V., Chen C. C., Lau L. F. TNF alpha-induced apoptosis enabled by CCN1/CYR61: pathways of reactive oxygen species generation and cytochrome c release.
15. Kanematsu Y., Kanematsu M., Kurihara C., Tada Y., Tsou T. L., van Rooijen N., Lawton M. T., Young W. L., Liang E. I., Nuki Y., Hashimoto T. Critical roles of macrophages in the formation of intracranial aneurysm. Stroke. 2011; 42(1): 173– 178.
16. McCormick M. L., Gavrila D., Weintraub N. L. Role of oxidative stress in the pathogenesis of abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 2007; 27(3): 461–469.
17. Nixon A. M., Gunel M., Sumpio B. E. The critical role of hemodynamics in the development of cerebral vascular disease. J. Neurosurg. 2010; 112(6): 1240–1253.
18. Sforza D. M., Putman C. M., Cebral J. R. Hemodynamics of Cerebral Aneurysms. Annu. Fluid Mech. 2009; 41(1): 91–107.
Annu. Fluid Mech. 2009; 41(1): 91–107.
19. Starke R. M., Chalouhi N., Ali M. S., Jabbour P. M., Tjoumakaris S. I., Gonzalez L. F., Rosenwasser R. H, Koch W. J., Dumont A. S. The Role of Oxidative Stress in Cerebral Aneurysm Formation and Rupture. Curr Neurovasc Res. 2013; 10 (3): 247–255.
20. Tateshima S., Omura H., Villablanca J. P., Vinuela F. Intra-aneurysmal hemodynamics during the growth of an unruptured aneurysm: in vitro study using longitudinal CT angiogram database. Am. J. Neiroradiol. 2007; 28: 622–627.
21. Thomas S., Rich M. W. Epidemiology, pathophysiology, and prognosis of heart failure in the elderly. Heart Fail. Clin. 2007; 3(4): 381 – 387.
Кровоснабжение глаз
Нормальная работа глаза требует постоянного и достаточного кровоснабжения.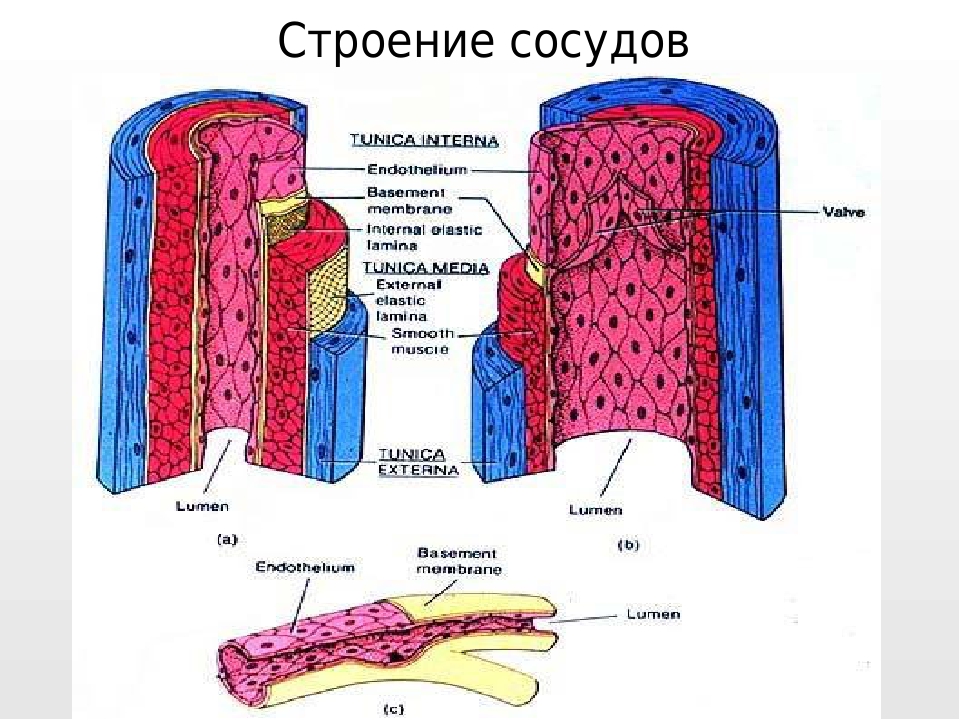 С кровотоком сюда приносятся питательные вещества и кислород, необходимые для работы клеток, в особенности, для нервной ткани, из которой и состоит сетчатка глаза.
С кровотоком сюда приносятся питательные вещества и кислород, необходимые для работы клеток, в особенности, для нервной ткани, из которой и состоит сетчатка глаза.
Любые нарушения кровообращения глазных яблок немедленно ведут к нарушению их функционирования, поэтому глаза снабжены богатой, разветвленной сетью кровеносных сосудов, которые обеспечивают работу и питание всех его тканей.
Поступление крови к глазному яблоку осуществляется основной магистралью внутренней сонной артерии, которой является глазная артерия, питающая глаз и вспомогательный его аппарат. Питание тканей непосредственно обеспечивает сеть капиллярных сосудов. При этом наибольшая значимость отводится сосудам, питающим сетчатку глаза совместно со зрительным нервом: центральной артерии сетчатки и задним коротким цилиарным артериям. Нарушение в них кровотока может привести к снижению зрения, вплоть до абсолютной слепоты.
Глазная венозная сеть полностью повторяет строение артерий. Особенность глазных вен — отсутствие в них клапанов, которые ограничивают обратный ток крови и соединения венозной сети лица, вен глазницы, и далее, головного мозга. Соответственно, гнойные воспалительные процессы, возникшие на лице, могут по венозному кровотоку распространяться в направлении головного мозга, что потенциально опасно для жизни.
Соответственно, гнойные воспалительные процессы, возникшие на лице, могут по венозному кровотоку распространяться в направлении головного мозга, что потенциально опасно для жизни.
Артериальная система глаза. Строение
Главная роль в кровоснабжении глаза отводится одной из основных магистралей внутренней сонной артерии, которой является глазная артерия. В глазницу она попадает со зрительным нервом сквозь его канал.
Внутрь глазницы от нее идут несколько основных ветвей: слезная артерия, центральная артерия сетчатки, задние короткие и длинные цилиарные артерии, надглазничная артерия, мышечные артерии, задние и передние решетчатые артерии, надблоковая артерия, внутренние артерии век, артерия спинки носа.
Задача центральной артерии сетчатки – участие в питании зрительного нерва, посредством небольшой веточки, которую она отдает в центральную артерию зрительного нерва. Проходя внутри зрительного нерва, артерия пронизывает его диск и выходит на глазное дно. Здесь она разделяется на ветви и образует густую сеть сосудов, которые питают четыре внутренних слоя сетчатой оболочки, а также внутриглазную часть самого зрительного нерва.
Здесь она разделяется на ветви и образует густую сеть сосудов, которые питают четыре внутренних слоя сетчатой оболочки, а также внутриглазную часть самого зрительного нерва.
Иногда на глазном дне можно определить дополнительный кровеносный сосуд, который питает макулярную область. Это цилиоретинальная артерия — ответвление задней короткой цилиарной артерии. В случае нарушения кровотока центральной артерии сетчатки это ответвление способно продолжать питать макулярную зону, без снижения центрального зрения.
Задние короткие цилиарные артерий также имеют ветви, отходящие от глазной артерии. Их количество колеблется от 6 до 12, все они пролегают в склере, окружающей зрительный нерв, образуя артериальный круг, который участвует в кровоснабжении части зрительного нерва уже после выхода его из глаза. Кроме того, они обеспечивают кровоток в сосудистой оболочке глаза. Что касается задних коротких цилиарных артерий, то они не имеют связи с цилиарным телом и радужной оболочкой, за счет чего процессы воспаления в переднем либо заднем отрезке глаза протекают относительно изолированно.
От глазной артерии отходят две ветви, это задние длинные цилиарные артерии. Они проходят сквозь склеру сбоку от зрительного нерва, минуют околососудистое пространство и достигают цилиарного тела. В этом месте они вливаются в передние ресничные артерии – ветви мышечных артерий, с частичным присоединением задних коротких цилиарных артерий, чтобы образовать большой артериальный круг оболочки радужки. Круг локализуется у корня радужки и направляет свои ветви к зрачку. Зрачковый и ресничный пояски радужки в месте стыка, формируют малый артериальный круг. Эти два артериальные круга (большой и малый) осуществляют кровоснабжение цилиарного тела и радужки.
Мышечные артерии снабжают кровью все мышцы глаза, вместе с тем, артерии всех прямых мышц имеют веточки, так называемые, передние цилиарные артерии. Они в свою очередь, делясь, образуют сети сосудов в области лимба, где присоединяются к задним длинным цилиарным артериям.
С внутренней стороны кожи к векам подходят их внутренние артерии, что бы затем распространиться уже и по поверхности век. Здесь они присоединяться к наружным артериям век, образуя веточки слезных артерий. Результатом слияния являются нижняя и верхняя артериальные дуги век, которые обеспечивают их кровоснабжение.
Здесь они присоединяться к наружным артериям век, образуя веточки слезных артерий. Результатом слияния являются нижняя и верхняя артериальные дуги век, которые обеспечивают их кровоснабжение.
От артерий к задней поверхности век отходит несколько веточек для кровоснабжения конъюнктивы – это задние конъюнктивальные артерии. У сводов конъюнктивы к ним присоединяются передние конъюнктивальные артерии посредством ветвей передних цилиарных артерий, которые заняты в питании конъюнктивы глаза.
Слезная артерия занята кровоснабжением находящихся рядом слезной железы, а также наружной и верхней прямой мышцы, кроме того она принимает участие в питании век. Через надглазничную вырезку в лобной кости выходит надглазничная артерия, неся кровь в область верхнего века совместно с надблоковой артерией.
Решетчатые артерии (передние и задние) заняты в процессе питания слизистой оболочки носа, а также решетчатого лабиринта.
Кровоснабжение глаза создают и иные сосуды: подглазничная артерия, являющаяся ответвлением верхнечелюстной артерии (принимает участие в снабжении нижнего века, а также прямой и косой нижних мышц, слезной железы и слезного мешка), кроме того, существует и лицевая артерия, отдающая угловую артерию, которая питает внутреннюю область век.
Венозная система глаза. Строение
Оттоком крови от тканей глаза занята система вен. Центральной веной сетчатки обеспечивается отток крови от структур, запитанных соответствующей артерией, затем она впадает в пещеристый синус либо в верхнюю глазную вену.
Вортикозные вены обеспечивают отвод крови от сосудистой оболочки органа зрения. Четыре вортикозные вены заняты на соответствующем отрезке глаза, две верхние вены далее соединяются с верхней глазной веной, а две нижние – с нижней.
Затем венозный отток от органов вспоможения глазницы и глаза, по сути своей, повторяет артериальное кровоснабжение, правда, происходит все в обратном порядке. Основная часть вен отходит к верхней глазной вене, покидающей глазницу сквозь верхнюю глазничную щель, гораздо меньшая часть отходит к нижней глазной вене, чаще имеющей две ветви. Одна ветвь присоединяется к верхней глазной вене, а вторая уходит сквозь нижнюю глазничную щель.
Отсутствие в венах клапанов и свободная связь между системами вен лица, глаза, а также головного мозга, является особенностью венозной системы глаза.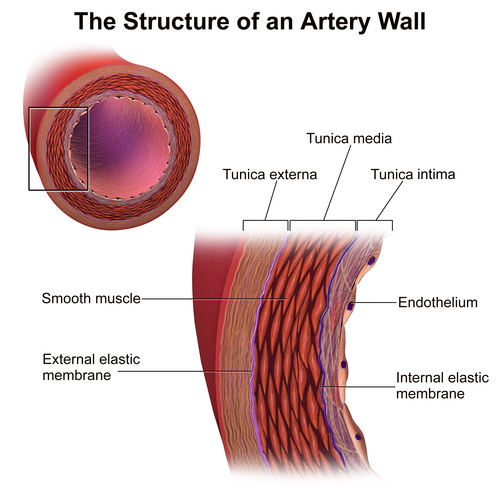 При этом венозный отток возможен и в направлении лица, и в направлении головного мозга, что создает потенциально опасные для жизни ситуации в случаях гнойных воспалительных процессов.
При этом венозный отток возможен и в направлении лица, и в направлении головного мозга, что создает потенциально опасные для жизни ситуации в случаях гнойных воспалительных процессов.
Методика диагностики патологий сосудов глаз
- Офтальмоскопия– инспекция и оценка состояния сосудов на глазном дне.
- Флуоресцентная ангиография– исследование хориоидеии сосудов сетчатки глаза, с помощью контрастного вещества.
- Ультразвуковая допплерография – исследование объема крови в сосудах.
- Реография – оценка оттока и притока крови за единицу времени.
Симптоматика заболеваний сосудов глаз
- Нарушение кровотока центральной артерии сетчатки либо ее ветвей.
- Образование тромбов в центральной вене сетчатки и ее ветвях.
- Задняя ишемическая нейропатия.
- Передняя ишемическая нейропатия.
- Папиллопатия.
- Глазной ишемический синдром.
При нарушениях кровотока, отеке и кровоизлияниях в зоне макулы, а также нарушениях кровотока сосудов зрительного нерва возникает снижение зрения.
Если изменения, возникшие в сетчатке, не затрагивают зону макулы, то нарушается только периферическое зрение.
Чем отличается строение артерий, вен и капилляров? Как это связано с их функциями?
Строение артерий, вен и капилляров. Сосуды, которые несут кровь от сердца к органам и тканям, называются артериями, а сосуды, несущие кровь от периферии к сердцу, — венами.
Артериальная и венозная части сосудистой системы соединяются между собой капиллярами, через стенки которых происходит обмен веществ между кровью и тканями.
Артерии, питающие стенки тела, называются париетальными (пристеночными), артерии внутренних органов — висцеральными (внутренностными).
По топографическому принципу артерии делятся на вне-органные и внутриорганные. Строение внутриорганных артерий зависит от развития, строения и функции органа. В органах, которые в период развития закладываются общей массой (легкие, печень, почки, селезенка, лимфатические узлы), артерии входят в центральную часть органа и дальше разветвляются соответственно долям, сегментам и долькам. В органах, которые закладываются в виде трубки (пищеводный тракт, выводные протоки мочеполовой системы, головной и спинной мозг), ветви артерий имеют кольцевидное и продольное направление в ее стенке.
В органах, которые закладываются в виде трубки (пищеводный тракт, выводные протоки мочеполовой системы, головной и спинной мозг), ветви артерий имеют кольцевидное и продольное направление в ее стенке.
Различают магистральный и рассыпной тип ветвления артерий. При магистральном типе ветвления имеются основной ствол и отходящие от артерии боковые ветви с постепенно уменьшающимся диаметром. Рассыпной тип ветвления артерии характеризуется тем, что основной ствол делится на большое количество конечных ветвей.
Артерии, обеспечивающие окольный ток крови, в обход основного пути, называются коллатеральными. Выделяют межсистемные и внутрисистемные анастомозы. Первые образуют соединения между ветвями разных артерий, вторые — между ветвями одной артерии.
Внутриорганные сосуды последовательно делятся на артерии 1—5-го порядка, образуя микроскопическую систему сосудов — микроциркуляторное русло. Оно формируется из артериолы, прекапиллярной артериолы, или прека-пилляров, капилляров, посткапиллярных венул или посткапилляров и венул. Из внутриорганных сосудов кровь поступает в артериолы, которые образуют в тканях органов богатые кровеносные сети. Затем артериолы переходят в более тонкие сосуды — прекапилляры, диаметр которых составляет 40—50 мкм, а последние — в более мелкие — капилляры с диаметром от 6 до 30—40 мкм и толщиной стенки 1 мкм. В легких, головном мозге, гладких мышцах расположены наиболее узкие капилляры, а в железах — широкие. Наиболее широкие капилляры (синусы) наблюдаются в печени, селезенке, костном мозге и лакунах пещеристых тел долевых органов.
Из внутриорганных сосудов кровь поступает в артериолы, которые образуют в тканях органов богатые кровеносные сети. Затем артериолы переходят в более тонкие сосуды — прекапилляры, диаметр которых составляет 40—50 мкм, а последние — в более мелкие — капилляры с диаметром от 6 до 30—40 мкм и толщиной стенки 1 мкм. В легких, головном мозге, гладких мышцах расположены наиболее узкие капилляры, а в железах — широкие. Наиболее широкие капилляры (синусы) наблюдаются в печени, селезенке, костном мозге и лакунах пещеристых тел долевых органов.
В капиллярах кровь течет с небольшой скоростью (0,5— 1,0 мм/с), имеет низкое давление (до 10—15 мм рт. ст.). Это связано с тем, что в стенках капилляров происходит наиболее интенсивный обмен веществ между кровью и тканями. Капилляры находятся во всех органах, кроме эпителия кожи и серозных оболочек, эмали зубов и дентина, роговицы, клапанов сердца и др. Соединяясь между собой, капилляры образуют капиллярные сети, особенности которых зависят от строения и функции органа.
Пройдя через капилляры, кровь поступает в посткапиллярные венулы, а затем в венулы, диаметр которых равен 30—40 мкм. Из венул начинается формирование внутриорганных вен 1—5-го порядка, которые затем впадают во внеорганные вены. В кровеносной системе встречается и прямой переход крови из артериол в венулы — артериоло-венулярные анастомозы. Общая вместимость венозных сосудов в 3—4 раза больше, чем артерий. Это связано с давлением и небольшой скоростью крови в венах, компенсируемых объемом венозного русла.
Вены являются депо для венозной крови. В венозной системе находится около 2/3 всей крови организма. Внеорганные венозные сосуды, соединяясь между собой, образуют самые крупные венозные сосуды тела человека — верхнюю и нижнюю полые вены, которые входят в правое предсердие.
Коронарные артерии. Перевод терминов и аббревиатур артерий сердца
Right coronary artery (RCA), right main coronary artery.

Правая коронарная артерия отходит от правого аортального (1-го лицевого) синуса, чаще всего в виде ствола, идущего кзади по правой атриовентрикулярной борозде, огибающей трехстворчатый клапан, и направляющегося к кресту сердца.
The RCA typically arises from the right sinus of Valsalva (RSV) of the ascending aorta, passes anteriorly and to the right between the right auricle and the pulmonary artery and then descends vertically in the right atrioventricular sulcus. When the RCA reaches the acute margin of the heart, it turns to continue posteriorly in the sulcus onto the diaphragmatic surface and base of the heart.
Одноплоскостная анатомическая схема строения венечно-артериального дерева и сердечного комплекса. А — система левой венечной артерии (ЛВА), Б: система правой венечной артерии (ПВА).
1 — первый лицевой синус аорты, 2 — второй лицевой синус аорты.
А — аорта, ЛА — легочная артерия, УПП — ушко правого предсердия, УЛП — ушко левого предсердия, ПМЖВ — передняя межжелудочковая ветвь, ОВ — огибающая ветвь, ДВ — диагональная ветвь, ВТК — ветвь тупого края, АСУ — артерия синусного узла, КА — конусная артерия, BOK — ветвь острого края, а.АВУ — артерия атриовентрикулярного узла,
ЗМЖВ — задняя межжелудочковая ветвь.
Источник: Бокерия Л. А., Беришвили И. И. Хирургическая анатомия венечных артерий. М.: Издательство НЦССХ им. А. Н. Бакулева РАМН, 2003.
Conus branch, infundibular branch, conus arteriosus branch.
Конусная артерия — первая крупная ветвь правой коронарной артерии, но может отходить самостоятельным устьем от 1-го лицевого синуса аорты. Конусная артерия снабжает артериальный конус (conus arteriosus) и переднюю стенку правого желудочка и может участвовать в кровоснабжении передней межжелудочковой перегородки.
The artery has a variable distribution, but usually supplies a region of the anterior interventricular septum and the conus of the main pulmonary artery (hence its name). Although an acute occlusion of the tiny artery has been shown to result in S-T elevation, another more important role it serves in pathophysiology is that of a route of collateral circulation. The conus artery has been shown to collateralise with the more distal acute marginal branch in RCA stenosis/obstruction, and collateralise with the left anterior descending artery (LAD) in LAD stenosis/obstruction, providing a potentially vital collateral pathway.
Sinoatrial nodal artery (SANa), sinus node artery, sinoatrial nodal branch, SA nodal artery, right SA node branch.
Артерия синусного узла — основная артерия, обеспечивающая кровоснабжение синусно-предсердного узла, и ее повреждение приводит к необратимым нарушениям ритма сердца. АСУ также участвует в кровоснабжении большей части межпредсердной перегородки и передней стенки правого предсердия.
Артерия синусного узла, как правило, отходит от доминантной артерии (см. типы кровоснабжения сердца). При правом типе кровоснабжения сердца (примерно в 60% случаев) АСУ является второй ветвью правой коронарной артерии и отходит от ПКА напротив места отхождения конусной артерии, но может отходить и от 1-го лицевого синуса самостоятельно. При левом типе кровоснабжения сердца артерия синусного узла отходит от огибающей ветви ЛКА.
The sinoatrial nodal artery (SANa) supplies blood to the sinoatrial node (SAN), Bachmann’s bundle, crista terminalis, and the left and right atrial free walls. The SANa most frequently originates from either the right coronary artery (RCA) or the left circumflex branch (LCX) of the left coronary artery (LCA).
Kugel’s artery, atrial anastomotic branch, Kugel’s anastomotic branch (Lat.: arteria auricularis magna, arteria anastomotica auricularis magna, ramus atrialis anastomoticus).
Артерия Кюгеля является анастомозирующей между системами правой и левой коронарных артерий. В 66% случаев она является ветвью ЛКА или артерии СПУ, отходящей от нее, в 26% — ветвью обеих коронарных артерий или артерии СПУ, отходящей от них одновременно, и в 8% случаев — ветвью более мелких ветвей, отходящих от правой и левой коронарных артерий к предсердиям.
Третья ветвь ПКА. Адвентициальная артерия может быть ветвью конусной артерии либо отходить самостоятельно от аорты. Она направляется вверх и вправо и лежит на передней стенке аорты (выше синотубулярного соединения), направляясь влево и исчезая в жировом футляре, окружающем магистральные сосуды.
Acute marginal artery, right marginal branch, right marginal artery.
Артерия острого края является одной из самых крупных ветвей ПКА. Она спускается от ПКА по острому правому краю сердца и образует мощные анастомозы с ПМЖВ. Участвует в питании передней и задней поверхностей острого края сердца.
AV node artery, AV nodal artery (branch), AVN artery.
Артерия (ветвь) предсердно-желудочкового узла отходит от ПКА в области креста сердца.
Posterior descending artery (PDA), posterior interventricular artery (PIA).
Задняя межжелудочковая ветвь может быть непосредственным продолжением ПКА, но чаще является ее ветвью. Проходит в задней межжелудочковой борозде, где отдает задние септальные ветви, которые анастомозируют с септальными ветвями ПМЖВ и питают терминальные отделы проводящей системы сердца. При левом типе кровоснабжения сердца ЗМЖВ получает кровь из левой коронарной артерии, отходя от огибающей ветви или ПМЖВ.
Posterior septal perforators, posterior septal (perforating) branches.
Задние («нижние») септальные ветви отходят от ЗМЖВ в задней межжелудочковой борозде, которые анастомозируют с «передними» септальными (перегородочными) ветвями ПМЖВ и питают терминальные отделы проводящей системы сердца.
Right posterolateral artery, posterolateral artery (PLA), posterior left ventricular (PLV) artery.
Приблизительно в 20% случаев ПКА формирует заднебоковую ветвь левого желудочка.
ТОПОГРАФО-АНАТОМИЧЕСКИЕ ОСОБЕННОСТИ СТРОЕНИЯ ЯГОДИЧНЫХ АРТЕРИЙ
Аникина Т. И. К вопросу о хирургической анатомии подвздошных артерий в связи с операцией аортобедренного шунтирования//Вопр. хирургии сердца и кров. сосудов. -Москва, 1969. -С. 128-140.
Кафиева Т. А. К морфологии системы внутренней подвздошной артерии: Автореф. дис. канд. мед. наук. -Ростов-н/Дону. -1959. -15 с.
Кованов В. В. Хирургическая анатомия артерий человека. -М: Медицина, 1974.
Мануйлов К. А. Об отношении ветвей подчревной артерии к крестцовому сплетению//Тр. Горьк. мед. ин-та. -1956. -С. 97-1 01.
Рылюк А. Ф. Топографическая анатомия и оперативная гинекология: Учеб. пособие. -Мн.: «Экоперспектива», 2001. -226с.
Рылюк А. Ф. Топографическая анатомия и хирургия органов брюшной полости: Практ. пособие. -3-е изд. допол. -Мн.: Выш. шк., 2003. -418с.
Шеров А. И. К возрастной морфологии артерий таза//Тр. Киргизского мед. ин-та. -1956. -Т. 8. -С. 11-14.
A statistical study of the branching of the human internal iliac artery/Yamaki K., Saga T., Doi Y. et al.//Kurume-Med-J. -1998. -Vol. 45, -№ 4. -P. 333-340.
Abnormal extrapelvic course of the inferior gluteal artery/Gabrielli C., Olave E., Sarmento A., Mizusaki C., Prates J.C.//Surg. Radiol. Anat. -1997. -Vol. 19, -№3. -P. 139-142.
Anatomy of pelvic arteries adjacent to the sacrospinous ligament: Importance of the coccygeal branch of the inferior gluteal artery/J.R.Thompson, J.S.Gibb, R.Genadry//Obstetrics and Gynecology. -1999. -Vol. 94, -№ 6. -P.973-977.
Superior gluteal artery in the extended iliofemoral approach/Reilly M.C., Olson S.A., Tornetta P. 3rd, Matta J.M.//J. Orthop. Trauma. -2000, May. -Vol. 14, -№4. P. -259-263.
The quantitative anatomy of the superior gluteal artery and its location -Ebraheim N.A., Olexa T.A., Xu R., Georgiadis G., Yeasting R.A.//Am. J. Orthop. -1998, Jun. -Vol. 27, -№6. P. 427-431.
The superior gluteal artery in complex acetabular procedures/Juliano P.J., Bosse M.J., Edwards K.J.//J-Bone-Joint-Surg-Am. -1994. Feb. -Vol. 76, -№ 2. -P. 244-248.
Артерии, вены, капилляры
Кровообращение и его регуляция. Строение артерий
Артерии несут кровь прочь от сердца к различным органам. Интересно, что кровь в этих сосудах не всегда артериальная, то есть содержащая много кислорода. Например, легочный ствол приносит к легким кровь, бедную кислородом. При различных патологиях также может возникнуть ситуация, когда в артериях смешиваются разные виды крови.
Как же устроены артерии? Их внешняя оболочка создана из рыхлой соединительной ткани. Средняя часть артерии представлена гладкими мышцами, состоящими из косоориентированных пучков, а также эластичных волокон под ними. Наконец, внутренняя оболочка состоит из эпителиальной ткани.
Строение артериол
Артериолы, или же «младшие» артерии — меньшие по сравнению с главными артериями сосуды, также переносящие артериальную кровь. Их строение идентично строению артерий, имеет те же три слоя, однако при этом слой гладких мышц является преобладающим.
Строение вен
Вены приносят кровь в направлении к сердцу. Строение их подобно строению артерий, но мышцы средней оболочки развиты довольно слабо (в венах слабо проталкивается кровь), а у вен сетчатки их вовсе нет. Эластичность у вен более высокая, чем у артерий за счет большего числа эластичных волокон. Это связано с необходимостью растягиваться при накоплении венозной крови, застоявшейся в органах, конечностях. На внутренней оболочке вен есть клапаны — это не характерно для артерий, но присуще значительному количеству средних вен и некоторым большим. Маленькие вены называются венулами.
Строение капилляров
Капилляры — тоненькие и очень многочисленные сосуды, проникающие во все уголки тела. Стенки капилляров тончайшие, проницаемые, они состоят из единственного слоя эпителиальных клеток, возлежащих на базальной мембране. Расположены капилляры обычно между артериолами и венулами, но есть исключения — клубочек капилляров почечного тельца находится между двумя артериолами, капилляры печени — между парой венул. Иногда выделяют кровеносные капилляры (с артериальной кровью) и венозные капилляры (с венозной кровью).
Особенности вен и артерий
1. У вен и артерий имеется кровоснабжение, осуществляемое с помощью мелких капилляров.
2. Вены требуют большего кровоснабжения, чем артерии, поскольку из вен необходимо быстро выводить углекислый газ, его избыток очень вреден. Именно поэтому вокруг вен больше капилляров, чем вокруг артерий.
3. Артериолы имеют наиболее толстую среднюю оболочку со многими гладкомышечными волокнами, наружная оболочка у них нежная, тонкая, содержит минимальное количество эластичных волокон, состоит в основном из коллагена (в составе рыхлой волокнистой соединительной ткани).
4. С понижением температуры кровоток в коже уменьшается. При этом уменьшается частота и сила сокращений сердца. Действительно, в этом есть логика — сердцу не нужно сокращаться сильно, ведь кровь не проталкивается в кожу.
5. В капиллярах кровь движется едва-едва, пробегая всего 0,5–1,2 мм/сек.
6. В полых венах она течет гораздо быстрее, со скоростью 0,2 м/сек.
7. В аорте — настоящий поток, скорость его 0,5 м/сек.
8. Интересно, что к печени подходят оба типа крови, и артериальная (печеночная артерия), и венозная (воротная вена печени), а вот отходит от нее лишь венозная (печеночная вена).
Стенка артерии — обзор
7.6.1 Модели кровотока при стенозе
Атеросклероз — это хронический воспалительный процесс в стенках артерий, приводящий к их утолщению и образованию бляшек. Атеросклеротическая бляшка состоит из пула липидов и фиброзного колпачка, встроенного в стенку пораженного сосуда. Вследствие образования бляшек просвет сосудов сужается и возникает стеноз. Последнее может вызвать резкое снижение кровотока в нижележащей части сосудистой сети либо из-за значительной окклюзии, либо из-за разрыва бляшки и связанного с ней образования сгустка и эмболизации.Тромбы, образующиеся в мозговом кровообращении, могут спровоцировать инсульт. Атеросклероз коронарных артерий вызывает недостаток кислорода в сердечной ткани, за которым следует ишемия, инфаркт миокарда, аритмия и фибрилляция. Это одна из основных причин смертности и заболеваемости.
Атеросклероз — сложное заболевание, включающее различные клеточные процессы, гемодинамические эффекты и биомеханику стенки сосуда. Модели пониженного порядка могут имитировать нарушение кровообращения, вызванное стенозом сосудов.Для обзора моделей проточного стеноза с сосредоточенным отделением (0D) мы отсылаем к Ref. [306]. 0D-модель — это система ОДУ, вытекающая из модели упругого резервуара с кровью или ее аналогов в электрических цепях, обсуждаемых в главе 6. Пример из работы. [269] такой системы ODE для потока в сосудистом отсеке является следующая система:
(7,62) Cedpˆdt = qin − qout,
(7,63) Ledqˆdt + Reqˆ = pin − pout,
, где C e , L e и R e — емкость, индуктивность и сопротивление отсека электрической цепи; q in , q out , p in и p out — это расходы и давления на входе и выходе сосредоточенного элемент; а pˆ, qˆ — усредненные давление и расход в сосредоточенном элементе.Если A 0 , A s , l 0 и l s обозначают площади поперечного сечения и длину нестенозированных и стенозированных сосудов, соответственно, то параметры стенозированной области со степенью α = As / A0 следует обновить:
Rs = Reα − 2, Cs = Ceα3 / 2, Ls = Leα − 1.
Физиологическое воздействие стеноза — это падение давления Δp в стенозированной области, что приводит к снижению скорости потока. Q .Эмпирические зависимости Δp от Q могут быть разными:
Δp = 288ρ2ReAs2Q2, [310] Δp = (R1 + R2) Q + (K1 + K2) Q2, [312] Δp = Kυμ2πR3Q + Ktρ2A02 (A0As − 1) | Q | + KuρlsA0dQdt, [222,311] dpdx = (8ρQ2B1B2π2R5) dRdx − 60μQB3πR4, [313]
, где Re — число Рейнольдса, R 1 , R K 2 1 , K 2 , B 1 , B 2 , B 3 , K v , K t , и K u — постоянные, а R — диаметр сосуда.Падение давления на стенозе с нерегулярной геометрической структурой требует более подробных двухуровневых 1D – 3D моделей, таких как модели, представленные в Refs. [271, 311] [271] [311], хотя асимметричный просвет не дает заметной разницы в перепаде давления, как указано в ссылках. [312 313] [312] [313]. Если стеноз рассматривается как узел одномерного сосудистого графа, эти соотношения для Δp можно использовать как часть граничных условий в одномерной гемодинамической модели вместо формул. (7.17), (7.18) или (7.19).
Стенозы могут быть учтены с помощью одномерной гемодинамической модели двумя способами.Во-первых, стеноз степени α может быть включен в здоровую сосудистую сеть в виде трубчатого сегмента с измененной площадью поперечного сечения As = αA0 и длиной Ls. На входе и выходе из этого сегмента к граничным условиям добавляется условие падения давления Пуазейля Δp = RsQ с гидравлическим сопротивлением Rs∼α − 2, как это было сделано в работах [1,96]. [242 314 315] [242] [314] [315]. Во-вторых, наличие стеноза может изменить определяющее соотношение (7.44) для здорового сосуда за счет локального увеличения жесткости стенки сосуда.
Более продвинутый подход — восстановить функцию f из уравнения. (7.44) для здоровых и стенозированных сосудов, как было предложено в [3]. [316 317] [316] [317]. Восстановление функции f основано на представлении стенки сосуда концентрическими упругими оболочками. Предполагается, что сосуд цилиндрический, а бляшка осесимметричная, однородная и протяженная; следовательно, деформация в осевом направлении незначительна. Неоднородное распределение волокон коллагена и эластина в здоровой стенке сосуда (см. Главу 2) приводит к нелинейному (например,g., neo-Hookean) эластичный ответ на нагрузку артериальным давлением. Состояние равновесия для такой тонкой стенки (со средним радиусом R и толщиной H ), состоящей из неогуковского материала с постоянной материала μ и надутой внутренним давлением p 0 , дает нелинейное уравнение для главного радиальное растяжение λr, полученное в работе. [317]:
μ (λr − 2 − λr2) = p0 / (λrH) (R / λr − λrH / 2).
Это уравнение неявно определяет функцию f , поскольку оно связывает давление и площадь просвета.
Поскольку атеросклеротическая стенка состоит из трех слоев, она может быть представлена трехслойной круглой цилиндрической оболочкой, надутой внутренним давлением p 0 . Внутренний (стенка сосуда) и внешний слои (фиброзная крышка) представлены тонкостенными цилиндрическими оболочками. Средний слой представляет собой толстостенный цилиндр, который представляет собой липидный пул. Условия статического равновесия позволяют авторам [316, 317] [316] [317] вычислить площадь просвета при заданном кровяном давлении p 0 для изотропных несжимаемых линейных эластичных материалов (Hookean) [316] или несжимаемых нелинейных материалов [317] стенки сосуда, липидного пула и фиброзной крышки.На рис. 7.7 мы сравниваем функции p 0 ( S / S 0 ) для атеросклеротического сосуда с длинной осесимметричной бляшкой и просветом 10%. Поскольку S 0 обозначает площадь просвета здоровой артерии, нулевое трансмуральное давление соответствует S / S 0 = 0,1. Параметры задачи статического равновесия устанавливаются в соответствии со свойствами общей сонной артерии. Существенная разница в давлениях наблюдается при трансмуральных давлениях более 4 кПа, а также при отрицательных трансмуральных давлениях.Нелинейные материалы демонстрируют более высокую чувствительность к трансмуральному давлению раздувания и более высокое удельное сопротивление к понижающему трансмуральному давлению.
Рисунок 7.7. Сравнение определяющих соотношений для материалов Гука и нео-Гука для атеросклеротической общей сонной артерии.
Автор: Ю. Василевский, С. Симаков, В. Саламатова, Ю. Иванов, Т. Добросердова, Модели стенок сосудов для моделирования атеросклеротических сосудистых сетей, Матем. Модель. Nat. Феном. 6 (7) (2011), 82–99.Вывод определяющего соотношения при несимметричности сосуда и бляшки основан на численных методах.Например, следуя Ref. [318], упругий отклик стенки трубы может быть вычислен из ее представления с помощью наборов осевых волокон, кольцевых волокон и спиральных волокон, а также вычисления реакции скопления волокон на деформацию. Реакция атеросклеротического сосуда на раздувание может быть вычислена из представления фиброзной капсулы и артериальной стенки набором линейных эластичных колец и липидного пула набором радиальных пружин. Реакция пружин определяется аналитически известными радиальными перемещениями несжимаемой линейной изотропной цилиндрической оболочки при приложении внешнего и внутреннего давления.Две концентрические сетки кольцевых волокон представляют собой внешний (артерия) и внутренний (фиброзный колпачок) слои. Эти слои и уравновешивающие силы, приложенные к этим слоям в каждой точке сетки, приводят к системе дискретных нелинейных уравнений, которые необходимо решить методом Ньютона. Для всех возможных давлений и бляшек, наблюдаемых в общей сонной артерии, такая численная модель показана в работе. [316], чтобы обеспечить ошибку для смещений менее 2% по сравнению с полуаналитическим решением, известным для осесимметричной геометрии, как показано.
Менее изучен случай нескольких последовательных стенозов. Нарушение кровообращения, вызванное последовательными стенозами, рассматривается в работах [3]. [319–322] [319] [320] [321] [322].
Система кровообращения: Руководство по гистологии
Существует три основных типа артерий:
- Артерии эластические
- Артерии мышечные
- Артериолы
Взгляните на это поперечное сечение эластической артерии и определить три основных слоя — внутреннюю оболочку оболочки, среднюю оболочку оболочки и адвентициальная оболочка.
Эластических артерий:
Эти артерии, которые получают кровь непосредственно из сердца — аорта и легочная артерия .:
Они должны быть эластичными, потому что:
Они относительно тонкие по сравнению с их диаметром.
Когда сердце сокращается и выбрасывает кровь в эти артерии,
стены должны растягиваться, чтобы принять прилив крови, сохраняя
энергия. Артериальное гидростатическое давление, возникающее в результате желудочкового
сокращение — это «систолическое артериальное давление» (систола по-гречески означает
договор).
Между сердечными сокращениями эластичные стенки отталкиваются, чтобы поддерживать кровяное давление, продолжающее движение крови, даже когда желудочки расслаблен. Артериальное гидростатическое давление между схватками это диастолическое артериальное давление (диастола в переводе с греческого означает расширение). в стенках этих артерий много эластина.
Tunica adventitia — имеет малую ‘vasa vasorum’ как крупные артерии нуждаются в собственном кровоснабжении. Туника медиа широкая и эластичная, с концентрическими окончатыми листами эластина, коллаген и только относительно небольшое количество гладких мышечных волокон.
Tunica intima состоит из эпителия, который представляет собой слой уплощенных эндотелиальных клеток вместе с поддерживающим слой богатого эластином коллагена. В этом слое тоже есть фибробласты. и «миоинтимальные клетки», которые накапливают липиды с возрастом, и слой интимы утолщается, что является одним из первых признаков атеросклероза.
Мышечная артерия
Эти артерии распределяют кровь по различным частям тела. Эти включают артерии, такие как бедренные и коронарные артерии. В стенки этих артерий имеют много гладких мышцы, что означает, что они могут сокращаться или расслабляться (расширять), чтобы при необходимости изменить количество доставляемой крови.
Сравнивая эти артерии с эластическими артериями, лист эластин сейчас значительно снижен и находится на границе между tunica intima и tunica media в слое, называемом внутренним эластичным слоем (IEL) что видно очень четко.Менее четко определен внешний вид . эластичный слой (EEL), между оболочкой tunica media и tunica adventitia . Есть четко определенная круговой слой гладкой мускулатуры в средней оболочке.
Внутренняя оболочка оболочки имеет эндотелий сплющенного эндотелия. Ячейки . Медиа-оболочка в первую очередь представляет собой слой гладкой мышцы, с некоторым количеством эластина и коллагена.мышечный слой и зажат между IEL и EEL. Туника Туника Адвентиция — это очень широкий и в основном содержит коллаген и эластин.
Можете ли вы идентифицировать слои tunica intima и tunica media этой эластичной артерии?
Можете ли вы идентифицировать tunica intima , IEL и tunica media этой мышечной артерии.
Артериол:
Это фотография небольших окрашенных артериол. Слой ТА трудно увидеть, но можно увидеть концентрические кольца мышц в T.M. слой.
Можете ли вы найти артериолу ?
На этом рисунке показана артериола .внутренний эластичный пластинчатый слой все еще присутствует. T.M. (слой медиа оболочки) имеет не более шести концентрических колец гладкой мускулатуры, а Слой tunica adventia (T.A.) примерно того же размера, что и слой T.M.
Более крупные артериолы имеют просвет менее 100–300 мкм в диаметр. Артериолы — это небольшие артерии, которые доставляют кровь к капиллярам. Артериолы контролируют кровоток через капиллярное русло, сокращаясь. или расширяя размер просвета, и, следовательно, оболочка слой media содержит концентрические кольца гладкой мускулатуры сделать это.Этот отсек важен для определения вашей крови. давление, поскольку узкий диаметр этих кровеносных сосудов сопротивляется крови поток, а противодавление помогает растянуть стенки артерий во время сердечных сокращений.
Внутренняя оболочка тела очень тонкая и в основном состоит одного слоя плоского эпителия. tunica media состоит почти полностью из одного слоя до шести слоев гладкой мышечные клетки, а EEL отсутствует.Туника Adventitia примерно такого же размера, как слой tunica media , сливается с окружающей тканью.
Это ЭМ очень маленькой артериолы. Есть только один слой гладкой мускулатуры (M), но остается внутренний эластичный слой (IEL).
Роль артерий в системе кровообращения
Артерии — это кровеносные сосуды, которые переносят кровь от сердца к остальным частям тела. Они имеют форму трубок и разветвляются на артериолы, достигая органов и тканей.Насосные сокращения сердца продвигают кровь по артериям.
Библиотека научных фотографий / Getty ImagesАртерии системного кровообращения
Основная артерия большого круга кровообращения — аорта. Он прикреплен к левому желудочку сердца и переносит насыщенную кислородом кровь. Аорта разветвляется на артерии, которые идут к разным органам и частям тела. Вы можете почувствовать пульс в артерии, например сонной артерии на шее или лучевой артерии на запястье.
Легочная артерия отличается от других тем, что она прикреплена к правому желудочку сердца и несет бедную кислородом кровь к легким. Там он разветвляется на артериолы и капилляры, чтобы кровь могла поглощать кислород, прежде чем вернуться в сердце через легочную вену. Эта насыщенная кислородом кровь поступает в левое предсердие и перекачивается в левый желудочек и выходит через аорту.
Строение артерий
Артерии содержат высокий процент особого типа мышц, называемых гладкими мышцами, которые могут контролироваться гормонами и особыми сигналами нервной системы.Внешний слой артерии состоит из коллагеновых волокон. Средний слой состоит из гладких мышц и эластичных волокон. Внутренний слой — это слизистая оболочка, называемая эндотелием.
Кровь проходит через полый центр артерий. Если этот полый центр сужается из-за чрезмерного развития мышцы или образования бляшек, это может повысить кровяное давление. Зубной налет также делает артерии менее гибкими. Если артерия разрывается или блокируется, например, при инсульте или сердечном приступе, ткани, которые она обычно снабжает, погибнут.
Толстые и прочные стенки артерий позволяют им противостоять высокому давлению, которое существует рядом с сердцем. У всех основных органов тела есть свои особые артерии, которые имеют уникальную структуру для доставки необходимых материалов.
Сердечная мышца снабжается кровью коронарных артерий. Левая коронарная артерия и правая коронарная артерия ответвляются от аорты, а левая коронарная артерия далее делится на огибающую артерию и левую переднюю нисходящую артерию.Эти четыре артерии могут быть заменены при операции по аортокоронарному шунтированию (АКШ). Четырехкратное шунтирование заменяет все четыре артерии.
Здоровье артерий
Упрочнение артерий — это общий термин для обозначения атеросклероза и заболевания периферических артерий (ЗПА). Это происходит, когда бляшка образуется из жира, холестерина, кальция, белка и воспалительных клеток, сужая или блокируя артерии. Когда это происходит в артериях сердца, это ишемическая болезнь сердца (ИБС).
Факторы риска ЗПА включают курение, диабет, высокое кровяное давление и высокий уровень холестерина. ЗПА может привести к сердечному приступу, инсульту, транзиторной ишемической атаке, заболеванию почечной артерии и ампутации.
ВИДЫ И СТРОЕНИЕ АРТЕРИЙ
ВИДЫ И СТРОЕНИЕ АРТЕРИЙВИДЫ И СТРУКТУРА АРТЕРИЙ
На своем пути от сердца к тканям кровь проходит через каналы шести основных типов: эластичные артерии, мышечные артерии, артериолы, капилляры, венулы и вены.В этой системе артерии постепенно уменьшаются в диаметре по мере удаления от сердца, примерно с 25 мм в аорте до 0,3 мм в некоторых артериолах. Обратное верно для вен; диаметр венул невелик и постепенно увеличивается по мере приближения вен к сердцу. Все артерии состоят из трех отдельных слоев: интимы, медиума и адвентиции, но пропорции и структура каждого из них зависят от размера и функции конкретной артерии. Большая артерия, такая как аорта, состоит из следующих слоев, идущих от просвета до самых внешних слоев:
1.интима, или самый промежуточный слой, состоит из слоя эндотелиальных клеток, отделенных от внутреннего слоя узким слоем соединительных тканей, которые прикрепляют клетки к стенке артерии.
2. Большой слой эластичных волокон, образующих внутренний эластичный слой.
3. Ниже этого слоя находятся концентрические волны гладкомышечных клеток, перемешанных с эластичными волокнами. Эластичные ламели и гладкомышечные клетки погружены в основное вещество, богатое протеогликанами. Протеогликаны состоят из дисахаридов, связанных с белком, и служат связующим или «цементирующим» материалом в интерстициальных пространствах.Внешний слой среды пронизан ветвями vasa vasorum.
4. Между слоем гладкой мускулатуры и адвентицией снова находится еще один слой эластичных волокон — elastica externa. Слои 2, 3 и 4 образуют носитель.
5. Внешний слой или адвентиция образована неправильно расположенными пучками коллагена, разбросанными фибробластами, несколькими эластическими волокнами и кровеносными сосудами, которые из-за своего расположения называются vasa vasorum или сосудами сосудов.
Эта структура аорты и крупных артерий хорошо соответствует их функции, которая служит резервуаром для крови и растягивается или отскакивает под действием перекачивания сердца.Стенка артериол содержит меньше эластичных волокон, но больше гладкомышечных клеток, чем аорта. Артериолы представляют собой основной участок сопротивления кровотоку, и небольшие изменения их калибра вызывают большие изменения общего периферического сопротивления. Мышечные клетки иннервируются норадренергическими нервными волокнами, которые ограничивают функцию, и в некоторых случаях холинергическими нервными волокнами, расширяющими сосуды.
Капиллярная структура имеет диаметр, достаточный для того, чтобы красные кровяные тельца могли протиснуться через нее одним файлом.Так же, как интима артерий, стенка капилляров образована слоем эндотелиальных клеток, покоящихся на базальной мембране. Основная функция капилляров — способствовать обмену питательными веществами и конечными продуктами метаболизма между кровью и интерстициальными тканями. Такому обмену способствует наличие специализированных соединений, щелей или окон.
Структура и функция системных артерий: отражение артериального пульса | Американский журнал гипертонии
Аннотация
«Структура и функция артерий» — тема, имеющая большое значение для тех, кто имеет дело с артериальной гипертензией, поскольку она связывает источник кровотока, левый желудочек сердца (чей выход пульсирующий) с периферическими тканями (чей кровоток является пульсирующим). почти непрерывный).Артериальное дерево действует пассивно как канал и подушка, а взаимодействие сердца, артериального дерева и органов обычно измеряется на основе артериального давления, измеренного с помощью манжеты в удобно расположенном месте (плечевая артерия). Для достижения любой точности и перспективы измерения плечевого систолического и диастолического давления необходимо дополнить другой информацией. Когда такая информация будет получена, можно понять, насколько красиво артериальное дерево настроено на биение сердца у животных разного размера и формы, а также у людей в возрасте от 30 до первой трети жизни в 3 миллиарда ударов.После 30 лет биения сами по себе постепенно разрушают человеческие артерии и их настройку на сердце, с появлением клинических синдромов. В этом обзоре эта тема решается количественно на основе опубликованных числовых, физических, физиологических и патофизиологических данных, с основным акцентом на сердцебиение, пульс артерий и их взаимодействие.
В течение последних 25 лет в Париже с интервалом в 2–3 года проводилась серия встреч по этой теме, последняя из которых состоялась в феврале 2018 г., они были созваны коллегами и учениками профессора Мишеля Сафара и спонсированы компанией Servier.Избранные статьи из них были опубликованы в крупных американских журналах, посвященных гипертонии: «Гипертония», «Американский журнал гипертонии» и «Журнал Американского общества гипертонии». Другие статьи были опубликованы в других местах, например, в журнале Journal of Hypertension , с согласованным обзором терминов и методов лечения гипертонии, заказанным Американской кардиологической ассоциацией, 1 и еще один согласованный документ Европейского общества об изолированной систолической гипертензии у молодежи. гипертонии в марте 2018 г. 2 Эта область сосредоточена на анатомических, гистологических и физических свойствах артериальной стенки, нормальной артериальной функции, использовании новых методов измерения и анализа артериальных свойств и пульсовых волн, а также механизмах, относящихся к заболеванию. Предыдущая встреча со многими из тех же участников, также спонсируемая Сервье, проводилась в качестве сателлита Международного общества гипертонии (ISH) в Сиднее в 1994 году и была сосредоточена на технических вопросах и физических принципах, калибровке и использовании неинвазивных методов. методы анализа пульсовой волны, измерения скорости волны, артериальной структуры и количественной оценки массы левого желудочка с помощью ультразвука.В то время (1994) акцент на заболевании делался на сужение артерии или окклюзию атеросклерозом, в то время как гипертензия измерялась исключительно с помощью манжеты плечевой артерии. Пять крупных книжных публикаций ранее были посвящены этой области — Карл Виггерс (позже назначенный первым редактором журнала Circulation Research) с «Пульсами давления в сердечно-сосудистой системе» в 1928 г., 3 Фрэнк Байром «Гипертонический сосудистый кризис: экспериментальное исследование» в 1969 г. 4 (см. также Байром и Додсон 5 ), учебник Джорджа Пикеринга «Высокое кровяное давление» (1968) 6 , в котором подчеркиваются физические механизмы и физический ущерб, причиненный сердцу и кровеносным сосудам пульсирующими явлениями, «Справочник Американского физиологического общества: кровообращение »в 1965 г. Гамильтон и Доу, 7 , в котором были представлены отражения волн, их величина и важность, и Макдональд« Кровоток в артериях »в 1960 г., 8 , в которых был представлен анализ форм пульсовых волн частота, а также во временной области.Книги Виггера и Макдональдса были приглашены для рецензирования (Британским) физиологическим обществом. Детали структуры и функции артериального дерева в последующие годы в основном не рассматривались, и побочные эффекты высокого кровяного давления обычно выражаются в виде систолического и диастолического давления, регистрируемого с помощью сфигмоманометрии плечевой манжеты. Соответствующие заголовки, включая жесткость аорты, импеданс аорты, скорость пульсовой волны в аорте, центральное давление в аорте, повышенное давление, не появляются в учебниках, журнальных статьях или призывах к презентации на научных собраниях.Тем не менее, исследования отражения волн позволили по-новому взглянуть на множество тем (Таблица 1).
Таблица 1. Отражение волнв клинической практике
| • Оптимальная настройка выхода ЛЖ на импеданс аорты у молодых людей |
| • Ритм бега (как выиграть марафон) |
| • Ухудшение оптимальной настройки от 30 до 100 лет |
| • Различная интерпретация АД плечевой манжеты у детей и взрослых |
| • Логическое лечение гипертонии и сердечной недостаточности |
| • «Систолические» и «диастолические» факторы при сердечной недостаточности |
| • Энцефалопатия пульсовой волны и возрастная деменция |
| • Количественная оценка действия нитратов и толерантности |
| • Оптимальная настройка выхода ЛЖ в соответствии с импедансом аорты у молодых людей | |
| • Ухудшение оптимальной настройки с 30 лет до 100 лет | |
| • Различная интерпретация АД плечевой манжеты у детей и взрослых | |
| • Логическое лечение гипертонии и сердечной недостаточности | |
| • «Систолические» и «диастолические» факторы при сердечной недостаточности | |
| • Пульсовая энцефалопатия и возрастная деменция | |
| • Количественная оценка действия и толерантности нитратов |
Отражение волн в клинической практике
| • Оптимальная настройка выхода ЛЖ в соответствии с импедансом аорты у молодых людей |
| • Ритм бега (как выиграть марафон) |
| • Ухудшение оптимальной настройки с 30 лет до 100 лет |
| • Различная интерпретация АД плечевой манжеты у детей и взрослых |
| • Логическое лечение гипертонии и сердечной недостаточности |
| • «Систолические» и «диастолические» факторы при сердечной недостаточности |
| • Пульсовая энцефалопатия и возрастная деменция |
| • Количественная оценка действия и толерантности нитратов |
| • Оптимальная настройка выхода ЛЖ в соответствии с импедансом аорты у молодых людей |
| • Ритм бега для победы в марафоне) |
| • Ухудшение оптимальной настройки с 30 лет до 100 уе ars |
| • Различная интерпретация АД плечевой манжеты у детей и взрослых |
| • Логическое лечение гипертонии и сердечной недостаточности |
| • «Систолические» и «диастолические» факторы при сердечной недостаточности |
| • Пульс волновая энцефалопатия и возрастная деменция |
| • Количественная оценка действия нитратов и толерантности |
Век, на который ссылаются (1918–2018 гг.), ознаменовался большими изменениями в обучении студентов и аспирантов естественным наукам.Кафедры физиологии как таковые были расформированы, а предметы нормального функционирования организма были объединены науками о жизни в клинические (например, медицина, анестезиология) и доклинические (например, упражнения, кинестезиология, питание). Общая перспектива нормального функционирования организма была утрачена в процессе вместе со сравнительной анатомией и физиологией, телесным развитием и старением, а также чувством красоты природы — структуры, связанной с функционированием всего животного царства.
Новое преподавание и управление высшим образованием сузили кругозор как раз в то время, когда ожидаемая продолжительность жизни увеличивается, а наиболее распространенными заболеваниями, с которыми приходится справляться медицинской системе, являются дегенеративные состояния; их нельзя понять без изучения нормального функционирования. В то же время для поступления в медицинский институт больше не требуется предварительно изучать физику как предмет или биологию, и уж тем более математику.
Неудивительно, что, учитывая вышесказанное, выпускники современной медицинской школы могут иметь меньше уверенности в оспаривании существующих взглядов, меньше способности видеть закономерности в различных проявлениях болезни и больше полагаться на согласованные документы и «руководящие принципы».Это может быть важной частью «эмоционального выгорания» и психиатрических проблем, связанных с депрессией и самоубийствами, которые преследуют современных врачей на протяжении всей их жизни, что сейчас подчеркивается в ведущих мировых журналах по медицинской практике. 9–12 Университетский курс должен открывать разум для более широких взглядов и пробуждать удовлетворяющее любопытство, что делает дальнейшую профессиональную жизнь неизменно приятной и приятной.
Парижская серия встреч проводилась по этим вопросам артериальной структуры и функции, последняя из которых была посвящена проблеме «Cést peut-être le début d’une grande idée (ou simplement des gribouillis)» {gribouillis = граффити или каракули}.
Цель данной статьи — показать, как анатомические особенности артериальной системы могут быть использованы для более точной характеристики ее функции в качестве канала, переносящего кровь от сердца к периферическим тканям тела, и в качестве подушки, сглаживающей пульсации, которые являются следствием прерывистой работы сердца, поэтому кровь может течь через капилляры почти непрерывным потоком. Эти простые вопросы побудили более недавнего выдающегося деятеля, Майкла Тейлора 13–15 , выйти на поле и внести основной вклад в отражение волн, которые являются основным фактором, ответственным за изменение формы волны артериального кровотока, исходящей из сердца. в волны давления, которые мы регистрируем по всему артериальному дереву.
Уильям Харви признан первооткрывателем кровообращения в системном кровотоке De Motu Cordis. 16 Он был анатомом в Королевском колледже врачей Лондона, когда написал эту физиологическую книгу о функции кровообращения. Немногие врачи или ученые осознают, что Харви также впервые описал волновое движение и отражение в артериальном дереве и подчеркнул это во второй крупной публикации (открытое письмо Жану Риолану в 1649 году). 17 Он распознал быстрое распространение волн в артериальном дереве, но не знал, зависело ли это от свойств артериальной стенки или крови внутри.(Moens 18 показал, что это комбинация обоих). Харви описал эксперимент, в котором он перекрыл артерию лигатурой и обнаружил, что дистальная артерия больше не показывала пульсацию, в то время как артерия над лигатурой пульсировала намного сильнее. Он описал это как отражение волны, вызванное прекращением притока крови в дистальную артерию. Его смысл был ясен, что подтверждается переводом оригинальной латыни. 17 Джон Хантер, отец современной хирургии, 19 использовал эту информацию при разработке успешной операции по восстановлению подколенной аневризмы.Он перевязал подколенную артерию непосредственно над аневризмой, затем наложил серию завязок проксимальнее первой, чтобы вызвать сужение артерии и тем самым вызвать отражение волн в местах этих связей, а не только в том месте, где аневризма ткани дегенерировали и не могли выдерживать пульсирующее давление в этом месте, которое ранее неизменно приводило к послеоперационному разрыву. Это был первый зарегистрированный случай, когда преднамеренное уменьшение отражения волн использовалось в терапевтических целях.
Многие хирурги до сих пор не осознают этот момент и считают операцию Хантера успешной из-за роста коллатеральных артерий. Но операция была сделана ранее Хантером и другими; он был успешным только после того, как послеоперационный разрыв и обескровливание были предотвращены за счет уменьшения отражения волн, и пациент прожил достаточно долго (от месяцев до лет) для развития коллатерального кровообращения. 20
ОТРАЖЕНИЕ ВОЛНЫ
Есть свидетельства отражения волн в каждом пульсе артериального давления, который мы можем зарегистрировать.Это легко видно из исторических фолиантов, описанных выше, особенно у Виггерса, Гамильтона и Макдональда. Если бы волны не отражались, волна аортального давления имела бы тот же контур, что и волна аортального кровотока 7,8 (Рисунок 1).
Рисунок 1.
Влияние снижения (левая панель) и повышения (правая панель) среднего артериального давления на контур волны давления в восходящей аорте кролика. Во время гипотензии, вызванной сосудорасширяющим средством, диастолическая волна смещается позже в диастолу, а волна давления приближается к волне потока.Во время гипертензии, вызванной сосудосуживающим средством, эта диастолическая волна переходит в систолу, создавая поздний систолический пик, в то время как давление во время диастолы падает почти экспоненциально. Воспроизведено из 21 по данным Wetterer. 22 Результаты показывают, что модель, которая включает передачу и отражение волн в различных условиях вазодилатации / вазоконстрикции и низких / нормальных / высоких значений, может быть подходящей для интерпретации формы пульсовой волны в различных клинических условиях, например, во время операции или в отделении интенсивной терапии.
Рисунок 1.
Влияние снижения (левая панель) и увеличения (правая панель) среднего артериального давления на контур волны давления в восходящей аорте кролика. Во время гипотензии, вызванной сосудорасширяющим средством, диастолическая волна смещается позже в диастолу, а волна давления приближается к волне потока. Во время гипертензии, вызванной сосудосуживающим средством, эта диастолическая волна переходит в систолу, создавая поздний систолический пик, в то время как давление во время диастолы падает почти экспоненциально.Воспроизведено из 21 по данным Wetterer. 22 Результаты показывают, что модель, которая включает передачу и отражение волн в различных условиях вазодилатации / вазоконстрикции и низких / нормальных / высоких значений, может быть подходящей для интерпретации формы пульсовой волны в различных клинических условиях, например, во время операции или в отделении интенсивной терапии.
Этот одиночный поток крови в аорту создает 2 отдельных пика давления — первый одновременно с выбросом, а второй обычно через 200–400 мс.Эта вторичная волна должна быть вызвана отражением волны в большом круге кровообращения. Это не вызвано сокращением артерии, поскольку артериальное дерево — пассивная система. Вторичная волна обычно наблюдается в диастоле у молодого человека через 400 мс после ступни волны и в поздней систоле у пожилого человека (через 200 мс). Такие вторичные волны давления видны через все артериальное дерево и выше в периферических артериях, чем в центральных (рис. 2).
Рисунок 2.
Аортальное давление (верхние панели) и поток (нижние панели), схематически изображенные у нормального человека (слева) и гипертоника (справа). Эффект раннего отражения волны заметно увеличивает пик волны давления.
Рис. 2.
Аортальное давление (верхние панели) и поток (нижние панели), схематически изображенные у нормального человека (слева) и гипертоника (справа). Эффект раннего отражения волны заметно увеличивает пик волны давления.
Кривые кровотока в системных артериях также свидетельствуют о вторично отраженной волне.Это наиболее очевидно в грудной аорте и наименее очевидно в периферических артериях (рис. 3).
Рисунок 3.
Кривые давления, измеренные в лучевой артерии (верхние панели) и синтезированные для восходящей аорты (нижние панели) от 3 женщин в одной семье — 18-летняя девушка слева, 48-летняя старая (ее мать) в центре и 97-летняя (ее бабушка) справа. Пульсовое давление увеличивается почти в 4 раза в восходящей аорте и в 2 раза в верхней конечности от подросткового возраста до пожилого возраста.От О’Рурка и Хашимото. 23
Рис. 3.
Кривые давления, измеренные в лучевой артерии (верхние панели) и синтезированные для восходящей аорты (нижние панели) от 3 женщин в одной семье — 18-летняя девочка слева, a 48-летняя (ее мать) в центре и 97-летняя (ее бабушка) справа. Пульсовое давление увеличивается почти в 4 раза в восходящей аорте и в 2 раза в верхней конечности от подросткового возраста до пожилого возраста. От О’Рурка и Хашимото. 23
Виггерс показал, что вторичные импульсы давления в большом круге кровообращения кажутся реципрокными в верхней части тела по сравнению с нижней частью тела. 3 Гамильтон записал волны давления вдоль аорты и использовал ЭКГ для измерения времени форм волны и отображения их, как если бы они были записаны в одно и то же время. Он показал, что основание волн давления задерживается при прохождении от проксимального отдела аорты к нижней конечности (что свидетельствует о передаче волны и конечной скорости волны), а также показал взаимность и вторичную задержку, как это видно на подошве волны. Он описал это явление в терминах «стоячих волн» 24 , которые указывают на очень сильное (почти 100%) отражение волны в артериальном дереве.Макдональд 8 продемонстрировал те же явления и дал такое же объяснение относительно отражения волн. Он также показал, что выражение сигналов в частотной области дает такое же объяснение. Однако он настаивал на том, что отражение волн не может быть 100%, а должно быть меньше, потому что отражение (чего-либо) и пассивное физическое явление должно быть меньше и позже исходного импульса.
В последующих исследованиях, проведенных Эрлом Вудом в клинике Майо и другими сотрудниками лабораторий катетеризации сердца после Второй мировой войны, эти явления отражения волн были отмечены у людей, включая верхние конечности людей, где традиционно измеряется артериальное давление. 25 Эти исследования установили феномен усиления волны давления между восходящей аортой и периферическими (включая плечевую и лучевую) артериями. Эти результаты бросают тень на достоверность измерений манжеты, сделанных на локте с помощью манжеты или запястья с помощью катетера или тонометрии.
Внедрение методов измерения пульсирующего потока (с помощью дифференциального давления, электромагнитной техники, ультразвука (допплера), сердечного магнитного резонанса) позволило измерять давление и поток вместе и, таким образом, характеризовать сосудистое русло как сосудистое сопротивление.Измерение импеданса восходящей аорты теперь используется для характеристики гидравлической нагрузки, оказываемой на сердце периферическим кровообращением. Эти исследования демонстрируют явные доказательства отражения волн отдельно от верхней и нижней части тела и подтверждают пагубные последствия старения для сердца. 26,27
На последней встрече в Париже был рассмотрен вопрос о мозговом кровотоке, и было показано, что изменение калибра внутренней сонной артерии, когда она входит в череп при повышенном внутричерепном давлении, меняет отражение волн и может быть распознано по центральному артериальному давлению и диаграммам транскраниальной доплеровской волны потока и может использоваться для неинвазивной оценки величины внутричерепного давления. 28
Парижские встречи помогли направить ход артериальной гемодинамики за последние 25 лет. Они проложили путь, чтобы показать ценность лекарств, уменьшающих отражение волн при лечении повышенного артериального давления и сердечной недостаточности, улучшить измерение артериального давления сверх значений, даваемых тонометром с манжетой, помогли выявить «ложную систолическую гипертензию», и теперь в сочетании с сердечным магнитным резонансом для обеспечения наиболее полного измерения нагрузки на левый желудочек при лечении гипертонии и левожелудочковой недостаточности. 26,27
САЙТЫ ВОЛНОВОГО ОТРАЖЕНИЯ
На встрече ISH в 1994 году Майкл Тейлор, профессор физиологии Сиднейского университета и главный протеже Дональда Макдональда, высказал фундаментальные взгляды на пульсирующую артериальную гемодинамику и важность отражения волн в артериальном дереве. Джей Кон из Миннеаполиса высказал противоположные взгляды, и консенсуса не возникло. Тема отражения волн, изучаемая во временной области (анализ формы пульсовой волны) и в частотной области (как сосудистый импеданс или передаточная функция), продолжалась в общей литературе и с разными мнениями, представленными на последней (2018 г.) Парижской встрече Майклом. О’Рурк (протеже Тейлора) и Гэри Митчелл.Возможно, уместно упомянуть, что О’Рурк, Митчелл и Кон хорошо знали и надлежащим образом заявляли о коммерческих конфликтах интересов в этой области.
На последней встрече в Париже О’Рурк расширил свои взгляды, которые возникли в результате недавнего сотрудничества с коллегами в области гипертонии, сосудистой медицины, нейрохирургической интенсивной терапии и нейроанатомии под руководством Одри Аджи из Сиднея. 26–31 Они подчеркнули актуальность измененного отражения волн как явления, возникающего в результате ограничения мозгового кровообращения человека в твердом черепе 32,33 и возможности того, что повышение внутричерепного давления после травмы головы может быть идентифицировано, объяснил и даже количественно путем анализа формы волны давления и потока в сонных артериях и их корешках.Взгляды могут объяснить возникновение «резонанса» в системных артериях у людей с повышенным внутричерепным давлением или стенозом сонной артерии 34 (Рисунок 4). Была повышена актуальность тем акустической и классической музыки.
Рисунок 4.
Волны давления, зарегистрированные одновременно в восходящей аорте и лучевой артерии пожилого мужчины (около 65 лет) с окклюзией одной внутренней сонной артерии, недавним инфарктом головного мозга и клиническим диагнозом повышенного внутричерепного давления (после 21 ).Волна давления показывает увеличение поздней систолической (или ранней диастолической) волны, что свидетельствует об отражении высокой волны от сжатого сосудистого русла головного мозга. Запись ЭКГ показана вверху. Частота пульса (приблизительно 200 / мин) в 3 раза выше, чем частота сердечных сокращений (ЭКГ) (приблизительно 70 / мин), из-за резонанса в артериальном дереве с преувеличением третьей гармоники пульса.
Рисунок 4.
Волны давления, зарегистрированные одновременно в восходящей аорте и лучевой артерии пожилого мужчины (около 65 лет) с окклюзией одной внутренней сонной артерии, недавним инфарктом головного мозга и клиническим диагнозом повышенного внутричерепного давления (после 90–354) 21 ).Волна давления показывает увеличение поздней систолической (или ранней диастолической) волны, что свидетельствует об отражении высокой волны от сжатого сосудистого русла головного мозга. Запись ЭКГ показана вверху. Частота пульса (приблизительно 200 / мин) в 3 раза выше, чем частота сердечных сокращений (ЭКГ) (приблизительно 70 / мин), из-за резонанса в артериальном дереве с преувеличением третьей гармоники пульса.
Наблюдаемые явления можно объяснить только на основе отражения волн, как это было представлено на встрече ISH Тейлором в 1994 году и на последующих встречах в Париже, организованных Safar et al.Считается, что отражение волн в артериальном дереве позвоночных вызывается не разветвлением магистральных артерий или эластической неоднородностью системных артерий (что аналогично у людей и позвоночных), а резким прекращением проводящих артерий с низким сопротивлением до очень высоких. артериолы сопротивления на самом конце артериального древа во всех органах и тканях, в пределах 1 см от капилляров размером 10 мкм, в которых среднее давление падает дальше и резко до венозного уровня.
Доказательства этой точки зрения исходят из исследований Молла, Шлейера, Грина и Ибералла, собранных и обсужденных Милнором в его учебнике «Гемодинамика» в 1989 году. 35 Это представлено в Таблице 2 и на Рисунке 5. Результаты показывают, что множественные отражающие участки расположены на периферическом артериальном русле всех органов, где сопротивление кровотоку резко возрастает по мере того, как кровь течет в капилляры на очень короткую длину (всего несколько мм). ). Это тот же механизм, который мы принимаем для объяснения периферийного сопротивления и того, как Гамильтон и Доу объясняли происхождение отражения волн. 24 В нем объясняется, как в катетерных лабораториях по всему миру катетеры можно перемещать ретроградно от паха к сердцу или мозгу или антероградно вниз по ноге ниже колена с легкостью и без значительного падения среднего давления, несмотря на прохождение через несколько участков разветвления. .На разветвлениях и на ветвях размеры дочерних сосудов по отношению к родительским имеют такой размер, чтобы минимизировать отражение волн. 36 Артериальная «магистраль» восходящей аорты к крошечной артерии используется для прохождения всех типов катетеров, стентов, устройств для извлечения тромба, баллонов и даже аортальных клапанов от периферических до центральных артерий без каких-либо препятствий. Тем не менее инженеры, физиологи, клиницисты и даже кардиологи-инвазивы утверждают, что сама пульсовая волна встречает сопротивление и отражение волны в аорте и крупных артериях, т.е.е., в «артериальной магистрали» с низким сопротивлением и высокой проводимостью. Это не имеет смысла!
Таблица 2. Модельс размерами сосудов у собаки весом 20 кг (после 35 )
| Номер класса . | Сосуды . | Средний диаметр (мм) . | Кол-во судов . | Средняя длина (мм) . | Общее поперечное сечение (см 2 ) . | Общий объем (мл) . | Общий объем крови . | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Системный | |||||||||||||||||||
| 1 | Аорта | (19–4,5) | 1 | (2,8–0,2) | 40 | 150,0 | 5,0 | 75 | |||||||||||
| 3 | Артерии | 1.300 | 500 | 45,0 | 6,6 | 30 | |||||||||||||
| 4 | Артерии | 0,450 | 6000 | 13,5 | 9,5 | 0,150 | 110,000 | 4,0 | 19,4 | 8 | |||||||||
| 6 | Артериолы | 0,050 | 2.8 × 10 6 | 1,2 | 55,0 | 7 | |||||||||||||
| 7 | Капилляры | 0,008 | 2,7 × 10 9 | 0,66 1357 | |||||||||||||||
| 8 | Венулы | 0,100 | 1,0 × 10 7 | 1,6 | 785,4 | 126 | |||||||||||||
| 9 | Жилы | 280660,000 | 4,8 | 406,4 | 196 | ||||||||||||||
| 10 | Жилы | 0,700 | 40,000 | 1,800 | 2,100 | 45,0 | 53,4 | 240 | 67% | ||||||||||
| 12 | Жилы | 4,500 | 1,100 | 150.0 | 17,5 | 263 | |||||||||||||
| 13 | Вены полые | (5–14) | 2 | (0,2–1,5) | 92 | 92 | 92 | 1,406 | |||||||||||
| Легочная | |||||||||||||||||||
| 1 | Основная артерия | 1.600 | 1 | 28.0 | 2,0 | 6 | |||||||||||||
| 2 | Артерии | 4000 | 20 | 10,0 | 2,5 | 25 | |||||||||||||
| 9037 14,0 | 12,2 | 17 | 3% | ||||||||||||||||
| 4 | Артериолы | 0,100 | 1,5 × 10 6 | 0.7 | 120,0 | 8 | |||||||||||||
| 5 | Капилляры | 0,008 | 2,7 × 10 9 | 0,5 | 1357,0 | 68 8 | 0,110 | 2,0 × 10 6 | 0,7 | 190,0 | 13 | ||||||||
| 7 | Жилы | 1,100 | 1650 | 14.0 | 15,7 | 22 | |||||||||||||
| 8 | Жилы | 4,500 | 25 | 100,0 | 35 | 35 | 5% | 30,0 | 6 | ||||||||||
| 200 | 30 | ||||||||||||||||||
| Желудочки | 2 | 54 | 5% | ||||||||||||||||
| 1,690 | 100% | ||||||||||||||||||
| Номер класса . | Сосуды . | Средний диаметр (мм) . | Кол-во судов . | Средняя длина (мм) . | Общее поперечное сечение (см 2 ) . | Общий объем (мл) . | Общий объем крови . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Системный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | Аорта | (19–4,5) | 1 | (2.8–0,2) | 60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | Артерии | 4.000 | 40 | 150,0 | 5,0 | 75 | 45,0 | 6,6 | 30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | Артерии | 0,450 | 6000 | 13,5 | 9,5 | 11% | 5 | 150110,000 | 4,0 | 19,4 | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | Артериолы | 0,050 | 2,8 × 10 6 | 1,2 | 1,2 | Капилляры | 0,008 | 2,7 × 10 9 | 0,65 | 1357,0 | 88 | 5% | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 | Венулы | 0.100 | 1,0 × 10 7 | 1,6 | 785,4 | 126 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | Вены | 0,280 | 4,8 | 4,8 | Жилы | 0,700 | 40,000 | 13,5 | 154,0 | 208 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 | Жилы | 1.800 | 2,100 | 45,0 | 53,4 | 240 | 67% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 | Жилы | 4.500 | 1,100 | каваэ | (5–14) | 2 | (0,2–1,5) | 92 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | Основная артерия | 1.600 | 1 | 28,0 | 2,0 | 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | Артерии | 4000 | 20 | 10,0 | 2,5 |
Модель размеров сосудов у собаки массой 20 кг (после 35 )
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


