Агонист-антагонист — Agonist-antagonist — qaz.wiki
Агонист против антагонистаВ фармакологии термин агонист-антагонист или смешанный агонист / антагонист используется для обозначения лекарственного средства, которое в одних условиях ведет себя как агонист (вещество, которое полностью активирует рецептор, с которым оно связывается), а в других условиях ведет себя как антагонист ( вещество, которое связывается с рецептором, но не активируется и может блокировать активность других агонистов).
Типы смешанных агонистов / антагонистов включают лиганды рецепторов, которые действуют как агонисты для некоторых типов рецепторов и антагонисты для других, или агонисты в одних тканях, в то время как антагонисты в других (также известные как селективные модуляторы рецепторов ).
Синаптические рецепторы
Для синаптических рецепторов агонист — это соединение, которое увеличивает активацию рецептора, связываясь непосредственно с ним или увеличивая количество времени, в течение которого нейротрансмиттеры находятся в синаптической щели. Антагонист — это соединение, которое оказывает противоположное действие агониста. Он снижает активацию синаптического рецептора за счет связывания и блокирования нейромедиаторов от связывания или за счет уменьшения количества времени, в течение которого нейротрансмиттеры находятся в синаптической щели. Эти действия могут быть выполнены с помощью нескольких механизмов. Обычным механизмом для агонистов является ингибирование обратного захвата , при котором агонист блокирует повторное проникновение нейротрансмиттеров в пресинаптический терминал аксона. Это дает нейротрансмиттеру больше времени в синаптической щели, чтобы действовать на синаптические рецепторы. Напротив, антагонисты часто связываются непосредственно с рецепторами в синаптической щели, эффективно блокируя связывание нейромедиаторов.
На альфа — адренорецепторов , ( R ) -3-nitrobiphenyline представляет собой α 2C селективный агонист, а также является слабым антагонистом на & alpha ; 2А и & alpha ; 2В подтипов.
Опиоиды-агонисты-антагонисты
Наиболее известными агонистами-антагонистами являются опиоиды . Примеры таких опиоидов:
Опиоиды-агонисты-антагонисты обычно имеют максимальный эффект — при приеме определенной дозы они не увеличивают свою эффективность. Следовательно, опиоиды-агонисты-антагонисты имеют более низкий потенциал привыкания, но также более низкую анальгетическую эффективность и с большей вероятностью вызывают психотомиметические эффекты.
Опиоиды-агонисты-антагонисты, которые блокируют дельта при активации мю-опиоидных рецепторов, вызывают анальгезию без развития толерантности .
Смотрите также
Ссылки
<img src=»https://en.wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>эффект, эффективность, активность, агонист (полный, частичный), антагонист. Клиническое различие понятий активность и эффективность лекарств.
Эффективность – мера реакции по оси эффекта – величина отклика биологической системы на фармакологическое воздействие; это способность ЛС оказывать максимально возможное для него действие. Т.е. фактически это максимальная величина эффекта, которую можно достигнуть при введении данного лекарства. Численно характеризуется величиной Еmax. Чем выше Еmax, тем выше эффективность лекарства
Активность – мера чувствительности к ЛС по оси
концентраций, характеризует аффинность
(сродство лиганда к рецептору), показывает,
какая доза (концентрация) ЛС способна
вызвать развитие стандартного эффекта,
равного 50% от максимально возможного
для этого лекарства.
Численно характеризуется величиной
ЕС50 или ED50.
Чем выше активность ЛС, тем меньшая его
доза требуется для воспроизведения
терапевтического эффекта.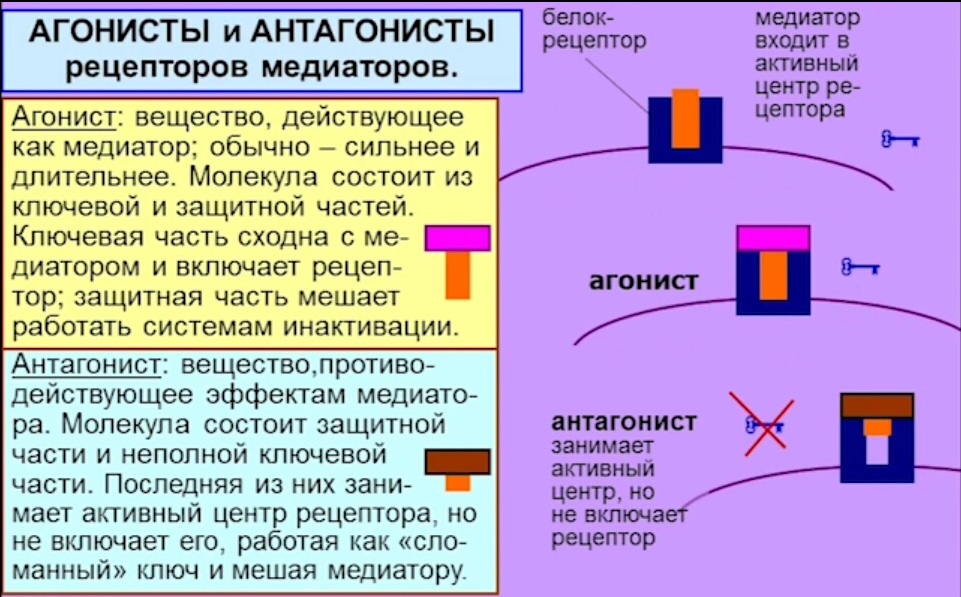
Эффективность: 1=2>3
Активность: 1>3>2
В клинической деятельности важнее знать эффективность, а не активность, т.к. нас больше интересует способность ЛС вызывать определенное действие в организме.
Агонист – лиганд, который связывается с рецептором и вызывает биологическую реакция, срабатывание физиологической системы. Полный агонист – максимальный отклик, частичный – вызывают меньшую реакцию даже при оккупации всех рецепторов.
Антагонист — лиганды занимающие рецепторы или изменяющие их таким образом, что они утрачивают способность взаимодействовать с другими лигандами, но сами не вызывающие биологической реакции (блокируют действие агонистов).
Конкурентные антагонисты
Неконкурентные антагонисты — необратимо изменяют сродство рецепторов к агонисту, связывание часто происходит не с активным участком рецептора, увеличение концентрации агониста не устраняет действие антагониста. Неконкурентный антагонист снижает Emax, не изменяет EC50, кривая «доза-эффект» сжимается относительно вертикальной оси.
33. Количественные закономерности действия лекарств. Закон уменьшения отклика биологических систем. Модель Кларка и ее следствия. Общий вид зависимости концентрация – эффект в нормальных и логнормальных координатах.
Модель Кларка-Ариенса:
1. Взаимодействие между лигандом (L) и рецептором (R) обратимы.
2. Все рецепторы для данного лиганда – эквивалентны и независимы (их насыщение не влияет на другие рецепторы).
3. Эффект прямо пропорционален числу занятых рецепторов.
4. Лиганд существует в двух состояниях: свободном и связанном с рецептором.
А)
,
гдеKd
– константа равновесия, Ke
– внутренняя активность.
Б) Т.к. при возрастании количества лигандов в какой-то момент времени все рецепторы окажутся заняты, то максимально возможное количество образованных комплексов лиганд-рецептор описывается формулой:
[RL] = [R] × (1)
Эффект определяется вероятностью активации рецептора при связывании с лигандом, т.е. его внутренней активностью (Ке), поэтому E = Ke×[RL]. При этом эффект максимален при Ке=1 и минимален и Ке=0. Естественно, что максимальный эффект описывается соотношением Emax = Ke×[Rобщий], где [Rобщий] – общее число рецепторов для данного лиганда
Эффект зависит и от концентрации лиганда на рецепторах [С], поэтому
E = Emax (2)
Из приведенных соотношений вытекает, что EC50=Kd
Emax – максимальный эффект, Bmax– максимальное число связанных рецепторов, EC50 – концентрация ЛС, при которой возникает эффект, равный половине от максимального, Kd – константа диссоциации вещества от рецептора, при которой связано 50% рецепторов.
Закону убывания отклика соответствует параболическая зависимость «концентрация – эффективность». Ответ на малые дозы ЛС обычно возрастает прямо пропорционально дозе. Однако при увеличении дозы прирост ответной реакции снижается и в конечном счете может быть достигнута доза, при которой не происходит дальнейшего увеличения ответа (за счет оккупации всех рецепторов для данного лиганда).
34. Изменение эффекта лекарств. Градуальная и квантовая оценка эффекта, сущность и клинические приложения. Меры количественной оценки активности и эффективности лекарств в экспериментальной и клинической практике.
Все фармакологические эффекты можно условно разделить на две категории:
а) градуальные
(непрерывные, интегральные) эффекты – такие эффекты ЛС, которые могут быть
измерены количественно { действие
гипотензивных ЛС – по уровню АД}.
Описываются градуальной «кривой
доза-эффект» (см. в. 36), на основе которой
можно оценить: 1)
индивидуальную чувствительность к ЛС
2) активность ЛС 3) максимальную
эффективность ЛС
в. 36), на основе которой
можно оценить: 1)
индивидуальную чувствительность к ЛС
2) активность ЛС 3) максимальную
эффективность ЛС
б) квантовые эффекты – такие эффекты ЛС, которые являются дискретной величиной, качественным признаком, т.е. описываются всего лишь несколькими вариантами состояний {головная боль после приема анальгетика или есть, или нет}. Описывается квантовой кривой доза-эффект, где отмечают зависимость проявления эффекта в популяции от величины принимаемой дозы ЛС. График зависимости доза-эффект при этом имеет куполообразный вид и идентичен Гауссовой кривой нормального распределения. На основе квантовой кривой можно : 1) оценить популяционную чувствительность ЛС 2) отметить наличие эффекта при данной дозе 3) выбрать среднюю терапевтическую дозу.
Различия между градуальной и квантовой характеристикой «доза-эффект»:
Параметр | Градуальная кривая | Квантовая кривая |
Характер эффекта | Количественный | Качественный |
Возможность построения | У индивидуума | В популяции |
Сила ЛС | Определяется величиной EC50 (ED50) | Определяется величиной EC50 (ED50) |
Эффективность | Определяется величиной Emax | Не может быть определена без специального анализа |
Вид кривой | Экспоненциальная зависимость (S-образная в полулогарифмических координатах) | Кривая Гауссова распределения |
Количественная
оценка активности и эффективности ЛС
проводится на основе построения кривых
«доза-эффект» и их последующей оценке
(см. в.35)
в.35)
| Буторфанол | ||||
| Буторфанол | Р-р д/в/м и в/в введения 2 мг/1 мл: амп. 5 или 10 шт. рег. №: П N016247/01 от 25.02.10 | |||
| Буторфанол | Р-р д/инъекц. 0.2%: амп. 1 мл 5 или 10 шт. рег. №: Р N001327/01 от 10.03.09 | |||
| Буторфанола тартрат | Р-р д/в/в и в/м введения 2 мг/1 мл: амп. | |||
| Буторфанола тартрат | Р-р д/в/м введения 2 мг/1 мл: шприц-тюбики 1 шт. рег. №: П N014372/01 от 12.09.08 | |||
| Налбуфин | Р-р д/в/в и в/м введения 10 мг/1 мл: амп. 5 или 10 шт. рег. №: Р N003470/01 от 18.02.10 | |||
| Налбуфин | Р-р д/инъекц. 10 мг/1 мл: амп. 5 шт. рег. №: ЛСР-000074 от 23.05.07 | |||
| Налбуфин | Р-р д/инъекц. | |||
| Налбуфин Серб | Р-р д/инъекц. 10 мг/1 мл: амп. 5 шт. рег. №: ЛС-000018 от 26.02.10 | |||
| Налбуфин Серб | Р-р д/инъекц. 20 мг/2 мл: амп. 5 шт. рег. №: ЛС-000018 от 26.02.10 | |||
| Налбуфина гидрохлорид | Р-р д/в/в и в/м введения 10 мг/1 мл: амп.10 шт. рег. №: ЛП-000437 от 28.02.11 | |||
| Налбуфина гидрохлорид | Р-р д/в/в и в/м введения 20 мг/1 мл: амп. | |||
| Таргин® | Таб. с пролонгированным высвобождением, покр. пленочной оболочкой, 2.5 мг+5 мг: 20 шт. рег. №: ЛП-002880 от 25.02.15 Дата перерегистрации: 27.12.17Таб. с пролонгированным высвобождением, покр. пленочной оболочкой, 5 мг+10 мг: 20 шт. рег. №: ЛП-002880 от 25.02.15 Дата перерегистрации: 27.12.17Таб. с пролонгированным высвобождением, покр. пленочной оболочкой, 10 мг+20 мг: 20 шт. рег. №: ЛП-002880 от 25.02.15 Дата перерегистрации: 27.12.17Таб. с пролонгированным высвобождением, покр. пленочной оболочкой, 20 мг+40 мг: 20 шт. рег. №: ЛП-002880 от 25.02.15 Дата перерегистрации: 27.12.17 |
больше, чем антагонисты? – тема научной статьи по фундаментальной медицине читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
Обзоры и оригинальные статьи
Reviews
ИНВЕРСИРОВАННЫЕ АГОНИСТЫ: БОЛЬШЕ, ЧЕМ АНТАГОНИСТЫ?
Аляутдин Р. Н., Романов Б.К.
Н., Романов Б.К.
Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации, Москва
Резюме. В обзоре представлены сведения о лекарственных препаратах, обладающих свойствами инверсированных агонистов. Рассмотрены особенности взаимодействия лиганд — рецептор при конститутивной кон-формационной активности последнего. Многие лиганды, считающиеся нейтральными антагонистами, проявляют в экспериментальных системах отрицательную внутреннюю активность. Это позволяет предположить, что их терапевтическое действие обусловлено не только блокадой рецепторов, но также снижением их спонтанной активности. В статье приведены примеры инверсированных агонистов, влияющих на процессы возбуждения адренергических, гистаминовых,опиоидных, бензодиазепиновых и других рецепторов. Обсуждается взаимосвязь между конститутивной активностью и патофизиологией заболеваний.
Ключевые слова: инверсированные антагонисты,римонабант,внутрен-няя активность,конститутивная активность рецепторов.
INVERSE AGONISTS: MORE THAN JUST ANTAGONISTS?
Alyautdin R.N., Romanov B.K.
Federal State Budgetary Institution «Scientific Centre for Expert Evaluation of Medicinal Products», Ministry of Health of the Russian Federation, Moscow
Abstract. This review presents information on pharmaceuticals that have the properties of inverse agonists. The article describes the features of the interaction of the ligand — receptor with constitutive conformational changes. Many of ligands, assumed to be neutral antagonists, behave as inverse agonists displaying negative efficacy in experimental systems. This suggests that their therapeutic actions may involve not only receptor blockade, but also the decrease of spontaneous receptor activity. Examples of inverse agonists that influence the processes of excitation of adrenergic, histaminergic, opioid and benzodiazepine receptors are presented. The existence of constitutive activity in vivo and its pathophysiological relevance are also discussed.
This suggests that their therapeutic actions may involve not only receptor blockade, but also the decrease of spontaneous receptor activity. Examples of inverse agonists that influence the processes of excitation of adrenergic, histaminergic, opioid and benzodiazepine receptors are presented. The existence of constitutive activity in vivo and its pathophysiological relevance are also discussed.
Key words: inverse agonists, rimonabant, intrinsic activity, constitutive activity.
В ноябре 2009 г. европейский ре-гуляторный орган EMA (European Medicines Agency) отменил регистрацию лекарственного средства для лечения ожирения римонабант, применявшегося с 2006 г. в 56 странах (кроме США, так как FDA не санкционировало применение этого препарата) [1].
Римонабант является инверсированным агонистом каннабиноидных СВ1 рецепторов. Известно, что кан-набиноидная система имеет важное значение в развитии алиментарного ожирения и возбуждение СВ1 рецепторов не только стимулирует аппетит, но также приводит к метаболическим расстройствам [2, 3].
Римонабант относится к высокоэффективным средствам от ожирения, которое наряду со снижением веса обеспечивало нормализацию таких факторов кардиометаболиче-ского риска, как уровень триглице-ридов, С реактивного белка, уровня липопротеинов высокой плотности (ЛПВП), чувствительности к инсулину [1].
Вместе с тем, непредвиденные нежелательные реакции — тошнота, рвота, расстройства психики, возникавшие у 26% пациентов привели к тому, что римонабант постигла участь его предшественников, фен-термина и сибутрамина — препарат был отозван с рынка. Одновременно были прекращены клинические исследования нескольких препаратов, по механизму действия аналогичных римонабанту.
Механизм действия препарата — инверсированный агонизм в отноше-
нии СВ1 рецепторов позволяет предположить, что кроме блокады этих рецепторов существуют дополнительные аспекты его действия. Подтверждением этого постулата служит исследование Canals M., Milligan G., в котором авторы указывают на влияние конститутивной активности СВ1 рецепторов на функции опиоид-ной системы [4].
Подтверждением этого постулата служит исследование Canals M., Milligan G., в котором авторы указывают на влияние конститутивной активности СВ1 рецепторов на функции опиоид-ной системы [4].
Согласно бинарной модели рецептор может находиться в активном (Ra) или неактивном (Ri) состояниях. Без внешнего воздействия между этими состояниями устанавливается равновесие, которое может быть сдвинуто с помощью лигандов этих рецепторов.
Лиганды, связывающиеся с рецептором и вызывающие сдвиг равновесия в сторону активной формы рецепторов, являются агонистами, а лиганды, обладающие аффинитетом, но не имеющие внутренней активности, не влияют на равновесное состояние системы и относятся к антагонистам.
Таким образом, антагонисты «замораживают» соотношение Ra и Ri форм рецепторов, лишь препятствуя сдвигу этого соотношения за счет внешнего воздействия. Частичные агонисты обладают меньшим, чем полные агонисты, сродством и/или внутренней активностью [5]. Это означает, что при создании эквимолярных концентраций полного и частичного агонистов количество рецепторов, перешедших из состояния Ra в Ri для последнего будет меньшим (менее 100%) (рис. 1).
Рис. 1. Типы взаимодействия лигандов с рецепторами
Эта логичная и стройная модель была существенно дополнена в 80-е годы ХХ столетия. В работах E. Bur-gissert и соавт. и С. Braestrap и со-авт. было отмечено необычное поведение некоторых лигандов мускари-новых и ГАМК-рецепторов, не укладывавшееся в понятия агонист/анта-гонист [6, 7].
Практически одновременно было показано, что два антагониста бензо-диазепиновых рецепторов Ro 15-1788 (из группы имидазодиазепинов) и метил бета-карболин-3-карбоксилат (бета-ССМ) ожидаемо устраняли действие бензодиазепинов, но при этом бета-ССМ вызывал судороги у мышей, крыс, кошек и бабуинов [8]. -рецепторов.
-рецепторов.
Спонтанная (конститутивная) активность рецепторов характерна для многих медиаторных систем, что, как следствие, позволяет выявить эффект инверсивного действия лиган-дов (табл. 1).
ным действием, типичным для полных агонистов, а, напротив, вызывают потливость, тошноту, сердцебиение, чувство стеснения в груди, тре-
Таблица 1. Инверсированные агонисты, используемые в клинической практике
Рецептор-мишень Подтип рецептора Пример инверсированного агониста
Ангиотензиновый АТ, Кандесартан, ирбесартан, олмесартан
Адренергический альфа Празозин, теразозин
Адренергический бета Метопролол, карведилол, тимолол
Гистаминовый Н, Цетиризин, лоратадин
Каннабиноидный СВ, Римонабант
Лейкотриеновый Монтелукаст, зафирлукаст
Окситоциновый Атосибан
Опиоидный И Налоксон
Серотонинергический 5НТ2С Клозапин, оланзапин, рисперидон
Холинергический м, Пирензепин
Холинергический Мз Дарифенацин, толтеронид
мор и неосознанный страх, т.е. симптомы тревожного состояния. При комбинированном применении нейро-активных соединений инверсированный агонист этих рецепторов ИО 194603 был эффективным антагонистом этанола, устраняя характерные локомоторные нарушения и снижая потребление этанола у линии алкоголь-предпочитающих крыс [11].
Опиоидные рецепторы. Хроническое введение морфина увеличивает конститутивную активность мю-опиоидных рецепторов, что позволяет исследовать эффекты инверсированных агонистов. Налоксон, обладающий такими свойствами, снижает спонтанную активацию опиоидных рецепторов, что приводит к возникновению абстинентного синдрома [12].
Дофаминовые и серотониновые рецепторы. Галоперидол проявляет свойства полного инверсированного агониста дофаминовых рецепторов, в то время как клозапин — лишь частичного. Однако в отношении се-ротониновых 5НТ2С рецепторов атипичные антипсихотические средства (клозапин, оланзапин, рисперидон) являются инверсированными агони-стами, а типичные нейролептики — нейтральными антагонистами. Таким образом, различия между типичными и атипичными антипсихотическими средствами состоят не только в спектре, но и характере взаимодействия с рецепторами. Многообещающие данные получены в отношении других подтипов серотониновых рецепторов. Так, инверсированный аго-нист 5-НТ1В рецепторов SB-224289 облегчал обучение экспериментальных животных, при этом антагонисты 5-НТ1В рецепторов ослабляли его действие [13].
Ангиотензиновые рецепторы. Конститутивная активация характерна для АТ1 рецепторов. Механиче-
ские растяжения мышцы сердца приводят к спонтанной активации этих рецепторов без участия ангиотензи-на. Лазартан, кандесартан и олме-сартан проявляют свойства инверсированных агонистов и способны снизить экспрессию генов, а также реакцию протеинкиназы на внешние стимулы [14].
Адренорецепторы. В исследованиях на изолированных миоцитах, полученных у пациентов с сердечной недостаточностью, было показано, что карведилол и метопрополол обладают свойствами инверсированных агонистов в отношении бета1-рецепторов, в то время как буцин-долол проявляет свойства их антагониста. шп-регуляции рецепторов, что приводит к снижению эффективности лечения. Инверсированные агонисты (надолол) при хроническом применении увеличивают число постсинаптических рецепторов, что может быть использовано при лечении бронхиальной астмы [16].
шп-регуляции рецепторов, что приводит к снижению эффективности лечения. Инверсированные агонисты (надолол) при хроническом применении увеличивают число постсинаптических рецепторов, что может быть использовано при лечении бронхиальной астмы [16].
Таким образом, спонтанная конститутивная активность характерна для рецепторов практически всех ме-диаторных систем. Это предполагает наличие соответствующих инвертированных агонистов, свойства которых отличаются от нейтральных антагонистов. Вместе с тем, в настоящее время отсутствует целенаправ-
Литература
ленный поиск новых инверсированных агонистов, данные об этих свойствах являются результатом экспериментальных исследований уже известных препаратов. Возможно, что новые знания о механизмах развития патологических состояний откроют мишени для новых инвертированных агонистов.
1. Kang JG, Park CY. Anti-Obesity Drugs: A Review about Their Effects and Safety//. Diabetes Metab. J. 2012.V.36. P.13-25.
2. Ravinet TC, Delgorge C, Menet C, Arnone M, Soubrin P. CB1 cannabinoid receptor knockout in mice leads to leanness, resistance to diet-induced obesity and enhanced leptin sensitivity//. J. Obes. Rela.t Metab. Disord. 2004. V.28. P.640-648.
3. Pang Z, Wu NN, Zhao W, Chain DC, Schaffer E, Zhang X. The central cannabinoid CB1 receptor is required for diet-induced obesity and rimonabant’s antiobesity effects in mice.// Obesity (Silver Spring). 2011. V.19. P.1923-1934.
4. Canals M, Milligan G. Constitutive activity of the cannabinoid CB1 receptor regulates the function of co-expressed mu opioid receptors.// J. Biol.Chem. 2008.V. 283. P. 11424 -1134.
5. jo J, Lima MG, de Jesus Oliveira B. Role of serotonin in zebrafish (Danio rerio) anxiety: relationship with serotonin levels and effect of buspirone, WAY 100635, SB 224289, fluoxetine and para-chlorophenylalanine (pCPA) in two behavioral models.//Neuropharmacology. 2013. V.71.P. 83-97.
jo J, Lima MG, de Jesus Oliveira B. Role of serotonin in zebrafish (Danio rerio) anxiety: relationship with serotonin levels and effect of buspirone, WAY 100635, SB 224289, fluoxetine and para-chlorophenylalanine (pCPA) in two behavioral models.//Neuropharmacology. 2013. V.71.P. 83-97.
14. Yasuda N, Akazawa H, Qin Y, Zou Y, Komuro I. A novel mechanism of mechanical stress-induced angiotensin II type 1-receptor activation without the involvement of angio-tensin II.// Naunyn Schmiedebergs Arch. Pharmacol. 2008. V.377. P. 393-399.
15. Zhang F, Steinberg SF. S49G and R389G polymorphisms of the P-adrenergic receptor influence signaling via the cAMP-PKA and eRk pathways.\\ Physiol. Genomics. 2013. V.45. P. 1186-1192.
16. Nguyen LP, Omoluabi O, Parra S, Joanna M, Frieske JM, Clement C, et al. Chronic exposure to beta-blockers attenuates inflammation and mucin content in a murine asthma model.// Am. J. Respir. Cell Mol. Biol. 2008. V.38. P.256-262.
Длительно‐действующие мускариновые антагонисты (ДДМА), добавленные к комбинации длительно‐действующих бета2‐агонистов и ингаляционных кортикостероидов (ДДБА/ИКС) против ДДБА/ИКС для взрослых с астмой — Kew, KM — 2016
Помогает ли добавление тиотропия, длительно‐действующего мускаринового антагониста (ДДМА), к комбинированной терапии (ДДБА/ИКС), контролировать астму?
Добавление ингалятора ДДМА тиотропия Респимат, к комбинации ингалятора ДДБА/ИКС может уменьшить потребность в пероральных стероидах при приступах. Заметная польза в отношении качества жизни маловероятна, и мы не можем сказать, уменьшало ли это число госпитализаций, но добавление тиотропия имело некоторую пользу в отношении функции легких, контроля астмы и несерьезных побочных эффектов.
Более детально об исследованиях и результатах:
Ежедневное использование ингалятора, содержащего длительно‐действующий бета2‐агонист и ингаляционный кортикостероид (ДДБА/ИКС) может улучшить симптомы и уменьшить вероятность приступов астмы. Если это не помогает, другой тип ингаляционных лекарств, называемых длительно‐действующими мускариновыми антагонистами (ДДМА), которые эффективны для людей с другими дыхательными нарушениями, доступны в настоящее время для людей с астмой для приема наряду с их ингаляторами ДДБА/ИКС.
Если это не помогает, другой тип ингаляционных лекарств, называемых длительно‐действующими мускариновыми антагонистами (ДДМА), которые эффективны для людей с другими дыхательными нарушениями, доступны в настоящее время для людей с астмой для приема наряду с их ингаляторами ДДБА/ИКС.
Мы хотели выяснить, лучше ли добавление ДДМА к ДДБА/ИКС, чем продолжение только ДДБА/ИКС для взрослых с астмой.
Мы нашли четыре приемлемых исследования, но одно было прекращено до того, как кто‐либо вошел в него. Другие три сравнивали ДДМА, который называется тиотропий Респимат, с плацебо в течение примерно года; участники в обеих группах продолжали принимать свои обычные ингаляторы ДДБА/ИКС. Люди, как правило, имели плохую функцию легких, когда они входили в исследования, что предполагало, что их астма не была хорошо контролируема ‐ в респираторной медицине это известно как «тяжелая астма».
За 48 недель, 328 из 1000 лицам, принимавшим свои обычные ДДБА/ИКС, пришлось принимать курс пероральных стероидов по сравнению с 271 принимавших также тиотропий. Однако, неопределенность в результатах значит, что вместо 271 человек, принимающих пероральные стероиды, могло быть от 218 до 333 человек на каждую 1000, которым пришлось бы принимать пероральные стероиды, так что мы не можем быть уверены в пользе. Оценка качества жизни не была такой различной между теми, кто принимал тиотропий и теми, кто не принимал. Исследования показали разные результаты по вопросу, с большей ли вероятностью люди, принимавшие тиотропий, страдали от серьёзных побочных эффектов; но у меньшего числа людей были несерьезные побочные эффекты в случае, если они принимали тиотропий.
Мы не можем сказать, уменьшает ли прием тиотропия в дополнение к ДДБА/ИКС число людей, которым пришлось идти в больницу из‐за приступа астмы, потому что это не происходило достаточно часто, чтобы мы были уверены в результате. Были доказательства высокого качества, которые показали пользу для функции легких и, возможно, небольшую пользу в отношении контроля астмы.
Что лучше добавлять, мускариновые антагонисты [антагонисты мускариновых рецепторов; М-холиноблокаторы] длительного действия или бета2-агонисты длительного действия, к ингаляционным кортикостероидам у людей с неконтролируемой астмой?
Основной вопрос
Различия между мускариновыми антагонистами длительного действия (МАДД) и бета2-агонистами длительного действия (БАДД), в основном, незначительные или неопределенные, основанные на исследованиях длительностью менее шести месяцев. Существующие доказательства недостаточно сильные, чтобы поддержать использование МАДД вместо БАДД у людей с астмой, неконтролируемой ингаляционными кортикостероидами.
Почему этот вопрос важен?
Люди с плохо контролируемой астмой часто страдают приступами, которые требуют дополнительного лечения и пребывания в больнице.
БАДД являются ингаляционными лекарствами, которые могут облегчить симптомы и уменьшить вероятность приступов астмы в случаях, когда применение только ингаляционных кортикостериодов не помогает, но они могут иметь серьезные побочные эффекты. МАДД — другой вид ингаляционных лекарств, которые уже используются при других заболеваниях легких, являются возможным новым вариантом лечения для этой группы людей с астмой.
Как мы ответили на этот вопрос?
Мы провели поиск рандомизированных контролируемых исследований (клинические исследования, в которых люди в случайном порядке попадают в одну из двух или более групп лечения), сравнивающих МАДД с БАДД, на фоне применения ингаляционных кортикостероидов, на протяжении, по меньшей мере, 12 недель. Два человека рассмотрели все возможные опубликованные и неопубликованные исследования, которые мы нашли в нескольких базах данных и на веб-сайтах, чтобы установить перечень исследований, рассматривающих интересующий нас вопрос. Самый последний поиск был сделан в апреле 2015 года.
Что мы обнаружили?
Мы не можем сказать, в большей или меньшей степени, люди, принимающие МАДД, нуждались в приеме пероральных кортикостероидов для лечения приступов астмы, чем люди, принимающие БАДД, т. к. немногие люди нуждались в них [пероральных кортикостероидах] и эти исследования показали разные результаты. В целом, на три человека больше на 1000, могли иметь приступ астмы на фоне применения МАДД, но реальный результат мог быть где-то между «на 29 меньше» и «на 61 больше», чем если бы вы принимали БАДД. Аналогичным образом, у слишком малого числа людей в исследованиях были серьезные побочные эффекты или приступы астмы, требующие неотложной медицинской помощи, чтобы оценить, было ли одно лечение лучше, чем другое.
к. немногие люди нуждались в них [пероральных кортикостероидах] и эти исследования показали разные результаты. В целом, на три человека больше на 1000, могли иметь приступ астмы на фоне применения МАДД, но реальный результат мог быть где-то между «на 29 меньше» и «на 61 больше», чем если бы вы принимали БАДД. Аналогичным образом, у слишком малого числа людей в исследованиях были серьезные побочные эффекты или приступы астмы, требующие неотложной медицинской помощи, чтобы оценить, было ли одно лечение лучше, чем другое.
Исследования показали, что МАДД, возможно, были немного лучше, чем БАДД, в отношении функции легких (насколько хорошо работают ваши легкие), а БАДД — немного лучше в отношении качества жизни, но различия были небольшими и мы не можем сказать, являются ли одни из них лучше, чем другие, для большинства исходов.
Эти результаты были, по большей части, основаны на четырех хороших исследованиях с участием около 2000 человек, длительностью от 14 до 24 недель. Во всех этих исследованиях в качестве МАДД изучали лекарство под названием тиотропий.
b2-агонисты: роль и место в лечении бронхиальной астмы | Синопальников А.И., Клячкина И.Л.
Государственный институт усовершенствования врачей МО РФ, Москва
ВведениеТерапия бронхиальной астмы (БА) может быть условно разделена на два основных направления. Первое – симптоматическая терапия, быстро и эффективно купирующая бронхоспазм, ведущий клинический симптом БА. Второе – противовоспалительная терапия, способствующая модификации главного патогенетического механизма заболевания, а именно, воспаления слизистой дыхательных путей (ДП) [1].
Терапия бронхиальной астмы (БА) может быть условно разделена на два основных направления. Первое – симптоматическая терапия, быстро и эффективно купирующая бронхоспазм, ведущий клинический симптом БА. Второе – противовоспалительная терапия, способствующая модификации главного патогенетического механизма заболевания, а именно, воспаления слизистой дыхательных путей (ДП) [1].
Центральное место среди средств симптоматического контроля БА, очевидно, занимают b2–агонисты, характеризующиеся выраженной бронхолитической активностью (и бронхопротективным действием) и минимальным числом нежелательных побочных явлений при их правильном использовании.
Краткая история b2–агонистов
История применения b–агонистов в XX веке – это последовательная разработка и внедрение в клиническую практику лекарственных средств со все более возрастающей b2–адренергической селективностью и увеличивающейся продолжительностью действия.
Впервые симпатомиметик адреналин (эпинефрин) был использован в лечении больных БА в 1900 г. [2]. Поначалу адреналин широко применялся как в инъекционной форме, так и в виде ингаляций. Однако неудовлетворенность врачей кратковременностью действия (1–1,5 ч), большим количеством негативных побочных эффектов препарата явилась стимулом к дальнейшему поиску более «привлекательных» лекарственных средств.
В 1940 г. появился изопротеренол – синтетический катехоламин. Он разрушался в печени так же быстро, как и адреналин (при участии фермента катехол–о–метилтрансферазы – КОМТ), и поэтому характеризовался небольшой продолжительностью действия (1–1,5 ч), а образующиеся в результате биотрансформации изопротеренола метаболиты (метоксипреналин) обладали b–адреноблокирующим действием. В то же время изопротеренол был свободен от таких нежелательных явлений, присущих адреналину, как головная боль, задержка мочи, артериальная гипертензия и др. Изучение фармакологических свойств изопротеренола привело к установлению гетерогенности адренорецепторов [3]. По отношению к последним адреналин оказался универсальным прямым a–b–агонистом, а изопротеренол – первым короткодействующим неселективным b–агонистом [2].
Первым селективным b2–агонистом стал появившийся в 1970 г. сальбутамол, характеризовавшийся минимальной и клинически незначимой активностью в отношении a– и b1–рецепторов. Он по праву приобрел статус «золотого стандарта» в ряду b2–агонистов. За сальбутамолом последовало внедрение в клиническую практику других b2–агонистов (тербуталин, фенотерол и др.). Эти препараты оказались столь же эффективны в качестве бронхолитиков, как и неселективные b–агонисты, поскольку бронхолитический эффект симпатомиметиков реализуется только через b2–адренорецепторы. Вместе с тем b2–агонисты демонстрируют существенно менее выраженное стимулирующее воздействие на сердце (батмотропное, дромотропное, хронотропное) по сравнению с b1–b2–агонистом изопротеренолом [4].
Он по праву приобрел статус «золотого стандарта» в ряду b2–агонистов. За сальбутамолом последовало внедрение в клиническую практику других b2–агонистов (тербуталин, фенотерол и др.). Эти препараты оказались столь же эффективны в качестве бронхолитиков, как и неселективные b–агонисты, поскольку бронхолитический эффект симпатомиметиков реализуется только через b2–адренорецепторы. Вместе с тем b2–агонисты демонстрируют существенно менее выраженное стимулирующее воздействие на сердце (батмотропное, дромотропное, хронотропное) по сравнению с b1–b2–агонистом изопротеренолом [4].
Некоторые различия в селективности b2–агонистов не имеют серьезного клинического значения. Большая частота нежелательных кардиоваскулярных эффектов при приеме фенотерола (по сравнению с сальбутамолом и тербуталином) может быть объяснена большей эффективной дозой препарата и, отчасти, более быстрой системной абсорбцией. У новых препаратов сохранилось быстродействие (наступление эффекта в первые 3–5 минут после ингаляции), характерное для всех предшествующих b–агонистов при заметном увеличении продолжительности их действия до 4–6 часов (менее выраженном при тяжелой БА). Это улучшало возможности контроля за симптомами БА в течение дня, но «не спасало» от ночных приступов [4,5].
Появившаяся возможность приема отдельных b2–агонистов внутрь (сальбутамол, тербуталин, формотерол, бамбутерол) в некоторой степени решала проблему контроля ночных приступов БА. Однако необходимость принимать значительно более высокие дозы (почти в 20 раз больше, чем при ингаляционном применении) способствовала появлению нежелательных явлений, связанных со стимуляцией a– и b1–адренорецепторов. Кроме того, была выявлена и более низкая терапевтическая эффективность этих препаратов [5].
Значительно изменило возможности терапии БА появление пролонгированных ингаляционных b2–агонистов – сальметерола и формотерола.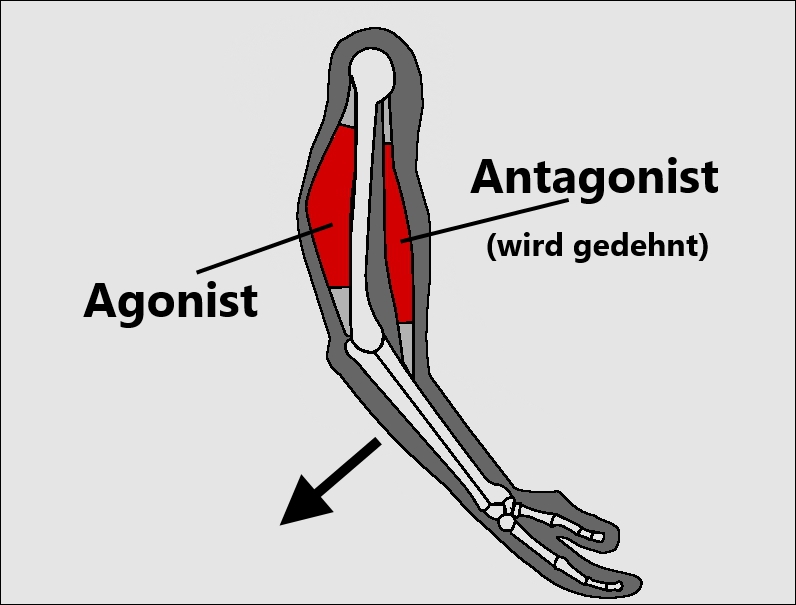 Первым появился на рынке сальметерол – высокоселективный b2–агонист, демонстрирующий продолжительность действия, по крайней мере, в течение 12 часов, но с медленным началом действия. Вскоре к нему «присоединился» формотерол, также являющийся высокоселективным b2–агонистом с 12–часовым действием, но со скоростью развития бронходилатационного эффекта, аналогичной таковой сальбутамола [4]. Уже в первые годы применения пролонгированных b2–агонистов было отмечено, что они способствуют урежению обострений БА, уменьшению количества госпитализаций, а также снижению потребности в ингаляционных кортикостероидах (ИГКС).
Первым появился на рынке сальметерол – высокоселективный b2–агонист, демонстрирующий продолжительность действия, по крайней мере, в течение 12 часов, но с медленным началом действия. Вскоре к нему «присоединился» формотерол, также являющийся высокоселективным b2–агонистом с 12–часовым действием, но со скоростью развития бронходилатационного эффекта, аналогичной таковой сальбутамола [4]. Уже в первые годы применения пролонгированных b2–агонистов было отмечено, что они способствуют урежению обострений БА, уменьшению количества госпитализаций, а также снижению потребности в ингаляционных кортикостероидах (ИГКС).
Наиболее эффективным путем введения лекарственных препаратов при БА, в том числе и b2–агонистов, признан ингаляционный. Важными преимуществами этого пути являются возможность непосредственной доставки лекарственных препаратов к органу–мишени (что в значительной степени обеспечивает быстродействие бронходилататоров) и минимизация нежелательных эффектов. Из известных в настоящее время средств доставки наиболее часто используются дозированные аэрозольные ингаляторы (ДАИ), реже дозированные порошковые ингаляторы (ДПИ) и небулайзеры. Пероральные b2–агонисты в виде таблеток или сиропов применяются крайне редко, главным образом как дополнительное средство при частых ночных симптомах БА или высокой потребности в ингаляционных короткодействующих b2–агонистах у больных, получающих высокие дозы ИГКС (эквивалентные 1000 мкг беклометазона в сутки и более) [1,6,7].
Механизмы действия b2–агонистов
b2–агонисты вызывают бронходилатацию в первую очередь в результате непосредственной стимуляции b2–адренорецепторов гладких мышц ДП. Доказательства этого механизма были получены как in vitro (при воздействии изопротеренола происходило расслабление бронхов человека и отрезков легочной ткани), так и in vivo (быстрое падение сопротивления ДП после ингаляций бронхолитика) [8].
Стимуляция b–адренорецепторов приводит к активации аденилатциклазы, образущей комплекс с G–протеином (рис.1), под воздействием которого повышается содержание внутриклеточного циклического аденозин–3,5–монофосфата (цАМФ). Последнее приводит к активации специфической киназы (протеинкиназы А), которая фосфорилирует некоторые внутриклеточные белки, в результате чего происходит снижение внутриклеточной концентрации кальция (активное его «перекачивание» из клетки во внеклеточное пространство), тормозится гидролиз фосфоинозитида, ингибируются киназы легких цепей миозина и, наконец, «открываются» большие кальций–активируемые калиевые каналы, обусловливающие реполяризацию (расслабление) гладкомышечных клеток и секвестрацию кальция во внеклеточное депо. Нужно сказать, что b2–агонисты могут связываться с калиевыми каналами и непосредственно вызывать релаксацию гладкомышечных клеток независимо от повышения внутриклеточной концентрации цАМФ [5,9].
Рис.1. Молекулярные механизмы, участвующие в бронходилатационном эффекте b2-агонистов [5] (объяснения в тексте). КСа — большой кальцийактивируемый калиевый канал; АТФ — аденозинтрифосфат; цАМФ — циклический аденозин-3,5-моносфат
b2–агонисты рассматриваются как функциональные антагонисты, обусловливающие обратное развитие бронхоконстрикции вне зависимости от имевшего место констрикторного воздействия. Это обстоятельство представляется чрезвычайно важным, поскольку многие медиаторы (медиаторы воспаления и нейротрансмиттеры) обладают бронхоконстрикторным действием.В результате воздействия на b–адренорецепторы, локализующиеся в различных отделах ДП (табл. 1), выявляются дополнительные эффекты b2–агонистов, которые объясняют возможность профилактического использования препаратов. В их числе угнетение высвобождения медиаторов из клеток воспаления, уменьшение проницаемости капилляров (предотвращение развития отека слизистой бронхов), угнетение холинергической передачи (уменьшение холинергической рефлекторной бронхоконстрикции), модуляция продукции слизи подслизистыми железами и, следовательно, оптимизация мукоцилиарного клиренса (рис. 2).
2).
Рис. 2. Прямой и непрямой бронходилатационный эффект b2-агонистов [5] (объяснения в тексте). Э — эозинофил; ТК — тучная клетка; ХН — холинергический нерв; ГмК — гладкомышечная клетка
Согласно микрокинетической диффузионной теории G.Andersen [10], продолжительность и время начала действия b2–агонистов связаны с их физико–химическими свойствами (в первую очередь липофильностью/гидрофильностью молекулы) и особенностями механизма действия. Сальбутамол – гидрофильное соединение. Попадая в водную среду внеклеточного пространства, он быстро проникает в «сердцевину» рецептора и после прекращения связи с ним удаляется путем диффузии (рис. 3). Сальметерол, созданный на основе сальбутамола, высоко липофильный препарат, быстро проникает в мембраны клеток дыхательных путей, выполняющих функцию депо, и затем медленно диффундирует через мембрану рецептора, обусловливая его длительную активацию и более позднее начало действия. Липофильность формотерола меньше, чем у сальметерола, поэтому он образует депо в плазматической мембране, откуда диффундирует во внеклеточную среду и затем одновременно связывается с b–адренорецептором и липидами, что обусловливает и быстроту наступления эффекта, и увеличение его продолжительности [7] (рис. 3). Продолжительный эффект сальметерола и формотерола объясняется их способностью длительное время находиться в бислое клеточных мембран гладкомышечных клеток в непосредственной близости от b2–адренорецепторов и взаимодействовать с последними.
Рис. 3. Механизм действия b2-агонистов [10] (объяснения в тексте)
При исследовании in vitro спазмированная мышца расслабляется быстрее при добавлении формотерола, нежели сальметерола. Это подтверждает то, что сальметерол является частичным агонистом b2–рецепторов относительно формотерола [5].
Рацематы
Селективные b2–агонисты представляют из себя рацемические смеси (50:50) двух оптических изомеров – R и S. Установлено, что фармакологическая активность R–изомеров в 20–100 раз выше, чем S–изомеров. Показано, что R–изомер сальбутамола проявляет свойства бронхолитика. [11] В то же время S–изомер проявляет прямо противоположные свойства: провоспалительное действие, увеличение гиперреактивности ДП, усиление бронхоспазма, кроме того, он значительно медленнее метаболизируется. Недавно был создан новый препарат, содержащий только R–изомер (левалбутерол). Он существует пока только в растворе для небулайзеров и имеет лучший терапевтический эффект, чем рацемический сальбутамол [12], так как эквивалентный эффект левалбутерол демонстрирует в дозе, равной 25% рацемической смеси (нет противодействующего S–изомера, уменьшено и количество нежелательных явлений) [12,13].
Селективность b2–агонистов
Цель применения селективных b2–агонистов состоит в том, чтобы обеспечить бронходилатацию и при этом избежать нежелательных явлений, индуцируемых стимуляцией a– и b1–рецепторов. В большинстве случаев умеренное применение b2–агонистов не ведет к развитию нежелательных эффектов. Однако селективность не может полностью устранить риск их развития, и тому есть несколько объяснений.
Прежде всего, селективность к b2–адренорецепторам всегда относительна и дозозависима. Незначительная активация a– и b1–адренорецепторов, незаметная при обычных среднетерапевтических дозах, становится клинически значимой при увеличении дозы препарата или частоты его приема в течение дня. Дозозависимый эффект b2–агонистов необходимо учитывать при лечении обострений БА, особенно жизнеугрожающих состояний, когда повторные ингаляции в течение короткого времени (нескольких часов) в 5–10 раз превышают допустимую суточную дозу. [2, 5]
b2–рецепторы широко представлены в ДП (табл. 1). Плотность их увеличивается по мере уменьшения диаметра бронхов, а у больных БА плотность b2–рецепторов в дыхательных путях выше, чем у здоровых. Многочисленные b2–адренорецепторы найдены на поверхности тучных клеток, нейтрофилов, эозинофилов, лимфоцитов [14]. И в то же время b2–рецепторы находят в разнообразных тканях и органах, особенно в левом желудочке, где они составляют 14% всех b–адренорецепторов, и в правом предсердии – 26% всех b–адренорецепторов [11]. Стимуляция этих рецепторов может привести к развитию нежелательных явлений, включая тахикардию, трепетание предсердий и ишемию миокарда. Стимуляция b2–рецепторов скелетных мышц может вызвать мышечный тремор. Активация больших калиевых каналов может способствовать развитию гипокалиемии и, как следствие этого – удлинению интервала QT и нарушениям сердечного ритма, в т.ч. фатальным. При системном введении больших доз препаратов могут наблюдаться метаболические эффекты (увеличение уровня свободных жирных кислот в сыворотке крови, инсулина, глюкозы, пирувата и лактата) [5].
1). Плотность их увеличивается по мере уменьшения диаметра бронхов, а у больных БА плотность b2–рецепторов в дыхательных путях выше, чем у здоровых. Многочисленные b2–адренорецепторы найдены на поверхности тучных клеток, нейтрофилов, эозинофилов, лимфоцитов [14]. И в то же время b2–рецепторы находят в разнообразных тканях и органах, особенно в левом желудочке, где они составляют 14% всех b–адренорецепторов, и в правом предсердии – 26% всех b–адренорецепторов [11]. Стимуляция этих рецепторов может привести к развитию нежелательных явлений, включая тахикардию, трепетание предсердий и ишемию миокарда. Стимуляция b2–рецепторов скелетных мышц может вызвать мышечный тремор. Активация больших калиевых каналов может способствовать развитию гипокалиемии и, как следствие этого – удлинению интервала QT и нарушениям сердечного ритма, в т.ч. фатальным. При системном введении больших доз препаратов могут наблюдаться метаболические эффекты (увеличение уровня свободных жирных кислот в сыворотке крови, инсулина, глюкозы, пирувата и лактата) [5].
При стимуляции сосудистых b2–рецепторов развивается вазодилатация и возможно снижение диастолического артериального давления. Особенно выражены нежелательные кардиальные эффекты в условиях тяжелой гипоксии во время обострений БА – увеличение венозного возврата (особенно в положении ортопноэ) может вызвать развитие синдрома Bezold–Jarisch с последующей остановкой сердца [15].
Связь между b2–агонистами и воспалением в ДП
В связи с широким использованием b2–агонистов короткого действия, а также внедрением в клиническую практику пролонгированных ингаляционных b2–агонистов стал особенно актуальным вопрос о том, обладают ли эти препараты противовоспалительным действием. Несомненно, противовоспалительным эффектом b2–агонистов, способствующим модификации острого воспаления бронхов, можно считать угнетение высвобождения медиаторов воспаления из тучных клеток и уменьшение проницаемости капилляров. В то же время при биопсии слизистой бронхов больных БА, регулярно принимающих b2–агонисты, было установлено, что число клеток воспаления, в т.ч. и активированных (макрофаги, эозинофилы, лимфоциты) не уменьшается [5, 16].
В то же время при биопсии слизистой бронхов больных БА, регулярно принимающих b2–агонисты, было установлено, что число клеток воспаления, в т.ч. и активированных (макрофаги, эозинофилы, лимфоциты) не уменьшается [5, 16].
При этом теоретически регулярный прием b2–агонистов может даже привести к усугублению воспаления в ДП. Так, обусловливаемая b2–агонистами бронходилатация позволяет осуществить более глубокий вдох, результатом чего может стать более массивная экспозиция аллергенов.
Кроме того, регулярное применение b2–агонистов может маскировать развивающееся обострение, тем самым задерживая начало или усиление истинной противовоспалительной терапии.
Потенциальный риск использования b2–агонистов
Толерантность
Частое регулярное применение ингаляционных b2–агонистов может привести к развитию толерантности (десенситизации) к ним. Накопление цАМФ способствует переходу рецептора в неактивное состояние. Чрезмерно интенсивная стимуляция b–адренорецепторов способствует развитию десенситизации (уменьшению чувствительности рецепторов в результате разобщения рецептора с G–протеином и аденилатциклазой) [14]. При сохранении избыточной стимуляции уменьшается число рецепторов на поверхности клетки («down»–регуляция). Нужно отметить, что b–рецепторы гладких мышц ДП имеют довольно значительный резерв и поэтому они более устойчивы к десенситизации, чем рецепторы нереспираторных зон (например, скелетной мускулатуры или регулирующие метаболизм). Установлено, что у здоровых лиц быстро развивается толерантность к высоким дозам сальбутамола, а к фенотеролу и тербуталину – нет. Вместе с тем у больных БА толерантность к бронхолитическому эффекту b2–агонистов появляется редко, гораздо чаще развивается толерантность к их бронхопротективному действию.
Уменьшение бронхопротективного действия b2–агонистов при их регулярном, частом применении в равной степени касается и короткодействующих, и пролонгированных препаратов даже на фоне базисной терапии ингаляционными кортикостероидами. В то же время речь идет не о полной потере бронхопротекции, а о небольшом снижении ее первоначального уровня. H.J.van der Woude et al. [17] установили, что на фоне регулярного применения больными БА формотерола и сальметерола бронхолитический эффект последних не снижается, бронхопротективное действие оказывается выше у формотерола, но при этом значительно меньше выражено бронхолитическое действие сальбутамола.
В то же время речь идет не о полной потере бронхопротекции, а о небольшом снижении ее первоначального уровня. H.J.van der Woude et al. [17] установили, что на фоне регулярного применения больными БА формотерола и сальметерола бронхолитический эффект последних не снижается, бронхопротективное действие оказывается выше у формотерола, но при этом значительно меньше выражено бронхолитическое действие сальбутамола.
Десенситизация развивается длительно, в течение нескольких дней или недель, в отличие от тахифилаксии, которая развивается очень быстро и не связана с функциональным состоянием рецепторов. Это обстоятельство объясняет снижение эффективности лечения и требует ограничения частоты применения b2–агонистов [18].
Индивидуальную вариабельность ответа на b2–агонисты и развития толерантности к их бронходилатирующему эффекту многие исследователи связывают с генетическим полиморфизмом генов. Ген b2–адренорецепторов локализуется на 5q хромосоме. Существенное влияние на течение БА и эффективность лечения оказывает изменение аминокислотной последовательности b2–адренорецепторов, в частности, перемещение аминокислот в 16 и 27 кодонах. Влияние полиморфизма генов не распространяется на вариабельность бронхопротективного эффекта. Справедливости ради надо отметить, что эти данные подтверждаются не во всех работах [19–22].
b2–агонисты и смертность больных БА
Серьезные сомнения в безопасности ингаляционных b–агонистов возникли в 60–х годах ХХ столетия, когда в ряде стран, в том числе Англии, Австралии, Новой Зеландии разразилась «эпидемия смертей» среди больных БА [23]. При этом высказывалось предположение о связи между терапией симпатомиметиками и увеличением смертности от БА. Причинно–следственные взаимоотношения между применением b–агонистов (изопротеренола) и возросшей смертностью тогда не были установлены, а по результатам ретроспективных исследований доказать их было практически невозможно. Связь же между приемом фенотерола и повышением смертности от БА в Новой Зеландии в 80–е годы удалось доказать, поскольку было установлено, что этот препарат чаще назначался в случаях фатальной БА, по сравнению с хорошо контролируемым заболеванием. Эта связь была косвенно подтверждена и снижением смертности, совпавшей с отменой широкого приема фенотерола (при общем увеличении продаж других b2–агонистов). В этом плане показательны результаты эпидемиологического исследования в Канаде, ставившего своей целью изучить возможную связь между частотой летальных исходов и назначаемыми лекарственными средствами [24]. Было показано, что возрастание частоты летальных исходов ассоциируется с высокодозной терапией любым из доступных ингаляционных b2–агонистов. Риск фатального исхода был наибольшим при применении фенотерола, однако при упорядоченном сравнении с эквивалентными дозами сальбутамола показатели смертности достоверно не отличались.
Связь же между приемом фенотерола и повышением смертности от БА в Новой Зеландии в 80–е годы удалось доказать, поскольку было установлено, что этот препарат чаще назначался в случаях фатальной БА, по сравнению с хорошо контролируемым заболеванием. Эта связь была косвенно подтверждена и снижением смертности, совпавшей с отменой широкого приема фенотерола (при общем увеличении продаж других b2–агонистов). В этом плане показательны результаты эпидемиологического исследования в Канаде, ставившего своей целью изучить возможную связь между частотой летальных исходов и назначаемыми лекарственными средствами [24]. Было показано, что возрастание частоты летальных исходов ассоциируется с высокодозной терапией любым из доступных ингаляционных b2–агонистов. Риск фатального исхода был наибольшим при применении фенотерола, однако при упорядоченном сравнении с эквивалентными дозами сальбутамола показатели смертности достоверно не отличались.
В то же время связь между высокодозной терапией b2–агонистами и увеличением смертности от БА надежно доказать не удается, поскольку больные с более тяжелой и плохо контролируемой БА чаще прибегают к помощи высоких доз b2–агонистов и, напротив, реже – к помощи эффективных противовоспалительных лекарственных средств. Кроме того, высокие дозы b2–агонистов маскируют признаки нарастающего фатального обострения БА [16].
Режим дозирования
Ингаляционные короткодействующие b2–агонисты
Не вызывает сомнений тот факт, что ингаляционные короткодействующие b2–агонисты являются препаратами выбора для ситуационного симптоматического контроля БА [1], а также для предупреждения развития симптомов астмы физического усилия (АФУ). Регулярное же применение ингаляционных b–агонистов может привести к утрате адекватного контроля над течением заболевания. Так, в исследовании, проведенном M.R. Sears et al. в Новой Зеландии [25], изучались бронхиальная гиперреактивность, утренняя ПСВ, ежедневные симптомы и потребность в ИГКС у пациентов, использующих b2–агонисты «по требованию», по сравнению с больными, применяющими фенотерол регулярно 4 раза в день. В группе больных с регулярным приемом фенотерола наблюдался плохой контроль над симптомами БА, кроме того, отмечались более частые и тяжелые обострения по сравнению с группой больных, применяющих b2–агонисты «по требованию» в течение полугода. У последних же наблюдались улучшение показателей функции внешнего дыхания, утренней ПСВ, снижение ответа на бронхопровокационную пробу с метахолином. Повышение гиперреактивности бронхов на фоне регулярного приема короткодействующих b2–агонистов, скорее всего, связано с наличием S–энантомеров в рацемической смеси препарата [26–27].
В группе больных с регулярным приемом фенотерола наблюдался плохой контроль над симптомами БА, кроме того, отмечались более частые и тяжелые обострения по сравнению с группой больных, применяющих b2–агонисты «по требованию» в течение полугода. У последних же наблюдались улучшение показателей функции внешнего дыхания, утренней ПСВ, снижение ответа на бронхопровокационную пробу с метахолином. Повышение гиперреактивности бронхов на фоне регулярного приема короткодействующих b2–агонистов, скорее всего, связано с наличием S–энантомеров в рацемической смеси препарата [26–27].
В отношении сальбутамола подобные закономерности установить не удалось, хотя, как и в случае с фенотеролом, его регулярный прием сопровождался незначительным возрастанием бронхиальной гиперреактивности. Имеются отдельные доказательства того, что регулярное применение сальбутамола сопровождается возрастанием частоты эпизодов АФУ и увеличением выраженности воспаления в ДП [5].
Короткодействующие b2–агонисты должны использоваться (в т.ч. и в рамках монотерапии) только «по требованию». Маловероятно, что обычно рекомендуемый режим дозирования b2–агонистов «по требованию» может ухудшить контроль над течением БА, однако при использовании высоких доз препарата ухудшение контроля становится реальным. Более того, многие больные становятся особенно чувствительными к агонистам при наличии полиморфизма b2–адренорецепторов, что обусловливает более быстрое ухудшение контроля [28]. Связь, установленная между повышением риска смерти у больных БА и применением высоких доз ингаляционных b2–агонистов, отражает лишь степень тяжести заболевания. Возможно также, что высокие дозы ингаляционных b2–агонистов оказывают вредоносное воздействие на течение БА [16]. Больные, получающие высокие дозы b2–агонистов (более 1,4 баллончика аэрозоля в месяц), безусловно, нуждаются в эффективной противовоспалительной терапии, в т. ч. и с целью уменьшения дозы b2–агонистов [28]. При увеличении потребности в бронходилататорах (чаще трех раз в неделю) показано дополнительное назначение противовоспалительных препаратов, а при употреблении b2–агонистов более 3–4 раз в день для купирования симптомов – увеличение их дозы.
ч. и с целью уменьшения дозы b2–агонистов [28]. При увеличении потребности в бронходилататорах (чаще трех раз в неделю) показано дополнительное назначение противовоспалительных препаратов, а при употреблении b2–агонистов более 3–4 раз в день для купирования симптомов – увеличение их дозы.
Прием короткодействующих b2–агонистов с целью бронхопротекции также ограничивается «разумными пределами» (не более 3–4 раз в сутки). Бронхопротективные свойства b2–агонистов позволяют многим высококвалифицированным спортсменам, страдающим БА, выступать в соревнованиях международного уровня (правила позволяют использовать короткодействующие b2–агонисты для профилактики АФУ при условии, что заболевание врачебно верифицировано). Так, например, на Олимпийских играх 1984 г. в Лос–Анджелесе принимали участие 67 спортсменов с АФУ, из которых 41 получил медали разного достоинства [29]. Известно, что пероральные b2–агонисты способствуют повышению работоспособности за счет увеличения мышечной массы, белкового и липидного анаболизма, психостимуляции [30,31,32]. В исследовании С.Goubart et al. [33] было показано, что влияние ингаляционных b2–агонистов у здоровых спортсменов ограничивается лишь небольшой бронходилатацией, которая, впрочем, может вносить существенный вклад в улучшение дыхательной адаптации в начале нагрузки.
Пролонгированные ингаляционные b2–агонисты
Доступные в настоящее время пролонгированные ингаляционные b2–агонисты – формотерол и сальметерол оказывают свое действие в течение 12 часов с равноценным бронхолитическим эффектом. Тем не менее различия между ними есть. В первую очередь, это быстродействие формотерола (в форме ДПИ), сопоставимое со временем начала действия сальбутамола (в форме ДАИ) [34], что позволяет использовать формотерол в качестве средства скорой помощи, вместо короткодействующих b2–агонистов. В то же время нежелательных явлений при использовании формотерола существенно меньше, чем при применении сальбутамола [17]. Эти препараты могут использоваться в качестве монотерапии у больных с легким течением БА в качестве бронхопротекторов при АФУ. При использовании формотерола чаще 2 раз в неделю «по требованию» необходимо добавлять к лечению ИГКС.
Эти препараты могут использоваться в качестве монотерапии у больных с легким течением БА в качестве бронхопротекторов при АФУ. При использовании формотерола чаще 2 раз в неделю «по требованию» необходимо добавлять к лечению ИГКС.
Следует отметить, что монотерапия пролонгированными b2–агонистами на регулярной основе не рекомендуется, так как до сих пор нет надежных доказательств их противовоспалительного, модифицирующего заболевание действия [35].
Есть научно обоснованные доказательства целесообразности комбинированного применения ИГКС и бронходилататоров. Кортикостероиды усиливают экспрессию b2–рецепторов и уменьшают потенциальную десенситизацию, в то время как пролонгированные b2–агонисты увеличивают чувствительность кортикостероидных рецепторов к ИГКС [36].
Проведенные к настоящему времени исследования свидетельствуют о возможности более раннего назначения пролонгированных ингаляционных b2–агонистов. Так, например, у больных с неадекватным контролем астмы на фоне приема 400–800 мкг ИГКС дополнительное назначение сальметерола обеспечивает более полный и адекватный контроль по сравнению с увеличением дозы ИГКС. Формотерол демонстрирует сходный эффект и одновременно способствует уменьшению частоты обострений заболевания. Эти и ряд других исследований свидетельствуют о том, что добавление пролонгированных ингаляционных b2–агонистов к низко–среднедозовой терапии ИГКС у больных с неадекватным контролем БА равноценно удвоению дозы стероидов [5].
В настоящее время рекомендовано использовать пролонгированные ингаляционные b2–агонисты только у больных, одновременно получающих ИГКС. Многообещающими представляются фиксированные комбинации, такие как сальметерол с флютиказоном (Серетид) и формотерол с будесонидом (Симбикорт). При этом отмечается лучшая комплаентность, исключается риск использования только одного из препаратов в рамках длительной терапии заболевания.
Литература:
1. National Institutes of Health, National Heart, Lung, and Blood Institute. Expert Panel Report 2: Guidelines for the Diagnosis and Management of Asthma. Bethesda, Md: National Institutes of Health, National Heart, Lung, and Blood Institute; April 1997. NIH publication 97–4051.
National Institutes of Health, National Heart, Lung, and Blood Institute. Expert Panel Report 2: Guidelines for the Diagnosis and Management of Asthma. Bethesda, Md: National Institutes of Health, National Heart, Lung, and Blood Institute; April 1997. NIH publication 97–4051.
2. Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. В 2–х томах. Москва: Медицина; 1991 г.
3. Машковский М.Д. Лекарственные средства. Москва: Медицина; 1984 г.
4. Show M. B2–agonists, from pharmacological properties to everyday clinical practice. International workshop report (based on a workshop held in London, UK February 28–29, 200)
5. Barnes P.J. b–Agonists, Anticholinergics, and Other Nonsteroid Drugs. In: Albert R., Spiro S., Jett J., editors. Comprehensive Respiratory Medicine. UK:Harcourt Publishers Limited; 2001. p.34.1–34–10
6. Updating guidelines on asthma in adults (editorial). BMJ 2001; 323:1380–1381.
7. Jonson M. b2–adrenoceptor agonists: optimal pharmacological profile. In: The role of b2–agonists in asthma management. Oxford: The Medicine Group; 1993. p. 6–8.
8. Barnes P.J. beta–adrenergic receptors and their regulation. Am J Respir Crit Care Med. 1995; 152:838–860.
9. Kume H., Takai A., Tokuno H., Tomita T. Regulation of Ca2+ dependent K+–channel activity in tracheal myocytes by phosphorylation. Nature 1989; 341:152–154.
10. Anderson G.P. Long acting inhaled beta–adrenoceptor agonists: the comparative pharmacology of formoterol and salmeterol. Agents Actions Suppl. 1993; 43:253–269.
11. Stiles GL, Taylor S, Lefkowitz RJ. Human cardiac beta–adrenergic receptors: subtype heterogeneity delineated by direct radioligand binding. Life Sci. 1983; 33:467–473.
12. Prior JG, Cochrane GM, Raper SM, Ali C, Volans GN. Self–poisoning with oral salbutamol. BMJ. 1981; 282:1932.
13. Handley D. The asthma–like pharmacology and toxicology of (S)–isomers of beta agonists. J Allergy Clin Immunol. 1999;104: S69–S76.
J Allergy Clin Immunol. 1999;104: S69–S76.
14. .Jonson M., Coleman R. Mechanisms of action beta–2–adrenoceptor agonists. In: Bisse W., Holgate S., editorials. Asthma and Rhinitis. Blackwell Science; 1995. p.1278–1308.
15. Burggsaf J., Westendorp R.G.J., in’t Veen J.C.C.M et al. Cardiovascular side effects of inhaled salbutamol in hypoxic asthmatic patients. Thorax 2001; 56: 567–569.
16. Van Shayck C.P., Bijl–Hoffland I.D., Closterman S.G.M. et al. Potential masking effect on dispnoea perception by short– and long–acting b2–agonists in asthma. ERJ 2002; 19:240–245.
17. Van der Woude H.J., Winter T.N., Aalbers R. Decreased bronchodilating effect of salbutamol in relieving methacholine induced moderate to severe bronchoconstriction during high dose treatment with long acting b2 agonists. Thorax 2001; 56: 529–535.
18. Nelson HS. Clinical experience with levalbuterol. J Allergy Clin Immunol. 1999; 104:S77–S84.
19. Lipworth BJ, Hall IP, Tan S, Aziz I, Coutie W. Effects of genetic polymorphism on ex vivo and in vivo function of b2–adrenoceptors in asthmatic patients. Chest 1999;115:324–328.
20. Lipworth BJ, Kopelman G.H., Wheatley A.P. et al. b2–adrenoceptor promoter polymorphism: extended halotypes and functional effects in peripheral blood mononuclear cells. Thorax 2002; 57: 61–66.
21. Lima JJ, Thomason DB, Mohamed MH, Eberle LV, Self TH, Johnson JA. Impact of genetic polymorphisms of the b2–adrenergic receptor on albuterol bronchodilator pharmacodynamics. Clin Pharm Ther 1999; 65:519–525.
22. Kotani Y, Nishimura Y, Maeda H, Yokoyama M. b2–adrenergic receptor polymorphisms affect airway responsiveness to salbutamol in asthmatics. J Asthma 1999; 36:583–590.
23. Taylor D.R., Sears M.R., Cockroft D.W. The beta–agonist controversy. Med Clin North Am 1996; 80: 719–748.
24. Spitzer WO, Suissa S, Ernst P, et al. The use of beta–agonists and the risk of death and near death from asthma. N Engl J Med 1992; 326:501–506.
Spitzer WO, Suissa S, Ernst P, et al. The use of beta–agonists and the risk of death and near death from asthma. N Engl J Med 1992; 326:501–506.
25. Sears MR, Taylor DR, Print CG, et al. Regular inhaled beta–agonist treatment in bronchial asthma. Lancet 1990; 336:1391–1396.
26. Handley D. The asthma–like pharmacology and toxicology of (S)–isomers of beta agonists. J Allergy Clin Immunol. 1999; 104:S69–S76.
27. Nelson HS. Clinical experience with levalbuterol. J Allergy Clin Immunol 1999;104:S77–S84.
28. Liggett S.B. Polymorphisms of the b2–adrenergic receptor in asthma. Am J Respir Cri. Care Med 1997; 156: S 156–162.
29. Voy R.O. The US Olympic Commitee experience with exercise–induced bronchospasm. Med Sci Exerc 1986; 18:328–330.
30. Lafontan M, Berlan M, Prud’hon M. Les agonistes beta–adrenergiques. Mecanismes d’action: lipomobilisation et anabolisme. Reprod Nutr Develop 1988; 28:61–84
31. Martineau L, Horan MA, Rothwell NJ, et al. Salbutamol, a b2–adrenoceptor agonist, increases skeletal muscle strength in young men. Clin Sci 1992; 83: 615–621.
32. Price AH, Clissold SP. Salbutamol in the 1980s. A reappraisal of its clinical efficacy. Drugs 1989; 38: 77–122.
33. Goubault C, Perault M–C, Leleu et al. Effects of inhaled salbutamol in exercising non–asthmatic athletes Thorax 2001; 56: 675–679.
34. Seberova E, Hartman P, Veverka J, et al. Formoterol given by Turbuhaler® had a rapid onset of action as salbutamol given by pMDI. Program and abstracts of the 1999 International Conference of the American Thoracic Society; April 23–28, 1999; San Diego, California. Abstract A637.
35. Wallin A., Sandstrom T., Soderberg M. et al. The effects of regular inhaled formoterol, budesonide, and placebo on mucosal inflammation and clinical indices of mild asthma. Am J Respir Crit Care Med. 1998; 158:79–86.
36. Greening AP, Ind PW, Northfield M, Shaw G. Added salmeterol versus higher–dose corticosteroid in asthma patients with symptoms on existing inhaled corticosteroid. Allen & Hanburys Limited UK Study Group. Lancet. 1994; 334:219–224.
Greening AP, Ind PW, Northfield M, Shaw G. Added salmeterol versus higher–dose corticosteroid in asthma patients with symptoms on existing inhaled corticosteroid. Allen & Hanburys Limited UK Study Group. Lancet. 1994; 334:219–224.
.
Агонист-антагонист — обзор | Темы ScienceDirect
Резюме
Смешанные опиоидные агонисты-антагонисты обладают рядом преимуществ по сравнению с чистыми опиоидными агонистами, такими как меперидин, фентанил и морфин. Хотя угнетение дыхания является важным фактором при назначении опиоидных агонистов, этот риск был снижен (хотя и не устранен) с помощью опиоидных агонистов-антагонистов. При приеме этих препаратов могут развиваться респираторные проблемы, но они возникают реже.
Пентазоцин доступен уже более 30 лет. Он редко используется внутривенно для седации из-за значительного количества негативных психотомиметических эффектов. Кроме того, сегодня известно, что физическая зависимость от пентазоцина действительно возникает. 138,174
Буторфанол, более недавнее дополнение к арсеналу, кажется, имеет меньше серьезных побочных эффектов, чем пентазоцин. Тем не менее, он вызывает увеличение нагрузки на сердечно-сосудистую систему, что снижает его использование у пациентов с сердечно-сосудистым риском. 166,172
Налбуфин обладает всеми преимуществами буторфанола; однако он не увеличивает нагрузку на сердечно-сосудистую систему и является отличным антагонистом опиоидов. 147,165 Еще одним преимуществом буторфанола и налбуфина является то, что они являются внеплановыми лекарствами, не требующими специальных форм или документов для их покупки или приема. Пентазоцин — это лекарство из Списка IV, а опиоидные агонисты — из Списка II.
Примечание: На протяжении всего обсуждения опиоидных агонистов и опиоидных агонистов-антагонистов в разделах «Предупреждения» и «Меры предосторожности» упоминалось, что использование этих агентов у пациентов со значительной дисфункцией печени или почек или и тем и другим. , а пациентам со значительной болезнью легких (ХОБЛ) противопоказан.Пожалуйста, имейте в виду, что использование седативных средств средней степени тяжести в / в ранее рекомендовалось пациентам, которые были отнесены к 1 и 2 классам физического статуса по ASA, и только несколько избранных пациентов с ASA 3 считались приемлемыми. Пациенты, упомянутые в разделах «Предупреждения» и «Меры предосторожности», считаются, в лучшем случае, ASA 3, а обычно — ASA 4. Соблюдение основных принципов отбора пациентов для внутривенной умеренной седации минимизирует количество проблем, которые могут возникнуть у этих пациентов. .
, а пациентам со значительной болезнью легких (ХОБЛ) противопоказан.Пожалуйста, имейте в виду, что использование седативных средств средней степени тяжести в / в ранее рекомендовалось пациентам, которые были отнесены к 1 и 2 классам физического статуса по ASA, и только несколько избранных пациентов с ASA 3 считались приемлемыми. Пациенты, упомянутые в разделах «Предупреждения» и «Меры предосторожности», считаются, в лучшем случае, ASA 3, а обычно — ASA 4. Соблюдение основных принципов отбора пациентов для внутривенной умеренной седации минимизирует количество проблем, которые могут возникнуть у этих пациентов. .
Агонисты и антагонисты — UTS Pharmacology
Злодей, который помогает нашему телу? Агонисты и антагонисты (черновой вариант)
Когда мы говорим об антагонистах и агонистах, нет, мы не говорим о злодеях из кино, пытающихся уничтожить половину населения Вселенной, вместо этого мы говорим о лекарствах, которые взаимодействуют с рецепторами нашего тела.
агонисты и антагонисты; обсудите ключевые различия между ними.
Агонист — это лекарство, которое связывается с рецептором, вызывая аналогичный ответ на предполагаемое химическое вещество и рецептор. В то время как антагонист — это лекарство, которое связывается с рецептором либо на первичном сайте, либо на другом сайте, что все вместе останавливает рецептор от выработки ответа.
Основное различие между этими двумя препаратами состоит в том, что один имитирует предполагаемую реакцию, когда антагонист связывается с рецептором и останавливает / замедляет ответы.Агонисты по существу имитируют активность нормальных нейромедиаторов, таких как ацетилхолин, и имитируют аналогичный ответ рецепторов, с которыми они связываются. Прекрасная аналогия — это торговый автомат. Обычно, чтобы купить напиток, вы вставляете монету в 1 доллар в автомат, и в ответ он выплевывает вашу любимую газировку. Агонистом в этом сценарии было бы использование металлического диска того же размера, что и монета, для вставки в автомат, таким образом, используя ту же прорезь для монет с имитацией монеты, чтобы получить газировку.
Антагонист действует противоположно агонисту. Он связывается с рецепторами и мешает рецептору производить желаемый ответ. Возвращаясь к аналогии, это похоже на заклинивание гнезда для монет автомата, так что он не может выполнять свою функцию, пока блокировка не будет устранена.
–Выберите антагонист, обсудите первичный механизм ингибирования и подробно объясните, как это связано со способом, которым он взаимодействует с рецепторами. — [ краткое описание темы, я могу изменить, если смогу найти более интересный антагонист]
Атропин — это обратимый конкурентный антагонист мускариновых рецепторов ацетилхолина, на языке, который мы с вами понимаем, это съемный блокиратор монет для торгового автомата, который контролирует некоторые из наших телесных функций, такие как слюноотделение и частоту сердечных сокращений. [изображение модели замка и ключа]
Атропин подавляет некоторые функции парасимпатической системы, поэтому он влияет на такие вещи, как частота сердечных сокращений, слюноотделение и расширение зрачков. Атропин используется для лечения брадикардии, то есть замедления сердечного ритма, у пациентов, а также для снижения количества слюны, вырабатываемой при некоторых конкретных операциях.
(Посещений 5396 раз, сегодня 8)
агонистов и антагонистов рецепторов | BioAspect
Рецепторы
Рецепторы— это трансмембранные белки, которые обеспечивают передачу химических сигналов из внешнего микроокружения клетки в клетки, а также внутри клетки.Рецепторы обычно встроены в мембрану и обращены либо вне клеток (внеклеточные рецепторы), либо в цитозоль (цитозольные рецепторы). Они также могут находиться в ядре клетки (ядерные рецепторы или факторы транскрипции).
Интересный факт: у нематоды C. elegans имеется 270 ядерных рецепторов. H umans, мыши и крысы, однако, имеют соответственно 48, 49 и 47 ядерных рецепторов каждый !
Рецепторы позволяют осуществлять межклеточную коммуникацию, а также регулировать многие клеточные биохимические процессы (транскрипцию генов, фосфорилирование белков, активацию ферментов и т. Д.).). Состояние активации рецептора изменяется, когда рецептор связывается с лигандом (т.е. эндогенные лиганды могут быть пептидами, гормонами, нейротрансмиттерами, витаминами A и D или другими соединениями). Связывание лиганда обычно запускает конформационное изменение рецептора, которое может активировать или деактивировать рецептор и инициировать каскад событий, необходимых для получения биологического функционального эффекта. В некоторых случаях занятый рецептор фактически сам выражает биологическую активность.Например, занятый рецептор может приобретать ферментативную активность или становиться активным ионным каналом.
Д.).). Состояние активации рецептора изменяется, когда рецептор связывается с лигандом (т.е. эндогенные лиганды могут быть пептидами, гормонами, нейротрансмиттерами, витаминами A и D или другими соединениями). Связывание лиганда обычно запускает конформационное изменение рецептора, которое может активировать или деактивировать рецептор и инициировать каскад событий, необходимых для получения биологического функционального эффекта. В некоторых случаях занятый рецептор фактически сам выражает биологическую активность.Например, занятый рецептор может приобретать ферментативную активность или становиться активным ионным каналом.
Ксенобиотические лиганды, которые вызывают те же биологические эффекты, что и природные лиганды, называются «агонистами рецепторов» . Напротив, «антагонисты рецептора» представляют собой лиганды, которые ингибируют биологическую активность рецептора. Обратите внимание, что концепция агонизма и антагонизма рецепторов относится только к взаимодействию между рецепторами и лигандами, а не к их биологическим эффектам.
См. Наш каталог агонистов и антагонистов рецепторов
Агонисты рецепторов
Агонист является миметиком природного лиганда и оказывает биологический эффект, аналогичный естественному лиганду, когда он связывается с рецептором. Агонисты связываются с рецептором в том же месте связывания, что и природный лиганд, и приводит либо к полной (обычные агонисты), либо к частичной (частичные агонисты) активации . Обычные агонисты увеличивают долю активированных рецепторов. Обратные агонисты — это агенты, которые связываются с тем же рецептором, что и агонист, но вызывают фармакологический ответ, противоположный этому агонисту. Термин «обратный агонистический» ответ имеет смысл только тогда, когда несвязанный свободный рецептор имеет базальную или конститутивную активность.
Обычный агонист увеличивает активность рецептора выше его базального уровня, тогда как обратный агонист снижает активность ниже базального уровня. Примером рецептора, который обладает базовой активностью и для которого были идентифицированы обратные агонисты, является рецептор ГАМК.Агонисты рецептора ГАМК (например, бензодиазепины) создают седативный эффект, тогда как обратные агонисты (например, Ro15-4513) обладают анксиогенным действием или даже судорожным действием (некоторые бета-карболины).
Примером рецептора, который обладает базовой активностью и для которого были идентифицированы обратные агонисты, является рецептор ГАМК.Агонисты рецептора ГАМК (например, бензодиазепины) создают седативный эффект, тогда как обратные агонисты (например, Ro15-4513) обладают анксиогенным действием или даже судорожным действием (некоторые бета-карболины).
Нейтральный антагонист не проявляет активности в отсутствие агониста или обратного агониста, но может блокировать активность любого из них. Эффективность полного агониста по определению составляет 100%, нейтральный антагонист имеет эффективность 0%, а обратный агонист имеет эффективность <0% (т. Е. Отрицательную) (см. График ниже).
Щелкните здесь, чтобы увидеть рецепторы Агонисты от BioAspect и наших высококачественных поставщиков
Антагонисты рецепторов
Антагонисты рецептора являются ингибиторами рецепторной активности. Антагонисты имитируют лиганды, которые связываются с рецептором и предотвращают активацию рецептора естественным лигандом. Предотвращение активации может иметь множество последствий. Если связывание природного агониста с рецептором приводит к усилению клеточной функции, антагонист, который связывает и блокирует этот рецептор, снижает функцию.Антагонисты усиливают клеточную функцию, если они блокируют действие вещества, которое обычно снижает клеточную функцию. И наоборот, антагонисты снижают клеточную функцию, если они блокируют действие вещества, которое обычно увеличивает клеточную функцию. Антагонисты рецепторов могут быть классифицированы как обратимые или необратимые . Обратимые антагонисты легко отделяются от своего рецептора; необратимые антагонисты образуют стабильную химическую связь со своим рецептором (например, путем алкилирования).Псевдо-необратимые антагонисты со временем медленно диссоциируют от своего рецептора. Описаны три типа антагонистов рецептора: конкурентный (связывание с активным сайтом рецептора), неконкурентный (связывание с сайтом, отличным от активного сайта или аллостерическим сайтом рецептора) и неконкурентный . Неконкурентные антагонисты отличаются от неконкурентных антагонистов тем, что они требуют активации рецептора агонистом, прежде чем они смогут связываться с отдельным аллостерическим сайтом связывания.
Неконкурентные антагонисты отличаются от неконкурентных антагонистов тем, что они требуют активации рецептора агонистом, прежде чем они смогут связываться с отдельным аллостерическим сайтом связывания.
Нажмите здесь, чтобы увидеть рецепторы Антагонисты от BioAspect и наших высококачественных поставщиков
опиоидных агонистов, частичных агонистов, антагонистов: Oh My!
Общие побочные эффекты
Тяжелые побочные эффекты
Когнитивные нарушения
Запор
Снижение тестостерона / сексуальная дисфункция
Тошнота / рвота
Ортостатическая гипотония
угнетение дыханияБыло идентифицировано 4 типа опиоидных рецепторов: мю, дельта, каппа и опиоидный рецептор, подобный-1 (ORL-1).Некоторые рецепторы можно разделить на подтипы. Эти рецепторы важны для выражения передачи боли и модуляции путей, включая нейротрансмиссию в лимбической системе, среднем мозге, спинном мозге и таламусе. Опиоидные рецепторы повсеместно присутствуют по всему телу, включая, помимо прочего, желудочно-кишечный тракт (ЖКТ), иммунные клетки, гипофиз и кожу. На этих участках опиоидные рецепторы выполняют различные обезболивающие и неанальгетические функции. Сводка фармакологических и физиологических эффектов для каждого опиоидного рецептора приведена в таблице 2 . 2-4
Таблица. 2. Обобщенные эффекты отдельных опиоидных рецепторов 2-4
Mu
Delta
Каппа
ORL-1
Клинические эффекты
EuphoriaФизическая зависимость
Респираторная
Седация
Анальгезия
Подавление высвобождения дофамина
Модуляция мю-рецептора
Анальгезия
Диурез
Дисфория
000 9000 9000 Оппозиционная дисфория на каппа-рецепторы.
Опиоидные рецепторы — это 7 трансмембранных белков, которые связаны с ингибирующими G-белками. При активации они уменьшают продукцию аденилциклазы вторичного мессенджера циклического аденозинмонофосфата. Это вызывает уменьшение притока кальция из-за ингибирования потенциал-управляемых кальциевых каналов и приводит к активации калиевых каналов, что приводит к гиперполяризации. Гиперполяризованное состояние вызывает подавление нейрональной передачи сигналов, что в данном случае подавляет передачу боли. 2,5
Опиоиды классифицируются по категориям в зависимости от связывания с рецептором и сродства (, таблица 3, ). Эти классификации являются агонистами, частичными агонистами и антагонистами. Есть опиоиды, которые обладают двойными агонистическими и антагонистическими функциями.
Таблица 3. Примеры опиоидов, связывающихся с рецепторами
Полный агонист
Частичный агонист
Смешанный агонист
Антагонист
000
000
000
000 Кодин000 Кодин000 Кодин000 ГидроморфонLevorphanol
Meperidine
Метадон
Морфин
оксикодон
Оксиморфон
бупренорфин
Буторфанол
Пентазоцин
Трамадол
бупренорфин
Буторфанол
Нальбуфин
Пентазоцин
налоксон
Налтрексон
Полные агонисты прочно связываются с опиоидными рецепторами и претерпевают значительные конформационные изменения для достижения максимального эффекта.Примеры полных агонистов включают кодеин, фентанил, героин, гидрокодон, метадон, морфин и оксикодон.
Частичные агонисты вызывают меньшие конформационные изменения и активацию рецепторов, чем полные агонисты. В низких дозах как полные, так и частичные агонисты могут оказывать действие, аналогичное их собратьям полными агонистами. Однако, когда доза частичных агонистов увеличивается, анальгетическая активность выйдет на плато, и дальнейшее увеличение доз не принесет дополнительного облегчения, но может усилить побочные эффекты.Примеры частичных агонистов включают бупренорфин, буторфанол и трамадол.
Однако, когда доза частичных агонистов увеличивается, анальгетическая активность выйдет на плато, и дальнейшее увеличение доз не принесет дополнительного облегчения, но может усилить побочные эффекты.Примеры частичных агонистов включают бупренорфин, буторфанол и трамадол.
Существуют смешанные агонисты / антагонисты, которые демонстрируют разную активность в зависимости от опиоидного рецептора, но также разную дозу. Примеры включают бупренорфин, буторфанол, налбуфин и пентазоцин. Некоторые опиоиды являются агонистами одного или нескольких опиоидных рецепторов, но также являются антагонистами других опиоидных рецепторов. Обобщение рецепторных эффектов агонистов / антагонистов можно найти в Табл. 4. 4
Табл. 4.Рецепторный эффект смешанных опиоидных агонистов / антагонистов 4
Опиоиды
Mu
Каппа
Дельта
Пентазоцин
Антагонист
Агонист
Бупренорфин
Частичный агонист
Антагонист
Антагонист (слабый)
Буторфанол
Антагонист
Пропентазин одобрен для лечения болеутоляющего препарата изопентазина, утвержденный для лечения частичного обезболивающего или налоксон.Механизм действия — частичный агонист мю-опиоидного рецептора и полный агонист каппа-опиоидного рецептора. Хотя пентазоцин слабо противодействует анальгетическим эффектам полных агонистов, он также вызывает неполное обращение депрессии поведения, сердечно-сосудистой системы и дыхания, вызванной морфином и другими полными агонистами. 6
Нальбуфин представляет собой синтетический анальгетический опиоид, проявляющий агонистическую активность в отношении каппа-рецептора, одновременно действуя как антагонист в отношении мю-рецептора.Налбуфин оказывает максимальное воздействие на угнетение дыхания в дозах более 30 мг. Сообщалось, что налбуфин устраняет угнетение дыхания, но не анальгезирует мю-агонисты. 7,8 Нальбуфин может вызвать синдром отмены у пациентов, которые физически зависят от агонистов мю-опиоидов. 9
Сообщалось, что налбуфин устраняет угнетение дыхания, но не анальгезирует мю-агонисты. 7,8 Нальбуфин может вызвать синдром отмены у пациентов, которые физически зависят от агонистов мю-опиоидов. 9
Бупренорфин показан в высоких дозах при расстройствах, связанных с употреблением опиоидов, а в более низких дозах — для лечения умеренной и сильной боли. Составы бупренорфина, одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов, для снятия боли, включают белбука, бупренекс и бутранс. 10-12 Препараты бупренорфина, одобренные для лечения опиоидной зависимости, включают бунавайл, пробуфин, субоксон, субутекс и зубсолв. 13-17 Бупренорфин в 25-100 раз сильнее морфина. 18 Бупренорфин проявляет частичное агонистическое поведение мю-рецептора и проявляет антагонистическое поведение каппа-рецептора. Бупренорфин имеет сильное сродство с мю-рецептором, вызывая сильное связывание и, следовательно, конкуренцию с рецептором, вытесняя другие опиоиды, такие как метадон и морфин.Кроме того, происходит неполная диссоциация мю-рецептора, вызывающая длительную активность рецептора. 18 Сродство количественно определяют с использованием значений Ki, и чем меньше значение Ki, тем сильнее сродство связывания с рецептором. Аффинность связывания мю бупренорфина по сравнению с другими опиоидами можно найти в Таблице 5. Следует отметить, что бупренорфин имеет более высокое сродство связывания по сравнению с налоксоном и, следовательно, в более высоких дозах, когда бупренорфин, скорее всего, будет злоупотреблять, а налоксон не может быстро восстановить его. .Только при более низких дозах наблюдается некоторое конкурентное связывание, и только тогда мы должны разумно ожидать некоторого изменения в результате приема высоких доз налоксона непрерывной инфузии. Это, конечно, вызывает вопрос о полезности комбинированного продукта, субоксона.
Таблица 5. Сродство различных опиоидов к рецепторам Mu 19
Сродство различных опиоидов к рецепторам Mu 19
Опиоиды
Диапазон значения Ki
Леворфанол
0,19 до 0,23 32
9ren 0.От 21 до 1,5Налтрексон
от 0,4 до 0,6 (эффекты антагониста) 20
Фентанил
0,7 до 1,9
Метадон
от 0,72 до 5,6
(эффекты антагонистов) 20
Морфин
от 1,02 до 4
Пентазоцин
от 3,9 до 6,9
Кодеин
от 65 до 135
Из-за эффектов частичного агонизмаa увеличивающиеся дозы, что делает этот вариант жизнеспособным для людей с повышенным риском угнетения дыхания. 21 Антагонизм каппа-рецепторов имеет преимущества для снижения вызванного стрессом поведения, связанного с поиском лекарств, из-за последующей блокады динорфинов. Динорфины — это опиоидные пептиды, селективные к каппа-рецепторам, которые вызывают тревогу, стресс и увеличивают желание употреблять опиоиды. Кроме того, антагонизм каппа продемонстрировал антидепрессивные свойства. 22,23
Буторфанол является антагонистом мю-опиоидов с низкой внутренней активностью и агонистом каппа-опиоидов, проявляющим высокое сродство. Буторфанол показан для снятия боли у пациентов, у которых альтернативные варианты лечения неэффективны, непереносимы или неадекватны, и представлен в виде назального спрея и инъекций.Из-за высокого сродства к каппа-рецепторам он может вызывать психотомиметические эффекты. При более высоких дозах степень угнетения дыхания существенно не увеличивается, как у большинства смешанных агонистов / антагонистов. Однако продолжительность угнетения дыхания больше из-за преобладающих физиологических реакций, опосредованных мю, по сравнению с каппа. 23-25
Опиоидные агонисты также связываются с периферическими мю-опиоидными рецепторами в желудочно-кишечном тракте, вызывая нарушение моторики и секреции, что приводит к запорам. Антагонисты мю-опиоидных рецепторов периферического действия (PAMORA) действуют конкретно в желудочно-кишечном тракте для борьбы с запорами. Однако периферические антагонисты мю-опиоидов не проникают через гематоэнцефалический барьер, что позволяет избежать блокады центрально-опосредованной анальгезии и других центрально-опосредованных эффектов агонистов опиоидов. Примеры ПАМОР включают алвимопан (Энтерег), метилналтрексон (Релистор) и налоксегол (Мовантик). Последние 2 рекомендованы FDA при запорах, вызванных опиоидами, обычно после того, как безрецептурные слабительные не действуют.Однако Алвимопан показан для периоперационного лечения послеоперационной кишечной непроходимости, чтобы ускорить восстановление верхних и нижних отделов ЖКТ после операции. Кроме того, в отличие от всех других ПАМОР, Алвимопан имеет предупреждение в виде черного ящика о потенциальном риске инфаркта миокарда при длительном применении, что не является признанным риском для других ПАМОР. 26-28
Антагонисты мю-опиоидных рецепторов периферического действия (PAMORA) действуют конкретно в желудочно-кишечном тракте для борьбы с запорами. Однако периферические антагонисты мю-опиоидов не проникают через гематоэнцефалический барьер, что позволяет избежать блокады центрально-опосредованной анальгезии и других центрально-опосредованных эффектов агонистов опиоидов. Примеры ПАМОР включают алвимопан (Энтерег), метилналтрексон (Релистор) и налоксегол (Мовантик). Последние 2 рекомендованы FDA при запорах, вызванных опиоидами, обычно после того, как безрецептурные слабительные не действуют.Однако Алвимопан показан для периоперационного лечения послеоперационной кишечной непроходимости, чтобы ускорить восстановление верхних и нижних отделов ЖКТ после операции. Кроме того, в отличие от всех других ПАМОР, Алвимопан имеет предупреждение в виде черного ящика о потенциальном риске инфаркта миокарда при длительном применении, что не является признанным риском для других ПАМОР. 26-28
Наконец, как и в любой большой истории, есть антагонисты. Однако в истории с опиоидами антагонисты опиоидов могут спасти жизни.Налтрексон является антагонистом опиоидов, который блокирует действие опиоидов путем конкурентного связывания. Налтрексон показан при алкогольной и опиоидной зависимости и полезен, поскольку его блокада опиоидных рецепторов вторично снижает активность дофамина, которая в противном случае усиливается алкоголем. 29 Налоксон является антагонистом мю-опиоидных рецепторов и реверсивным средством, используемым для снижения риска вызванного опиоидами угнетения дыхания путем вытеснения полных опиоидных агонистов. Доступные составы — это Наркан (назальный), Евцио (Автоинъектор) и раствор для инъекций, последний из которых часто вводится интраназально без указания инструкции, прикрепляя распылитель к концу шприца. 30,31 Членам семьи, друзьям и посторонним лицам теперь разрешено осуществлять административную деятельность в большинстве штатов (защищенных законами Доброго Самаритянина) в дополнение к профессиональным службам быстрого реагирования, таким как парамедики.
Хотя химический состав опиоидов описан, существуют и другие параметры, которые также необходимо учитывать для определения индивидуальной реакции. К ним относятся возраст, сопутствующие заболевания, тяжесть заболевания, пол, генетика и вес, все из которых могут положительно или отрицательно повлиять на реакцию на лекарство.В дополнение к описанной здесь фармакодинамике многие синтетические опиоиды обладают дополнительными механизмами действия, такими как блокада норадренергического обратного захвата и ингибирование рецепторов n-метил-D-аспартазы (NMDA). По этой причине, как это ошибочно подразумевается недавними рекомендациями CDC, неудача и / или непереносимость одного опиоида не обязательно приравнивается к неудаче другого. Поэтому важно учитывать все эти переменные при принятии решений, влияющих на выбор или прекращение приема опиоидов.
Эта статья является исключительной работой авторов, и высказанные мнения / утверждения не отражают мнение перечисленных работодателей, аффилированных лиц сотрудников и / или фармацевтических компаний.
Ребекка Чу — кандидат медицинских наук, специализируется в области экономики и здравоохранения в Колледже фармации и здравоохранения Олбани (Нью-Йорк).
Александра Чиани — кандидат фармацевтических наук в Фармацевтическом колледже Университета Западной Новой Англии в Спрингфилде, Массачусетс. Она работает стажером в аптеке Hannaford Supermarket Pharmacy в Роттердаме, Нью-Йорк.
Mena Raouf, PharmD, проживает в медицинском центре Stratton VA в Олбани, штат Нью-Йорк.Он закончил резидентуру PGY-1 в системе здравоохранения VA Tennessee Valley в Нэшвилле и получил степень PharmD в Колледже фармации и медицинских наук Олбани (Нью-Йорк).
Ссылки
- Benyamin R, Trescot AM, Datta S, et al. Опиоидные осложнения и побочные эффекты. Врач боли. 2008; 11 (2 доп.): S105-20.
- Вальехо Р., Баркин Р.Л., Ван В.К. Фармакология опиоидов в лечении хронических болевых синдромов.
 Врач-болеутоляющий. 2011; 14 (4): E343-60.
Врач-болеутоляющий. 2011; 14 (4): E343-60. - Waldhoer M, Bartlett SE, Whistler JL. Опиоидные рецепторы. Annu Rev Biochem. 2004; 73: 953–90.
- Нельсон Л.С., Олсен Д. Опиоиды. В: Hoffman RS, Howland M, Lewin NA, Nelson LS, Goldfrank LR. ред. Чрезвычайные токсикологические ситуации Голдфрэнка. 10-е изд. Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл; 2015.
- Аль-Хасани Р., Брюхас М.Р. Молекулярные механизмы передачи сигналов и поведения, зависимых от опиоидных рецепторов. Анестезиология. 2011; 115 (6): 1363-81.DOI: 10.1097 / ALN.0b013e318238bba6.
- Talwin [информация о назначении]. Бриджуотер, Нью-Джерси: Санофи-авентис; 2011. accessdata.fda.gov/drugsatfda_docs/label/2011/018733s015lbl.pdf. По состоянию на 5 января 2018 г.
- Freye E, Azevedo L, Hartung E. Устранение угнетения дыхания, связанного с фентанилом, с помощью налбуфина. Влияние на кривую реакции на CO2 у человека. Acta Anaesthesiol Belg. 1985; 36 (4): 365-74.
- Blaise GA, Nugent M, McMichan JC Durant, PA. Побочные эффекты налбуфина при обращении вызванного опиоидами угнетения дыхания: сообщение о четырех случаях. Can J Anaesth. 1990; 37 (7): 794-7
- Nubain [информация о назначении]. Честнат-Ридж, штат Нью-Йорк: Par Pharmaceutical; 2016. accessdata.fda.gov/drugsatfda_docs/label/2016/018024s041lbl.pdf. По состоянию на 5 января 2018 г.
- Buprenex [информация о назначении]. Норт-Честерфилд, Вирджиния: Indivior; 2017. accessdata.fda.gov/drugsatfda_docs/label/2017/209819s000lbl.pdf. По состоянию на 5 января 2018 г.
- Бутранс [информация о назначении]. Стэмфорд, Коннектикут: Purdue Pharma; 2014. accessdata.fda.gov/drugsatfda_docs/label/2014/021306s015s019lbl.pdf. По состоянию на 5 января 2018 г.
- Belbuca [информация о назначении]. Малверн, Пенсильвания: Endo Pharmaceuticals; 2015. accessdata.fda.gov/drugsatfda_docs/label/2015/207932s000lbl.pdf. По состоянию на 5 января 2018 г.

- Subutex [предписывающая информация]. Колумбус, Огайо: Roxane Laboratories; 2015. docs.boehringer-ingelheim.com/Prescribing%20Information/PIs/Roxane/Buprenorphine%20HCl%20Sublingual%20Tabs/10004964_01%20Buprenorphine%20HCl%20Sublingual%20Tabs.pdf. По состоянию на 5 января 2018 г.
- Bunavail [предписывающая информация]. Роли, Северная Каролина: BioDelivery Sciences International, Inc; 2014. accessdata.fda.gov/drugsatfda_docs/label/2014/205637s000lbl.pdf. По состоянию на 5 января 2018 г.
- Субоксон [информация о назначении]. Ричмонд, Вирджиния: Reckitt Benckiser Pharmaceuticals; 2010. accessdata.fda.gov/drugsatfda_docs/label/2010/022410s000lbl.pdf. По состоянию на 5 января 2018 г.
- Zubsolv [информация о назначении]. Морристаун, Нью-Джерси: Orexo US, Inc; 2017 г.zubsolv.com/wp-content/uploads/2015/01/ZubsolvFullPrescribingInformation.pdf. По состоянию на 5 января 2018 г.
- Пробуфин [информация о назначении]. Принстон (Нью-Джерси): Braeburn Pharms, Inc; 2016. accessdata.fda.gov/drugsatfda_docs/label/2016/204442Orig1s000lbl.pdf. По состоянию на 5 января 2018 г.
- Lutfy K, Cowan A. Бупренорфин: уникальный препарат со сложной фармакологией. Curr Neuropharmacol. 2004; 2 (4): 395-402. DOI: 10,2174 / 15701559477.
- PDSP Ki База данных pdsp.unc.edu/databases/pdsp.php?recDDRadio=recDDRadio&receptorDD=1&receptor=&speciesDD=&speciesFreeRadio=speciesFreeRadio&species=human&sourceDDRadio=sourceDDRadio&sourcesDD=&source=&hotDDRadio=hotDDRadio&hotLigandDD=&hotLigand=&testDDRadio=testDDRadio&testLigandDD=&testLigand=&refDDRadio=refDDRadio&referenceDD=&reference=&KiGreater=&KiLess= & kiAllRadio = все & doQuery = Отправить + Запрос. По состоянию на 5 января 2018 г.
- Wang D, Sun X, Sadee W.Различные эффекты опиоидных антагонистов на μ-, δ- и κ-опиоидные рецепторы с предварительной обработкой агонистами и без нее. J Pharmacol Exp Ther. 2007; 321 (2): 544-52.
- Дахан А. Респираторные эффекты, вызванные опиоидами: новые данные о бупренорфине.
 Palliat Med. 2006; 20 Приложение 1: s3-8.
Palliat Med. 2006; 20 Приложение 1: s3-8. - Маклафлин Дж. П., Мартон-Поповичи М, Чавкин С. (2003). Антагонизм каппа-опиоидных рецепторов и нарушение гена продинорфина блокируют вызванные стрессом поведенческие реакции. J Neurosci. 23 (13): 5674-83.
- Ежедневное психическое здоровье. 2 новых антагониста каппа-опиоидных рецепторов (KOR) при депрессии. mentalhealthdaily.com/2014/12/19/2-new-kappa-opioid-receptor-kor-antagonists-for-depression/. По состоянию на 5 января 2018 г.
- Stadol [информация о назначении]. Дейтон, Нью-Джерси: Женева Фармасьютикалз, Инк; 2002. accessdata.fda.gov/drugsatfda_docs/label/2002/19890s17lbl.pdf. По состоянию на 5 января 2018 г.
- Walsh SL, Chausmer AE, Strain EC, Bigelow GE. Оценка мю- и каппа-опиоидного действия буторфанола у людей посредством дифференциальной блокады налтрексона. Психофармакология (Берл). 196 (1): 143-55
- Мовантик [инструкции по применению]. Уилмингтон, Делавэр: AstraZeneca Pharmaceuticals, LP; 2017. azpicentral.com/movantik/movantik.pdf. Проверено 5 января 2018 г.
- Relistor [предписывающая информация]. Бриджуотер, Нью-Джерси: Salix Pharmaceuticals; 2017. shared.salix.com/shared/pi/relistor-pi.pdf. По состоянию на 5 января 2018 г.
- Entereg [информация о назначении]. Станция Уайтхаус, Нью-Джерси: Merck & Co; 2015. merck.com/product/usa/pi_circulars/e/entereg/entereg_pi.pdf. По состоянию на 5 января 2018 г.
- Revia [информация о назначении]. Помона, штат Нью-Йорк: Barr Pharmaceuticals, Inc; 2013. accessdata.fda.gov/drugsatfda_docs/label/2013/018932s017lbl.pdf. По состоянию на 5 января 2018 г.
- Narcan [информация о назначении]. Рэднор, Пенсильвания: Adapt Pharma, Inc; 2015. accessdata.fda.gov/drugsatfda_docs/label/2015/208411lbl.pdf. По состоянию на 5 января 2018 г.
- Evzio [информация о назначении]. Ричмонд, Вирджиния: Калео; 2014. accessdata.fda.gov/drugsatfda_docs/label/2014/205787Orig1s000lbl.pdf.
 По состоянию на 5 января 2018 г.
По состоянию на 5 января 2018 г. - Prommer E. Levorphanol: возвращение к недостаточно используемому анальгетику. Паллиативная помощь: исследования и лечение . 2014 Янв; 8: PCRT-S13489.
14.4C: Агонисты, антагонисты и лекарственные препараты
Лекарства, влияющие на холинергическую нейротрансмиссию, могут блокировать, препятствовать или имитировать действие ацетилхолина и изменять постсинаптическую передачу.
Цели обучения
- Различать эффекты агониста и антагониста в вегетативной нервной системе
Ключевые точки
- Агонисты и антагонисты рецепторов ацетилхолина оказывают либо прямое действие на рецепторы, либо действуют косвенно, воздействуя на фермент ацетилхолинэстеразу.
- Агенты, нацеленные на рецепторы ACh, могут нацеливаться на никотиновые или мускариновые рецепторы ACh.
- Атропин, антагонист мускариновых рецепторов ACh, снижает парасимпатическую активность мышц и желез парасимпатической нервной системы.
- Неостигмин является непрямым агонистом рецептора ACh, который ингибирует ацетилхолинэстеразу, предотвращая распад ацетилхолина. Он используется при лечении миастении и отменяет действие нервно-мышечных блокаторов, используемых для анестезии.
- Фенилэфрин, продаваемый как заменитель Судафеда в противоотечных целях, является агонистом α1-адренорецепторов.
- Бета-блокаторы, как следует из их названия, блокируют действие адреналина и норэпинефрина на β-адренорецепторы и используются для лечения сердечных аритмий, кардиозащиты после сердечного приступа и гипертонии.
Ключевые термины
- ацетилхолинэстераза : фермент, катализирующий распад нейромедиатора ацетилхолина.
- бета-блокаторы : Также называемые бета-адреноблокаторами, бета-адреноблокаторами, антагонистами бета-адренорецепторов или бета-антагонистами, это класс препаратов, используемых по различным показаниям.
 Как антагонисты бета-адренорецепторов, они уменьшают действие адреналина (адреналина) и других гормонов стресса.
Как антагонисты бета-адренорецепторов, они уменьшают действие адреналина (адреналина) и других гормонов стресса. - атропин : алкалоид, извлеченный из растения смертоносный паслен (Atropa belladonna) и других источников. Он используется в медицине в качестве лекарственного средства из-за его паралитического действия (например,(например, в хирургии для расслабления мышц, в стоматологии для высушивания рта, в офтальмологии для расширения зрачков), хотя передозировки фатальны.
Блокирование, сдерживание или имитация действия ацетилхолина имеет множество применений в медицине. Лекарства, которые действуют на ацетилхолиновую систему, являются либо агонистами рецепторов, которые стимулируют систему, либо антагонистами, которые ее ингибируют.
Агонисты и антагонисты рецепторов ацетилхолина могут оказывать прямое действие на рецепторы или оказывать свое действие косвенно.Например, при воздействии на фермент ацетилхолинэстеразу лиганд рецептора разлагается. Агонисты повышают уровень активации рецепторов, антагонисты снижают.
Ацетилхолин в ANS
Блуждающие (парасимпатические) нервы, которые иннервируют сердце, выделяют ацетилхолин (ACh) в качестве основного нейромедиатора. ACh связывается с мускариновыми рецепторами (M2), которые обнаруживаются в основном на клетках, составляющих синоатриальный (SA) и атриовентрикулярный (AV) узлы.
мускариновых рецепторов связаны с G i -белком; следовательно, активация блуждающего нерва снижает цАМФ.Активация G i -белка также приводит к активации каналов KACh, которые увеличивают отток калия и гиперполяризует клетки.
Повышение активности блуждающего нерва в узле SA снижает частоту активации клеток кардиостимулятора за счет уменьшения наклона потенциала кардиостимулятора и уменьшения частоты сердечных сокращений. Путем гиперполяризации клеток активация блуждающего нерва увеличивает порог активации клетки, что способствует снижению скорости возбуждения.
Подобные электрофизиологические эффекты также наблюдаются в атриовентрикулярном АВ-узле.Однако в этой ткани эти изменения проявляются в снижении скорости проведения импульса через АВ-узел. В состоянии покоя сердце в значительной степени подвержено тонусу блуждающего нерва, который отвечает за низкую частоту сердечных сокращений в состоянии покоя.
Также имеется некоторая иннервация блуждающего нерва предсердной мышцы и, в гораздо меньшей степени, мышцы желудочка. Таким образом, активация блуждающего нерва приводит к умеренному снижению сократимости предсердий (инотропии) и даже меньшему снижению сократимости желудочков.
Мускариновые антагонисты
Атропин : Здесь проиллюстрирована двумерная химическая структура атропина.
Антагонисты мускариновых рецепторов связываются с мускариновыми рецепторами, тем самым предотвращая связывание ACh и активацию рецептора. Блокируя действие ACh, антагонисты мускариновых рецепторов очень эффективно блокируют влияние активности блуждающего нерва на сердце. Тем самым они увеличивают частоту сердечных сокращений и скорость проводимости.
Атропин — природный тропановый алкалоид, извлекаемый из смертоносного паслена (Atropa belladonna), сорняков Джимсон (Datura stramonium), мандрагоры (Mandragora officinarum) и других растений семейства Solanaceae. Фармакологические эффекты атропина обусловлены его способностью связываться с мускариновыми рецепторами ацетилхолина. Это антимускариновое средство.
Действуя как неселективный мускариновый ацетилхолинергический антагонист, атропин увеличивает возбуждение синоатриального узла (СА) и проводимость через атриовентрикулярный узел (АВ) сердца, противодействует действиям блуждающего нерва, блокирует участки рецепторов ацетилхолина и снижает бронхиальную секрецию.При передозировке атропин ядовит.
Никотиновые агонисты
Никотиновый агонист — это лекарство, которое имитирует, так или иначе, действие ацетилхолина (ACh) на никотиновые рецепторы ацетилхолина (nAChR). Никотиновые рецепторы ацетилхолина — это рецепторы, обнаруженные в центральной нервной системе, периферической нервной системе и скелетных мышцах.
Никотиновые рецепторы ацетилхолина — это рецепторы, обнаруженные в центральной нервной системе, периферической нервной системе и скелетных мышцах.
Это ионные каналы, управляемые лигандами, с сайтами связывания для ацетилхолина, а также других агонистов. Когда агонисты связываются с рецептором, он стабилизирует открытое состояние ионного канала, обеспечивая приток катионов.
Никотиновые рецепторы ацетилхолина: NAchR представляют собой холинергические рецепторы, которые образуют лиганд-зависимые ионные каналы в плазматических мембранах определенных нейронов и на постсинаптической стороне нервно-мышечного соединения.
Разработка агонистов никотиновых рецепторов ацетилхолина началась в начале девяностых годов после открытия положительного воздействия никотина на память животных. Никотиновые антагонисты в основном используются при параличе периферических мышц в хирургии, классическим агентом этого типа является тубокурарин, но некоторые соединения центрального действия, такие как бупропион, мекамиламин и 18-метоксикоронаридин, блокируют никотиновые ацетилхолиновые рецепторы в головном мозге и были предложены для лечения лекарственными препаратами. зависимость.
Агонисты никотиновых рецепторов ацетилхолина привлекают все большее внимание в качестве кандидатов в лекарственные средства при множественных расстройствах центральной нервной системы, таких как болезнь Альцгеймера, шизофрения, синдром дефицита внимания и гиперактивности (СДВГ) и никотиновая зависимость. В 2009 году на рынке было не менее пяти препаратов, влияющих на никотиновые рецепторы ацетилхолина.
Большинство агонистов рецепторов ACh непрямого действия действуют путем ингибирования фермента ацетилхолинэстеразы. В результате накопление ацетилхолина вызывает постоянную стимуляцию мышц, желез и центральной нервной системы.
Они являются примерами ингибиторов ферментов и усиливают действие ацетилхолина, задерживая разложение; некоторые из них использовались в качестве нервно-паралитических агентов (зарин и нервно-паралитический газ VX) или пестицидов (органофосфаты и карбаматы). В клинической практике их применяют для отмены действия миорелаксантов, для лечения миастении и для лечения симптомов болезни Альцгеймера (ривастигмин увеличивает холинергическую активность в головном мозге).
В клинической практике их применяют для отмены действия миорелаксантов, для лечения миастении и для лечения симптомов болезни Альцгеймера (ривастигмин увеличивает холинергическую активность в головном мозге).
Антагонисты бета-рецепторов
Бета-блокаторы (иногда обозначаемые как β-блокаторы) или бета-адреноблокаторы, бета-адренергические антагонисты, антагонисты бета-адренорецепторов или бета-антагонисты — это класс препаратов, используемых по различным показаниям.Они особенно используются для лечения сердечных аритмий, защиты сердца после инфаркта миокарда (сердечного приступа) и гипертонии.
Как антагонисты бета-адренорецепторов они уменьшают действие адреналина (адреналина) и других гормонов стресса. Бета-блокаторы блокируют действие эндогенных катехоламинов — в частности, эпинефрина (адреналин) и норадреналина (норадреналин) — на β-адренорецепторы, часть симпатической нервной системы, которая опосредует реакцию «бей или беги».
ЛИЦЕНЗИИ И АТРИБУЦИИ
CC ЛИЦЕНЗИОННЫЙ КОНТЕНТ, ПРЕДЫДУЩИЙ РАЗДЕЛ
- Курирование и проверка. Автор: : Boundless.com. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, СПЕЦИАЛЬНАЯ АТРИБУЦИЯ
- Ацетилхолиновый рецептор. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Acetylcholine_receptor . Лицензия : CC BY-SA: Attribution-ShareAlike
- Ацетилхолин. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Acetylcholine . Лицензия : CC BY-SA: Attribution-ShareAlike
- Холинергический. Источник : Википедия.
 Расположен по адресу : en.Wikipedia.org/wiki/Cholinergic . Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : en.Wikipedia.org/wiki/Cholinergic . Лицензия : CC BY-SA: Attribution-ShareAlike - холинацетилтрансфераза. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/choline…tyltransferase . Лицензия : CC BY-SA: Attribution-ShareAlike
- никотиновых рецепторов. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/nicotinic%20receptors . Лицензия : CC BY-SA: Attribution-ShareAlike
- вегетативные ганглии. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/autonomic%20ganglia . Лицензия : CC BY-SA: Attribution-ShareAlike
- Ацетилхолин. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Acetylcholine . Лицензия : Общественное достояние: неизвестно Авторские права
- Мускариновый рецептор ацетилхолина. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Muscari…oline_receptor . Лицензия : Общественное достояние: неизвестно Авторские права
- Открытие и разработка лекарств: агонисты никотиновых ацетилхолиновых рецепторов. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Drug_Di…eptor_Agonists . Лицензия : CC BY-SA: Attribution-ShareAlike
- Адренергический рецептор.
 Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Adrenergic_receptor . Лицензия : CC BY-SA: Attribution-ShareAlike
Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Adrenergic_receptor . Лицензия : CC BY-SA: Attribution-ShareAlike - G рецепторы, связанные с белками. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/G%20pro…ed%20receptors . Лицензия : CC BY-SA: Attribution-ShareAlike
- адренорецептор. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/adrenoreceptor . Лицензия : CC BY-SA: Attribution-ShareAlike
- адренорецептор. Источник : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/adrenergic_receptor . Лицензия : CC BY-SA: Attribution-ShareAlike
- Ацетилхолин. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Acetylcholine . Лицензия : Общественное достояние: неизвестно Авторские права
- Мускариновый рецептор ацетилхолина. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Muscari…oline_receptor . Лицензия : Общественное достояние: неизвестно Авторские права
- Открытие и разработка лекарств: агонисты никотиновых ацетилхолиновых рецепторов. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Drug_Di…eptor_Agonists .
 Лицензия : CC BY-SA: Attribution-ShareAlike
Лицензия : CC BY-SA: Attribution-ShareAlike - Адренергический рецептор. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Adrenergic_receptor . Лицензия : Общественное достояние: неизвестно Авторские права
- Адренергический рецептор. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Adrenergic_receptor . Лицензия : Общественное достояние: неизвестно Авторские права
- Адренергический рецептор. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Adrenergic_receptor . Лицензия : CC BY-SA: Attribution-ShareAlike
- Открытие и разработка лекарств: агонисты никотиновых ацетилхолиновых рецепторов. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Drug_Di…eptor_Agonists . Лицензия : CC BY-SA: Attribution-ShareAlike
- Никотиновый антагонист. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Nicotinic_antagonist . Лицензия : CC BY-SA: Attribution-ShareAlike
- Фенилэфрин. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Phenylephrine . Лицензия : CC BY-SA: Attribution-ShareAlike
- Ацетилхолин. Источник : Википедия.
 Расположен по адресу : en.Wikipedia.org/wiki/Acetylcholine . Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : en.Wikipedia.org/wiki/Acetylcholine . Лицензия : CC BY-SA: Attribution-ShareAlike - Бета-блокаторы. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Beta_blockers . Лицензия : CC BY-SA: Attribution-ShareAlike
- Атропин. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Atropine . Лицензия : CC BY-SA: Attribution-ShareAlike
- ацетилхолинэстераза. Источник : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/acetylcholinesterase . Лицензия : CC BY-SA: Attribution-ShareAlike
- атропин. Источник : Викисловарь. Находится по адресу : en.wiktionary.org/wiki/atropine . Лицензия : CC BY-SA: Attribution-ShareAlike
- бета-адреноблокатор. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/beta-blockers . Лицензия : CC BY-SA: Attribution-ShareAlike
- Ацетилхолин. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Acetylcholine . Лицензия : Общественное достояние: неизвестно Авторские права
- Мускариновый рецептор ацетилхолина. Источник : Википедия. Расположен по адресу : en.
 Wikipedia.org/wiki/Muscari…oline_receptor . Лицензия : Общественное достояние: неизвестно Авторские права
Wikipedia.org/wiki/Muscari…oline_receptor . Лицензия : Общественное достояние: неизвестно Авторские права - Открытие и разработка лекарств: агонисты никотиновых ацетилхолиновых рецепторов. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Drug_Di…eptor_Agonists . Лицензия : CC BY-SA: Attribution-ShareAlike
- Адренергический рецептор. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Adrenergic_receptor . Лицензия : Общественное достояние: неизвестно Авторские права
- Адренергический рецептор. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Adrenergic_receptor . Лицензия : Общественное достояние: неизвестно Авторские права
- Адренергический рецептор. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Adrenergic_receptor . Лицензия : CC BY-SA: Attribution-ShareAlike
- Открытие и разработка лекарств: агонисты никотиновых ацетилхолиновых рецепторов. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Drug_Di…eptor_Agonists . Лицензия : CC BY-SA: Attribution-ShareAlike
- Атропин. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Atropine . Лицензия : Общественное достояние: неизвестно Авторские права
C6.
 Агонист и антагонист связывания лиганда с рецепторами — расширение
Агонист и антагонист связывания лиганда с рецепторами — расширениеАнализ конкурентных, неконкурентных и неконкурентных ингибиторов ферментов теперь можно расширить, чтобы понять, как на активность мембранных рецепторов влияет связывание лекарств. Когда рецепторы связывают свои естественные лиганды-мишени (гормоны, нейротрансмиттеры), возникает биологический эффект. Обычно это связано с изменением формы рецептора, трансмембранного белка, который активирует внутриклеточную активность.Связанный рецептор обычно не выражает напрямую биологической активности, но инициирует каскад событий, который приводит к выражению внутриклеточной активности. Однако в некоторых случаях занятый рецептор фактически сам проявляет биологическую активность. Например, связанный рецептор может приобретать ферментативную активность или становиться активным ионным каналом.
Лекарства, нацеленные на мембранные рецепторы, могут иметь множество эффектов. Они могут вызывать те же биологические эффекты, что и природный лиганд.В таком случае их называют агонистами. И наоборот, они могут подавлять биологическую активность рецептора. Если так они называли антагонистов
Агонист
Агонист является имитатором природного лиганда и при связывании с рецептором оказывает такое же биологическое действие, как и природный лиганд. Он связывается в одном и том же сайте связывания и приводит, в отсутствие природного лиганда, к полному или частичному ответу. В последнем случае его называют частичным агонистом. На рисунке ниже показано действие лиганда, агониста и частичного агониста.
Есть еще один вид агонистов, получивший странное название обратный агонист. Этот термин имеет смысл только тогда, когда он применяется к рецептору, который имеет базальную (или конститутивную) активность в отсутствие связанного лиганда. Если природный лиганд или агонист связывается с рецепторным участком, базальная активность увеличивается. Однако, если связывается обратный агонист, активность снижается. Примером обратного агониста (который мы обсудим позже) является связывание препарата Ro15-4513 с рецептором ГАМК, который также связывает бензодиазепины, такие как валиум.Когда он занят своим естественным лигандом, ГАМК, белковый рецептор «активируется», становясь каналом, позволяющим входящий поток Cl- в нервную клетку, ингибируя активацию нейронов. Валиум усиливает действие ГАМК, которое еще больше усиливается в присутствии этанола. Ro15-4513 связывается с бензодиазепиновым участком, что приводит к противоположному действию валиума — ингибированию активности рецептора — хлоридного канала.
Примером обратного агониста (который мы обсудим позже) является связывание препарата Ro15-4513 с рецептором ГАМК, который также связывает бензодиазепины, такие как валиум.Когда он занят своим естественным лигандом, ГАМК, белковый рецептор «активируется», становясь каналом, позволяющим входящий поток Cl- в нервную клетку, ингибируя активацию нейронов. Валиум усиливает действие ГАМК, которое еще больше усиливается в присутствии этанола. Ro15-4513 связывается с бензодиазепиновым участком, что приводит к противоположному действию валиума — ингибированию активности рецептора — хлоридного канала.
Рисунок 1 : Агонист и частичный агонист
Антагонисты
Как следует из названия, антагонист подавляет эффекты природного лиганда (гормона, нейромедиатора), агониста, частичного агониста и даже обратных агонистов (которые не будут упоминаться снова).Мы можем рассматривать их как ингибиторы активности рецепторов, во многом так же, как мы рассматривали в предыдущих разделах ингибиторы активности ферментов. Таким образом, могут быть разные типы антагонистов. К ним относятся:
- Конкурентные антагонисты , которые представляют собой лекарственные средства, которые связываются с тем же сайтом, что и природный лиганд, агонисты или частичные агонисты, и ингибируют их эффекты. Они были бы аналогичны конкурентным ингибиторам фермента. Можно также представить сценарий, в котором «аллостерический» антагонист связывается с аллостерическим участком рецептора, вызывая конформационное изменение рецептора, так что лиганд, агонист или частичный агонист не могут связываться.
- Неконкурентный антагонист (или, в более общем смысле, смешанный антагонист), которые представляют собой лекарства, которые связываются с другим участком рецептора, чем природный лиганд, агонист или частичный агонист, и подавляют биологическую функцию рецептора. смешанные ингибиторы ферментов, неконкурентный антагонист может изменить кажущуюся \ (K_d \) для лиганда, агониста или частичного агониста (концентрация лиганда, необходимая для достижения полумаксимальных биологических эффектов), но изменит максимальный ответ на лиганд (как смешанные ингибиторы изменяют кажущееся \ (V_ {max} \).
 На рисунке ниже показано действие конкурентного и неконкурентного антагониста.
На рисунке ниже показано действие конкурентного и неконкурентного антагониста. - Необратимый агонист , который возникает в результате ковалентной модификации рецептора.
Рисунок 2: Антагонисты: конкурентные и неконкурентные (смешанные)
Авторы и ссылки
Агонисты и антагонисты химических рецепторов
Для тех, кто не знаком, химические рецепторы — это трансмембранные белки, которые позволяют передавать химические сигналы из внешней клеточной микросреды внутрь.Эти белки также позволяют переносить химические вещества внутри клетки. Обычно обращенные либо снаружи клетки, либо на цитозольные рецепторы, химические рецепторы обнаруживаются встроенными в мембрану. Кроме того, они также могут быть обнаружены в ядре клетки. Давайте посмотрим на различия между агонистами и антагонистами рецепторов, а также на некоторые конкретные примеры каждого из них.
Что такое агонисты рецепторов?
Проще говоря, агонисты рецепторов — это химические вещества, которые связываются с рецепторами, чтобы активировать рецептор и вызвать биологический ответ.Агонисты имитируют врожденные молекулярные связи и имеют тенденцию создавать биологические эффекты, которые сродни естественным молекулярным связям, когда они связаны с рецептором.
Что такое антагонисты рецепторов?
Напротив, антагонисты рецепторов — это химические вещества, которые служат для подавления активности рецепторов. Антагонисты имитируют ионные или молекулярные связи, которые связываются с рецепторами, чтобы предотвратить активацию данного рецептора естественной связью. Это может вызвать множество эффектов. Например, в то время как связывание природного агониста с рецептором может привести к увеличению функциональности клетки, антагонист рецептора может привести к снижению функциональности внутри клетки.Дополнительно антагонисты рецепторов можно классифицировать следующим образом:
- Обратимый — Эти типы антагонистов свободно отделяются от своих рецепторов.

- Необратимый — Эти типы антагонистов образуют стабильную, длительную связь со своими рецепторами.
Какие примеры химических агонистов и антагонистов?
Поскольку химические агонисты представляют собой вещества, активирующие определенные рецепторы, одним из примеров класса хорошо известных агонистов могут быть опиоиды, которые активируют опиоидные рецепторы в головном мозге.Некоторыми хорошо известными примерами опиоидных агонистов являются оксикодон, героин, метадон, гидрокодон, морфин и опиум. Химические агонисты также используются в научных исследованиях, включая GSK-137647 (G-2367), проницаемый для клеток низкомолекулярный агонист; агонист рецептора TGR5 (T-2457) и хорошо известный агонист рецептора глутамата, L-квисквалиевая кислота (Q-1000). Хотя эти вещества нацелены на различные специфические рецепторы, суть в том, что они служат агонистами для активации рецепторов.
L-квискваловая кислота (Q-1000) химическая структура
С другой стороны, поскольку известно, что антагонисты обладают противоположным действием, они фактически служат способом блокирования действия агонистов.Присоединяясь к химическим рецепторам, не активируя их, антагонисты блокируют потенциальные эффекты. Некоторыми примерами антагонистов являются налоксон, налтрексон и квискваловая кислота.
В целом, хотя агонисты рецепторов могут использоваться для создания определенного ответа или реакции в организме, антагонисты используются для прямо противоположной цели. Хотя мы можем быть знакомы с примерами каждого из них, важно отметить, что как агонисты, так и антагонисты потенциально могут быть полезны для организма в зависимости от обстоятельств.Например, в то время как агонисты могут использоваться для снятия боли и облегчения определенных травм и состояний, антагонисты могут использоваться для уменьшения зависимости от вредных веществ, которые в противном случае могут навредить нашему телу и жизни долгосрочным привычкам.


 5 или 10 шт.
5 или 10 шт. 20 мг/1 мл: амп. 5 шт.
20 мг/1 мл: амп. 5 шт. 10 шт.
10 шт.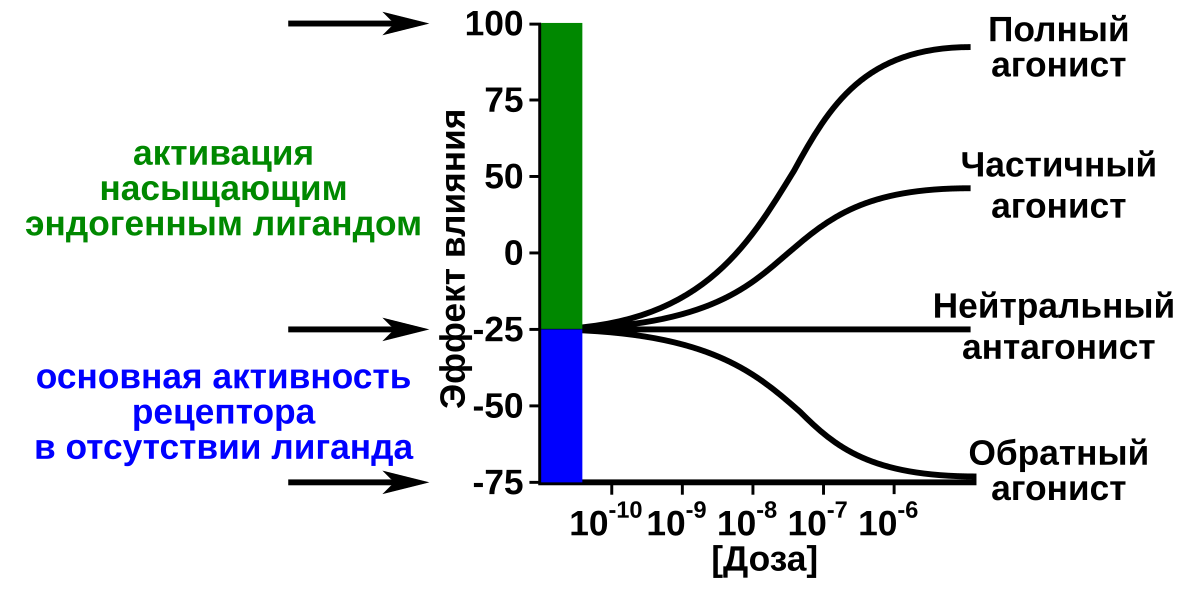 Врач-болеутоляющий. 2011; 14 (4): E343-60.
Врач-болеутоляющий. 2011; 14 (4): E343-60.
 Palliat Med. 2006; 20 Приложение 1: s3-8.
Palliat Med. 2006; 20 Приложение 1: s3-8. По состоянию на 5 января 2018 г.
По состоянию на 5 января 2018 г. Как антагонисты бета-адренорецепторов, они уменьшают действие адреналина (адреналина) и других гормонов стресса.
Как антагонисты бета-адренорецепторов, они уменьшают действие адреналина (адреналина) и других гормонов стресса. Расположен по адресу : en.Wikipedia.org/wiki/Cholinergic . Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : en.Wikipedia.org/wiki/Cholinergic . Лицензия : CC BY-SA: Attribution-ShareAlike  Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Adrenergic_receptor . Лицензия : CC BY-SA: Attribution-ShareAlike
Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Adrenergic_receptor . Лицензия : CC BY-SA: Attribution-ShareAlike  Лицензия : CC BY-SA: Attribution-ShareAlike
Лицензия : CC BY-SA: Attribution-ShareAlike  Расположен по адресу : en.Wikipedia.org/wiki/Acetylcholine . Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : en.Wikipedia.org/wiki/Acetylcholine . Лицензия : CC BY-SA: Attribution-ShareAlike  Wikipedia.org/wiki/Muscari…oline_receptor . Лицензия : Общественное достояние: неизвестно Авторские права
Wikipedia.org/wiki/Muscari…oline_receptor . Лицензия : Общественное достояние: неизвестно Авторские права 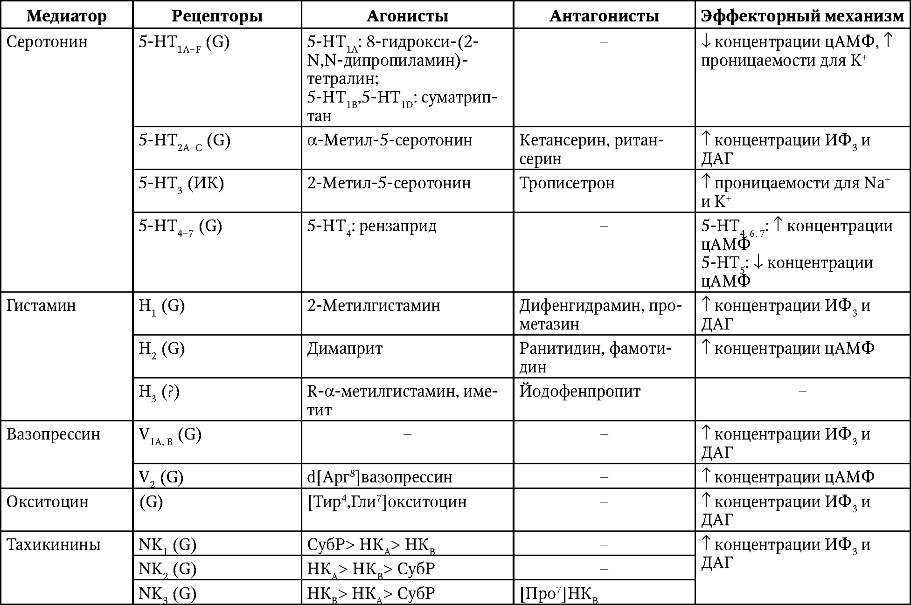 На рисунке ниже показано действие конкурентного и неконкурентного антагониста.
На рисунке ниже показано действие конкурентного и неконкурентного антагониста.
