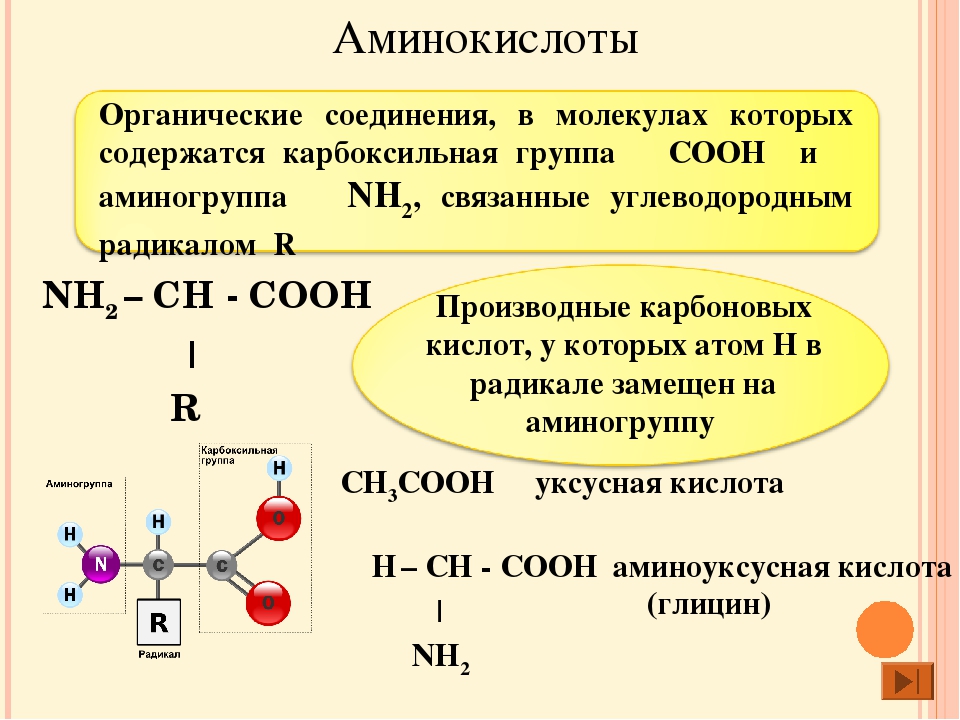
Биоорганическая химияАминокислоты.Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные (-COOH) и аминные группы (-NH2). Строение аминокислот можно выразить приведённой ниже общей формулой, (где R – углеводородный радикал, который может содержать и различные функциональные группы). Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы (-Nh3). В качестве примера можно привести простейшие: аминоуксусную кислоту, или глицин, и аминопропионовую кислоту или аланин: Химические свойства аминокислотАминокислоты – амфотерные соединения, т. За счёт карбоксильной группы (-COOH) они образуют соли с основаниями. За счёт аминогруппы (-NH2) образуют соли с кислотами. Ион водорода, отщепляющийся при диссоциации от карбоксила (-ОН) аминокислоты, может переходить к её аминогруппе с образованием аммониевой группировки (NH3+). Таким образом, аминокислоты существуют и вступают в реакции также в виде биполярных ионов (внутренних солей). Этим объясняется, что растворы аминокислот, содержащих одну карбоксильную и одну аминогруппу, имеют нейтральную реакцию. Альфа-аминокислотыИз молекул аминокислот строятся молекулы белковых веществ или белков, которые при полном гидролизе под влиянием минеральных кислот,
щелочей или ферментов распадаются, образуя смеси аминокислот. Общее число встречающихся в природе аминокислот достигает 300, однако некоторые из них достаточно редки. Среди аминокислот выделяется группа из 20 наиболее важных. Они встречаются во всех белках и получили название альфа-аминокислот. Альфа-аминокислоты – кристаллические вещества, растворимые в воде. Многие из них обладают сладким вкусом. Это свойство нашло отражение в названии первого гомолога в ряду альфа-аминокислот – глицина, явившегося также первой альфа-аминокислотой, обнаруженной в природном материале.
Незаменимые аминокислотыОсновным источником альфа-аминокислот для животного организма служат пищевые белки. Многие альфа-аминокислоты синтезируются в организме, некоторые же необходимые для синтеза белков альфа-аминокислоты в организме не синтезируются и должны поступать извне, с продуктами питания. Такие аминокислоты называют незаменимыми. Вот их список:
При некоторых, часто врождённых, заболеваниях перечень незаменимых кислот расширяется. Использование аминокислот в медицинской практикеАльфа-аминокислоты занимают ключевое положение в азотистом обмене. Многие из них используются в медицинской практике в качестве лекарственных средств, влияющих на тканевый обмен. Так, глутаминовая кислота применяется для лечения заболеваний центральной нервной системы, метионин и гистидин – лечения и предупреждения заболеваний печени, цистеин – глазных болезней. | ОглавлениеОрганическая химияКосметическая химияКоллоидная химияБиохимияБелки• Аминокислоты • Белки и пептиды • Нуклеиновые кислоты — Строение нуклеиновых кислот. — Структура и простран- ственная организация нуклеиновых кислот Углеводы. Их роль и классификация.• Моносахариды (глюкоза и фруктоза). • Олигосахариды (сахароза). • Полисахариды (крахмал и целлюлоза). Липиды. Классификация.• Структурные компоненты липидов — Жирные кислоты и спирты, — Полиспирты, глицерин. • Простые омыляемые липиды: — Воски, — Жиры и масла. • Сложные омыляемые липиды. Классификация. — Фосфолипиды, лецитин, — Сфинголипиды, церамиды, — Гликолипиды. — Терпены, — Стероиды
— стерины, холестерин,
— желчные кислоты,
— стероидные гормоны,
— сердечные гликозиды. — Низкомолекулярные био- регуляторы липидной природы — Жирорастворимые витамины, — Простагландины. | |
Что такое аминокислоты и для чего они нужны?
Находя информацию про тот или иной продукт, в перечне полезных веществ кроме витаминов и минералов почти всегда присутствуют аминокислоты. Если о кальции или ретиноле и прочих веществах более и менее понятно, то такие названия как аланин или лейцин могут ввести в ступор. Данная статья поможет разобраться, что такое аминокислоты и для чего они нужны человеческому организму.
Что представляют собой аминокислоты?
Белок – обязательный компонент любой живой клетки организма, а аминокислоты – обязательные компоненты белка. Всего существует порядка 200 аминокислот, но входят в состав белка лишь 20 из них. Они подразделяются на заменимые, условно заменимые и незаменимые. Первые организм может синтезировать сам, обеспечивая минимум потребностей. Вторые могут быть выработаны при необходимости из незаменимых, которые в свою очередь поступают в организм только вместе с белковой пищей, такой как мясо, молочные продукты, яйца и соя. Для нормальной жизнедеятельности организму требуются все существующие аминокислоты, так как каждая из них несет свою особую функцию.
Первые организм может синтезировать сам, обеспечивая минимум потребностей. Вторые могут быть выработаны при необходимости из незаменимых, которые в свою очередь поступают в организм только вместе с белковой пищей, такой как мясо, молочные продукты, яйца и соя. Для нормальной жизнедеятельности организму требуются все существующие аминокислоты, так как каждая из них несет свою особую функцию.
- Аланин – заменимая глюкогенная аминокислота, отвечающая за уровень глюкозы в крови.
- Аргинин – условно заменимая глюкогенная аминокислота необходимая для набора мышечной массы.
- Аспарагин – заменимая глюкогенная аминокислота, участвующая в работе имуннитета.
- Аспарагиновая кислота – заменимая глюкогенная аминокислота, которая помогает преобразовывать углеводы в энергию мышц.
- Валин – незаменимая глюкогенная аминокислота, необходимая для координации движений.
- Гистидин – условно незаменимая глюкогенная аминокислота, стимулирующая выработку кровяных телец.
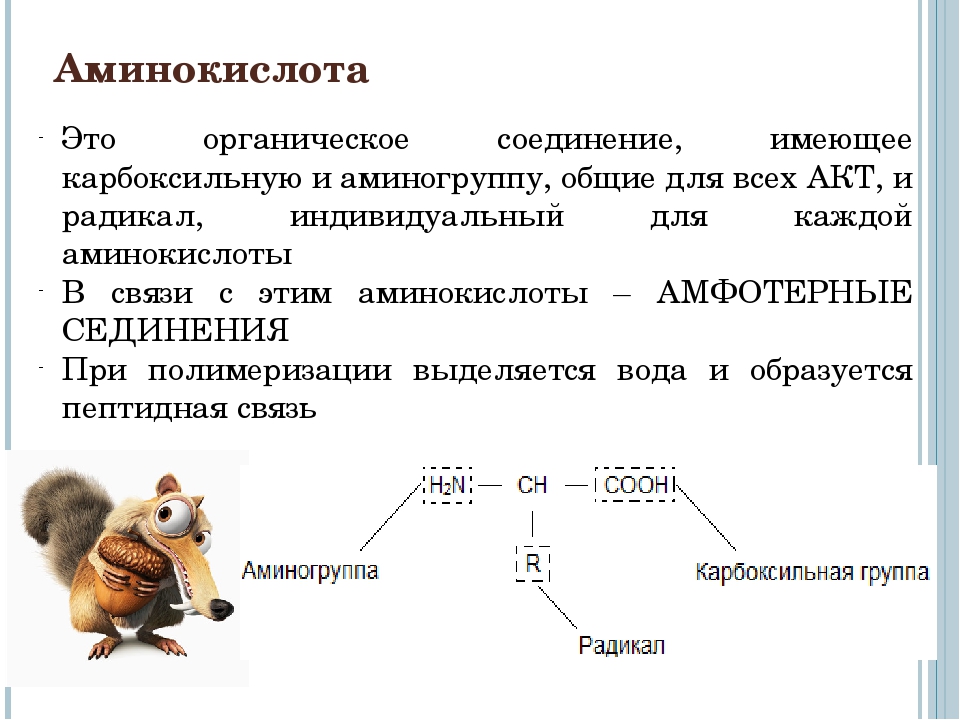
- Глицин – заменимая глюкогенная аминокислота, необходимая для поддержания нервной системы.
- Глютамин – заменимая глюкогенная аминокислота, выполняющая роль топлива при больших и продолжительных нагрузках.
- Глутаминовая кислота – заменимая глюкогенная аминокислота, улучшает деятельность мозга.
- Изолейцин – незаменимая глюкогенная аминокислота, способствующая накапливанию энергии в мышцах.
- Лейцин – незаменимая кетогенная аминокислота для крепкого иммунитета.
- Лизин – незаменимая кетогенная аминокислота для лучшего кислородного обмена внутри мышц.
- Метионин – незаменимая глюкогенная аминокислота для восстановления поврежденных тканей.
- Пролин – заменимая глюкогенная аминокислота для формирования соединительных тканей.
- Серин – заменимая глюкогенная аминокислота, продуцирующая энергию клеток.
- Тирозин – условно заменимая аминокислота, помогающая бороться с усталостью.

- Треонин – незаменимая глюкогенная аминокислота, участвующая в очищении печени.
- Триптофан – незаменимая кетогенная аминокислота, необходимая для выработки серотонина и отвечающая заболевой порог и аппетит.
- Фенилаланин – незаменимая аминокислота для соединительных тканей, таких как хрящи и связки.
- Цистеин – условно заменимая глюкогенная аминокислота, способствующая выработке коллагена.
Для людей, ведущих размеренный образ жизни без усиленных физических нагрузок аминокислоты необходимы для нормального функционирования. Что же касается спортсменов, здесь картина немного иная.
Аминокислоты: организм может получить в полном объеме из биологически активных добавокАминокислоты для спортсменов
Аминокислоты в виде БАДов
При интенсивных занятиях спортом, бодибилдинге, похудении или сушке очень важно сохранять мышцы и быстро восстанавливаться после тренировок. Особую роль для спортсменов играют аминокислоты ВCAA, из которых на 35% состоит мышечная ткань. К ним относятся валин, изолейцин и лейцин. Эти незаменимые аминокислоты можно получать не только из продуктов питания. Сейчас очень доступны аминокислоты в виде капсул, которые продаются как спортивное питание наряду с протеиновыми коктейлями. Помимо перечисленных аминокислот среди спортсменов популярны следующие добавки:
К ним относятся валин, изолейцин и лейцин. Эти незаменимые аминокислоты можно получать не только из продуктов питания. Сейчас очень доступны аминокислоты в виде капсул, которые продаются как спортивное питание наряду с протеиновыми коктейлями. Помимо перечисленных аминокислот среди спортсменов популярны следующие добавки:
- Карнитин — широко используют в качестве БАДа. Это очень эффективный жиросжигатель.
- Орнитин — аминокислота, которая широко используется в бодибилдинге для улучшения атлетических показателей. Он не входит в состав белков, но присутствует в организме.
- Таурин — сульфокислота, образующаяся в организме из аминокислоты цистеина. Помогает поглощать жиры, улучшает выносливость и подавляет катаболизм.
- Цистин — цистеин и цистин легко превращаются один в другой, в связи с этим цистин не менее популярен в качестве БАДа.
- Цитруллин – питает мышцы, поддерживает баланс азота в организме и повышает выносливость.
Как правильно принимать аминокислоты в виде БАДов?
Но, даже зная, что такое аминокислоты и для чего они нужны, некоторые начинающие спортсмены не знают наверняка, когда и как правильно принимать аминокислоты в качестве БАДов. В зависимости от цели занятий спортом (набор мышечной массы или похудение) прием БАДов немного отличается. Чтобы набрать массу, аминокислоты принимают до и после тренировки, а в течение дня употребляют протеиновые коктейли. Чтобы наоборот сбросить лишние килограммы, аминокислоты употребляют чаще: утром, перед тренировкой, после и между приемами пищи. Кроме таблеток и капсул существуют аминокислоты в порошках и даже растворах для инъекций. Чему отдать предпочтение – решать вам.
В зависимости от цели занятий спортом (набор мышечной массы или похудение) прием БАДов немного отличается. Чтобы набрать массу, аминокислоты принимают до и после тренировки, а в течение дня употребляют протеиновые коктейли. Чтобы наоборот сбросить лишние килограммы, аминокислоты употребляют чаще: утром, перед тренировкой, после и между приемами пищи. Кроме таблеток и капсул существуют аминокислоты в порошках и даже растворах для инъекций. Чему отдать предпочтение – решать вам.
Таким образом, аминокислоты необходимы тем людям, кто не может представить себе жизни без спорта или желающим подкорректировать свои фигуру и вес. При грамотном подходе к употреблению аминокислот ваши спортивные успехи не заставят себя долго ждать.
Незаменимые аминокислоты — понятие и виды
Мы продолжаем рассмотрение спортивных пищевых добавок, применяемых в бодибилдинге. Очередная остановка — незаменимые аминокислоты.
Незаменимые аминокислоты — понятие
Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме, в частности, в организме человека. Поэтому их поступление в организм с пищей необходимо.
Поэтому их поступление в организм с пищей необходимо.
Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треони́н, триптофан и фенилалани́н. Несмотря на то, что самостоятельно организм не способен синтезировать незаменимые аминокислоты, их недостаток в некоторых случаях все же может быть частично компенсирован.
Метионин
Это — аминокислота, которая содержится фактически во всех полноценных источниках белка, таких как мясо, птица, рыба, свинина, яйца, соевые бобы, деревенский сыр и йогурт. Эта аминокислота играет важную роль в формировании рибонуклеиновой кислоты и дезоксирибонуклеиновой кислоты. Это также мощный антиоксидант, который принимает некоторое участие в борьбе со свободными радикалами, высвобождаемыми алкоголем. Вдобавок, метионин помогает увеличивать усвоение селена — микроэлемента, который является достаточно мощным антиоксидантом.
Кроме того, метионин — одна из трех аминокислот, которые участвуют в синтезе креатина в организме человека. Правда, надо сказать, что, несмотря на бодрые заверения торговцев пищевыми добавками, я так и не нашел научного подтверждения тому, что потребление мегадоз метионина как отдельно, так и вместе с креатином, хотя бы как-то повышало эффект этой самой “подпитки” креатином.
Правда, надо сказать, что, несмотря на бодрые заверения торговцев пищевыми добавками, я так и не нашел научного подтверждения тому, что потребление мегадоз метионина как отдельно, так и вместе с креатином, хотя бы как-то повышало эффект этой самой “подпитки” креатином.
Прием метионина в количествах, превышающих те, что содержатся в белковых продуктах, не дает вам ровным счетом никаких преимуществ в плане набора “массы” или сжигания жира.
Фенилаланин
Эта аминокислота также содержится практически во всех полноценных источниках белка, а также в орехах, чечевице и тд. Принимаемый натощак в количествах от 200 до 500 мг фенилаланин подавляет аппетит, действуя двумя способами: во-первых, стимулируя норадреналин, а во-вторых, фенилааланин способен подавлять аппетит, высвобождая большие количества “холецистокинина” (ССК). ССК… подает сигнал мозгу, “показывающий”, достаточное ли количество пищи получено, так чтобы организм мог чувствовать себя комфортно.
Изредка встречаются люди, страдающие болезнью под названием фенилкегонурия. В печени таких людей отсутствует фермент, который усваивает диетический фенилаланин. Это заболевание настолько серьезно, что на упаковке некоторых продуктов питания вы можете прочитать предупреждающую надпись: “Содержит фенилаланин”.
Широко известный подсластитель аспартам получают из трех компонентов: фенилаланина, аспаратовой кислоты и метанола. И хотя этот подсластитель, по сути, вовсе не является токсичным, люди, болеющие фенилкетонурией вынуждены ограничивать и даже совсем избегать его потребление.
Треонин
Я не слишком хорошо уверен в том, какую функцию в организме выполняет эта аминокислота, но должен отметить, что ее нехватка препятствует нормальному формированию тысяч белковых структур человеческого организма. Конечно же, треонин содержится в продуктах, содержащих полноценный белок, таких как молоко, яйца и так далее.
Триптофан
Триптофан был очень популярен. Причина этого заключается в том, что эта аминокислота — великолепное натуральное снотворное. Вам достаточно принять несколько граммов триптофана поздно вечером — и здоровый сон вам обеспечен. Некоторые аминокислоты, ив самом деле, очень похожи по своему действию на стимуляторы, поскольку влияют на нейротрансмиттеры головного мозга.
Причина этого заключается в том, что эта аминокислота — великолепное натуральное снотворное. Вам достаточно принять несколько граммов триптофана поздно вечером — и здоровый сон вам обеспечен. Некоторые аминокислоты, ив самом деле, очень похожи по своему действию на стимуляторы, поскольку влияют на нейротрансмиттеры головного мозга.
Триптофан — как раз из их числа. Когда вы принимаете триптофан, он преодолевает барьер кровь — мозг и действует как исходное вещество для производства серотонина — нейротрансмиттера, который помогает вам заснуть (поскольку триптофан сейчас не слишком часто встретишь в широкой продаже, люди переключились на мелатонин, который имеет похожие свойства).
Любопытно, что продукты, содержащие полноценный белок, не слишком богаты триптофановм, зато его много в углеводах, особенно бананах, а также в растительном масле и молоке. Теперь становятся понятным, почему нам порой советуют пить молоко на ночь — это улучшает сон за счет триптофана.
Существуют некоторые доказательства того, что триптофан мог бы быть неплохим подавителем аппетита. Правда, лично я пробовал применять триптофан на “сушке” и что-то не заметил, чтобы эта аминокислота помогала мне контролировать тягу к еде.
Правда, лично я пробовал применять триптофан на “сушке” и что-то не заметил, чтобы эта аминокислота помогала мне контролировать тягу к еде.
Как ни странно, сегодня триптофан можно встретить на полках некоторых магазинов, продающих диетическое питание, правда, в качестве пищевой добавки для..животных (лошадей, собак и тд). Очевидно, якобы предназначая свою продукцию для животных, эти компании таким образом пытаются обойти запрет, установленный в 80-е годы и удовлетворить спрос тысяч людей, свято верящих в эффективность этой добавки. И надо сказать, что хотя этот триптофан и предназначается для животных, по имеющимся у меня данным это — качественный чистый продукт (процент содержания чистого триптофана составляет 99%).
Если делать какие-то выводы из вышеизложенного, то я считаю, что триптофан — отличное подспорье в борьбе с бессонницей, но применять его в бодибилдинге смысла особого не вижу, если, конечно, не учитывать то обстоятельство, что здоровый сон — важная часть восстановительного процесса в бодибилдинге.
Валин
Валин представляет собой одну из трех аминокислот с разветвленными цепочками (БЦАА). Между прочим, эти аминокислоты называются так из-за их строения на молекулярном уровне. Только не бойтесь: я не собираюсь “грузить” вас выкладками из молекулярной физики или химии.
Валин и две остальные аминокислоты, также относящиеся к БЦАА, представляют интерес тем, что составляют примерно третью часть мышечного белка. Из этих трех аминокислот валин наиболее загадочен. Во всяком случае, лично я не знаю, почему упражнения с отягощениями “пожирают” так много валина. Забавно, что ученые не знают этого тоже.
Возможно, это происходит потому, что валин, лейцин и изолейцин являются жизненно важными субстанциями для двух других аминокислот — глютамина и аланина, которые высвобождаются в больших объемах во время интенсивной тренировки. Следовательно, можно предположить, что валин используется мышцами в качестве топлива, и это сберегает от расщепления другие аминокислоты.
На самом деле какой-то особой необходимости в приеме валина в свободной форме нет, хотя идея использования ВЦАА не лишена смысла. Хорошей новостью является то, что потребляя в день две хороших порции сывороточного протеина, вы получаете примерно по 1 грамму каждой из ВЦАА.
А потому если только у вас не возникает особых проблем с использованием протеиновых коктейлей или заменителей пищи, я не рекомендую пользоваться этими аминокислотами. Вряд ли это поможет вам заметно прибавить в силе или массе мышц.
Изолейцин
Изолейцин похож на валин во многих отношениях: оба вещества относятся к аминокислотам с разветвленными цепочками и ни одна из них не используется с терапевтической целью. Кроме того, они используются в качестве исходного материала для образования глютамина и аланина которые, как я уже упоминал выше, используются в безумных количествах во время тренировки с отягощениями.
Нужно отметить, что изолейцин, так же, как и валин, может использоваться в качестве топлива мышечными клетками, оберегая тем самым от расщепления остальные аминокислоты.
Изолейцин играет весьма важную роль в синтезе протеина, анаболизме и антикатаболизме. Без соответствующих количеств ВЦАА мышечные клетки будут не в состоянии быстро восстанавливаться и расти. Как я уже упоминал, использование сывороточного протеина — отличный способ загрузить мышцы ВЦАА.
Лейцин
Это третья из аминокислот с разветвленными боковыми цепочками и, надо сказать, что наряду с глютамином это — наиболее исследованная учеными аминокислота, по крайней мере, в отношении ее воздействия на мышечный рост и метаболизм белка. Ряд исследований показал, что прием примерно 1 грамма лейцина заметно улучшает силовые показатели.
Другие исследования показали, что когда пациенты, находившиеся в состоянии глубокого катаболизма (последствия травмы, послеоперационная реабилитация), принимали большие количества лейцина, потери мышечной массы резко замедлялись. В то же время есть ряд исследований, при проведении которых абсолютно здоровые люди получали лейцин, и при этом не наблюдалось никаких заметных улучшений ни в плане строительства мышц, ни в плане улучшения силовой выносливости.
В то же время есть ряд исследований, при проведении которых абсолютно здоровые люди получали лейцин, и при этом не наблюдалось никаких заметных улучшений ни в плане строительства мышц, ни в плане улучшения силовой выносливости.
Безусловно, точно так же, как валин и изолейцин, лейцин является незаменимой аминокислотой, которая просто необходима для полноценного образования и функционирования всех видов протеина, включая мышечную ткань.
Исследователем, который изучал воздействие лейцина на человеческий организм более тщательно, чем кто-либо, является доктор Стив Ниссен из университета штата Айова. В течение более чем 10 лет доктор Ниссен пытался найти ключ к загадочным свойствам лейцина. В конечном итоге он обнаружил, что анаболический и антикатаболический эффекты лейцина связаны с выбросом метаболита, называемого бета-гидрокси бета-метилбутиратом (широкого известного как “НМВ”).
Согласно исследованиям доктора Ниссена, которые недавно были подтверждены доктором Вуковичем из университета Вичита, очевидно, что НМВ оказывает заметно более сильное воздействие, чем лейцин.
Я не верю в то, что дополнительное потребление лейцина принесет вам какие-то дивиденды. Вполне достаточно того, что вы получаете из мяса, молочных продуктов и сывороточного протеина. Фактически, для того, чтобы заметить, что лейцин на самом деле работает, его нужно принимать по 20-60 граммов в день, что и дорого, и непрактично, ну а кроме того, может пагубно отразиться на работе вашего желудка. Вместо этого лучше принимать несколько граммов НМВ.
Лизин
Эта незаменимая аминокислота используется организмом для образования карнитина — еще одной аминокислоты, которая играет ключевую роль в транспортировке жирных кислот в мышечные клетки, в которых они могут быть утилизированы как источники энергии. Если уровни карнитина в организме не оптимальны, вряд ли уровень метаболизма жиров будет заметным, а это, в свою очередь приведет к повышению уровня липидов в крови и может заметно помешать вашим попыткам избавиться от излишков жира.
Но я лично не встречал бодибилдеров, которым удавалось улучшить процессы жиросжигания за счет приема лизина. Если ваша диета богата белком, вам нет необходимости дополнительно принимать лизин.
Если ваша диета богата белком, вам нет необходимости дополнительно принимать лизин.
Цены на аминокислоты
Смотрите также:
Незаменимые аминокислоты: таблица, сокращения и структура
Аминокислота Ala
Аланин, обнаруженный в белке в 1875 году, составляет 30% остатков в шелке. Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, сопротивление растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
Аминокислота Arg
У человека аргинин вырабатывается при переваривании белков.Затем он может быть преобразован организмом в оксид азота, химическое вещество, которое, как известно, расслабляет кровеносные сосуды.
Благодаря своему сосудорасширяющему действию аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования по этим направлениям все еще продолжаются.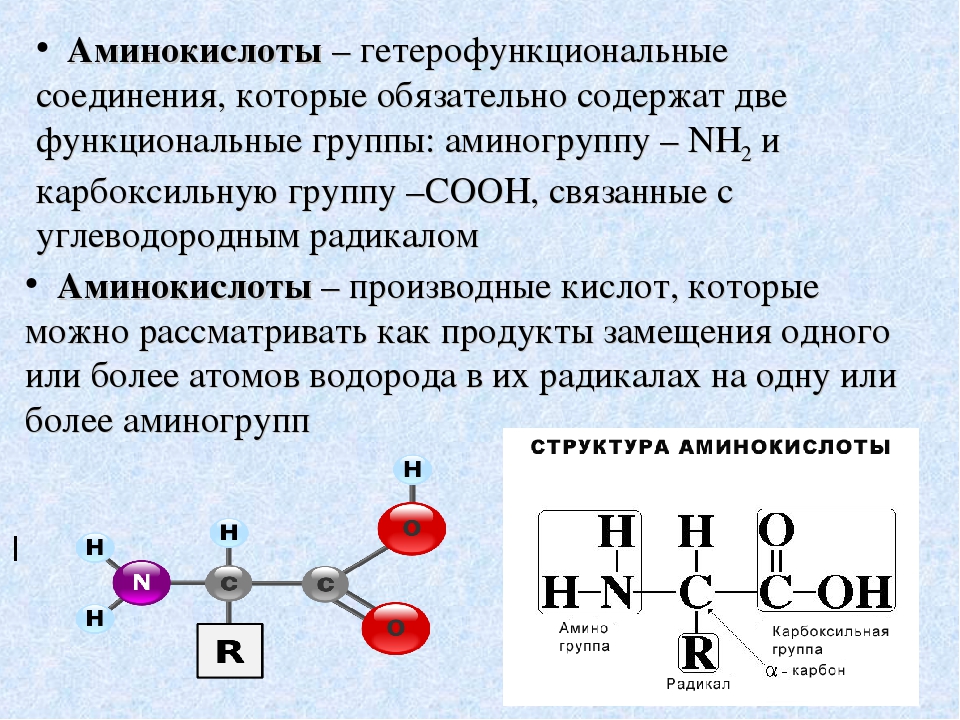 Аргинин также может быть произведен синтетическим путем, и родственные аргинину соединения можно использовать для лечения людей с дисфункцией печени из-за их роли в стимулировании регенерации печени.Хотя аргинин необходим для роста, но не для поддержания организма, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
Аргинин также может быть произведен синтетическим путем, и родственные аргинину соединения можно использовать для лечения людей с дисфункцией печени из-за их роли в стимулировании регенерации печени.Хотя аргинин необходим для роста, но не для поддержания организма, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
Аминокислота Asn
В 1806 году аспарагин был очищен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника. Однако только в 1932 году ученые смогли доказать, что аспарагин присутствует в белках. Только l-стереоизомер участвует в биосинтезе белков млекопитающих.Аспарагин важен для удаления токсичного аммиака из организма.
Аминокислота Asp
Аспарагиновая кислота, обнаруженная в белках в 1868 году, обычно содержится в животных белках, однако только l-стереоизомер участвует в биосинтезе белков. Растворимость этой аминокислоты в воде обусловлена наличием рядом с активными центрами ферментов, таких как пепсин.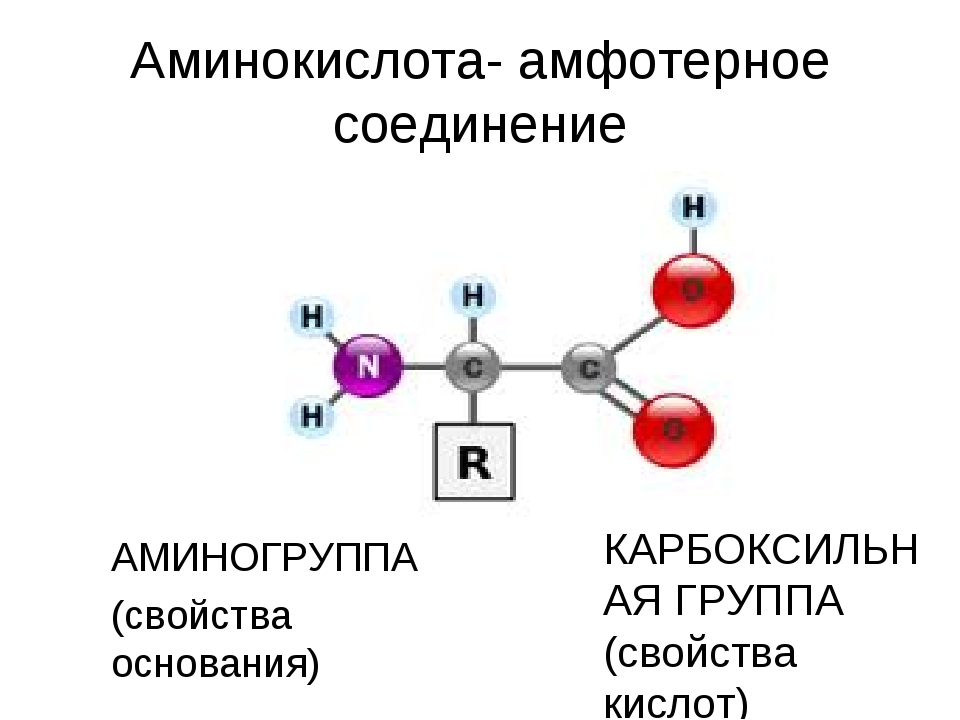
Аминокислота Cys
Цистеин особенно богат белками волос, копыт и кератином кожи, который был выделен из мочевого камня в 1810 году и из рога в 1899 году.Впоследствии он был химически синтезирован, а структура решена в 1903–1904 годах.
Серосодержащая тиоловая группа в боковой цепи цистеина является ключевой для его свойств, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петли в одной цепи, влияя на окончательную структуру белка. Две молекулы цистеина, связанные между собой дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот.Цистеин вырабатывается в организме из серина и метионина и присутствует только в l-стереоизомере белков млекопитающих.
Люди с генетическим заболеванием цистинурией не могут эффективно реабсорбировать цистин в кровоток. Следовательно, в их моче накапливается высокий уровень цистина, где он кристаллизуется и образует камни, которые блокируют почки и мочевой пузырь.
Аминокислота Gln
Глутамин был впервые выделен из свекольного сока в 1883 году, выделен из белка в 1932 году и впоследствии химически синтезирован в следующем году.Глютамин — это самая распространенная в нашем организме аминокислота, которая выполняет несколько важных функций. У человека глутамин синтезируется из глутаминовой кислоты, и этот этап преобразования жизненно важен для регулирования уровня токсичного аммиака в организме, образуя мочевину и пурины.
Аминокислота Glu
Глутаминовая кислота была выделена из пшеничного глютена в 1866 году и химически синтезирована в 1890. Обычно встречается в животных белках, только l-стереоизомер встречается в белках млекопитающих, которые люди могут синтезировать из обычных промежуточных продуктов. α-кетоглутаровая кислота.Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG) обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты способна действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками. Свободная глутаминовая кислота также может разлагаться до диоксида углерода и воды или превращаться в сахара.
Свободная глутаминовая кислота также может разлагаться до диоксида углерода и воды или превращаться в сахара.
Аминокислота Gly
Глицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной, которая не является оптически активной (без d- или l-стереоизомеров).Структурно простейшая из α-аминокислот, она очень инертна при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
His-аминокислота
Гистидин был выделен в 1896 году, и его структура была подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов.При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и ферментами, участвующими в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого периода времени обходиться без диетического питания, но по-прежнему считается незаменимой.
Иле аминокислота
Изолейцин был выделен из патоки свекловичного сахара в 1904 году.Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые она включена.
У людей, страдающих редким наследственным заболеванием, называемым болезнью мочи кленового сиропа, имеется дефектный фермент в пути разложения, который является общим для изолейцина, лейцина и валина. Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название состоянию.
Аминокислота Leu
Лейцин был выделен из сыра в 1819 году и из мышц и шерсти в его кристаллическом состоянии в 1820 году.В 1891 году он был синтезирован в лаборатории.
Только l-стереоизомер присутствует в белке млекопитающих и может расщепляться на более простые соединения ферментами организма.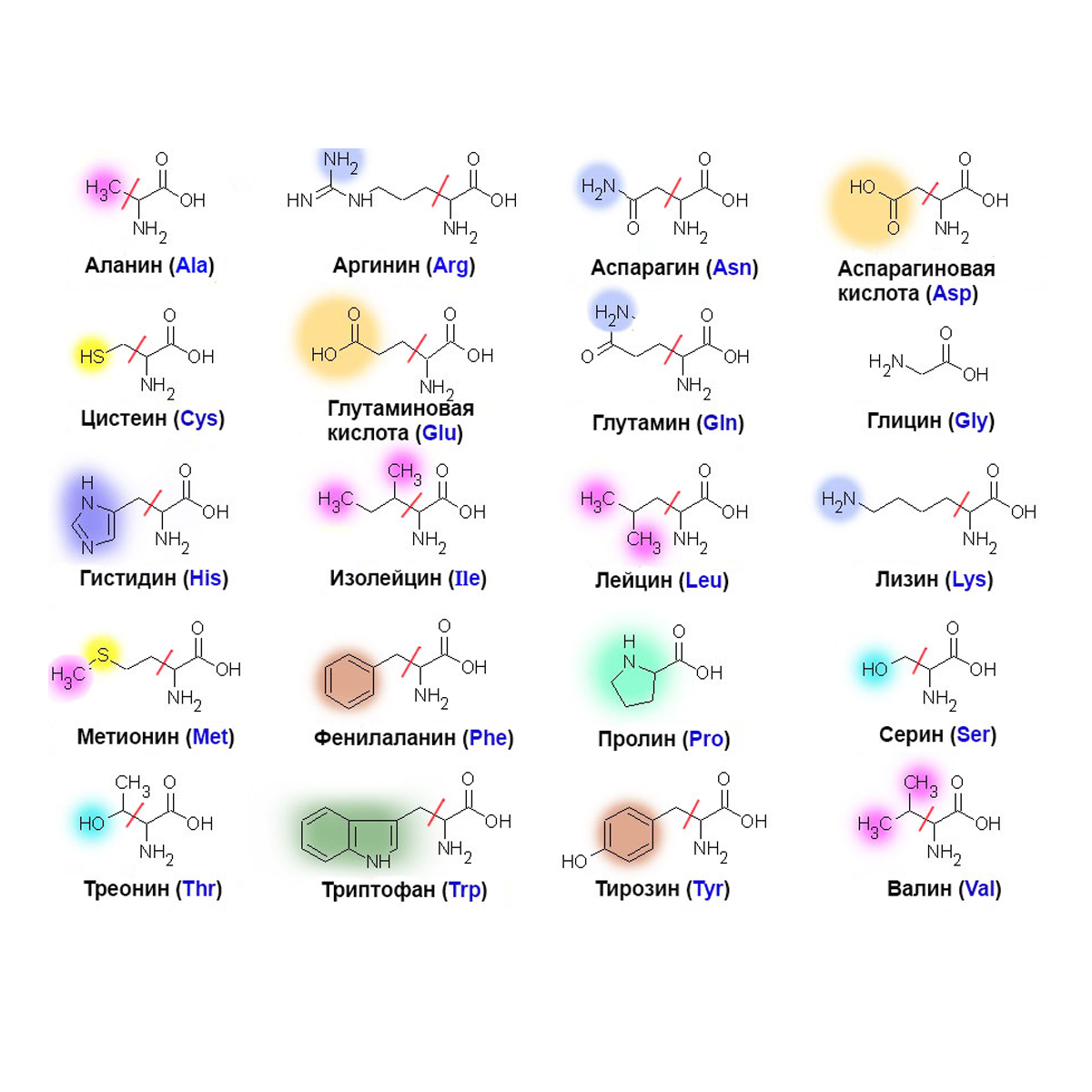 Некоторые связывающие ДНК белки содержат области, в которых лейцины расположены в конфигурации, называемые лейциновыми застежками-молниями.
Некоторые связывающие ДНК белки содержат области, в которых лейцины расположены в конфигурации, называемые лейциновыми застежками-молниями.
Аминокислота Lys
Лизин был впервые выделен из казеина молочного белка в 1889 году, а его структура была выяснена в 1902 году. Лизин важен для связывания ферментов с коферментами и играет важную роль в функционировании гистонов.
Многие зерновые культуры содержат очень мало лизина, что привело к его дефициту у некоторых групп населения, которые сильно зависят от них в продуктах питания, а также у вегетарианцев и людей, сидящих на низкожирной диете. Следовательно, были предприняты усилия по разработке штаммов кукурузы, богатых лизином.
Аминокислота Met
Метионин был выделен из казеина молочного белка в 1922 году, и его структура была решена путем лабораторного синтеза в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин.Благодаря содержанию серы метионин помогает предотвратить накопление жира в печени и помогает выводить токсины и шлаки метаболизма.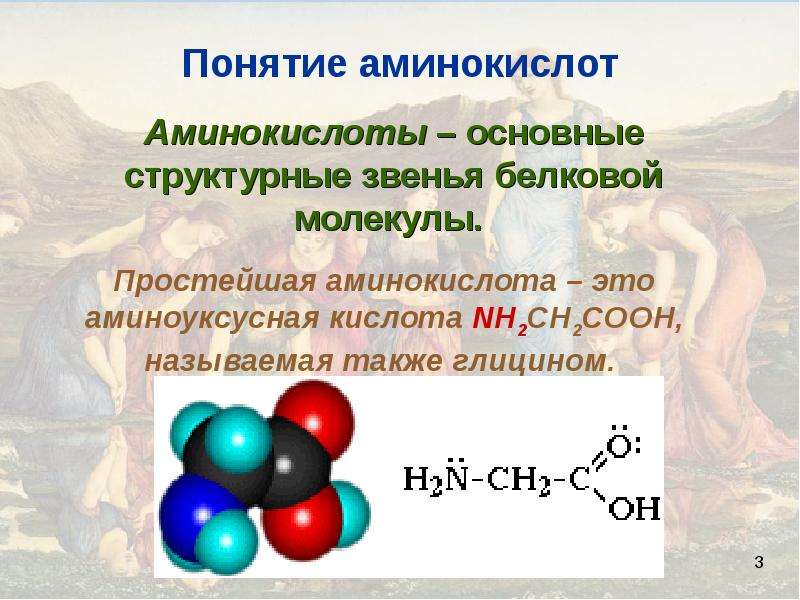
Метионин — единственная незаменимая аминокислота, которая не присутствует в значительных количествах соевых бобов и поэтому производится коммерчески и добавляется во многие соевые продукты.
Аминокислота Phe
Фенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году и впоследствии химически синтезирован в 1882 году.Организм человека обычно способен расщеплять фенилаланин до тирозина, однако у людей с наследственным заболеванием фенилкетонурией (ФКУ) фермент, выполняющий это преобразование, неактивен. Если его не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. Примерно 10 000 детей рождаются с этим заболеванием, поэтому диета с низким содержанием фенилаланина в раннем возрасте может облегчить его последствия.
Pro аминокислота
В 1900 году был химически синтезирован пролин.В следующем году он был выделен из казеина из молочного белка, и его структура оказалась такой же.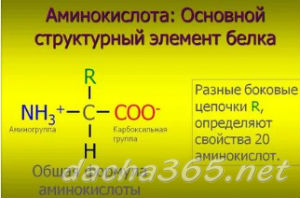 Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только как l-стереоизомер в белках млекопитающих. Когда пролин включается в белки, его особая структура приводит к резким изгибам или перегибам в пептидной цепи, что в значительной степени способствует окончательной структуре белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только как l-стереоизомер в белках млекопитающих. Когда пролин включается в белки, его особая структура приводит к резким изгибам или перегибам в пептидной цепи, что в значительной степени способствует окончательной структуре белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Аминокислота Ser
Серин был впервые выделен из белка шелка в 1865 году, но его структура не была установлена до 1902 года. Люди могут синтезировать серин из других метаболитов, включая глицин, хотя только l-стереоизомер присутствует в белках млекопитающих. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервные газы и некоторые инсектициды действуют путем объединения с остатком серина в активном центре ацетилхолинэстеразы, полностью ингибируя фермент. Активность эстеразы важна для расщепления нейромедиатора ацетилхолина, в противном случае накапливается опасно высокий уровень, что быстро приводит к судорогам и смерти.
Активность эстеразы важна для расщепления нейромедиатора ацетилхолина, в противном случае накапливается опасно высокий уровень, что быстро приводит к судорогам и смерти.
Аминокислота Thr
Треонин был выделен из фибрина в 1935 году и синтезирован в том же году. Только l-стереоизомер появляется в белках млекопитающих, где он относительно инертен. Хотя он играет важную роль во многих реакциях бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Аминокислота Trp
Структура триптофана, выделенная из казеина (молочного белка) в 1901 году, была установлена в 1907 году, но только l-стереоизомер присутствует в белках млекопитающих. В кишечнике человека бактерии расщепляют пищевой триптофан, выделяя такие соединения, как скатол и индол, которые придают фекалиям неприятный аромат. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но не в достаточной степени, чтобы поддерживать наше здоровье. Следовательно, мы также должны принимать витамин B3, несоблюдение этого правила приводит к его дефициту, называемому пеллагрой.
Следовательно, мы также должны принимать витамин B3, несоблюдение этого правила приводит к его дефициту, называемому пеллагрой.
Аминокислота Tyr
В 1846 году тирозин был выделен в результате разложения казеина (сырного белка), после чего он был синтезирован в лаборатории и его структура была определена в 1883 году. Присутствует только в l-стереоизомере в белки млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норэпинефрина, гормонов щитовидной железы, включая тироксин, а также пигмента волос и кожи меланина.В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие тяжелым генетическим заболеванием фенилкетонурия (ФКУ) неспособны превращать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией метаболизм тирозина нарушен, и моча становится отчетливой и темнеет на воздухе.
Val аминокислота
Структура валина была установлена в 1906 году после его первого выделения из альбумина в 1879 году.В белке млекопитающих появляется только l-стереоизомер. Валин может разлагаться в организме на более простые соединения, но у людей с редким генетическим заболеванием, называемым болезнью мочи кленового сиропа, неисправный фермент прерывает этот процесс и может оказаться фатальным, если его не лечить.
Незаменимые аминокислоты: определение, преимущества и продукты питания
Организму необходимо 20 различных аминокислот для поддержания хорошего здоровья и нормального функционирования. Люди должны получать девять из этих аминокислот, называемых незаменимыми аминокислотами, с пищей.Хорошие диетические источники включают мясо, яйца, тофу, сою, гречку, киноа и молочные продукты.
Аминокислоты — это соединения, которые образуют белки. Когда человек ест пищу, содержащую белок, его пищеварительная система расщепляет белок на аминокислоты. Затем организм комбинирует аминокислоты различными способами для выполнения функций организма.
Затем организм комбинирует аминокислоты различными способами для выполнения функций организма.
Здоровый организм может вырабатывать другие 11 аминокислот, поэтому они обычно не нуждаются в поступлении в организм с пищей.
Аминокислоты укрепляют мышцы, вызывают химические реакции в организме, переносят питательные вещества, предотвращают болезни и выполняют другие функции.Дефицит аминокислот может привести к снижению иммунитета, проблемам с пищеварением, депрессии, проблемам с фертильностью, снижению умственной активности, замедлению роста у детей и многим другим проблемам со здоровьем.
Каждая из незаменимых аминокислот играет различную роль в организме, и симптомы дефицита соответственно различаются.
Существует много типов незаменимых аминокислот, в том числе:
Лизин
Лизин играет жизненно важную роль в наращивании мышц, поддержании прочности костей, помощи в восстановлении после травм или хирургических операций, а также в регулировании гормонов, антител и ферментов. Он также может иметь противовирусное действие.
Он также может иметь противовирусное действие.
Существует не так много исследований дефицита лизина, но исследование на крысах показывает, что дефицит лизина может приводить к вызванной стрессом тревоге.
Гистидин
Гистидин способствует росту, образованию клеток крови и восстановлению тканей. Он также помогает поддерживать особое защитное покрытие нервных клеток, которое называется миелиновой оболочкой.
В организме гистидин превращается в гистамин, который имеет решающее значение для иммунитета, репродуктивного здоровья и пищеварения.Результаты исследования, в котором приняли участие женщины с ожирением и метаболическим синдромом, показывают, что добавки гистидина могут снизить ИМТ и инсулинорезистентность.
Дефицит может вызвать анемию, а низкий уровень в крови чаще встречается у людей с артритом и заболеванием почек.
Треонин
Треонин необходим для здоровой кожи и зубов, так как он входит в состав зубной эмали, коллагена и эластина. Он помогает метаболизму жиров и может быть полезен для людей с расстройством желудка, тревожностью и легкой депрессией.
Он помогает метаболизму жиров и может быть полезен для людей с расстройством желудка, тревожностью и легкой депрессией.
Исследование 2018 года показало, что дефицит треонина у рыб привел к снижению устойчивости этих животных к болезням.
Метионин
Метионин и заменимая аминокислота цистеин играют важную роль в здоровье и эластичности кожи и волос. Метионин также помогает сохранять ногти крепкими. Он помогает правильному усвоению селена и цинка и удалению тяжелых металлов, таких как свинец и ртуть.
Валин
Валин необходим для умственной сосредоточенности, координации мышц и эмоционального спокойствия.Люди могут использовать добавки валина для роста мышц, восстановления тканей и получения энергии.
Дефицит может вызвать бессонницу и снижение умственной функции.
Изолейцин
Изолейцин способствует заживлению ран, укреплению иммунитета, регуляции уровня сахара в крови и выработке гормонов. Он в основном присутствует в мышечной ткани и регулирует уровень энергии.
Пожилые люди могут быть более подвержены дефициту изолейцина, чем молодые люди. Этот недостаток может вызвать мышечное истощение и тряску.
Лейцин
Лейцин помогает регулировать уровень сахара в крови и способствует росту и восстановлению мышц и костей.Он также необходим для заживления ран и выработки гормона роста.
Дефицит лейцина может вызвать кожную сыпь, выпадение волос и усталость.
Фенилаланин
Фенилаланин помогает организму использовать другие аминокислоты, а также белки и ферменты. Организм превращает фенилаланин в тирозин, который необходим для определенных функций мозга.
Дефицит фенилаланина, хотя и встречается редко, может приводить к плохой прибавке веса у младенцев. Это также может вызвать экзему, усталость и проблемы с памятью у взрослых.
Фенилаланин часто входит в состав искусственного подсластителя аспартама, который производители используют для приготовления диетических газированных напитков. Большие дозы аспартама могут повышать уровень фенилаланина в головном мозге, вызывать беспокойство и нервозность, а также влиять на сон.
Люди с редким генетическим заболеванием, называемым фенилкетонурией (ФКУ), не могут метаболизировать фенилаланин. В результате им следует избегать употребления продуктов, содержащих высокий уровень этой аминокислоты.
Триптофан
Триптофан необходим для нормального роста младенцев и является предшественником серотонина и мелатонина.Серотонин — нейромедиатор, регулирующий аппетит, сон, настроение и боль. Мелатонин также регулирует сон.
Триптофан является седативным средством и входит в состав некоторых снотворных. Одно исследование показывает, что добавление триптофана может улучшить умственную энергию и эмоциональную обработку у здоровых женщин.
Дефицит триптофана может вызвать состояние, называемое пеллагрой, которое может привести к слабоумию, кожной сыпи и проблемам с пищеварением.
Многие исследования показывают, что низкий уровень белка и незаменимых аминокислот влияет на мышечную силу и работоспособность.
Согласно исследованию 2014 года, недостаток незаменимых аминокислот может привести к снижению мышечной массы у пожилых людей.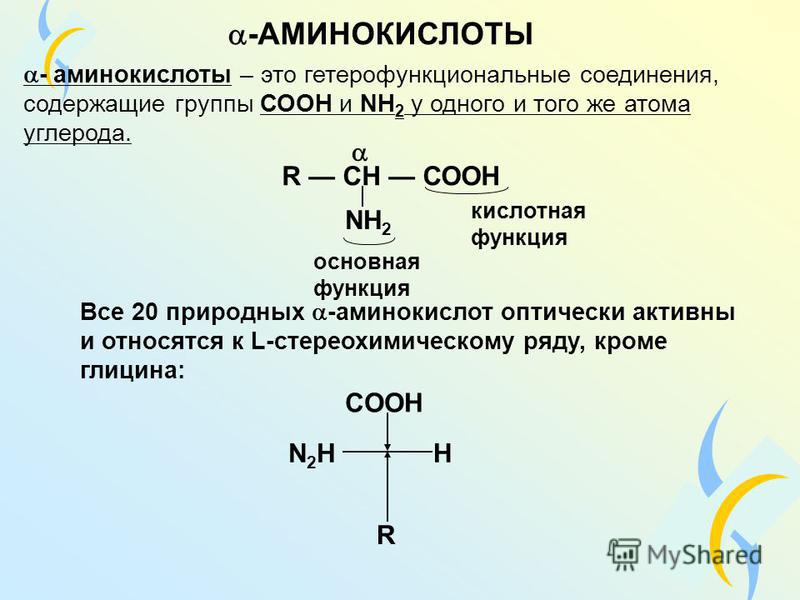
Дополнительное исследование показывает, что аминокислотные добавки могут помочь спортсменам восстановиться после тренировки.
Врачи ранее считали, что люди должны есть продукты, содержащие все девять незаменимых аминокислот за один прием пищи.
В результате, если человек не ел мясо, яйца, молочные продукты, тофу или другую пищу со всеми незаменимыми аминокислотами, необходимо было комбинировать два или более растительных продукта, содержащих все девять, таких как рис и бобы.
Однако сегодня эта рекомендация иная. Люди, которые придерживаются вегетарианской или веганской диеты, могут получать свои незаменимые аминокислоты из различных растительных продуктов в течение дня, и им необязательно есть их все вместе за один прием пищи.
Поделиться на Pinterest Человеку следует поговорить со своим врачом, прежде чем принимать добавки с незаменимыми аминокислотами. Хотя 11 аминокислот не являются незаменимыми, людям могут потребоваться некоторые из них, если они находятся в состоянии стресса или болеют. В это время организм может быть не в состоянии производить достаточное количество этих аминокислот для удовлетворения повышенных потребностей.Эти аминокислоты являются «условными», что означает, что они могут потребоваться человеку в определенных ситуациях.
В это время организм может быть не в состоянии производить достаточное количество этих аминокислот для удовлетворения повышенных потребностей.Эти аминокислоты являются «условными», что означает, что они могут потребоваться человеку в определенных ситуациях.
Иногда люди могут захотеть принимать добавки с незаменимыми аминокислотами. Лучше сначала проконсультироваться с врачом относительно безопасности и дозировки.
Хотя дефицит незаменимых аминокислот возможен, большинство людей может получить их в достаточном количестве, соблюдая диету, включающую белок.
Продукты из следующего списка являются наиболее распространенными источниками незаменимых аминокислот:
- Лизин содержится в мясе, яйцах, сое, черной фасоли, лебеде и семенах тыквы.
- Мясо, рыба, птица, орехи, семена и цельные зерна содержат большое количество гистидина.
- Творог и зародыши пшеницы содержат большое количество треонина.
- Метионин содержится в яйцах, зернах, орехах и семенах.

- Валин содержится в сое, сыре, арахисе, грибах, цельнозерновых и овощах.
- Изолейцин содержится в большом количестве в мясе, рыбе, птице, яйцах, сыре, чечевице, орехах и семенах.
- Источниками лейцина являются молочные продукты, соя, фасоль и бобовые.
- Фенилаланин содержится в молочных продуктах, мясе, птице, сое, рыбе, бобах и орехах.
- Триптофан содержится в большинстве продуктов с высоким содержанием белка, включая зародыши пшеницы, творог, курицу и индейку.
Это лишь несколько примеров продуктов, богатых незаменимыми аминокислотами. Все продукты, содержащие белок, будь то растительного или животного происхождения, будут содержать по крайней мере некоторые из незаменимых аминокислот.
Потребление незаменимых аминокислот имеет решающее значение для хорошего здоровья.
Ежедневное употребление разнообразных продуктов, содержащих белок, — лучший способ для людей получать достаточное количество незаменимых аминокислот. При современной диете и доступе к большому разнообразию продуктов дефицит редко встречается у людей с хорошим здоровьем.
При современной диете и доступе к большому разнообразию продуктов дефицит редко встречается у людей с хорошим здоровьем.
Перед приемом пищевых добавок следует всегда проконсультироваться с врачом.
Номенклатура для описания вариантов последовательностей: кодоны и аминокислоты
Номенклатура для описания вариантов последовательностей: кодоны и аминокислоты |
Содержание
Генетический код
ПРИМЕЧАНИЕ — начиная с версии 3 VarNomen, ‘*’ используется для обозначения
стоп-кодон трансляции, заменяющий использованный ранее ‘X’ (см. Предпосылки).
Предпосылки).
| Положение нуклеотида в кодоне | |||||
|---|---|---|---|---|---|
| первая | секунд | третья | |||
| U | С | А | G | ||
| U | UUU — Phe UUC — Phe UUA — лей UUG — лей | UCU — Ser UCC — Ser UCA — Ser UCG — Ser | UAU — Tyr UAC — Tyr UAA — * UAG — * | UGU — Cys UGC — Cys UGA — * UGG — Trp | U C A G |
| С | CUU — Leu CUC — Leu CUA — Leu CUG — Leu | CCU — Pro CCC — Pro CCA — Pro CCG — Pro | CAU — His CAC — His CAA — Gln CAG — Gln | CGU — Arg CGC — Arg CGA — Arg CGG — Arg | U C A G |
| А | AUU — Ile AUC — Ile AUA — Ile AUG — Met | ACU — Thr ACC — Thr ACA — Thr ACG — Thr | AAU — Asn AAC — Asn AAA — Lys AAG — Lys | AGU — Ser AGC — Ser AGA — Arg AGG — Arg | U C A G |
| G | GUU — Val GUC — Val GUA — Val GUG — Val | GCU — Ala GCC — Ala GCA — Ala GCG — Ala | GAU — Asp GAC — Asp GAA — Glu GAG — Glu | GGU — Gly GGC — Gly GGA — Gly GGG — Gly | U C A G |
Описание аминокислот
| Одна буква код | Трехбуквенный код | Аминокислота | Возможные кодоны |
|---|---|---|---|
| А | Ала | Аланин | GCA, GCC, GCG, GCT |
| B | Asx | Аспарагин или аспарагиновая кислота | AAC, AAT, GAC, GAT |
| С | Cys | Цистеин | ТГК, ТГТ |
| D | Асп | Аспарагиновая кислота | GAC, GAT |
| E | Glu | Глутаминовая кислота | GAA, GAG |
Ф. | Phe | Фенилаланин | ТТС, ТТТ |
| G | Gly | Глицин | GGA, GGC, GGG, GGT |
| H | Его | Гистидин | CAC, CAT |
| I | Иль | Изолейцин | ATA, ATC, ATT |
| К | Lys | Лизин | AAA, AAG |
| л | Leu | Лейцин | CTA, CTC, CTG, CTT, TTA, TTG |
| M | Мет | метионин | ATG |
| N | Asn | Аспарагин | AAC, AAT |
п. | Pro | Proline | CCA, CCC, CCG, CCT |
| Q | Gln | Глютамин | CAA, CAG |
| R | Арг. | Аргинин | AGA, AGG, CGA, CGC, CGG, CGT |
| S | Ser | Серин | AGC, AGT, TCA, TCC, TCG, TCT |
| Т | Thr | Треонин | ACA, ACC, ACG, ACT |
| В | Вал | Валин | GTA, GTC, GTG, GTT |
| Вт | Trp | Триптофан | TGG |
| X | Х | любой кодон | NNN |
| Y | Тир | Тирозин | TAC, TAT |
| Z | Glx | Глутамин или глутаминовая кислота | CAA, CAG, GAA, GAG |
| * | * | стоп-кодон | TAA, TAG, TGA |
Аминокислотные свойства
| Имущество | Аминокислоты | |
|---|---|---|
| малый | Ала, Гли | |
| кислый / амид | Asp, Glu, Asn, Gln | |
| начислено | отрицательный | Asp, Glu |
| положительный | Lys, Arg | |
| полярный | Ala, Gly, Ser, Thr, Pro | |
| гидрофобный | Вал, Лей, Иль, Мет | |
| размер | большой | Glu, Gln, His, Ile, Lys, Leu, Met, Phe, Trp, Tyr |
| малый | Ala, Asn, Asp, Cys, Gly, Pro, Ser, Thr, Val | |
| алифатический | Иль, Лей, Вал | |
| ароматический | His, Phe, Tyr, Trp | |
| Вверх страницы | MutNomen
домашняя страница | Контрольный список |
| Рекомендации: ДНК, РНК, белок, неопределенные |
| Обсуждения | Символы, кодоны и т. Д.| FAQ’s | История |
Д.| FAQ’s | История |
| Пример описания: QuickRef / символов,
ДНК, РНК, белок |
Авторские права HGVS 2007 Все права защищены |
Аминокислоты: химия, биохимия и питание
Резюме ниже только для образовательных целей . По большей части он адаптирован из книги проф.Мы с Ниром Бен-Талем написали «Введение в белки: структура, функции и движение»:
. В книге обсуждается структура и функции белков, а также рассматриваются многие повседневные применения белковой науки, такие как болезни и лечение, наркотики, токсины, промышленные инженерные и многое другое. Некоторые рисунки взяты из других источников, таких как «Принципы биохимии» Ленингера, 5-е издание учебника.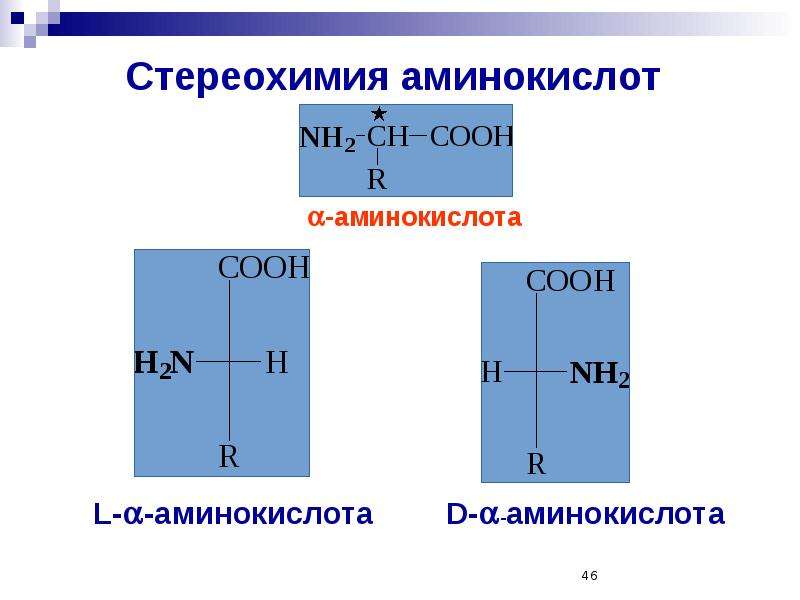
д
1.ЧТО ТАКОЕ АМИНОКИСЛОТ?
Аминокислоты — это небольшие органические молекулы, которые играют несколько важных ролей в живых организмах:
- Это основные строительные блоки белков , наиболее функционально разнообразных биомолекул в природе. Подробнее об этих замечательных молекулах см. В этом разделе.
- Они служат предшественниками для многих биологически активных молекул , таких как нейротрансмиттеров (например, дофамин, серотонин, ГАМК, эпинефрин), местных медиаторов (например,г. медиатор аллергии гистамин), энергетических метаболитов (например, креатин, цитруллин, карнитин), кислородсвязывающая молекула « гем » и основания ДНК, называемые пуринами . Подробнее см. Раздел 5 ниже.
- Они служат источником энергии во время длительного голодания, диабета и когда диета богата белками.
- Некоторые действуют как регуляторы экспрессии гена и клеточной передачи сигналов .Это влияет на несколько физиологических процессов, которые связаны с ростом, поддержанием, воспроизводством и иммунитетом .
В следующих подразделах дается краткое описание структуры, функции и метаболизма аминокислот. Большинство тем подробно описано в моей книге (см. Верхнюю часть этой страницы), тогда как другие взяты из учебников биохимии (например, Lehninger’s) и из статьи Ву « Аминокислоты: метаболизм, функции и питание » ( Amino Кислоты (2009) 37 : 1–17).
f
2. ОБЩАЯ СТРУКТУРА И СВОЙСТВА
Как следует из названия, все аминокислоты содержат группы как амино, так и карбоновых кислот. В природе существует примерно 300 типов аминокислот, из которых только 20 обычно служат строительными блоками белков. Другие действуют как метаболиты, посланники и регуляторы биологических процессов. Как мы увидим ниже, есть две аминокислоты, селеноцистеин и пирролизин, которые включены в некоторые белки.По этой причине в некоторых книгах и на веб-сайтах они упоминаются как «двадцать первая» и «двадцать вторая» аминокислоты ». Однако эта ссылка не является общепринятой, поскольку две аминокислоты присутствуют только в определенных белках, тогда как остальные 20 встречаются во всех.
Другие действуют как метаболиты, посланники и регуляторы биологических процессов. Как мы увидим ниже, есть две аминокислоты, селеноцистеин и пирролизин, которые включены в некоторые белки.По этой причине в некоторых книгах и на веб-сайтах они упоминаются как «двадцать первая» и «двадцать вторая» аминокислоты ». Однако эта ссылка не является общепринятой, поскольку две аминокислоты присутствуют только в определенных белках, тогда как остальные 20 встречаются во всех.
Все аминокислоты, которые появляются в белках (также известные как ‘ α-аминокислоты ), обладают структурой, которая включает центральный атом углерода, называемый Cα , окруженный четырьмя заместителями: атомом водорода, аминогруппой ( α-амино ), карбоксильная группа ( α-карбоксил ) и четвертая группа, называемая боковой цепью :
Рисунок 1а.Общий состав аминокислоты
- α-карбоксильная группа имеет низкое значение pKa (~ 2), поэтому депротонирована и отрицательно заряжена при физиологическом pH (7).
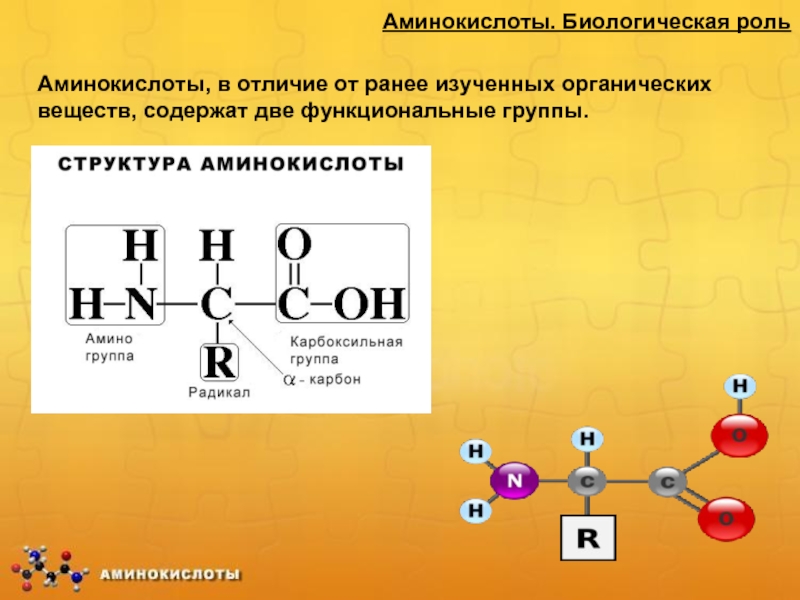
- Группа α-амино имеет высокий pKa (9–10), поэтому она протонирована и положительно заряжена при физиологическом pH.
- Боковая цепь является химически различными в каждой из аминокислот (рис. 1b). Они определяют уникальность 20 природных аминокислот , обнаруженных в белках.
- Аминокислоты в белках почти исключительно имеют конфигурацию л . Аминокислоты с D-конфигурацией могут быть обнаружены в микроорганизмах (например, в бактериальной клеточной стенке и в пептидах антибиотика ) и в некоторых животных (например, пептид кожи лягушки «дерморфин»)
Рисунок 1б. 20 типов аминокислот. Боковые цепи розового цвета.
(источник)
д
3.ГРУППЫ АМИНОКИСЛОТ
Принято сгруппировать 20 природных аминокислот, содержащихся в белках, на 4 типа в соответствии с полярностью их боковых цепей (рис. 1b). Аминокислоты с полярными боковыми цепями являются гидрофильными . То есть они имеют тенденцию появляться на поверхности водорастворимых белков, где они могут благоприятно взаимодействовать с окружающей водой. Аминокислоты с неполярными боковыми цепями гидрофобны. То есть они, как правило, находятся внутри белков, где они находятся вдали от воды и могут благоприятно взаимодействовать друг с другом.
f
I. Неполярные аминокислоты
К ним относятся следующие (рис. 2):
- Глицин (gly, G) — имеет один атом водорода в качестве боковой цепи.
- Аланин (Ala, A) — имеет метильную группу (Ch4) в качестве боковой цепи.
- Валин (val, V), лейцин (leu, L) и изолейцин (ile, I) — имеют разветвленную алифатическую боковую цепь.
- Метионин (met, M) — имеет серосодержащую линейную алифатическую боковую цепь.
- Пролин (про, Р) — имеет алифатическую боковую цепь, которая ковалентно связана с α-аминогруппой.
Рисунок 2. Неполярные аминокислоты
В водорастворимых белках неполярные аминокислоты находятся в основном в гидрофобном ядре. Здесь их взаимодействия друг с другом («гидрофобный эффект , ») — это то, что удерживает вместе 3-мерную складку белка. В мембраносвязанных белках неполярные аминокислоты находятся на поверхности, где они могут благоприятно взаимодействовать с мембранными липидами.Наконец, неполярные взаимодействия с участием этих аминокислот служат движущей силой для связывания лигандов и субстратов с белком.
Вот несколько интересных фактов о некоторых неполярных аминокислотах:
- Метионин , несмотря на то, что в целом неполярен, все еще способен слабо взаимодействовать с полярными частицами , такими как металлы. Это происходит благодаря несвязывающим электронам атома серы метионина, которые лишь слабо удерживаются ядром.
- Глицин , имеющий только водород в качестве боковой цепи, придает гибкость участкам белка, в которых он присутствует. Пролин делает противоположное (придает жесткость ) из-за того, что его боковая цепь сливается с остальной аминокислотой.
- Разветвленные аминокислоты (валин, лейцин, изолейцин) являются важным источником энергии в мышцах и сигнальных клетках для синтеза белков.
y
II. Полярно-незаряженные аминокислоты
К ним относятся следующие (рис.3):
- Серин (ser, S) и треонин (thr, T) — имеют в своей боковой цепи гидроксильную группу .
- Цистеин (cys, C) — имеет тиол (сульфгидрил) группу в своей боковой цепи.
- Глутамин (gln, Q) и аспарагин (asn, N) — имеют амидную группу в своих боковых цепях.
Рисунок 3. Полярно-незаряженные аминокислоты
В белках полярно незаряженные аминокислоты образуют водородных связей друг с другом и с лигандом / субстратом белка.Это придает специфичность взаимодействиям белок-лиганд, в отличие от гидрофобного эффекта, который придает стабильность и служит движущей силой для взаимодействий. Некоторые из полярно-незаряженных аминокислот также функционируют как нуклеофилов в ферментативном катализе .
Вот интересные факты о некоторых полярно-незаряженных аминокислотах:
- Серин и треонин часто фосфорилируются в белках, которые участвуют в межклеточной коммуникации .Эта модификация обратима и служит в качестве химического тега , передающего сигнал . Две аминокислоты могут также функционировать как нуклеофилов при ферментативном катализе благодаря гидроксильной группе в их боковой цепи.
- Серин и треонин на поверхности мембранных / секретируемых белков также могут быть гликозилированы (присоединены с помощью сахарных групп). Это защищает белок и увеличивает его растворимость в воде . В некоторых случаях присоединенные сахарные группы служат также в качестве кода распознавания для других внеклеточных элементов.
- Цистеин , несмотря на то, что он полярен, имеет тенденцию появляться в ядре водорастворимых белков. В окислительных условиях его тиоловая боковая цепь депротонируется и имеет тенденцию к образованию (ковалентной) дисульфидной связи с тиоловой группой соседнего цистеина. Эти связи важны для , стабилизирующих белков, которые секретируются клетками (гормоны, антитела, некоторые ферменты). Цистеин также служит нуклеофилом и агентом переноса электрона в ферментативном катализе . Оба являются результатом несвязывающих электронов атома серы цистеина, что придает ему высокую химическую реакционную способность и способность существовать в различных степенях окисления .
- Группа карбоксамида из глутамина и аспарагина может служить как донором, так и акцептором водородной связи. В результате эти аминокислоты обычно участвуют в сетях водородных связей внутри белков. Эта группа в аспарагине также гликозилирована в мембранных / секретируемых белках (преимущества гликозилирования см. Выше).
д
III. Полярно-заряженные аминокислоты
К ним относятся следующие (рис. 4):
- Аспартат (asp, D) и глутамат (glu, E) — имеют карбоксильную группу в своих боковых цепях. Как объяснялось выше, эта группа имеет низкое значение pKa и поэтому имеет тенденцию становиться депротонированными и иметь отрицательный заряд при физиологическом pH. По этой причине аспартат и глутамат обозначаются как « кислый ». В белках они имеют тенденцию электростатически взаимодействовать с положительно заряженными группами других аминокислот или лиганда / субстрата белка.
- Лизин (lys, K) и аргинин (arg, R) — имеют азотсодержащих группы в своих боковых цепях ( амино группа в лизине и гуанидин группа в аргинине). Эти группы имеют высокий pKa и поэтому имеют тенденцию становиться протонированными и положительно заряженными при физиологическом pH. По этой причине лизин и аргинин обозначаются как « основной ». В белках они имеют тенденцию электростатически взаимодействовать с отрицательно заряженными группами других аминокислот или лиганда / субстрата белка.
- Гистидин (his, H) — имеет группу имидазола в своей боковой цепи. Эта группа имеет pKa ~ 6 и, следовательно, имеет 50% шанс быть протонированным (положительно заряженным) или депротонированным (нейтральным) при физиологическом pH. Это позволяет гистидину действовать в ферментативном катализе с переносом водорода , где он может действовать как донор, акцептор водорода или и то, и другое.
Рис. 4. Полярно заряженные аминокислоты.
Вот интересные факты о некоторых полярно-незаряженных аминокислотах:
- Карбоксилирование глутамата на его γ-углероде (см.рис.6 ниже) позволяет ему эффективно связывать катионы, такие как двухвалентный кальций. Это очень полезно для белков свертывания, таких как протромбин, активность которого регулируется уровнем кальция в крови.
- Аминогруппа боковой цепи лизина способна образовывать основание Шиффа с альдегидами. Это помогает некоторым белкам связывать альдегидсодержащие простетические группы (например, пиридоксальфосфатный кофермент фермента аминотранферазы).
- Окисление боковой цепи лизина в структурных белках, таких как коллаген , позволяет ему участвовать в реакциях сшивания, которые стабилизируют эти белки.
- Как объяснено выше, боковая цепь имидазола гистидина может служить как кислотой , так и основанием благодаря своей pKa, которая близка к физиологическому pH. Это важно, например, для каталитического механизма фермента ацетилхолинэстеразы , который инактивирует нейротрансмиттер ацетилхолин . Инактивация важна для предотвращения перехода нашей нервной системы в состояние , паралич и смерть, что происходит, когда фермент подвергается атаке и инактивируется токсичными нервно-паралитическими агентами .Ацетилхолин представляет собой сложный эфир, и он гидролизуется до холина и ацетата под действием фермента посредством нуклеофильной атаки каталитического серинового остатка на сложноэфирной связи. Для этого серин должен депротонироваться, и это становится возможным благодаря близлежащему гистидину, который действует как основание, отвлекая протон серина:
Рисунок 4а. Гидролиз ацетилхолина его соответствующей эстеразой (источник)
г
IV. Ароматические аминокислоты
К ним относятся следующие (рис.5):
- Фенилаланин (phe, F) — имеет фенильную группу в боковой цепи.
- Тирозин (tyr, Y) — имеет в боковой цепи фенольную группу .
- Триптофан (trp, W) — имеет группу индола в боковой цепи.
Рисунок 5. Ароматические аминокислоты.
В отличие от других аминокислотных групп, эта группа определяется не в соответствии с полярностью боковой цепи, а скорее в соответствии с ее ароматической природой (в химическом смысле, а не обонятельной…).Ароматические группы содержат делокализованных π-электронов , которые могут взаимодействовать с другими ароматическими группами ( π-π-взаимодействий, ) , а также с положительно заряженными группами ( π-катионных взаимодействий, ) . Действительно, все эти взаимодействия наблюдаются в белках между ароматическими боковыми цепями. Ароматические аминокислоты важны для образования закрытых каркасов внутри белков, особенно сайтов связывания лигандов и субстратов.
Вот интересные факты о некоторых ароматических аминокислотах:
- Подобно серину и треонину, тирозин также может стать фосфорилированным на белках, участвующих в клеточной коммуникации.Хорошо известным примером являются мембраносвязанные рецепторы, которые отвечают на факторов роста . Связывание последних с этими рецепторами приводит к их фосфорилированию, которое, в свою очередь, передает сигнал в клетку и приводит к клеточному делению на . Генетические дефекты, которые делают возможным гормон-независимое фосфорилирование этих белков, часто приводят к раку .
- Фенольная группа тирозина также участвует в различных механизмах ферментативного катализа (например,г. нуклеофильная атака , катализ cid-основание и стабилизация промежуточных продуктов реакции ).
- Индольная группа в боковой цепи триптофана способна участвовать в различных полярных и неполярных нековалентных взаимодействиях с другими химическими f-видами. Таким образом, для белка характерны сайты связывания . Он также участвует в ферментативном катализе и переносе электронов.
- Боковая цепь триптофана флуоресцирует при поглощении УФ-света.Это позволяет биохимикам идентифицировать белки или изучать изменений в их структуре путем облучения их УФ-излучением с последующей регистрацией флуоресценции их аминокислот триптофана.
ff
20 природных аминокислот можно сгруппировать в соответствии с их физико-химическими свойствами, как показано на следующей диаграмме Венна:
20 типов аминокислот, сгруппированных по их физико-химическим свойствам (взяты из Esquivel et al. (2013 г.)
ff
Как упоминалось выше, 20 типов α-аминокислот, обычно присутствующих в белках, являются лишь небольшой частью из ~ 300 типов аминокислот, встречающихся в природе, в целом. Остальные включают производные, которые, хотя и похожи на α-аминокислоты, могут иметь немного другую химическую структуру. Например, таурин и β-аланин имеют свою аминогруппу, присоединенную к Cβ , а не к Cα.
Такие «особые» аминокислоты можно разделить на два типа:
- Аминокислотные производные , которые образуются в результате посттрансляционной модификации.
- Биогенные амины , которые действуют независимо (как небелковые образования) в различных клеточных и физиологических процессах.
Эти два типа описаны в следующих разделах.
д
4. ПРОИЗВОДНЫЕ АМИНОКИСЛОТ, ОБНАРУЖЕННЫЕ В БЕЛКАХ
I. Селеноцистеин и пирролизин
Селеноцистеин и пирролизин — две производные аминокислот, которые эволюция нашла способ генетически встроить в определенные белки.По этой причине их иногда называют «двадцать первой» и двадцать второй »аминокислотами. Включение белков достигается путем загрузки этих аминокислот на специализированную молекулу тРНК, которая связывается внутри рибосомы с «стоп-кодоном» мРНК (UGA в случае селеноцистеина и UAG в случае пирролизина). Стоп-кодон обычно сигнализирует механизму трансляции о прекращении трансляции, но в случае селеноцистеина и пирролизина кодон также содержит мотив добавочной последовательности, который предотвращает терминацию.
Селеноцистеин очень похож на цистеин, в котором атом серы заменен на селен . Однако он создается ферментативно из серина, а не из цистеина. Замена серы селеном превращает (селено) цистеин в лучший нуклеофил , что является преимуществом в ферментативном катализе . Действительно, селеноцистеин присутствует в некоторых окислительно-восстановительных ферментах . Некоторые ферменты, содержащие селеноцистеин, такие как глутатионпероксидаза и некоторые формы тиоредоксинредуктазы , действуют как антиоксиданты.То есть они являются частью встроенной системы организма, которая борется и обращает вспять окислительных повреждений, вызванных свободными радикалами . Кроме того, селеноцистеин содержится в ферментах, которые образуют T3, самый мощный гормон щитовидной железы . Вот почему селен в рационе важен для функции щитовидной железы.
Пирролизин появляется в ферменте ( метилтрансфераза ) метанпродуцирующих Archaea и 0ne Eubacterium.Он ферментативно создан из натуральной аминокислоты лизина.
dd
II. Аминокислоты, образующиеся посттрансляционно
В некоторых случаях природная аминокислота, уже присутствующая в белке, может быть ферментативно модифицирована с образованием химического производного. Например, коллаген , белок, широко распространенный в соединительных тканях животных, содержит гидроксипролин и гидроксилизин . Они образуются путем присоединения гидроксильной группы к природным аминокислотам пролину и лизину соответственно.Другая неприродная аминокислота, γ-карбоксиглутамат , образуется путем присоединения карбоксильной группы к аминокислоте глутамату в белках свертывания крови.
Рисунок 6а. Некоторые примеры неприродных аминокислот.
ff
III. D-аминокислоты
аминокислот с противоположной конфигурацией ( D-аминокислот ) можно найти в некоторых белках и пептидах. Большинство последних — это бактериальные белки / пептиды.Например, стенка бактериальной клетки ( пептидогликан ) содержит D-аланин , тогда как бактериальный антибиотик валиномицин содержит D-валин . Однако D-аминокислоты также можно найти в многоклеточных организмах. Например, пептид под названием dermorphin , который вырабатывается южноамериканской лягушкой для отпугивания хищников, содержит D-аланин.
Рисунок 6б. Два пептида, содержащие D-аминокислоты.
сд
д
5.АМИНОКИСЛОТ КАК ИСТОЧНИК ДРУГИХ СОЕДИНЕНИЙ
Некоторые аминокислоты, такие как тирозин, триптофан, гистидин и глутамат, служат предшественниками « биогенных аминов », соединений, которые не являются протеогенными (не присутствуют в белках), но играют разные клеточные и физиологические роли. Многие биогенные амины действуют как нейротрансмиттеры, гормоны или местные медиаторы. Вот несколько примеров:
- Тирозин является источником группы возбуждающих нейротрансмиттеров и гормонов, называемых « катехоламинов », которые включают эпинефрин ( адреналин ), норадреналин ( норадреналин) и норадреналин .Их называют так, потому что каждый из них содержит катехиновое (ароматическое) кольцо, которое является частью боковой цепи тирозина. Тирозин также является источником пигмента меланина и гормонов щитовидной железы тироксин (T4) и трийодтиронин (T3) .
Рис. 7. Биосинтез катехоламинов из тирозина (источник)
д
- Триптофан является источником « индоламинов » (a.k.a. « триптаминов »). То есть биогенные амины, содержащие индольное кольцо боковой цепи триптофана. Самым известным индоламином является нейромедиатор серотонин , участвующий в регуляции настроения , аппетита и сна . Действительно, серотонинергический механизм в головном мозге является мишенью популярных антидепрессантов / анксиолитиков, называемых «селективными ингибиторами обратного захвата серотонина (СИОЗС) ». Они повышают уровень серотонина в головном мозге, что оказывает антидепрессивное и успокаивающее действие.На серотонинергическую нейропередачу также нацелены другие типы лекарств, такие как нейролептики , противорвотные и лекарства от мигрени , а также психоделических препаратов и эмпатогенов .
Рис. 8. Биосинтез серотонина из триптофана (источник)
д
- Другой хорошо известный индоламин — мелатонин , который регулирует цикл сна-бодрствования ( циркадный ритм, ) у людей.
f
- Гистидин является источником гистамина , местного медиатора воспаления и иммунного ответа на определенные патогены. Таким образом, гистамин также опосредует аллергию , а его рецепторы нацелены на антигистаминов (лекарства для борьбы с аллергией).
Рис. 9. Биосинтез гистамина из гистидина (источник)
f
- Глутамат является источником гамма-аминомасляной кислоты (ГАМК) , основного тормозного нейромедиатора головного мозга.
Рисунок 10а. Биосинтез ГАМК из глутамата (источник)
f
Глутамат, наряду с глицином и цистеином , также создает трипептид глутатион — соединение, которое борется с окислительным стрессом, вызванным в нашем организме свободными радикалами.
Рисунок 10б. Структура глутатиона
f
Когда глутатион истощается под действием внешних факторов, наш организм подвергается окислительному повреждению.Это происходит, например, в случаях передозировки ацетаминофена (парацетамола) . Это распространенное болеутоляющее обычно метаболизируется в печени до различных метаболитов. При употреблении в больших количествах один из этих метаболитов истощает глутатион клеток печени, что приводит к острой печеночной недостаточности. Лечение в таких случаях включает восстановление уровня глутатиона в печени путем введения его предшественника, N -ацетилцистеина . Последний, который является химическим производным аминокислоты цистеина , также используется для лечения других случаев истощения глутатиона, таких как токсичность нафталина .
- Серин используется для создания фосфатидилсерина, и фосфатидилэтаноламина, двух фосфолипидов, строящих мембраны наших клеток. серин также является предшественником церамида , восковой молекулы из группы других мембранных липидов, сфинголипидов .
f
- Аргинин является предшественником креатина (резервуар энергии в наших мышцах, подробнее см. Ниже), оксида азота (медиатор сужения кровеносных сосудов), цитруллина (антиоксидант, подробнее см. Ниже), и группа из полиаминов , которые выполняют различные физиологические и клеточные роли.
f
Другие амины, созданные из аминокислот, имеют другие функции. Вот несколько примеров (ссылки на соответствующую страницу Википедии):
Орнитин участвует в (i) детоксикации аммиака (цикл мочевины) (ii) синтезе пролина, глутамата и полиаминов (iii) целостности митохондрий и (iv) заживлении ран. Он построен из глутамата аминокислоты, а также является промежуточным звеном в цикле мочевины.
Цитруллин — антиоксидант.Он также участвует в (i) синтезе аргинина, (ii) регуляции осмо, (iii) детоксикации аммиака. Наконец, это резервуар азота. Он построен из аминокислоты аргинина, а также как промежуточный продукт в цикле мочевины.
Теанин — аналог глютамина, содержащийся в чайных листьях. Помимо того, что он действует как антиоксидант, он участвует в повышении уровня ГАМК, дофамина и серотонина в головном мозге и, как считается, обладает нейропротекторным эффектом.
Карнитин облегчает транспортировку длинноцепочечных жирных кислот в митохондрии.Он построен из аминокислоты лизина.
Таурин — это сульфоновая кислота, которая является основным компонентом желчи. Это важно для конъюгации желчных кислот, антиоксидантной защиты, осморегуляции, стабилизации мембран и передачи сигналов кальция. Он построен из аминокислоты цистеина.
Коэнзим A важен для центрального метаболизма у всех форм жизни. Это крайне важно для их способности получать энергию для пищевых продуктов, а также вырабатывать жирные кислоты, холестерин и нейромедиатор ацетилхолин.Он состоит из аминокислоты цистеина и пантотеновой кислоты (витамин B5).
Креатин — это молекула в наших скелетных мышцах, которая связывает высокоэнергетические фосфатные группы. В течение первых секунд напряженной работы мышц АТФ расходуется, и нет времени восстанавливать его из глюкозы. Затем фосфорилированный креатин используется для пополнения АТФ из АДФ, что особенно важно в случаях «бей или беги». Креатин расщепляется в мышцах до креатинина , который секретируется почками и поэтому считается показателем почечной функции.Креатин состоит из аргинина, глицина и метионина.
S -аденозилметионин представляет собой молекулу, построенную из аминокислоты метионина и аденозильной группы АТФ. Это общий и важный ферментативный кофактор, необходимый для многочисленных биохимических реакций, включающих метилирование.
д
6. МЕТАБОЛИЗМ АМИНОКИСЛОТ И ПИТАТЕЛЬНАЯ ЦЕННОСТЬ
Аминокислоты синтезируются всеми живыми организмами. Они построены из других аминокислот или из разных метаболитов (например,г. α-кетокислоты):
- Пируват → аланин
- Пируват → валин, лейцин, изолейцин (только в бактериях и растениях)
- Разветвленные кетокислоты → валин, лейцин, изолейцин
- α-кетоглутарат → глутамат
- Гистидин → глутамат
- Глутамат → глутамин, пролин, аргинин
- Оксоалоацетат → аспартат
- Аспартат → аспарагин
- Аспартат → метионин, треонин, лизин (только в бактериях и растениях)
- Рибозо-5-фосфат + глутамин → гистидин
- 3-фосфоглицерат → серин
- гидроксипуруват → серин
- Глицин → серин (в организме человека)
- Глутатион → серин (в организме человека)
- Серин → глицин, цистеин
- Глиоксилат → глицин
- Изоцитрат → глицин
- Аскорбиновая кислота → глицин
- фосфоенолпируват + эритрозо-4-фосфат → хоризмат → триптофан, фенилаланин, тирозин (только для бактерий и растений)
- Фенилаланин → тирозин
- Метионин → цистеин
(аминокислоты — красным, другие метаболиты — синим)
Хотя углеродный скелет аминокислот может происходить из разных метаболитов в результате различных биохимических реакций, аминогруппа в конечном итоге происходит из атмосферного азота.Последний ассимилируется в свои пригодные для использования формы (аммиак / аммоний) некоторыми бактериями, которые в совокупности называются диазотрофами . К ним относятся свободных цианобактерий , а также ризобий , которые представляют собой бактерии, существующие внутри корневых клубеньков бобовых. Фиксация азота возможна благодаря ферменту под названием нитрогеназа , которым обладают эти бактерии.
В то время как бактерии и растения могут синтезировать все 20 типов аминокислот, люди могут синтезировать только 5 из них в достаточных количествах и при любых условиях.Их называют « заменимых аминокислот » (фиг. 11а). Все ткани в нашем организме способны синтезировать аминокислоты, но основными источниками вновь синтезированных аминокислот являются печень и (в меньшей степени) кишечник . Девять аминокислот вообще не могут быть синтезированы нашим организмом, и поэтому должны быть получены с пищей. Эти аминокислоты обозначаются как « незаменимые ». Остальные 6 аминокислот, обозначенные как «условно незаменимые» , могут быть синтезированы, но при определенных условиях или ситуациях их необходимо дополнять из рациона (например,г. когда организм растет или болеет). Обратите внимание, что это различие не относится к важности двух типов аминокислот; все 20 важны для клеточной и физиологической функции.
Рисунок 11а. Незаменимые и заменимые аминокислоты.
(Взято из Принципов биохимии Ленингера, 5-е издание)
Общая мнемоника для запоминания идентичности незаменимых аминокислот: « PVT.ТИМ ХЕЛЛ »(произносится« частный ТИМ Холл »). Обратите внимание, что (1) следует рассматривать только заглавные буквы, (2) два Ts обозначают T хреонин и T риптофан, и (3) два L обозначают L ysine и L eucine.
f
Незаменимые аминокислоты могут быть получены из различных пищевых источников:
Рисунок 11b. Основные пищевые источники незаменимых аминокислот.
(адаптировано из Википедии)
f
Пищевая ценность белка отражает его незаменимый аминокислотный состав. Казеин (основной молочный белок) — единственный белок, содержащий все незаменимые аминокислоты, и поэтому имеет очень высокую пищевую ценность.
f
Белки внутри организма и те, которые происходят из нашей пищи, постоянно расщепляются, что является частью нормального гомеостаза . Белки пищевого происхождения расщепляются в нашей пищеварительной системе такими ферментами, как пепсин, трипсин, хемотрипсин и эластаза , в то время как тканевые белки разрушаются внутри наших клеток либо лизосомами , либо убиквитин-протеасомной системой (см. Этот раздел) .Однако чистая деградация белков для производства энергии происходит только во время диеты с высоким содержанием белка, продолжительного голодания , или у больных сахарным диабетом без лечения. Фактически, эффективность производства АТФ из аминокислот ниже по сравнению с углеводами или жирами на молярной основе (подробнее см. Ниже).
Аминокислоты, образующиеся в результате расщепления проглоченных белков в желудке и кишечнике, всасываются в кровь и достигают печени через воротную вену .У млекопитающих несколько заменимых аминокислот (например, Gln, Glu и Asp) составляют исключение из этого правила; они настолько сильно окисляются внутри клеток кишечника, что почти все они при обычном питании не попадают в воротную вену ( аминокислоты (2009) 37 : 1–17). Клетки кишечника также разлагают Pro с образованием орнитина, цитруллина и Arg (цитруллин преобразуется в Arg в основном почками). Наконец, клетки кишечника также расщепляют 30-50% незаменимых аминокислот в рационе ( Amino Acids (2009) 37 : 1-17).
Внутри организма аминокислоты могут подвергаться различным катаболическим (деградационным) процессам (щелкните рисунок, чтобы увеличить):
Рисунок 12.
Однако при центральном метаболизме деградация аминокислот всегда включает ферментативное удаление аминогруппы из остальной части молекулы, как аммиак . Это можно сделать с помощью трансаминирования , процесса, в котором аминогруппа переносится с аминокислоты на кетокислоту (рис.13). Этот процесс отвечает за удаление аминогруппы из большинства аминокислот. Аминогруппа обычно переносится на α-кетоглутарат с образованием Glu:
Рисунок 13. Трансаминирование.
(Взято из Принципов биохимии Ленингера, 5-е издание)
Другим способом удаления аминогруппы из аминокислот является окислительное дезаминирование . В этом процессе аминогруппа высвобождается непосредственно в цитоплазму в виде аммиака (рис.14). Этот процесс используется для дезаминирования глутамата после его образования путем трансаминирования (рис. 13 выше):
Рисунок 14. Окислительное дезаминирование глутамата
(Взято из Принципов биохимии Ленингера, 5-е издание)
д
Аммиак, выделяемый при дезаминировании глутамата, является токсичным (подробнее см. Ниже). Следовательно, он должен быть немедленно интегрирован в новую молекулу или выведен из организма через мочу .Аммиак можно интегрировать в нуклеотид, новую аминокислоту или биологический амин.
Хотя некоторая часть аммиака выводится почками «как есть», большая часть его сначала преобразуется печенью (и в меньшей степени кишечными клетками) в менее токсичное химическое вещество, мочевину , которая затем передается в почками выводится через мочу. Процесс, названный «цикл мочевины » (фиг. 15), происходит в митохондриях и цитозоле клеток печени / кишечника и требует Asp в качестве источника второй аминогруппы мочевины.Помимо мочевины, в процессе также получают фумарат , промежуточный продукт цикла лимонной кислоты («Кребса») . Это соединяет два метаболически важных цикла.
Рисунок 15. Цикл мочевины.
(Взято из Принципов биохимии Ленингера, 5-е издание)
v
В некоторых случаях в организме может накапливаться аммиак ( гипераммониемия ). Это происходит по причине:
- Повреждение печени — e.г. при циррозе печени.
- Низкое кровоснабжение почек — например, в результате обезвоживания или застойной сердечной недостаточности.
- Острая почечная недостаточность.
- Заболевание нижних мочевых путей (опухоль, камни).
Накопление аммиака опасно; он нарушает цикл Кребса путем аминирования α-кетоглутарата до глутамата, таким образом «закаливая» важный промежуточный продукт цикла. В результате производство энергии в мозгу серьезно нарушается, вызывая резкие неврологические симптомы, которые могут привести к коме (« coma hepatica ») или даже смерти.
Мочевина также может накапливаться в крови ( уремия ) в результате повреждения почек. Действительно, лабораторный тест на накопление мочевины, называемый «мочевина азота в крови » (B.U.N) , используется в качестве средства диагностики почечной недостаточности.
г
Углеродный скелет, оставшийся после удаления аммиака из аминокислоты, представляет собой кетокислоту . Эти углеродные скелеты могут быть дополнительно разрушены для производства энергии посредством гликолиза и / или цикла лимонной кислоты .Как упоминалось выше, при расщеплении белка выделяется меньше АТФ по сравнению с углеводами или жирами на молярной основе. Эффективность передачи энергии от аминокислот к АТФ колеблется от 29% для метионина до 59% для изолейцина ( Amino Acids (2009) 37 : 1–17). Тем не менее, для быстро делящихся клеток (например, энтероцитов, лимфоцитов, макрофагов и опухолей) глутамин является предпочтительным топливом.
В качестве альтернативы они могут использоваться в качестве строительного материала для различных метаболитов (см. Рисунок 16 ниже) или биогенных аминов (см. Раздел 5 выше).Все аминокислоты, за исключением лейцина и лизина, могут разлагаться с образованием промежуточных продуктов метаболизма, которые могут быть преобразованы в глюкозу посредством глюконеогенеза . Поэтому эти аминокислоты называются « глюкогенными» . Аминокислоты, при разложении которых образуются промежуточные продукты, которые могут быть преобразованы в кетоновых тел (ацетоацетат, β-гидроксибутират или ацетон), называются « кетогенными ». Лизин и лейцин являются чисто кетогенными (мнемоническое: « LL »), тогда как фенилаланин, изолейцин, треонин, тирозин и триптофан являются глюкогенными и кетогенными (мнемоническое: « PITTT », где P означает фениаланин, а не пролин).
Рис. 16. Превращение аминокислот в строительные блоки центрального метаболизма.
(Взято из Принципов биохимии Ленингера, 5-е издание)
а
Генетические дефекты ферментов, участвующих в путях разложения аминокислот, приводят к различным заболеваниям, таким как Болезнь кленового сиропа и Фенилкетонурия (PKU) . В последнем случае дефект фермента фенилаланингидроксилазы предотвращает превращение фенилаланина в тирозин.Накопление первых препятствует переносу других аминокислот в мозг, что ухудшает синтез белков и миелина . Это приводит к тяжелой задержке умственного развития и развития у младенцев, а также к более короткой продолжительности жизни . Таким образом, чтобы избежать этих тяжелых исходов, люди с фенилкетонурией должны соблюдать диету с низким содержанием белка и избегать употребления газированных напитков, которые содержат аспартам (имеет в своей структуре фенилаланин).
ff
7.АМИНОКИСЛОТ В КАЧЕСТВЕ ДОБАВОК
Участие аминокислот и их производных в различных клеточных и физиологических процессах предполагает, что их можно использовать для ускорения желаемых процессов или подавления нежелательных. Аминокислоты могут поставляться в виде пищевых добавок в кристаллической форме (Wu 2009). Это предотвращает их разложение во время пищеварения и позволяет им напрямую всасываться в тонком кишечнике. В следующей таблице от Wu (2009) приведены некоторые примеры клеточных и физиологических процессов, на которые может повлиять добавление аминокислот (щелкните рисунок, чтобы увеличить).
Поскольку введение больших количеств определенных аминокислот может серьезно нарушить нормальный метаболизм , этот вопрос далеко не прост, и он широко обсуждается в литературе (например, Wu (2009)). Например, доступ к аминокислотам может привести к уменьшению потребления пищи, ненормальному поведению, нарушению роста и другим побочным эффектам. Это может быть результатом не только дисбаланса аминокислот, но и антагонизма, то есть неблагоприятно-противоположных действий различных аминокислот.
Нравится:
Нравится Загрузка …
Аминокислота — RationalWiki
Крошечное представление аспарагиновой кислоты, аминокислоты. — Outline Only —Эта статья представляет собой лишь краткое описание предмета и не предназначена для полного объяснения.
Более подробную информацию можно найти в разделах «См. Также» или «Ссылки» или в статье Википедии.
Аминокислоты — это вещества, образованные из молекул, состоящих из атомов определенных функциональных групп.Они являются строительными блоками белковых молекул. Аминокислоты можно найти во всех известных организмах, а уникальные разновидности можно создать искусственно.
Химия [править]
Название «аминокислота» происходит от наличия двух функциональных групп: аминогруппы (-NH 2 ) и карбоновой кислоты (-COOH). Любая молекула, содержащая обе эти группы, технически является аминокислотой, но этот термин обычно используется для выбора органических молекул, имеющих биологическое значение, таких как глицин (H 2 N-CH 2 -COOH).Эти молекулы различаются своими боковыми цепями , которые придают каждой из них разные химические свойства, такие как, например, полярность (свойство, которое определяет, является ли молекула привлекательной для воды или нет; это свойство важно для сворачивания белка, как описано ниже. ).
Аминная группа аминокислоты может химически присоединяться к кислотной группе другой аминокислоты с образованием амидной связи . Это позволяет образовывать длинные цепочки аминокислот. Эти короткие полимеры на основе аминокислот (химические цепи) известны как пептидов и могут варьироваться по длине от двух до нескольких сотен или тысяч (как белки).
Стереохимия [править]
Важным свойством встречающихся в природе аминокислот является их стереохимия (химия, касающаяся пространства и его занятия). Центральный атом углерода в природных аминокислотах является хиральным, к нему присоединены четыре различных групп. [1] Эти четыре разные группы могут быть расположены по-разному в пространстве для создания зеркальных отображений друг друга, описываемых простыми словами как левосторонние или правосторонние в отношении того, как руки по существу идентичны, но зеркальные изображения, которые нельзя накладывать друг на друга.
Последствия стереохимии [править]
Почти все аминокислоты имеют одинаковую абсолютную стереохимическую конфигурацию, конфигурацию (S) . [2] Это противоречит интуиции, которая предполагала бы смесь каждой из них в соотношении 50:50, поскольку обе формы имеют равную энергию и одинаковые химические свойства, невозможно различить их без другого хирального источника.
Хотя стереохимия может быть сохранена из химических предшественников, это не полностью объясняет, откуда она взялась изначально, что приводит некоторых людей к выводу, что должна быть какая-то форма дизайна или творчества.Натуралистическое объяснение того, почему одна форма предпочтительнее другой, сформировано не полностью, хотя креационисты пренебрегают присутствием диастереоизомеров (которые возникают, когда два стереоизомера взаимодействуют и не являются химически или энергетически эквивалентными) или присутствием других хиральных агентов, таких как поляризованный свет. .
Биология [править]
В генетическом коде, состоящем из ДНК, группа из трех нуклеотидов (кодон) кодирует определенную аминокислоту. По мере того как рибосома движется по цепи ДНК, набор кодонов будет считываться с образованием полипептида.Достаточно длинные цепи с помощью других ферментов затем сворачиваются, чтобы стать активными белками или другими ферментами.
Список аминокислот [править]
Из 20 существующих аминокислот (плюс одна особая редкая аминокислота, обычно не учитываемая) человеческий организм может естественным образом синтезировать 12 из них. Это означает, что остальные 9 должны быть получены из внешних источников, то есть потребляя белок, а затем расщепляя его на компоненты (а именно, аминокислоты). Практически любой источник белка будет содержать хотя бы некоторое количество незаменимых аминокислот; но если вы полностью питаетесь жирами и углеводами (сахарами) с потреблением белка без потребления белка , вы в конечном итоге получите состояние дефицита белка, такое как Квашиоркор (белковая недостаточность).
20 аминокислот, используемых при трансляции (синтезе белков):
Графическое представление того, как читать генетический код через кодоны (тройки нуклеотидов): вы начинаете с середины ( 5 ‘) — более крупные буквы — и отдаляетесь от нее ( 3′ ). Обратите внимание, что несколько кодонов кодируют одну и ту же аминокислоту, но не перекрывает , какую аминокислоту он кодирует; это важно, поскольку это предотвращает двусмысленность генетического кода i.е. кодон, кодирующий несколько аминокислот. Это было бы катастрофой!▶ Стартовый кодон: аминокислота метионин (Met / M) запускает каждую последовательность белка (через кодон AUG).
● Стоп-кодон: Он не кодируется аминокислотой, но сигнализирует биологической машине о прекращении синтеза белка.
Две особые аминокислоты:
| Аминокислота | Кодоны (нуклеотидные триплеты) | Essential? | Хиральный? |
|---|---|---|---|
| Селеноцистеин | UGA | № [примечание 5] | Да |
| Пирролизин | UAG [примечание 6] | НЕТ | Да |
Внешние ссылки [править]
- ↑ «Существенные» в данном контексте означает, что аминокислоты должны потребляться как часть человеческого рациона, они не могут быть получены (у людей) путем преобразования одной аминокислоты в другую.
- ↑ Техническое слово, означающее «выглядит как пара перчаток» (хиральные молекулы похожи на перчатки в том смысле, что они сделаны из одних и тех же частей, но являются зеркальным отображением друг друга)
- ↑ Если вы взрослый, это не обязательно.
- ↑ Цистеин может иметь важное значение в редких случаях, но обычно это не так.
- ↑ Селеноцистеин вырабатывается людьми. Обычно UGA означает «стоп», но через сложный процесс он будет кодировать селеноцистеин.
- ↑ Нет, это не ошибка.Пирролизин используется в бактериях, , а не в организме человека , где он кодируется для использования UAG.
Ссылки [править]
- ↑ За исключением глицина, который является ахиральным из-за наличия двух идентичных групп, присоединенных к центральному атому углерода.
- ↑ За исключением глицина, потому что он является ахиральным, и цистеина, потому что его группы имеют другой приоритет в системе, используемой для их идентификации.


 е. в зависимости от условий они могут проявлять как основные, так и кислотные свойства.
е. в зависимости от условий они могут проявлять как основные, так и кислотные свойства.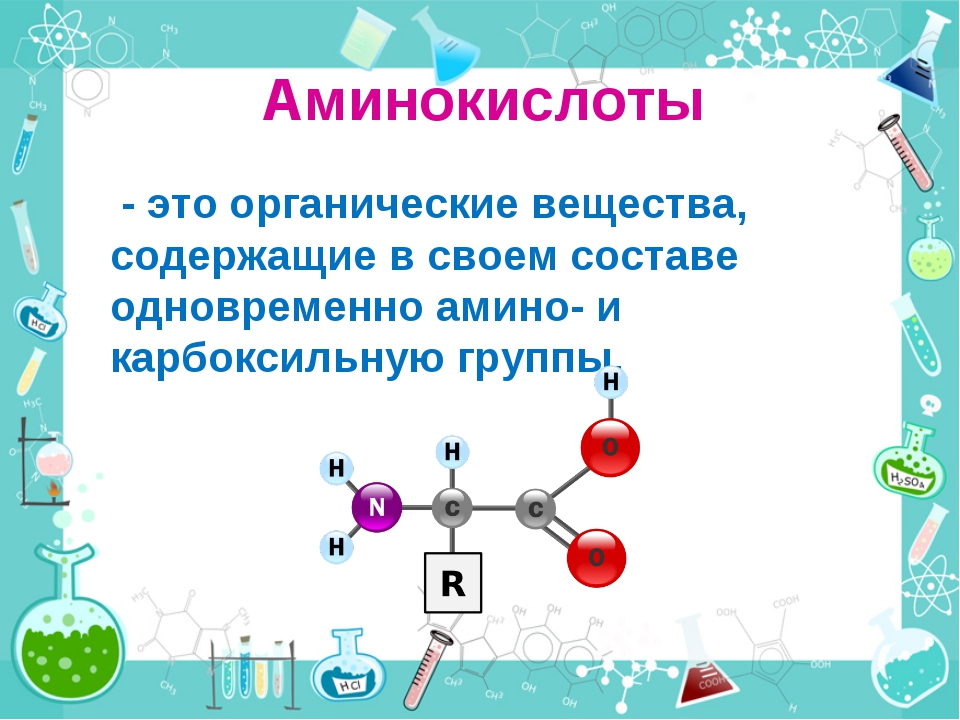

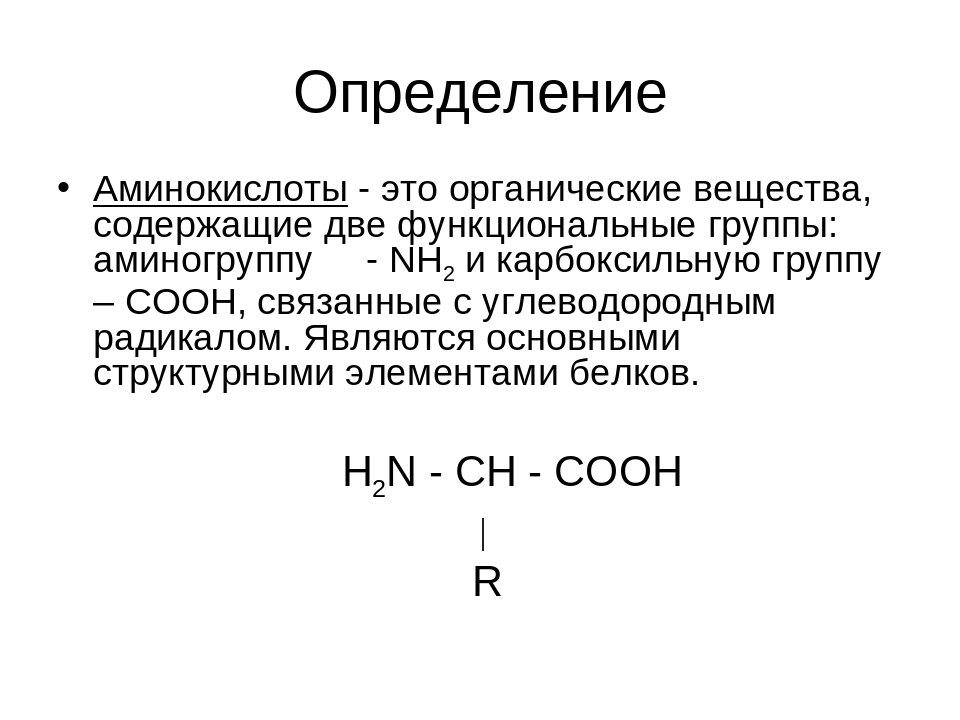
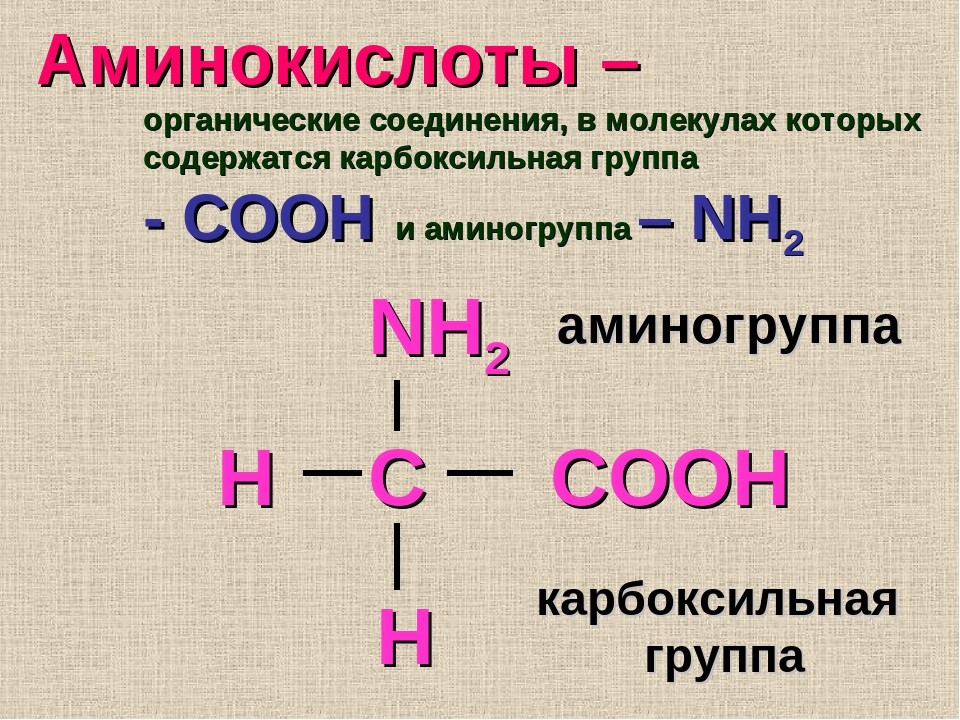 Нуклеотиды и нуклеозиды.
Нуклеотиды и нуклеозиды.
