Аминокислоты для мозга — Золотой Кубок
Белок является важнейшей частью тканей организма. Белки состоят из аминокислот, которые крайне важны для нормального функционирования внутренних органов, в том числе головного мозга. Аминокислоты поддерживают работу ЦНС, контролируют настроение, эмоции. Достаточное количество этих элементов улучшает память, повышает умственные способности, восприимчивость к информации.
Краткое содержание:Чтобы все органы и системы работали исправно, требуется достаточно много различных аминокислот, но для мозга необходимы лишь некоторые из них, а именно глутаминовая кислота, тирозин, триптофан и глицин, о котором слышали многие. Их называют нейромедиаторами, поскольку они являются передатчиками нервных импульсов в мозге, отвечают за работу ЦНС и память.
Есть и другие элементы, отвечающие за
состояние психики и эмоции. От них зависит настроение человека в конкретный
момент, а также внимание. Часть из них участвуют в производстве
нейромедиаторов.
Также существуют аминокислоты, которые позволяют человеку переносить эмоциональные нагрузки, стрессы, то есть отвечают за способность нервной системы противостоять негативным факторам.
Незаменимые аминокислоты для мозга
Аминокислоты делят на заменимые и незаменимые. Вторые не производятся в организме. Для того, чтобы поддерживать их достаточное количество, нужно правильно питаться, принимать специальные добавки при необходимости. Эти аминокислоты стоит рассмотреть отдельно.
Изолейцин
Эта аминокислота имеет разветвленное строение молекулы. Изолейцин играет важную роль для поддержания психической и физической выносливости организма. Также среди функций этого элемента поддержание в норме уровня гемоглобина в крови и регуляция уровня глюкозы.
Изолейцин крайне важен как при высоких
физических нагрузках, так и при стрессах, психических заболеваниях. Его
применяют при лечении болезни Паркинсона. Дефицит изолейцина проявляется в виде
тревожности, обмороков и головокружения, беспричинного беспокойства, усталости,
тахикардии, повышенной потливости.
Организм нуждается в изолейцине (3-4 г в сутки). Содержится эта аминокислота в миндале и кешью, курице, яйцах, бобовых, сое, рыбе, печени. Большое количество изолейцина содержится в молочных продуктах, морепродуктах, мясе.
Лейцин
Данная аминокислота не оказывает прямого воздействия на работу мозга, но играет важную роль для поддержания психического равновесия, а также отвечает за восстановление мышечной и костной ткани. Часто эту аминокислоту рекомендуют принимать после травм. Лейцин содержится в рисе, бобовых, сое, пшенице, мясных продуктах.
Лизин
Эта аминокислота входит в состав
практически всех белков в человеческом организме. Для восстановления тканей она
необходима. Человек, который страдает от дефицита лизина, испытывает раздражительность,
плаксивость, слабость, плохо ест, у него выпадают волосы, нарушается внимание,
замечается снижение веса, появляются проблемы с репродуктивной функцией. Также
лизин играет важную роль в создании гормонов, ферментов в организме,
поддерживает иммунитет.
Также
лизин играет важную роль в создании гормонов, ферментов в организме,
поддерживает иммунитет.
Особенно важен лизин для детей, у которых растут кости. Аминокислота улучшает усвоение кальция в организме. Богаты лизином яйца, молочные продукты, картофель, дрожжи, соя, говядина.
Метионин
Эта аминокислота крайне важна для здоровых суставов и выведения вредных веществ из организма. Метионин рекомендуют принимать при интоксикации (алкогольной или химической). Также аминокислоту назначают женщинам при сильном токсикозе.
Для здоровья организма необходимо получать по 2-4 г метионина в сутки. Дефицит этого элемента приведет к отекам, слабости мышечных тканей, проблемам с органами ЖКТ, печенью, задержке развития плода во время беременности.
Содержат метионин бобы, куриные яйца, мясные продукты, кисломолочные продукты, лук и чеснок.
Фенилаланин
Особенность этой аминокислоты в том,
что в организме она способна преобразовываться и принимать участие в синтезе
нейромедиатора. Поэтому можно сказать, что фенилаланин оказывает воздействие на
настроение человека, его восприимчивость к боли, способность обучаться и
запоминать. Недостаток этой аминокислоты может привести к сильнейшим депрессии,
гормональным сбоям, снижению умственных способностей. Синтетический фенилаланин
назначают людям с артритом, депрессией, болезненными месячными, мигренями и
ожирением, так как этот элемент способен снижать аппетит.
Поэтому можно сказать, что фенилаланин оказывает воздействие на
настроение человека, его восприимчивость к боли, способность обучаться и
запоминать. Недостаток этой аминокислоты может привести к сильнейшим депрессии,
гормональным сбоям, снижению умственных способностей. Синтетический фенилаланин
назначают людям с артритом, депрессией, болезненными месячными, мигренями и
ожирением, так как этот элемент способен снижать аппетит.
Можно найти фенилаланин в следующих продуктах: говядина, курица, морепродукты, молочные продукты.
Треонин
Эта аминокислота играет очень важную роль в белковом и жировом обмене, стимулирует работу иммунной системы. Для взрослого достаточной дозой треонина является 0,5 г в сутки. Если аминокислоты недостаточно, это приводит к слабости мышц и уменьшению мышечной массы, депрессивным состояниям, снижению внимания.
Достаточно большое количество треонина
содержится в куриных яйцах, молочных продуктах, говядине. В зерновых его мало,
поэтому люди, отказывающиеся от употребления мяса, страдают от дефицита
треонина гораздо чаще.
Триптофан
В организме эта аминокислота превращается в важный нейромедиатор, отвечающий за состояние эмоционального благополучия. При недостатке триптофана развивается депрессивное состояние, подавленность, беспричинная тревожность, мигрень. Если у человека есть бронхиальная астма, дефицит этой аминокислоты усилит приступы.
Триптофан часто используют и как снотворное. Его желательно принимать с пищей. Аминокислоты достаточно много в молочных продуктах, растительных маслах, бананах. Поэтому сложилось мнение, что стакан молока на ночь помогает заснуть. Также эта аминокислота содержится в овсянке, арахисе, морепродуктах, курице, индейке.
Прием триптофана в синтетическом виде давно запрещен, так как он был признан опасным для сердца.
Валин
Данная аминокислота играет важную роль
в стимуляции умственной деятельности и поддержании координации. Валин способствует
скорому заживлению поврежденных тканей. Дефицит валина становит заметен по
причине повышения чувствительности кожи и нарушения координации движения.
Чтобы восполнить недостаток валина в организме, нужно есть больше сыра и творога, орехов, мяса и яиц.
Заменимые аминокислоты для мозга
Эта разновидность аминокислот синтезируется организмом самостоятельно, а также поступает с пищей.
Аланин
Мозгу для работы требуется много энергии, а данная аминокислота является ее источником. Также аланин поддерживает работу иммунитета и регулирует уровень глюкозы. Эта аминокислота очень часто используется в психиатрии, так как способствует снижению раздражительности и апатии, а также избавляет от мигреней. Способность аланина регулировать уровень глюкозы позволяет долго не ощущать голод.
Пища, богатая аланином, поможет восполнить дефицит: мясо, яйца, желатин, молочные продукты.
Аспарагин
Аминокислота выводит аммиак из
организма и защищает ЦНС от его токсического воздействия. Аспарагин регулирует
все процессы ЦНС, предотвращая ее излишнее возбуждение или торможение. Также
есть мнение, что этот элемент играет важную роль в сопротивлении организма усталости,
то есть повышает выносливость. Наибольшее количество аспарагина содержится в
мясе.
Аспарагин регулирует
все процессы ЦНС, предотвращая ее излишнее возбуждение или торможение. Также
есть мнение, что этот элемент играет важную роль в сопротивлении организма усталости,
то есть повышает выносливость. Наибольшее количество аспарагина содержится в
мясе.
Дефицит аминокислоты приводит к мышечным болям, заметному снижению работоспособности, ухудшению памяти. Однако избыток тоже опасен. Он может спровоцировать агрессию, проблемы со сном, головным болям.
Аргинин
Этот элемент участвует в синтезе инсулина и гормона роста, а также стимулирует защитные функции организма. Он очень важен для роста мышц, а также поддержания здоровья психики. Из-за активного воздействия на выработку гормона роста детям принимать аргинин не рекомендуется, чтобы не спровоцировать гигантизм. Также избыток аргинина вызывает проблемы с кожей и аллергические реакции, провоцирует тошноту и диарею.
Чтобы восполнить дефицит аргинина,
необходимо есть горький шоколад, молочные продукты, пшеницу, орехи, желатин,
овсянку.
Глицин
Глицин является ноотропом и известен многим как средство от депрессии. Он способен нормализовать психоэмоциональное состояние, улучшить память и способность к обучению. Дефицит глицина приводит в первую очередь к недостатку энергии и хронической усталости. Люди с недостатком этой аминокислоты часто испытывают проблемы с работой кишечника, плохо спят.
Глицин применяют в синтетическом виде. В природе он содержится в говядине, печени, овсянке. Столкнуться с переизбытком глицина очень трудно, так как в организме он не скапливается, а свободно выводится.
Цистеин
Данная аминокислота защищает клетки мозга от токсического воздействия этилового спита и никотина, а также других вредных химических веществ. Также цистеин замедляет процессы старения в организме, облегчает клиническое проявление заболеваний. Недостаток может спровоцировать снижение иммунитета, кожные заболевания, выпадение волос, ломкость ногтей.
Цистеин присутствует в куриных яйцах,
чесноке, луке, орехах и овсянке.
ГАМК
Содержание этой аминокислоты в тканях головного мозга очень велико. Она оказывает противосудорожное и успокаивающее действие. Часто назначается при патологиях головного мозга, снижении умственной активности, хронической и тяжелой депрессии. К недостатку АМК приводит избыток физической нагрузки в сочетании с неправильным питанием и низким количеством питательных веществ в еде. Для восполнения дефицита этой аминокислоты рекомендуют пить чай.
Гистидин
Данная аминокислота полезна для восстановления тканей, роста организма. Она помогает бороться со стрессами, нормализует работу ЖКТ, защищает от инфекций, выводит тяжелые металлы из организма.
Избыток гистидина ведет к возникновению
психозов и прочих психических недугов. Также эта аминокислота влияет на половое
возбуждение. При дефиците гистидина половое влечение снижается, помимо этого
могут возникнуть проблемы со слухом и усилиться тромбообразование. Гистидин
содержится в рыбе, красном мясе, злаковых.
Глутаминовая кислота
Это важный нейромедиатор, оказывающий ноотропный эффект и необходимый для нормальной работы головного мозга. Глютаминовая кислота служит источником энергии для клеток мозга. В синтетическом виде ее назначают при эпилептических припадках, проблемах с умственным развитием у детей. Дефицит глутаминовой кислоты может привести к ранней седине, плохому настроению, снижению иммунитета. Глютаминовая кислота содержится в мясных продуктах, знаковых, натуральном молоке.
Глютамин
Данная аминокислота выводит из организма аммиак и снижает его токсическое воздействие на организм. Он улучшает работу мозга, поэтому рекомендуется людям с эпилепсией, импотенцией, страдающим шизофренией.
Глютамин выпускают в синтетическом виде, однако такие препараты должны храниться как можно дальше от влаги, иначе будет выделяться аммиак. При серьезных заболеваниях печени такие препараты не назначаются.
Аминокислота содержится во многих
пищевых продуктах, однако при термической обработке разрушается. Чтобы
восполнить дефицит глютамина, рекомендуют есть сырую петрушку и шпинат.
Чтобы
восполнить дефицит глютамина, рекомендуют есть сырую петрушку и шпинат.
Таурин
Защищает мозг от вредного воздействия. При гиперактивности у детей довольно часто назначают синтетический таурин. Также он является частью лечения эпилепсии и беспричинного беспокойства. Организм способен сам производить эту аминокислоту, если в организме нет дефицита витамина В6. Также много таурина в мясных и молочных продуктах, морепродуктах.
Незаменимые аминокислоты для нормальной работы мозга и нервной системы
- Главная
- Статьи
Аминокислоты
– это строительные блоки, из которых строятся белки, являющиеся структурой тканей человеческого организма в целом, и мозга в частности.
Также аминокислоты используются организмом для развития и функционирования органов. Если говорить про мозг, то часть аминокислот является строительным компонентом мозга и центральной нервной системы, другая выступает в роли нейромедиаторов и напрямую воздействует на функции мозга – улучшает краткосрочную и долгосрочную память, повышает интеллект и способность к обучению.
Так работают нейромедиаторы (нейротрансмитеры) в мозге.
Для функционирования организма необходимы все аминокислоты, но для работы мозга и центральной нервной системы особо важны следующие аминокислоты: триптофан, глицин, глутаминовая кислота и тирозин. Эти аминокислоты выделены в таблице. Большая часть из них являются нейромедиаторами – активными биологическими веществами, отвечающими за передачу нервных импульсов, а значит эти аминокислоты отвечают за память, интеллект и возбудимость нервной системы.
Вторая группа аминокислот, выделенная зеленым цветом, также активно участвует в психических и интеллектуальных процессах. Эти аминокислоты отвечают за устойчивость психики, настроение, психическую активность, внимание. Многие из этих аминокислот используются при синтезе нейромедиаторов.
Эти аминокислоты отвечают за устойчивость психики, настроение, психическую активность, внимание. Многие из этих аминокислот используются при синтезе нейромедиаторов.
Третья группа: аминокислоты, отвечающие за психическую энергию, они выделены желтым цветом. Эта группа отвечает за выносливость нервной системы и помогает мозгу при длительных нагрузках.
| Аминокислота | Воздействие на психические процессы | |
| Изолейцин | Увеличение психической выносливости. | Незаменимая аминокислота |
| Лейцин | Источник психической энергии. | Незаменимая аминокислота |
| Лизин | Структурный элемент. Недостаток ведет к раздражительности и усталости. | Незаменимая аминокислота |
| Метионин | Важный компонент метаболизма. Недостаток провоцирует гнев и раздражительность. Недостаток провоцирует гнев и раздражительность. |
Незаменимая аминокислота |
| Фенилаланин | Улучшает память и способность к обучению. | Незаменимая аминокислота |
| Треонин | Структурный элемент центральной нервной системы. | Незаменимая аминокислота |
| Триптофан | Нейромедиатор. Умственное расслабление и эмоциональное благополучие. Важнейший элемент при лечении депрессии. Натуральное снотворное. | Незаменимая аминокислота |
| Валин | Стимулирует умственную деятельность. | Незаменимая аминокислота |
| Аланин | Источник энергии для центральной нервной системы и головного мозга. | Заменимая аминокислота |
| Аргинин | Психическая энергия. Положительный психотропный эффект. Положительный психотропный эффект. |
Заменимая аминокислота |
| Аспарагин | Стабилизатор нервных процессов. Увеличение выносливости. | Заменимая аминокислота |
| Цистеин | Антиоксидант. | Заменимая аминокислота |
| ГАМК | Главный тормозящий нейротрансмиттер ЦНС. Нормализатор метабализма, источник энергии. | Заменимая аминокислота |
| Глицин | Стабилизатор психических процессов. Повышение умственной работоспособности. Используется для лечения депрессии. | Заменимая аминокислота |
| Гистидин | Строительный компонент для клеток нервной системы. | Заменимая аминокислота |
| Глутаминовая кислота | Нейромедиатор. Ноотроп. Ноотроп. |
Заменимая аминокислота |
| Глутамин | Предшественник мозговых нейротрансмиттеров. | Заменимая аминокислота |
| Орнитин | Необходимый компонент для метаболических процессов мозга. | Заменимая аминокислота |
| Пролин | Вспомогательные ГАМК функции торможения ЦНС. | Заменимая аминокислота |
| Таурин | Антиоксидант. | Заменимая аминокислота |
| Тирозин | Нейромедиатор. Улучшение памяти, интеллелекта. Лечение стресса и депрессии. | Заменимая аминокислота |
Незаменимые аминокислоты, необходимые мозгу.
Незаменимые аминокислоты не синтезируются в организме человека, а поступают в организм только из продуктов питания.
Изолейцин – незаменимая аминокислота, которая определяет физическую и психическую выносливость, т.к. регулирует процессы энергообеспечения организма. Является необходимой для синтеза гемоглобина, регулирует уровень сахара в крови. В силу вышеупомянутых свойств очень важна при физических нагрузках, а также при проблемах с психикой, в т.ч. при психических заболеваниях. Недостаток изолейцина вызывает возбуждение, беспокойство, тревогу, страх, утомление, головокружение, обморочные состояния, учащенное сердцебиение, потливость.
Источники изолейцина: миндаль, кешью, куриное мясо, турецкий горох, яйца, рыба, чечевица, печень, мясо, рожь, большинство семян, соевые белки.
Лейцин – очень важная незаменимая аминокислота, которая напрямую не влияет на работу мозга, но является источником психической энергии. Стимулирует гормон роста и таким образом способствует восстановлению костей, кожи, мышц. Несколько понижает уровень сахара в крови, рекомендуется в восстановительный период после травм и операций.
Источники лейцина: бурый рис, бобы, мясо, орехи, соевая и пшеничная мука.
Лизин – незаменимая аминокислота, которая участвует в синтезе, формировании коллагена и восстановлении тканей. Недостаток лизина может приводить к раздражительности, усталости и слабости, плохому аппетиту, замедлению роста и снижению массы тела. Лизин участвует в синтезе антител, гормонов, ферментов и таким образом способствует противовирусной защите организма. Он необходим для нормального формирования костей и роста детей, способствует усвоению кальция и поддержанию нормального обмена азота у взрослых.
Пищевыми источниками лизина являются: сыр, яйца, рыба, молоко, картофель, красное мясо, соевые и дрожжевые продукты.
Метионин – незаменимая аминокислота, которая защищает суставы и обеспечивает детоксикацию организма. Метионин в организме переходит в цистеин, который является предшественником гпютатиона. Это очень важно при отравлениях, когда требуется большое количество гпютатиона для обезвреживания токсинов и защиты печени. Препятствует отложению жиров. От количества метионина в организме зависит синтез таурина, который, в свою очередь, снижает реакции гнева и раздражительности, снижает гиперактивность у детей. Метионин применяют в комплексной терапии ревматоидного артрита и токсикоза беременности. Метионин оказывает выраженное антиоксидантное действие (связывает свободные радикалы). Он также необходим для синтеза нуклеиновых кислот, коллагена и многих других белков.
Препятствует отложению жиров. От количества метионина в организме зависит синтез таурина, который, в свою очередь, снижает реакции гнева и раздражительности, снижает гиперактивность у детей. Метионин применяют в комплексной терапии ревматоидного артрита и токсикоза беременности. Метионин оказывает выраженное антиоксидантное действие (связывает свободные радикалы). Он также необходим для синтеза нуклеиновых кислот, коллагена и многих других белков.
Пищевые источники метионина: бобовые, яйца, чеснок, чечевица, мясо, лук, соевые бобы, семена и йогурт.
Фенилаланин – это незаменимая аминокислота. В организме она может превращаться в другую аминокислоту — тирозин, которая, в свою очередь, используется в синтезе основного нейромедиатора: дофамина. Поэтому эта аминокислота влияет на настроение, уменьшает боль, улучшает память и способность к обучению, подавляет аппетит. Фенилаланин используют в лечении артрита, депрессии, болей при менструации, мигрени, ожирения.
Фенилаланин содержится: в говядине, курином мясе, рыбе, соевых бобах, яйцах, твороге, молоке, а также является составной частью синтетического сахарозаменителя – аспартама (в настоящее время ведутся активные дискуссии относительно опасности данного сахарозаменителя).
Треонин – это незаменимая аминокислота, способствующая поддержанию нормального белкового обмена в организме. Она важна для синтеза коллагена и эластина, помогает работе печени и участвует в обмене жиров в комбинации с аспарагиновой кислотой и метионином. Треонин находится в сердце, центральной нервной системе, скелетной мускулатуре и препятствует отложению жиров в печени. Эта аминокислота стимулирует иммунитет, так как способствует продукции антител. Треонин в незначительных количествах содержится в зернах, поэтому у вегетарианцев чаще возникает дефицит этой аминокислоты.
Пищевые источники треонина: яйца, молоко, горох, говядина, пшеница.
Триптофан – незаменимая аминокислота, которая в организме человека непосредственно преобразуется в серотонин — нейромедиатор, который вызывает умственное расслабление и создает ощущение эмоционального благополучия. У людей, находящихся в состоянии депрессии, в крови мало как серотонина, так и триптофана. Их низкое содержание в организме вызывает депрессию, тревожность, бессонницу, расстройства внимания, гиперактивность, мигрень, головные боли, напряжение. Высокое содержание триптофана может вызвать утомление и затруднение дыхания у людей, страдающих астмой. Триптофан — великолепное натуральное снотворное. Его много в углеводах, особенно в бананах, а также в растительном масле и молоке. Молоко на ночь улучшает сон за счет триптофана. В 1988 году продажа триптофана в виде препарата была запрещена, т.к. были зафиксированы случаи сердечной недостаточности.
У людей, находящихся в состоянии депрессии, в крови мало как серотонина, так и триптофана. Их низкое содержание в организме вызывает депрессию, тревожность, бессонницу, расстройства внимания, гиперактивность, мигрень, головные боли, напряжение. Высокое содержание триптофана может вызвать утомление и затруднение дыхания у людей, страдающих астмой. Триптофан — великолепное натуральное снотворное. Его много в углеводах, особенно в бананах, а также в растительном масле и молоке. Молоко на ночь улучшает сон за счет триптофана. В 1988 году продажа триптофана в виде препарата была запрещена, т.к. были зафиксированы случаи сердечной недостаточности.
Триптофан содержится: в овсе, бананах, сушёных финиках, арахисе, кунжуте, кедровых орехах, молоке, йогурте, твороге, рыбе, курице, индейке, мясе.
Валин – незаменимая аминокислота, является одним из главных компонентов роста и синтеза тканей тела, стимулирует умственную деятельность, активность и координацию. Валин необходим для метаболизма в мышцах, восстановления поврежденных тканей, может быть использован мышцами в качестве источника энергии. При недостатке валина нарушается координация движений тела и повышается чувствительность кожи к многочисленным раздражителям.
Валин необходим для метаболизма в мышцах, восстановления поврежденных тканей, может быть использован мышцами в качестве источника энергии. При недостатке валина нарушается координация движений тела и повышается чувствительность кожи к многочисленным раздражителям.
Много валина содержится: в сое и других бобовых, твердых сырах, икре, твороге, орехах и семечках, в мясе и птице, яйцах. Значительно меньше — в крупах и макаронах.
Заменимые аминокислоты, необходимые мозгу.
Заменимые аминокислоты синтезируются в организме человека, поступают из продуктов питания.
Аланин является важным источником энергии для головного мозга и центральной нервной системы. Необходим для поддержания тонуса мышц и адекватной половой функции. Регулятор уровня сахара в крови, участвует в синтезе антител (стимулирует иммунитет). Синтезируется из разветвленных аминокислот (лейцин, изолейцин, валин). Широко распространён в живой природе. Организм стремится поддерживать постоянный уровень глюкозы в крови, поэтому падение уровня сахара и недостаток углеводов в пище приводит к тому, что белок мышц разрушается, и печень превращает полученный аланин в глюкозу.
Природные источники аланина: кукуруза, говядина, яйца, желатин, свинина, молоко, соя, овес.
Аргинин относится к условно незаменимым аминокислотам, оказывает стимулирующее действие на выработку инсулина поджелудочной железой в качестве компонента вазопрессина (гормона гипофиза) и помогает синтезу гормона роста, который, в свою очередь, улучшает сопротивляемость заболеваниям. Он способствует восстановлению тканей, усиливает синтез белка для роста мышц, уменьшает уровень мочевины в крови и моче, участвует в процессах сжигания жира, превращения его в энергию. L- аргинин способен увеличивать мышечную и уменьшать жировую массу тела, делает человека более активным, инициативным и выносливым, привнося определенного качества психическую энергию в поведение человека, обладает положительным психотропным эффектом. Недостаток аргинина в питании приводит к замедлению роста детей. Аргинин интенсифицирует рост подростков, не показан детям, т.к. может вызвать гигантизм. Аргинин не рекомендуется беременным и кормящим женщинам. Не показан при шизофрении. При недостатке Аргинина и недостаточной активности NO-синтез диастолическое давление возрастает.
Аргинин не рекомендуется беременным и кормящим женщинам. Не показан при шизофрении. При недостатке Аргинина и недостаточной активности NO-синтез диастолическое давление возрастает.
Источниками аргинина являются: шоколад, кокосовые орехи, молочные продукты, желатин, мясо, овес, арахис, соевые бобы, грецкие орехи, белая мука, пшеница и пшеничные зародыши.
Лучшие натуральные источники: орехи, кукуруза, желатин, шоколад, изюм, овсяная крупа, кунжут.
Аспарагин помогает защитить центральную нервную систему, т.к. помогает выделять вредный аммиак (действует как высокотоксичное вещество) из организма. Необходим для поддержания баланса в процессах, происходящих в центральной нервной системе; препятствует как чрезмерному возбуждению, так и излишнему торможению. Он участвует в процессах синтеза аминокислот в печени. Последние исследования указывают на то, что он может быть важным фактором в повышении сопротивляемости к усталости. Когда соли аспарагиновой кислоты давали атлетам, их стойкость и выносливость значительно повышались.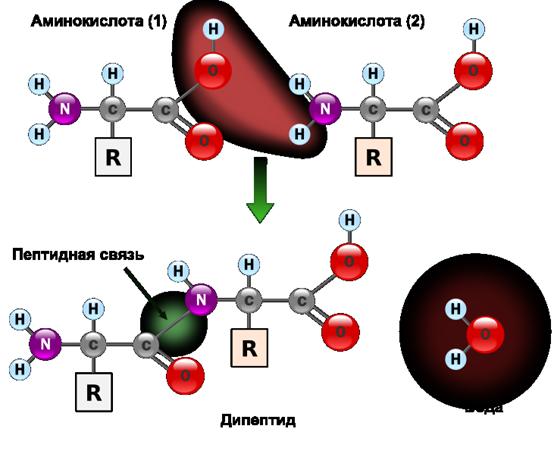
Больше всего аспарагина в мясных продуктах.
Цистеин (Цистин) является предшественником глютатиона — вещества, оказывающего защитное действие на клетки печени и головного мозга от повреждения алкоголем, некоторых лекарственных препаратов и токсических веществ, содержащихся в сигаретном дыме, помогает обезвреживать некоторые токсические вещества и защищает организм от повреждающего действия радиации. Он представляет собой один из самых мощных антиоксидантов. Он необходим для роста волос и ногтей. Прием цистина/цистеина с витаминами С и B1 не рекомендуются людям с сахарным диабетом, т.к. сочетание этих питательных веществ может понизить эффективность инсулина.
Источниками цистеина и цистина являются: яйца, овес, кукуруза.
Гамма-аминомасляная кислота (ГАМК) – выполняет роль главного тормозящего нейротрансмиттера ЦНС, концентрация которой особенно высока в тканях головного мозга. Гамма-аминомасляная кислота улучшает метаболизм мозга, оказывает ноотропное, седативное и противосудорожное действие. Она особенно важна при сосудистых заболеваниях головного мозга, снижении интеллектуальных функций, энцефалопатии, депрессии. В экстремальных ситуациях ГАМК расщепляется с выделением большого количества энергии, тем самым обеспечивая максимальную скорость работы мозга. Гамма-аминомасляная кислота синтезируется в нервной системе из глутаминовой.
Она особенно важна при сосудистых заболеваниях головного мозга, снижении интеллектуальных функций, энцефалопатии, депрессии. В экстремальных ситуациях ГАМК расщепляется с выделением большого количества энергии, тем самым обеспечивая максимальную скорость работы мозга. Гамма-аминомасляная кислота синтезируется в нервной системе из глутаминовой.
Глицин является регулятором обмена веществ, нормализует и активирует процессы защитного торможения в центральной нервной системе, уменьшает психоэмоциональное напряжение, повышает умственную работоспособность. Он необходим для центральной нервной системы и хорошего состояния предстательной железы. Его применяют в лечении депрессивных состояний. Он способствует мобилизации гликогена из печени и является исходным сырьем в синтезе креатина, важнейшего энергоносителя. Недостаток этой аминокислоты ведет к снижению уровня энергии в организме.
Глицин обладает ноотропными свойствами, улучшает память и способность к обучению.
Источниками глицина являются: желатин, говядина, печень, арахис, овес.
Гистидин незаменимая аминокислота, способствующая росту и восстановлению тканей. Гистидин входит в состав миелиновых оболочек, защищающих нервные клетки, а также необходим для образования красных и белых клеток крови. Карнозин — это дипептид (бета-аланил-L-гистидин), содержащийся в мышцах, мозге и других тканях. Гомокарнозин — это дипептид, родственный гамма-аминобутановой кислоте и гистидину, который находится только в мозге, обычно в подклассе гамма-аминобутановых нейронов. Ученые также предполагают, что карнозин и гомокарнозин могут обладать нейропротективными эффектами при ишемии и влиять на нервную функцию. Слишком высокое содержание гистидина может привести к возникновению стресса и даже психических нарушений (возбуждения и психозов). Гистидин легче других аминокислот выделяется с мочой. Поскольку он связывает цинк, большие дозы его могут привести к дефициту этого металла. Метионин способствует понижению уровня гистидина в организме. Гистамин, очень важный компонент многих иммунологических реакций, синтезируется из гистидина. Гистамин также способствует возникновению полового возбуждения. Люди, страдающие маниакально-депрессивным психозом, не должны принимать гистидин, за исключением случаев, когда дефицит этой аминокислоты точно установлен.
Метионин способствует понижению уровня гистидина в организме. Гистамин, очень важный компонент многих иммунологических реакций, синтезируется из гистидина. Гистамин также способствует возникновению полового возбуждения. Люди, страдающие маниакально-депрессивным психозом, не должны принимать гистидин, за исключением случаев, когда дефицит этой аминокислоты точно установлен.
Природные источники гистидина: бананы, рыба, говядина, пшеница и рожь. Глутаминовая (Глютаминовая) кислота – заменимая аминокислота, играющая роль нейромедиатора с высокой метаболической активностью в головном мозге, стимулирует окислительно-восстановительные процессы в головном мозге, обмен белков, оказывает ноотропное действие. Нормализует обмен веществ, изменяя функциональное состояние нервной и эндокринной систем. Глютаминовая кислота может использоваться клетками головного мозга в качестве источника энергии. Глютаминовую кислоту применяют при коррекции расстройств поведения у детей, а также при лечении эпилепсии, мышечной дистрофии, гипогликемических состояний, осложнений инсулинотерапии сахарного диабета и нарушений умственного развития.
Источники глутаминовой кислоты: злаки, мясо, молоко, соя.
Глутамин (Глютамин) производится в мозге, необходим для детоксикации аммиака – побочного продукта протеинового обмена. Он также служит предшественником мозговых нейротрансмиттеров, таких как возбуждающий нейротрансмиттер глютамат и подавляющий нейротрансмиттер гамма-аминобутировая кислота. Гамма-аминомасляная кислота (GABA) выполняет в организме функцию нейромедиатора центральной нервной системы. Гамма-аминомасляную кислоту назначают при синдроме дефицита внимания. Глютамин очень легко проникает через гематоэнцефалический барьер и в клетках головного мозга переходит в глютаминовую кислоту и обратно. Глютамин находится в больших количествах в мышцах и используется для синтеза белков клеток скелетной мускулатуры. Глютамин улучшает деятельность мозга и поэтому применяется при эпилепсии, синдроме хронической усталости, импотенции, шизофрении Пищевые добавки, содержащие глютамин, следует хранить только в сухом месте, иначе глютамин переходит в аммиак и пироглютаминовую кислоту. Не принимают глютамин при циррозе печени, заболеваниях почек, синдроме Рейе.
Не принимают глютамин при циррозе печени, заболеваниях почек, синдроме Рейе.
Глютамин содержится во многих продуктах как растительного, так и животного происхождения, но он легко уничтожается при нагревании. Шпинат и петрушка являются хорошими источниками глютамина, но при условии, что их потребляют в сыром виде.
Орнитин заменимая аминокислота, улучшающая метаболизм мозга, поэтому показанием к ее применению являются программы, нацеленные на повышение интеллектуальных функций. Орнитин помогает высвобождению гормона роста, который способствует сжиганию жиров в организме. Гормон роста (соматотропный гормон, соматотропин) представляет собой белок, состоящий из 191 аминокислоты. Синтез и секреция гормона роста осуществляется в передней доли гипофиза — эндокринной железе. Он выделяется передней долей гипофиза в течение дня путем пульсации, но особенно активно — после интенсивных упражнений или во время сна. Этот эффект усиливается при применении орнитина в комбинации с аргинином и карнитином. Орнитин также необходим для иммунной системы и работы печени, участвуя в дезинтоксикационных процессах и восстановлении печеночных клеток. Эта аминокислота способствует восстановлению поврежденных тканей. Орнитин в организме синтезируется из аргинина и, в свою очередь, служит предшественником для цитруллина, пролина, гпютаминовой кислоты.
Орнитин также необходим для иммунной системы и работы печени, участвуя в дезинтоксикационных процессах и восстановлении печеночных клеток. Эта аминокислота способствует восстановлению поврежденных тканей. Орнитин в организме синтезируется из аргинина и, в свою очередь, служит предшественником для цитруллина, пролина, гпютаминовой кислоты.
Пролин — заменимая аминокислота выполняет вспомогательные ГАМК функции торможения ЦНС, содержится в большинстве белков. Пролин стал основой для создания нейролептиков нового поколения запатентованных в России и США, которые показаны при инсультах, болезни Дауна, умственной отсталости и нарушении памяти. При помощи пролина, можно значительно повысить эффективность обучения.
Пролин содержится в твороге, в хрящах животных, в зернах злаков, яйцах.
Таурин оказывает защитное действие на головной мозг. Эта аминокислота в высокой концентрации содержится в сердечной мышце, ЦНС, белых клетках крови. Его применяют для профилактики и лечения гиперактивности, беспокойства, возбуждения, эпилепсии. Синтезируется в организме человека при условии достаточного количества витамина В6.
Его применяют для профилактики и лечения гиперактивности, беспокойства, возбуждения, эпилепсии. Синтезируется в организме человека при условии достаточного количества витамина В6.
Таурин содержится в молоке, мясе, рыбе.
Тирозин является предшественником нейромедиаторов норэпинефрина и дофамина, оказывает положительное инотропное действие. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норэпинефрина, что, в свою очередь, приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина и улучшает функции надпочечников, щитовидной железы и гипофиза. Тирозин также участвует в обмене фенипаланина. Симптомами дефицита тирозина также являются пониженное артериальное давление, низкая температура тепа и синдром беспокойных ног. Прием биологически активных пищевых добавок с тирозином используют для снятия стресса, полагают, что они могут помочь при синдроме хронической усталости нарколепсии. Их используют при тревоге, депрессии, аллергиях и головной боли, а также при отвыкании от лекарств.
Их используют при тревоге, депрессии, аллергиях и головной боли, а также при отвыкании от лекарств.
Естественные источники тирозина: миндаль, авокадо, бананы, молочные продукты, семечки тыквы и кунжут.
Источник: butakova.info.
Обязательно прочтите книгу ДЗЫНЬ ▼
Книга ДЗЫНЬ — новейшая философия, система оздоровления и психотехника.
Самый эффективный креативный метод №10.
Задавайте вопросы, пишите комментарии и отзывы:
Взгляните на эти публикации, там много интересного:
Секреты здоровья: аминокислоты
Аминокислоты — это строительная основа для белка, который в свою очередь, является стройматериалом для всего организма. Вполне логично, что при недостатке нехватке каких-либо аминокислот повышается риск развития заболеваний, ухудшения работы организма. Рассмотрим самые основные из них.
Рассмотрим самые основные из них.
Нервная система состоит из нервных клеток, а клетки из белков. Умственная активность, память, сопровождаются гормонами, которые тоже состоят из белков. Именно белковые соединения помогают мозгу в работе и выработке энергии. Исследования показали, что если клетки мозга и нервной системы получают достаточное количество питательных веществ, то производят исключительно приятные эмоции: эйфория, радость, духовный подъем, желание смеяться. И, напротив, при истощении нервных клеток, человек становится раздражительным, депрессивным, рассеянным, чувствует постоянную усталость. Для того чтобы этого не происходило, нужно заботиться о достаточном количестве аминокислот: глицина, теанина и триптофана.
Глицин
основной компонент клеточной мембраны нервного волокна и головного мозга. Он участвует в обмене веществ, укрепляет сосуды и клетки. При дефиците глицина повышается давление, эмциональный фон становится напряженным, снижается работоспособность, ухудшается сон.
Триптофан
В организме это аминокислота расщепляется до серотонина или«гормона радости». Он успокаивает нервную систему, является мощным антидепрессантом. При регулярном поступлении триптофана, уровень серотонина сохраняется в норме. В темное время суток важным условием является отсутствие освещения, благодаря чему происходит выработка мелатонина, отвечающего за качественный сон. При хорошем уровне триптофана, высыпаться можно за более короткий срок.Теанин
Именно эта аминокислота отвечает за мозговую активность и активизацию умственных процессов. При этом теанин не вызывает нервного возбуждения, а наоборот, позволяет сохранять спокойствие, ясный ум, держать под контролем давление, которое может резко подскакивать при стрессах. Он способен повышать человеческую активность и работоспособность, улучшает процесс запоминания новой информации, вызывает прилив сил и энергии. Получают теанин из листьев зеленого чая. Однако злоупотребление зеленым чаем не рекомендовано, из-за высокого содержания в нем кофеина, а содержание теанина все равно не покрывает суточную норму в 500 мг.
Метионин
Серосодержащая аминокислота. Участвует в синтезе таких важных соединений, как креатин, адреналин, холин и др. Также она обеспечивает формирование фосфолипидов – элементов в структуре клеток печени. Метионин нейтрализует токсические продукты распада, снижает скорость отложения жира в печени и артериях, за счет ускорения липотропного обмена.
L-орнитин
Это детоксикационное и гепатопротекторное средство, при курсовых применениях помогает восстановлению клеток печени, способствует нейтрализации токсичных процессов. Выводит из организма аммиак и азотосодержащие продукты.L-карнитин
Повышает работоспособность, уменьшает утомляемость. При физических нагрузках помогает снижению веса засчет уменьшения жировой прослойки в мышцах. Также данная аминокислота отлично защищает мозг от старческих проявлений, ускоряет регенерацию в тканях, что незаменимо после перенесенных серьезных заболеваний. Возврат к спискуТоп 5 аминокислот, которые успокаивают гиперактивную нервную систему
Прочитано: 3 639
Аминокислоты являются питательной средой для нервной системы. Они являются краеугольным камнем эмоций, сенсорных функций, внимания и сна. Мы попросили д-ра Джареда Скоурона рассказать нам, что именно нужно детям с аутизмом для достижения успеха.
Они являются краеугольным камнем эмоций, сенсорных функций, внимания и сна. Мы попросили д-ра Джареда Скоурона рассказать нам, что именно нужно детям с аутизмом для достижения успеха.
Ключом к здоровому мозгу является баланс. У большинства детей, находящихся в спектре есть сверхвозбудимая нервная система. Некоторые дети гиперактивны и агрессивны, некоторые обеспокоены и избегают социальных взаимодействий любой ценой, некоторые с физической гиперчувствительностью и те, кто «ищет сенсоры», все они имеют чрезмерно активную нервную систему, которую необходимо успокоить до среднего здорового уровня.
Топ 5 аминокислот, которые успокаивают гиперактивную нервную систему
Гамма-аминомасляная кислота (GABA)
Гамма-аминомасляная кислота (ГАМК) – важнейший тормозной нейромедиатор центральной нервной системы человека. Принимает участие в нейромедиаторных и метаболических процессах в мозге. Некоторые формы этой аминокислоты пересекают гематоэнцефалический барьер, чтобы увеличить выработку альфа-волн, которые создают расслабленное, но сфокусированное психическое состояние. ГАМК приводит к плавному и спокойному ритмическому потоку электрических импульсов в мозге, которые создают здоровое чувство эмоционального благополучия.
ГАМК приводит к плавному и спокойному ритмическому потоку электрических импульсов в мозге, которые создают здоровое чувство эмоционального благополучия.
Под влиянием ГАМК активируются энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение. Рекомендуемая дозировка 750 мг в сутки
5-Гидрокситриптофан (5-HTP) – аминокислота, входящая в состав белков. Является прекурсором нейротрансмиттерасеротонина и является промежуточным веществом в метаболизме триптофана, одной из важнейших аминокислот. 5-HTP повышает уровень серотонина и мелатонина в мозге, регулируя здоровое настроение и поведение. Рекомендуемая дозировка – 50 мг в сутки
Теанин
Теанин (Theanine)- это единственная аминокислота, которая действует как антагонист NMDA. Многие недавние исследования показывают, что антагонисты NMDA могут значительно контролировать поведение. Theanine, естественно встречающийся в зеленом чае, расслабляет ум без сонливости.
Theanine, естественно встречающийся в зеленом чае, расслабляет ум без сонливости.
L-теанин может влиять на уровень определенных химических веществ в мозге. К ним относятся серотонин и дофамин, которые влияют на настроение, сон и эмоции, а также кортизол, который помогает организму справляться со стрессом .
Изменение баланса этих химических веществ может изменить настроение человека или уровень стресса.
Рекомендуемая безопасная дозировка – 200 мг в день
Таурин
Таурин – сульфокислота, образующаяся в организме из аминокислоты цистеина. Таурин принимает участие в обмене липидов, улучшает энергетические и обменные процессы, входит в состав жёлчных кислот, способствующих эмульгированию жиров в кишечнике. В центральной нервной системе выполняет функцию тормозящего нейромедиатора, обладает некоторой противосудорожной активностью.
Таурин обладает широким спектром воздействия; известно, что он противодействует многим физиологическим проблемам, зарегистрированным или изучаемым при РАС, которые могут усиливать возбуждение мозга, таким как:
- антиоксидантные эффекты (Oliveira et al.
 2010), которые противодействуют окислительному стрессу (Chauhan et al. 2009; James et al. 2006),
2010), которые противодействуют окислительному стрессу (Chauhan et al. 2009; James et al. 2006), - поддерживают гомеостаза кальция (Albinana et al. 2010; El Idrissi and Trenkner 2003), который может быть генетически и / или экологически нарушен (Pessah and Lein 2008),
- защита от глютаматной токсичности (Молчанова и соавт. 2007) которые могут снова присутствовать в РАС по генетическим и / или экологическим причинам (Rubenstein and Merzenich 2003) (Blaylock and Strunecka 2009; Harada et al. 2010)
- токсичность ксенобиотиков и тяжелых металлов (Yu et al. 2007; Zhu et al. и др. 2005) и для защиты от судорог (El Idrissi et al. 2003; Kirchner et al. 2003).
Глицин
Глицин- это еще одна расслабляющая аминокислота для мозга, глицин обладает благотворным побочным эффектом, имея сладкий вкус. Хотя мы связываем сладость с сахаром, это один из немногих белков, сладких на вкус без сахара. Глицин можно сочетать с минералами, такими как бисглицинат магния и бисглицинат цинка. > (откроется в новой вкладке)”>Подробнее про глицин >>
> (откроется в новой вкладке)”>Подробнее про глицин >>
Аминокислоты работают быстро. У многих детей изменения видны уже через неделю после приема правильных аминокислот. Они быстро метаболизируются, и некоторые из них для получения успокаивающих эффектов могут нуждаться в постоянном пополнении (приеме) каждые 8 часов.
Добавка аминокислот намного превосходит белок, получаемый из пищи. Для обработки яйца, куриного мяса или хот-дога требуются часы, а молекула белка содержит не менее тысячи аминокислот, которые необходимо переварить и усвоить, прежде чем они смогут начать работать и мы увидим нужный эффект в мозге и нервной системе. Аминокислотная добавка немедленно всасывается, а эффект можно заметить в течение десяти минут.
Добавками, которые я использую в своей практике для достижения быстрых результатов, являются Spectrum Awakening’s Power & Focus, а также Calm & Cool. Обе содержат эффективные дозы аминокислот.
Сдайте анализ крови или мочи (крови предпочтительней) на аминокислоты. У многих детей в моче или крови отсутствуют уровни ГАМК, а у многих детей уровень триптофана, теанина, таурина и глицина ниже нормы. Добавление аминокислот быстро, просто и эффективно.
У многих детей в моче или крови отсутствуют уровни ГАМК, а у многих детей уровень триптофана, теанина, таурина и глицина ниже нормы. Добавление аминокислот быстро, просто и эффективно.
Никогда не оставляйте надежду и старайтесь делать все возможное для своего ребенка.
Об авторе
Jared Skowron
Доктор
Доктор Джаред Сковрон (Jared Skowron) создал одну из крупнейших биомедицинских клиник аутизма в Новой Англии, помогая детям на протяжении уже 15 лет выходить из спектра. Он является членом Консультативного совета Autism Hope Alliance и читает лекции на Autism Education Summit в рамках программы Generation Rescue, TACA, Autism One и других международных конференциях.
К опухолям мозга подобрались изнутри / / Независимая газета
Биохимики ищут способы мобилизации макрофагов
|
Ферменты синтеза и «считывания» ДНК (транскрипции генов). Иллюстрация Physorg |
До самого последнего времени нейробиологи не подозревали, что их исследования могут хоть как‑то пересекаться с клеточной биологией вообще – уж очень специфичны нейроны, отличающиеся от других клеток. Но дело в том, что у всех 200 типов клеток тела одинаковый геном, полученный ими после слияния яйцеклетки и спермия. Просто реализуется генный пул по‑разному.
В Университете Дж. Гопкинса в Балтиморе (США) выяснили, что вещества, которые необходимы для передачи нервных сигналов, нейротрансмиттеры (или медиаторы), например глютаминовая кислота, способствуют аномальному делению и стимулируют подвижность клеток. Лекарство РМРА, примененное учеными, снижает уровень глютамина в опухоли и ее размер, блокируя фермент образования аминокислоты.
Другая аминокислота, тирозин, из которой образуется допамин (его нехватка приводит к паркинсонизму), подвергается нитрованию, присоединяет – NO2, в результате подавляет нормальный энергообмен в митохондриях.
Немецкий биохимик Отто Варбург еще в 1931 году получил Нобелевскую премию за открытие закисления нездоровых разрастаний вследствие накопления в их клетках молочной кислоты, то есть лактата – продукта расщепления глюкозы в отсутствие кислорода. Помимо тирозина в этом принимает участие и глютамин, являющийся одним из регуляторов работы митохондрий.
Сотрудники университетов штата Орегон в Корвалисе и Центрального Флориды в Орландо (США) показали, что агрессивный азотный радикал ONOO (пероксинитрит) присоединяется к тирозину. При этом выяснилось, что нормальная работа клеточных энергостанций возможна лишь в присутствии функционального гена Merlin (назван так в память о злом волшебнике Мерлине, забросившем меч короля Артура в озеро). Выключение гена Merlin привело к возникновению у мышей многочисленных разрастаний клеток так называемой шванновской оболочки нервных отростков (разрушение оболочек наблюдается при нейродегенеративном рассеянном склерозе).
Шванновские клетки относятся к глие, или «клею» белого вещества мозга. Наиболее агрессивные разрастания глии получили название «глиобластома» (GBM). Обычно отклоняющиеся от нормы клетки подвергаются запрограммированной смерти, апоптозу.
Исходной клеткой иммунного ответа и надзора является мечниковский макрофаг. В Университете штата Миннесота в Миннеаполисе (США) нашли трипептид, состоящий из трех аминокислот, который способствует «оживлению» опухолевых макрофагов и их мобилизации на борьбу.
В Университете штата Миннесота в Миннеаполисе (США) нашли трипептид, состоящий из трех аминокислот, который способствует «оживлению» опухолевых макрофагов и их мобилизации на борьбу.
В Институте науки и технологии Сеула в 2018 году показали наличие стволовых клеток GBM в зоне, прилегающей к стенке мозговой полости (желудочка). Это удалось доказать введением мышам клеток от 28 пациентов с GBM.
Ученые в США остановили деменцию у подопытных мышей
Автор фото, BBC World Service
Группа американских ученых достигла первых успехов в предотвращении старческой дегенерации мозга у лабораторных мышей путем воздействия на иммунную систему.
Они доказали, что клетки иммунной системы мозга, которые начинают поглощать питательные вещества, могут играть роль инициатора процесса дегенерации нервной ткани.
Ученые из университета Дьюка в США утверждают, что их открытие может проложить новые пути исследований в области, в которой до сих пор не создано ни одного лекарственного препарата для замедления процесса старческого слабоумия.
Исследователи установили, что клетки класса микроглия — специализированного класса глиальных клеток центральной нервной системы, которые выступают в роли фагоцитов, уничтожающих инфекционные агенты и разрушающих нервные клетки, — являются активными участниками процесса развития старческого слабоумия, или деменции.
Некоторые клетки этого класса на ранних этапах развития деменции проявляют большую активность в расщеплении аминокислоты аргинин. При снижении уровня аргинина иммунные клетки начинают тормозить реакции всей иммунной системы мозга.
Борьба с деменцией
В проводившихся на лабораторных животных экспериментах ученые применили химический препарат, который блокирует действие ферментов, расщепляющих аргинин.
Автор фото, BBC World Service
Подпись к фото,Клетки микроглии, обозначенные черным цветом, начинают поглощать аминокислоту аргинин
Подвергшиеся такому вмешательству животные имели не столь значительные концентрации поврежденных белков в мозгу и при тестировании памяти показывали лучшие результаты по сравнению с контрольной группой.
«Мы предполагаем, что если нам удастся заблокировать процесс разрушения данной аминокислоты в мозгу, такие мыши не заболевают синдромом Альцгеймера», — говорит доктор Мэтью Кан, принимавший участие в этом исследовании.
«Мы рассматриваем наше открытие в качестве совершенно нового подхода к пониманию синдрома Альцгеймера», — подчеркнул он.
Надежда есть
Полученные учеными из университета Дьюка данные, однако, свидетельствуют, что простое введение добавочного количества аргинина в организм не влияет на развитие деменции, так как процесс расщепления аминокислоты не прекращается.
Член британского общества Альцгеймера доктор Джеймс Пикетт считает, что новое исследование дает надежду на появление новых методов лечения старческого слабоумия.
«Эти результаты, полученные при опытах на лабораторных животных, дают ответы на некоторые открытые до сих пор вопросы в нашем понимании процессов, которые вызывают синдром Альцгеймера, в особенности в том, что касается роли, которую играет при этом иммунная система», — поясняет Пикетт.
Мозг, аминокислоты — Справочник химика 21
Наблюдалось полное восстановление найденных изменений от воздействия малой концентрации Нарушение условнорефлекторной деятельности, выпадение натурального рефлекса на вид и запах пищи, нарушение межнейронных связей в коре головного мозга Недействующая концентрация НЬ—, эритроциты—, ретикулоциты-Ь, нейтрофилы-Ь, лимфоциты—, СПП—, нарушение условнорефлекторной деятельности, гиппуровая кислота в моче—, белок в моче-Ь, аминокислоты в моче-Ь, содержание Н-групп в сыворотке крови-Ь, морфологические изменения-Ь Не восстанавливались полностью морфологические изменения в центральной нервной системе и печени [c.173]Катаболизм аминокислот с разветвленной цепью лейцина, изолейцина и валина—преимущественно осуществляется не в печени (место распада большинства остальных аминокислот), а в мышечной и жировой тканях, в почках и ткани мозга. Сначала все три аминокислоты подвергаются трансаминированию с а-кетоглутаратом под действием одного общего и специфического фермента—аминотрансферазы аминокислот с разветвленной цепью (КФ 2.
 6.1.42) (не содержится в печени) с образованием соответствующих а-кетокислот. Последующее окислительное декарбоксилирование а-кетокислот приводит к образованию ацил-КоА-производных. [c.459]
6.1.42) (не содержится в печени) с образованием соответствующих а-кетокислот. Последующее окислительное декарбоксилирование а-кетокислот приводит к образованию ацил-КоА-производных. [c.459] Азотистый обмен связан преимущественно с обменом белков, структурными единицами которых являются аминокислоты. Поэтому далее представлены накопленные к настоящему времени данные о нарушениях обмена отдельных аминокислот при патологии. Повышенный интерес биохимиков, физиологов и клиницистов к проблемам патологии обмена аминокислот объясняется рядом обстоятельств. Во-первых, имеются экспериментальные доказательства и клинические наблюдения о развитии патологического синдрома, в основе которого лежат нарушения нормального пути обмена отдельных аминокислот в организме. Во-вторых, в последнее время аминокислоты и их производные нашли широкое применение в клинической практике в качестве лекарственных средств например, метионин используется для лечения ряда болезней печени, глутаминовая кислота — некоторых поражений мозга, глутамин — кетонурии и т. д. Наконец, ряд аминокислот и продукты их декарбоксилирования (биогенные амины) оказывают регулирующее влияние на многие физиологические функции организма. Следовательно, знание закономерностей обмена отдельных аминокислот в норме и особенно при патологии представляет исключительный научно-теоретический и практический интерес. [c.464]
д. Наконец, ряд аминокислот и продукты их декарбоксилирования (биогенные амины) оказывают регулирующее влияние на многие физиологические функции организма. Следовательно, знание закономерностей обмена отдельных аминокислот в норме и особенно при патологии представляет исключительный научно-теоретический и практический интерес. [c.464]
Врожденные нарушения обмена отдельных аминокислот. Пристальное внимание ученых привлекают некоторые наследственные заболевания человека, являющиеся следствием первичного дефекта обмена отдельных аминокислот. Возникновение и дальнейшее развитие специфического патологического синдрома при таких заболеваниях обусловлено полным или частичным отсутствием активности определенных ферментов организм либо теряет способность синтезировать данный фермент, либо образуется недостаточное количество его, либо синтезируется аномальный фермент, отличающийся по структуре от нативного. Следствием такого врожденного дефекта обмена является накопление в тканях нормальных промежуточных или побочных (неспецифических) продуктов обмена, оказывающих токсическое влияние на организм и в первую очередь на ЦНС. Этим, пожалуй, объясняется тот факт, что в основном заболевают дети в раннем возрасте, у которых затем развиваются специфические расстройства психической деятельности. Весьма вероятно также, что отдельные аминокислоты и продукты их обмена в оптимальных концентрациях являются эссенциальными для деятельности мозга. Поэтому задача биохимиков, физиологов и клиницистов состоит в том, чтобы выяснить зависимость между развитием патологического синдрома при врожденных пороках обмена и специфическими нарушениями обмена аминокислот. Приводим примеры подобных нарушений. [c.467]
Этим, пожалуй, объясняется тот факт, что в основном заболевают дети в раннем возрасте, у которых затем развиваются специфические расстройства психической деятельности. Весьма вероятно также, что отдельные аминокислоты и продукты их обмена в оптимальных концентрациях являются эссенциальными для деятельности мозга. Поэтому задача биохимиков, физиологов и клиницистов состоит в том, чтобы выяснить зависимость между развитием патологического синдрома при врожденных пороках обмена и специфическими нарушениями обмена аминокислот. Приводим примеры подобных нарушений. [c.467]
В ряде случаев вследствие блокирования действия какого-либо фермента имеет место резкое отставание умственного развития. Вопрос о том, чем обусловлено это торможение психической деятельности токсическим действием ненормально высоких концентраций аминокислот или их метаболитов на мозг, нарушением нормального соотношения аминокислот и, следовательно, биосинтеза белка либо вторичными нарушениями энергетического и других видов обмена—окончательно не решен.
 Таким образом, идентификация химической реакции или ферментативной системы, нарушение функции которой является первопричиной развития тяжелого наследственного заболевания, в наши дни не только представляет большой теоретический интерес, но в ряде случаев играет решающую роль в диагностике и терапии этих болезней. Всегда следует учитывать, что при блокировании нормального пути обмена какой-либо аминокислоты промежуточные метаболиты, следующие за местом блокирования, становятся незаменимыми при данном заболевании. [c.468]
Таким образом, идентификация химической реакции или ферментативной системы, нарушение функции которой является первопричиной развития тяжелого наследственного заболевания, в наши дни не только представляет большой теоретический интерес, но в ряде случаев играет решающую роль в диагностике и терапии этих болезней. Всегда следует учитывать, что при блокировании нормального пути обмена какой-либо аминокислоты промежуточные метаболиты, следующие за местом блокирования, становятся незаменимыми при данном заболевании. [c.468]Известно, что обмен аминокислот в мозговой ткани протекает в разных направлениях. Прежде всего пул свободных аминокислот используется как источник сырья для синтеза белков и биологически активных аминов. Одна из функций дикарбоновых аминокислот в головном мозге-связывание аммиака, освобождающегося при возбуждении нервных клеток. [c.634]
Установлено, что белки в головном мозге находятся в состоянии активного обновления, о чем свидетельствует быстрое включение радиоактивных аминокислот в молекулы белков. Однако в разных отделах головного мозга скорость синтеза и распада белковых молекул неодинакова. Белки серого вещества полушарий большого мозга и белки мозжечка отличаются особенно большой скоростью обновления. В участках головного мозга, богатых проводниковыми структурами —аксонами (белое вещество головного мозга), скорость синтеза и распада белковых молекул меньше. [c.635]
Однако в разных отделах головного мозга скорость синтеза и распада белковых молекул неодинакова. Белки серого вещества полушарий большого мозга и белки мозжечка отличаются особенно большой скоростью обновления. В участках головного мозга, богатых проводниковыми структурами —аксонами (белое вещество головного мозга), скорость синтеза и распада белковых молекул меньше. [c.635]
Содержание белка в цереброспинальной жидкости незначительно (0,15— 0,40 г/л), причем отношение альбумины/глобулины равно 4 липидов в сотни раз меньше, чем в плазме крови. Возможно, что липиды плазмы крови в цереброспинальной жидкости отсутствуют. Общее содержание низкомолекулярных азотсодержащих веществ, особенно аминокислот, в 2—2,5 раза меньше, чем в крови. В ткани мозга, как отмечалось, количество свободных аминокислот велико и во много раз превышает концентрацию их в крови и тем более в цереброспинальной жидкости. Установлено, что некоторые аминокислоты (например, глутаминовая кислота) почти не проникают через гематоэнцефалический барьер. В то же время амиды аминокислот (в частности, глутамин) легко преодолевают этот барьер. Содержание глюкозы в цереброспинальной жидкости относительно велико (2,50—4,16 ммоль/л), но несколько меньше, чем в крови, причем концентрация глюкозы в спинномозговой жидкости может повышаться или снижаться в зависимости от изменений содержания глюкозы в крови. [c.644]
В то же время амиды аминокислот (в частности, глутамин) легко преодолевают этот барьер. Содержание глюкозы в цереброспинальной жидкости относительно велико (2,50—4,16 ммоль/л), но несколько меньше, чем в крови, причем концентрация глюкозы в спинномозговой жидкости может повышаться или снижаться в зависимости от изменений содержания глюкозы в крови. [c.644]
Активность систем транспорта аминокислот, так же как и состав их пула, изменяется в процессе развития мозга. Аминокислоты проникают в мозг молодых животньгх быстрее и достигают более высоких концентраций, чем у взрослых. [c.41]
Глюкоз а— одна из наиболее распространенных соедннетн в животном организме. Особенно велика ее роль в нервной ткани, так как она является НС только основным энергетическим источником, но н предшественником ряда важнейших метаболитов головного мозга (аминокислот, ацетил-КоА и др.). Молекула глюкозы может иметь открытую форму — альдегидную л замкнутую— циклическую в виде ииранозного или фуранозного кольца. В пг-стоящее время установлено, что ациклические формы глюкозы характеризуются наибольшей реакционной способностью. Свободная глюкоза во внекле точных пространствах характеризуется также высокой обновляемостью. [c.261]
В пг-стоящее время установлено, что ациклические формы глюкозы характеризуются наибольшей реакционной способностью. Свободная глюкоза во внекле точных пространствах характеризуется также высокой обновляемостью. [c.261]
Синтез РНК связан с количеством транспортной т-РНК, т. е. РНК переносящей аминокислоты. Если концентрация молекул т-РНК, не имеющих нагрузки, возрастает, то синтез РНК задерживается. Действие этого поразительного механизма уже само по себе указывает на постоянную пространственную близость всех деталей аппарата, синтезирующего белок. В действительности так оно и есть, ведь синтез белка протекает в рибосомах, т. е. в организованных частицах клетки. Число структур, образуемых мембранами, не исчерпывается, конечно, митохондриями и рибосомами. Ядро клетки, лизосомы, аппарат Гольджи и другие органел-лы также построены из мембран они же послужили и материалом для создания нейронов — элементов нервной системы, в том числе и мозга, выполняющего высшие кодовые функции. [c.395]
[c.395]
Кефалин (греч. керНа1е — голова), впервые выделенный из тканей головного мозга, является смесью фосфолипидов трех типов. Один из них, соединение V, отличается от лецитинов только тем, что в качестве основного компонента вместо холина в нем содержится этано/ -амин в другом — фосфолипиде VI таким компонентом служит аминокислота — серин [c.634]
Существует и другой путь распада глутамата а-аминобутиратный шунт, рассматриваемый в гл. 9 (рис. 9-4). а-Аминобутиратный шунт начинается не с дезаминирования или переаминирования, а с зависимого от пиридоксальфосфата декарбоксилирования. Поскольку декарбоксилазы известны для большинства аминокислот, обычно существует несколько путей, по которым может пойти начинающееся таким образом расщепление. В ткани мозга -у-аминобутират, как полагают, функционирует как важный нейромедиатор (гл. 16, разд. Б, 4, б). [c.101]
Витамин В 2 регулирует углеводный и липидный обмен, участвует в метаболизме незаменимых аминокислот, пуриновых и пиримидиновых оснований, стимулирует образование предшественников гемоглобина в костном мозге применяется в медицине для лечения злокачественной анемии, лучевой болезни, заболеваний печени, полиневрита и т. п. Добавление витамина к кормам способствует более полноцершому усвоению растительных белков и повышает продуктивность сельскохозяйственных животных на 10 —15 %. [c.54]
п. Добавление витамина к кормам способствует более полноцершому усвоению растительных белков и повышает продуктивность сельскохозяйственных животных на 10 —15 %. [c.54]
Эндорфин — опиат мозга, состоящий из 31 аминокислотного остатка, был синтезирован в генетически сконструированных клетках в 1980 г. группой ученых из Австралии и США. -Эндорфин получен в клетках Е. соН в виде гибридного белка с -галактози-дазой. Процедура синтеза -эндорфина включала получение путем обратной транскрипции мРНК — кДНК, кодирующей белок-предшественник, содержащий помимо последовательности -эндорфина последовательность АКТГ и -липотропина ( -JITT), в дальнейшем удаляемые. -Эндорфин, полученный из гибридного белка и тщательно очищенный, обладал значительной биологической активностью. Он специфически взаимодействовал с антисывороткой против -эндорфина. От -эндорфина человека генно-инженерный -эндорфин отличался по двум аминокислотам, и эти отличия можно было легко устранить на нуклеотидном уровне путем замены двух кодонов в ДНК бактериальной плазмиды. [c.139]
[c.139]
Мутации могут передаваться по наследству и являются причиной многих генетических наследственных заболеваний. Примером такого заболевания является фенилкетонурия. В норме фенилаланин превращается в тирозин с помощью фермента гидроксилазы, но если произошла мутация и данный фермент не синтезировался или вместо него синтезировался другой белок, то в результате нарушения гидроксилирования тирозина будет накапливаться фенилпируват (фенилкетон), а также фениллактат и фенилацетат. При накоплении этих продуктов нарушается нормальное развитие мозга у детей, появляется умственная отсталость. Единственный способ предотвращения фенилкетонурии — резкое уменьшение количества фенилаланина в детском питании до выработки в организме компенсаторных механизмов обмена аминокислот. [c.53]
Выделение и характеристика пептидных гормонов — обычно кропотливая и трудная работа это относится и к гормонам гипоталамуса [19]. Гипоталамус является той областью ткани мозга, которая осуществляет тонкий контроль за эндокринной системой, влияя на активность продуцирования гормонов внещней долей гипофиза. В ткани одного животного присутствуют лишь нанограм-мовые количества гормонов. Первые исследования тиротропин-ре-лизинг гормона (TRH) представляли собой огромную работу по экстракции сотен тысяч свиных гипоталамусов и даже в результате ее удалось получить не полностью очищенный препарат. Аминокислоты, найденные в гидролизате, первоначально рассматривали как примеси, и только после того как в достаточно чистом препарате были обнаружены три аминокислоты гистидин, пролин и глутаминовая кислота в эквимольных количествах, предположили, что гормон имеет пептидную природу. Были синтезировавш шесть возможных изомерных трипептида, однако все они оказались неактивными. Дальнейшие исследования привели, наконец, к пептиду (7), содержащему пироглутаминовую кислоту и амидную функцию этот пептид и оказался идентичным природному ТКН [20, 21]. Таким образом, синтез гормона и определение его структуры были достигнуты одновременно. [c.292]
В ткани одного животного присутствуют лишь нанограм-мовые количества гормонов. Первые исследования тиротропин-ре-лизинг гормона (TRH) представляли собой огромную работу по экстракции сотен тысяч свиных гипоталамусов и даже в результате ее удалось получить не полностью очищенный препарат. Аминокислоты, найденные в гидролизате, первоначально рассматривали как примеси, и только после того как в достаточно чистом препарате были обнаружены три аминокислоты гистидин, пролин и глутаминовая кислота в эквимольных количествах, предположили, что гормон имеет пептидную природу. Были синтезировавш шесть возможных изомерных трипептида, однако все они оказались неактивными. Дальнейшие исследования привели, наконец, к пептиду (7), содержащему пироглутаминовую кислоту и амидную функцию этот пептид и оказался идентичным природному ТКН [20, 21]. Таким образом, синтез гормона и определение его структуры были достигнуты одновременно. [c.292]
Недавние результаты, полученные в различных областях, указывают на щирокую распространенность в нервной ткани неболь-щих пептидов и на их влияние на эту ткань. Так, оказалось, что выделенный из мозга свиньи природный материал, обладающий наркотическим действием и долгое время постулировавщийся, представляет собой два тетрапептида [34] (17) и (18). Существование таких молекул, обладающих свойствами физиологических передатчиков, предполагалось и ранее для объяснения функций морфиновых рецепторов, играющих важную роль в передаче болевых ощущений, однако морфин и родственные соединения не являются для этих рецепторов обычными агонистами. Интересно отметить, что в обоих указанных пептидах Л -концевой аминокислотой является тирозин, что было причиной оживленного обсуждения связи между топологией пептидов и морфина [35]. [c.294]
Так, оказалось, что выделенный из мозга свиньи природный материал, обладающий наркотическим действием и долгое время постулировавщийся, представляет собой два тетрапептида [34] (17) и (18). Существование таких молекул, обладающих свойствами физиологических передатчиков, предполагалось и ранее для объяснения функций морфиновых рецепторов, играющих важную роль в передаче болевых ощущений, однако морфин и родственные соединения не являются для этих рецепторов обычными агонистами. Интересно отметить, что в обоих указанных пептидах Л -концевой аминокислотой является тирозин, что было причиной оживленного обсуждения связи между топологией пептидов и морфина [35]. [c.294]
Возможно, что исследования в этой области, привлекшие большое внимание, касались пептидов, выделенных из мозга животных, которые возникали лишь в связи с определенным стимулом. В некоторых случаях утверждалось, что такие пептиды способны к передаче обусловленного ответа при инъекции подопытным животным [37]. Среди таких веществ наиболее известен скотофобин. Полученные биологические результаты несколько противоречивы, полученные химические данные не помогли разрешить это противоречие. Синтетический пептид, имеющий предложенную ранее последовательность остатков аминокислот, оказался неактивным, однако активность природного пептида была подтверждена (38]. Эта проблема находится, несомненно, на ранней стадии своего разрешения, но она явно представляет значительный интерес для химии и биологии и, возможно, связана с другими, более широкими областями нашего знания. [c.295]
Среди таких веществ наиболее известен скотофобин. Полученные биологические результаты несколько противоречивы, полученные химические данные не помогли разрешить это противоречие. Синтетический пептид, имеющий предложенную ранее последовательность остатков аминокислот, оказался неактивным, однако активность природного пептида была подтверждена (38]. Эта проблема находится, несомненно, на ранней стадии своего разрешения, но она явно представляет значительный интерес для химии и биологии и, возможно, связана с другими, более широкими областями нашего знания. [c.295]
Масляная кислота образует несколько важных аминокислот. Так, у-аминомасляная кислота h3N- h3- h3- h3- OOH найдена в мозгу животных и человека. [c.657]
Следует отметить, что фермент, катализирующий окислительное декарбоксилирование указанных а-кетокислот, высокоспецифичен (по аналогии с пируватдегидрогеназным и а-кетоглутаратдегидрогеназным комплексами) и также нуждается в присутствии всех пяти кофакторов (см. главу 10). Известно наследственное заболевание болезнь кленового сиропа , при которой нарушено декарбоксилирование указанных а-кетокислот (вследствие синтеза дефектного дегидрогеназного комплекса), что приводит не только к накоплению в крови аминокислот и а-кетокислот, но и к их экскреции с мочой, издающей запах кленового сиропа. Болезнь встречается редко, проявляется обычно в раннем детском возрасте и приводит к нарушению функции мозга и летальному исходу, если не ограничить или полностью не исключить поступление с пищей лейцина, изолейцина и валина. [c.459]
главу 10). Известно наследственное заболевание болезнь кленового сиропа , при которой нарушено декарбоксилирование указанных а-кетокислот (вследствие синтеза дефектного дегидрогеназного комплекса), что приводит не только к накоплению в крови аминокислот и а-кетокислот, но и к их экскреции с мочой, издающей запах кленового сиропа. Болезнь встречается редко, проявляется обычно в раннем детском возрасте и приводит к нарушению функции мозга и летальному исходу, если не ограничить или полностью не исключить поступление с пищей лейцина, изолейцина и валина. [c.459]
Аспарагиновая кислота принимает непосредственное участие в орни-типовом цикле мочевинообразования, в реакциях трансаминирования и биосинтезе углеводов (гликогенная аминокислота), карнозина и ансерина, пуриновых и пиримидиновых нуклеотидов (см. главу 14), а также в синтезе М-ацетиласпарагиновой кислоты в ткани мозга. Роль последней, содержащейся в довольно высоких концентрациях в ткани мозга млекопитающих, пока не выяснена. [c.460]
[c.460]
При другом наследственном пороке обмена,-гепатоцеребральной дистрофии (болезнь Вильсона), помимо генерализованной (общей) гипер-аминоацвдурии, отмечаются снижение концентрации медьсодержащего белка церулоплазмина в сыворотке крови и отложение меди в мозге, печени, почках. Генетический дефект связан с нарушением синтеза церулоплазмина. Возможно образование комплексов меди с аминокислотами, которые не всасываются в канальцах. Аналогичная гипераминоацвдурия наблюдается при галактоземии, синдроме Лоу и других наследственных заболеваниях. Пониженная экскреция аминокислот описана при квашиоркоре. [c.467]
Общее содержание аминокислот в ткани мозга человека в 8 раз превышает концентрацию их в крови. Аминокислотный состав мозга отличается определенной специфичностью. Так, концентрация свободной глутаминовой кислоты в мозге выше, чем в любом другом органе млекопитающих (10 мкмоль/г). На долю глутаминовой кислоты вместе с ее амидом глутамином и трипептидом глутатионом приходится более 50% а-аминоазота головного мозга. В мозге содержится ряд свободных аминокислот, которые лишь в незначительных количествах обнаруживаются в других тканях млекопитающих. Это у-амино масляная кислота, К-ацетиласпарагиновая кислота и цистатионин (см. главу 1). [c.634]
В мозге содержится ряд свободных аминокислот, которые лишь в незначительных количествах обнаруживаются в других тканях млекопитающих. Это у-амино масляная кислота, К-ацетиласпарагиновая кислота и цистатионин (см. главу 1). [c.634]
Видовые различия, наблюдаемые при изучении противосудорожной активности диазепама на новорожденных крысятах и морских свинках, можно объяснить физиологическими и биохимическими особенностями их головного мозга. Установлено, что крысята рождаются менее развитыми, чем морские свинки, отсюда разница в составе биогенных аминов, аминокислот (48, 491, активности ферментов [501 головного мозга и его миэлинизации [511, [c.168]
4 Ароматические аминокислоты в головном мозге
- М. Канцев
- Р. Дж. Вуртман
- 11 Цитаты
- 796 Загрузки
В этой главе описаны ароматические l-аминокислоты триптофан и тирозин, а также влияние фенилаланина на метаболизм тирозина. Триптофан и фенилаланин являются незаменимыми аминокислотами и в конечном итоге должны быть получены из пищевых белков; тирозин получают как из пищевых белков, так и в результате гидроксилирования фенилаланина фенилаланингидроксилазой (ПАУ). Доли триптофана, тирозина и фенилаланина, поступающих в системный кровоток, ограничены тремя печеночными ферментами — триптофандиоксигеназой, тирозинаминотрансферазой и фенилаланингидроксилазой — которые разрушают их. Все эти ферменты имеют высокий уровень субстрата K m ‘s, следовательно, они мало влияют на свои аминокислотные субстраты, присутствующие в системной крови, но имеют большое, зависящее от концентрации влияние на повышенные концентрации, присутствующие после приема пищи в крови воротной вены.
Триптофан и фенилаланин являются незаменимыми аминокислотами и в конечном итоге должны быть получены из пищевых белков; тирозин получают как из пищевых белков, так и в результате гидроксилирования фенилаланина фенилаланингидроксилазой (ПАУ). Доли триптофана, тирозина и фенилаланина, поступающих в системный кровоток, ограничены тремя печеночными ферментами — триптофандиоксигеназой, тирозинаминотрансферазой и фенилаланингидроксилазой — которые разрушают их. Все эти ферменты имеют высокий уровень субстрата K m ‘s, следовательно, они мало влияют на свои аминокислотные субстраты, присутствующие в системной крови, но имеют большое, зависящее от концентрации влияние на повышенные концентрации, присутствующие после приема пищи в крови воротной вены.
Все большие нейтральные аминокислоты (LNAA) — например, три ароматические аминокислоты; три аминокислоты с разветвленной цепью, лейцин, изолейцин и валин — через капилляры мозга в его субстанцию за счет действия единственной транспортной молекулы LAT1. Кинетические свойства этой молекулы таковы, что она насыщена LNAA в нормальных концентрациях в системной крови, так что отдельные LNAA конкурируют друг с другом за транспорт через гематоэнцефалический барьер. Следовательно, влияние любого лечения, например, на триптофан в головном мозге, будет зависеть не от триптофана в плазме как такового, а от отношения концентрации триптофана в плазме к суммированным концентрациям другого, конкурирующего LNAA.Небольшие количества молекул LNAA также попадают в мозг через хориоидное сплетение в спинномозговую жидкость.
Кинетические свойства этой молекулы таковы, что она насыщена LNAA в нормальных концентрациях в системной крови, так что отдельные LNAA конкурируют друг с другом за транспорт через гематоэнцефалический барьер. Следовательно, влияние любого лечения, например, на триптофан в головном мозге, будет зависеть не от триптофана в плазме как такового, а от отношения концентрации триптофана в плазме к суммированным концентрациям другого, конкурирующего LNAA.Небольшие количества молекул LNAA также попадают в мозг через хориоидное сплетение в спинномозговую жидкость.
Уровни триптофана в головном мозге определяют насыщение триптофангидроксилазы субстратом и, следовательно, скорость, с которой триптофан превращается в 5-гидрокситриптофан, а затем в серотонин или мелатонин. Уровни тирозина в мозге могут влиять или не влиять на скорость, с которой тирозин гидроксилируется и превращается в катехоламины, допамин и норэпинефрин, в зависимости от частоты возбуждения конкретного катехоламинергического нейрона. Если нейрон возбуждается с высокой частотой, фермент тирозингидроксилазы многократно фосфорилируется; это заметно увеличивает его сродство к его ограничивающему в других отношениях кофактору (тетрагидробиоптерину), так что локальные концентрации тирозина становятся ограничивающими (несколько групп префронтальных дофаминергических нейронов обычно активируются необычно часто и, таким образом, всегда чувствительны к контролю предшественников с помощью доступных уровней тирозина). Способность аминокислот-предшественников, триптофана и тирозина, контролировать скорость, с которой нейроны могут производить и высвобождать свои нейромедиаторные продукты, лежит в основе ряда физиологических процессов, а также является потенциальным инструментом для усиления или уменьшения синаптической нейротрансмиссии.
Если нейрон возбуждается с высокой частотой, фермент тирозингидроксилазы многократно фосфорилируется; это заметно увеличивает его сродство к его ограничивающему в других отношениях кофактору (тетрагидробиоптерину), так что локальные концентрации тирозина становятся ограничивающими (несколько групп префронтальных дофаминергических нейронов обычно активируются необычно часто и, таким образом, всегда чувствительны к контролю предшественников с помощью доступных уровней тирозина). Способность аминокислот-предшественников, триптофана и тирозина, контролировать скорость, с которой нейроны могут производить и высвобождать свои нейромедиаторные продукты, лежит в основе ряда физиологических процессов, а также является потенциальным инструментом для усиления или уменьшения синаптической нейротрансмиссии.
- AMP
аденозинмонофосфат
- BBB
гематоэнцефалический барьер
- BH 4
тетрагидробиоптерин
- CSF 900b34
- спинномозговая жидкость
- DOCA
дезоксикортикостерон
- DOPA
дигидроксифенилаланин
- DOPAC
дигидрофенилуксусная кислота
- EMS
Синдром эозинофильной-миалгической кислоты
- -миалгийная
5-миалгийная кислота- 5-HT
5-гидрокситриптамин
- 5-HTP
5-гидрокситриптофан
- HVA
гомованиловая кислота
- IDO
индоламин 2,3-диоксигеназа
- INF-гамма
интерфейс eron-gamma
- L-AAAD
декарбоксилаза ароматических L-аминокислот
- L-DOPA
L-дигидроксифенилаланин
- LAT1
Большой нейтральный переносчик аминокислот 1
LNAA- MAO
моноаминоксидаза
- MOPEG-SO4
3-метокси-4-гидроксифенилэтиленгликоль-сульфат
- NAD
Никотинамид
NAD
аденин-дин-нуклеоэфир
жирные кислоты
- NMDA
N -метил-D-аспартат
- PAH
фенилаланингидроксилаза
- PKU
фенилкетонурия
- SOD
- Superoxide
- T
- тирозинаминотрансфераза
- TDO
триптофандиоксигеназа
- TH
тирозингидроксилаза
- TNF-альфа
фактор некроза опухоли-альфа
- TPH
триптофангидроксилаза
Большая нейтральная аминокислота
Это предварительный просмотр содержимого подписки войдите в систему
, чтобы проверить доступ.
Примечания
Выражение признательности
Исследования, описанные в этом обзоре, были частично поддержаны исследовательскими грантами Национальных институтов психического здоровья (грант MH-28783) и Благотворительного фонда Центра исследований мозга и метаболизма, а также грантом NIH Центр клинических исследований Массачусетского технологического института (грант M01-RR-01066).
Ссылки
Abita J-P, Milstein S, Chang N, Kaufman S. 1976. Активация in vitro фенилаланингидроксилазы печени крысы путем фосфорилирования.J Biol Chem 251: 5310–5314.
PubMedGoogle ScholarAcworth IN, Во время MJ, Wurtman RJ. 1988. Тирозин: Влияние на высвобождение катехоламинов. Brain Res Bull 21: 473–477.
PubMedGoogle ScholarAgharanya JC, Wurtman RJ. 1982а. Влияние однократного введения нейтральных и других аминокислот на экскрецию катехоламинов с мочой. Life Sci 30: 739–746.
PubMedGoogle ScholarAgharanya JC, Wurtman RJ.
PubMedGoogle Scholar 1982b. Исследования механизма, посредством которого тирозин повышает уровень катехоламинов в моче.Биохим Фарм 31: 3577–3580.
1982b. Исследования механизма, посредством которого тирозин повышает уровень катехоламинов в моче.Биохим Фарм 31: 3577–3580.Agharanya JC, Alonso R, Wurtman RJ. 1981. Изменения в экскреции катехоламинов после кратковременного приема тирозина у нормально питающихся людей. Am J Clin Nutr 34: 82–87.
PubMedGoogle ScholarАлмас Б., Ле Бурдель Б., Флатмарк Т., Маллет Дж., Хаавик Дж. 1992. Регулирование рекомбинантных изоферментов тирозингидроксилазы человека путем связывания катехоламинов и исследований структуры / активности фосфорилирования и механистических последствий.Eur J Biochem 209: 249–255.
PubMedGoogle ScholarAlonso R, Agharanya JC, Wurtman RJ. 1980. Тирозиновая нагрузка увеличивает выведение катехоламинов крысами. J Neural Transm 49: 31–43.
PubMedGoogle ScholarAlonso R, Gibson C, Wurtman RJ, Agharanya JC, Prieto L. 1982. Повышение содержания катехоламинов в моче и их метаболитов после введения тирозина людям.
Google Scholar Biol Psych 17: 781–790.
Biol Psych 17: 781–790.Amer A, Breu J, McDermott J, Wurtman RJ, Maher TJ.2004. 5-Гидрокситриптофан, повышает уровень 5-HTP в плазме у людей и крыс и подавляет потребление пищи гипофагическими и стрессированными крысами. Pharm Biochem Behav 77: 137–143.
Google ScholarЭймс М.М., Лернер П., Ловенберг В. 1978. Активация тирозингидроксилазы фосфорилированием белка и ингибированием конечного продукта. J Biol Chem 253: 27–31.
PubMedGoogle ScholarАндерссон К.К., Кокс Д.Д., Ку Л. мл., Флатмарк Т., Хаавик Дж. 1988. Резонансные рамановские исследования сине-зеленой тирозин-3-монооксигеназы надпочечников крупного рогатого скота (тирозингидроксилаза).Доказательства того, что ингибиторы обратной связи адреналин и норадреналин координируются с железом. J Biol Chem 263: 18621–18626.
PubMedGoogle ScholarAshcroft GW, Eccleston D, Crawford TBB. 1965. 5 – Метаболизм гидроксииндола в головном мозге крысы. Изучение промежуточного метаболизма с использованием метода нагрузки триптофана-I.
PubMedGoogle Scholar Журнал Neurochem 12: 483–492.
Журнал Neurochem 12: 483–492.Axelrod J, Shein HM, Wurtman RJ. 1969. Стимуляция синтеза C
14–мелатонина из C
14–триптофана норадреналином в пинеальной железе крысы в органной культуре.Proc Natl Acad Sci USA 62: 544–549.
PubMedCentralPubMedGoogle ScholarAyling JE, Pirson WD, Al-Janabi JM, Helfand GD. 1974. Сравнение почек фенилаланингидроксилазы человека и крысы с ферментом печени. Биохимия 13: 78–85.
PubMedGoogle ScholarBadawy AA-B, Williams DL. 1982. Повышение синтеза катехоламинов в головном мозге крыс путем введения малых доз тирозина и доказательство субстратного ингибирования активности тирозингидроксилазы большими дозами аминокислоты.Biochem J 206: 165–168.
PubMedCentralPubMedGoogle ScholarBailey SW, Dillard SB, Bradford-Thomas K, Ayling JE. 1989. Изменения в домене связывания кофактора тирозингидроксилазы полосатого тела крупного рогатого скота при физиологическом pH после цАМФ-зависимого фосфорилирования, картированного аналогами тетрагидробиоптерина.
PubMedGoogle Scholar Биохимия 28: 494–504.
Биохимия 28: 494–504.Бараццони Р., Занетти М., Ветторе М., Тессари П. 1998. Взаимосвязь между гидроксилированием фенилаланина и концентрацией ароматических аминокислот в плазме у людей.Метаболизм 47: 669–674.
PubMedGoogle ScholarБеларби А., Бек Г., Бергманн С., Боллак С. 1979. Внутренние формы растворимой и митохондриальной тирозин-аминотрансферазы из тканей крысы. FEBS Lett 104: 59–65.
PubMedGoogle ScholarBernheimer H, Birkmayer W., Hornykiewicz O, Jellinger K, Seitelberger F. 1973. Дофамин мозга и синдромы Паркинсона и Хантингтона. Клинические, морфологические и нейрохимические корреляции. J Neurol Sci 20: 415–455.
PubMedGoogle ScholarБерри EM, Growdon JH, Wurtman JJ, Caballero B, Wurtman RJ.1991. Сбалансированные углеводы: белковая диета в лечении болезни Паркинсона. Неврология 41: 1295–1297.
PubMedGoogle ScholarBiggio G, Porceddu ML, Gessa GL. 1976. Уменьшение содержания гомованилиновой, дигидроксифенилуксусной кислоты и циклического аденозин-3,5′-монофосфата в хвостатом ядре крысы, вызванное однократным введением смеси аминокислот, не содержащей тирозина и фенилаланина.
PubMedGoogle Scholar Журнал Neurochem 26: 1253–1255.
Журнал Neurochem 26: 1253–1255.Bjork JM, Dougherty DM, Moeller G, Swann AC.2000. Дифференциальные поведенческие эффекты истощения и нагрузки триптофана в плазме у агрессивных и неагрессивных мужчин. Нейропсихофармакология 22: 357–369.
PubMedGoogle ScholarBlasberg R, Lajtha A. 1966. Гетерогенность опосредованных транспортных систем захвата аминокислот в мозге. Brain Res 1: 86–104.
PubMedGoogle ScholarBoado RJ, Li JY, Nagaya M, Zhang C, Pardridge WM. 1999. Селективное выражение большого транспорта нейтральных аминокислот через гематоэнцефалический барьер.Proc Natl Acad Sci USA 96: 12079–12084.
PubMedCentralPubMedGoogle ScholarBramwell GJ. 1974. Факторы, влияющие на активность 5 – HT-содержащих нейронов. Brain Res 79: 515–519.
PubMedGoogle ScholarBrzezinski A, Shalitin N, Ever-Hadani P, Schenker JG. 1990. Концентрации триптофана в плазме и диета. Brit Med J 301: 183
PubMedCentralPubMedGoogle ScholarBurkin DJ, Kimbro KS, Barr BL, Jones C, Taylor MW, et al.
PubMedGoogle Scholar 1993 г.Локализация гена индоламин-2,3-диоксигеназы (IDO) человека в перицентромерной области хромосомы 8 человека. Геномика 17: 262–263.
1993 г.Локализация гена индоламин-2,3-диоксигеназы (IDO) человека в перицентромерной области хромосомы 8 человека. Геномика 17: 262–263.Caballero B, Wurtman RJ. 1988. Контроль фенилаланина в плазме. Диетический фенилаланин и функция мозга. Вуртман Р.Дж., редактор. Бостон / Базель: Биркхаузер; С. 3–12.
Google ScholarCaballero B, Finer N, Wurtman RJ. 1988. Аминокислоты в плазме и уровни инсулина при ожирении: реакция на потребление углеводов и добавки триптофана.Метаболизм 37: 672–676.
PubMedGoogle ScholarCaballero B, Gleason RE, Wurtman RJ. 1991. Концентрации аминокислот в плазме у здоровых пожилых мужчин и женщин. Am J Clin Nutr 53: 1249–1252.
PubMedGoogle ScholarCarlin JM, Ozaki Y, Byrne GI, Brown RR, Borden EC. 1989. Интерфероны и индоламин-2,3-диоксигеназа: роль в противомикробных и противоопухолевых эффектах. Experientia 45: 535–541.
PubMedGoogle ScholarКарлссон А.
PubMedGoogle Scholar , Линдквист М.1978. Действие антидепрессантов на синтез моноаминов мозга. J Neural Transm 43: 73–91.
, Линдквист М.1978. Действие антидепрессантов на синтез моноаминов мозга. J Neural Transm 43: 73–91.Карлссон А., Линдквист М., Магнуссон Т., Вальдек Б. 1958. О наличии 3-гидрокситирамина в мозге. Science 127: 471
PubMedGoogle ScholarКарпентер Л.Л., Андерсон Г.М., Пелтон Г.Х., Гудин Дж.А., Кирвин П.Д., Прайс Л.Х., Хенингер Г.Р., Макдугл С.Дж. 1998. Истощение запасов триптофана во время непрерывного отбора проб спинномозговой жидкости у здоровых людей. Нейропсихофармакология 19: 26-35.
Google ScholarЦентры контроля заболеваний (CDC). 1989. Синдром эозинофилии-миалгии: Нью-Мексико. Morb Mortal Wkly Rep 38: 765–767.
Google ScholarЧиодо Л.А., Бэннон М.Дж., Грейс А.А., Рот Р.Х., Банни Б.С. 1984. Доказательства отсутствия регулирующих импульсы соматодендритных и модулирующих синтез ауторецепторов нервных окончаний в субпопуляциях мезокортикальных дофаминовых нейронов. Неврология 12: 1–16.
PubMedGoogle ScholarClarke JTR, Bier DM.
кольцо 1982. Превращение фенилаланина в тирозин у человека. Прямое измерение с помощью непрерывных внутривенных инфузий L- [
1982. Превращение фенилаланина в тирозин у человека. Прямое измерение с помощью непрерывных внутривенных инфузий L- [—
2H
5] фенилаланин и L- [1–
13C] тирозин в постабсорбционном состоянии. Метаболизм 31: 999–1005.
PubMedGoogle ScholarColmenares JL, Wurtman RJ. 1979. Связь между уровнями 5-гидроксииндолуксусной кислоты в моче и соотношением триптофана к другим крупным нейтральным аминокислотам, попадающим в желудок.Метаболизм 28: 820–827.
PubMedGoogle ScholarComings DE, Muhleman D, Dietz GW Jr, Donlon T. 1991. Человеческая триптофаноксигеназа, локализованная в 4q31: возможные последствия для алкоголизма и других поведенческих расстройств. Геномика 9: 301–308.
PubMedGoogle ScholarConlay LA, Maher TJ, Wurtman RJ. 1981. Тирозин повышает кровяное давление у гипотензивных крыс. Наука 212: 559–560.
PubMedGoogle ScholarConlay LA, Maher TJ, Wurtman RJ.
PubMedGoogle Scholar 1984. Прессорный эффект тирозина у гипотензивных крыс не опосредуется тирамином. Life Sci 35: 1207–1212.
1984. Прессорный эффект тирозина у гипотензивных крыс не опосредуется тирамином. Life Sci 35: 1207–1212.Coppen A, Whybrow PC, Noguera R, Maggs R, Prange AJ Jr. 1972. Сравнительная антидепрессивная ценность
L-триптофана и имипрамина с попыткой потенцирования лиотиронином и без нее. Arch Gen Psychiatry 26: 234–241.
PubMedGoogle ScholarДе Йонг В., Зандберг П., Бохус Б. 1975. Роль норадреналина в центральном контроле артериального давления у нормотензивных и спонтанно гипертензивных крыс.Arch Int Pharmacodyn Ther 213: 272–284.
PubMedGoogle ScholarDelgado PD, Price LH, Miller HL, Salomon RM, Licinio J, et al. 1991. Быстрое истощение серотонина как провокационный тест для пациентов с большой депрессией: актуальность для антидепрессивного действия и нейробиологии депрессии. Psychopharmacol Bull 27: 321–330.
PubMedGoogle ScholarДемиш К., Бауэр Дж, Георги К., Демиш Л. 1987. Лечение тяжелой хронической бессонницы L-триптофаном: результаты двойного слепого перекрестного исследования.
PubMedGoogle Scholar Фармакопсихиатрия 20: 242–244.
Фармакопсихиатрия 20: 242–244.Demling J, Langer K, Mehr MQ. 1996. Возрастная зависимость уровней больших нейтральных аминокислот в плазме. Сосредоточьтесь на триптофане. Достижения экспериментальной медицины и биологии, Vol. 398. Филиппини Г.А., Коста CVL, Бертаццо А., редакторы. Нью-Йорк: Пленум Пресс; С. 579–582.
Google ScholarДе Пьетро FR, Fernstrom JD. 1998. Влияние фенилаланина на синтез ДОФА в клетках PC12. Neurochem Res 23: 1011–1020.
Google ScholarDhondt JL, Dautrevaux M, Biserte G, Farriaux JP. 1978. Аналоги фенилаланина как ингибиторы фенилаланин-гидроксилазы из печени крысы. Новые выводы о кинетическом поведении фермента. Biochimie 60: 787–794.
PubMedGoogle ScholarDietrich J-B. 1992. Тирозинаминотрансфераза: трансаминаза среди других? Cell Mol Biol 38: 95–114.
PubMedGoogle ScholarDong-Ruyl L, Sawada M, Nakano K. 1998. Триптофан и его метаболит кинуренин стимулируют экспрессию фактора роста нервов в культивируемых астроглиальных клетках мышей.
PubMedGoogle Scholar Neurosci Lett 244: 17–20.
Neurosci Lett 244: 17–20.Докеланд А.П., Дёскланд С.О., Огрейд Д., Флэтмарк Т. 1984. Влияние лигандов фенилаланин-4-монооксигеназы на цАМФ-зависимое фосфорилирование фермента. J Biol Chem 259: 11242–11248.
PubMedGoogle ScholarDunkley PR, Bobrovskaya L, Graham ME, von Nagy-Felsobuki EI, Dickson PW. 2004. Фосфорилирование тирозингидроксилазы: регуляция и последствия. J Neurochem 91: 1025–1043.
PubMedGoogle ScholarВо время MJ, Acworth IN, Wurtman RJ.1988. Введение фенилаланина влияет на высвобождение дофамина в полосатом теле крысы. Neurosci Lett 93: 91–95.
PubMedGoogle ScholarВо время MJ, Acworth IN, Wurtman RJ. 1989. Высвобождение дофамина в полосатом теле крысы: физиологическая связь с поставкой тирозина. Журнал Neurochem 52: 1449–1454.
PubMedGoogle ScholarEidson M, Philen RM, Sewell CM, Voorhees R, Kilbourne EM. 1990.
l-Триптофан и синдром эозинофилии-миалгии в Нью-Мексико.
PubMedGoogle Scholar Ланцет 335: 645–648.
Ланцет 335: 645–648.Elliott TR. 1912. Контроль над надпочечниками внутренними нервами. J. Physiol (Лондон) 44: 374–409.
Google ScholarFarber SA, Savci V, Wei A, Slack BE, Wurtman RJ. 1996. Фосфорилирование холина в срезах полосатого тела крысы регулируется активностью холинергических нейронов. Brain Res 723: 90–99.
PubMedGoogle ScholarFernstrom JD, Faller DV. 1978. Нейтральные аминокислоты в мозге: изменения в ответ на прием пищи.Журнал Neurochem 30: 1531–1538.
PubMedGoogle ScholarFernstrom JD, Wurtman RJ. 1971a. Содержание серотонина в мозге: физиологическая зависимость от уровня триптофана в плазме. Наука 173: 149–152.
PubMedGoogle ScholarFernstrom JD, Wurtman RJ. 1971b. Содержание серотонина в мозге: повышается после углеводной диеты. Наука 174: 1023–1025.
PubMedGoogle ScholarFernstrom JD, Wurtman RJ. 1972a. Повышение уровня триптофана в плазме инсулином у крыс.
PubMedGoogle Scholar Метаболизм 21: 337–342.
Метаболизм 21: 337–342.Fernstrom JD, Wurtman RJ. 1972b. Содержание серотонина в мозге: физиологическая регуляция нейтральными аминокислотами плазмы. Наука 178: 414–416.
PubMedGoogle ScholarFernstrom JD, Hirsch MJ, Faller DV. 1976. Концентрации триптофана в мозге крысы не могут коррелировать со свободным триптофаном в сыворотке или его соотношением к сумме других нейтральных аминокислот в сыворотке. Biochem J 160: 589–595.
PubMedCentralPubMedGoogle ScholarFernstrom JD, Wurtman RJ, Hammarstrom-Wiklund Rand WM, Munro HN, et al.1979. Суточные колебания концентраций триптофана, тирозина и других нейтральных аминокислот в плазме: влияние потребления белка с пищей. Am J Clin Nutr 32: 1912–1922.
PubMedGoogle ScholarFernstrom MH, Fernstrom JD. 1995. Влияние хронического употребления белка на уровни тирозина в центральной нервной системе крыс и скорость гидроксилирования тирозина in vivo. Brain Res 672: 97–103.
PubMedGoogle Scholar
Fishman B, Wurtman RJ, Munro HN. 1969. Суточные ритмы в профилях полисомов печени и активности тирозинтрансаминаз: роль диетического белка.Proc Natl Acad Sci USA 64: 677–682.
PubMedCentralPubMedGoogle ScholarFuller RW, Snoddy HD. 1968. Изменение суточного ритма кормления тирозин-альфа-кетоглутарат трансаминазой печени крысы. Science 159: 738
PubMedGoogle ScholarFuller RW, Snoddy HD. 1982.
l-Тирозин Повышение концентрации 3,4-дигидроксифенилуксусной кислоты в головном мозге крысы спипероном и амфонелевой кислотой. J Pharm Pharmacol 34: 117–118.
PubMedGoogle ScholarGallager DW, Aghajanian GK.1976. Ингибирование возбуждения нейронов шва триптофаном и 5-гидрокситриптофаном: блокада путем ингибирования синтеза серотонина с помощью Ro-4-4602. Нейрофармакология 15: 149–156.
PubMedGoogle ScholarГариботто Г., Тессари П., Верзола Д., Дертенуа Л. 2002. Метаболическое превращение фенилаланина в тирозин в почках человека: имеет ли это влияние на питание у пациентов с заболеваниями почек? Дж.
PubMedGoogle Scholar Рен Нутр 12: 8–16.
Рен Нутр 12: 8–16.Gessa FL, Biggio G, Fadda F, Corsini GU, Tagliamonte A.1974. Влияние перорального приема смесей аминокислот, не содержащих триптофана, на метаболизм тирптофана, триптофана в мозге и серотонина. Журнал Neurochem 22: 869–870.
PubMedGoogle ScholarGibson CJ, Wurtman RJ. 1977. Физиологический контроль синтеза катехолов в мозге по концентрации тирозина в мозге. Биохим Фарм 26: 1137–1142.
PubMedGoogle ScholarGibson CJ, Wurtman RJ. 1978. Физиологический контроль синтеза норэпинефрина в мозге по концентрации тирозина в мозге.Life Sci 22: 1399–1406.
PubMedGoogle ScholarГибсон С.Дж., Уоткинс С.Дж., Вуртман Р.Дж. 1983. Введение тирозина увеличивает синтез и высвобождение дофамина в сетчатке глаза крыс, активируемой светом. J Neural Trans 56: 153–160.
Google ScholarGijsman HJ, Scarnà A, Harmer CJ, McTavish SFB, Odontiadis J, et al. 2002. Исследование по подбору доз воздействия аминокислот с разветвленной цепью на суррогатные маркеры дофаминовой функции мозга.
Google Scholar Психофармакология (Берл) 160: 192–197.
Психофармакология (Берл) 160: 192–197.Glaeser BS, Melamed E, Growdon JH, Wurtman RJ. 1979. Повышение уровня тирозина в плазме после однократного перорального приема
л-тирозина. Life Sci 25: 265–271.
PubMedGoogle ScholarГудман Д.С. 1958. Взаимодействие сывороточного альбумина человека с анионами длинноцепочечных жирных кислот. J Am Chem Soc 80: 3892–3898.
Google ScholarGoodwin GM, Cowen PJ, Fairburn CG, Parry-Billings M, Calder PC, et al. 1990. Концентрации триптофана в плазме и диета.Br Med J 300: 1499–1500.
Google ScholarGrahame-Smith DG, Parfitt AG. 1970. Транспорт триптофана через синаптосомную мембрану. Журнал Neurochem 17: 1339–1353.
PubMedGoogle ScholarGrange T, Guenet C, Dietrich JB, Chasserot S, Fromont M, et al. 1985. Полная комплементарная ДНК матричной РНК тирозинаминотрансферазы крысы. Выведение первичной структуры фермента. J Mol Biol 184: 347–350.
PubMedGoogle Scholar
Грин Х, Гринберг С. М., Эриксон Р. У., Сойер Дж. Л., Эллисон Т.1962. Влияние диетического фенилаланина и триптофана на уровни аминов в мозгу крысы. J Pharmacol Exp Ther 136: 174–178.
PubMedGoogle ScholarGrima B, Lamouroux A, Blanot F, Biguet NF, Malli J. 1985. Полная кодирующая последовательность мРНК тирозингидроксилазы крысы. Proc Natl Acad Sci USA 82: 617–621.
PubMedCentralPubMedGoogle ScholarGrowdon JH, Melamed E, Logue M, Hefti F, Wurtman RJ. 1982. Влияние перорального введения L-тирозина на уровни тирозина и гомованилловой кислоты в спинномозговой жидкости у пациентов с болезнью Паркинсона.Life Sci 30: 827–832.
PubMedGoogle ScholarGuidetti P, Eastman CL, Schwarcz R. 1995. Метаболизм [5–
3H] кинуренина в головном мозге крысы in vivo: доказательства существования функционального кинруенинового пути. J Neurochem 65: 2621–2632.
PubMedGoogle ScholarGuroff G, Udenfriend S.
PubMedGoogle Scholar 1962. Исследования поглощения ароматических аминокислот мозгом крысы in vivo. Поглощение фенилаланина и триптофана; Подавление и стереоселективность поглощения тирозина мозгом и мышцами.J Biol Chem 237: 803–806.
1962. Исследования поглощения ароматических аминокислот мозгом крысы in vivo. Поглощение фенилаланина и триптофана; Подавление и стереоселективность поглощения тирозина мозгом и мышцами.J Biol Chem 237: 803–806.Harris JE, Morgenroth VH, Baldessarini RJ, Roth RH. 1974. Регулирование синтеза катехоламинов в мозге крысы in vitro с помощью циклического АМФ. Nature 252: 156–158.
PubMedGoogle ScholarХартманн Э, Гринвальд Д. 1984. Триптофан и человеческий сон: анализ 43 исследований. Прогресс в исследованиях триптофана и серотонина. Schlossberger W, Kochen B, Steonhart E, редакторы. Берлин: Вальтер де Грюйтер; С. 297–304.
Google ScholarHayaishi O, Rothberg S, Mehler AH, Saito Y.1957. Исследования по оксигеназам; ферментативное образование кинуренина из триптофана. J Biol Chem 229: 889–896.
PubMedGoogle ScholarHayashi S-I, Granner DK, Tomkins GM. 1967. Тирозинаминотрансфераза. J Biol Chem 242: 3998–4006.
PubMedGoogle Scholar
Hefti F, Melamed E, Wurtman RJ. 1980. Декарбоксилирование ДОФА в паркинсоническом мозге: исследования in vivo на модели животных. J Neur Trans Suppl 16: 95–101.
Google ScholarHolten D, Kenney FT.1967. Регулирование тирозин-α-кетоглутарат трансаминазы в печени крыс VI. Индукция гормонами поджелудочной железы. J Biol Chem 19: 4372–4377.
Google ScholarHrboticky N, Leiter LA, Anderson GH. 1985. Влияние
L-триптофана на кратковременное потребление пищи у худощавых мужчин. Nutr Res (Los Angel) 5: 595–607.
Google ScholarHufton SE, Jennings IG, Cotton RGH. 1995. Структура и функция гидроксилаз ароматических аминокислот. Biochem J 311: 353–366.
PubMedCentralPubMedGoogle ScholarHull KM, Maher TJ. 1990.
l-Тирозин усиливает анорексию, вызванную симпатомиметическими препаратами смешанного действия у гиперфагических крыс. J Pharmacol Exp Ther 255: 403–409.
PubMedGoogle ScholarHull KM, Maher TJ.
l 1991.
1991.-Тирозин не потенцирует некоторые периферические действия симпатомиметиков. Pharmacol Biochem Behav 39: 755–759.
PubMedGoogle ScholarHull KM, Maher TJ.1992. Влияние
L-тирозина на прессорное действие смешанного действия, вызванное симпатомиметиками. Pharmacol Biochem Behav 43: 1047–1052.
PubMedGoogle ScholarIchikawa S, Sasaoka T, Nagatsu T. 1991. Первичная структура тирозингидроксилазы мыши, выведенная из ее кДНК. Biochem Biophys Res Commun 176: 1610–1616.
PubMedGoogle ScholarИкеда М., Левитт М., Уденфренд С. 1967. Фенилаланин как субстрат и ингибитор тирозингидроксилазы. Arch Biochem Biophys 120: 420–427.
PubMedGoogle ScholarИваки М., Парняк М.А., Кауфман С. 1985. Исследования первичной структуры фенилаланингидроксилазы печени крысы. Biochem Biophys Res Commun 126: 922–932.
PubMedGoogle ScholarJaskiw GE, Collins KA, Pehek EA, Yamamoto BK. 2001. Тирозин увеличивает острую выработку дофамина, вызванную клозапином, но не галоперидолом, в медиальной префронтальной коре головного мозга крысы: исследование микродиализа in vivo.
PubMedGoogle Scholar Нейропсихофармакология 25: 149–156.
Нейропсихофармакология 25: 149–156.Jedlicki E, Kaufman S, Milstein S.1977. Частичная очистка и характеристика фосфатазы фенилаланингидроксилазы печени крысы. J Biol Chem 252: 7711–7714.
Google ScholarJohnson RW, Roberson LE, Kenney FT. 1973. Регулирование тирозинаминотрансферазы в Х-характеристиках печени крыс и взаимном превращении множественных форм ферментов. J Biol Chem 248: 4521–4527.
PubMedGoogle ScholarKanai Y, Segawa H, Miyamoto K-I, Uchino H, Takeda E, et al. 1998. Клонирование экспрессии и характеристика переносчика больших нейтральных аминокислот, активируемых антигеном тяжелой цепи 4F2 (CD98).J Biol Chem 273: 23629–23632.
PubMedGoogle ScholarКанеда Н., Кобаяши К., Ичиносе Х., Киши Ф., Накадзава А. и др. 1987. Выделение нового клона кДНК для тирозингидроксилазы человека: альтернативный сплайсинг РНК дает четыре вида мРНК из одного гена. Biochem Biophys Res Commun 146: 971–975.
PubMedGoogle Scholar
Kappock TJ, Caradonna JP. 1996. Птерин-зависимые аминокислотные гидроксилазы. Chem Rev 96: 2659–2756.
PubMedGoogle ScholarКац И., Ллойд Т., Кауфман С.1976. Исследования гидроксилирования фенилаланина и тирозина тирозингидроксилазой головного мозга крысы. Biochim Biophys Acta 445: 567–578.
PubMedGoogle ScholarКауфман С. 1986. Регулирование активности фенилаланингидроксилазы печени. Достижения в регуляции ферментов, Vol. 25. Вебер Г., редактор. Элмсфорд, штат Нью-Йорк: Pergamon Press; С. 37–65.
Google ScholarKenney FT. 1967. Оборот тирозинтрансаминазы печени крысы: стабилизация после ингибирования синтеза белка.Наука 156: 525–528.
PubMedGoogle ScholarKenney FT, Flora RM. 1961. Индукция тирозин-α-кетоглутарат трансаминазы в печени крысы I. Гормональная природа. J Biol Chem 236: 2699–2702.
PubMedGoogle ScholarKim JH, Miller LL. 1969. Функциональное значение изменений активности ферментов триптофанпирролазы и тирозинтрансаминазы после индукции у интактных крыс и в изолированной перфузированной печени крыс.
PubMedGoogle Scholar J Biol Chem 244: 1410–1416.
J Biol Chem 244: 1410–1416.Ким В., Эрландсен Х., Сурендран С., Стивенс Р.С., Гамез А. и др.2004. Тенденции в энзимотерапии фенилкетонурии. Мол Тер 10: 220–224.
PubMedGoogle ScholarКлеппе Р., Тоска К., Хаавик Дж. 2001. Взаимодействие фосфорилированной тирозингидроксилазы с 14–3–3 белками: данные о фосфосерин-40-зависимой ассоциации. J Neurochem 77: 1097–1107.
PubMedGoogle ScholarKnott PJ, Curzon G. 1972. Свободный триптофан в плазме и метаболизме триптофана в мозге. Природа 239: 452–453.
PubMedGoogle ScholarKnox WE, Auerbach VH.1955. Гормональный контроль триптрофанпероксидазы у крыс. J Biol Chem 214: 307–313.
PubMedGoogle ScholarKotake Y, Masayama T. 1936. Uber den Mechanus der kynurenin-bildung aus триптофан Z. Physiol Chem 243: 237–244.
Google ScholarKowlessur D, Kaufman S. 1999. Клонирование и экспрессия рекомбинантной триптофангидроксилазы пинеальной железы человека в Escherischia coli: очистка и характеристика клонированного фермента. Biochim Biophys Acta. 1434: 317–330.
PubMedGoogle ScholarKowlessur D, Citron BA, Kaufman S. 1996. Рекомбинантная фенилаланингидроксилаза человека: новые регуляторные и структурные свойства. Arch Biochem Biophys 333: 85–95.
PubMedGoogle ScholarКрогер Х., Грац Р. 1980. Об индукции тирозинаминотрансферазы (ТАТ) триптофаном и метионином. Int J Biochem 12: 575–582.
PubMedGoogle ScholarКветнанский Р., Армандо И., Вайсе В.К., Холмс С., Фукухара К. и др.1992. Плазменная реакция допа во время стресса: зависимость от симпатоневральной активности и гидроксилирования тирозина. J Pharmacol Exp Ther 261: 899–909.
PubMedGoogle ScholarKwidzinski E, Bunse J, Aktas O, Richter D, Mutlu L, 2005. Индоламин-2,3-диоксигеназа экспрессируется в ЦНС и подавляет аутоиммунное воспаление. FASEB J 19: 1347-1349.
Google ScholarLe Bourdelles B, Horellou P, Le Caer J-P, Denèfle P, Latta M и др. 1991. Фосфорилирование изоформ 1 и 2 рекомбинантной тирозингидроксилазы человека: дополнительный фосфорилированный остаток в изоформе 2, полученный путем альтернативного сплайсинга.J Biol Chem. 266: 17124–17130.
PubMedGoogle ScholarLevitt M, Spector S, Sjoerdsma A, Udenfiend S. 1965. Выяснение лимитирующего шага в биосинтезе норэпинефрина в перфузируемом сердце морской свинки. J Pharmacol Exp Ther 148: 1–8.
PubMedGoogle ScholarLidsky AS, Law ML, Morse HG, Kao F-T, Rabin M, et al. 1985. Региональное картирование гена фенилаланингидроксилазы и локуса фенилкетонурии в геноме человека. Proc Natl Acad Sci USA 82: 6221–6225.
PubMedCentralPubMedGoogle ScholarLieberman HR, Corkin S, Spring BJ, Growdon JH, Wurtman RJ. 1982/1983. Настроение, работоспособность и болевая чувствительность: изменения, вызванные компонентами пищи. J Psychiat Res 17: 135–145.
Google ScholarЛиберман Х. Р., Коркин С., Спринг Б. Дж., Вуртман Р. Дж., Гроудон Дж. Х. 1985. Влияние диетических предшественников нейромедиаторов на поведение человека. Am J Clin Nutr 42: 366–370.
PubMedGoogle ScholarLieberman HR, Wurtman JJ, Chew B.1986. Изменения настроения после употребления углеводов у тучных людей. Am J Clin Nutr 44: 772–778.
PubMedGoogle ScholarLin ECC, Knox WE. 1957. Адаптация тирозин-α-кетоглутарат трансаминазы печени крысы. Biochim Biophysic Acta 26: 85–88.
Google ScholarLin ECC, Knox WE. 1958. Специфика адаптивного ответа тирозин-α-кетоглутарат трансаминазы у крыс. J Biol Chem 233: 1186–1189.
PubMedGoogle ScholarLipsett D, Madras BK, Wurtman RJ, Munro HM.1973. Уровень триптофана в сыворотке после приема углеводов: Избирательное снижение уровня триптофана, не связанного с альбумином, совпадающее со снижением уровня свободных жирных кислот в сыворотке. Life Sci 12: 57–64.
Google ScholarЛлойд Т., Кауфман С. 1975. Доказательства отсутствия прямого фосфорилирования хвостатой тирозингидроксилазы крупного рогатого скота после активации под воздействием условий ферментативного фосфорилирования. Biochem Biophys Res Commun 66: 907–913.
PubMedGoogle ScholarЛоренцо А.В.1974. Механизмы транспорта аминокислот спинномозговой жидкости. Fed Proc 33: 2079–2085.
PubMedGoogle ScholarLynch HJ, Wurtman RJ, Moskowitz MA, Archer MC, Ho HM. 1975. Суточный ритм мелатонина в моче человека. Наука 187: 169–171.
PubMedGoogle ScholarMac Kenzie CR, Hucke C, Müller D, Seidel K, Takikawa O, et al. 1999. Подавление роста мультирезистентных энтерококков активированными интерфероном-γ человеческими уроэпителиальными клетками. J Med Microbiol 48: 935–941.
Google ScholarMadras BK, Cohen EL, Fernstrom JD, Larin F, Munro HN, et al. 1973. Углеводы в пище повышают уровень триптофана в мозге и снижают содержание триптофана в сыворотке крови. Природа 244: 34–35.
PubMedGoogle ScholarMaher TJ, Glaeser BS, Wurtman RJ. 1984. Суточные колебания концентраций в плазме основных и нейтральных аминокислот и концентраций аспартата и глутамата в красных кровяных тельцах: влияние потребления белка с пищей. Am J Clin Nutr 39: 722–729.
PubMedGoogle ScholarМаркус Ч.Р., Оливье Б., де Хаан EHF. 2002. Сывороточный протеин, богатый α-лактальбумином, увеличивает соотношение триптофана в плазме к сумме других крупных нейтральных аминокислот и улучшает когнитивные способности у подверженных стрессу субъектов. Am J Clin Nutr 75: 1051–1056.
PubMedGoogle ScholarМарлисс Э.Б., Аоки Т.Т., Унгер Р.Х., Зельднер Дж. С., Кэхилл Г. Ф. мл. 1970. Уровни глюкагона и метаболические эффекты у голодного человека. Дж. Клин Инвест 49: 2256–2270.
PubMedCentralPubMedGoogle ScholarMartin-Du-Pan R, Mauron C, Glaeser B, Wurtman RJ. 1982. Влияние различных пероральных доз глюкозы на уровни нейтральных аминокислот в плазме. Метаболизм 31: 937–943.
Google ScholarМастроберардино Л., Спиндлер Б., Пфайфер Р., Скелли П. Дж., Лоффинг Дж. И др. 1998. Транспорт аминокислот гетеродимерами 4F2hc / CD98 и членами семейства пермеаз. Природа 395: 288–291.
PubMedGoogle ScholarMcKinney J, Knappskog PM, Haavik J.2005. Различные свойства центральной и периферической форм триптофангидроксилазы человека. J Neurochem 92: 311–320.
PubMedGoogle ScholarMcMenamy RH, Oncley JL. 1958. Специфическое связывание
L-триптофана с сывороточным альбумином. J Biol Chem 233: 1436–1447.
PubMedGoogle ScholarMcTavish SFB, Mannie ZN, Harmer CJ, Cowen PJ. 2005. Отсутствие влияния истощения тирозина на настроение у выздоровевших депрессивных женщин. Нейропсихофармакология 30: 786–791.
PubMedGoogle ScholarMelamed E, Glaeser B, Growdon JH, Wurtman RJ. 1980a. Тирозин в плазме у нормальных людей: эффекты перорального тирозина и белковой пищи. J Neural Transm 47: 299–306.
PubMedGoogle ScholarMelamed E, Hefti F, Wurtman RJ. 1980b. Введение тирозина увеличивает высвобождение дофамина в полосатом теле у крыс с частичными нигростриатными поражениями. Proc Natl Acad Sci USA 77: 4305–4309.
PubMedCentralPubMedGoogle ScholarMena I, Cotzias GC.1975. Потребление белка и лечение болезни Паркинсона леводопой. N Engl J Med 292: 181–184.
PubMedGoogle ScholarMilner JD, Wurtman RJ. 1986. Комментарий: Синтез катехоламинов: физиологическая связь с поставкой прекурсоров. Biochem Pharmacol 35: 875–881.
PubMedGoogle ScholarMilner JD, Irie K, Wurtman RJ. 1986. Влияние фенилаланина на высвобождение эндогенного дофамина из срезов полосатого тела крысы. J Neurochem 47: 1444–1448.
PubMedGoogle ScholarMilstein S, Kaufman S.1975. Исследования фенилаланингидроксилазной системы in vivo. Анализ in vivo, основанный на высвобождении дейтерия или трития в воду организма из меченного кольцом
L-фенилаланина. J Biol Chem 250: 4782–4785.
Google ScholarMoja EA, Stoff DM, Gessa GL, Castoldi D, Assereto R, et al. 1988. Снижение уровня триптофана в плазме после смешивания аминокислот без триптофана у человека. Life Sci 42: 1551–1556.
PubMedGoogle ScholarMoldawer LL, Kawamura I, Bistrian BR, Blackburn GR.1983. Вклад фенилаланина в метаболизм тирозина in vivo. Исследования на крысах, подвергшихся постабсорбции и фенилаланину. Biochem J 210: 811–817.
PubMedCentralPubMedGoogle ScholarMorre MC, Wurtman RJ. 1981. Характеристики захвата тирозина синаптосомами в различных областях мозга: влияние других аминокислот. Life Sci 28: 65–75.
PubMedGoogle ScholarMorre MC, Hefti F, Wurtman RJ. 1980. Региональные уровни тирозина в головном мозге крысы после введения тирозина.J Neural Trans 49: 45–50.
Google ScholarMunn DH, Zhou M, Attwood JT, Bondarev I, Conway SJ, et al. 1998. Профилактика аллогенного отторжения плода путем катаболизма триптофана. Наука 281: 1191–1193.
PubMedGoogle ScholarMunn DH, Shafizadeh E, Attwood JT, Bondarev I, Pashine A, et al. 1999. Ингибирование пролиферации Т-клеток катаболизмом триптофана макрофагов. J Exp Med 189: 1363–1372.
PubMedCentralPubMedGoogle ScholarMunro HN.1968. Роль поставки аминокислот в регуляции функции рибосом. Fed Proc 27: 1231–1237.
PubMedGoogle ScholarNagatsu T. 1983. Кофактор биоптерина и моноаминсинтезирующие монооксигеназы. Neurochem Int 5: 27–38.
PubMedGoogle ScholarНагацу Т., Левитт М., Уденфренд С. 1964. Тирозингидроксилаза. Начальный этап биосинтеза норэпинефрина. J Biol Chem 239: 2910–2917.
PubMedGoogle ScholarNatt E, Kao F-T, Rettenmeier R, Scherer G.1986. Отнесение гена тирозинаминотрансферазы человека к хромосоме 16. Hum Genet 72: 225–228.
PubMedGoogle ScholarNishizawa S, Benkelfat C, Young SN, Leyton M, Mzengeza S, et al. 1997. Различия между мужчинами и женщинами в скорости синтеза серотонина в человеческом мозге. Proc Natl Acad Sci USA 94: 5308–5313.
PubMedCentralPubMedGoogle ScholarOrr ML, Watt BK. 1968. Содержание аминокислот в продуктах Министерства сельского хозяйства США. Отчет по исследованию домохозяйства № 4.
Google ScholarПалковиц М., Заборский Л.1977. Нейроанатомия центрального ядра сердечно-сосудистой системы, контролирующего солитарное ядро: афферентные и эфферентные нейрональные связи по отношению к барорецепторной рефлекторной дуге. Prog Brain Res 47: 9–34.
PubMedGoogle ScholarPardridge WM. 1977. Регулирование доступности аминокислот для мозга. Питание и мозг, Vol. 1. Вуртман Р. Дж., Вуртман Дж. Дж., Редакторы. Нью-Йорк: Raven Press; С. 141–204.
Google ScholarPardridge WM. 2001. Инвазивная доставка лекарств в мозг. Направление лекарств для мозга: будущее разработки лекарств для мозга.Пардридж В.М., редактор. Кембридж: Издательство Кембриджского университета; С. 13–35.
Google ScholarПардридж В.М., Фирер Г. 1990. Транспорт триптофана в мозг из циркулирующего пула, связанного с альбумином, у крыс и кроликов. J Neurochem 54: 971–976.
PubMedGoogle ScholarPardridge WM, Oldendorf WH, Cancilla P, Frank HJ. 1986. Гематоэнцефалический барьер: интерфейс между внутренней медициной и мозгом. Ann Intern Med 105: 82–95.
PubMedGoogle ScholarПарняк М.А., Кауфман С.1985. Каталитически активные олигомерные формы фенилаланингидроксилазы. Биохимия 24: 3379A.
Google ScholarПател П.Д., Понтрелло С., Берк С. 2004. Сильная и тканеспецифическая экспрессия TPh3 по сравнению с TPh2 в шве и шишковидной железе крысы. Биол Психиатрия 55: 428–433.
PubMedGoogle ScholarPerkins MN, Stone TW. 1982. Ионтофоретическое исследование действия кинуренинов, вызывающих судороги, и их взаимодействия с эндогенным возбудителем хинолиновой кислотой.Brain Res 247: 184–187.
PubMedGoogle ScholarPfefferkorn ER. 1984. Интерферон γ блокирует рост
Toxoplasma gondiiв человеческих фибробластах, заставляя клетки-хозяева расщеплять триптофан. Proc Natl Acad Sci USA 87: 908–912.
Google ScholarФилиппу А., Дитл Х., Синха Дж. Н.. 1980. Повышение артериального давления увеличивает выброс эндогенных катехоламинов в переднем гипоталамусе кошки Наунин Шимидеберг. Arch Pharmacol 310: 237–240.
Google ScholarRapoport MI, Feigin RD, Bruton J, Beisel WR. 1966. Циркадный ритм активности триптофан пирролазы и ее циркулирующий субстрат. Наука 153: 1642–1644.
PubMedGoogle ScholarRassoulpour A, Wu H-Q, Ferre S, Schwarcz R. 2005. Наномолярные концентрации кинуреновой кислоты снижают уровни внеклеточного дофамина в полосатом теле. J Neurochem 93: 762–765.
PubMedGoogle ScholarReinstein DK, Lehnert H, Scott NA, Wurtman RJ.1984. Тирозин предотвращает поведенческие и нейрохимические корреляты острого стресса у крыс. Life Sci 34: 2225–2232.
PubMedGoogle ScholarReinstein DK, Lehnert H, Wurtman RJ. 1985. Диетический тирозин подавляет повышение уровня кортикостерона в плазме после острого стресса у крыс. Life Sci 37: 2157-2163.
Google ScholarRosenthal NE, Sack DA, Gillin JC, Lewy AJ, Goodwin FK, et al. 1984. Сезонное аффективное расстройство. Arch Gen Psychiatry 41: 72–80.
PubMedGoogle ScholarRoss DS, Fernstrom JD, Wurtman RJ.1973. Роль пищевого белка в формировании суточных ритмов триптофанпирролазы и тирозинтрансаминазы печени крысы. Метаболизм 22: 1175–1184.
PubMedGoogle ScholarСааведра Дж. М., Аксельрод Дж. 1974. Триптамин в мозге и эффекты лекарств. Adv Biochem Psychopharmacol 10: 135–139.
PubMedGoogle ScholarSayegh R, Schiff I, Wurtman J, Spiers P, McDermott J, et al. 1995. Влияние богатого углеводами напитка на настроение, аппетит и когнитивные функции у женщин с предменструальным синдромом.Obstet Gynecol 86: 520–528.
PubMedGoogle ScholarScally MC, Wurtman RJ. 1977 г. Уровень тирозина в мозге контролирует синтез дофамина в полосатом теле у крыс, получавших галоперидол. J Neural Trans 41: 1–6.
Google ScholarSchaechter JD, Wurtman RJ. 1989. Доступность триптофана модулирует высвобождение серотонина из срезов гипоталамуса крысы. Журнал Neurochem 53: 1925–1933.
PubMedGoogle ScholarSchaechter JD, Wurtman RJ. 1990. Высвобождение серотонина зависит от уровня триптофана в мозге.Brain Res 532: 203–210.
PubMedGoogle ScholarSchimke RT, Sweeney EW, Berlin CM. 1965. Исследования стабильности in vivo и in vitro триптофанпирролазы печени крысы. J Biol Chem 240: 4609–4620.
PubMedGoogle ScholarЗельцер С., Стох Р., Маркус Р., Джексон Э. 1982. Изменение болевых порогов человека путем манипуляции с питанием и добавок L-триптофана. Боль 13: 385–393.
PubMedGoogle ScholarSheehan BD, Tharyan P, McTavish SFB, Campling GM, Cowen PJ.1996. Использование диетических манипуляций для истощения тирозина и фенилаланина в плазме у здоровых субъектов. J Psychopharmacol 10: 231–234.
PubMedGoogle ScholarShiman R, Mortimore GE, Schworer CM, Gray DW. 1982. Регулирование активности фенилаланингидроксилазы фенилаланином in vivo, in vitro и в перфузированной печени крыс. J Biol Chem 257: 11213–11216.
PubMedGoogle ScholarСимидзу Т., Номияма С., Хирата Ф., Хаяиси О. 1978. Индолеамин-2,3-диоксигеназа.Очищение и некоторые свойства. J Biol Chem 253: 4700–4706.
Google ScholarШукитт-Хейл Б., Стиллман MJ, Либерман HR. 1996. Введение тирозина предотвращает вызванное гипоксией снижение обучаемости и памяти. Physiol Behav 59: 867–871.
PubMedGoogle ScholarSilberstein SD, Lemberger L, Klein DC, Axelrod J, Kopin IJ. 1972. Индукция тирозингидроксилазы надпочечников в органной культуре. Нейрофармакология 11: 721–726.
PubMedGoogle ScholarSlutsker L, Hoesly FC, Miller L, Williams P, Watson JC, et al.1990. Синдром эозинофилии-миалгии, связанный с воздействием триптофана от одного производителя. ИАМА 264: 213–217.
PubMedGoogle ScholarSmith KA, Fairburn CG, Cowen PJ. 1997. Рецидив депрессии после быстрого истощения триптофана. Ланцет 349: 915–919.
PubMedGoogle ScholarSpector S, Gordon R, Sjoerdsma A, Udenfriend S. 1967. Ингибирование конечным продуктом тирозингидроксилазы как возможного механизма регуляции синтеза норэпинефрина.Mol Pharmacol 3: 549–555.
PubMedGoogle ScholarSpring B, Wurtman J, Gleason R, Kessler K, Wurtman RJ. 1991. Увеличение веса и симптомы отмены после отказа от курения: профилактическое вмешательство с использованием d-фенфлурамина. Психология здоровья 10: 216–223.
PubMedGoogle ScholarStenfors C, Ross SB. 2002. Доказательства участия ауторецепторов 5-гидрокситриптамина
1Bв усилении оборота серотонина в головном мозге мышей после многократного лечения флуоксетином.Life Sci 71: 2867–2880.
PubMedGoogle ScholarStone TW, Дарлингтон, LG. 2002. Эндогенные кинуренины как мишени для открытия и разработки лекарств. Nat Rev Drug Discov 1: 609–620.
PubMedGoogle ScholarStone TW, Perkins MN. 1981. Хинолиновая кислота: мощный эндогенный возбудитель аминокислотных рецепторов в ЦНС. Eur J Pharmacol 72: 411–412.
PubMedGoogle ScholarSved A, Fernstrom J. 1981. Доступность тирозина и синтез дофамина в полосатом теле: исследования с гамма-бутиролактоном.Life Sci 17: 743–748.
Google ScholarSved AF, Fernstrom JD, Wurtman RJ. 1979а. Введение тирозина снижает кровяное давление и усиливает высвобождение норэпинефрина в головном мозге у крыс со спонтанной гипертензией. Proc Natl Acad Sci USA 76: 3511–3514.
PubMedCentralPubMedGoogle ScholarSved AF, Fernstrom JD, Wurtman RJ. 1979b. Введение тирозина снижает уровень пролактина в сыворотке у хронически резерпинизированных крыс. Life Sci 25: 1293–1299.
PubMedGoogle ScholarTam S-Y, Elsworth JD, Bradberry CW, Roth RH.1990. Мезокортикальные дофаминовые нейроны: высокая базальная частота возбуждения предсказывает тирозиновую зависимость синтеза дофамина. J Neural Transm 81: 97–110.
Google ScholarTanaka T, Knox WE. 1959. Природа и механизм триптофанпирролазной (пероксидазо-оксидазной) реакции псевдомонад и печени крысы. J Biol Chem 234: 1162–1170.
PubMedGoogle ScholarТейлор М.В., Фенг Г. 1991. Взаимосвязь между интерфероном-γ, индоламин-2,3-диоксигеназой и катаболизмом триптофана.FASEB J 5: 2516–2522.
PubMedGoogle ScholarThoenen H, Mueller RA, Axelrod J. 1969. Повышенная активность тирозингидроксилазы после вызванного лекарством изменения симпатической передачи. Nature 221: 1264
PubMedGoogle ScholarTourian A, Goddard J, Puck TT. 1969. Активность фенилаланингидроксилазы в клетках млекопитающих. J Cell Physiol 73: 159–170.
PubMedGoogle ScholarVahvelainen M-L, Oja SS. 1975. Кинетический анализ фенилаланин-индуцированного ингибирования насыщаемого притока тирозина, триптофана, лейцина и гистидина в срезы коры головного мозга взрослых и 7-дневных крыс.J Neurochem 24: 885–892.
PubMedGoogle Scholarvan Praag HM. 1981. Управление депрессией с помощью предшественников серотонина. Биол Психиатрия 16: 291–310.
PubMedGoogle ScholarVan Woert MH, Rosenbaum D. 1979.
l-5 – Терапия гидрокситриптофаном при миоклонии. Достижения в неврологии, Vol. 26. Fahn S, Davis JN, Rowland LP, редакторы. Нью-Йорк: Raven Press; С. 107–115.
Google ScholarВерри Ф. 2003. Система L: Гетеромерные обменники больших нейтральных аминокислот, участвующие в направленном транспорте Pflugers.Arch Eur J Physiol 445: 529–533.
Google ScholarViveros OH, Arqueros L, Connett RJ, Kirshner N. 1969. Механизм секреции из мозгового вещества надпочечников IV. Судьба везикул накопления после введения инсулина и резерпина. Mol Pharmacol 5: 69–92.
PubMedGoogle ScholarФогт М. 1954. Концентрация симпатина в различных отделах центральной нервной системы при нормальных условиях и после приема лекарств. J. Physiol 123: 451–481.
PubMedCentralPubMedGoogle ScholarWalther DJ, Bader M. 2003. Уникальная центральная изоформа триптофангидроксилазы. Biochem Pharmacol 66: 1673–1680.
PubMedGoogle ScholarWang HL, Harwalkar VH, Waisman HA. 1962. Влияние диетического фенилаланина и триптофана на серотонин мозга. Arch Biochem Biophys 96: 181–184.
Google ScholarWang Y, Citron BA, Ribeiro P, Kaufman S. 1991. Высокий уровень экспрессии кДНК тирозингидроксилазы PC12 крысы в Esceriaiia coli: очистка и характеристика клонированного фермента.Proc Natl Acad Sci USA 88: 8779–8783.
PubMedCentralPubMedGoogle ScholarWeiner N, Rabadjija M. 1968. Влияние нервной стимуляции на синтез и метаболизм норэпинефрина в изолированном препарате гипогастрального семявыносящего протока морской свинки. J Pharmacol Exp Ther 160: 61–71.
PubMedGoogle ScholarWhite FJ, Wang RY. 1984. A10 дофаминовые нейроны: роль ауторецепторов в определении скорости возбуждения и чувствительности к агонистам дофамина. Life Sci 34: 1161–1170.
PubMedGoogle ScholarWicks WD, Kenney FT, Lee K-L. 1969. Индукция синтеза печеночных ферментов in vivo аденозин-3 ‘, 5’-монофосфатом. J Biol Chem 244: 6008–6013.
PubMedGoogle ScholarWitkovsky P, Veisenberger E, Haycock JW, Akopian A, Garcia-Espana A, et al. 2004. Активно-зависимое фосфорилирование тирозингидроксилазы в дофаминергических нейронах сетчатки крысы. J Neurosci 24: 4242–4249.
PubMedGoogle ScholarWretborn M, Humble E, Ragnarsson U, Engström L.1980. Аминокислотная последовательность в фосфорилированном сайте фенилаланингидроксилазы печени крысы и фосфорилирование соответствующего синтетического пептида. Biochem Biophys Res Commun 93: 403–408.
PubMedGoogle ScholarWurtman JJ, Wurtman RJ, Growdon JH, Henry P, Lipscomb A, et al. 1981. Тяга к углеводам у тучных людей: подавление с помощью лечения, влияющего на серотонинергическую передачу. Int J Eating Dis 1: 2–15.
Google ScholarWurtman JJ, Moses PL, Wurtman RJ.1983. Предыдущее потребление углеводов влияет на количество углеводов, которые крысы предпочитают есть. J Nutr 113: 70–78.
PubMedGoogle ScholarWurtman JJ, Wurtman RJ, Berry E, Gleason R, Goldberg H, et al. 1993. Дексфенфлурамин, флуоксетин и потеря веса среди женщин, тянущих к углеводам. Нейропсихофармакология 9: 201–210.
PubMedGoogle ScholarWurtman RJ. 2005. Мелатонин. Энциклопедия пищевых добавок. Коутс П.М., Блэкман М.Р., Крэгг Г.М., Левин М., Мосс Дж. И др.редакторы. Нью-Йорк: Марсель Деккер; С. 457–466.
Google ScholarWurtman RJ, Axelrod J. 1965. Шишковидная железа. Sci Am 213: 50–60.
PubMedGoogle ScholarWurtman RJ, Axelrod J. 1967. Ежедневные ритмические изменения активности тирозинтрансаминазы в печени крысы. Proc Natl Acad Sci USA 57: 1594–1598.
PubMedCentralPubMedGoogle ScholarWurtman JJ, Wurtman RJ. 1977. Фенфлурамин и флуоксетин экономят потребление белка, подавляя потребление калорий крысами.Science 198: 1178–1180.
PubMedGoogle ScholarWurtman JJ, Wurtman RJ. 1979. Лекарства, которые усиливают центральную серотонинергическую передачу, уменьшают избирательное потребление углеводов крысами. Life Sci 24: 895–904.
PubMedGoogle ScholarWurtman RJ, Wurtman JJ. 1989. Углеводы и депрессия. Sci Am 68–75.
Google ScholarWurtman RJ, Larin F, Axelrod J, Shein HM, Rosasco K. 1968a. Образование мелатонина и 5-гидроксииндолуксусной кислоты из
14С-триптофана эпифизом крысы в органной культуре.Nature 217: 953–954.
PubMedGoogle ScholarWurtman RJ, Shoemaker WJ, Ларин Ф. 1968b. Механизм суточного ритма активности печеночной тирозинтрансаминазы: роль диетического триптофана. Proc Natl Acad Sci USA 59: 800–807.
PubMedCentralPubMedGoogle ScholarWurtman RJ, Shein HM, Axelrod J, Larin F. 1969. Включение 14C-триптофана в 14C-белок культивированными пинеальными железами крыс: стимуляция I-норэпинефрина. Proc Natl Acad Sci USA 62: 749–755.
PubMedCentralPubMedGoogle ScholarWurtman RJ, Larin F, Mostafapour S, Fernstrom JD.1974. Синтез катехолов в мозге: контроль концентрацией тирозина в мозге. Наука 185: 183–184.
PubMedGoogle ScholarWurtman RJ, Wurtman JJ, Regan MM, McDermott JM, Tsay RH, et al. 2003. Влияние обычной пищи, богатой углеводами или белками, на соотношение триптофана в плазме. Am J Clin Nutr 77: 128–132.
PubMedGoogle ScholarЯмаока К.А., Миясака Н., Инуо Г., Сайто И., Колб Дж. П. и др. 1994. 1,1′-Этилиденбис (триптофан) (пик E) индуцирует функциональную активацию человеческих эозинофилов и продукцию интерлейкина 5 Т-лимфоцитами: ассоциация синдрома эозинофилии-миалгии с контаминантом
-триптофана
L.J Clin Immun 14: 50–60. PubMedGoogle ScholarЯмаути Т., Фудзисава Х. 1979. Регулирование тирозин-3-монооксигеназы надпочечников крупного рогатого скота с помощью реакции фосфорилирования-дефосфорилирования, катализируемой аденозин 3 ‘: 5’-монофосфат-зависимой протеинкиназой и фосфопротеинфосфатазой. J Biol Chem 254: 6408–6413.
PubMedGoogle ScholarЯмадзаки Ф., Куроива Т., Такикава О., Кидо Р. 1985. Индолламин-2,3-диоксигеназа человека. Его тканевое распределение и характеристика плацентарного фермента.Biochem J 230: 635–638.
PubMedCentralPubMedGoogle ScholarYokogoshi H, Wurtman RJ. 1986. Состав пищи и соотношение аминокислот в плазме: влияние различных белков или углеводов и различных концентраций белка. Метаболизм 35: 837–842.
PubMedGoogle ScholarZavisca FG, Wurtman RJ. 1978. Влияние нейтральных аминокислот на антигипертензивное действие метилдопы у крыс со спонтанной гипертензией. J Pharm Pharmacol 30: 60–62.
PubMedGoogle ScholarZhang X, Gainetdinov RR, Beaulieu J-M, Sotnikova TD, Burch LH, et al.2005. Мутация потери функции в триптофангидроксилазе-2 идентифицирована при униполярной большой депрессии. Нейрон 45: 11–16.
PubMedGoogle ScholarZigmond RE, Schwarzschild MA, Rittenhouse AR. 1989. Острая регуляция тирозингидроксилазы нервной активностью и нейротрансмиттерами посредством фосфорилирования. Анну Рев Neurosci 12: 415–461.
PubMedGoogle Scholar
Информация об авторских правах
© Springer Science + Business Media, LLC 2007
Авторы и аффилированные лица
- M.Cansev
- R. J. Wurtman
Нет данных о филиалах
Аминокислоты и химия мозга | Здоровое питание
Эндрю Френч Обновлено 27 декабря 2018 г.
Аминокислоты часто называют строительными блоками для белковых тканей и соединений в организме, таких как мышечные волокна, кожа, волосы и ферменты. Однако аминокислоты также необходимы для производства нейротрансмиттеров, которые представляют собой химические вещества в мозгу, которые либо возбуждают, либо ингибируют нейроны.Аминокислоты, способные преодолевать гематоэнцефалический барьер, стимулируют синтез большинства нейротрансмиттеров, что влияет на химию мозга и настроение.
Нейротрансмиттеры
Аминокислоты необходимы мозгу для построения нейронов, соединительной ткани и нейротрансмиттеров. Большинство нейротрансмиттеров состоит из аминокислот, метаболизируемых из пищевого белка. Ткани тела, такие как мышечные волокна, забирают подавляющее большинство аминокислот из кровотока, а в мозг остается сравнительно мало.Кроме того, аминокислотам трудно преодолеть защитный гематоэнцефалический барьер, поэтому употребление некоторого количества белка не всегда гарантирует, что в вашем мозгу будет достаточно аминокислот для оптимального функционирования. Попадая в мозг, аминокислоты используются для выработки большей части возбуждающих и тормозных нейротрансмиттеров. По сути, нейротрансмиттеры создают сообщение, нейроны передают сообщение, а рецепторы принимают сообщение в мозгу. Эта эффективная коммуникационная сеть позволяет вашему мозгу выполнять 20 миллионов миллиардов вычислений в секунду.
Синтез нейротрансмиттеров
Аминокислоты тирозин или фенилаланин — в присутствии достаточного количества кислорода и определенных витаминов и минералов — используются для выработки нейромедиаторов дофамина и норэпинефрина. Дофамин является одновременно возбуждающим и тормозящим действием, в зависимости от концентрации, но он является важным регулятором настроения и помогает бороться с депрессией, повышая мотивацию и умственную концентрацию. Норэпинефрин возбуждает и необходим для настороженности, концентрации и формирования новых воспоминаний.Серотонин — нейротрансмиттер-ингибитор, необходимый для хорошего настроения, обучения и нормального сна, — синтезируется из аминокислоты триптофана, если в рационе есть достаточное количество витаминов группы B. Другим важным нейромедиатором, зависящим от пищевых аминокислот, является ГАМК, которая производится из глутаминовой кислоты. ГАМК подавляет чрезмерную активность мозга и снижает беспокойство и стресс, так же как транквилизатор диазепам.
Ацетилхолин
В отличие от других нейромедиаторов, ацетилхолин не синтезируется из аминокислот.Он состоит из холина, который попадает в мозг гораздо легче, чем аминокислоты, поэтому уровень ацетилхолина редко бывает несбалансированным, если нет дефицита витамина C или B-5. Ацетилхолин возбуждает и необходим для хранения и восстановления памяти. Холин является компонентом лецитина, который в изобилии содержится в яичных желтках, зародышах пшеницы, большинстве цельнозерновых продуктов, соевых продуктах и мясных субпродуктах.
Хорошие источники тирозина и триптофана
Продукты, богатые определенными аминокислотами, особенно тирозином и триптофаном, могут влиять на химию мозга и настроение.Превосходные источники тирозина включают соевые продукты, птицу, рыбу, миндаль, авокадо, бобы Лимы, семена тыквы, арахис, бананы и большинство молочных продуктов, особенно выдержанный сыр. Богатые источники триптофана включают птицу, лосось, тунец, моллюски, красное мясо, соевые бобы, коричневый рис, творог, арахис и семена кунжута.
Борьба с депрессией с помощью аминокислотной терапии
Большая депрессия — это серьезное заболевание, от которого страдают 9,9 миллиона взрослых американцев, или примерно 5 процентов взрослого населения в конкретный год.В отличие от обычных эмоциональных переживаний, таких как грусть, потеря или преходящее состояние настроения, большая депрессия носит стойкий характер и может существенно влиять на мысли, поведение, настроение, активность и физическое здоровье человека. Депрессия обычно лечится антидепрессантами, такими как прозак. Аминокислотная терапия может быть хорошо переносимой и эффективной альтернативой рецептурным антидепрессантам для многих пациентов.
Узнайте больше о доступных у нас целевых аминокислотных добавках!
Чтобы поставить диагноз клинической депрессии, по крайней мере, пять из девяти нижеприведенных симптомов должны присутствовать в течение двух или более недель, большую часть времени, почти каждый день.
- Подавленное настроение
- Пониженный уровень интереса или удовольствия от занятий
- Значительная потеря или увеличение веса или аппетита
- Бессонница или чрезмерное сонливое поведение, вызывающее возбуждение или замедление
- Усталость или снижение энергии
- Мысли о никчемности или вине
- Пониженная способность думать или концентрироваться
- Частые мысли о самоубийстве или смерти или попытки самоубийства
Дополнительные факторы
Одним из ведущих факторов, связанных с депрессией, является снижение уровня нейротрансмиттеров норэпинефрина, серотонина и дофамина (аминовая теория) (Hou C et al 2006; Prange AJ et al 1974).Вероятно, что несколько факторов, в том числе генетическая предрасположенность и гормональный дисбаланс, работают вместе у любого конкретного человека и вызывают депрессивный эпизод. Есть также свидетельства того, что структура самого мозга может быть изменена при депрессии, особенно гиппокампа (Campbell S et al 2004), хотя было проведено мало исследований по эффективному лечению этих изменений. К другим факторам, которые могут способствовать депрессии, относятся оксидативный стресс, который может вызывать разрушение клеточной мембраны и ДНК в мозге (Khanzode SD et al 2003), воспаление (Elenkov IJ et al 2005) и гиперактивность гипоталамо-гипофизарно-надпочечниковой системы (HPA). ) оси (Антониевич И.А., 2006).
Нейротрансмиттеры, регулирующие настроение
На протяжении многих лет в медицине было известно, что низкие уровни этих нейромедиаторов могут вызывать множество болезней и недомоганий. Дисбаланс нейротрансмиттеров может вызвать депрессию, беспокойство, панические атаки, бессонницу, раздраженный кишечник, гормональную дисфункцию, расстройства пищевого поведения, фибромиалгию, навязчивые идеи, компульсии, дисфункцию надпочечников, хроническую боль, мигренозные головные боли и даже преждевременную смерть. Наиболее распространенными нарушениями баланса нейромедиаторов, на которые нацелена фармацевтическая промышленность, являются допамин, ГАМК, глутамат, норэпинефрин и серотонин.
Аминокислотная терапия или терапия прекурсорами нейротрансмиттеров
Хорошо известно, что нейротрансмиттеры синтезируются из аминокислот, полученных из белков, содержащихся в пище. Это начинается с действия определенных химических веществ и ферментов, которые расщепляют белки на их аминокислотные составляющие. Эти аминокислоты являются субстратом для ферментов, которые могут превращать аминокислоты в нейротрансмиттеры.
Гематоэнцефалический барьер — это защитный барьер, который помогает удерживать опасные вещества и поддерживать устойчивую среду для мозга.Он также предотвращает доступ многих нейромедиаторов в организме к мозгу, поэтому использование аминокислот (предшественников нейромедиаторов) в определенных комбинациях и при соответствующем времени введения позволяет нам производить больше конкретных нейротрансмиттеров, повышающих настроение, в мозге. Поскольку аминокислоты конкурируют с другими крупными нейтральными аминокислотами за доступ к мозгу, важно контролировать время приема белковой пищи при приеме продуктов, содержащих прекурсоры. Пища с высоким содержанием белка и протеиновые порошки повышают уровень всех этих аминокислот, и это фактически снижает синтез серотонина в головном мозге.Прием аминокислот-предшественников, таких как тирозин и 5 HTP, вместе с углеводом и вдали от белковой пищи, обеспечит повышенную конверсию в нейротрансмиттеры, восстанавливающие настроение.
Катехоламины
Дофамин, эпинефрин и норэпинефрин (катехоламины) отвечают за мотивацию, энергию, интерес, сексуальное функционирование, удовольствие / вознаграждение, драйв, внимание и концентрацию. Они связаны с положительными стрессовыми состояниями, такими как влюбленность, занятия спортом, прослушивание музыки и секс.Недостаточный уровень усугубляет трудности с началом или выполнением задач, депрессию, плохую концентрацию, низкую энергию и отсутствие мотивации. Может возникнуть привыкание, такое как употребление алкоголя, наркотиков, сигарет, азартные игры и переедание.
L-тирозин — предшественник катехоламинов
L-тирозин является предшественником синтеза катехоламинов адреналина, норадреналина и дофамина, гормонов щитовидной железы тироксина и трийодтиронина и пигмента меланина.Механизм предполагаемой антидепрессивной активности L-тирозина можно объяснить ролью предшественника L-тирозина в синтезе нейромедиаторов адреналина, норадреналина и дофамина. Считается, что повышенные уровни норэпинефрина и дофамина в мозге связаны с антидепрессивным действием.
Одно исследование пришло к выводу, что тирозин может защитить от некоторых форм экологического стресса. В этом двойном слепом плацебо-контролируемом перекрестном исследовании испытуемым вводили дозу тирозина 100 мг / кг, а затем подвергали в течение 4,5 часов холоду и гипоксии.Сообщалось, что тирозин значительно снижает неблагоприятные симптомы, включая ухудшение настроения и работоспособности. Требуется наблюдение.
ГАБА
ГАМК (гамаминомасляная кислота) является основным тормозным нейромедиатором мозга, она не дает нервной системе стать сверхактивной, расслабляет и успокаивает. Низкие уровни связаны со злоупотреблением психоактивными веществами, тревогой, депрессией, паническими атаками, судорогами и перепадами настроения. Этот нейротрансмиттер и его рецепторы являются мишенью вызывающих привыкание лекарств, таких как ативан и ксанакс.
Глутамат
Глутамат — главный возбуждающий нейротрансмиттер в головном мозге. Это необходимо для обучения и памяти. Низкий уровень может привести к усталости и снижению активности мозга. Повышенный уровень глутамата может вызвать смерть нейронов (нервных клеток) в головном мозге, симптомом этого может быть потеря памяти. Дисфункция глутамата участвует во многих нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, болезнь Паркинсона, Хантингтона и Туретта. Высокий уровень также способствует депрессии, ОКР и аутизму.
L-теанин, предшественник ГАМК и модулятор глутамата
Теанин может обладать как улучшающими настроение, так и ноотропными свойствами. Он помогает поддерживать ГАМК и тормозную систему, чтобы успокоить чрезмерно стимулированные нервные клетки. Он работает, чтобы предотвратить чрезмерную стимуляцию нейромедиатора, поддерживая баланс нервной системы. Эта аминокислота была тщательно изучена на предмет ее способности снижать поглощение возбуждающей (стимулирующей) аминокислоты глутамата и уравновешивать выводимое количество серотонина, дофамина и норадреналина.Было обнаружено, что теанин оказывает защитное действие на нейроны мозга, защищая их от смертельных токсических эффектов окисления и чрезмерной стимуляции глутамата.
Возможные преимущества приема теанина включают нейрозащиту, улучшение настроения и снижение тревожности, улучшение способности к обучению, снижение артериального давления и уровня холестерина, антиоксидантные эффекты, антиканцерогенные эффекты (особенно в сочетании с другими лекарствами), улучшение иммунитета, потерю веса и лечение PMS
Серотонин
Серотонин является ключом к нашему чувству счастья и очень важен для наших эмоций, потому что он помогает защищаться как от тревоги, так и от депрессии.Симптомы истощения включают печальное депрессивное настроение, беспокойство, панические атаки, упадок сил, мигрень, проблемы со сном, навязчивую идею или компульсии, чувство напряжения и раздражения, тягу к сладкому и снижение интереса к сексу. Кроме того, гормоны и уровни эстрогена могут влиять на уровень серотонина, и это может объяснить, почему у некоторых женщин есть проблемы с настроением перед менструацией и менопаузой. Более того, стресс может значительно снизить запасы серотонина.
Предшественники серотонина: 5-гидрокситриптофан или L-триптофан
5 HTP
5-Гидрокситриптофан является непосредственным предшественником в биосинтезе нейромедиатора 5-гидрокситриптамина (5-HT или серотонина).Механизм возможной антидепрессивной активности 5-HTP объясняется его превращением в нейротрансмиттер серотонин, который играет центральную роль в аффективном состоянии. В то время как гематоэнцефалический барьер очень хорош в исключении больших и / или заряженных молекул, небольшие липофильные молекулы, такие как 5-HTP, могут легко пересекать гематоэнцефалический барьер.
Разрозненные исследования показали, что добавление 5-HTP в некоторых случаях оказывает значительное антидепрессивное действие. В одном двойном слепом многоцентровом исследовании было показано, что 5-HTP оказывает антидепрессивное действие немного лучше, чем флуоксамин SSRI.Другие исследования были более двусмысленными.
Есть некоторые свидетельства того, что 5-HTP обладает некоторой анальгетической активностью у людей с фибромиалгией, и в одном исследовании было обнаружено, что 5-HTP имеет некоторый положительный эффект у людей с хроническими головными болями напряжения. Также было обнаружено, что 5-HTP увеличивает уровни бета-эндорфина и тромбоцитов мет-энкефалина, что может означать усиливающий эффект на эндогенный анальгетический эффект.
L-триптофан
L-триптофан является предшественником серотонина, нейромедиатора в головном мозге, дефицитного при депрессии.L-триптофан является естественным релаксантом и помогает облегчить бессонницу, вызывая нормальный сон. L-триптофан снижает тревогу и депрессию; помогает при лечении мигрени; помогает иммунной системе; помогает снизить риск спазмов артерий и сердца.
CoFactor Витамины помогают аминокислотам-предшественникам синтезироваться в нейротрансмиттеры.
Витамин C Необходимый кофактор для превращения 5-HTP в серотонин, он также предотвращает превращение 5-HTP в серотонин в желудочно-кишечном тракте.Витамин С также является необходимым питательным веществом для превращения дофамина в норэпинефрин.
Фолиевая кислота жизненно важна для здоровья нервной системы. Низкие уровни связаны с депрессией и деменцией. Помогает предотвратить и снизить уровень токсичного гомоцистеина, который может вызвать сердечные приступы и инсульты. Фолиевая кислота — необходимое питательное вещество для образования многих нейротрансмиттеров.
Витамин B6 Пиридоксил-5′-фосфат — это активная коферментная форма B6. Пиридоксил-5-фосфат необходим для метаболизма аминокислот и жирных кислот, а также для производства серотонина и других ключевых нейротрансмиттеров.Жизненно важно предотвратить производство токсичного гомоцистеина и процесс метилирования, который превращает один нейромедиатор в другой.
Витамин B 12
Требуется для неврологического здоровья и метаболизма жирных кислот. Дефицит витамина B-12 приводит к пагубной анемии и утомляемости. Витамин B-12 хранится в печени и влияет на неврологические системы. Помимо анемии, дефицит B-12 может включать слабоумие, депрессию и снижение концентрации внимания в результате неврологической дегенерации.
Аминокислотымогут быть хорошо переносимой и эффективной альтернативой рецептурным антидепрессантам для многих пациентов. Они часто работают в течение нескольких дней, а не недель, практически без побочных эффектов.
Узнайте больше о доступных у нас целевых аминокислотных добавках!
Список литературы
Бандерет Л.Е., Либерман HR. Лечение тирозином, предшественником нейромедиатора, снижает экологический стресс у человека. Brain Res Bull. 1989; 22: 759-762.
Benkelfat C, Ellenbogen MA, Dean P, Palmour Rm, Young SN. Снижающий настроение эффект истощения триптофана. Повышенная восприимчивость у молодых мужчин с генетическим риском серьезных аффективных расстройств. Arch Gen Psychiatry 1994; 51 (9): 687-697.
Biochem Biophys Res Commun. 2004 16 июля; 320 (1): 116-22. Возможное участие mGluR группы I в нейропротекторном действии теанина. Нагасава К., Аоки Х., Ясуда Е., Нагаи К., Шимохама С., Фудзимото С.
Biosci Biotechnol Biochem. 2002 декабрь; 66 (12): 2683-6.Ингибирование теанином связывания [3H] AMPA, [3H] каината и [3H] MDL 105 519 с рецепторами глутамата. Какуда Т., Нозава А., Сугимото А., Ниино Х.
Байерли В.Ф., Джадд Л.Л., Реймхерр Ф.В. и др. 5-Гидрокситриптофан: обзор его антидепрессивной эффективности и эффектов. J Clin Psychopharmacol. 1987; 7: 127-137.
Кэмпбелл С., Маккуин Г. Роль гиппокампа в патофизиологии большой депрессии. J Psychiatry Neurosci. 2004 ноябрь; 29 (6): 417–26.
Cangiano C, Ceci F, Cascino A и др.Пищевое поведение и соблюдение диетических предписаний у взрослых с ожирением, получавших 5-гидрокситриптофан. Am J Clin Nutr. 1992; 56: 863-867.
Delgado PL, Charney DS, Price LH, Aghajanian GK, Landis H, Heninger GR. Функция серотонина и механизм антидепрессивного действия. Обращение ремиссии, вызванной приемом антидепрессантов, за счет быстрого истощения триптофана в плазме. Arch Gen Psychiatry 1990; 47 (5): 411-18.
Hintikka J, Tolmunen T. et al. Высокий уровень витамина B12 и хорошие результаты лечения могут быть связаны с большим депрессивным расстройством.BMC Psychiatry. 2 декабря 2003 г .; 3 (1): 17.
Hou C, Jia F et al. Уровни серотонина, 5-гидроксииндолуксусной кислоты и нейропептида Y в спинномозговой жидкости при тяжелом большом депрессивном расстройстве. Brain Res. 20 июня 2006 г.; 1095 (1): 154–8.
Геленберг AJ, Гибсон CJ. Тирозин для лечения депрессии. Nutr Health. 1984; 3: 163-173.
Геленберг А.Дж., Войчик Д.Д., Фальк В.Е. и др. Тирозин от депрессии: двойное слепое исследование. J влияет на Disord. 1990; 19: 125-132.
Геленберг А.Дж., Войчик Д.Д., Гибсон С.Дж., Вуртман Р.Дж.Тирозин от депрессии. J Psychiatr Res. 1982-83; 17: 175-180.
Мейерс С. Использование предшественников нейромедиаторов для лечения депрессии. Altern Med Rev.2000 февраля; 5 (1): 64–71.
Паттини П.С., Карузо И. Синдром первичной фибромиалгии и 5-гидрокси-L-триптофан: открытое 90-дневное исследование. J Int Med Res.1992; 20: 182-189.
Рейнштейн Д.К., Ленерт Х., Вуртман Р.Дж. Диетический тирозин подавляет повышение уровня кортикостерона в плазме после острого стресса у крыс. Life Sci 1985; 37 (23): 2157-2163.
Смит К.А., Фэйрберн К.Г., Коуэн П.Дж. Рецидив депрессии после быстрого истощения триптофана. Ланцет 1997; 349 (9056): 915-19.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Лучшие аминокислоты для работы мозга
Аминокислоты и нейротрансмиттеры
Следующее соображение для оптимальной функции мозга — наличие достаточного количества правильных аминокислот из белка, чтобы обеспечить сырье для производства нейротрансмиттеров и нейропептидов, то есть химических веществ, которые нервные клетки используют для связи. Например, если вы хотите повысить бдительность и внимание, улучшить свое самочувствие и помочь предотвратить последствия стресса, вам следует повысить уровень аминокислоты тирозина.Тирозин превращается в тревожные нейротрансмиттеры дофамин и норадреналин, а затем в гормон адреналин. (Примечание: адренелин также называют адреналином). В совокупности эти молекулы называются катехоламинами.
Дофамин — нейромедиатор «хорошего самочувствия»
Дофамин — это нейромедиатор «хорошего самочувствия», связанный с центрами вознаграждения в нашем мозгу, помогающий вызвать чувство оптимизма и энтузиазма. Дофамин и другие катехоламины способствуют нормальной нервной функции, помогают снизить усталость и поддерживать постоянный уровень энергии.Например, адреналин вместе с другими гормонами, вырабатываемыми надпочечниками, помогает поддерживать уровень сахара в крови, от которого наш мозг чрезвычайно зависит. Еще одна причина, по которой катехоламины сохраняют энергию, заключается в том, что особенно норадреналин и адреналин обладают очень сильным противовоспалительным действием … (подумайте о эпипенете, который держит дыхательные пути открытыми после укуса пчелы или другой анафилактической реакции). Как обсуждалось ранее, борясь с воспалением, они позволяют вашим митохондриям, вырабатывающим энергию, продолжать работать, а это ключ к здоровому мозгу и нервной системе.
С другой стороны, воспаление, останавливающее выработку митохондриальной энергии, является ключевым событием в развитии таких заболеваний, как болезнь Альцгеймера, БАС или болезнь Паркинсона, потому что клетки мозга, которые не могут производить энергию, умирают! (При болезни Паркинсона именно дофамин и катехоламины перестают нормально вырабатываться мозгом.)
На самом деле именно высвобождение и / или длительное присутствие катехоламинов позволяет наркотикам, таким как кокаин, амфетамины или некоторые антидепрессанты, вызывать чувство возбуждения, энергии или улучшения настроения.Проблема в том, что эти вещества не делают ничего, чтобы фактически увеличить или восполнить ваши запасы катехоламинов, и они вызывают зависимость. С другой стороны, тирозин является естественным средством вашего организма вырабатывать катехоламины.
Тирозин также необходим для производства гормонов щитовидной железы и меланина, то есть цветного пигмента в нашей коже и волосах, и присутствует практически во всех белках по всему телу. Тирозин не считается незаменимым, потому что он может быть произведен из другой аминокислоты, называемой фенилаланином.И даже несмотря на то, что дефицит белка и по умолчанию дефицит тирозина в развитом мире может быть редкостью, как всегда, может быть большая разница между просто достаточным количеством, чтобы избежать клинических симптомов, и достижением оптимальных результатов за счет повышения уровня. Здесь могут быть полезны продукты, богатые белком, такие как рыба, птица, молочные белки или орехи и семена, а также добавки с тирозином, которые могут специально повысить уровень в крови, особенно при приеме натощак в отсутствие других белков или аминокислот. которые соревнуются за его поглощение.
Хотя некоторые веб-сайты утверждают, что добавки с тирозином неэффективны, я должен сказать, что это не имеет большого смысла и определенно не согласуется с результатами, которые я наблюдал за эти годы. Мой опыт показывает, что повышение бдительности может быть довольно быстрым, если вы принимаете достаточно … что, согласно Министерству здравоохранения Канады, может достигать 10 ГРАММОВ ДВАЖДЫ В ДЕНЬ! Смеяться в голос. Если ничто иное, это свидетельствует о его безопасности, но для начала я бы попробовал 1-3 грамма за раз.
Ацетил-L-карнитин и витамины группы В для энергии
Дофамин вместе с другим нейромедиатором под названием ацетилхолин, который очень важен для обучения и памяти, также может быть повышен приемом ацетил-L-карнитина, ( ALCAR .) Несмотря на то, что ALCAR и его родственное соединение под названием L-карнитин вырабатываются в организме из аминокислот, на самом деле они намного ближе по структуре к витамину B, и, как и другие B-витамины, играют важную роль в нашей энергии, Обмен веществ и нервная система . (Как уже говорилось в прошлых статьях этого блога, основная функция карнитина состоит в том, чтобы позволить транспортировать свободные жирные кислоты в митохондрии, которые будут сжигаться… то есть без него мы не сможем сжигать жир. Но если вы можете сжечь жир, это отличный источник энергии … особенно для таких тканей, как сердце.)
Помимо повышения уровня дофамина и ацетилхолина в головном мозге, ALCAR также способствует лучшему использованию кислорода и, в свою очередь, лучшей функции митохондрий и увеличению энергии. В этом отношении он работает синергетически с другими веществами, поддерживающими митохондрии, такими как альфа-липоевая кислота и кофермент Q10 . Другими словами, ALCAR способен заряжать энергией и защищать ваш мозг, и были исследованы его способности замедлять прогрессирование болезни Альцгеймера.Также было показано, что он помогает выводить из организма аммиак, повышенный уровень которого может напрямую нарушать работу мозга. Но вам не обязательно иметь сбои в работе мозга, чтобы воспользоваться преимуществами ALCAR. Его может использовать любой, кто хочет улучшить обучение, память, бдительность и концентрацию внимания. Для этого рекомендую 1-2 грамма в день. Эффект становится более заметным, если вы принимаете его натощак, хотя они могут проявиться через некоторое время… до 90 дней. Для получения дополнительной информации об ALCAR или L-карнитине.
См. Статью о карнитине №1 и статью №2 ALCAR.
Успокойся и расслабься
С другой стороны, для тех, кто хочет большего успокаивающего и расслабляющего эффекта или лучшего сна, вы можете рассмотреть аминокислоту триптофан или его прямой последующий метаболит 5-гидрокси-триптофан ( 5-HTP ), из которого ваше тело производит нейротрансмиттер серотонин, а затем гормон мелатонин. В Турции, например, очень много триптофана, и именно поэтому после праздничных обедов люди обычно чувствуют себя расслабленными и сонными после того, как съели его в больших количествах.
Триптофан или 5-HTP лучше всего работают при потреблении с углеводами для повышения уровня инсулина, тем самым заставляя другие аминокислоты накапливаться, но оставляя триптофан в крови свободным для превращения в серотонин и / или мелатонин. Тем не менее, для того, чтобы ваше тело могло производить эти преобразования, должна присутствовать активная или «коферментная» форма витамина B-6 , называемая пиридоксаль-5-фосфатом или P-5-P.
В дополнение к ферментативным превращениям, подобным этому, витаминный комплекс B выполняет огромное количество важнейших метаболических функций в вашей нервной системе, принимая непосредственное участие в производстве энергии, метилировании, генной модуляции … и этот список можно продолжать бесконечно долго. .Обзор всех этих функций выходит за рамки этой статьи, но достаточно сказать, что кое-что, что я узнал в Институте функциональной медицины, состоит в том, что первым признаком дефицита витамина B в являются нарушения в нервной системе, в том числе утомляемость, бессонница, нервные подергивания, беспокойные конечности и т. д. 900 16. Хотя это не обязательно означает, что витамины группы B волшебным образом сотрут все признаки этих проблем, при попытке их решения они являются первой базой, которую нужно покрыть, т.е.убедитесь, что вы получаете адекватный или оптимальный запас.
Важно помнить, что из-за различной активности и скорости ферментов люди могут сильно различаться в своих потребностях в витамине B. Согласно статье известного ученого Брюса Эймса, доктора философии, до 10 000 раз (!!!) для любого данного витамина B. Это означает, что вам, возможно, придется поэкспериментировать с потреблением, чтобы найти уровни, которые подходят вам. Недавний прогресс в добавлении витаминов B — это доступность более активных форм коферментов, таких как упомянутый выше P-5-P, которые позволяют организму пропускать преобразования, прежде чем они смогут их использовать.Другие примеры этих форм коферментных добавок включают рибофлавин-5-фосфат для витамина B-2 или MTHF (метил-тетрагидро-фолат), превосходную альтернативу обычной фолиевой кислоте.
Многие уже знакомы с тем, насколько важен Витамин B-12 для энергии и нормального функционирования нервной системы, и хотя это не коферментная форма витамина B-12, форма метилкобаламина в добавках очень полезна. долгожданное улучшение низшей формы добавки цианокобаламина, которая раньше доминировала.Кроме того, относительно новая жирорастворимая форма витамина B1, называемая , Бенфотиамин , более активна в нервной системе и обеспечивает преимущества, которых нет у обычных добавок витамина B1 (то есть тиамина).
Примечание для вегетарианцев
Для вегетарианцев или веганов, которые недоумевают по поводу получения достаточного количества правильных аминокислот или витаминов B в своем рационе, включая витамин B-12, который обычно содержится только в продуктах животного происхождения, есть варианты. Спирулина — это вид сине-зеленых водорослей, выращиваемых для употребления в пищу человеком.Это отличный источник витамина B-12, который легко усваивается и переваривается. Это также полноценный белок, содержащий соотношение аминокислот, аналогичное человеческому организму. Кроме того, содержащиеся в нем аминокислотные или пептидные цепи очень короткие и легко доступны для нервной системы, где они могут заметно улучшить ясность ума и бдительность. Незаменимые жирные кислоты, такие как GLA, также содержатся в спирулине. Хотя это и не доставляет удовольствия во вкусе, это вполне полноценный суперпродукт. За 28 лет помощи людям с питанием и добавками я убедился, что если люди потребляют их в течение нескольких месяцев, преимущества для остроты ума и общего состояния здоровья становятся очень заметными.
Польза для здоровья другой водоросли под названием хлорелла сопоставима со спирилиной. Какой из них более полезен, обычно зависит от человека. Еще раз, это ЕДА!
Список полезных добавок для улучшения работы мозга и производительности, конечно же, на этом не заканчивается! Для тех из вас, кто хочет получить больше информации по этой теме, просмотрите готовящуюся к выпуску электронную книгу Optimum Health по этой теме… Питание и добавки для лучшего и счастливого мозга. А пока…
Подробнее: Омега 3-6-9 для более счастливого мозга (Часть 1 из 2)
Be Well,
Иоанна
Ресурсов:
Обзор альтернативной медицины — Монография по L-тирозину
Клинический обзор: Иммуномодулирующие эффекты дофамина при общем воспалении, Читать здесь
Ацетил-L-карнитин замедляет старение мозга, Роберт Крейон, Ph.D., Международный журнал интегративной медицины — Том 2, № 3 — май / июнь 2000 г.
Медицинский центр Университета Мэриленда: сводка по тирозину
Заявление об ограничении ответственности: Вышеуказанная информация предоставлена только в информационных целях и не заменяет рекомендации вашего врача.
Кровяной мозговой барьер и церебральный метаболизм (Раздел 4, Глава 11) Нейробиология в Интернете: Электронный учебник для нейронаук | Кафедра нейробиологии и анатомии
11.1 Гематоэнцефалический барьер поддерживает постоянство внутренней среды мозга
Гематоэнцефалический барьер (ГЭБ) защищает нервную ткань от изменений в составе крови и токсинов. В других частях тела внеклеточные концентрации гормонов, аминокислот и калия часто колеблются, особенно после еды, физических упражнений или стресса. Поскольку многие из этих молекул регулируют возбудимость нейронов, подобное изменение в составе интерстициальной жидкости в ЦНС может привести к неконтролируемой активности мозга.Эндотелиальные клетки, образующие гематоэнцефалический барьер, имеют узкую специализацию, что позволяет точно контролировать вещества, которые входят в мозг или покидают его.
Открытие гематоэнцефалического барьера. Открытие ГЭБ датируется более чем 100 лет назад, когда в 1880-х годах Пауль Эрлих заметил, что внутривенное введение определенных красителей (например, трипанового синего) окрашивает все органы, кроме головного и спинного мозга. Он пришел к выводу, что красители имеют более низкое сродство к связыванию с нервной системой по сравнению с другими тканями.В 1913 году Эдвин Голдман, сотрудник Эрлиха, продемонстрировал, что те же самые красители при прямом введении в спинномозговую жидкость (CSF) легко окрашивали нервную ткань, но не другие ткани. Термин «гематоэнцефалический барьер» был придуман Левандовски в 1898 году после того, как он и его коллеги провели эксперименты, чтобы продемонстрировать, что нейротоксические агенты влияют на функцию мозга только при прямом введении в мозг, но не при введении в сосудистую систему. Потребовалось еще 70 лет, прежде чем Риз и его коллеги с помощью электронно-микроскопических исследований локализовали барьер для эндотелиальных клеток капилляров внутри мозга.
Рисунок 11.1a | Рисунок 11.1b |
Эндотелиальные клетки в капиллярах головного мозга являются участком ГЭБ. ГЭБ у взрослых состоит из сложной клеточной системы узкоспециализированной базальной мембраны, большого количества перицитов, встроенных в базальную мембрану, и концевых ножек астроцитов.В то время как эндотелиальные клетки образуют собственно барьер, взаимодействие с соседними клетками, по-видимому, необходимо для развития барьера. Эндотелиальные клетки головного мозга отличаются от эндотелиальных клеток других органов двумя важными способами. Во-первых, между эндотелиальными клетками головного мозга существуют постоянные плотные контакты. Эти плотные соединения предотвращают параклеточное движение молекул. Во-вторых, нет никаких обнаруживаемых трансэндотелиальных путей, таких как внутриклеточные везикулы. Эти свойства эндотелиальных клеток головного мозга создают барьер между кровью и мозгом.Некоторые из ключевых процессов изображены на рисунке 11.1.
Рисунок 11.2 |
- Непрерывные плотные контакты, которые соединяют эндотелиальные клетки в капиллярах мозга, ограничивают диффузию молекул через ГЭБ.
- Базальная (базальная) мембрана обеспечивает структурную поддержку капилляров, и было высказано предположение, что специфические белки, присутствующие в базальной мембране, участвуют в развитии ГЭБ.
- Астроцитарные отростки стопы выделяют специфические факторы и необходимы для развития ГЭБ. Отростки астроцитарной стопы содержат водные каналы (аквапорин-4), которые обеспечивают поглощение воды и способствуют отеку мозга.
- Транспортные носители глюкозы и незаменимых аминокислот способствуют перемещению этих растворенных веществ в мозг. Поскольку клетки мозга не могут синтезировать эти незаменимые аминокислоты, они попадают в кровь.
- Вторичные транспортные системы, по-видимому, вызывают отток небольших молекул и заменимых аминокислот из мозга в кровь.
- Переносчики ионов натрия на просветной мембране и Na, K-АТФаза на антипросветной мембране отвечают за перемещение натрия из крови в мозг. Большое количество митохондрий, присутствующих в эндотелиальных клетках головного мозга, обеспечивает энергию для функции этой Na, K-АТФазы.
- «Ферментативный гематоэнцефалический барьер». Метаболические процессы в эндотелиальных клетках капилляров головного мозга важны для функции крови и мозга и контролируют проникновение нейротрансмиттеров в мозг.
11.2 Молекулярные компоненты плотных контактов
Рис. 11.3 |
Плотные контакты между эндотелиальными клетками отвечают за барьерную функцию. Окклюдин был первым интегральным мембранным белком, локализованным исключительно в плотных контактах. Однако у мышей, несущих нулевую мутацию в гене окклюдина, развиваются морфологически нормальные плотные контакты, что указывает на то, что окклюзия не является существенной для правильного образования плотных контактов.В отличие от окклюзии, клаудины необходимы для образования плотных контактов. Интегральные мембранные белки плотных контактов связаны с цитоскелетом через зоны окклюзии-1 (ZO-1), ZO-2 и ZO-3. Кроме того, стыки, не связанные с окклюдином, перемешиваются с плотными стыками. В слипчивых соединениях обнаруживаются специфические для эндотелия интегральные мембранные белки VE-кадгерины. Кроме того, семейство белков, называемых молекулами соединительной адгезии (JAM), и недавно обнаруженные молекулы адгезии, избирательной к эндотелиальным клеткам (ESAM), локализуются в плотных контактах ГЭБ.Их точная функция в целостности BBB еще предстоит определить.
Все области мозга не имеют гематоэнцефалического барьера. Структуры, расположенные в стратегических позициях по средней линии желудочковой системы и не имеющие ГЭБ, в совокупности называются окружными желудочковыми органами (CVO). В этих небарьерных областях плотные контакты между эндотелиальными клетками прерываются, что позволяет молекулам проникать. Многие из этих областей участвуют в гормональном контроле.
Области головного мозга без гематоэнцефалического барьера:
- Гипофиз
- Среднее возвышение
- Площадь пострема
- Преоптический карман
- Парафиз
- Шишковидная железа
- Эндотелий сосудистого сплетения
Рисунок 11.4 |
Вещества с высокой растворимостью в липидах могут перемещаться через ГЭБ путем простой диффузии. Распространение — основной механизм проникновения большинства психоактивных веществ. Рисунок 11.2 показывает, что скорость поступления соединений, которые диффундируют в мозг, зависит от их растворимости в липидах. Растворимость липидов оценивается по коэффициенту распределения масло / вода.
На рисунке 11.5a показано, как рассчитывается коэффициент разделения нефть / вода.На рисунке 11.5b показана взаимосвязь между коэффициентом разделения масло / вода и проникновением в мозг выбранных молекул.
Рисунок 11.5a | Рисунок 11.5b | Рисунок 11.6 |
Вода. Вода легко попадает в мозг. Вследствие высокой проницаемости вода свободно перемещается в мозг и выходит из него при изменении осмолярности плазмы. Это явление клинически полезно, так как внутривенное введение плохо проницаемых соединений, таких как маннит, осмотически обезвоживает мозг и снижает внутричерепное давление.Этот метод иногда используется у пациентов с травмами головы для снижения внутричерепного давления.
Газы. Такие газы, как CO2, O2 и летучие анестетики быстро проникают в мозг. Как следствие, скорость, с которой их концентрация в головном мозге приходит в равновесие с плазмой, ограничивается в первую очередь скоростью церебрального кровотока.
11.3 Транспорт глюкозы и аминокислот
Рисунок 11.7 |
Опосредованный переносчиком транспорт позволяет молекулам с низкой растворимостью в липидах преодолевать гематоэнцефалический барьер. Глюкоза из крови попадает в мозг с помощью транспортного белка. Глюкоза — это основной энергетический субстрат мозга. Белок транспорта глюкозы (GLUT-1) высоко обогащен эндотелиальными клетками капилляров головного мозга. Эти переносчики переносят молекулы глюкозы через гематоэнцефалический барьер. Хотя это бывает редко, пациенты с дефицитом Glut-1 (вызванным генетическими мутациями) могут иметь серьезные трудности в обучении.Низкий уровень глюкозы в спинномозговой, но не в крови, указывает на состояние.
Незаменимые аминокислоты не могут быть синтезированы мозгом и, следовательно, должны поступать в результате распада белка и диеты. Фенилаланин, лейцин, тирозин, изолейцин, валин, триптофан, метионин и гистидин, которые являются незаменимыми аминокислотами, а также предшественник дофамина, L-DOPA, попадают в мозг так же быстро, как и глюкоза. Эти аминокислоты транспортируются в мозг с помощью белков, предпочитающих лейцин, или транспортных белков L-типа.Эти соединения конкурируют друг с другом за попадание в мозг. Следовательно, повышение уровня одного из них в плазме подавляет поглощение других. Эта конкуренция может быть важной при некоторых метаболических заболеваниях, таких как фенилкетонурия (ФКУ), когда высокий уровень фенилаланина в плазме снижает поглощение мозгом других незаменимых аминокислот.
Небольшие нейтральные аминокислоты, такие как аланин, глицин, пролин и ГАМК (гамма-аминомасляная кислота), значительно ограничены в их поступлении в мозг.Эти аминокислоты являются незаменимыми аминокислотами и транспортируются с помощью транспортного белка, предпочитающего аланин, или транспортного белка А-типа. Транспортный белок A-типа не присутствует на просветной поверхности гематоэнцефалического барьера. Напротив, эти небольшие нейтральные аминокислоты, по-видимому, транспортируются из мозга через гематоэнцефалический барьер.
11.4 Защита мозга от переносимых с кровью нейротоксинов и лекарственных препаратов
P-гликопротеины — это насосы, управляемые АТФ, которые придают множественную лекарственную устойчивость раковым клеткам, выкачивая лекарства из клеток.Эти белки экспрессируются в эндотелиальных клетках головного мозга, которые могут ограничивать проницаемость ГЭБ гидрофобных соединений, таких как циклоспорин А и винбластин, перекачивая их из эндотелиальных клеток обратно в кровь.
Метаболические процессы в эндотелиальных клетках капилляров головного мозга важны для функции крови и мозга. Большинство нейротрансмиттеров, присутствующих в крови, не попадают в мозг из-за их низкой растворимости в липидах и отсутствия специфических транспортных носителей в просветной мембране эндотелиальных клеток капилляров (см.рис.11.1). Напротив, L-ДОФА, предшественник дофамина, имеет сродство к переносчику L-типа. Следовательно, он легче попадает в мозг из крови, чем можно было бы предсказать, исходя из его липидной растворимости. По этой причине пациентов с болезнью Паркинсона лечат L-ДОФА, а не дофамином. Однако проникновение L-DOPA в мозг ограничено присутствием ферментов L-DOPA декарбоксилазы и моноаминоксидазы в эндотелиальных клетках капилляров. Этот «ферментативный гематоэнцефалический барьер» ограничивает проникновение L-ДОФА в мозг и объясняет необходимость применения больших доз L-ДОФА при лечении болезни Паркинсона.В настоящее время терапия усилена одновременным лечением ингибитором L-DOPA декарбоксилазы.
Рисунок 11.8b |
Эндотелиальная моноаминоксидаза также может играть роль в инактивации нейротрансмиттеров, высвобождаемых нейрональной активностью.Моноамины демонстрируют очень низкое поглощение при поступлении со стороны просвета. Системы захвата моноаминов присутствуют на антилюминальной поверхности эндотелиальных клеток капилляров головного мозга. Эндотелиальный капилляр головного мозга также содержит множество других ферментов, метаболизирующих нейромедиаторы, таких как холинэстеразы, трансаминазы ГАМК, аминопептидазы и эндопептидазы. Кроме того, в капиллярах головного мозга обнаружено несколько ферментов, метаболизирующих лекарства и токсины. Таким образом, «ферментативный гематоэнцефалический барьер» защищает мозг не только от циркулирующих нейротрансмиттеров, но и от многих токсинов.
Скомпрометированный BBB и заболевание. Дисфункция ГЭБ может привести к повреждению нейронов и нарушению функции мозга. Такие заболевания, как энцефалит, рассеянный склероз (РС), инсульт или опухоли, вызывают ухудшение ГЭБ с разрушительным влиянием на функцию нейронов. Эти условия снижают выработку белка плотного соединения клаудина. Опухоли головного мозга вызывают полное разрушение ГЭБ, что приводит к перитуморальному отеку. Кроме того, опухолевые клетки секретируют специфические факторы [например,фактор роста эндотелия сосудов (VEGF), который вызывает образование новых кровеносных сосудов (или ангиогенез)], которые имеют тенденцию к протечке.
Рисунок 11.9 |
Обход ГЭБ с помощью лекарств. Ряд лекарств, имеющих потенциальную терапевтическую ценность, нелегко проникает в мозг, поскольку они обладают низкой растворимостью в липидах и не переносятся специфическими носителями, присутствующими в ГЭБ.Чтобы преодолеть это ограничение, были разработаны схемы, улучшающие поступление лекарств в мозг. 1) Один из способов обойти ГЭБ — доставить лекарство непосредственно в спинномозговую жидкость. Этот подход может использоваться для лечения пациентов с менингитом или раковыми клетками в спинномозговой жидкости. 2) Некоторые вазоактивные соединения, такие как брадикинин и гистамин, которые не изменяют ГЭБ у нормальных людей, могут увеличивать проницаемость ГЭБ при патологических состояниях. Эти соединения можно использовать для доставки химиотерапевтических агентов в мозг.3) Могут быть синтезированы препараты с высокой проницаемостью по ГЭБ для улучшения проникновения в мозг. Большинство нейроактивных препаратов эффективны, потому что растворяются в липидах и легко проникают в мозг. Например, героин и морфин очень похожи по структуре. Однако героин, который имеет две ацетильные группы, более растворим в липидах. Более высокая растворимость героина в липидах объясняет его более быстрое начало действия. Попадая в мозг, ацетильная группа героина удаляется ферментативно с образованием морфина, который лишь медленно покидает мозг.Понимание процесса транспортировки имеет решающее значение для разработки следующего поколения лекарств, полезных для лечения заболеваний мозга.
11.5 Церебральный метаболизм и кровоток
Церебральный метаболизм
Мозг метаболически является одним из самых активных органов тела. Мозг не накапливает лишнюю энергию и получает почти все свои потребности в энергии за счет аэробного окисления глюкозы. Следовательно, для удовлетворения его энергетических потребностей требуется постоянное поступление глюкозы и кислорода.Большая часть энергии, потребляемой мозгом, используется для активного транспорта ионов, чтобы поддерживать и восстанавливать мембранные потенциалы, разряженные в процессе возбуждения и проводимости. Когда приток крови к мозгу прекращается и возникает отсутствие кислорода и крови, потеря сознания наступает через 5-10 секунд. Если кровоток не возобновляется в течение нескольких минут, происходит необратимое повреждение мозга. Хорошо известно, что во время кризов, таких как остановка сердца, повреждение головного мозга происходит раньше всего и имеет решающее значение для определения степени выздоровления.Отсутствие глюкозы столь же разрушительно, но время, приводящее к необратимым повреждениям от гипогликемии, больше, потому что можно использовать другие субстраты.
Различные области мозга имеют разные потребности в энергии, которые связаны с активностью нейронов в этих областях. Измерение количества глюкозы, используемой в минуту в различных областях мозга нормальной сознательной крысы и обезьяны, демонстрирует, что использование глюкозы широко варьируется в разных частях мозга.Причем среднее значение в сером веществе примерно в пять раз больше, чем в белом.
Количество кровотока напрямую связано с активностью мозга. У отдельной группы животных определяли приток крови к областям мозга. Результаты показывают, что больше крови поступает в область мозга с высокой метаболической активностью.
Рисунок 11.10 Взаимосвязь церебрального кровотока и метаболизма глюкозы. |
На рисунке 11.10 показано, что существует отличная корреляция между количеством потребляемой глюкозы и местным церебральным кровотоком.
Регулирование притока крови к области мозга достигается за счет контроля расширения сосудов головного мозга. Расширение кровеносных сосудов контролируется местными факторами, такими как оксид азота (NO), PaCO2, PaO2 и pH. Высокий уровень NO, высокий PaCO2, низкий PaCO2 и низкий pH, которые образуются в результате мозговой деятельности, имеют тенденцию расширять кровеносные сосуды и увеличивать кровоток.Скорость производства этих химических веществ зависит от активности и скорости энергетического обмена. Следовательно, кровоток в области мозга связан с активностью нейронов в этой области.
Утилизация глюкозы и визуализация головного мозга. Метаболизм глюкозы — главный источник энергии для мозга. Глюкоза из крови поступает в мозг с помощью транспортного белка Glut-1. Попав внутрь клетки мозга, он вступает в гликолитический путь, где превращается в пируват, а затем метаболизируется в цикле Кребса с образованием АТФ.Часть молекул АТФ используется для генерации молекул фосфокреатина высокой энергии. В определенных условиях аэробный метаболизм глюкозы способен обеспечить мозг достаточным количеством энергии из АТФ и фосфокреатина для поддержания нормальной функции. Когда возникает мозговая недостаточность, сначала происходит потеря фосфокреатина, за которой следует истощение АТФ, что обычно сигнализирует о серьезном повреждении мозга.
Депривация глюкозы может привести к нарушению функции мозга. Гипогликемия, которая может возникнуть в результате избыточного инсулина, связана с изменениями психического состояния.Эти изменения можно быстро обратить вспять введением глюкозы. В определенных обстоятельствах, например, во время голодания, мозг может использовать «кетоновые тела» вместо глюкозы в качестве субстратов. Кетоновые тела, ацетоацетат и D-бета-гидроксибутират образуются в результате катаболизма жирных кислот в печени. Кетоновые тела метаболизируются с образованием ацил-КоА, который входит в цикл трикарбоновых кислот (ТСА) с достаточной скоростью, чтобы удовлетворить метаболические потребности мозга.
Измерение местного использования глюкозы.Местный энергетический обмен сочетается с местной функциональной активностью. Использование авторадиографического аналога глюкозы, 2-дезоксиглюкозы (2-DG), применялось для измерения метаболизма глюкозы у экспериментальных животных.
Рис. 11.11a | Рисунок 11.11b |
Рисунок 11.4 иллюстрирует фундаментальный принцип метода радиоактивной дезоксиглюкозы для измерения локальной утилизации глюкозы в головном мозге. Утилизация глюкозы начинается с фосфорилирования глюкозы гексокиназой. Образующийся глюкозо-6-фосфат не задерживается в тканях. Вместо этого он далее метаболизируется до продуктов, таких как CO2 и h3O, которые покидают ткань.2-дезоксиглюкоза является аналогом глюкозы и транспортируется через гематоэнцефалический барьер системой носителей глюкозы. Внутри клеток мозга 2-дезоксиглюкоза фосфорилируется гексокиназой до дезоксиглюкозо-6-фосфата (DG-6-P) и не может далее разлагаться на CO2 и h3O. Вместо этого он улавливается и количественно накапливается в ткани в течение разумного периода времени. Помещая метку на дезоксиглюкозу (например, в [18F] фтор-2-дезокси-D-глюкозу), можно измерить скорость образования меченого дезоксиглюкозо-6-фосфата.Количество 18FDG-6-фосфата можно непосредственно определить с помощью позитронно-эмиссионной томографии (ПЭТ). Метод 2-дезоксиглюкозы был модифицирован для использования человеком с ПЭТ, с короткоживущими изотопами, испускающими позитроны, помеченными как 2-дезоксиглюкоза.
11.6 Функциональная активация энергетического метаболизма
Рисунок 11.12 |
Из-за связи метаболизма с функцией функциональная активация с помощью специфических стимулирующих задач приводит к региональному увеличению метаболизма глюкозы в соответствующих структурах головного мозга.Движение пальцев и рук увеличивает метаболизм в соответствующих областях мозга. У добровольцев-правшей спонтанная речь увеличивала метаболическую активность в области Брока. Представление зрительных образов увеличивает использование глюкозы в первичной зрительной коре.
Функциональная МРТ. Вариант МРТ, называемый функциональной МРТ (фМРТ), основан на увеличении кровотока к определенным областям мозга, которое сопровождает активность нейронов. Увеличение кровотока приводит к локальному снижению дезоксигемоглобина из-за меньшей экстракции кислорода.Дезоксигемоглобин парамагнитен и служит источником сигнала в фМРТ. В отличие от ПЭТ, фМРТ использует сигнал, присущий мозгу, и стала предпочтительной технологией для исследования функций мозга.
Рисунок 11.13 |
11.7 Заболевания головного мозга и метаболизм
Судорожные расстройства — это функциональные нарушения мозговой деятельности, приводящие к заметным изменениям метаболизма мозга и мозгового кровотока.Метаболические изменения, обнаруженные с помощью ПЭТ, часто могут дополнять электрофизиологические записи для определения эпилептогенных очагов. Эта информация помогает нейрохирургам удалить эпилептогенный очаг хирургическим путем.
Метаболические измерения с помощью ПЭТ можно использовать для определения размера инфаркта после ишемического инсульта. Опухоли головного мозга имеют высокие метаболические потребности и сильно васкуляризированы. ПЭТ или фМРТ можно использовать для определения местонахождения опухоли и оценки эффективности лечения.
аминокислот для восстановления мозга и когнитивной функции
Нейромедиаторы в нашем мозге отвечают за наш уровень энергии, наши воспоминания, наше настроение, наши способности к обучению и многое другое.Если эти нейротрансмиттеры не сбалансированы, наш мозг не может функционировать и наше благополучие находится под угрозой. Нарушение уровня серотонина может привести к тревоге и депрессии, недостаточность дофамина может вызвать чувство лени и гнева, а без ГАМК, которая помогает нам успокоиться, мы подвержены паническим атакам и стрессу. Аминокислоты действуют как нейротрансмиттеры и помогают стабилизировать уровни нейротрансмиттеров, что делает их ключевой диетической терапией для мозга и психического здоровья. Исследователи также применяют аминокислотную терапию при черепно-мозговой травме.Действительно, аминокислоты играют решающую роль в функциях нашего мозга и многом другом, и в этой статье подробно рассказывается, как диетические аминокислоты для восстановления мозга могут помочь сбалансировать наш разум.
Как работает химия мозга
Клетки нашего мозга общаются через сеть синапсов. Каждая нервная клетка имеет пре- и постсинаптические приемники, которые могут связываться с другими клетками с помощью химических сигнальных молекул. Эти молекулы — наши нейротрансмиттеры. Нейротрансмиттеры путешествуют через крошечные промежутки между клетками, как астронавты без привязки, плавающие с корабля на корабль в космосе.
Когда к одной клетке присоединяется достаточное количество нейромедиаторов, эта клетка передает сигнал следующей клетке, создавая цепную реакцию связи. Как только нейротрансмиттеры передают свое сообщение, другие ферменты приходят, чтобы очистить их, чтобы нервная клетка не активировалась навсегда. Нейромедиаторы либо разрушаются, либо реабсорбируются, что называется обратным захватом.
Равновесие — ключ к предотвращению расстройств мозга и расстройств настроения. Например, СИОЗС — это ингибиторы обратного захвата серотонина, разработанные, чтобы препятствовать чрезмерному захвату серотонина, увеличивая силу его сигнала, так что счастье ощущается более остро, а депрессия подавляется.
Любое нарушение этого процесса, вызванное дисбалансом или травмой, может нарушить работу всей нервной системы. Аминокислоты играют жизненно важную роль в танце нейротрансмиттеров. Давайте узнаем, как это сделать.
Аминокислоты для ремонта мозга
Аминокислоты являются строительными блоками белка в организме, поэтому они имеют решающее значение для создания и восстановления мышечных волокон. Но они также работают, чтобы синтезировать гормоны, необходимые нам для коммуникации по всему телу, и они являются предшественниками наших самых важных нейромедиаторов.
Ароматические аминокислоты тирозин, триптофан и фенилаланин являются предшественниками нейромедиаторов дофамина, серотонина и норэпинефрина (гормона, который функционирует как нейротрансмиттер и регулирует кровяное давление). Аминокислоты с разветвленной цепью лейцин, изолейцин и валин имеют данные, указывающие на то, что они могут помочь восстановить мозг после травм. Вот как каждая из этих аминокислот помогает поддерживать когнитивные функции и активность мозга.
Ароматические аминокислоты и ГАМК
Тирозин, триптофан, фенилаланин и ГАМК — важные аминокислоты, которые могут просто помочь улучшить нейрохимическое восстановление и когнитивные способности.Без правильного баланса ароматических аминокислот вы можете испытывать слишком низкие или слишком высокие уровни следующих нейротрансмиттеров.
1. Дофамин
Низкий уровень дофамина связан с болезнью Паркинсона, прогрессирующим нейродегенеративным расстройством, которое нарушает равновесие, движение, контроль мышц и другие важные функции организма. Слишком высокий уровень дофамина был связан с шизофренией.
Нарушение уровня дофамина может проявляться как отсутствие мотивации, необъяснимое чувство страха или безнадежности, изоляционное поведение и апатия по отношению к семье и друзьям.Без правильного баланса аминокислот уровень дофамина может быть не в порядке.
2. Серотонин
Серотонин, известный как «гормон счастья», тесно связан с настроением и эмоциями, а его недостаточный уровень может быть причиной социальной тревоги и депрессии. Серотонин помогает формировать наше восприятие реальности настолько, что большинство психоделических препаратов, изменяющих это восприятие, воздействуют на серотониновые пути в мозге.
Без достаточного количества серотонина люди чувствуют себя несчастными, беспокойными и больше не могут получать удовольствие от того, что они когда-то делали.Эти чувства могут быть опасными для жизни, особенно у подростков, молодых людей и тех, кто переживает серьезные изменения в жизни.
3. Норэпинефрин
Низкий уровень норадреналина связан с депрессией, СДВГ и низким кровяным давлением. В медицинских целях норадреналин иногда назначают специально для лечения низкого кровяного давления, но как гормон стресса и нейротрансмиттер норадреналин играет большую роль в когнитивной функции.
4. ГАМК
Гамма-аминомасляная кислота, сокращенно ГАМК, действует как баланс против норэпинефрина, успокаивая нервную систему, когда пора отдыхать или спать.Без достаточного количества ГАМК люди испытывают панические расстройства и симптомы, такие как учащенное сердцебиение, одышка, потливость, дрожь, беспокойные мысли и чрезмерное беспокойство.
Исследования на людях показывают, что лечение ГАМК может помочь регулировать тревогу, возвращая баланс в дисбаланс в мозгу. ГАМК можно употреблять в качестве добавки, а также синтезировать в организме из аминокислот с разветвленной цепью.
Аминокислоты с разветвленной цепью (BCAA)
Баланс химических веществ в здоровом мозге достаточно важен, но наши девять незаменимых аминокислот (из которых три аминокислоты с разветвленной цепью) также могут оказывать благотворное влияние в случаях черепно-мозговой травмы (ЧМТ) и когнитивных нарушений.
Penn Medicine News заявляет: «Исследователи неврологии показали, что кормление аминокислотами животных с травмами головного мозга восстанавливает их когнитивные способности и может подготовить почву для первого эффективного лечения когнитивных нарушений, от которых страдают люди с черепно-мозговой травмой».
То, что начинается как клинические испытания, основанные на моделях черепно-мозговой травмы на животных, однажды может помочь людям с повреждением мозга от ЧМТ восстановить качество жизни, просто приняв BCAA лейцин, изолейцин и валин.
Многие спортсмены и бодибилдеры принимают BCAA как часть своего режима приема добавок для синтеза белка и наращивания мышечной массы, но для тех спортсменов, которые занимаются видами спорта, которые связаны с потенциальными травмами головы, эти аминокислоты с разветвленной цепью могут оказаться намного более ценными в этой области. ремонта мозга.
Как избежать дисбаланса мозга
Вы не можете предсказать или предотвратить травму головного мозга (за исключением шлема, когда это уместно), но вы можете помочь предотвратить химический дисбаланс, позаботившись о своем кишечнике.
Незаменимые аминокислоты называются так, потому что мы должны потреблять их из внешних источников, таких как продукты питания или целевые аминокислотные добавки. Употребляя аминокислотные продукты, такие как мясо и источники растительного белка, мы получаем необходимые нам аминокислоты, и мы не только поглощаем наши аминокислоты в кишечнике, но и синтезируем там наши нейромедиаторы. До 90% серотонина вырабатывается в кишечнике, поэтому, если у вас плохое здоровье кишечника, дисбаланс кишечных микробов или у вас нарушение всасывания, такое как болезнь Крона, у вас могут быть нарушения здоровья вашего мозга.
Помимо поддержания здоровья пищеварительной системы, необходимо обеспечить надлежащий баланс всех девяти незаменимых аминокислот. На самом деле, аминокислоты настолько важны для многих функций организма, что специалисты AminoCo разработали научно сбалансированные формулы аминокислот, предназначенные для наращивания мышечной массы и улучшения здоровья печени, здоровья мозга и многого другого.


 2010), которые противодействуют окислительному стрессу (Chauhan et al. 2009; James et al. 2006),
2010), которые противодействуют окислительному стрессу (Chauhan et al. 2009; James et al. 2006), 1982b. Исследования механизма, посредством которого тирозин повышает уровень катехоламинов в моче.Биохим Фарм 31: 3577–3580.
1982b. Исследования механизма, посредством которого тирозин повышает уровень катехоламинов в моче.Биохим Фарм 31: 3577–3580. Журнал Neurochem 12: 483–492.
Журнал Neurochem 12: 483–492. Биохимия 28: 494–504.
Биохимия 28: 494–504. Журнал Neurochem 26: 1253–1255.
Журнал Neurochem 26: 1253–1255. 1993 г.Локализация гена индоламин-2,3-диоксигеназы (IDO) человека в перицентромерной области хромосомы 8 человека. Геномика 17: 262–263.
1993 г.Локализация гена индоламин-2,3-диоксигеназы (IDO) человека в перицентромерной области хромосомы 8 человека. Геномика 17: 262–263. , Линдквист М.1978. Действие антидепрессантов на синтез моноаминов мозга. J Neural Transm 43: 73–91.
, Линдквист М.1978. Действие антидепрессантов на синтез моноаминов мозга. J Neural Transm 43: 73–91. 1984. Прессорный эффект тирозина у гипотензивных крыс не опосредуется тирамином. Life Sci 35: 1207–1212.
1984. Прессорный эффект тирозина у гипотензивных крыс не опосредуется тирамином. Life Sci 35: 1207–1212. Фармакопсихиатрия 20: 242–244.
Фармакопсихиатрия 20: 242–244. Neurosci Lett 244: 17–20.
Neurosci Lett 244: 17–20. Ланцет 335: 645–648.
Ланцет 335: 645–648. Метаболизм 21: 337–342.
Метаболизм 21: 337–342.
 Рен Нутр 12: 8–16.
Рен Нутр 12: 8–16. Психофармакология (Берл) 160: 192–197.
Психофармакология (Берл) 160: 192–197.
 1962. Исследования поглощения ароматических аминокислот мозгом крысы in vivo. Поглощение фенилаланина и триптофана; Подавление и стереоселективность поглощения тирозина мозгом и мышцами.J Biol Chem 237: 803–806.
1962. Исследования поглощения ароматических аминокислот мозгом крысы in vivo. Поглощение фенилаланина и триптофана; Подавление и стереоселективность поглощения тирозина мозгом и мышцами.J Biol Chem 237: 803–806.
 Нейропсихофармакология 25: 149–156.
Нейропсихофармакология 25: 149–156.
 J Biol Chem 244: 1410–1416.
J Biol Chem 244: 1410–1416.