Альбумин — важный белок сыворотки крови
Альбумин (ALB) – белок плазмы крови, который выполняет большое количество важных функций. Он участвует в процессах метаболизма, переносит по организму ряд химических веществ и прочее. Определение уровня этого белка играет важную роль в оценке состояния печени. ALB составляет примерно 60% от общего количества белка.
Биохимический анализ: альбумин
Поддержание оптимального уровня этого белка крайне важно для функционирования организма в целом. От этого зависит объем крови, циркулирующей в организме. Кроме того, белок отвечает за регулирование осмотического давления. Этот показатель меняется под влиянием многих факторов (например, после употребления соленых продуктов). Поэтому его регулирование является очень важным процессом. Альбумин также отвечает за транспортировку и хранение многих биологических соединений и аминокислот. При обследовании состояния здоровья уровень ALB является одним из ключевых показателей.
Кому необходимо сдать анализ
Анализ крови на альбумин используется в комплексе с данными других исследований при диагностике многих заболеваний. Чаще всего анализ назначается при подозрении на патологии почек и печени. Также его результаты используют для оценки состояния здоровья пациентов с онкологическими диагнозами, обширными травмами или ожогами. Тест назначается самостоятельно или в комплексе с другими анализами. Состав необходимого в конкретном случае обследования определяется врачом на основании жалоб пациента, результатов осмотра, анамнеза.
Интерпретация результатов
Альбумин синтезируется в печени. В норме за сутки вырабатывается примерно 15 грамм белка. Он сохраняется в организме и выполняет свои функции в течение нескольких недель. Основное назначение данного теста – оценка белково-синтетической функции печени.
Повышение показателей свидетельствует об обезвоживании организма. Причины дегидратации могут быть разными (например, серьезные ожоги).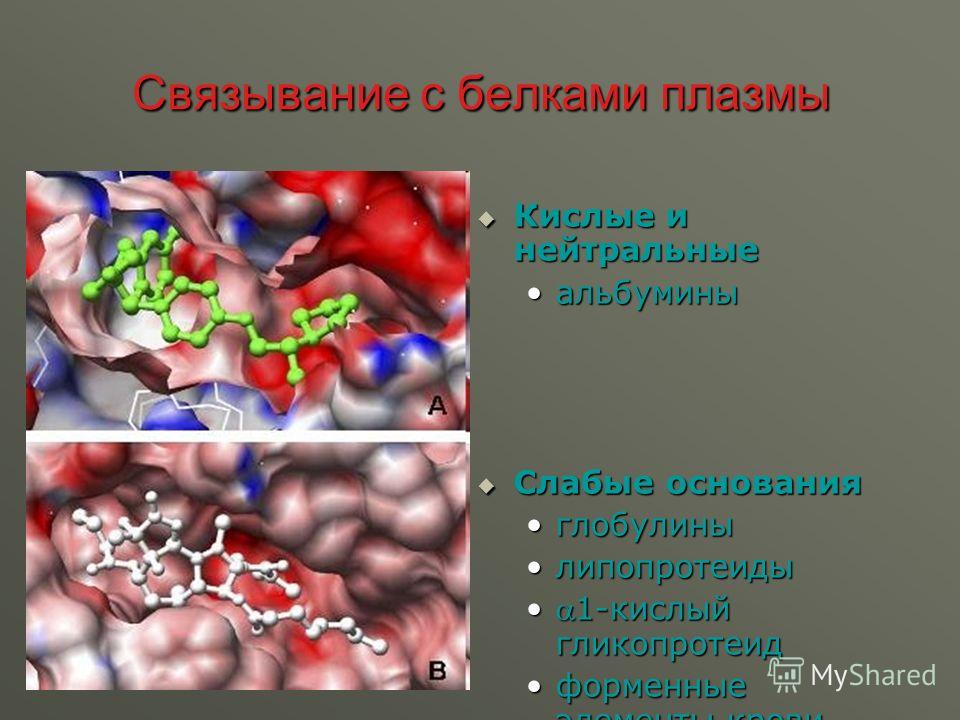
Недостаток белка в большинстве случаев указывает на патологии почек. Также он может наблюдаться при наличии воспалительного процесса. Снижение показателей во время беременности является нормой. Референсные значения зависят от возраста пациента. Для взрослых норма колеблется в пределах 35-52 г/л. По результатам теста можно судить о степени тяжести ряда заболеваний.
Выводы
Количество ALB требуется для диагностики ряда заболеваний, выбора оптимальной тактики лечения. Оно характеризует обмен веществ, состояние здоровья в целом. При выраженных симптомах проблем с почками данный тест назначается в первую очередь. Также он может проводиться в составе комплексного обследования либо после него, если выявлены отклонения и необходимо уточнить их характер и причину.
 В некоторых случаях возможны отклонения от нормы при отсутствии заболеваний.
В некоторых случаях возможны отклонения от нормы при отсутствии заболеваний.
Альбумин человеческий инструкция по применению: показания, противопоказания, побочное действие – описание Human albumin р-р д/инф. 20%: фл. 50 мл или 100 мл (3850)
Аллергические реакции/анафилактический шок
Любое подозрение на аллергические или анафилактические реакции требуют немедленного прекращения введения препарата. В случае развития шока следует применять стандартную противошоковую терапию.
Так как данный препарат изготавливается из плазмы крови человека, он может нести в себе риск передачи возбудителей инфекций, например, вирусов и, теоретически, возбудителя болезни Крейцфельда-Якоба. Это также относится и к неизвестным или новым вирусам и другим патогенам.
Риск передачи возбудителей инфекций снижен путем скрининга доноров плазмы на предмет возможного заражения определенными вирусами в прошлом, путем тестирования на наличие в настоящее время определенных вирусных инфекций, а также путем инактивации и/или удаления определенных вирусов. Принятые меры считаются эффективными для оболочечных вирусов, таких как ВИЧ, вирус гепатита В, вирус гепатита С, а также для безоболочечных вирусов, таких как вирус гепатита А и парвовирус В19. Настоятельно рекомендуется при каждом введении Альбумина человечеcкого пациенту записывать название и номер серии препарата с целью установления связи между пациентом и серией препарата.
Принятые меры считаются эффективными для оболочечных вирусов, таких как ВИЧ, вирус гепатита В, вирус гепатита С, а также для безоболочечных вирусов, таких как вирус гепатита А и парвовирус В19. Настоятельно рекомендуется при каждом введении Альбумина человечеcкого пациенту записывать название и номер серии препарата с целью установления связи между пациентом и серией препарата.
Гемодинамика
Не вводить без тщательного контроля гемодинамических показателей, отслеживать развитие симптомов сердечной или дыхательной недостаточности, почечной недостаточности или повышения внутричерепного давления.
Гиперволемия/гемодилюция
Альбумин человеческий следует применять с осторожностью при состояниях, при которых гиперволемия и ее последствия или гемодилюция могут представлять особый риск для пациента. Примерами таких состояний являются: декомпенсированная сердечная недостаточность, гипертензия, варикозное расширение вен, отек легкого, геморрагический диатез, тяжелая анемия, почечная и постренальная недостаточность. Скорость введения должна быть подобрана в соответствии с концентрацией раствора и гемодинамическими параметрами пациента. Быстрое введение может привести к циркуляторной перегрузке и отеку легких. При первых клинических признаках перегрузки сердечно-сосудистой системы (головная боль, одышка, закупорка яремных вен) или повышении кровяного давления, повышения давления в центральной вене и отеке легких введение препарата следует немедленно прекратить.
Скорость введения должна быть подобрана в соответствии с концентрацией раствора и гемодинамическими параметрами пациента. Быстрое введение может привести к циркуляторной перегрузке и отеку легких. При первых клинических признаках перегрузки сердечно-сосудистой системы (головная боль, одышка, закупорка яремных вен) или повышении кровяного давления, повышения давления в центральной вене и отеке легких введение препарата следует немедленно прекратить.
Применение в педиатрической практике
Безопасность и эффективность раствора Альбумина человечеcкого у пациентов детского возраста не установлена, однако какие-либо дополнительные риски применения данного препарата у детей, кроме рисков, существующих при его применении у взрослых, не выявлены.
Большие объемы
При замещении сравнительно больших объемов необходимо осуществлять контроль показателей системы свертывания и уровня гематокрита. Необходимо обеспечить адекватное замещение других компонентов крови (факторов свертывания, электролитов, тромбоцитов и эритроцитов). Необходимо строго мониторировать гемодинамические показатели.
Необходимо строго мониторировать гемодинамические показатели.
Электролитный статус
При введении Альбумина человечеcкого следует контролировать электролитный статус пациента, а также принимать необходимые меры для восстановления и поддержания баланса электролитов.
Кровяное давление
Повышение кровяного давления после инфузии Альбумина человечеcкого обусловливает необходимость тщательного наблюдения за пациентом после травмы или после хирургического вмешательства с целью обнаружения и лечения поврежденных сосудов, которые могли не кровоточить при более низком давлении крови.
Применение, обращение и утилизация
Раствор Альбумина человечеcкого не должен смешиваться с другими лекарственными средствами, в т.ч. с цельной кровью и компонентами крови, однако он может использоваться как сопутствующее средство, если это целесообразно с медицинской точки зрения.
Не использовать при помутнении раствора или нарушении герметичности флакона. Препараты для парентерального введения перед применением должны визуально обследоваться на наличие механических включений и изменение цвета, если раствор и контейнер позволяют это сделать. При обнаружении утечек препарат необходимо выбросить.
Препараты для парентерального введения перед применением должны визуально обследоваться на наличие механических включений и изменение цвета, если раствор и контейнер позволяют это сделать. При обнаружении утечек препарат необходимо выбросить.
Существует риск гемолиза с потенциально летальными последствиями, а также риск острой почечной недостаточности при использовании стерильной воды для инъекций для разведения альбумина человеческого с концентрацией 20% и выше. Рекомендуемые растворители включают 0.9% раствор натрия хлорида или 5% раствор декстрозы в воде.
Влияние на способность к управлению транспортными средствами и механизмами
Данные о влиянии Альбумина человечеcкого на способность к вождению автомобиля и работу с другими машинами и механизмами отсутствуют.
| Альбумин человеческий | Р-р д/инф. | |||
| Волювен | Раствор для инфузий рег. №: П N011337/01 от 30.01.12 | |||
| Волюлайт | Раствор для инфузий рег. №: ЛП-000025
от 08.11.10 №: ЛП-000025
от 08.11.10 | |||
| Гемодез-8000 | Раствор для инфузий рег. №: Р N000671/01 от 12.05.11 | |||
| Гемодез-Н | Р-р д/инф. | |||
| Глюкостерил | Раствор для инфузий рег. №: П N011834/01 от 30.09.11 | |||
| Допамин Адмеда | Концентрат для приготовления раствора для инфузий рег. №: П N015933/01
от 30.06.11 №: П N015933/01
от 30.06.11 | |||
| Дофамин-Бинергия | Конц. д/пригот. р-ра д/инф. 5 мг/1 мл: амп. 5 мл 5, 10, 250 или 500 шт. рег. №: ЛП-000444 от 01.03.11 Дата перерегистрации: 20.03.20Конц. Конц. д/приготовления р-ра д/инфузий 20 мг/1 мл: 5 мл амп. 5, 10, 250 или 500 шт. рег. №: ЛП-000444 от 01.03.11 Дата перерегистрации: 20.03.20Конц. д/приготовления р-ра д/инфузий 40 мг/1 мл: 5 мл амп. 5, 10, 250 или 500 шт. рег. №: ЛП-000444 от 01.03.11 Дата перерегистрации: 20.03.20 | |||
| Желатиноль | Раствор для инфузий в растворе натрия хлорида 0. | |||
| Зенальб-20 | Раствор для инфузий рег. №: П N009282 от 06.10.08 | |||
| Ивепред | Лиофилизат д/пригот. Лиофилизат д/пригот. р-ра д/в/в и в/м введения 1000 мг: фл. 1 шт. в компл. с растворителем рег. №: ЛП-002113 от 28.06.13 | |||
| Инфукол ГЭК | Р-р д/инф. Р-р д/инф. 10%: фл. 100 мл, 250 мл или 500 мл рег. №: П N014908/01-2003 от 29.04.08 | |||
| Квинтасоль | Р-р д/инф.: фл. 200 мл или 400 мл рег. №: ЛС-000239 от 03.12.09 | |||
| Конфумин® | Раствор для инфузий рег. | |||
| Мафусол | Р-р д/инф.: фл. 400 мл или 450 мл рег. №: ЛСР-009901/08 от 11.12.08 | |||
| Мезатон | Р-р д/инъекц. | |||
| Метипред | Лиофилизат д/пригот. р-ра д/в/в и в/м введения 250 мг: фл. 1 шт. рег. №: П N015709/02 от 20.02.09 Дата перерегистрации: 18.01.16Лиофилизат д/пригот. р-ра д/в/в и в/м введения 250 мг: фл. | |||
| Перфторан® | Эмульсия для инфузий рег. №: Р N001962/01 от 07.08.08 Дата перерегистрации: 27.04.16 | |||
| Плазбумин-20 | Р-р д/инф. Р-р д/инф. 20% (10 г/50 мл): фл. 1 или 100 шт. рег. №: П N014887/01 от 06.05.08 | |||
| Плазма-Лит 148 водный раствор | Раствор для инфузий рег. №: П N014661/01-2002 от 23.01.09 | |||
| Преднизолон | Р-р д/инъекц. | |||
| Раствор Рингера | Р-р д/инф.: бут. 200 мл или 400 мл рег. №: ЛП-000349 от 22.02.11 Дата перерегистрации: 26.08.16 | |||
| Раствор Рингера | Р-р д/инф. | |||
| Реоглюман | Р-р д/инф. 10 г+5 г+900 мг/100 мл: фл. 400 мл рег. №: Р N001779/01-2002 от 17.06.08 | |||
| Реополиглюкин с глюкозой | Р-р д/инф. | |||
| Реополиглюкин-40 | Р-р д/инф. 10%: фл. 200 мл 1, 24 или 28 шт., фл. 400 мл 1, 12 или 15 шт. рег. №: Р N002530/01 от 17.04.08 | |||
| Реосорбилакт® | Раствор для инфузий рег. №: ЛСР-003845/08
от 19.05.08 №: ЛСР-003845/08
от 19.05.08 | |||
| Рингера-лактат с магнием | Раствор для инфузий рег. №: Р N000077/01-2000 от 27.01.12 | |||
| Сорбилакт® | Раствор для инфузий рег. №: ЛСР-003832/08
от 19.05.08 №: ЛСР-003832/08
от 19.05.08 | |||
| Тетраспан 10 | Раствор для инфузий рег. №: ЛСР-008114/08 от 14.10.08 | |||
| Тетраспан 6 | Раствор для инфузий рег. №: ЛСР-006272/08
от 06.08.08 №: ЛСР-006272/08
от 06.08.08 | |||
| Трометамол Н | Раствор для инфузий рег. №: ЛСР-001567/08 от 14.03.08 | |||
| Гелоплазма Баланс | Раствор для инфузий рег. №: ЛСР-009253/08
от 21.11.08 №: ЛСР-009253/08
от 21.11.08 | |||
| ГиперХАЕС | Раствор для инфузий рег. №: ЛС-001399 от 10.06.11 | |||
| Декстроза | Р-р д/инф. | |||
| Декстроза | Р-р д/инф. 5%: бут. или фл. 100 мл рег. №: ЛП-000161 от 13.01.11 | |||
| Деперзолон | Раствор для в/в и в/м введения рег. №: П N012433/01
от 16.09.05 №: П N012433/01
от 16.09.05 | |||
| Лемод® | Лиофилизат д/пригот. р-ра д/в/в и в/м введения 125 мг: фл. в компл. с растворителем рег. №: ЛСР-001550/08 от 14.03.08 | |||
| Лемод® | Таб. | |||
| Плазма | Лиофилизат д/пригот. р-ра д/инф. 14 г: бут. рег. №: ЛС-002619 от 29.12.06 | |||
| Плазма | Лиофилизат д/пригот. | |||
| Полиоксифумарин | Р-р д/инф: 200 мл или 100 мл бут. 1 шт., 400 мл бут. 1 или 5 шт. рег. №: 99/398/8 от 05.11.99 | |||
| Полиоксифумарин | Р-р д/инф: бут. | |||
| Хаес-Стерил | Р-р д/инф. 10% (ГЭК 200/0.5): фл. стеклян. 250 мл или 500 мл 10 шт. с держателями д/капельн. или без них, фл. пласт. 250 мл или 500 мл 10 или 20 шт. с петлей-держателем д/капельн., контейнеры полиолеф. «фрифлекс» 250 мл или 500 мл 10, 15, 20 или 30 шт. рег. №: П N013101/01 от 07.06.10 | |||
| Хаес-Стерил | Р-р д/инф. | |||
| Альбумин человеческий | Р-р д/инф. 20%: фл. 50 мл или 100 мл рег. №: П N015003/01 от 29.06.11 | |||
| Волювен | Раствор для инфузий рег. №: П N011337/01
от 30.01.12 №: П N011337/01
от 30.01.12 | |||
| Волюлайт | Раствор для инфузий рег. №: ЛП-000025 от 08.11.10 | |||
| Гемодез-8000 | Раствор для инфузий рег. №: Р N000671/01
от 12.05.11 №: Р N000671/01
от 12.05.11 | |||
| Гемодез-Н | Р-р д/инф.: бут. 100 мл, 200 мл, 250 мл, 400 мл или 500 мл 1 шт. рег. №: ЛС-002115 от 09.04.12 Дата перерегистрации: 03.09.19 | |||
| Глюкостерил | Раствор для инфузий рег. №: П N011834/01
от 30.09.11 №: П N011834/01
от 30.09.11 | |||
| Дексаметазон | Р-р д/инъекц. 4 мг/1 мл: амп. 5, 10, 20, 25 или 25 шт. рег. №: П N014442/01-2002 от 18.11.08Р-р д/инъекц. 8 мг/2 мл: амп. 5, 10, 15, 20 или 25 шт. рег. №: П N014442/01-2002 от 18.11.08 | |||
| Дексаметазон-Виал | Раствор для инъекций рег. №: ЛСР-006923/10
от 21.07.10 №: ЛСР-006923/10
от 21.07.10 | Упаковано: ОЗОН (Россия) | ||
| Допамин Адмеда | Концентрат для приготовления раствора для инфузий рег. №: П N015933/01
от 30.06.11 №: П N015933/01
от 30.06.11 | |||
| Дофамин-Бинергия | Конц. д/пригот. р-ра д/инф. 5 мг/1 мл: амп. 5 мл 5, 10, 250 или 500 шт. рег. №: ЛП-000444 от 01.03.11 Дата перерегистрации: 20.03.20Конц. Конц. д/приготовления р-ра д/инфузий 20 мг/1 мл: 5 мл амп. 5, 10, 250 или 500 шт. рег. №: ЛП-000444 от 01.03.11 Дата перерегистрации: 20.03.20Конц. д/приготовления р-ра д/инфузий 40 мг/1 мл: 5 мл амп. 5, 10, 250 или 500 шт. рег. №: ЛП-000444 от 01.03.11 Дата перерегистрации: 20.03.20 | |||
| Желатиноль | Раствор для инфузий в растворе натрия хлорида 0. | |||
| Зенальб-20 | Раствор для инфузий рег. №: П N009282 от 06.10.08 | |||
| Ивепред | Лиофилизат д/пригот. Лиофилизат д/пригот. р-ра д/в/в и в/м введения 1000 мг: фл. 1 шт. в компл. с растворителем рег. №: ЛП-002113 от 28.06.13 | |||
| Инфукол ГЭК | Р-р д/инф. Р-р д/инф. 10%: фл. 100 мл, 250 мл или 500 мл рег. №: П N014908/01-2003 от 29.04.08 | |||
| Квинтасоль | Р-р д/инф.: фл. 200 мл или 400 мл рег. №: ЛС-000239 от 03.12.09 | |||
| Конфумин® | Раствор для инфузий рег. №: ЛП-001067
от 27.10.11
Дата перерегистрации: 16.03.17 №: ЛП-001067
от 27.10.11
Дата перерегистрации: 16.03.17 | |||
| Мафусол | Р-р д/инф.: фл. 400 мл или 450 мл рег. №: ЛСР-009901/08 от 11.12.08 | |||
| Мезатон | Р-р д/инъекц. | |||
| Метипред | Лиофилизат д/пригот. р-ра д/в/в и в/м введения 250 мг: фл. 1 шт. рег. №: П N015709/02 от 20.02.09 Дата перерегистрации: 18.01.16Лиофилизат д/пригот. р-ра д/в/в и в/м введения 250 мг: фл. | |||
| Перфторан® | Эмульсия для инфузий рег. №: Р N001962/01 от 07.08.08 Дата перерегистрации: 27.04.16 | |||
| Плазма-Лит 148 водный раствор | Раствор для инфузий рег. №: П N014661/01-2002
от 23.01.09 №: П N014661/01-2002
от 23.01.09 | |||
| Преднизол | Раствор для в/в и в/м введения рег. №: П N013091/01 от 07.09.07 | |||
| Преднизолон | Р-р д/инъекц. | |||
| Раствор Рингера | Р-р д/инф.: бут. 200 мл или 400 мл рег. №: ЛП-000349 от 22.02.11 Дата перерегистрации: 26.08.16 | |||
| Раствор Рингера | Р-р д/инф. | |||
| Реоглюман | Р-р д/инф. 10 г+5 г+900 мг/100 мл: фл. 400 мл рег. №: Р N001779/01-2002 от 17.06.08 | |||
| Реополиглюкин с глюкозой | Р-р д/инф. | |||
| Реополиглюкин-40 | Р-р д/инф. 10%: фл. 200 мл 1, 24 или 28 шт., фл. 400 мл 1, 12 или 15 шт. рег. №: Р N002530/01 от 17.04.08 | |||
| Реосорбилакт® | Раствор для инфузий рег. №: ЛСР-003845/08
от 19.05.08 №: ЛСР-003845/08
от 19.05.08 | |||
| Рингера-лактат с магнием | Раствор для инфузий рег. №: Р N000077/01-2000 от 27.01.12 | |||
| Солу-Кортеф | Лиофилизат д/пригот р-ра д/в/в и в/м введен. Лиофилизат д/пригот р-ра д/в/в и в/м введен. 100 мг: фл. 1 шт. рег. №: П N008915 от 19.09.11 | |||
| Солу-Медрол® | Лиофилизат д/пригот. р-ра д/в/в и в/м введения 1 г: фл. в компл. с растворителем рег. №: П N014983/01
от 12.08.09 №: П N014983/01
от 12.08.09Лиофилизат д/пригот. р-ра д/в/в и в/м введения 250 мг: фл. двухъемкостные с растворителем рег. №: П N014983/01 от 12.08.09Лиофилизат д/пригот. р-ра д/в/в и в/м введения 500 мг: фл. в компл. с растворителем рег. №: П N014983/01 от 12.08.09 | |||
| Сорбилакт® | Раствор для инфузий рег. №: ЛСР-003832/08
от 19.05.08 №: ЛСР-003832/08
от 19.05.08 | |||
| Тетраспан 10 | Раствор для инфузий рег. №: ЛСР-008114/08 от 14.10.08 | |||
| Тетраспан 6 | Раствор для инфузий рег. №: ЛСР-006272/08
от 06.08.08 №: ЛСР-006272/08
от 06.08.08 | |||
| Трометамол Н | Раствор для инфузий рег. №: ЛСР-001567/08 от 14.03.08 | |||
| Гелоплазма Баланс | Раствор для инфузий рег. №: ЛСР-009253/08 от 21.11.08 | |||
| ГиперХАЕС | Раствор для инфузий рег. №: ЛС-001399 от 10.06.11 | |||
| Декстроза | Р-р д/инф. 10%: бут. или фл. 100 мл рег. №: ЛП-000161 от 13.01.11 | |||
| Декстроза | Р-р д/инф. 5%: бут. или фл. 100 мл рег. №: ЛП-000161 от 13.01.11 | |||
| Деперзолон | Раствор для в/в и в/м введения рег. №: П N012433/01 от 16.09.05 | |||
| Лемод® | Лиофилизат д/пригот. р-ра д/в/в и в/м введения 125 мг: фл. в компл. с растворителем рег. №: ЛСР-001550/08 от 14.03.08 | |||
| Лемод® | Таб. 4 мг: 20 шт. рег. №: ЛСР-001573/08 от 14.03.08 | |||
| Плазма | Лиофилизат д/пригот. р-ра д/инф. 14 г: бут. рег. №: ЛС-002619 от 29.12.06 | |||
| Плазма | Лиофилизат д/пригот. р-ра д/инф. 4 г: бут. рег. №: ЛС-002619 от 29.12.06 | |||
| Полиоксифумарин | Р-р д/инф: 200 мл или 100 мл бут. 1 шт., 400 мл бут. 1 или 5 шт. рег. №: 99/398/8 от 05.11.99 | |||
| Полиоксифумарин | Р-р д/инф: бут. 200 мл или 400 мл рег. №: ЛП-000196 от 08.02.11 Дата перерегистрации: 12.04.12 | |||
| Хаес-Стерил | Р-р д/инф. 10% (ГЭК 200/0.5): фл. стеклян. 250 мл или 500 мл 10 шт. с держателями д/капельн. или без них, фл. пласт. 250 мл или 500 мл 10 или 20 шт. с петлей-держателем д/капельн., контейнеры полиолеф. «фрифлекс» 250 мл или 500 мл 10, 15, 20 или 30 шт. рег. №: П N013101/01 от 07.06.10 | |||
| Хаес-Стерил | Р-р д/инф. 6% (ГЭК 200/0.5): фл. стеклян. 250 мл или 500 мл 10 шт. с держателями д/капельн. или без них, фл. пласт. 250 мл или 500 мл 10 или 20 шт. с петлей-держателем д/капельн., контейнеры полиолеф. «фрифлекс» 250 мл или 500 мл 10, 15, 20 или 30 шт. рег. №: П N013101/01 от 07.06.10 | |||
| Альбумин человеческий | Р-р д/инф. 20%: фл. 50 мл или 100 мл рег. №: П N015003/01 от 29.06.11 | |||
| Волювен | Раствор для инфузий рег. №: П N011337/01 от 30.01.12 | |||
| Волюлайт | Раствор для инфузий рег. №: ЛП-000025 от 08.11.10 | |||
| Гемодез-8000 | Раствор для инфузий рег. №: Р N000671/01 от 12.05.11 | |||
| Дексаметазон | Р-р д/инъекц. 4 мг/1 мл: амп. 5, 10, 20, 25 или 25 шт. рег. №: П N014442/01-2002 от 18.11.08Р-р д/инъекц. 8 мг/2 мл: амп. 5, 10, 15, 20 или 25 шт. рег. №: П N014442/01-2002 от 18.11.08 | |||
| Дексаметазон-Виал | Раствор для инъекций рег. №: ЛСР-006923/10 от 21.07.10 | Упаковано: ОЗОН (Россия) | ||
| Допамин Адмеда | Концентрат для приготовления раствора для инфузий рег. №: П N015933/01 от 30.06.11 | |||
| Желатиноль | Раствор для инфузий в растворе натрия хлорида 0.9% рег. №: Р N001285/01-2002 от 20.08.08 | |||
| Ивепред | Лиофилизат д/пригот. р-ра д/в/в и в/м введения 500 мг: фл. 1 шт. в компл. с растворителем рег. №: ЛП-002113 от 28.06.13Лиофилизат д/пригот. р-ра д/в/в и в/м введения 1000 мг: фл. 1 шт. в компл. с растворителем рег. №: ЛП-002113 от 28.06.13 | |||
| Инфукол ГЭК | Р-р д/инф. 6%: фл. 100 мл, 250 мл или 500 мл рег. №: П N014908/01-2003 от 29.04.08Р-р д/инф. 10%: фл. 100 мл, 250 мл или 500 мл рег. №: П N014908/01-2003 от 29.04.08 | |||
| Квинтасоль | Р-р д/инф.: фл. 200 мл или 400 мл рег. №: ЛС-000239 от 03.12.09 | |||
| Конфумин® | Раствор для инфузий рег. №: ЛП-001067 от 27.10.11 Дата перерегистрации: 16.03.17 | |||
| Мафусол | Р-р д/инф.: фл. 400 мл или 450 мл рег. №: ЛСР-009901/08 от 11.12.08 | |||
| Мезатон | Р-р д/инъекц. 10 мг/1 мл: амп. 10 шт. рег. №: П N016059/01 от 24.09.09 Дата перерегистрации: 09.04.13 | |||
| Метипред | Лиофилизат д/пригот. р-ра д/в/в и в/м введения 250 мг: фл. 1 шт. рег. №: П N015709/02 от 20.02.09 Дата перерегистрации: 18.01.16Лиофилизат д/пригот. р-ра д/в/в и в/м введения 250 мг: фл. 1 шт. в компл. с растворителем (амп. 4 мл 1 шт.) рег. №: П N015709/02 от 20.02.09 Дата перерегистрации: 18.01.16 | |||
| Перфторан® | Эмульсия для инфузий рег. №: Р N001962/01 от 07.08.08 Дата перерегистрации: 27.04.16 | |||
| Преднизол | Раствор для в/в и в/м введения рег. №: П N013091/01 от 07.09.07 | |||
| Преднизолон | Р-р д/инъекц. 30 мг/1 мл: амп. 3, 5, 6, 10 или 20 шт. рег. №: П N014426/01-2002 от 19.11.08 | |||
| Раствор Рингера | Р-р д/инф.: бут. 200 мл или 400 мл рег. №: ЛП-000349 от 22.02.11 Дата перерегистрации: 26.08.16 | |||
| Раствор Рингера | Р-р д/инф.: фл. 500 мл 1 или 10 шт. рег. №: П N014717/01 от 10.04.08 | |||
| Реоглюман | Р-р д/инф. 10 г+5 г+900 мг/100 мл: фл. 400 мл рег. №: Р N001779/01-2002 от 17.06.08 | |||
| Реополиглюкин с глюкозой | Р-р д/инф. 10 г+5 г/100 мл: фл. 100 мл 1 или 56 шт., фл. 200 мл 1, 24 или 28 шт, фл. 250 мл 24 или 28 шт, фл. 400 мл 1,12 или 15 шт, фл. 500 мл 12 или 15 шт. рег. №: ЛС-001517 от 31.08.11 | |||
| Реополиглюкин-40 | Р-р д/инф. 10%: фл. 200 мл 1, 24 или 28 шт., фл. 400 мл 1, 12 или 15 шт. рег. №: Р N002530/01 от 17.04.08 | |||
| Реосорбилакт® | Раствор для инфузий рег. №: ЛСР-003845/08 от 19.05.08 | |||
| Рингера-лактат с магнием | Раствор для инфузий рег. №: Р N000077/01-2000 от 27.01.12 | |||
| Солу-Кортеф | Лиофилизат д/пригот р-ра д/в/в и в/м введен. 100 мг: фл. двухъемкостн. 1 шт. (с растворителем) рег. №: П N008915 от 19.09.11Лиофилизат д/пригот р-ра д/в/в и в/м введен. 100 мг: фл. 1 шт. рег. №: П N008915 от 19.09.11 | |||
| Сорбилакт® | Раствор для инфузий рег. №: ЛСР-003832/08 от 19.05.08 | |||
| Тетраспан 10 | Раствор для инфузий рег. №: ЛСР-008114/08 от 14.10.08 | |||
| Тетраспан 6 | Раствор для инфузий рег. №: ЛСР-006272/08 от 06.08.08 | |||
| Гелоплазма Баланс | Раствор для инфузий рег. №: ЛСР-009253/08 от 21.11.08 | |||
| ГиперХАЕС | Раствор для инфузий рег. №: ЛС-001399 от 10.06.11 | |||
| Декстроза | Р-р д/инф. 10%: бут. или фл. 100 мл рег. №: ЛП-000161 от 13.01.11 | |||
| Декстроза | Р-р д/инф. 5%: бут. или фл. 100 мл рег. №: ЛП-000161 от 13.01.11 | |||
| Плазма | Лиофилизат д/пригот. р-ра д/инф. 14 г: бут. рег. №: ЛС-002619 от 29.12.06 | |||
| Плазма | Лиофилизат д/пригот. р-ра д/инф. 4 г: бут. рег. №: ЛС-002619 от 29.12.06 | |||
| Полиоксифумарин | Р-р д/инф: 200 мл или 100 мл бут. 1 шт., 400 мл бут. 1 или 5 шт. рег. №: 99/398/8 от 05.11.99 | |||
| Полиоксифумарин | Р-р д/инф: бут. 200 мл или 400 мл рег. №: ЛП-000196 от 08.02.11 Дата перерегистрации: 12.04.12 | |||
| Хаес-Стерил | Р-р д/инф. 10% (ГЭК 200/0.5): фл. стеклян. 250 мл или 500 мл 10 шт. с держателями д/капельн. или без них, фл. пласт. 250 мл или 500 мл 10 или 20 шт. с петлей-держателем д/капельн., контейнеры полиолеф. «фрифлекс» 250 мл или 500 мл 10, 15, 20 или 30 шт. рег. №: П N013101/01 от 07.06.10 | |||
| Хаес-Стерил | Р-р д/инф. 6% (ГЭК 200/0.5): фл. стеклян. 250 мл или 500 мл 10 шт. с держателями д/капельн. или без них, фл. пласт. 250 мл или 500 мл 10 или 20 шт. с петлей-держателем д/капельн., контейнеры полиолеф. «фрифлекс» 250 мл или 500 мл 10, 15, 20 или 30 шт. рег. №: П N013101/01 от 07.06.10 | |||
Анализы в KDL. Белковые фракции (включает определение общего белка и альбумина)
Белковые фракции представляют собой совокупность различных групп белков, которые в сумме составляют общий белок крови. К ним относятся альфа-1 и альфа 2 глобулины, бета-1 и бета-2 глобулины и гамма-глобулин, а также альбумин. Эти фракции находятся в определенном качественном и количественном соотношении, изменение которого может указывать на наличие тех или иных заболеваний.
Изменение процентного соотношения белковых фракций крови наблюдается при многих заболеваниях, в первую очередь, моноклональных гаммапатиях (множественная миелома, макроглобулинемия Вальденстрема), хроническом миелобластном лейкозе, нефротическом синдроме, амилоидозе, болезнях печени и аутоиммунных процессах. Для диагностики этих заболеваний назначается анализ белковых фракций методом электрофореза.
В каких случаях обычно назначают исследование?
- При диагностике моноклональных и поликлональных гаммапатий;
- При заболеваниях почек и печени;
- При подозрении на хронические инфекционные или аутоиммунные воспалительные процессы;
- При диагностике иммунодефицитных состояний;
- При наличии симптомов рассеянного склероза.
Что именно определяется в процессе анализа?
Электрофорез белков – это метод разделения белковых молекул в исследуемом образце. Его принцип заключается в том, что молекулы с разной массой, зарядом и формой в электрическом поле движутся с различной скоростью и отображаются в результате как полосы разной ширины и с местоположением, специфичным для каждой фракции. Самая интенсивная полоса соответствует альбумину, на долю которого приходится около 70% общего белка крови. Остальные полосы имеют свои нормы интенсивности, отклонение от которых свидетельствует о тех или иных нарушениях в организме. Например, при отсутствии какой-либо полосы можно говорить о дефиците белка, избыток же указывает на повышенную выработку этой группы белков, что, например, встречается при гаммапатиях. Наиболее характерным патологическим признаком является пик – резкое увеличение интенсивности одной из фракций белка.
Как врачам, так и пациентам следует помнить о том, что электрофорез белков не является специфичным методом, поскольку отклонения в результатах анализа наблюдаются при многих заболеваниях. Для дальнейшей диагностики необходимы другие профильные анализы и инструментальные исследования.
Что означают результаты теста?
Любые отклонения от нормы, в особенности появление пиков и резко выраженный избыток или недостаток какой-либо фракции – серьезный повод для консультации с врачом и дальнейшего обследования, поскольку могут указывать на наличие серьезных патологических процессов в организме. Однако следует помнить о том, что электрофорез белков – неспецифический тест и его недостаточно для установления диагноза.
При моноклональных гаммапатиях происходит бесконтрольная выработка одного вида иммуноглобулинов (IgG, IgM или IgA), что отражается в результатах электрофореза появлением узкого интенсивного пика гамма-глобулинов – так называемый М-пик. Этот показатель является важным диагностическим критерием, однако он не позволяет отличить миеломную болезнь от гаммапатии другого генеза, поскольку сам метод электрофореза не способен определить тип иммуноглобулина, выработка которого повышена. Для этого используется другое исследование — Типирование парапротеина в сыворотке крови (с помощью иммунофиксации с панелью антисывороток IgG, IgA, IgM, kappa, lambda).
При поликлональной гаммапатии нет выраженного М-пика; вместо этого наблюдается увеличение всей полосы гамма-глобулинов. Это может указывать на хронические воспалительные процессы в организме, аутоиммунные заболевания и патологию печени.
При иммунодефицитных состояниях концентрация иммуноглобулинов резко снижается, что отражается в результате анализа отсутствием или низкой интенсивностью полосы гамма-глобулинов. Пример такого заболевания – агаммаглобулинемия Брутона.
Сроки выполнения теста.
Обычно результат анализа можно получить через 1-2 дня после сдачи крови.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены.
Сдать анализ на альбумин в крови
Метод определения Колориметрия с бромкрезолом зеленым, Биохимический анализ крови, Биохимия, Биохимия крови, Биохимический, Биохимический анализ, Биохимический скрининг, биохимический анализ крови расширенный,
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Альбумин человека; Альбумин крови; Сывороточный альбумин.
Albumin; ALB; Serum albumins; Albumin Blood Test.
Краткая характеристика определяемого аналита Альбумин
Основной белок плазмы крови.
Синтез альбумина происходит в печени. Относительная молекулярная масса альбумина составляет 65 000 Да. Период полураспада составляет 18-20 дней. Альбумин поддерживает коллоидно-осмотическое (онкотическое) давление плазмы, и, соответственно, объём циркулирующей крови. Является резервом белка, при длительном голодании он расходуется в первую очередь.
Альбумин выполняет транспортную функцию, связываясь с билирубином, желчными кислотами, ионами металлов, в частности, с кальцием, свободными жирными кислотами и лекарствами, поступающими в организм извне, например, с антибиотиками, салицилатами. Действие лекарств, связывающихся альбумином, например, кортикостероидов, усиливается при гипоальбуминемии. В результате могут развиться токсические эффекты при обычных дозировках препаратов.
С какой целью определяют уровень альбумина в сыворотке крови
Альбумин – основной белок плазмы, определение уровня которого в сыворотке крови используют в комплексной диагностике болезней печени, почек, при оценке состояния пациента в различных клинических ситуациях.
Особенность аналита, которая может повлиять на результат теста «Альбумин»
Уровень альбумина несколько ниже у детей раннего возраста, у женщин во время беременности, особенно в третьем триместре, во время лактации, а также у курящих.
Гипоальбуминемия вызывает снижение общего кальция плазмы, сдвиг происходит за счёт физиологически неактивной части кальция, связанной с альбумином, и клинически дефицит кальция не проявляется.
Какова функция альбумина в организме человека?
Автор
Рубен Перальта, доктор медицины, FACS Профессор хирургии, анестезии и неотложной медицины, старший медицинский советник, совет директоров, руководитель программы травматологии, неотложной и критической помощи, консультант, профессор травматологической больницы Хуана Боша, Доминиканская Республика
Рубен Перальта, доктор медицины, FACS является членом следующих медицинских обществ: Американской ассоциации банков крови, Американского колледжа хирургов, Американской медицинской ассоциации, Ассоциации академической хирургии, Массачусетского медицинского общества, Общества интенсивной терапии, Общества лапароэндоскопических хирургов, Восточного Ассоциация хирургии травм, Американский колледж руководителей здравоохранения
Раскрытие информации: раскрывать нечего.
Соавтор (ы)
Брэд А. Рубери, доктор медицины Консультант, отделение внутренней медицины, отделение неотложной медицины, Gastroenterology Associates
Брэд А. Рубери, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей, Американской медицинской ассоциации
Раскрытие информации : Нечего раскрывать.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу.для: Medscape.
Гарольд Л. Мэннинг, доктор медицины Профессор, кафедры медицины, анестезиологии и физиологии, отделение легочной медицины и реанимации, Дартмутская медицинская школа
Гарольд Л. Мэннинг, доктор медицины, является членом следующих медицинских обществ: Американский колледж грудных врачей , Американский колледж врачей, Американское торакальное общество
Раскрытие информации: нечего раскрывать.
Главный редактор
Майкл Р. Пинский, доктор медицинских наук, доктор (HC), FCCP, FAPS, MCCM Профессор реанимации, биоинженерии, сердечно-сосудистых заболеваний, клинических и трансляционных наук и анестезиологии, заместитель председателя по академическим вопросам, Департамент интенсивной терапии Медицина, Медицинский центр Университета Питтсбурга, Школа медицины Университета Питтсбурга
Майкл Р. Пински, доктор медицинских наук, доктор медицины, доктор медицинских наук, FCCP, FAPS, MCCM является членом следующих медицинских обществ: Американский колледж грудных врачей, Американский Колледж интенсивной терапии, Американское торакальное общество, Европейское общество интенсивной терапии, Общество интенсивной терапии
Раскрытие информации: полученный доход в размере 250 долларов США или выше от: Baxter Medical, Exostat, LiDCO
Получен гонорары от LiDCO Ltd за консультации; Получены права интеллектуальной собственности от iNTELOMED.
Дополнительные участники
Сат Шарма, доктор медицины, FRCPC Профессор и руководитель отделения легочной медицины, отделение внутренней медицины, медицинский факультет Университета Манитобы; Директор отделения респираторной медицины, больница общего профиля Св. Бонифация, Канада
Сат Шарма, доктор медицины, FRCPC является членом следующих медицинских обществ: Американской академии медицины сна, Американского колледжа грудных врачей, Американского колледжа врачей-Американского общества внутренних болезней. Медицина, Американское торакальное общество, Канадская медицинская ассоциация, Королевский колледж врачей и хирургов Канады, Королевское медицинское общество, Общество интенсивной терапии, Всемирная медицинская ассоциация
Раскрытие информации: не раскрывать.
Альбумин — обзор | Темы ScienceDirect
Альбумин
Альбумин составляет 25% белков, синтезируемых печенью. 114 Концентрация сывороточного альбумина отражает чистый результат синтеза гепатоцитами, системное распределение и деградацию. Будучи относительно небольшим по размеру (66000 дальтон), альбумин может выводиться из кровотока через патологически измененные сосуды (например, васкулит), стенку кишечника (например, лимфангиэктазию) или клубочки (например, при лимфангиэктазии).g., гломерулонефрит, амилоидоз) или в брюшную полость в результате синусоидальной гипертензии печени. Нарушение или подавление синтеза печеночного альбумина или потери, превышающие синтетические возможности, приводят к гипоальбуминемии различной степени тяжести. Печень обладает огромным резервом для синтеза альбумина. 138 Обычно только 20–30% гепатоцитов производят альбумин, и при необходимости синтез можно увеличить в 200–300% случаев. 60
Продукция печеночного альбумина колеблется в зависимости от физиологических условий и требований (рис.19-3). Наиболее важными переменными являются питание и внутреннее осмотическое давление, определяемое гепатоцитом. 137 Влияние питания на производство альбумина может быть огромным. Синтез альбумина снижается на 50% в течение 24 часов после голодания или при соблюдении диеты с дефицитом белка. Концентрация сывороточного альбумина отражает это изменение только после периода задержки от нескольких дней до недель, поскольку достигается новый баланс между пулами заменяемого альбумина. Избыточное потребление калорий рационом с ограничением белка способствует развитию гипоальбуминемии, равно как и истощение запасов аминокислот с разветвленной цепью. 88,102,138 Гипоальбуминемия, частично вызванная снижением синтеза альбумина, также может быть следствием изменений онкотического давления сыворотки, связанных с гиперглобулинемией и лечением синтетическими коллоидами (например, декстраном). 52,137 Синтез альбумина также снижается, иногда резко, во время критического состояния как часть отрицательной реакции в острой фазе. 23,27
После синтеза в гепатоците альбумин высвобождается в пространство Диссе путем экзоцитоза.Затем он диффундирует в синусоиды печени, где смешивается с системным кровообращением. Затем он распространяется в межклеточное пространство, возвращаясь в системный кровоток через лимфатические сосуды и грудной проток. У нормальных животных от 50% до 70% альбумина находится вне сосудов, с наибольшим количеством в интерстициальных пространствах кожи и мышц. 102 Нормальный транскапиллярный выход составляет около 5% в час, но воспаление может увеличить это количество в несколько раз. Это явление обычно способствует возникновению эффекта «острой отрицательной фазы», который незначительно снижает концентрацию сывороточного альбумина при воспалении.
Катаболизм альбумина, вероятно, происходит внутри или рядом с эндотелием сосудов тканей. 181 Период полувыведения альбумина плазмы у собак составляет от 7 до 10 дней. 54,62 Период полураспада кошки недоступен. Скорость катаболизма альбумина сильно варьируется, но его фракционная скорость катаболизма прямо пропорциональна концентрации альбумина в плазме и размеру пула. 81 В условиях, вызывающих гипоальбуминемию, фракционная и абсолютная скорость катаболизма альбумина снижается.Скорость катаболизма альбумина увеличивается после переливания альбумина или синтетического коллоида. Таким образом, переливание альбумина или инфузии синтетических коллоидов могут усиливать эндогенную гипоальбуминемию двумя отдельными механизмами. Вследствие большого пространства распределения и многочисленных механизмов, влияющих на синтез, распределение и катаболизм альбумина, сывороточная концентрация альбумина не точно отражает современные изменения общих ресурсов альбумина в организме или его печеночного синтеза.
Сильный суммарный отрицательный заряд альбумина (-17) объясняет его важный вклад в сильную ионную разницу (SID) и позволяет ему слабо и обратимо связываться с различными ионами. В этом качестве альбумин функционирует как циркулирующая депо и транспортная молекула для многих ионов (например, Ca + 2 , Mg + 2 , Cu + 2 ) и метаболитов (например, жирных кислот , тироксин, билирубин, соли желчных кислот, аминокислоты). 104 Альбумин составляет большую часть содержания тиолов в плазме (т.е.например, сульфгидрильные связи) и обеспечивает защиту от окислительного стресса. 135 Альбумин также обеспечивает антиоксидантную активность, связывая реакционноспособные переходные металлы (например, Cu + 2 ), которые катализируют образование свободных радикалов. 104 Другие важные эффекты альбумина включают антикоагулянтное, антитромботическое и противовоспалительное действие.
Окисленные и гликозилированные формы альбумина встречаются у людей с циррозом печени, 175 , и концентрация этих форм увеличивается по мере снижения общей концентрации сывороточного альбумина.Увеличение окисленной формы альбумина отражает его роль поглотителя активных форм кислорода. Гликозилирование альбумина влияет на его характеристики связывания и проницаемости и увеличивает агрегацию тромбоцитов, что может предрасполагать к тромбоэмболическим осложнениям. 175 Клиническое значение более низкого отношения восстановленного / окисленного альбумина заключается в его связи с окислительным стрессом, вызванным низкой доступностью тиолового субстрата.
На концентрацию сывороточного альбумина влияют многочисленные факторы (см.рис.19-3). Умеренная гипоальбуминемия может отражать снижение синтеза альбумина или усиление катаболизма, но обычно они возникают медленно. Катаболизм белков, вызванный болезнью, обычно не влияет на альбумин и нацелен на мышцы. Реакция острой фазы на повреждение ткани увеличивает транскапиллярный выход альбумина и может снизить лимфатический клиренс. Наиболее резкое быстрое снижение концентрации сывороточного альбумина носит разбавляющий характер и связано с введением кристаллоидов (с синтетическим коллоидом или без него).Такие терапевтические эффекты разбавления обычно усугубляют острые тяжелые экстракорпоральные потери (например, кровотечение). Потеря альбумина в результате энтеропатии или нефропатии с потерей белка первоначально компенсируется потоком альбумина между внутрисосудистым и интерстициальным пулами. При хроническом течении становится очевидным чистый дефицит альбумина в организме и развивается гипоальбуминемия. Наиболее тяжелая хроническая гипоальбуминемия возникает из-за нарушений, которые нарушают синтез альбумина, одновременно увеличивая катаболизм или экстракорпоральную потерю (например,g., энтеропатия с потерей белка, нефропатия с потерей белка).
Гипоальбуминемия у пациентов с циррозом печени является результатом многих факторов, включая асцит, связанный с портальной гипертензией, снижение синтеза, снижение потребления азота, эффекты разведения от увеличения внутреннего и системного объема циркуляции, сопутствующие заболевания, вызывающие экстракорпоральную потерю альбумина, и острую фазу ответ (например, снижение синтеза альбумина, увеличение транскапиллярной потери).
| Обозначение объекта | Позиция (я) | Описание Действия | Графическое изображение | Длина | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
Этот подраздел раздела «PTM / Обработка» обозначает присутствие N-концевого сигнального пептида. Сигнальный пептид i | 1–18 | Добавить BLAST | 18 | ||||||||
В этом подразделе раздела PTM / Processing описывается пропептид, который является частью белка. который расщепляется во время созревания или активации. После расщепления пропептид обычно не имеет независимой биологической функции. Пропептид i PRO_0000001067 | 19–24 | 6 | |||||||||
В этом подразделе раздела «PTM / Обработка» описывается протяженность полипептидной цепи в зрелом белке после процессинга или протеолитического расщепления. Цепь i PRO_0000001068 | 25-609 | AlbuminAdd BLAST | 585 | ||||||||
| Функциональный ключ | Положение (я) | Описание Действия | Графическое представлениеДлина | ||||||||
В этом подразделе раздела «PTM / Обработка» указываются положение и тип каждого измененного остатка, за исключением lipids , гликаны и перекрестные ссылки протеина . Подробнее … Модифицированный остаток i | 29 | Фосфосерин; по FAM20C Ручное утверждение, основанное на эксперименте в i
| 1 | ||||||||
Этот подраздел PTM / Processing определяет положение и тип каждой ковалентно присоединенной гликановой группы (моно-, ди- или полисахарид). Гликозилирование i | 36 | N-связанный (Glc) (гликирование) лизин Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Гликозилирование i | 75 | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
Этот подраздел раздела PTM / Processing «: / help / ptm_processing_section описывает положения остатков цистеина, участвующих в дисульфидных связях. Дисульфидная связка i | 77 ↔ 86 | Подтвержденная вручную информация, созданная автоматической системой аннотаций UniProtKB. Ручное утверждение в соответствии с правилами iРучное утверждение, выведенное из комбинации экспериментальных и вычислительных данных i Ручное утверждение, основанное на эксперименте в i
| |||||||||
| Модифицированный остаток i | 82 | Фосфосерин; by FAM20C Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i
Ручное утверждение, основанное на эксперименте в i
| 1 | ||||||||
| Модифицированный остаток i | 89 | Фосфосерин; по FAM20C Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i
Ручное утверждение, основанное на эксперименте в i
| 1 | ||||||||
| Дисульфидная связь i | 99 ↔ 115 | Утверждение вручную в соответствии с правилами i Утверждение вручную, выведенное из комбинации экспериментальных данных 63 и расчетных данных Ручное утверждение на основе эксперимента в i
| |||||||||
| Модифицированный остаток i | 107 | Фосфотреонин; by FAM20C Ручное утверждение, основанное на эксперименте в i
| 1 | ||||||||
| Дисульфидная связь i | 114 ↔ 125 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных данных 63 i и расчетных данных. Ручное утверждение на основе эксперимента в i
| |||||||||
| Дисульфидная связь i | 148 ↔ 193 | Утверждение вручную в соответствии с правилами i Утверждение вручную, выведенное из комбинации экспериментальных и расчетных данных на основе 63 i 4 на эксперименте в i
| |||||||||
| Гликозилирование i | 161 | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
| Гликозилирование i | 186 | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
| Дисульфидная связь i | 192 ↔ 201 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и вычислительных 9000 9000 9000 9000 9000 вручную 9000 Утверждение, основанное на эксперименте в i
| |||||||||
| Гликозилирование i | 223 | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение, основанное на эксперименте в i
| 1 | ||||||||
| Дисульфидная связь i | 224 ↔ 270 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных 9 i064 Ручное утверждение на основе эксперимента вi
| |||||||||
| Модифицированный остаток i | 229 | N6-сукциниллизин Утверждение вручную, выведенное из сходства последовательностей с i | 1 | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||
| Гликозилирование i | 257 | N-связанный (Glc) (гликирование) лизин Утверждение вручную на основе эксперимента CE в i 90QU206 CTEIN для: 90QU206 CTEINУказано за: GLYCATION AT LYS-36; LYS-223; LYS-257; LYS-305; LYS-341; LYS-375; LYS-463; LYS-549 И LYS-558. | 1 | ||||||||
| Дисульфидная связь i | 269 ↔ 277 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных 9 i. Ручное утверждение на основе эксперимента в i
| |||||||||
| Дисульфидная связь i | 289 ↔ 303 | Утверждение вручную в соответствии с правилами i Утверждение вручную, выведенное из комбинации экспериментальных и расчетных данных на основе 634 на эксперименте в i
| |||||||||
| Модифицированный остаток i | 297 | Фосфосерин Ручное утверждение, выведенное из сходства последовательности с i | 1 9014 | 9014 | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | |||||
| Дисульфидная связь i | 302 ↔ 313 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и i 4 9000 расчетных данных Утверждение, основанное на эксперименте в i
| |||||||||
| Гликозилирование i | 305 | N-связанный (Glc) (гликирование) лизин Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
| Гликозилирование i | 337 | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
| Дисульфидная связь i | 340 ↔ 385 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и 4 расчетных данных. Утверждение, основанное на эксперименте в i
| |||||||||
| Гликозилирование i | 341 | N-связанный (Glc) (гликирование) лизин Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Гликозилирование i CAR_000226 | 342 | N-связанный (GlcNAc…) аспарагин; в варианте Redhill | 1 | ||||||||
| Гликозилирование i | 347 | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
| Гликозилирование i | 375 | N-связанный (Glc) (гликирование) лизин Ручное утверждение на основе эксперимента CE в i 90QU206 CTEINУказано за: GLYCATION AT LYS-36; LYS-223; LYS-257; LYS-305; LYS-341; LYS-375; LYS-463; LYS-549 И LYS-558. | 1 | ||||||||
| Дисульфидная связь i | 384 ↔ 393 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i. Ручное утверждение на основе эксперимента в i
| |||||||||
| Гликозилирование i | 402 | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
| Дисульфидная связь i | 416 ↔ 462 | Утверждение вручную в соответствии с правилами i Утверждение вручную, выведенное из комбинации экспериментальных и i 4 данных 9000 Утверждение, основанное на эксперименте в i
| |||||||||
| Гликозилирование i | 437 | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
| Модифицированный остаток i | 443 | Фосфосерин Ручное утверждение, выведенное из комбинации экспериментальных и вычислительных данных i | 1 | Модифицированный остаток | 444 | Фосфотреонин Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 1 | ||||
| Модифицированный остаток i | 446 9sphored | из экспериментальной комбинации Phosphothreon2 | и вычислительные данные i1 | ||||||||
| Модифицированный остаток i | 460 | N6-сукциниллизин Утверждение вручную, выведенное из сходства последовательностей с i 03 | 42 1|||||||||
| Дисульфидная связь i | 461 ↔ 472 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и вычислительных данных i Ручное утверждение, основанное на эксперименте i
| |||||||||
| Гликозилирование i | 463 | N-связанный (Glc) (гликирование) лизин Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Гликозилирование i | 468 | N-связанный (Glc) (гликозилирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
| Дисульфидная связь i | 485 ↔ 501 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и i 4 данных 9000. Утверждение, основанное на эксперименте в i
| |||||||||
| Дисульфидная связь i | 500 ↔ 511 | Утверждение вручную в соответствии с правилами i Утверждение вручную на основе комбинации экспериментальных и расчетных данных на основе 3 9 4 на эксперименте в i
| |||||||||
| Модифицированный остаток i | 513 | Фосфосерин Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i 207PHOSCED [Цитировано для SER-82; SER-89 И SER-513, ИДЕНТИФИКАЦИЯ ПОМОЩЬЮ МАСС-СПЕКТРОМЕТРИИ [БОЛЬШОЙ МАСШТАБ АНАЛИЗА]. | 1 | ||||||||
| Гликозилирование i CAR_000069 | 518 | N-связанный (GlcNAc …) аспарагин; в варианте Casebrook | 1 | ||||||||
| Дисульфидная связь i | 538 ↔ 583 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и вычислительных данных 4 9000 Ручное утверждение, основанное на эксперименте в i
| |||||||||
| Модифицированный остаток i | 543 | N6-сукциниллизин Ручное утверждение, выведенное из сходства последовательностей с i | 1 | N-связанный (Glc) (гликирование) лизин Ручное утверждение, основанное на эксперименте в i
| 1 | ||||||
| Модифицированный остаток i | 558 | N6-метиллизин; альтернатива Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i
| 1 | ||||||||
| Гликозилирование i | 558 | в качестве альтернативы N-гликозилированному (Glc) эксперимент в i
| 1 | ||||||||
| Гликозилирование i | 560 | N-связанный (Glc) (гликозилирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
| Гликозилирование i | 569 | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
| Дисульфидная связь i | 582 ↔ 591 | Ручное утверждение в соответствии с правилами i Ручное утверждение, выведенное из комбинации экспериментальных и i 4 данных 9000 Утверждение, основанное на эксперименте в i
| |||||||||
| Модифицированный остаток i | 588 | N6-сукциниллизин Ручное утверждение, выведенное из сходства последовательностей с i | 1 9014yl | N-связанный (Glc) (гликирование) лизин; in vitro Ручное утверждение на основе эксперимента в i
| 1 | ||||||
| Функциональный ключ | Позиция (я) | Описание Действия | Графическое представление | Длина | |||||||
| Сайт i | 28 | Без гликозилирования Ручное утверждение на основе эксперимента
| 1 | ||||||||
| Сайт i | 44 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 65 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 88 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 97 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 117 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Участок i | 130 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 160 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 183 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 198 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 205 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 214 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 219 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 229 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 236 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Участок i | 264 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Участок i | 286 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 298 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 310 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 383 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 396 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 413 | Не гликозилированный Ручное утверждение на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 426 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 438 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Участок i | 456 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Участок i | 460 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 490 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 499 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 524 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 543 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 548 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 562 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 565 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 581 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 584 | Не гликозилированный Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 588 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 | ||||||||
| Сайт i | 598 | Без гликирования Утверждение вручную на основе эксперимента в i
| 1 |
Альбумин | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
2019 обзор выполнен Нэнси Альбтуш, доктором философии.
(13 января 2015 г.) Деварадж, С. Альбумин. Medscape. Доступно на сайте https://emedicine.medscape.com/article/2054430-overview. Доступ 28.07.19.
Альбумин, сыворотка. Медицинские лаборатории Мэйо. Доступно на сайте https://endocrinology.testcatalog.org / show / ALB. Доступ 28.07.19.
(13 ноября 2018 г.) Моман Р.Н., Варакалло М. Физиология, Альбумин. StatPearls [Международный]. Остров сокровищ (Флорида): StatPearls Publishing; 2019. Доступно на сайте https://www.ncbi.nlm.nih.gov/books/NBK459198/. Доступ 28.07.19.
Источники, использованные в предыдущих обзорах
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (2001). Справочник по диагностическим и лабораторным испытаниям Мосби, 5-е издание: Mosby, Inc., Сент-Луис, Миссури.
Пагана, К.Д. и Пагана, Т. Дж. (© 2007). Справочник по диагностическим и лабораторным испытаниям Мосби, 8-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 775-780.
Кларк В. и Дюфур Д. Р., редакторы (© 2006). Современная практика клинической химии: AACC Press, Вашингтон, округ Колумбия. С. 197-198.
Ву, А. (© 2006). Клиническое руководство Tietz по лабораторным испытаниям, 4-е издание: Saunders Elsevier, Сент-Луис, Миссури. С. 66-71.
Dugdale, III, D. (Обновлено 23 февраля 2009 г.). Альбумин — сыворотка. Медицинская энциклопедия MedlinePlus [Он-лайн информация].Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003480.htm. По состоянию на июнь 2009 г.
Шашидхар, Х. и Григсби, Д. (Обновлено 9 апреля 2009 г.). Недоедание. eMedicine [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/985140-overview. По состоянию на июнь 2009 г.
Peralta, R. et. al. (Обновлено 17 июня 2008 г.). Гипоальбуминемия. eMedicine Critical Care [он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/166724-overview.Июнь 2009г.
(обновлено в декабре 2008 г.). Белки. ARUP Консультации [Он-лайн информация]. Доступно в Интернете по адресу http://www.arupconsult.com/Topics/GastrointestinalDz/NutritionalAssessment/Proteins.html. По состоянию на июнь 2009 г.
Дагдейл, Д. (Обновлено 20 февраля 2011 г.). Альбумин — сыворотка. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003480.htm. По состоянию на январь 2013 г.
Дельгадо, Дж. (Обновлено в ноябре 2012 г.).Белки. ARUP Консультации [Он-лайн информация]. Доступно в Интернете по адресу http://www.arupconsult.com/Topics/Proteins.html?client_ID=LTD. По состоянию на январь 2013 г.
Деварадж, С. (Обновлено 5 января 2012 г.). Альбумин. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/2054430-overview#showall. По состоянию на январь 2013 г.
(© 1995-2013). Альбумин, сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http: // www.mayomedicallaboratories.com/test-catalog/Overview/8436. По состоянию на январь 2013 г.
Пагана, К. Д. и Пагана, Т. Дж. (© 2011). Справочник по диагностическим и лабораторным испытаниям Мосби, 10-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 799-804.
Кларк, У., редактор (© 2011). Современная практика в клинической химии, 2-е издание: AACC Press, Вашингтон, округ Колумбия. Стр. 234.
Макферсон Р. и Пинкус М. (© 2011). Клиническая диагностика и лечение Генри с помощью лабораторных методов 22-е издание: Elsevier Saunders, Филадельфия, Пенсильвания.Стр. 264-265.
Деварадж, С. (Обновлено 13 января 2015 г.). Альбумин. Наркотики и болезни, помогающие избежать болезней [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/2054430-overview. Дата обращения 23.03.16.
Lerma, E. et. al. (Обновлено 10 декабря 2015 г.). Протеинурия. Наркотики и болезни, помогающие избежать болезней [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/238158-overview. Дата обращения 23.03.16.
(© 1995–2016). Альбумин, сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация].Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8436. Дата обращения 23.03.16.
Дельгадо, Дж. (Обновлено за декабрь 2015 г.). Белки. ARUP Консультации [Он-лайн информация]. Доступно на сайте https://arupconsult.com/content/proteins. Дата обращения 23.03.16.
(1 марта 2012 г.). Что такое альбумин мочи. Национальный институт диабета, болезней пищеварительной системы и почек [онлайн-информация]. Доступно в Интернете по адресу http://www.niddk.nih.gov/health-information/health-communication-programs/nkdep/learn/causes-kidney-disease/testing/understand-urine-albumin/Pages/understand-urine-albumin .aspx. Дата обращения 23.03.16.
Коэн, Э. и Липпольд, К. (обновлено 8 марта 2016 г.). Нефротический синдром. Наркотики и болезни, помогающие избежать болезней [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/244631-overview. Дата обращения 23.03.16.
Перальта Р. и Рубери Б. (Обновлено 1 апреля 2015 г.). Гипоальбуминемия. Наркотики и болезни, помогающие избежать болезней [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/166724-overview. Дата обращения 23.03.16.
PDB-101: Молекула месяца: сывороточный альбумин
Молекула месяца
| по категориям | по дате | по названию |
сывороточный альбумин доставляет 927 молекул жирных кислот через 927 молекул крови
Подумайте, как удобно есть.Каждая из ваших десяти триллионов клеток требует постоянного питания. Но нам не нужно об этом беспокоиться — мы просто едим наш обед, а наше тело делает все остальное. Пища переваривается, и полезные частицы доставляются к клеткам по всему телу, используя кровоток в качестве системы доставки. Доставка водорастворимых молекул, таких как сахар, проста. Они плавают в водянистом кровотоке и по пути улавливаются клетками. Однако другие важные питательные вещества не растворяются в воде, поэтому необходимо создать специальные носители, которые будут сопровождать их голодным клеткам.
Несущие жирные кислоты
Сывороточный альбумин, показанный здесь из записи PDB 1e7i , является переносчиком жирных кислот в крови. Жирные кислоты необходимы для двух основных функций вашего тела. Они являются строительными блоками для липидов, которые образуют все мембраны вокруг и внутри клеток. Они также являются богатыми источниками энергии и могут расщепляться внутри клеток с образованием АТФ. Таким образом, ваше тело поддерживает кладезь жирных кислот, хранящихся в виде жира. Когда вашему организму нужна энергия или строительные материалы, жировые клетки выделяют жирные кислоты в кровь.Там они улавливаются сывороточным альбумином и доставляются в отдаленные части тела.Универсальный белок
Сывороточный альбумин — самый распространенный белок в плазме крови. Каждая молекула белка может нести семь молекул жирных кислот. Они связываются в глубоких трещинах в белке, надежно закапывая свои богатые углеродом хвосты вдали от окружающей воды. Сывороточный альбумин также связывается со многими другими нерастворимыми в воде молекулами. В частности, сывороточный альбумин связывается со многими молекулами лекарств, такими как ибупрофин, и может сильно влиять на то, как они доставляются в организм.
Общий белок
Поскольку сывороточный альбумин так часто встречается в крови и его легко очищать, это был один из первых белков, изученных учеными. Сегодня аналогичный коровий белок — бычий сывороточный альбумин или БСА — широко используется в исследованиях, когда необходим общий белок. Многие ферменты нестабильны, когда их помещают в разбавленный раствор, поэтому их трудно изучить в лаборатории. Одно из решений — добавить немного BSA. Он стабилизирует фермент во время эксперимента, но относительно нейтрален, поэтому не влияет на свойства фермента.
Коллекция носителей
В крови переносится множество различных молекул, поэтому неудивительно, что мы составляем разнообразный набор белков для их переноса. В отличие от сывороточного альбумина, многие из них являются специфическими носителями, доставляющими только один тип молекулы. Здесь показаны два примера. Трансферрин, показанный здесь из записи PDB 1h76 , несет ионы железа, а транстиретин из записи PDB 1tha доставляет гормоны щитовидной железы. Кровью наполнены эти занятые носители, которые доставляют свой груз по всему телу.Изучение структуры
Ряд структур человеческого сывороточного альбумина, которые показывают, как различные жирные кислоты связываются с белком, доступны в PDB. Запись PDB 1e7i включает семь молекул насыщенной жирной кислоты, связанной с белком. Некоторые можно увидеть выглядывающими с поверхности на иллюстрации в начале колонки этого месяца. Показанная здесь структура из записи PDB 1gnj имеет семь связанных с ней молекул арахидоновой кислоты. Белок показан синими трубками, а жирные кислоты показаны сферами у каждого атома.Изучая эту структуру, обратите внимание на то, как белковая цепь окружает богатые углеродом хвосты жирных кислот, защищая их от окружающей воды. Арахидоновая кислота представляет собой ненасыщенную жирную кислоту с несколькими двойными связями, которые образуют жесткие изгибы в углеродной цепи. Это важно для построения молекулярных мессенджеров, используемых для передачи сигналов о боли и воспалении.Темы для дальнейшего обсуждения
- Веб-сайт Albumin содержит открытия, касающиеся сывороточного альбумина, обновленный список опубликованных мутаций альбумина со ссылками и другую интересную информацию, относящуюся к альбумину.
Связанные ресурсы PDB-101
Ссылки
- Стивен Карри, Питер Брик и Николас П. Фрэнкс (1999): Связывание жирных кислот с человеком
- Альбумин сыворотки: новые открытия кристаллографических исследований. Biochimica et Biophysica Acta 1441 , стр. 131-140.
Январь 2003, Дэвид Гудселл
doi: 10.2210 / rcsb_pdb / mom_2003_1О молекуле месяца
Молекула месяца RCSB PDB Дэвид С.Goodsell (Исследовательский институт Скриппса и RCSB PDB) представляет краткие отчеты по выбранным молекулам из банка данных по белкам. Каждый выпуск включает введение в структуру и функцию молекулы, обсуждение значимости молекулы для здоровья и благополучия человека, а также предложения о том, как посетители могут просматривать эти структуры и получать доступ к более подробной информации. ПодробнееКонформационная гибкость белков бычьего сывороточного альбумина, не содержащих жирных кислот, обеспечивает превосходное противообрастающее покрытие
Белки бычьего сывороточного альбумина
Шесть типов белков бычьего сывороточного альбумина (БСА), используемых в этом исследовании, были выбраны на основе трех различных методов фракционирования без или со стадией удаления жирных кислот, и были закуплены у Sigma-Aldrich (St.Луис, Миссури, США). Лиофилизированные порошки белков БСА, содержащих жирные кислоты, очищенные фракционированием холодным этанолом, фракционированием тепловым шоком и холодным этанолом с последующим фракционированием тепловым шоком, были отобраны и имеют каталожные номера. A2153, A3059 и A7638 соответственно. Эти три жирных белка BSA были обозначены как BSA 1, 2, 3 соответственно. Были также получены соответствующие версии без жирных кислот, имеющие каталожные номера. A6003, A7030 и A0281 соответственно. Эти три обезжиренных белка BSA были обозначены как BSA 4, 5, 6 соответственно.Все шесть белков BSA были использованы, как предусмотрено, и было подтверждено, что версии без жирных кислот содержат ≤0,01% остатков жирных кислот с помощью экспериментов с газовой хроматографией в соответствии с данными производителя (дополнительная таблица 1).
Реагенты
Додецилсульфат натрия (SDS, каталожный номер L4390), хлорид натрия (NaCl, каталожный номер 746398), гидроксид натрия (каталожный номер S5881) и октановая кислота (каприловая кислота, каталожный номер C2875) также были приобретены у Sigma-Aldrich, а трис (гидроксиметил) аминометан (Трис, каталожный номер.0497) был приобретен в Amresco (Солон, Огайо, США). Этанол (95%) был приобретен у Aik Moh (Сингапур), соляная кислота (HCl, каталожный номер 100317) была куплена у Merck (Берлингтон, Массачусетс, США) и фетальная бычья сыворотка (FBS, каталожный номер SV30160.03, партия № RC35960) был приобретен в HyClone Laboratories (Логан, Юта, США) и хранился при -20 ° C до эксперимента. Нормальную человеческую сыворотку (каталожный номер NHS, лот № 38) получали от Complement Technology (Тайлер, Техас, США) и хранили при -80 ° C до эксперимента.30% раствор акриламида / бис 29: 1 (каталожный номер 1610156), персульфат аммония (каталожный номер 1610700), тетраметилэтилендиамин (TEMED, каталожный номер 1610800), 4 × буфер для образцов Лэммли (каталожный номер 1610747), 2-меркаптоэтанол (№ по каталогу 1610710), 10 × Трис-буферный солевой раствор (TBS, № по каталогу 1706435), 10 × Трис / глициновый буфер (№ по каталогу 1610734), 10 × Трис / глицин / SDS буфер (№ по каталогу 1610732), Твин 20 (каталожный номер 1706531), нитроцеллюлозные мембраны (каталожный номер 1620112), Precision Plus Protein Standards (каталожный номер.1610375), усиленный хемилюминесцентный (ECL) субстрат Clarity Max Western (номер по каталогу 1705062) и конъюгированные с пероксидазой хрена (HRP) козьи антитела против иммуноглобулина G (IgG) мыши (номер по каталогу 1721011, номер партии 64109318). приобретены в Bio-Rad Laboratories (Геркулес, Калифорния, США). Моноклональное антитело комплемента C3b (номер по каталогу MA1-40155, номер партии Sh3428445) было приобретено в Thermo Fisher Scientific (Waltham, MA, USA). Метанол (каталожный номер M / 4000/17) был получен от Fisher Scientific (Лафборо, Великобритания) и наночастиц диоксида кремния диаметром 100 нм (каталожный номер.SISN100) были получены от компании nanoComposix (Сан-Диего, Калифорния, США).
Подготовка образца
Водный буферный раствор 10 мМ Трис, 150 мМ NaCl и pH 7,5 готовили с водой, обработанной Milli-Q (удельное сопротивление> 18,2 МОм · см при 25 ° C), и фильтровали через фильтр 0,2 мкм. мембранный фильтр из полиэфирсульфона (PES) (Thermo Fisher Scientific, каталожный номер 595-4520). Растворы БСА получали растворением лиофилизированного порошка БСА в этом Трис-буфере и затем фильтрованием через шприцевой фильтр 0,2 мкм (каталожный номер.ПН-4612; Pall Corporation, Порт Вашингтон, Нью-Йорк, США). Молярные концентрации белков BSA в водном буферном растворе определяли измерениями поглощения ультрафиолетового (УФ) света при 280 нм и со значением коэффициента молярной экстинкции 43 824 M -1 см -1 . Где это применимо, добавление каприловой кислоты к образцам BSA проводили, сначала растворяя каприловую кислоту и гидроксид натрия в Трис-буфере, чтобы получить 50 мМ раствор каприловой кислоты с pH 7.5. Затем раствор каприловой кислоты добавляли к соответствующим количествам раствора BSA для получения образца BSA, допированного каприловой кислотой, с молярным соотношением каприловая кислота: BSA 10: 1. Кроме того, буфер для вестерн-блоттинга готовили путем разбавления 10-кратного трис / глицин / SDS-буфера водой до 1-кратной концентрации, а буфер для переноса получали разбавлением 10-кратного трис / глицинового буфера водой и метанолом до 1-кратной концентрации. и 20% (об. / об.) метанола. Растворы для пассивации («блокирования») поверхности, содержащие BSA, для экспериментов вестерн-блоттинга готовили, сначала разбавляя 10 × TBS водой с последующим добавлением Tween 20 для получения раствора 1 × TBS с 0.1% (об. / Об.) Твин 20 (TBST). Затем BSA растворяли в TBST с получением 3% (мас. / Об.) Блокирующего раствора BSA.
Динамическое рассеяние света
Динамическое рассеяние света (DLS) использовали для измерения среднего гидродинамического диаметра и полидисперсности 451 мкМ (~ 30 мг / мл) молекул белка BSA в растворе с использованием анализатора размера частиц (ZetaPALS, Brookhaven Instruments, Holtsville, NY, USA), который оснащен монохроматическим лазером 658,0 нм. Измерения проводились при угле рассеяния 90 °, и программа BIC Particle Sizing (v5.27; Brookhaven Instruments) использовался для анализа функции автокорреляции интенсивности с целью получения гауссова распределения размеров, взвешенного по интенсивности. Температуру в измерительной камере контролировали с помощью петли обратной связи, и измерения образца белка сначала регистрировали при 25 ° C, затем нагревали и повышали температуру с 50 ° C до 75 ° C с шагом 5 ° C. После каждого скачка температуры измерительная камера уравновешивалась в течение 5 мин перед выполнением измерения DLS.В некоторых зависящих от времени измерениях температура в измерительной камере сначала повышалась с 50 ° C до 55 ° C перед поддержанием постоянной температуры на уровне 60 ° C и измерением размера белка каждые 10 мин в течение 200 мин. Все заявленные значения были получены из 5 технических повторений.
Спектроскопия кругового дихроизма
Эксперименты по спектроскопии кругового дихроизма (CD) проводили с использованием спектрометра AVIV Model 420 CD с программным пакетом AVIV CDS (v3.36 MX) (AVIV Biomedical, Лейквуд, Нью-Джерси, США).Спектроскопические измерения КД проводили с использованием 400 мкл растворов 2,5 мкМ образцов БСА в кювете с длиной оптического пути 1 мм с пробкой из ПТФЭ (каталожный № 110-QS; Hellma, Müllheim, Germany). Измерения регистрировались со спектральной полосой пропускания 1 нм, шагом 0,5 нм и временем усреднения 0,1 с. Эксперименты при повышенных температурах проводились путем повышения температуры в измерительной камере с шагом 5 ° C от 50 ° C до 75 ° C и регистрации спектров в каждой температурной точке после 5-минутного времени уравновешивания.{- 1}} \ right) = \ frac {{{\ mathrm {millidegrees}}}} {{{\ mathrm {n}} \ times {\ mathrm {c}} \ times 1 \ times 10}} $$
(1)
где n — количество аминокислотных остатков, c — молярная концентрация белка, а l — длина пути кюветы в см. Все спектры КД были сглажены с помощью функции сглаживания Savitzky-Golay 52 с окном сглаживания из 20 точек и полиномиальным порядком 2 в OriginPro 2019b (v9.6.5.169) (OriginLab, Нортгемптон, Массачусетс, США). Процент α-спирали каждого белка BSA был рассчитан из данных [ θ ] при 222 нм ([ θ ] 222 ) на основе следующего уравнения 53 :
$$ {\ mathrm {Helicity }} (\%) = \ frac {{([\ theta] _ {222} — 3000)}} {{(- 36000 — 3000)}} \ times 100 \% $$
(2)
Мониторинг микровесов-диссипации кварцевых кристаллов
Измерения микровесов-диссипации кварцевых кристаллов (QCM-D) проводили с использованием прибора QSense E4 (Biolin Scientific AB, Стокгольм, Швеция).Сенсорный кристалл кварцевого кристалла АТ-среза с покрытием из диоксида кремния с основной частотой 5 МГц (QSX 303, Biolin Scientific) использовали для характеристики адсорбции белка на поверхностях из диоксида кремния. Температуру устанавливали на 25 ° C для всех экспериментов, а операцию измерения контролировали с помощью программного пакета QSoft 401 (v2.5.13.664) (Biolin Scientific). Перед каждым экспериментом сенсорные чипы последовательно промывали 1% (масс. / Об.) Водным раствором SDS, водой и этанолом, а затем сушили в слабом потоке газообразного азота с последующей обработкой кислородной плазмой (PDC-002, Harrick Plasma, Итака, Нью-Йорк, США) на 3 мин.Перистальтический насос использовался для закачки жидких образцов в измерительную камеру с объемной скоростью потока 100 мкл мин. -1 . Стабильный базовый сигнал был сначала установлен в буферном растворе Трис перед тем, как 100 мкМ белка BSA был введен в измерительную камеру на 30 мин, после чего следовала стадия промывки буфером. Сдвиги резонансной частоты (ΔF) и рассеяния энергии (ΔD) регистрировались в режиме реального времени с несколькими нечетными обертонами, как описано ранее 54 , и приводятся нормализованные данные для пятого обертона.
Метод QCM-D также использовался для определения эффективности пассивирования BSA-покрытий против биообрастания сыворотки. Для этих экспериментов 100 мкМ раствор BSA сначала добавляли к чистой поверхности диоксида кремния при непрерывном потоке в течение 60 минут, после чего следовала 40-минутная стадия промывки буфером. Затем вводили неразбавленную фетальную бычью сыворотку (FBS) при непрерывном потоке в течение 80 минут с последующей стадией заключительной промывки буфером в течение 30 минут. Процент эффективности пассивации был рассчитан путем сравнения абсолютной разницы между сдвигом частоты из-за адсорбции только BSA (после первой стадии промывки буфера) и последующим сдвигом частоты из-за биообрастания FBS (после второй стадии промывки буфером), которая обозначается как ΔF FBS-BSA .Контрольный эксперимент без покрытия BSA также был проведен для измерения абсолютного сдвига частоты из-за одного только биообрастания FBS (после стадии промывки буфером), который обозначен как ΔF Control . Для каждого покрытия BSA процент эффективности пассивации был рассчитан по следующему уравнению:
$$ {\ mathrm {Passivation}} \, {\ mathrm {efficiency}} ({\ mathrm {\%}}) = \ left ( {1 — \ frac {{\ Delta {\ mathrm {F}} _ {{\ mathrm {FBS}} — {\ mathrm {BSA}}}}}} {{\ Delta {\ mathrm {F}} _ {{ \ mathrm {Control}}}}}} \ right) \ times 100 \% $$
(3)
Локализованный поверхностный плазмонный резонанс
Измерения усредненного по ансамблю локализованного поверхностного плазмонного резонанса (LSPR) были проведены в режиме оптического пропускания с использованием прибора Insplorion XNano (Insplorion AB, Гетеборг, Швеция), как описано ранее 55 .Луч белого света, освещающий круглую область размером ~ 4 мм 2 , проходит через сенсорный чип с кремнеземным покрытием (Insplorion), состоящий из хорошо разделенных массивов золотых нанодисков (покрытие поверхности ~ 8%), нанесенных методом коллоидной литографии с отверстиями-маской 56 на прозрачной стеклянной подложке. Нанодиски имели среднюю высоту и диаметр 20 нм и 120 нм соответственно, а поверхность сенсорного чипа была конформно покрыта пленкой кремнезема (толщиной ~ 10 нм). Затем свет проходил через окно из кварцевого стекла и собирался спектрофотометром.Перед каждым экспериментом сенсорный чип последовательно промывали 1% (масс. / Об.) Водным раствором SDS, водой и этанолом, затем сушили в слабом потоке газообразного азота. Затем чип обрабатывали кислородной плазмой в течение 2,5 мин. Затем сенсорный чип загружали в измерительную камеру, и жидкие образцы вводили перистальтическим насосом с объемной скоростью потока 100 мкл мин. -1 . Стабильный базовый сигнал был установлен в буферном растворе Трис перед тем, как 100 мкМ BSA было введено в измерительную камеру при непрерывном потоке в течение 30 мин, после чего следовала стадия промывки буфером.Программный пакет Insplorer (Insplorion AB) использовался для записи спектров экстинкции LSPR с временным разрешением 1 Гц, а положение центра тяжести (пика) ( λ ) в спектре экстинкции в каждый момент времени рассчитывалось с использованием высокой порядок полиномиальной аппроксимации 57 . Таким образом, с помощью программного пакета OriginPro 2019b можно было определить смещение Δ λ с временным разрешением из-за адсорбции белка, а график производной от времени сдвига Δ λ был также рассчитан с использованием программного пакета OriginPro 2019b.
ATR-FTIR-спектроскопия
Инфракрасная спектроскопия с ослабленным полным отражением-преобразованием Фурье (ATR-FTIR) была проведена с использованием FTIR-спектрометра Bruker Vertex 70 с охлаждаемым жидким азотом фотодетектором теллурида кадмия (MCT) (Bruker, Baden- Вюртемберг, Германия), оснащенный аксессуаром MIRacle ATR, содержащим кристалл ZnSe ATR с тремя отражениями (PIKE Technologies, Фитчбург, Висконсин, США). Аликвоту 30 мкл раствора BSA 100 мкМ пипеткой наносили на кристалл ATR для образования капли, и сразу же записывали спектр поглощения, чтобы охарактеризовать вторичную структуру белков BSA в фазе раствора.Затем BSA инкубировали с поверхностью кристалла ATR при комнатной температуре в течение 30 мин, после чего следовала серия из десяти этапов промывки буфером для удаления слабо адсорбированных белков. Во время каждой стадии промывки к капле образца добавляли 30 мкл дополнительного буферного раствора (без белка) с последующей аспирацией из капли общего объема 30 мкл. После завершения этапов промывки регистрировали второй спектр поглощения, чтобы охарактеризовать вторичную структуру белков БСА в адсорбированном состоянии.Во время измерений отделение для образца непрерывно продували газообразным азотом для минимизации влажности окружающей среды. Программный пакет OPUS 6.5 (Bruker) использовался для сбора спектров поглощения ATR-FTIR при разрешении 4 см -1 и усреднения по 128 сканированным изображениям. Все записанные спектры были нормализованы путем вычитания фоновых спектров только из буфера и водяного пара, чтобы удалить артефакты поглощения воды и окружающего водяного пара, соответственно.
Относительный вклад различных элементов вторичной структуры был определен для всех образцов путем аппроксимации кривой амидных полос I спектров поглощения (1720-1580 см, -1 ) гауссовым компонентам на основе пиков, идентифицированных на графике второй производной спектры поглощения и из литературных ссылок 22,58 .Все анализы аппроксимации кривых проводились с использованием функции Peak Analyzer в программном пакете OriginPro 2019b. Предполагалось, что спектр поглощения, полученный в результате эксперимента, представляет собой линейную комбинацию нескольких составляющих гауссовых пиков, каждый из которых сосредоточен вокруг заданного значения волнового числа и представляет собой элемент вторичной структуры белка. Процентные значения вторичной структуры определяли путем вычисления площади под аппроксимированными кривой пиками, которые были присвоены каждому элементу вторичной структуры, в виде доли от общей площади под подобранной кривой.Пики с центрами 1682–1678 см −1 были отнесены к структурам β-витков, 1656–1654 см −1 к α-спирали, 1649–1648 см −1 к случайной катушке, 1639–1624 см – 1 для протяженных цепей и 1618–1612 см −1 для межмолекулярных β-листов.
SDS-PAGE и вестерн-блоттинг
Перед экспериментами были приготовлены гели, разделяющие 10% полиакриламид при pH 8,8 и 5% -ные гели при pH 6,8 с пятнадцатью лунками для загрузки образцов на гель. Для подготовки образцов нормальную человеческую сыворотку (NHS) размораживали и затем сразу же разбавляли до 1% (об. / Об.) В Трис-буфере с последующей инкубацией при 37 ° C в течение 30 минут.Затем аликвоту разбавленного NHS объемом 180 мкл смешивали с 54 мкл 4-кратного буфера Лэммли и 6 мкл 2-меркаптоэтанола. Затем смесь образцов нагревали до 95 ° C в течение 5 минут для полной денатурации белков сыворотки, а затем снова охлаждали до комнатной температуры. Аликвоту стандартов белка 10 мкл загружали в первую дорожку полиакриламидного геля, а в следующие две дорожки загружали по 10 мкл смеси образцов; эту последовательность повторяли всего пять раз, чтобы заполнить все дорожки в геле. Затем проводили электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) при 50 В в течение 15 минут, а затем при 100 В в течение 90 минут в рабочем буфере.
Полосы белка в геле затем переносили на нитроцеллюлозную мембрану при 300 мА в течение 2 ч в буфере для переноса и использовали пакеты со льдом, чтобы буфер для переноса оставался холодным во время процесса переноса. После этапа переноса мембраны разрезали на полоски, каждая из которых содержала три дорожки стандартов белка (дорожка 1) и образцы сыворотки (дорожки 2–3). Растворы для пассивирования («блокирования») поверхности готовили с использованием жирного или обезжиренного BSA [3% (вес / объем) BSA в TBST; BSA 1 или 5], и каждую полоску инкубировали с 5 мл соответствующего блокирующего раствора BSA при комнатной температуре в течение 1 часа.Затем мембраны инкубировали с моноклональным антителом комплемента C3b в качестве первичного антитела (разведение 1: 500 в блокирующем растворе) в течение ночи. Затем каждую мембрану промывали TBST в течение 10 мин. После трех стадий промывки мембраны инкубировали с HRP-конъюгированными вторичными антителами козы против IgG мыши (разведение 1: 2000 в блокирующем растворе) в течение 1 ч с последующими четырьмя последующими стадиями промывки TBST.
Затем мембраны инкубировали с субстратом Clarity Max Western ECL в течение 5 минут для усиления хемилюминесцентных свойств.Все этапы инкубации и промывки проводились на качающейся платформе. Полосы белка впоследствии были визуализированы с использованием прибора Amersham Imager 600 и сопутствующего программного обеспечения (v0.9.8) (GE Healthcare, Чикаго, Иллинойс, США) с временем экспозиции 1 с. Затем был использован программный пакет Fiji / ImageJ 59 для количественной оценки интенсивности шумовых полос, которые были расположены около маркеров молекулярной массы 250, 75 и 50 кДа. Цифровое изображение пятен сначала было настроено на 8-битную шкалу серого, а затем был построен профиль интенсивности для каждой выбранной дорожки с использованием функции анализа гелей.Пики из неспецифических интересующих полос были идентифицированы, и базовая линия была создана путем проведения прямой линии между двумя точками минимума по обе стороны от каждого интересующего пика. Затем инструмент Wand использовался для определения площади, ограниченной пиком и базовой линией. Эти значения были определены как значения интенсивности для каждой выбранной неспецифической полосы.
Иммуноферментный анализ
Набор для иммуноферментного анализа MicroVue SC5b-9 Plus (номер по каталогу A020; Quidel, Сан-Диего, Калифорния, США) использовали для экспериментов с иммуноферментным анализом (ELISA).Образцы наночастиц диоксида кремния, покрытые BSA, были приготовлены путем смешивания равных объемов соответствующего раствора 1 мг / мл -1 BSA с 2 мг / мл наночастиц диоксида кремния -1 в Трис-буфере. Затем смеси инкубировали при 37 ° C в течение 2 часов с последующим центрифугированием при 16000 × g в течение 30 минут. Супернатанты удаляли, и наночастицы ресуспендировали в свежем Трис-буфере. Другой цикл центрифугирования и ресуспендирования был проведен с получением 1 мг / мл образцов наночастиц диоксида кремния -1 , покрытых BSA.Аликвоту 10 мкл каждого образца наночастиц диоксида кремния, покрытого BSA, затем смешивали с аликвотой 40 мкл свежеоттаявшей нормальной сыворотки человека (NHS). Сама аликвота NHS объемом 50 мкл была использована в качестве отрицательного контроля (самый низкий уровень активации комплемента), а 10 мкл 1 мг / мл наночастиц диоксида кремния -1 без покрытия плюс 40 мкл NHS были использованы в качестве положительного контроля (самый высокий уровень комплемента). активация). Все исследуемые образцы инкубировали при 37 ° C в течение 30 мин.
Затем анализ выполняли с использованием 96-луночных планшетов, которые были предоставлены в наборе для ELISA, в соответствии с инструкциями производителя.Все образцы сыворотки, включая контрольные, были разбавлены в 40 раз с использованием предоставленного раствора для разбавления образцов перед добавлением в лунки. Стандартные растворы добавляли без разбавления. Значения оптической плотности в каждой лунке определяли с помощью планшет-ридера Infinite Pro 200 (Tecan, Männedorf, Швейцария). Стандартные кривые рассчитывали путем сопоставления известных концентраций стандартных растворов с соответствующими значениями оптической плотности. Затем вычисляли концентрацию белка SC5b-9 в каждом образце.Степень защиты, обеспечиваемую каждым покрытием BSA, рассчитывали, рассматривая концентрации белка SC5b-9 из образцов отрицательного и положительного контроля как 100% и 0% защиты соответственно.
Статистический анализ
Статистический анализ проводился с использованием программного пакета GraphPad Prism (v8.0.1) от GraphPad Software (Ла-Холла, Калифорния, США). Односторонний или двусторонний дисперсионный анализ (ANOVA) с соответствующим тестом множественных сравнений и непарный t -тест использовали для вычисления статистической значимости экспериментальных данных, если это необходимо.Весь статистический анализ включал двусторонние тесты. Результаты непарных тестов t представлены как значения P , в то время как результаты тестов множественных сравнений представлены как значения P с поправкой на множественность. P <0,05, P <0,01, P <0,001 и P <0,0001 указывают уровни статистической значимости. Дополнительную информацию можно найти в дополнительных таблицах 6–14.
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.


 20%: фл. 50 мл или 100 мл
20%: фл. 50 мл или 100 мл : бут. 100 мл, 200 мл, 250 мл, 400 мл или 500 мл 1 шт.
: бут. 100 мл, 200 мл, 250 мл, 400 мл или 500 мл 1 шт. д/приготовления р-ра д/инфузий 10 мг/1 мл: 5 мл амп. 5, 10, 250 или 500 шт.
д/приготовления р-ра д/инфузий 10 мг/1 мл: 5 мл амп. 5, 10, 250 или 500 шт.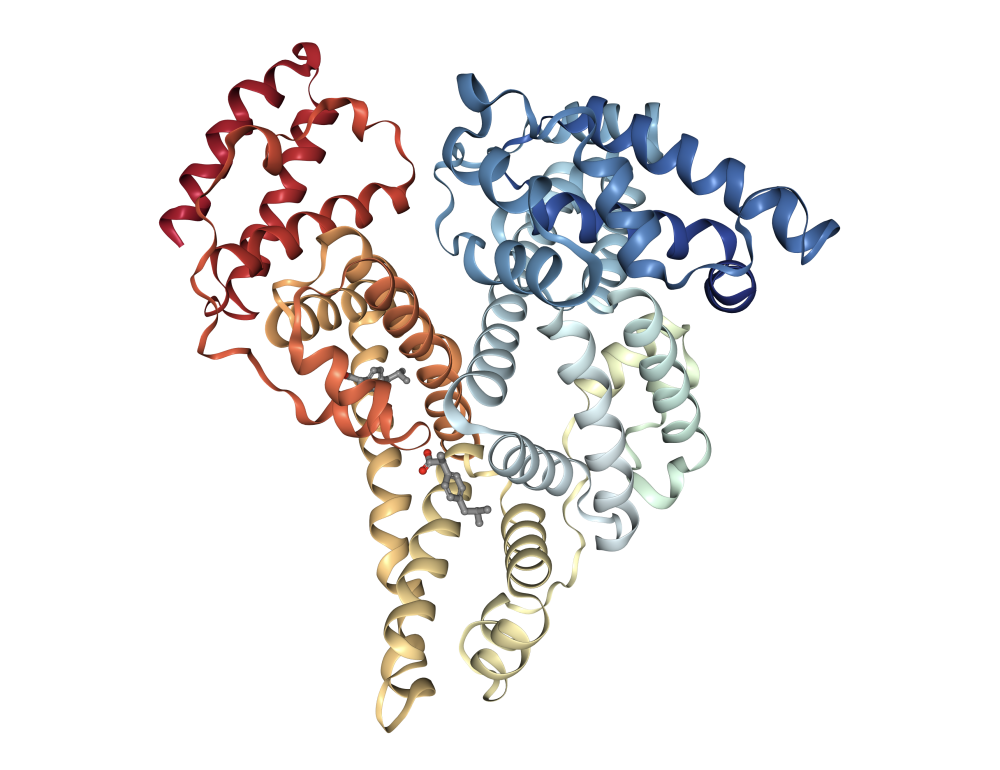 9%
9% р-ра д/в/в и в/м введения 500 мг: фл. 1 шт. в компл. с растворителем
р-ра д/в/в и в/м введения 500 мг: фл. 1 шт. в компл. с растворителем 6%: фл. 100 мл, 250 мл или 500 мл
6%: фл. 100 мл, 250 мл или 500 мл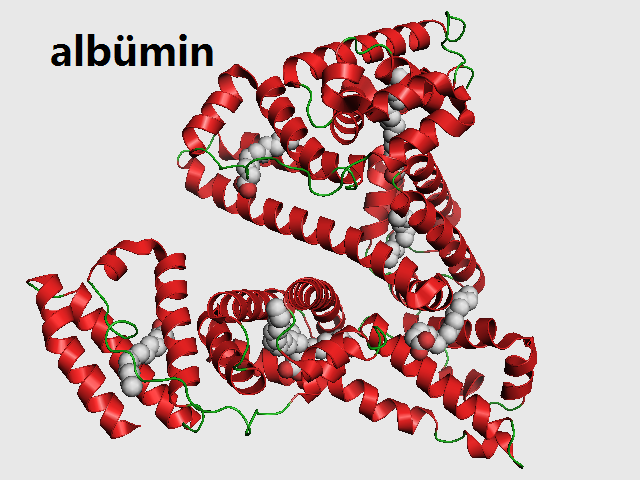 10 мг/1 мл: амп. 10 шт.
10 мг/1 мл: амп. 10 шт. 1 шт. в компл. с растворителем (амп. 4 мл 1 шт.)
1 шт. в компл. с растворителем (амп. 4 мл 1 шт.) 20% (20 г/100 мл): фл. 1 или 100 шт.
20% (20 г/100 мл): фл. 1 или 100 шт. 30 мг/1 мл: амп. 3, 5, 6, 10 или 20 шт.
30 мг/1 мл: амп. 3, 5, 6, 10 или 20 шт. : фл. 500 мл 1 или 10 шт.
: фл. 500 мл 1 или 10 шт. 10 г+5 г/100 мл: фл. 100 мл 1 или 56 шт., фл. 200 мл 1, 24 или 28 шт, фл. 250 мл 24 или 28 шт, фл. 400 мл 1,12 или 15 шт, фл. 500 мл 12 или 15 шт.
10 г+5 г/100 мл: фл. 100 мл 1 или 56 шт., фл. 200 мл 1, 24 или 28 шт, фл. 250 мл 24 или 28 шт, фл. 400 мл 1,12 или 15 шт, фл. 500 мл 12 или 15 шт. 10%: бут. или фл. 100 мл
10%: бут. или фл. 100 мл 4 мг: 20 шт.
4 мг: 20 шт. р-ра д/инф. 4 г: бут.
р-ра д/инф. 4 г: бут. 200 мл или 400 мл
200 мл или 400 мл 6% (ГЭК 200/0.5): фл. стеклян. 250 мл или 500 мл 10 шт. с держателями д/капельн. или без них, фл. пласт. 250 мл или 500 мл 10 или 20 шт. с петлей-держателем д/капельн., контейнеры полиолеф. «фрифлекс» 250 мл или 500 мл 10, 15, 20 или 30 шт.
6% (ГЭК 200/0.5): фл. стеклян. 250 мл или 500 мл 10 шт. с держателями д/капельн. или без них, фл. пласт. 250 мл или 500 мл 10 или 20 шт. с петлей-держателем д/капельн., контейнеры полиолеф. «фрифлекс» 250 мл или 500 мл 10, 15, 20 или 30 шт. д/приготовления р-ра д/инфузий 10 мг/1 мл: 5 мл амп. 5, 10, 250 или 500 шт.
д/приготовления р-ра д/инфузий 10 мг/1 мл: 5 мл амп. 5, 10, 250 или 500 шт. 9%
9% р-ра д/в/в и в/м введения 500 мг: фл. 1 шт. в компл. с растворителем
р-ра д/в/в и в/м введения 500 мг: фл. 1 шт. в компл. с растворителем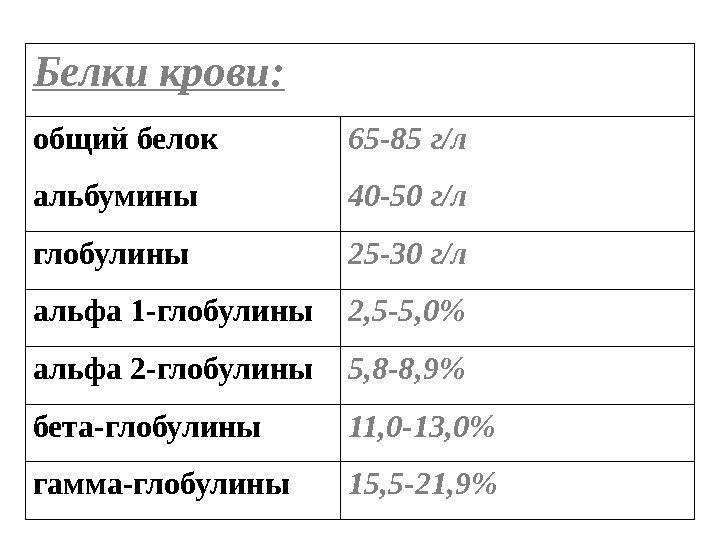 6%: фл. 100 мл, 250 мл или 500 мл
6%: фл. 100 мл, 250 мл или 500 мл.JPG) 10 мг/1 мл: амп. 10 шт.
10 мг/1 мл: амп. 10 шт. 1 шт. в компл. с растворителем (амп. 4 мл 1 шт.)
1 шт. в компл. с растворителем (амп. 4 мл 1 шт.)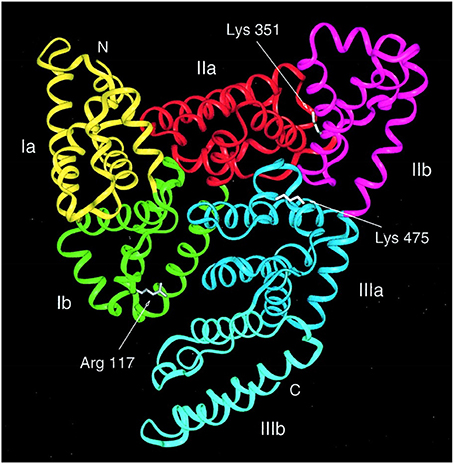 30 мг/1 мл: амп. 3, 5, 6, 10 или 20 шт.
30 мг/1 мл: амп. 3, 5, 6, 10 или 20 шт. : фл. 500 мл 1 или 10 шт.
: фл. 500 мл 1 или 10 шт. 10 г+5 г/100 мл: фл. 100 мл 1 или 56 шт., фл. 200 мл 1, 24 или 28 шт, фл. 250 мл 24 или 28 шт, фл. 400 мл 1,12 или 15 шт, фл. 500 мл 12 или 15 шт.
10 г+5 г/100 мл: фл. 100 мл 1 или 56 шт., фл. 200 мл 1, 24 или 28 шт, фл. 250 мл 24 или 28 шт, фл. 400 мл 1,12 или 15 шт, фл. 500 мл 12 или 15 шт. 100 мг: фл. двухъемкостн. 1 шт. (с растворителем)
100 мг: фл. двухъемкостн. 1 шт. (с растворителем)