Продукты, богатые белком [список] :: Здоровье :: РБК Стиль
Материал проверила и прокомментировала Александра Разаренова, врач-диетолог, нутрициолог, терапевт, член Российского союза нутрициологов, диетологов и специалистов пищевой индустрии
Зачем нужен белок
Белок — строительный материал для клеток организма. Он незаменим для мышц, внутренних органов и кожи, участвует во многих процессах, включая производство гормонов, необходим для поддержания роста и восстановления тканей. Белок нужно включать в сбалансированный рацион, это неотъемлемый элемент правильного питания.
Рекомендуемая среднестатистическая суточная доза макроэлемента:
- для женщин — 60–90 г;
- для мужчин — 80–150 г;
- для дошкольников — 3 г/кг массы тела;
- для школьников — 2,5 г/кг массы тела.
Норма может быть увеличена, если вы занимаетесь активным спортом или физическим трудом, больше белка требуется для женщин в период беременности и кормления ребенка.
15 продуктов, богатых белком
Яйца
Цельные яйца — одни из самых полезных и питательных продуктов. Они служат отличным источником витаминов, минералов, полезных жиров и антиоксидантов. В одном яйце 6 г белка и 78 ккал [1].
6 идей, чем заменить яйца в кулинарии
Миндаль
Популярный вид древесных орехов богат питательными веществами, включая клетчатку, витамин Е, марганец и магний. Как и в случае с яйцами, необходимо убедиться в отсутствии аллергии на продукт, прежде чем включать его в меню. В одной порции миндаля (примерно 28 г) содержится 164 ккал и 6 г белка [2].
10 полезных орехов: как понять, какие стоит есть именно вам
Куриная грудка
Первое, что советуют диетологи, когда речь идет о полезном белке в рационе, — куриная грудка без кожи. Этот ингредиент легко приготовить, он выступает основой многих салатов и супов. Если вы стремитесь нормализовать вес, грудку лучше варить и запекать. В 100 г продукта содержится 62 ккал и 31 г белка [3].
Этот ингредиент легко приготовить, он выступает основой многих салатов и супов. Если вы стремитесь нормализовать вес, грудку лучше варить и запекать. В 100 г продукта содержится 62 ккал и 31 г белка [3].
Овес
Крупы редко упоминают в высокобелковом рационе, но они — отличный источник энергии и пищевых волокон. Овес — один из самых полезных злаков. Он содержит магний, марганец, тиамин (витамин В1) и ряд других необходимых организму веществ. Одна чашка приготовленного овса содержит 307 ккал и 11 г белка [4].
Творог
Врачи рекомендуют выбирать продукт жирностью не менее 5% — в отличие от обезжиренного варианта, в нем меньше добавок, нужных для получения необходимой консистенции и усиления вкуса. Творог как разновидность сыра богат кальцием, фосфором, селеном, витаминами В2 и В12. В 100 г продукта содержится 71 ккал и 8,3 г белка [5]. Если вас не смущает жирность, можно добавить в рацион другие высокобелковые сыры, такие как моцарелла, чеддер и пармезан, а также кисломолочные продукты — кефир и ряженку.
Если вас не смущает жирность, можно добавить в рацион другие высокобелковые сыры, такие как моцарелла, чеддер и пармезан, а также кисломолочные продукты — кефир и ряженку.
Почему кефирная диета не так хороша, как кажется
Греческий йогурт
Густой кисломолочный продукт хорошо сочетается с закусками, его можно использовать как основу для десерта или заправку для салатов. Выбирайте натуральный йогурт без добавления сахара, он также богат белком, но менее калориен. Порция продукта (170 г) содержит 17 г белка и 100 ккал [6].
7 причин есть греческий йогурт каждый день
Молоко
Напиток содержит много полезных веществ, включая фосфор, кальций и рибофлавин (витамин В2). В одной чашке цельного молока 149 ккал и 8 г белка [7]. В случае непереносимости лактозы молоко может вызвать проблемы с ЖКТ. В качестве альтернативы можно выбирать растительный напиток, например соевое молоко, в котором также много белка.
Кальций: в каких продуктах содержится и как определить дневную норму
Брокколи
Если вы не едите мясо, молочные продукты и яйца, небольшое количество белка можно получать из овощей. Так, в 100 г брокколи содержится 2,8 г протеина и 31 ккал [8]. Кроме того, в зеленом овоще много клетчатки, калия, витаминов С и К. Исследования подтверждают, что систематическое употребление брокколи помогает укрепить иммунитет, улучшить зрение, полезно для костей и суставов.
Весенний детокс: 8 причин приготовить на ужин брокколи
Постная говядина
Содержание белка в говядине — 29 г при 219 ккал на 100 г продукта. В мясе много высокобиодоступного железа и витамина В12. Говядина подходит для людей, которые придерживаются правильного питания или низкоуглеводной диеты [9].
Не только мясо: 8 продуктов для роста мышц
Тунец
Диетический сорт рыбы можно готовить как горячее блюдо либо добавлять консервы в супы и салаты. В тунце мало жиров, при этом он служит прекрасным источником белка: на 100 г продукта — 29,15 г протеина и 130 ккал [10]. Эту рыбу не рекомендуют есть в больших количествах, так как за время жизни ее организм накапливает небольшие количества ртути [11]. Употребление тунца лучше ограничить до одного раза в неделю.
В тунце мало жиров, при этом он служит прекрасным источником белка: на 100 г продукта — 29,15 г протеина и 130 ккал [10]. Эту рыбу не рекомендуют есть в больших количествах, так как за время жизни ее организм накапливает небольшие количества ртути [11]. Употребление тунца лучше ограничить до одного раза в неделю.
В каких продуктах содержится витамин D и как восполнить его дефицит
Киноа
Злак, который часто упоминают как суперфуд, богат антиоксидантами, клетчаткой, минералами и витаминами. В одной порции киноа (185 г) содержится 222 ккал и 8 г белка [12]. Учитывайте, что в крупе, наравне с 14% белка, немало углеводов — 64%. Продукт не содержит глютена, поэтому его можно есть людям с целиакией.
Без мяса: 7 продуктов с запасом белка растительного происхождения
Чечевица
Разновидность бобовых с высоким содержанием клетчатки, магния, фосфора, фолиевой кислоты, меди и марганца.
8 продуктов для улучшения памяти
Иезекиильский хлеб
Его также называют библейским; это хлеб из пророщенных зерен. Как правило, его делают из нескольких видов зерна, включая пшеницу, ячмень, полбу и просо. Реже добавляют бобовые культуры [14]. В продукте остается меньше клейковины по сравнению с крупами для варки. Хлеб влажный и жесткий, хранится очень непродолжительное время. Он немного сладкий на вкус, потому что в процессе приготовления высвобождаются свободные сахара. Кстати, зерна можно покупать или проращивать самостоятельно и добавлять их в другие блюда для восполнения дефицита белка в рационе. Например, в пророщенной гречке его 7,5 г на 100 г продукта, в пшенице — 14 г, а в полбе — 15 г.
Как выбрать самый полезный хлеб
Тыквенные семечки
Содержание белка в семенах тыквы — 30 г на 100 г продукта [15]. Кажется, что это очень много, но вряд ли вы съедите так много за один раз. К тому же тыквенные семечки очень калорийные — 559 ккал на 100 г. Их можно добавлять в салаты, супы-пюре и к горячим блюдам, посыпать ими десерты и использовать как полезный перекус.
Креветки
В 100 морепродуктов содержится 99 ккал и почти 24 г белка, поэтому креветки по праву считают одними из важных продуктов для нормализации веса. Их часто добавляют в разнообразные меню, в том числе для кето-диеты. К тому же в них есть селен и витамин В12, а также присущие рыбе жирные кислоты Омега-3.
Комментарий эксперта
Александра Разаренова, врач-диетолог, нутрициолог, терапевт, член Российского союза нутрициологов, диетологов и специалистов пищевой индустрии
Белок — один из важнейших элементов питания. Его функции сложно недооценить: он участвует в транспортировке жизненно важных витаминов, жирных кислот, служит катализатором основных биохимических процессов.
Для получения всех необходимых аминокислот необходимо заботиться о разнообразии их источников: включать в рацион белок как животного, так и растительного происхождения. Но важно помнить, что, как и любое вещество, белок может приносить и пользу, и потенциальный вред. Особенно это касается людей с нарушением функции почек, печени, а кроме того, при подагре и аллергических реакциях на белковые компоненты. Поэтому важно включать его в рацион в соответствии с индивидуальными потребностями.
Также следует понимать, что полноценным питание будет только тогда, когда оно содержит в балансе все необходимые для жизни компоненты. Помимо белка, в рационе должно быть достаточное количество жиров, сложных углеводов, клетчатки, пищевых волокон, пектина. Поэтому не забывайте добавлять к белковым продуктам разнообразные овощи, зелень, растительные масла и цельные углеводные продукты. При этом рекомендуется ограничивать простые углеводы и сладкие газированные напитки.
При этом рекомендуется ограничивать простые углеводы и сладкие газированные напитки.
Какие продукты богаты белком? — Водовоз.RU
КомментироватьДля нормального функционирования организма каждому из нас необходим белок. Восстановление клеток, рост мышечной массы. Можно сказать, что белок – основной строительный материал в нашем организме. Основа здорового питания –достаточное количество белка. Но для того, чтобы его получать в достаточном количестве, необходимо знать в каких продуктах он присутствует.
В среднем для человека, который ведет обычный образ жизни достаточно 1-1,2 грамма белка на 1 килограмм веса. Для тех, кто регулярно тренируется, эта пропорция немного больше. Рассмотрим более подробно, какие функции белок выполняет в нашем организме.
1. Транспортная функция всех полезных веществ по организму.
2. Избавление от лишнего углекислого газа.
3. Укрепляет иммунитет.
4. Является компонентом многих гормонов.
5. Стабилизирует нервную систему.
6. Отвечает за двигательную систему.
7. Влияет на обменные процессы.
Действительно важный компонент для каждого человека.
Где получить достаточное количество белка?
— Мясо и птица. Пожалуй, эти продукты имеют самое большое содержание белка. Если вы хотите восполнить запас белка, обязательно введите в свой рацион питания мясо курицы и индейку. Мясо этих птиц содержит большее количество белка, чем свинина или говядина. Всего в 100 граммах этого продукта содержится 15-20 грамм белка. Обратите внимание, что действительно качественный продукт содержит необходимое количество белка. Поэтому при выборе курицы или индейки, обратите внимание на фермерские продукты. Только мясо, привезенное прямиком с фермы, пополнит баланс белков в вашем организме. Конечно же, оно будет вкуснее. Поэтому обязательно загляните в раздел фермерских продуктов на нашем сайте. Только качественное мясо и вкусные товары с доставкой на дом.
Поэтому при выборе курицы или индейки, обратите внимание на фермерские продукты. Только мясо, привезенное прямиком с фермы, пополнит баланс белков в вашем организме. Конечно же, оно будет вкуснее. Поэтому обязательно загляните в раздел фермерских продуктов на нашем сайте. Только качественное мясо и вкусные товары с доставкой на дом.
-Молочные продукты! Купить молочные продукты не составит труда, особенно, когда ассортимент позволяет выбрать любимые молочные продукты. Кефир, сметана, творог содержат достаточное количество белка, поэтому не забывайте включать их в свой рацион. Домашний творог на завтрак или свежий салат со сметанной заправкой – то, что необходимо вашему организму на регулярной основе! Вы можете купить натуральный йогурт, и в нём тоже будет достаточное количество белков. Попробуйте! Сыр — любимое дополнение завтрака, праздничного стола и многих блюд. А ведь в сыре содержится 20-25 грамм белка. Находка!
-Морепродукты и рыба. Необычно, но факт! В рыбных консервах содержится 29 грамм белка, что даже больше, чем в мясе. Про пользу других морепродуктов ходят легенды, они полезны не только для восполнения белка, но и в целом для общего здоровья человека.
Про пользу других морепродуктов ходят легенды, они полезны не только для восполнения белка, но и в целом для общего здоровья человека.
-Растительные источники белка также должны присутствовать в вашем рационе. Например, фасоль содержит 22 г. белка, а горох 23!
Закажите онлайн! Самые свежие мясные продукты, вкуснейшие молочные товары и многое другое с доставкой на дом. Теперь вам не придется тратить время на походы по магазинам. Интернет-магазин Водовоз.RU — только качественный сервис, помощь при заказе онлайн и быстрая доставка. Попробуйте, вам обязательно понравится!
Советуем также почитать
Какие продукты являются жиросодержащими?
Зачастую, преследуя фигуру своей мечты, мы исключаем из своего рациона продукты, содержащие жиры. Это неправильно, ведь именно жиры необходимы нашему организму для нормального функционирования. Именно поэтому, полностью исключать жиры из своего рациона не стоит.
Какие продукты человеку стоит есть каждый день?
Какие продукты купить, чтобы, несмотря на активную городскую жизнь, выглядеть моложе и свежее, а главное – хорошо себя чувствовать?
ПодробнееКакие продукты разрешены при диетическом столе №5 ?
Особенность такой диеты – то, что она способствует снижению нагрузки на печень и желчевыводящие пути.
Какие же продукты можно тем, кто сидит на диете №5?
ПодробнееНаписать комментарий:
Белки — незаменимый фактор питания / EDPRO
В этой статье поговорим, где происходит синтез белков в организме и где расщепляются белки. А также, где содержатся белки и в каких продуктах их больше.
А также, где содержатся белки и в каких продуктах их больше.
Что такое белок и для чего он нужен?
Белок — крупная молекула, состоящая из множества аминокислот. Из белков состоят все органы и ткани, и особенно — наши мышцы. Белки могут быть ферментами, гормонами и другими жизненно необходимыми веществами.
Где происходит синтез белков? Он происходит внутри каждой клетки организма. Для этого ей необходимы субстраты — аминокислоты. Часть из них организм может синтезировать самостоятельно, а часть (8 незаменимых аминокислот) должны поступать с пищей. Вот почему регулярное потребление белков необходимо для здоровья.
Дальше мы поговорим о том, где происходит расщепление белка и где после расщепления белков происходит их всасывание.
Где перевариваются белки?
Белки частично разрушаются в желудке под действием фермента пепсина, далее поступают в двенадцатиперстную кишку, где происходит дальнейшее переваривание белков. В кишечнике они продолжают расщепляться до пептидов и аминокислот ферментом поджелудочной железы трипсином. Всасывание аминокислот происходит в кишечнике.
В кишечнике они продолжают расщепляться до пептидов и аминокислот ферментом поджелудочной железы трипсином. Всасывание аминокислот происходит в кишечнике.
Далее поговорим о нормах потребления белков.
Суточная норма потребления белков
Норма потребления белка зависит от:
- Пола и возраста;
- Рода занятий;
- Уровня физической активности.
Суточное потребление белка для взрослого — 1-1,2 грамма в сутки на 1 кг массы тела, а при наборе мышечной массы — до 2 грамм на 1 кг веса. Норма потребления белка и углеводов у спортсменов рассчитывается индивидуально, исходя из вида спорта и нагрузки.
У детей нормы потребления белков и жиров несколько иные. Поскольку жиры являются источником жирорастворимых витаминов и Омега-кислот, необходимо, чтобы в рационе ребёнка они присутствовали в достаточном, но не чрезмерном, количестве. Нормы белков для детей вы найдёте ниже, а таблицу содержания жиров в продуктах питания — по этой ссылке.
Норма суточного потребление белков для детей:
|
Возраст ребёнка |
Количество белка в гр. на 1 кг массы тела |
|
0 -1 год |
3,0 — 3,5 |
|
1 — 7 |
2,5 — 3,0 |
|
7 — 12 |
2,0 — 2,5 |
|
12 — 18 |
2,0 |
Важно, что норма потребления белков, жиров и углеводов должна соответствовать потребностям организма. Несколько ниже мы поговорим, где больше всего белка в продуктах.
Несколько ниже мы поговорим, где больше всего белка в продуктах.
Демо-уроки по программе «Нутрициология»
Белки и голодание
Известно, что разгрузочные дни и кратковременные периоды голодания запускают процесс аутофагии и клеточного обновления. Однако, при длительном голодании, при отказе от продуктов с высоким (большим) содержанием белков, например, на фоне диеты, организм начинает процесс сжигания собственных белков. Происходит разрушение белков мышечной ткани и уменьшение мышечной массы.
Так происходит потому, что для организма собственный белок является более легким способом получения энергии, чем сжигание жира. К тому же для жиров и углеводов в организме есть соответствующие депо, а для белка нет.
Мы не можем откладывать белок и незаменимые жиры про запас и поэтому потребление белков и жиров должно быть регулярным и нормированным. О видах жиров и их значении для организма читайте тут.
Голодание и несбалансированное питание с отказом от животных продуктов с высоким содержанием белков приводит к развитию белковой недостаточности и серьезно угрожает здоровью и даже жизни человека. Во избежание этого необходимо, чтобы в рационе присутствовали продукты, где содержится белок.
Далее разберем, где содержатся белки и какие продукты с высоким содержанием белка относятся к легкоусвояемым.
Содержание белков в продуктах
Теперь давайте поговорим, где содержится белок и какие белки усваиваются организмом легче всего. К таким относятся:
- белки молока,
- яичный белок.
Высокое содержание белка наблюдается в продуктах животного происхождения:
- мясо и птица,
- яйца,
- творог,
- рыба,
- икра и морепродукты.
Любопытно, что морепродукты при высоком содержании белка и важных микроэлементов, весьма низкокалорийны..gif) Они являются источником коллагена и содержат большое количество Омега-кислот. Вместе с другими их можно отнести к продуктам, замедляющим старение.
Они являются источником коллагена и содержат большое количество Омега-кислот. Вместе с другими их можно отнести к продуктам, замедляющим старение.
К продуктам растительного происхождения, где содержится больше всего белка, относятся орехи и бобовые. Не стоит недооценивать их, т.к. по содержанию белка они могут «дать фору» самому лучшему стейку.
Продукты, где много белков, нежелательно сочетать с сахарами. При комбинации продуктов с высоким содержании белков и углеводов, возможен процесс гликации белка, в результате которого белок становится недоступным для пищеварительных ферментов.
Мы достаточно поговорили о свойства белка, теперь стоит упомянуть о содержание белков в продуктах; эту информацию вы найдете в таблице.
Таблица «Содержание белков в продуктах питания».
|
Продукт |
Содержание белка в гр на 100 гр продукта |
|
Сыр «Пармезан» |
35,8 |
|
Соя |
34,9 |
|
Свинина |
20-29 |
|
Арахис |
26,3 |
|
Гуси, утки |
11-25 |
|
Тыквенные семечки |
24,5 |
|
Горох |
23,8 |
|
Скумбрия |
22,7 |
|
Фасоль |
22,3 |
|
Тунец |
22,2 |
|
Курятина |
20,0 |
|
Говядина |
18-20 |
|
Баранина |
11-18 |
|
Печень (свиная, говяжья) |
17-18 |
|
Кедровые орехи |
16-20 |
|
Творог 9% |
16,2 |
|
Куриное яйцо |
12,5 |
|
Гречневая крупа |
12 |
Завершая обзор, стоит подчеркнуть важность ежедневного поступления белков в организм человека.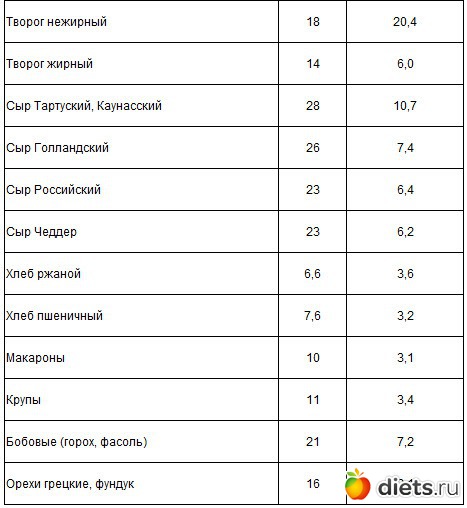 А при отказе от пищи животного происхождения — регулярный приём аминокислот. Подробнее о видах, роли белков их недостатке и избытке, читайте в статьях нашего блога «Нутрициология».
А при отказе от пищи животного происхождения — регулярный приём аминокислот. Подробнее о видах, роли белков их недостатке и избытке, читайте в статьях нашего блога «Нутрициология».
Полезное питание во время беременности
Беременность – это особый и важный период в жизни женщины. В это время отдельное внимание рекомендуется уделить питанию.
Как питаться, чтобы развиваться плоду правильно? Что выбрать из всего многообразия полезных предложений и поддержать здоровье будущей мамы? Как не ошибиться при выборе?
Будущей маме с первых дней беременности необходимо готовить свой организм для того, чтобы плод будущего ребенка правильно формировался, а мама при этом чувствовала себя максимально здоровой и после родов обеспечила ребенка полным количеством полезного грудного молока.
Не рациональное, не сбалансированное, неправильное питание во время беременности может вести к следующим вещам:
- Отеки
- Повышенное артериальное давление
- Нарушение плацентарного кровообращения
- Тошнота, рвота
Первое, на что необходимо обратить основное внимание – это три главных источника, которые обеспечивают правильное развитие плода и здоровье будущей мамы:
1. Белок.
Белок.
Белок обладает жизненно важными функциями:
- Строительной
- Транспортной
- Энергетической
- Защитной – все защитные антитела – это белок
Все, что есть в организме будущего ребенка – все состоит из белка.
В качестве источника белка во время беременности рекомендуется употреблять:
- Из мяса: кролик, так как в нем содержится больше всего белка (21 %) по сравнению с другими видами мяса, оно не жирное и в нем отсутствует холестерин.
- Из бобовых:(Фасоль,Чечевица,Нут,Маш, особенно желтый и пр.)
2. Кальций, так как кальций — это основа формирования костной ткани.
Недостаток кальция ведет к двум последствиям:
- Не формирование нормальной костной ткани у плода
- Костопороз (вымывание костной ткани у беременной женщины)
Если в первые 3 месяца будущей маме не хватает кальция ребенок может родиться глухим.
Одним из богатых источников кальция является КУНЖУТ, также кальцием богат:
- Творог
- Брынза 5 %
- Орехи – миндаль, грецкий, фундук, арахис
- Семена тыквы и подсолнечника
- Финики
- Сельдерей
- Петрушка и многое другое
Необходимая доза – 1200 мкг кальция
3. Витамин В9 – фолиевая кислота
Фолиевая кислота необходима на ранних этапах формирования нервной ткани, центральной нервной системы плода и прежде всего без фолиевой кислоты невозможно образование эритроцитов и перенос кислорода.
В качестве источника фолиевой кислоты рекомендуется употреблять:
- Брокколи, шпинат
- Чечевица, фасоль, зеленый горошек
- Авокадо
- Семена льна
- Семена подсолнечника
- Орехи, такие как миндаль, арахис
Суточная норма потребления – около 600 мкг. Такое количество обеспечит правильный стул и снабдит необходимым количеством фолиевой кислоты.
Правильное питание для беременных исключительно важно!
Оно должно быть разнообразным и при этом кушать необходимо небольшими порциями.
Если вы решили начать свою беременность с правильного питания, рекомендуется включить в свой рацион питания:
- Каши, такие как льняная, гречневая кедровая
В них содержатся необходимая клетчатка, витамины, минеральные вещества и многое другое. Употребление таких каш будет благоприятно действовать на эмоциональный фон, контролировать настроение, заряжать полезными калориями, регулировать стул и пищеварение, и надолго обеспечивать чувством сытости.
- Обязательно льняное масло, так оно является незаменимым источником Омега 3 и помогает в формировании костной ткани будущего ребенка
Во время беременности будущих мам также беспокоит понижение гемоглобина. Понижение уровня гемоглобина – это естественный процесс, ведь вас теперь стало двое и крови необходимо больше циркулировать и еще больше доносить кислорода до каждой клеточки.
Продукт, который самым лучшим и безопасным образом поможет отрегулировать уровень гемоглобина – это конопляное масло. К тому же конопляное масло обладает огромным количеством достоинств:
- Великолепный антиоксидант
- Источник витаминов, в том числе витамна D, который помогает усваиваться кальцию в организме
- Богат железом, цинком, магнием
- Содержит 20 аминокислот, 9 из которых незаменимые
- В его состав входят незаменимые жирные кислоты – Омега3 и Омега6 и многое другое.
Суточная норма потребления конопляного масла – 1, 2 столовые ложки.
Для повышения лактации одним из самых лучших и безопасных источников являются кедровые орехи. Отжим кедровых орешков деревянным прессом позволяет сохранить все живые витамины и полезные вещества в масле, поэтому такое масло считается самым лучшим и эффективным для правильного питания и оздоровления. Считается, что любое масло можно заменить друг другом, а кедровое масло ничем заменить нельзя, аналогов ему не существует. Из всех природных продуктов кедровое масло обладает самой целебной силой. Уникальность кедрового масла в его составе, оно содержит все микро и макроэлементы, все витамины, все незаменимые аминокислоты, легкие жиры, комплекс ненасыщенных жирных кислот – омега 3, 6, 9. Причем все вещества идеально сбалансированы и имеют оптимальное соотношение для человека.
Из всех природных продуктов кедровое масло обладает самой целебной силой. Уникальность кедрового масла в его составе, оно содержит все микро и макроэлементы, все витамины, все незаменимые аминокислоты, легкие жиры, комплекс ненасыщенных жирных кислот – омега 3, 6, 9. Причем все вещества идеально сбалансированы и имеют оптимальное соотношение для человека.
Немаловажную роль в здоровье будущей мамы играет вода.
Какую воду выбрать для правильного питания?
Самый простой способ пить воду, очищенную при помощи природных фильтров для воды.
Где содержится больше всего белка, кальция и Омега-3? – 4fresh блог
В летнем выпуске 4fresh Guide мы проводили викторину на тему здорового питания.
Подробные ответы подготовил фитнес тренер и специалист по питанию Антон Полухин, который поделился ценной информацией в нашем интервью.
Антон, расскажи про Омега-3, для чего он нужен нашему организму?
Омега 3 — полиненасыщенные незаменимые жирные кислоты, самое важное в них – это ЭПК (эйкозапентаеновая) и ДГК (докозагексаеновая) жирные кислоты и без них невозможен правильный обмен веществ. Незаменимые они потому, что не синтезируются у нас в организме, и получить мы можем их только извне. Они очень важны для организма, так как улучшают работу сердечно-сосудистой системы, тормозят процессы старения кожи, помогают нашему иммунитету. И это далеко не все.
Незаменимые они потому, что не синтезируются у нас в организме, и получить мы можем их только извне. Они очень важны для организма, так как улучшают работу сердечно-сосудистой системы, тормозят процессы старения кожи, помогают нашему иммунитету. И это далеко не все.
В каком продукте наибольшее содержание Омега-3 — в семенах Чиа, лососе или льняном масле?
Льняное масло лидирует по содержанию Омега-3, но каждый продукт хорош по-своему.
Семена чиа подходят для похудения, лосось — это еще и качественный источник белка (по аминокомплексу), а льняное масло — это полиненасыщенные жирные кислоты для обмена веществ.
Как понять, есть ли в организме дефицит Омега3 и как его правильно восполнять?
Дефицит Омега-3 можно понять по самочувствию человека, по состоянию его иммунитета, сухости кожи, боли в мышцах, быстрой утомляемости и ломкости волос.
Что такое аминокислотный профиль, важен ли он для человека? Нужно ли за ним следить, и как это делать?
Аминокислотный профиль — это количественное содержание отдельных аминокислот в составе белка. И он, конечно же, важен. Следить за ним не обязательно, если ваша цель не профессиональные выступления, но важно знать, что питание должно быть разнообразным.
И он, конечно же, важен. Следить за ним не обязательно, если ваша цель не профессиональные выступления, но важно знать, что питание должно быть разнообразным.
Нельзя есть только курицу или рыбу, нужно потреблять разные продукты и тем самым получать все необходимые нам аминокислоты. Я лично всегда рекомендую как можно разнообразнее питаться, что скажется и на физическом и на эмоциональном состоянии. Возьмите за эталон яичный белок — в нем максимально полный аминокислотный профиль и высокая скорость усвоения.
В каком продукте лучший аминокислотный профиль? В курином мясе, протеине из семян конопли или в нуте?
Вопрос с подвохом 🙂 Протеиновый порошок конопли является отличным источником белка и содержит 8 незаменимых аминокислот, которые организм не может синтезировать.
В отличие от других растительных источников белка, таких как пшеница и соя, конопля не вызывает аллергии. В нуте тоже присутствуют все аминокислоты, но в готовом виде получается очень большое количество продукта. А самыми полноценными источниками белка считаются продукты животного происхождения, поэтому по соотношению аминокислотного профиля побеждает куриное мясо. Но питание всегда должно быть органическое, и цельное.
А самыми полноценными источниками белка считаются продукты животного происхождения, поэтому по соотношению аминокислотного профиля побеждает куриное мясо. Но питание всегда должно быть органическое, и цельное.
Все спортивное питание это лишь дополнительные добавки, без них можно вполне себе функционировать, а вот без еды нет. Куриное мясо — хороший и недорогой источник белка с незначительным содержанием животных жиров, а нут подойдет для веганов. Все бобовые имеют достаточное количество белка, но если употреблять только бобовые — то будет как раз страдать аминокислотный профиль.
Что важнее — количество белка или полноценный аминокислотный профиль?
Известно, что большое количество белка человеку занимающемуся без фармакологической поддержки не нужно (1,5-2.0 г на 1 кг веса), здесь уже встает вопрос о качестве потребляемой еды.
Опять же, нужно разнообразить и составить грамотно свою диету, для потребления общего количества белка и иметь полноценный аминокислотный профиль.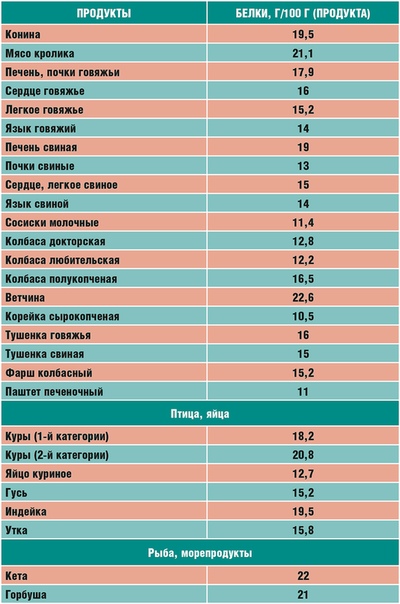
Не зацикливайтесь и не превращайтесь в «куриногрудных мучеников». Секрет прост — держите суточную норму БЖУ, улыбайтесь и получайте удовольствие от жизни.
Следующий вопрос про кальций. Большинство участников опроса считают, что его много в твороге. Так ли это? Где его содержится больше — в твороге, брокколи или тунце?
На 100 грамм продукта больше всего кальция содержится в твороге. Но хочется отметить, что молочные продукты, рыба и зеленые продукты (брокколи, шпинат, спаржа и тд.) — самые богатые источники кальция.
Нельзя есть только один творог и надеется, что у нас будет все хорошо с кальцием, советую всем, если нет возможности добавлять в рацион хорошие сорта рыбы ежедневно, то хотя бы раз в неделю, и также зеленые овощи, каши — это все источник кальция. И чем разнообразнее мы питаемся, тем лучше для нашего организма.
Как отражается дефицит кальция на здоровье? Как восполнить этот дефицит?
При дефиците кальция страдает почти весь организм, симптомы: развитие кариеса, судороги, страдает нервно-мышечная система, боли в суставах и костях и в худшем случае сердечная недостаточность.
Для избежания дефицита нужно употреблять продукты питания, богатые витамином D, они должны в достаточном количестве присутствовать в рационе каждого человека. Большое количество этого витамина содержится в кисломолочных продуктах, в растительных маслах, яичных желтках, морепродуктах, особенно в рыбьем жире и печени рыб. Кроме того, витамин D присутствует в овсяной крупе, картофеле и зелени.
Спасибо тебе, Антон, за то, что помог разобраться нам и нашим читателям в таких интересных вопросах. Думаю, многим будет полезно узнать мнение эксперта, и благодаря этому здоровый образ жизни будет становиться еще эффективнее для каждого из нас.
Гликирование белков — преграда для долголетия
Глюкоза необходима для нормального функционирования нашего тела. Головной мозг работает исключительно на глюкозе. Но ее избыток дает побочное действие, при котором сахар крови вступает в реакцию с белками, нарушая функцию последних. В этом состоит суть процесса гликирования белков организма, который ведет к скорейшему старению, образованию морщин, сердечно — сосудистым и другим заболеваниям.
Белки становятся не работоспособными, поскольку нарушается их структура. Вследствие гликирования эластина и коллагена, — основных белков сосудистых стенок, развивается фиброз и атеросклероз. Стенки сосудов становятся хрупкими, теряется их эластичность, в них образуются трещины, которые заполняются холестериновыми бляшками.
Глюкоза содержится в любой ткани. С процессом гликирования белка мы сталкиваемся часто в повседневной жизни, когда поджариваем что-либо до хрустящей корочки. При воздействии высокой температуры глюкоза вступает в реакцию с белком ткани.
Схожие процессы запекания белков происходят и в организме человека, с той лишь разницей, что протекают они медленнее. Наиболее опасны конечные продукты гликирования для сетчатки глаза и хрусталика, коронарных артерий и почек.
Возникают различные воспалительные процессы, развиваются остеоартрит, ревматоидый артрит, рак предстательной железы. Повышается свертываемость крови, что увеличивает риск тромбозов и гипертонии.
Гликирование вызывает инсулиннезависимый диабет второго типа. Это приводит к высокому содержанию глюкозы в крови, а это в свою очередь к еще большему накоплению конечных продуктов гликирования. Эта взаимосвязь и является основной причиной осложнений, которые дает диабет.
Таким образом, для предотвращения гликирования белка в нашем организме, а следовательно и для замедления старения, нам необходимо устранить причины, ведущие к нарушению функций белков и являющиеся преградой для здоровья и долголетия. Таких причин две.
1. Излишнее потребление быстрых углеводов, продуктов имеющих высокий гликемический индекс.
Гликемический индекс того или иного продукта — это показатель его влияния на уровень сахара крови после его употребления. Он показывает быстроту усвоения источника сахара по сравнению с глюкозой, индекс которой принят за 100 процентов. Значения гликемического индекса выше семидесяти, считаются высокими.
2. Потребление гликированного белка в пищу. Вся жареная пища, приготовленная нами, содержит гликированный белок.
Вся жареная пища, приготовленная нами, содержит гликированный белок.
Особенно опасны в этом плане готовые блюда общепита, в особенности еда в ресторанах, или так называемая «высокая кухня» где основное значение придается внешнему виду подаваемых блюд. Они содержат многократно больше продуктов гликирования, чем пища домашнего приготовления.
Чтобы не разрушать себя изнутри, нужно отказаться от жарки, как способа приготовления пищи. Еда приготовленная при температуре ниже 120 градусов, не ведет к образованию продуктов гликирования.
Пищу можно готовить в микроволновке, варить, готовить на пару, тушить, бланшировать, мариновать в натуральном уксусе или лимонном соке и т.д. Многие продукты можно и нужно употреблять в сыром виде.
Получается замкнутый круг. Углеводы нам жизненно необходимы, как источник энергии. А употребление углеводов ведет к старению. Где же выход?
Наука пока не дала окончательного ответа на этот вопрос, но исследования в этом направлении ведутся. Возможно, скоро будет найдено средство, полностью предотвращающее гликирование белков в организме.
На сегодняшний день уже существует такой препарат, — это Метформин, который довольно хорошо изучен и рекомендован как средство для продления жизни, понижающее уровень сахара крови, то есть имитирующее низкокалорийное питание. Метформин противопоказан людям с почечной недостаточностью, и назначается только врачем.
Уровень гликирования определяет скорость старения. Определить этот уровень можно, сдав анализ крови на гликированный гемоглобин (HbA1C). Анализ не обязательно проводить натощак. Оценить результаты анализа можно так. Ниже 7.6% — хорошо. От 7.6 до 9% — удовлетворительно. Выше 9% — плохо.
Для успешной борьбы со старением следует привести в порядок свой образ питания. Для этого необходимо придерживаться принципов калорийно ограниченного питания, при помощи которого снижается уровень сахара крови, а соответственно снижается и вероятность реакции глюкозы крови с белками тела.
Кроме этого, калорийно ограниченное питание увеличивает аутофагию — процесс, обеспечивающий переваривание поврежденных белков и клеточного мусора. Структуры клеток обновляются и улучшаются их функции.
Очень хорошо способствует аутофагии проведение разгрузочных овощных дней 2-4 раза в месяц, когда вы в течение суток пьете воду и едите неограниченно только овощи и никакой другой пищи.
При обычном, традиционном питании основным фактором риска является высокий гликемический индекс продуктов. Избежать высоких концентраций глюкозы в крови можно, употребляя продукты с невысокими значениями гликемического индекса, которые более медленно отдают глюкозу в кровь.
Некоторые продукты обладают небольшим гликемическим индексом, но содержат другие моносахара, которые еще более вредны, чем глюкоза, — это фруктоза, содержащаяся в мёде и сладких фруктах, которая в десять раз активнее производит гликирование белков, а также лактоза — молочный сахар, содержащийся в молоке. Поэтому, ни мёд, ни молоко не могут быть рекомендованы как продукты для здоровья и долголетия, в связи с тем, что они способствуют только лишь ускоренному старению.
Поэтому, ни мёд, ни молоко не могут быть рекомендованы как продукты для здоровья и долголетия, в связи с тем, что они способствуют только лишь ускоренному старению.
В образе здорового питания должно быть сведено к минимуму или вовсе исключено из рациона питания употребление быстрых углеводов, которые в избытке содержатся в выпечке, конфетах, сладких напитках (сладкий чай, фруктовые соки, сладкая газировка и т.д.
Калорийно ограниченное питание следует строить в основном на употреблении большого количества овощей, бобовых, каш из различных круп, включая в меню не жареные рыбу и морепродукты, мясо птицы и немного нежирного мяса. То есть питание должно строиться в основном на медленных углеводах, полисахаридах, которые медленно без скачков, повышают уровень сахара крови, не усиливая процесс гликирования, а значит и старения, и надолго сохраняя чувство сытости.
Я сам поступаю так и рекомендую всем добавлять в углеводные блюда (например в каши) и в напитки (например в кофе) молотую корицу.
Корица понижает уровень сахара крови и действует по типу препаратов бигуанидов. Научно установлено, что куркума также эффективно снижает образование конечных продуктов гликирования. Две этих специи должны всегда присутствовать в рационе для профилактики старения.
С одной стороны, контроль над своим питанием дело довольно хлопотное. С другой стороны — чрезвычайно полезное. Как с точки зрения здоровья и долголетия, так и с точки зрения материальных затрат. Основные компоненты такого питания — крупы для каш и свежие овощи — это самое малозатратное питание, какое только может быть.
Животный белок — в каких продуктах найти и чем заменить животный белок?
Первые против белков животного происхождения, постоянно рассуждают, чем заменить животный белок, вторые за животный белок в продуктах. Кто прав, решайте сами.
Кроме животного белка, яйца, говядина, курица и рыба – содержат и другие необходимые организму питательные вещества.
Белки — это те макроэлементы, которые нужны нам, что называется, в изобилии (в условиях дефицита белка наш организм начнет понемногу утрачивать способность синтезировать и восстанавливать ткани). Белки составляют около двадцати процентов веса сердца, скелетных мышц и печени и примерно десять процентов мозговой ткани. Качество белка, которое потребляет человек, может существенно повлиять на его здоровье. С увеличением числа вегетарианцев по всему миру, качество и сравнение белков животного происхождения и растительных белков является очень распространенной темой.
Белки составляют около двадцати процентов веса сердца, скелетных мышц и печени и примерно десять процентов мозговой ткани. Качество белка, которое потребляет человек, может существенно повлиять на его здоровье. С увеличением числа вегетарианцев по всему миру, качество и сравнение белков животного происхождения и растительных белков является очень распространенной темой.
Белки любого происхождения состоят из аминокислот, которые необходимы для регулирования различных функций организма. Качество белка может быть определено в зависимости от содержания в нем аминокислот и их структуры. Белки животного происхождения содержат аминокислоты, которые больше удовлетворяют запросам организма. Напротив, у источников растительного белка низкая биологическая ценность, а зачастую и низкое содержание некоторых аминокислот, таких как лизин и цистеин.
Чем белки животного происхождения лучше белков растительных? Во многих растительных источниках белков содержится больше, чем в мясе, однако в них все равно не хватает ключевых аминокислот. В 100г говядины содержится от 20 до 25г белка, а в 100г лосося содержит 16,9г белка. Из всех растительных источников соя является наиболее биологически полной. Соевый белок и бобы содержат примерно 22г белка на 100г продукта, в то время как в таком же количестве арахиса белков около 40г.
В 100г говядины содержится от 20 до 25г белка, а в 100г лосося содержит 16,9г белка. Из всех растительных источников соя является наиболее биологически полной. Соевый белок и бобы содержат примерно 22г белка на 100г продукта, в то время как в таком же количестве арахиса белков около 40г.
Чем растительные белки лучше белков животного происхождения? В белках животного происхождения часто больше жира и холестерина, чем в белках, полученных из растительных источников. 100г говядины содержат до 25 процентов от рекомендуемой дневной нормы жира и до 30 процентов холестерина в крови. Растительные белки, такие как соя, не имеют холестерина и содержат только 1 процент от ежедневного рекомендуемого значения жира. Тесная связь между высоким содержанием жиров, высоким содержанием холестерина и болезнями сердца оставляет в этом отношении за растительными белками очевидное преимущество.
В каких продуктах содержится животный белок? Основные источники животного белка это почти виды мяса, морепродуктов и птицы. 100-граммовая порция мясного говяжьего фарша содержит в себе 21г белка, такое же количество тунца содержит 25г белка, а куриной грудки — 29г. Даже если вы не едите мясо, вы все еще можете получать животный белок продуктов: из яиц и молока, сыров, йогуртов. В этих продуктах содержится от 7 до 10г животного белка на 100-граммовую порцию. Некоторые пищевые продукты содержат белки животного происхождения в виде ингредиентов, таких как молоко, концентрат белка или белок молочной сыворотки.
100-граммовая порция мясного говяжьего фарша содержит в себе 21г белка, такое же количество тунца содержит 25г белка, а куриной грудки — 29г. Даже если вы не едите мясо, вы все еще можете получать животный белок продуктов: из яиц и молока, сыров, йогуртов. В этих продуктах содержится от 7 до 10г животного белка на 100-граммовую порцию. Некоторые пищевые продукты содержат белки животного происхождения в виде ингредиентов, таких как молоко, концентрат белка или белок молочной сыворотки.
Кроме животного белка, эти продукты – говядина, курица и рыба – содержат и другие необходимые организму питательные вещества. В первую очередь, они обеспечивают нас железом, важным для здоровых красных кровяных клеток минералом. Железо в таких продуктах содержится форме гема (так называется небелковая часть гемоглобина). Именно в такой форме человеческому организму легче всего их переварить. Другие содержащие животный белок продукты – молоко и жирная рыба – необходимы также и для здоровья костей, потому что в них есть кальций. Говядина, моллюски, молочные продукты и птица являются также хорошими источниками цинка. Кроме того, продукты с животными белками также обеспечивают нас витамином B12.
Говядина, моллюски, молочные продукты и птица являются также хорошими источниками цинка. Кроме того, продукты с животными белками также обеспечивают нас витамином B12.
Различают также нежирные белки животного происхождения, источниками которым являются, например, обезжиренные молочные продукты, куриные грудки без кожи, яичные белки и постная говядина, с низким содержанием жира и калорий. Все эти продукты часто в диетах, чтобы лучше контролировать свой вес. Продукты с жирными белками животного происхождения, такие как цельный сыр, говядина с видимым жиром и курица с кожей, считаются нездоровыми с точки зрения содержания в них насыщенных жиров и холестерина. Но, например, жирная рыба с низким содержанием насыщенных жиров является для организма источником длинноцепочечных жирных кислот омега-3, которые помогают снизить риск сердечно-сосудистых заболеваний.
Конечно, мясо является для нас основным поставщиком белка. Но есть и другие ресурсы, которые не являются источниками животного происхождения. Чем же можно заменить животный белок?
Чем же можно заменить животный белок?
Во-первых, заменить животный белок можно бобовыми. Например, 250-граммовая порция фасоли содержит 11,5г белка. Не так уж и мало! Для того, чтобы разнообразить вкус, можно чередовать или смешивать сорта бобовых нут, черная и красная фасоль тоже являются хорошими источниками белка.
Во-вторых, заменить животный белок можно орехами. Кроме белка, орехи снабжают нас витаминами, минералами и клетчаткой. Хотя разные орехи по содержанию белка различаются, во всех видах его достаточно, чтобы обеспечивать потребности организма. Например, 30г арахиса содержит 7,3г белка.
Третий способ заменить животный белок – это употребление мюслей. 150г смеси овса, орехов, пшеницы и фруктов содержит от 7 до 10г белка. Это может быть хорошим вариантом завтрака.
Наконец, еще один ответ на вопрос, чем заменить животный белок – соевый творог тофу. Средняя потребность взрослого человека в белке — от 45 до 55г в день. 150-граммовая порция тофу, который является производным от соевого растения, содержит 10,3г белка. Чтобы сделать тофу частью полноценного обеда, его можно перемешать с овощами и заправить соусом. Попробуйте сами!
Чтобы сделать тофу частью полноценного обеда, его можно перемешать с овощами и заправить соусом. Попробуйте сами!
Источник
Структура белка: первичная, вторичная, третичная, четвертичная структура
Скачать версию PDF
Разработчики лекарств все чаще обращаются к большим молекулам, особенно к белкам, в качестве терапевтического средства. Приготовление белкового лекарственного продукта может быть довольно сложной задачей, и без хорошего понимания природы белковой структуры и конформационных характеристик конкретного разрабатываемого белка результаты могут быть плачевными. Это краткое техническое описание призвано дать читателю краткий обзор структуры белка.В нем также будет кратко описано, как структура белка может быть затронута во время приготовления, и некоторые аналитические методы, которые можно использовать как для определения структуры, так и для анализа стабильности белка.
Термин «структура», когда он используется в отношении белков, принимает гораздо более сложное значение, чем для небольших молекул.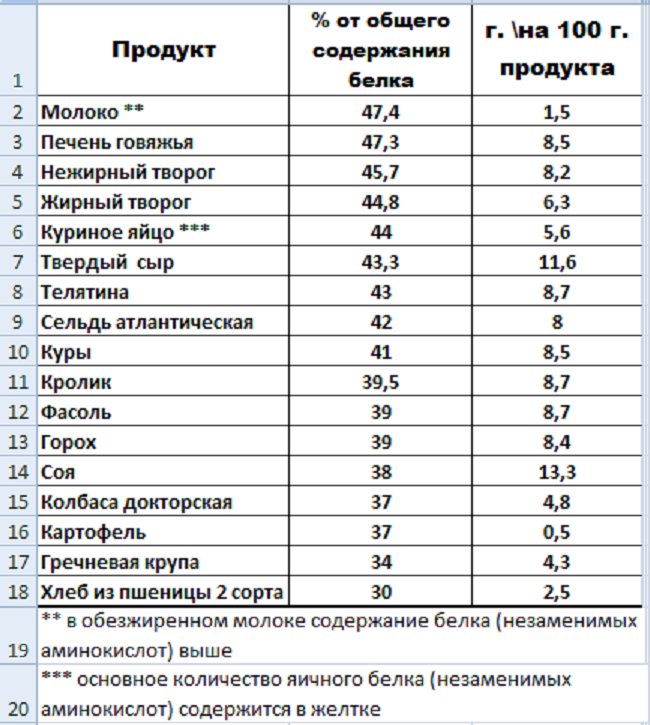 Белки представляют собой макромолекулы и имеют четыре различных уровня структуры: первичный, вторичный, третичный и четвертичный.
Белки представляют собой макромолекулы и имеют четыре различных уровня структуры: первичный, вторичный, третичный и четвертичный.
Первичная структура
Существует 20 различных стандартных L-α-аминокислот, используемых клетками для построения белков.Аминокислоты, как указывает их название, содержат как основную аминогруппу, так и кислотную карбоксильную группу. Эта дифункциональность позволяет отдельным аминокислотам объединяться в длинные цепи путем образования пептидных связей : амидных связей между -NH 2 одной аминокислоты и -COOH другой. Последовательности, содержащие менее 50 аминокислот, обычно называют пептидами, тогда как термины белок и полипептид используются для более длинных последовательностей. Белок может состоять из одной или нескольких молекул полипептида.Конец пептидной или белковой последовательности со свободной карбоксильной группой называется карбокси-концом или С-концом. Термины «амино-конец» и «N-конец» описывают конец последовательности со свободной α-аминогруппой.
Аминокислоты различаются по структуре заместителями в их боковых цепях. Эти боковые цепи придают конечному пептиду или белку различные химические, физические и структурные свойства. Структуры 20 аминокислот, обычно встречающихся в белках, показаны на рисунке 1.Каждая аминокислота имеет как однобуквенное, так и трехбуквенное сокращение. Эти сокращения обычно используются для упрощения записанной последовательности пептида или белка.
В зависимости от заместителя в боковой цепи аминокислота может быть классифицирована как кислая, основная или нейтральная. Хотя для синтеза различных белков человека требуется 20 аминокислот, мы можем синтезировать только десять. Остальные 10 называются незаменимыми аминокислотами и должны поступать с пищей.
Аминокислотная последовательность белка кодируется ДНК. Белки синтезируются с помощью ряда этапов, называемых транскрипцией (использование цепи ДНК для создания дополнительной цепи матричной РНК — мРНК) и трансляцией (последовательность мРНК используется в качестве матрицы для управления синтезом цепочки аминокислот, которые образуют белок). Часто происходят посттрансляционные модификации, такие как гликозилирование или фосфорилирование, которые необходимы для биологической функции белка.В то время как аминокислотная последовательность составляет первичную структуру белка, химические / биологические свойства белка очень сильно зависят от трехмерной или третичной структуры.
Часто происходят посттрансляционные модификации, такие как гликозилирование или фосфорилирование, которые необходимы для биологической функции белка.В то время как аминокислотная последовательность составляет первичную структуру белка, химические / биологические свойства белка очень сильно зависят от трехмерной или третичной структуры.
Вторичная структура
Участки или нити белков или пептидов имеют различные характерные локальные структурные конформации или вторичную структуру, зависящую от водородных связей. Двумя основными типами вторичной структуры являются α-спираль и β-лист.
α-спираль — это правая спиральная нить.Заместители боковых цепей аминокислотных групп в α-спирали простираются наружу. Водородные связи образуются между кислородом каждой связи C = O в цепи и водородом каждой группы N-H на четыре аминокислоты ниже нее в спирали. Водородные связи делают эту структуру особенно устойчивой. Заместители в боковых цепях аминокислот соответствуют группам N-H.
Водородная связь в ß-листе находится между нитями (между нитями), а не внутри нитей (внутри нитей).Конформация листа состоит из пар расположенных бок о бок прядей. Карбонильные атомы кислорода в одной цепи связываются с атомами водорода соседней цепи. Две нити могут быть параллельными или антипараллельными, в зависимости от того, совпадают ли направления нитей (от N-конца к C-концу) или противоположны. Антипараллельный ß-лист более стабилен из-за более хорошо выровненных водородных связей.
Третичная структура
Общая трехмерная форма белковой молекулы — это третичная структура.Молекула белка будет изгибаться и скручиваться таким образом, чтобы достичь максимальной стабильности или самого низкого энергетического состояния. Хотя трехмерная форма белка может казаться неправильной и случайной, она формируется многими стабилизирующими силами из-за связывающих взаимодействий между группами боковых цепей аминокислот.
В физиологических условиях гидрофобные боковые цепи нейтральных неполярных аминокислот, таких как фенилаланин или изолейцин, имеют тенденцию находиться внутри белковой молекулы, тем самым защищая их от водной среды. Алкильные группы аланина, валина, лейцина и изолейцина часто образуют гидрофобные взаимодействия друг с другом, в то время как ароматические группы, такие как группы фенилаланина и тирозина, часто складываются вместе. Боковые цепи кислотных или основных аминокислот обычно открываются на поверхности белка, поскольку они гидрофильны.
Алкильные группы аланина, валина, лейцина и изолейцина часто образуют гидрофобные взаимодействия друг с другом, в то время как ароматические группы, такие как группы фенилаланина и тирозина, часто складываются вместе. Боковые цепи кислотных или основных аминокислот обычно открываются на поверхности белка, поскольку они гидрофильны.
Образование дисульфидных мостиков путем окисления сульфгидрильных групп цистеина является важным аспектом стабилизации третичной структуры белка, позволяя ковалентно удерживать вместе различные части белковой цепи.Кроме того, водородные связи могут образовываться между различными группами боковых цепей. Как и в случае с дисульфидными мостиками , эти водородные связи могут объединять две части цепи, которые находятся на некотором расстоянии друг от друга с точки зрения последовательности. Солевые мостики, ионные взаимодействия между положительно и отрицательно заряженными участками боковых цепей аминокислот также помогают стабилизировать третичную структуру белка.
Четвертичная структура
Многие белки состоят из нескольких полипептидных цепей, часто называемых белковыми субъединицами.Эти субъединицы могут быть такими же, как в гомодимере, или разными, как в гетеродимере. Четвертичная структура относится к тому, как эти белковые субъединицы взаимодействуют друг с другом и организуются, образуя более крупный агрегированный белковый комплекс. Окончательная форма белкового комплекса снова стабилизируется различными взаимодействиями, включая водородные связи, дисульфидные мостики и солевые мостики. Четыре уровня структуры белка показаны на рисунке 2.
Стабильность белка
Из-за природы слабых взаимодействий, контролирующих трехмерную структуру, белки являются очень чувствительными молекулами.Термин «нативное состояние» используется для описания белка в его наиболее стабильной естественной конформации in situ . Это естественное состояние может быть нарушено несколькими внешними стрессовыми факторами, включая температуру, pH, удаление воды, присутствие гидрофобных поверхностей, присутствие ионов металлов и высокий сдвиг. Утрата вторичной, третичной или четвертичной структуры из-за воздействия стрессового фактора называется денатурацией. Денатурация приводит к разворачиванию белка в случайную или неправильно свернутую форму.
Денатурированный белок может иметь совершенно другой профиль активности, чем белок в его нативной форме, обычно теряя биологическую функцию. Помимо денатурирования, белки могут также образовывать агрегаты в определенных стрессовых условиях. Агрегаты часто образуются в процессе производства и, как правило, нежелательны, в основном из-за того, что они могут вызывать неблагоприятные иммунные реакции при введении.
В дополнение к этим физическим формам деградации белка также важно знать о возможных путях химической деградации белка.К ним относятся окисление, дезамидирование, гидролиз пептидных связей, перетасовка дисульфидных связей и сшивание. Методы, используемые при обработке и приготовлении белков, включая любую стадию лиофилизации, должны быть тщательно изучены, чтобы предотвратить разложение и повысить стабильность белкового биофармацевтического препарата как при хранении, так и во время доставки лекарственного средства.
Анализ структуры белка
Сложность структуры белка делает выяснение полной структуры белка чрезвычайно трудным даже с использованием самого современного аналитического оборудования.Анализатор аминокислот можно использовать для определения присутствующих аминокислот и молярных соотношений каждой из них. Затем последовательность белка может быть проанализирована посредством картирования пептидов и использования деградации Эдмана или масс-спектроскопии. Этот процесс является обычным для пептидов и небольших белков, но становится более сложным для больших мультимерных белков.
Пептидное картирование обычно влечет за собой обработку белка различными ферментами протеазы для расщепления последовательности на более мелкие пептиды в определенных сайтах расщепления.Два обычно используемых фермента — это трипсин и химотрипсин. Масс-спектроскопия стала бесценным инструментом для анализа белков, переваренных ферментами, с помощью методов снятия отпечатков пептидов и поиска в базе данных. Деградация по Эдману включает отщепление, разделение и идентификацию одной аминокислоты за раз из короткого пептида, начиная с N-конца.
Одним из методов, используемых для характеристики вторичной структуры белка, является спектроскопия кругового дихроизма (КД). Различные типы вторичной структуры, α-спираль, β-лист и случайная спираль, все имеют характерные спектры кругового дихроизма в дальней УФ-области спектра (190–250 нм).Эти спектры можно использовать для аппроксимации доли всего белка, состоящего из каждого типа структуры.
Более полный анализ трехмерной структуры белка с высоким разрешением проводится с помощью рентгеновской кристаллографии или анализа ядерного магнитного резонанса (ЯМР). Чтобы определить трехмерную структуру белка с помощью дифракции рентгеновских лучей, требуется большой хорошо упорядоченный монокристалл. Рентгеновская дифракция позволяет измерять короткие расстояния между атомами и дает трехмерную карту электронной плотности, которую можно использовать для построения модели структуры белка.
Использование ЯМР для определения трехмерной структуры белка имеет некоторые преимущества перед дифракцией рентгеновских лучей в том, что его можно проводить в растворе, и, таким образом, белок свободен от ограничений кристаллической решетки. Обычно используются методы двумерного ЯМР: NOESY, который измеряет расстояния между атомами в пространстве, и COESY, который измеряет расстояния через связи.
Анализ стабильности структуры белка
Для определения стабильности белка можно использовать множество различных методов.Для анализа разворачивания белка можно использовать спектроскопические методы, такие как флуоресценция, УФ, инфракрасное излучение и КД. Термодинамические методы, такие как дифференциальная сканирующая калориметрия (ДСК), могут быть полезны для определения влияния температуры на стабильность белка. Сравнительное пептидное картирование (обычно с использованием ЖХ / МС) — чрезвычайно ценный инструмент для определения химических изменений в белке, таких как окисление или дезамидирование. ВЭЖХ также является бесценным средством анализа чистоты белка. Другие аналитические методы, такие как SDS-PAGE, изоэлектрическое фокусирование и капиллярный электрофорез, также могут быть использованы для определения стабильности белка, и для определения эффективности белкового биофармацевтического препарата следует использовать подходящий биоанализ.Агрегатное состояние можно определить, следуя размеру «частиц», и теперь доступны инструменты, расположенные в массиве, чтобы следить за этим с течением времени в различных условиях.
Разнообразие методов определения стабильности белка еще раз подчеркивает сложность природы структуры белка и важность поддержания этой структуры для успешного биофармацевтического продукта.
Список литературы
- Структура, стабильность и сворачивание белка, Методы молекулярной биологии, 168, под редакцией Кеннета П.Мерфи
- Стабильность и сворачивание белков, Теория и практика, Методы молекулярной биологии, Vol. 40, под редакцией Брета Ширли
Набор проблем с большими молекуламиПроблема 3: третичная структура белка Третичная структура белка относится к: А. Последовательность аминокислот Учебник
Третичная структура белков
Биологический проект Кафедра биохимии и молекулярной биофизики Аризонский университет Доработка: октябрь 2004 г. Связаться с разработкой Команда http: // www.biology.arizona.edu | |
Структура белка | Безграничная химия
Структура белка
Каждый последующий уровень сворачивания белка в конечном итоге влияет на его форму и, следовательно, на его функцию.
Цели обучения
Обобщите четыре уровня структуры белка
Основные выводы
Ключевые моменты
- Структура белка зависит от его аминокислотной последовательности и локальных низкоэнергетических химических связей между атомами как в основной цепи полипептида, так и в боковых цепях аминокислот.
- Структура белка играет ключевую роль в его функции; если белок теряет свою форму на каком-либо структурном уровне, он может больше не функционировать.
- Первичная структура — это аминокислотная последовательность.
- Вторичная структура — это локальные взаимодействия между участками полипептидной цепи, включающая α-спираль и β-складчатые листовые структуры.
- Третичная структура — это общее трехмерное сворачивание, в значительной степени обусловленное взаимодействием между R-группами.
- Четвертичные структуры — это ориентация и расположение субъединиц в мульти-субъединичном белке.
Ключевые термины
- антипараллельный : природа противоположных ориентаций двух цепей ДНК или двух бета-цепей, составляющих вторичную структуру белка.
- дисульфидная связь : связь, состоящая из ковалентной связи между двумя атомами серы, образованная реакцией двух тиоловых групп, особенно между тиоловыми группами двух белков
- β-складчатый лист : вторичная структура белков, где группы N-H в основной цепи одной полностью вытянутой цепи устанавливают водородные связи с группами C = O в основной цепи соседней полностью вытянутой цепи
- α-спираль : вторичная структура белков, где каждый N-H основной цепи создает водородную связь с группой C = O аминокислоты на четыре остатка ранее в той же спирали.
Форма белка имеет решающее значение для его функции, поскольку она определяет, может ли белок взаимодействовать с другими молекулами. Белковые структуры очень сложны, и только совсем недавно исследователи смогли легко и быстро определить структуру полных белков вплоть до атомного уровня. (Используемые методы относятся к 1950-м годам, но до недавнего времени они были очень медленными и трудоемкими в использовании, поэтому полные белковые структуры решались очень медленно.) Ранние структурные биохимики концептуально разделили белковые структуры на четыре «уровня», чтобы упростить задачу. чтобы понять сложность общей структуры.Чтобы определить, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять эти четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Первичная структура
Первичная структура белка — это уникальная последовательность аминокислот в каждой полипептидной цепи, из которой состоит белок. На самом деле, это просто список аминокислот в полипептидной цепи, а не ее структура. Но поскольку окончательная структура белка в конечном итоге зависит от этой последовательности, это было названо первичной структурой полипептидной цепи.Например, гормон поджелудочной железы инсулин имеет две полипептидные цепи, A и B.
Первичная структура : Цепь А инсулина состоит из 21 аминокислоты, а цепь В — из 30 аминокислот, и каждая последовательность уникальна для белка инсулина.
Ген или последовательность ДНК в конечном итоге определяет уникальную последовательность аминокислот в каждой пептидной цепи. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры белка и, следовательно, функции.
Гемоглобин, транспортирующий кислород, состоит из четырех полипептидных цепей, двух идентичных α-цепей и двух идентичных β-цепей. При серповидно-клеточной анемии простая замена аминогруппы в β-цепи гемоглобина вызывает изменение структуры всего белка. Когда аминокислота глутаминовая кислота заменяется валином в β-цепи, полипептид складывается в несколько иную форму, что создает дисфункциональный белок гемоглобина. Итак, всего одна замена аминокислоты может вызвать кардинальные изменения.Эти дисфункциональные белки гемоглобина в условиях низкого содержания кислорода начинают связываться друг с другом, образуя длинные волокна, состоящие из миллионов агрегированных гемоглобинов, которые искажают эритроциты в форме полумесяца или «серпа», которые закупоривают артерии. Люди, страдающие этим заболеванием, часто испытывают одышку, головокружение, головные боли и боли в животе.
Серповидно-клеточная анемия : серповидные клетки имеют форму полумесяца, тогда как нормальные клетки имеют форму диска.
Вторичная структура
Вторичная структура белка — это любые регулярные структуры, возникающие в результате взаимодействий между соседними или соседними аминокислотами, когда полипептид начинает складываться в свою функциональную трехмерную форму.Вторичные структуры возникают, когда образуются Н-связи между локальными группами аминокислот в области полипептидной цепи. Редко единичная вторичная структура распространяется по всей полипептидной цепи. Обычно это просто часть цепочки. Наиболее распространенными формами вторичной структуры являются α-спиральные и β-складчатые листовые структуры, и они играют важную структурную роль в большинстве глобулярных и волокнистых белков.
Вторичная структура : α-спираль и β-складчатый лист образуются из-за водородной связи между карбонильной и аминогруппой в основной цепи пептида.Некоторые аминокислоты имеют склонность к образованию α-спирали, а другие — к образованию β-складчатого листа.
В цепи α-спирали водородная связь образуется между атомом кислорода в карбонильной группе основной цепи полипептида в одной аминокислоте и атомом водорода в аминогруппе основной цепи полипептида другой аминокислоты, которая находится на четыре аминокислоты дальше по цепи. Это удерживает отрезок аминокислот в правой спирали. Каждый виток в альфа-спирали имеет 3.6 аминокислотных остатков. Группы R (боковые цепи) полипептида выступают из цепи α-спирали и не участвуют в Н-связях, которые поддерживают структуру α-спирали.
В β-гофрированных листах участки аминокислот сохраняются в почти полностью вытянутой конформации, которая «складывается» или зигзагообразно из-за нелинейной природы одиночных ковалентных связей C-C и C-N. β-гофрированные листы никогда не встречаются в одиночку. Они должны удерживаться на месте другими β-гофрированными листами. Участки аминокислот в β-складчатых листах удерживаются в их складчатой структуре, потому что водородные связи образуются между атомом кислорода в карбонильной группе полипептидной основной цепи одного β-складчатого листа и атомом водорода в аминогруппе полипептидного каркаса другого β-складчатого листа. лист гофрированный.Скрепляющие друг друга β-гофрированные листы выровнены параллельно или антипараллельно друг другу. Группы R аминокислот в β-складчатом листе указывают перпендикулярно водородным связям, удерживающим β-складчатые листы вместе, и не участвуют в поддержании структуры β-складчатого листа.
Третичная структура
Третичная структура полипептидной цепи — это ее общая трехмерная форма после того, как все элементы вторичной структуры сложены вместе друг с другом.Взаимодействия между полярной, неполярной, кислотной и основной группой R в полипептидной цепи создают сложную трехмерную третичную структуру белка. Когда сворачивание белка происходит в водной среде организма, гидрофобные группы R неполярных аминокислот в основном лежат внутри белка, в то время как гидрофильные группы R лежат в основном снаружи. Боковые цепи цистеина образуют дисульфидные связи в присутствии кислорода, единственную ковалентную связь, образующуюся во время сворачивания белка.Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка. Когда белок теряет свою трехмерную форму, он больше не функционирует.
Третичная структура : Третичная структура белков определяется гидрофобными взаимодействиями, ионными связями, водородными связями и дисульфидными связями.
Четвертичная структура
Четвертичная структура белка — это то, как его субъединицы ориентированы и расположены относительно друг друга.В результате четвертичная структура применима только к многосубъединичным белкам; то есть белки, состоящие из более чем одной полипептидной цепи. Белки, полученные из одного полипептида, не будут иметь четвертичной структуры.
В белках с более чем одной субъединицей слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Ферменты часто играют ключевую роль в связывании субъединиц с образованием конечного функционирующего белка.
Например, инсулин представляет собой шарообразный глобулярный белок, который содержит как водородные связи, так и дисульфидные связи, которые удерживают вместе две его полипептидные цепи.Шелк — это волокнистый белок, который образуется в результате водородных связей между различными β-складчатыми цепями.
Четыре уровня структуры белка : На этих иллюстрациях можно увидеть четыре уровня структуры белка.
Денатурация и сворачивание белка
Денатурация — это процесс, при котором белки теряют свою форму и, следовательно, свою функцию из-за изменений pH или температуры.
Цели обучения
Обсудить процесс денатурации белка
Основные выводы
Ключевые моменты
- Белки меняют свою форму при воздействии различных значений pH или температуры.
- Организм строго регулирует pH и температуру, чтобы предотвратить денатурацию белков, таких как ферменты.
- Некоторые белки могут повторно укладываться после денатурации, а другие — нет.
- Белки-шапероны помогают некоторым белкам принимать правильную форму.
Ключевые термины
- шаперонин : белки, которые обеспечивают благоприятные условия для правильного сворачивания других белков, тем самым предотвращая агрегацию
- денатурация : изменение складчатой структуры белка (и, следовательно, физических свойств), вызванное нагреванием, изменением pH или воздействием определенных химических веществ
Каждый белок имеет свою собственную уникальную последовательность аминокислот, и взаимодействия между этими аминокислотами создают определенную форму.Эта форма определяет функцию белка, от переваривания белка в желудке до переноса кислорода в кровь.
Изменение формы белка
Если белок подвержен изменениям температуры, pH или воздействию химикатов, внутренние взаимодействия между аминокислотами белка могут измениться, что, в свою очередь, может изменить форму белка. Хотя аминокислотная последовательность (также известная как первичная структура белка) не изменяется, форма белка может измениться настолько, что станет дисфункциональной, и в этом случае белок считается денатурированным.Пепсин, фермент, расщепляющий белок в желудке, действует только при очень низком pH. При более высоких значениях pH конформация пепсина, способ сворачивания его полипептидной цепи в трех измерениях, начинает меняться. В желудке поддерживается очень низкий уровень pH, чтобы пепсин продолжал переваривать белок и не денатурировал его.
Ферменты
Поскольку почти все биохимические реакции требуют ферментов, и поскольку почти все ферменты оптимально работают только в относительно узких диапазонах температуры и pH, многие гомеостатические механизмы регулируют соответствующие температуры и pH, чтобы ферменты могли поддерживать форму своего активного центра.
Реверс денатурации
Часто можно обратить денатурацию, потому что первичная структура полипептида, ковалентные связи, удерживающие аминокислоты в их правильной последовательности, не повреждена. После удаления денатурирующего агента первоначальные взаимодействия между аминокислотами возвращают белок к его исходной конформации, и он может возобновить свою функцию.
Однако денатурация может быть необратимой в экстремальных ситуациях, например, при жарке яйца. Тепло от сковороды денатурирует белок альбумина в жидком яичном белке, и он становится нерастворимым.Белок в мясе также денатурирует и становится твердым при приготовлении.
Денатурация белка иногда необратима. : (Вверху) Белковый альбумин в сыром и вареном яичном белке. (Внизу) Аналогия со скрепкой визуализирует процесс: когда скрепки сшиты, скрепки («аминокислоты») больше не перемещаются свободно; их структура перестраивается и «денатурируется».
Белки-шапероны (или шаперонины) являются белками-помощниками, которые обеспечивают благоприятные условия для сворачивания белков.Шаперонины скапливаются вокруг формирующегося белка и предотвращают агрегацию других полипептидных цепей. Как только целевой белок сворачивается, шаперонины диссоциируют.
Сворачивание белков: хорошее, плохое и уродливое
Мы часто думаем о белках как о питательных веществах в пище, которые мы едим, или как об основном компоненте мышц, но белки также представляют собой микроскопические молекулы внутри клеток, которые выполняют разнообразные и жизненно важные функции. Завершив проект «Геном человека», ученые обращают свое внимание на «протеом» человека — каталог всех человеческих белков.Эта работа показала, что мир белков увлекателен, он полон молекул с такими замысловатыми формами и точными функциями, что они кажутся почти фантастическими.
Функция белка зависит от его формы, и, когда образование белка идет не так, получаемые в результате деформированные белки вызывают проблемы, которые варьируются от плохих, когда белки пренебрегают своей важной работой, до уродливых, когда они образуют липкую комковатую массу внутри клеток. Текущие исследования показывают, что мир белков далек от первозданного.Образование белка — это процесс, подверженный ошибкам, и ошибки на этом пути были связаны с рядом заболеваний человека.
Мир белков:
В типичной человеческой клетке содержится от 20 000 до более чем 100 000 уникальных типов белков. Почему так много? Белки — это рабочие лошадки клетки. Каждый мастерски выполняет определенную задачу. Некоторые из них являются структурными, например, придают жесткость и жесткость мышечным клеткам или длинным тонким нейронам. Другие связываются с определенными молекулами и доставляют их в новые места, а третьи катализируют реакции, которые позволяют клеткам делиться и расти.Такое разнообразие и специфичность функций стало возможным благодаря, казалось бы, простому свойству белков: они сворачиваются.
Белки складываются в функциональную форму
Белок начинается в клетке как длинная цепочка, состоящая в среднем из 300 строительных блоков, называемых аминокислотами. Существует 22 различных типа аминокислот, и их порядок определяет, как белковая цепь будет складываться сама по себе. При складывании первыми обычно образуются конструкции двух типов. Некоторые области белковой цепи сворачиваются в тонкие образования, называемые «альфа-спиралями», тогда как другие области складываются в зигзагообразные узоры, называемые «бета-листами», которые напоминают складки бумажного веера.Эти две структуры могут взаимодействовать, образуя более сложные структуры. Например, в одной структуре белка несколько бета-листов обвиваются вокруг себя, образуя полую трубку с несколькими альфа-спиралями, выступающими из одного конца. Трубка короткая и приземистая, так что общая структура напоминает змей (альфа-спирали), выходящих из банки (бета-листовая трубка). Несколько других белковых структур с описательными названиями включают «бета-ствол», «бета-пропеллер», «альфа / бета-подкову» и «складку желе-ролла».”
Эти сложные структуры позволяют белкам выполнять свою разнообразную работу в клетке. Белок «змеи в банке», будучи встроенным в клеточную мембрану, создает туннель, который позволяет входить и выходить из клеток. Другие белки образуют формы с карманами, называемыми «активными центрами», которые идеально подходят для связывания с определенной молекулой, например, с замком и ключом. Сворачиваясь в различные формы, белки могут выполнять очень разные роли, несмотря на то, что они состоят из одних и тех же основных строительных блоков. Чтобы провести аналогию, все автомобили сделаны из стали, но обтекаемая форма гоночного автомобиля побеждает в гонках, в то время как автобус, самосвал, кран или дзамбони имеют форму для выполнения своих уникальных задач.
Почему иногда происходит сбой сворачивания белка?
Сворачивание позволяет белку принимать функциональную форму, но это сложный процесс, который иногда терпит неудачу. Сворачивание белка может пойти не так по трем основным причинам:
1: Человек может обладать мутацией, которая изменяет аминокислоту в белковой цепи, что затрудняет поиск конкретным белком его предпочтительной складки или «нативного» состояния. Это касается наследственных мутаций, например, приводящих к муковисцидозу или серповидно-клеточной анемии.Эти мутации расположены в последовательности ДНК или «гене», кодирующем один конкретный белок. Следовательно, эти типы унаследованных мутаций влияют только на этот конкретный белок и связанные с ним функции.
2: С другой стороны, нарушение сворачивания белков можно рассматривать как продолжающийся и более общий процесс, который влияет на многие белки. Когда создаются белки, машина, считывающая указания ДНК для создания длинных цепочек аминокислот, может делать ошибки. По оценкам ученых, этот механизм, рибосома, допускает ошибки в 1 из каждых 7 белков! Эти ошибки могут снизить вероятность правильного сворачивания полученных белков.
3: Даже если аминокислотная цепь не имеет мутаций или ошибок, она все равно может не достичь своей предпочтительной складчатой формы просто потому, что белки не складываются правильно в 100% случаев. Сворачивание белка становится еще более трудным, если условия в клетке, такие как кислотность и температура, изменяются от тех, к которым привык организм.
Нарушение сворачивания белка вызывает несколько известных заболеваний, и ученые предполагают, что многие другие болезни могут быть связаны с проблемами сворачивания.Есть две совершенно разные проблемы, которые возникают в клетках, когда их белки не сворачиваются должным образом.
Один тип проблемы, называемый «потеря функции», возникает, когда недостаточное количество определенного белка сворачивается должным образом, вызывая нехватку «специализированных работников», необходимых для выполнения конкретной работы. Например, представьте, что правильно свернутый белок имеет идеальную форму, чтобы связывать токсин и расщеплять его на менее токсичные побочные продукты. Без достаточного количества правильно сложенного белка токсин будет накапливаться до разрушительного уровня.В качестве другого примера, белок может отвечать за метаболизм сахара, так что клетка может использовать его для получения энергии. Клетка будет расти медленно из-за недостатка энергии, если в ее функциональном состоянии будет недостаточно белка. Причина, по которой клетка заболевает, в этих случаях связана с нехваткой одного специфического, правильно сложенного функционального белка. Муковисцидоз, болезнь Тея-Сакса, синдром Марфана и некоторые формы рака являются примерами заболеваний, которые возникают, когда один тип белка не может выполнять свою работу.Кто знал, что один тип белка из десятков тысяч может быть настолько важен?
Белки, которые сворачиваются неправильно, также могут повлиять на здоровье клетки независимо от функции белка. Когда белки не могут свернуться в свое функциональное состояние, полученные неправильно свернутые белки могут принимать форму, неблагоприятную для переполненной клеточной среды. Большинство белков содержат липкие, «ненавидящие воду» аминокислоты, которые они закапывают глубоко внутри своего ядра. Неправильно свернутые белки носят эти внутренние части снаружи, как леденцы в шоколаде, раздавленные, чтобы обнажить липкую карамельную серединку.Эти неправильно свернутые белки часто слипаются, образуя сгустки, называемые «агрегатами». Ученые предполагают, что накопление неправильно свернутых белков играет роль в нескольких неврологических заболеваниях, включая болезнь Альцгеймера, Паркинсона, Хантингтона и болезнь Лу Герига (БАС), но ученые все еще работают над тем, чтобы выяснить, как именно эти неправильно свернутые липкие молекулы наносят ущерб клеткам. .
Один неправильно свернутый белок выделяется среди остальных и заслуживает особого внимания. «Прионный» белок при болезни Крейтцфельдта-Якоба, также известной как болезнь коровьего бешенства, является примером неправильно свернутого белка.Этот белок не только необратимо неправильно свернут, но и превращает другие функциональные белки в свое скрученное состояние.
Как наши клетки защищаются от неправильно свернутых белков?
Недавние исследования показывают, что неправильная укладка белков часто происходит внутри клеток. К счастью, клетки привыкли справляться с этой проблемой и имеют несколько систем для повторного укладки или разрушения аберрантных белковых образований.
Шапероны — одна из таких систем. Правильно названные, они сопровождают белки в процессе сворачивания, улучшая шансы белка на правильное сворачивание и даже позволяя некоторым неправильно свернутым белкам возможность повторно укладываться.Интересно, что шапероны сами по себе являются белками! Есть много разных типов шаперонов. Некоторые специально предназначены для того, чтобы помочь одному типу белка сворачиваться, в то время как другие действуют более широко. Некоторые шапероны имеют форму больших полых камер и обеспечивают белкам безопасное пространство, изолированное от других молекул, в котором они могут складываться. Производство нескольких шаперонов усиливается, когда клетка сталкивается с высокими температурами или другими условиями, затрудняющими сворачивание белка, таким образом, эти шапероны получили прозвище «белки теплового шока».”
Другая линия защиты клеток от неправильно свернутых белков называется протеасомой. Если неправильно свернутые белки задерживаются в клетке, они будут уничтожены этой машиной, которая пережевывает белки и выплевывает их в виде небольших фрагментов аминокислот. Протеасома похожа на центр переработки, позволяющий клетке повторно использовать аминокислоты для производства большего количества белков. Сама протеасома — это не один белок, а множество действующих вместе. Белки часто взаимодействуют с образованием более крупных структур с важными клеточными функциями.Например, хвост спермы человека представляет собой структуру, состоящую из многих типов белков, которые работают вместе, образуя сложный роторный двигатель, который продвигает сперму вперед.
Будущие исследования сворачивания и неправильного сворачивания белков:
Почему некоторые неправильно свернутые белки способны уклоняться от таких систем, как шапероны и протеасома? Как липкие неправильно свернутые белки могут вызывать перечисленные выше нейродегенеративные заболевания? Некоторые белки неправильно складываются чаще, чем другие? Эти вопросы находятся в авангарде текущих исследований, направленных на понимание основ биологии белков и болезней, которые возникают в результате неправильного сворачивания белка.
Обширный мир белков с большим разнообразием форм наделяет клетки способностями, которые позволяют жизни существовать и допускают ее разнообразие (например, различия между клетками глаза, кожи, легких или сердца, а также различия между видами) . Возможно, по этой причине слово «белок» происходит от греческого слова «протас», что означает «первостепенное значение».
— Подготовлено Керри Гейлер, аспирантом 4-го курса Гарвардского факультета органической и эволюционной биологии
14.4. Белки — Chemistry LibreTexts
Навыки для развития
- Опишите четыре уровня структуры белка.
- Определите типы привлекательных взаимодействий, которые удерживают белки в их наиболее стабильной трехмерной структуре.
- Объясните, что происходит, когда белки денатурируются.
- Определите, как белок может быть денатурирован.
Каждый из тысяч встречающихся в природе белков имеет свой собственный характерный аминокислотный состав и последовательность, что приводит к уникальной трехмерной форме.С 1950-х годов ученые определили аминокислотные последовательности и трехмерную конформацию множества белков и таким образом получили важные сведения о том, как каждый белок выполняет свою конкретную функцию в организме.
Белки представляют собой соединения с высокой молярной массой, состоящие в основном или полностью из цепочек аминокислот. Из-за их большой сложности белковые молекулы не могут быть классифицированы на основе определенного структурного сходства, поскольку углеводы и липиды классифицируются.Две основные структурные классификации белков основаны на гораздо более общих качествах: является ли белок (1) волокнообразным и нерастворимым или (2) глобулярным и растворимым. Некоторые белки, из которых состоят волосы, кожа, мышцы и соединительная ткань, похожи на волокна. Эти волокнистые белки нерастворимы в воде и обычно выполняют структурные, соединительные и защитные функции. Примерами волокнистых белков являются кератины, коллагены, миозины и эластины. Волосы и внешний слой кожи состоят из кератина.Соединительные ткани содержат коллаген. Миозины — это мышечные белки, способные сокращаться и расширяться. Эластины находятся в связках и эластичной ткани стенок артерий.
Глобулярные белки, другой основной класс, растворимы в водной среде. В этих белках цепи сложены так, что молекула в целом имеет примерно сферическую форму. Знакомые примеры включают яичный альбумин из яичных белков и сывороточный альбумин в крови. Сывороточный альбумин играет важную роль в транспортировке жирных кислот и поддержании надлежащего баланса осмотического давления в организме.Гемоглобин и миоглобин, которые важны для связывания кислорода, также являются глобулярными белками.
Уровни структуры белка
Структура белков обычно описывается как имеющая четыре организационных уровня. Первая из них — это первичная структура, которая представляет собой количество и последовательность аминокислот в полипептидной цепи или цепях белка, начиная со свободной аминогруппы и поддерживаемых пептидными связями, соединяющими каждую аминокислоту со следующей. Первичная структура инсулина, состоящая из 51 аминокислоты, показана на рисунке \ (\ PageIndex {1} \).
Рисунок \ (\ PageIndex {1} \): Первичная структура человеческого инсулина. Человеческий инсулин, аминокислотная последовательность которого показана здесь, является гормоном, который необходим для правильного метаболизма глюкозы.
Белковая молекула — это не случайный клубок полипептидных цепей. Вместо этого цепи расположены в уникальных, но специфических формах. Термин вторичная структура относится к фиксированному расположению основной цепи полипептида. На основе рентгеновских исследований Линус Полинг и Роберт Кори предположили, что определенные белки или их части скручиваются в спираль или спираль.Эта спираль стабилизирована внутрицепочечной водородной связью между карбонильным атомом кислорода одной аминокислоты и амидным атомом водорода на четыре аминокислоты вверх по цепи (расположенный на следующем витке спирали) и известна как правосторонняя α- спираль. Данные рентгеновского излучения показывают, что эта спираль делает один оборот на каждые 3,6 аминокислоты, а боковые цепи этих аминокислот выступают наружу из спиральной основной цепи (рис. \ (\ PageIndex {2} \)). Α-кератины, содержащиеся в волосах и шерсти, имеют исключительно α-спиральную форму.Некоторые белки, такие как гамма-глобулин, химотрипсин и цитохром с, имеют небольшую спиральную структуру или не имеют ее. Другие, такие как гемоглобин и миоглобин, имеют спиралевидную форму в одних областях, но не в других.
Рисунок \ (\ PageIndex {2} \) Шарообразная модель α-спирали. Эта шарообразная модель показывает внутрицепочечную водородную связь между карбонильными атомами кислорода и амидными атомами водорода. Каждый виток спирали охватывает 3,6 аминокислоты. Обратите внимание, что боковые цепи (представленные зелеными сферами) указывают на спираль.
Другой распространенный тип вторичной структуры, называемый конформацией β-складчатый лист , представляет собой пластинчатую структуру, в которой две или более протяженных полипептидных цепей (или отдельные области в одной цепи) выровнены бок о бок. Выровненные сегменты могут быть параллельны или антипараллельны, то есть N-концы могут быть обращены в одном направлении на соседних цепях или в разных направлениях — и связаны между собой водородной связью межцепочечной (Рисунок \ (\ PageIndex {3} \ )).Β-складчатый лист особенно важен для структурных белков, таких как фиброин шелка. Это также наблюдается в частях многих ферментов, таких как карбоксипептидаза А и лизоцим.
Рисунок \ (\ PageIndex {3} \): Шарообразная модель структуры β-гофрированного листа в белках. Боковые цепи проходят над или под листом и чередуются вдоль цепи. Белковые цепи удерживаются вместе за счет межцепочечных водородных связей.
Третичная структура относится к уникальной трехмерной форме белка в целом, которая возникает в результате складывания и изгиба основной цепи белка.Третичная структура тесно связана с правильным биохимическим функционированием белка. На рисунке \ (\ PageIndex {4} \) показано изображение трехмерной структуры инсулина.
Рисунок \ (\ PageIndex {4} \) : Ленточная модель трехмерной структуры инсулина. Спиральные области представляют участки полипептидной цепи, которые имеют α-спиральную структуру, а широкие стрелки представляют собой β-складчатые листовые структуры.
Четыре основных типа взаимодействий притяжения определяют форму и стабильность третичной структуры белков.Вы уже изучили несколько из них.
- Ионная связь. Ионные связи возникают в результате электростатического притяжения между положительно и отрицательно заряженными боковыми цепями аминокислот. Например, взаимное притяжение между ионом карбоксилата аспарагиновой кислоты и ионом лизин-аммония помогает поддерживать конкретную свернутую область белка (часть (а) рисунка \ (\ PageIndex {5} \)).
- Водородная связь. Водородная связь образуется между сильно электроотрицательным атомом кислорода или атомом азота и атомом водорода, присоединенным к другому атому кислорода или атому азота, например, таким, которые обнаруживаются в боковых цепях полярных аминокислот.Водородные связи (а также ионное притяжение) чрезвычайно важны как для внутри-, так и для межмолекулярных взаимодействий белков (часть (b) рисунка \ (\ PageIndex {5} \)). КОРРЕКТИРУЮЩЕЕ ПРИМЕЧАНИЕ: В верхней части рисунка пунктирная линия, представляющая взаимодействие, образующее водородные связи, должна идти от водорода воды к кислороду в -CH 2 O H (не к углероду).
- Дисульфидные связи. Две аминокислотные единицы цистеина могут сближаться, когда молекула белка складывается.Последующее окисление и связывание атомов серы в высокореакционных сульфгидрильных (SH) группах приводит к образованию цистина (часть (c) рисунка \ (\ PageIndex {5} \)). Внутрицепочечные дисульфидные связи обнаруживаются во многих белках, включая инсулин (желтые полосы на рисунке \ (\ PageIndex {1} \)), и оказывают сильное стабилизирующее действие на третичную структуру.
- Рассеивающие силы. Дисперсионные силы возникают, когда обычно неполярный атом становится на мгновение полярным из-за неравномерного распределения электронов, что приводит к мгновенному диполю, который вызывает сдвиг электронов в соседнем неполярном атоме.Силы дисперсии слабые, но могут быть важны, когда другие типы взаимодействий отсутствуют или минимальны (заштрихованные части, отмеченные (d) на рисунке \ (\ PageIndex {5} \)). Так обстоит дело с фиброином, основным белком шелка, в котором большая часть аминокислот в белке имеет неполярные боковые цепи. Термин гидрофобное взаимодействие часто неправильно используется как синоним дисперсионных сил. Гидрофобные взаимодействия возникают из-за того, что молекулы воды участвуют в водородных связях с другими молекулами воды (или группами в белках, способными образовывать водородные связи).Поскольку неполярные группы не могут участвовать в водородных связях, белок сворачивается таким образом, что эти группы погружаются во внутреннюю часть структуры белка, сводя к минимуму их контакт с водой.
Рисунок \ (\ PageIndex {5} \): Взаимодействия третичной структуры белка. Четыре взаимодействия стабилизируют третичную структуру белка: (а) ионная связь, (б) водородная связь, (в) дисульфидные связи и (г) дисперсионные силы.
Когда белок содержит более одной полипептидной цепи, каждая цепь называется субъединицей .Расположение нескольких субъединиц представляет четвертый уровень структуры, четвертичную структуру белка. Гемоглобин с четырьмя полипептидными цепями или субъединицами является наиболее часто цитируемым примером белка, имеющего четвертичную структуру (Рисунок \ (\ PageIndex {6} \)). Четвертичная структура белка продуцируется и стабилизируется теми же видами взаимодействий, которые производят и поддерживают третичную структуру. Схематическое изображение четырех уровней структуры белка показано на рисунке \ (\ PageIndex {7} \).
Рисунок \ (\ PageIndex {6} \) Четвертичная структура гемоглобина. Гемоглобин — это белок, который переносит кислород по всему телу.
Источник: Изображение из RCSB PDB (www.pdb.org) PDB ID 1I3D (RD Kidd, HM Baker, AJ Mathews, T. Brittain, EN Baker (2001) Олигомеризация и связывание лиганда в гомотетрамерном гемоглобине: два высоких разрешение кристаллических структур гемоглобина Барта (гамма (4)), маркера альфа-талассемии.Protein Sci. 1739–1749).
Рисунок \ (\ PageIndex {7} \): Уровни структуры в белках
Первичная структура состоит из определенной аминокислотной последовательности. Полученная пептидная цепь может скручиваться в α-спираль, которая является одним из типов вторичной структуры . Этот спиральный сегмент включен в третичную структуру свернутой полипептидной цепи. Единая полипептидная цепь представляет собой субъединицу, которая составляет четвертичную структуру белка, такого как гемоглобин, который имеет четыре полипептидных цепи.
Денатурация белков
Высокоорганизованные структуры белков — настоящие шедевры химической архитектуры. Но высокоорганизованные структуры, как правило, обладают определенной деликатностью, и это верно в отношении белков. Денатурация — это термин, используемый для любого изменения трехмерной структуры белка, которое делает его неспособным выполнять возложенную на него функцию. Денатурированный белок не может выполнять свою работу. (Иногда денатурация приравнивается к осаждению или коагуляции белка; наше определение немного шире.) Широкий спектр реагентов и условий, таких как тепло, органические соединения, изменения pH и ионы тяжелых металлов, могут вызвать денатурацию белка (Рисунок \ (\ PageIndex {1} \)).
| Метод | Влияние на структуру белка |
|---|---|
| Нагрев выше 50 ° C или ультрафиолетовое (УФ) излучение | Тепло или УФ-излучение снабжает молекулы белка кинетической энергией, заставляя их атомы вибрировать быстрее и разрушая относительно слабые водородные связи и силы дисперсии. |
| Использование органических соединений, таких как этиловый спирт | Эти соединения способны участвовать в межмолекулярных водородных связях с молекулами белка, нарушая внутримолекулярные водородные связи внутри белка. |
| Соли ионов тяжелых металлов, таких как ртуть, серебро и свинец | Эти ионы образуют прочные связи с карбоксилат-анионами кислых аминокислот или SH-группами цистеина, разрывая ионные связи и дисульфидные связи. |
| Алкалоидные реагенты, такие как дубильная кислота (используется при дублении кожи) | Эти реагенты сочетаются с положительно заряженными аминогруппами в белках, разрушая ионные связи. |
У любого, кто жарил яйцо, наблюдается денатурация. Прозрачный яичный белок становится непрозрачным, поскольку альбумин денатурирует и коагулирует. Никто еще не обратил вспять этот процесс. Однако при соответствующих обстоятельствах и достаточном времени белок, который развернулся в достаточно мягких условиях, может повторно свернуться и снова проявить биологическую активность (Рисунок \ (\ PageIndex {8} \)).Такие данные свидетельствуют о том, что, по крайней мере, для этих белков первичная структура определяет вторичную и третичную структуру. Кажется, что данная последовательность аминокислот естественным образом принимает свое трехмерное расположение при подходящих условиях.
Рисунок \ (\ PageIndex {8} \) : Денатурация и ренатурация белка. Изображены денатурация (разворачивание) и ренатурация (рефолдинг) белка. Красные прямоугольники представляют собой стабилизирующие взаимодействия, такие как дисульфидные связи, водородные связи и / или ионные связи.
Первичные структуры белков довольно прочны. В общем, для гидролиза пептидных связей необходимы довольно жесткие условия. Однако на вторичном и четвертичном уровнях белки весьма уязвимы для атак, хотя их уязвимость к денатурации различается. Изящно свернутые глобулярные белки денатурировать намного легче, чем жесткие волокнистые белки волос и кожи.
Сводка
Белки можно разделить на две категории: волокнистые, которые обычно нерастворимы в воде, и глобулярные, которые лучше растворяются в воде.Белок может иметь до четырех уровней структуры. Первичная структура состоит из определенной аминокислотной последовательности. Полученная пептидная цепь может образовывать α-спираль или β-складчатый лист (или локальные структуры, которые не так легко классифицировать), что известно как вторичная структура. Эти сегменты вторичной структуры включены в третичную структуру свернутой полипептидной цепи. Четвертичная структура описывает расположение субъединиц в белке, который содержит более одной субъединицы.Четыре основных типа взаимодействий притяжения определяют форму и стабильность свернутого белка: ионная связь, водородная связь, дисульфидные связи и дисперсионные силы. Широкий спектр реагентов и условий может вызвать разворачивание или денатурирование белка.
Упражнения по обзору концепции
Какая преобладающая сила притяжения стабилизирует образование вторичной структуры в белках?
Различают третичный и четвертичный уровни белковой структуры.
Кратко опишите четыре способа денатурирования белка.
ответы
Третичная структура относится к уникальной трехмерной форме одной полипептидной цепи, в то время как четвертичная структура описывает взаимодействие между несколькими полипептидными цепями для белков, которые имеют более одной полипептидной цепи.
(1) нагревать белок выше 50 ° C или подвергать его воздействию УФ-излучения; (2) добавить к раствору белка органические растворители, такие как этиловый спирт; (3) добавить соли ионов тяжелых металлов, таких как ртуть, серебро или свинец; и (4) добавить алкалоидные реагенты, такие как дубильная кислота
Упражнения
Классифицируйте каждый белок как волокнистый или глобулярный.
- гемоглобин
- кератин
- фиброин
Белок имеет третичную структуру, образованную взаимодействиями между боковыми цепями следующих пар аминокислот. Для каждой пары определите наиболее сильный тип взаимодействия между этими аминокислотами.
- аспарагиновая кислота и лизин
- фенилаланин и аланин
- серин и лизин
- два цистеина
Какой уровень (уровни) структуры белка обычно нарушается при денатурации? Какого уровня (уровней) нет?
4.Какой класс белков денатурируется легче — волокнистый или глобулярный?
5. Известно, что определенный глобулярный белок функционирует в водной среде цитозоля клеток. (а) Вероятна ли боковая цепь лейцина внутри или снаружи свернутого белка? (б) Если один лейцин заменен треонином, белок будет менее эффективным, но все же функциональным. Какая аминокислота может заменить лейцин, которая может иметь незначительный эффект или не иметь никакого эффекта? Какая аминокислота может заменить лейцин, что, вероятно, будет иметь больший эффект, чем замена треонином?
ответов
- шаровидный
- волокнистый
- волокнистый
- ионная связь
- Дисперсионные силы
- Дисперсионные силы
- дисульфидная связь
3.Денатурация белка нарушает вторичный, третичный и четвертичный уровни структуры. Только первичная структура не подвержена денатурации.
4. Шаровидный
5. (a) Лейцин неполярен, поэтому он, вероятно, находится внутри глобулярного белка (а не за пределами очень полярных вод). (b) Замена другой неполярной аминокислотой, особенно такой же (например, изолейцин), вероятно, будет иметь наименьшее влияние. Если замена полярным треонином имеет отрицательный эффект, замена одной из заряженных аминокислот (asp, glu, his, lys, arg) может иметь большее влияние.
19.1: Полипептиды и белки — Biology LibreTexts
Цели обучения
- Определите или опишите следующее:
- аминокислота
- Группа «Р»
- пептидная связь
- пептид
- полипептид
- первичная структура белка
- Вторичная структура белка
- структура третичного белка
- Четвертичная структура белка
- ген
- Опишите, как первичная структура белка или полипептида в конечном итоге определяет его окончательную трехмерную форму.
- Опишите, как порядок нуклеотидных оснований в ДНК в конечном итоге определяет окончательную трехмерную форму белка или полипептида.
Аминокислоты — строительные блоки для белков. Все аминокислоты содержат аминогруппу или группу NH 2 и карбоксильную (кислотную) группу или группу COOH. В белках обычно содержится 20 различных аминокислот, а на молекулу белка часто приходится 300 и более аминокислот. Каждая аминокислота отличается своей группой «R». Группа «R» аминокислоты представляет собой остаток – молекулы, то есть часть, отличную от аминогруппы, кислотной группы и центрального атома углерода.Каждая аминокислота имеет уникальную группу «R», и уникальные химические свойства аминокислоты зависят от свойств ее группы «R» (рисунок \ (\ PageIndex {1} \)).
Рисунок \ (\ PageIndex {1} \) : аминокислоты. Состав аминокислоты.Для образования полипептидов и белков аминокислоты соединяются пептидными связями, в которых амино или NH 2 одной аминокислоты связываются с карбоксильной (кислотной) или COOH-группой другой аминокислоты, как показано на (Рисунок \ ( \ PageIndex {2} \) и рисунок \ (\ PageIndex {3} \)).
Рисунок \ (\ PageIndex {2} \) : Пептидные связи. Пептидная связь образуется, когда аминогруппа одной аминокислоты связывается с карбоксильной группой другой аминокислоты.Пептид — это две или более аминокислоты, соединенные вместе пептидными связями, а полипептид — это цепь из многих аминокислот. Белок содержит один или несколько полипептидов. Следовательно, белки представляют собой длинные цепочки аминокислот, удерживаемые вместе пептидными связями.
Рисунок \ (\ PageIndex {3} \) : Образование пептидной связи.Пептидная связь образуется, когда аминогруппа одной аминокислоты связывается с карбоксильной группой другой аминокислоты.Фактический порядок аминокислот в белке называется его первичной структурой (рисунок \ (\ PageIndex {4} \)) и определяется ДНК. Как будет показано далее в этом разделе, ДНК разделена на функциональные единицы, называемые генами. Ген — это последовательность дезоксирибонуклеотидных оснований вдоль одной цепи ДНК, которая кодирует функциональный продукт — определенную молекулу информационной РНК, транспортной РНК или рибосомной РНК.Продукт обычно представляет собой информационную РНК (мРНК), и мРНК в конечном итоге приводит к синтезу полипептида или белка. Поэтому обычно говорят, что порядок дезоксирибонуклеотидных оснований в гене определяет аминокислотную последовательность конкретного белка. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка.
Рисунок \ (\ PageIndex {4} \) : Первичная структура белка или полипептида.Первичная структура белка или полипептида — это фактическая последовательность его аминокислот. Первичная структура определяется порядком дезоксирибонуклеотидных оснований в генах.Вторичная структура белка обусловлена водородными связями, которые образуются между атомом кислорода одной аминокислоты и атомом азота другой. Это придает белку или полипептиду двумерную форму альфа-спирали или бета-складчатого листа (рис. \ (\ PageIndex {5} \)).
Рисунок \ (\ PageIndex {5} \) : Вторичная структура белка или полипептида.(слева) Вторичная структура белка или полипептида обусловлена водородными связями, образующимися между атомом кислорода одной аминокислоты и атомом азота другой. Есть два возможных типа вторичной структуры: альфа-спираль и бета-лист. В случае альфа-спирали водородная связь заставляет полипептид скручиваться в спираль. С бета-листом водородная связь позволяет полипептиду складываться вперед и назад, как гофрированный лист. (справа) Вторичная структура белка или полипептида обусловлена водородными связями, образующимися между атомом кислорода одной аминокислоты и атомом азота другой.Есть два возможных типа вторичной структуры: альфа-спираль и бета-лист. В случае альфа-спирали водородная связь заставляет полипептид скручиваться в спираль. С бета-листом водородная связь позволяет полипептиду складываться вперед и назад, как гофрированный лист.В глобулярных белках, таких как ферменты, длинная цепь аминокислот складывается в трехмерную функциональную форму или третичную структуру. Это связано с тем, что некоторые аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи.Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру (рисунок \ (\ PageIndex {6} \)). В некоторых белках, таких как молекулы антител и гемоглобин, несколько полипептидов могут связываться вместе, образуя четвертичную структуру (рисунок \ (\ PageIndex {7} \)).
Рисунок \ (\ PageIndex {6} \) : Третичная структура белка или полипептида. В глобулярных белках, таких как ферменты, длинная цепь аминокислот складывается в трехмерную функциональную форму или третичную структуру.Это связано с тем, что некоторые аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи. Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру.Как будет показано далее в этом разделе, во время синтеза белка порядок нуклеотидных оснований в гене транскрибируется в комплементарную цепь мРНК, которая затем транслируется тРНК в правильный порядок аминокислот для этого полипептида или белка.Следовательно, порядок дезоксирибонуклеотидных оснований в ДНК определяет порядок аминокислот в белках. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами, порядок аминокислот для каждого белка определяет его окончательную трехмерную форму, которая, в свою очередь, определяет функцию этого белка (например, с каким субстратом будет реагировать фермент, с какими эпитопами Fab антитела будет сочетаться с рецепторами, с которыми свяжется цитокин).
Рисунок \ (\ PageIndex {7} \) : Четвертичная структура белка.Четвертичная структура белка обусловлена соединением нескольких полипептидов, как в случае молекул антител. Схематическая диаграмма базовой единицы иммуноглобулина (антитела) Fab Fc тяжелой цепи (состоит из VH, Ch2, шарнира, областей Ch3 и Ch4: от N-члена) легкой цепи (состоит из областей VL и CL: от N-члена) антигена шарнирные области сайта связывания (*) -SS- означают дисульфидные связи. (CC-SA-BY 3.0; Ы_тамбе).Сводка
- Аминокислоты — это строительные блоки для белков.В белках обычно содержится 20 различных аминокислот, а на молекулу белка часто приходится 300 и более аминокислот.
- Все аминокислоты содержат аминогруппу или группу NH 2 и карбоксильную (кислотную) группу или группу COOH.
- Для образования полипептидов и белков аминокислоты соединяются пептидными связями, в которых амино или NH 2 одной аминокислоты связываются с карбоксильной (кислотной) или COOH-группой другой аминокислоты.
- Пептид — это две или более аминокислоты, соединенные пептидными связями; полипептид — это цепь из множества аминокислот; и белок содержит один или несколько полипептидов.Следовательно, белки представляют собой длинные цепочки аминокислот, удерживаемые вместе пептидными связями.
- Фактический порядок аминокислот в белке называется его первичной структурой и определяется ДНК.
- Порядок дезоксирибонуклеотидных оснований в гене определяет аминокислотную последовательность конкретного белка. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка.
- Вторичная структура белка обусловлена водородными связями, которые образуются между атомом кислорода одной аминокислоты и атомом азота другой и придают белку или полипептиду двумерную форму альфа-спирали или бета-складчатого листа. .
- В глобулярных белках, таких как ферменты, длинная цепь аминокислот складывается в трехмерную функциональную форму или третичную структуру. Это связано с тем, что некоторые аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи.Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру.
- В некоторых белках, таких как молекулы антител, несколько полипептидов могут связываться вместе с образованием четвертичной структуры.
Авторы и авторство
Связь между наличием цистеина в белках и сложностью организмов | Молекулярная биология и эволюция
Аннотация
Встречаемость и относительное положение остатков цистеина были исследованы в белках различных видов.Учитывая случайное математическое появление аминокислоты, кодируемой двумя кодонами (3,28%), цистеин недостаточно представлен во всех исследованных организмах. Представленность цистеина, по-видимому, положительно коррелирует со сложностью организма, варьируя от 2,26% у млекопитающих до 0,5% у некоторых представителей отряда Archeabacteria . Это наблюдение вместе с результатами, полученными при сравнении содержания цистеина в различных рибосомных белках, указывает на то, что эволюция использует преимущества увеличения использования остатков цистеина.Во всех изученных организмах, кроме растений, два цистеина часто обнаруживаются на расстоянии двух аминокислотных остатков (мотив C- (X) 2 -C). Известно, что такой мотив присутствует во множестве металлсвязывающих белков и оксидоредуктаз. Примечательно, что более 21% всех цистеинов было обнаружено в мотивах C- (X) 2 -C в Archea. Это наблюдение может указывать на то, что цистеин сначала появился в древних металлсвязывающих белках, а позже был введен в другие белки.
Введение
Цистеин уникален среди кодируемых аминокислот, потому что он содержит реактивную сульфгидрильную группу.Следовательно, два остатка цистеина могут образовывать цистин (дисульфидную связь) между различными частями одного и того же белка или между двумя отдельными полипептидными цепями. Образование дисульфидной связи связано со сворачиванием белка и поддерживается ферментами тиолдисульфид оксидоредуктаза и протеиндисульфидизомераза (Loferer and Hennecke 1994; Noiva 1994; Raina and Missiakas 1997). Известно, что цитозольные белки содержат относительно мало дисульфидных связей, а системы глутаредоксина и тиоредоксина участвуют в поддержании групп -SH в восстановленной форме (Derman et al.1993; Стюарт, Ослунд и Беквит, 1998 г .; Чжун и др. 1998).
Простые структурные ограничения также могут мешать взаимодействию цистеинов. Из-за жесткой планарной природы пептидной связи два соседних цистеина не могут взаимодействовать. То же самое верно, если два цистеина разделены только одной аминокислотой. Основываясь на физических размерах и выравнивании аминокислотных остатков в конфигурациях альфа-спирали и бета-витков, два цистеина наиболее близки друг к другу, когда они разнесены двумя другими аминокислотами (мотив C- (X) 2 -C; X может стоять для любой кодированной аминокислоты).В самом деле, известно, что мотивы C- (X) 2 -C являются хорошо консервативными частями различных железо-серных белков и оксидоредуктаз (Shuber et al. 1986; Ammendola et al. 1992). Однако мы признали, что появление доменов C- (X) 2 -C не ограничивается этими группами белков. Кроме того, количество доменов C- (X) 2 -C оказалось удивительно высоким в большой случайно выбранной популяции известных белков Saccharomyces cerevisae .
Эти наблюдения побудили нас проанализировать, возникли ли цистеины случайным образом или организованы преимущественно в мотивы C- (X) 2 -C в известных белках различных видов.Перед проведением такого анализа необходимо было проанализировать наличие цистеинов и других кодируемых аминокислот в белках различных видов. Цистеин кодируется триплетами кодонов UGU и UGC соответственно. Все известные организмы содержат цистеины в своих белках.
Поскольку все известные живые организмы содержат одни и те же 20 кодированных аминокислот, нет прямого способа узнать, была ли та или иная аминокислота введена раньше или позже в процессе эволюции. С другой стороны, жизнь на Земле могла возникнуть с примитивных организмов, содержащих известные 20 кодированных аминокислот.Доказательства, подтверждающие постепенное расширение генетического кода, в первую очередь основаны на аномальном распределении кодонов у различных видов (Osawa et al. 1992; Bauman and Oro 1993).
Кроме того, Doring и Marliere (1998) показали, что мутантные тРНК, которые включают цистеин в положениях, соответствующих кодонам изолейцина или метионина, могут сохраняться в Escherichia coli. Токсичность неправильного кодирования цистеина была низкой, что доказывает, что цистеин является приемлемой заменой в большинстве положений белка.Таким образом, включение цистеина может преодолеть стерические и полярные ограничения, которые ограничивают эволюцию генетического кода.
Таким образом, возможно, что цистеин был введен на относительно поздней стадии эволюции через захват некоторых кодонов другой аминокислоты (серин, глицин). Если синтез боковой цепи аминокислоты прогрессирует с помощью того же или аналогичного пути (путей) биосинтеза, полученные аминокислоты физико-химически подобны (например, Ile, Val, Leu, Phe, Tyr, Asp, Glu) (Miseta 1989) .Важно отметить, что физико-химически родственные аминокислоты занимают аналогичные кодоны (Jungck 1978; Weber and Lacey 1978). Следовательно, генетический код разработан таким образом, чтобы свести к минимуму вероятность того, что изменение одного нуклеотидного основания приведет к замене на физико-химически другую аминокислоту.
Результатом нецелевого введения цистеина должно было быть то, что многие цистеины оказались не в «оптимальных местах». Последующая эволюция должна была исправить эти «ошибки», оставив цистеины в положениях, где их физико-химические свойства могли быть использованы на благо организма.Одновременно мутации, приводящие к триплетам, кодирующим цистеин, способствовали развитию новых, более сложных белков.
На основании этой гипотезы можно было ожидать найти простые организмы с относительно небольшим количеством цистеинов и сложные организмы со значительно большим количеством цистеинов. Точно так же можно ожидать обнаружения цистеинов в ограниченном количестве белковых доменов у простых организмов.
В настоящем отчете мы пытаемся выделить взаимосвязь между сложностью различных организмов и наличием цистеина в их белках.
Материалы и методы
Последовательности белков, файлы данных последовательностей и анализ аминокислотного состава
Анализ последовательностей проводился на файлах данных последовательностей, созданных из последовательностей, хранящихся в базе данных SwissProt (CDPROT31). Файлы данных последовательности были созданы с помощью правила выбора. В правиле отбора указывается научное название вида. Если указано, также было указано субклеточное расположение белков.Затем были отредактированы файлы сохраненных данных, содержащие каталоги последовательностей белков. Это редактирование ограничивалось удалением нескольких поврежденных файлов последовательностей, для которых последующие программы анализа данных не могли работать.
Были созданы следующие файлы данных: Homo sapiens (человек), 2681 последовательность белка; Mus musculus (мышь), 1727; Bos taurus (крупный рогатый скот), 719; Drosophila melanogaster (плодовая муха), 624; Caernorhabditis elegans, 690; Zea mays (кукуруза), 287; Orysa sativa (рис), 219; Lycopersicon esculentum (томат), 117; Saccharomyces cerevisiae (пекарские дрожжи), 3 127; E.coli, 3 151; Rhodobacter sphaeroides, 58; Pseudomonas aeruginosa, 214; Haloarcula marismortui ( ранее Halobacterium marismortui ), 62; и Thermus aquaticus, 88. В некоторых случаях для анализа использовались белки родственных видов. Файлы данных для различных Cyanobacteria содержали 556 последовательностей, файлы для Archea содержали 553 последовательности, а файлы для Sulpho-archea содержали 137 последовательностей.Файлы данных для рибосомных белков включали 66 последовательностей для людей, 134 последовательности для дрожжей, 59 последовательностей для E. coli, и 51 последовательность для H. marismortui.
Поскольку данные были сгенерированы и предназначались для сравнения файлов данных, содержащих разное количество последовательностей белков, было важно рассчитать стандартные отклонения любых результатов для файлов данных меньшего и большего размера. Таким образом, мы сгенерировали пять файлов данных, каждый из которых содержит 50 последовательностей S. cerevisiae , с помощью случайного генератора.Встречаемость 20 кодированных аминокислот была проанализирована в пяти файлах данных, и были рассчитаны средние значения и стандартные отклонения. Мы обнаружили, что в этом случае среднее значение SD для 20 аминокислот составляло 5,57%. Например, мы обнаружили 291,2 ± 36,8 остатков цистеина (среднее значение ± стандартное отклонение). Когда каждая из пяти баз данных S. cerevisiae содержала 100 или 200 случайно выбранных белковых последовательностей вместо 50, средние значения SD снизились до 3,50% и 2,21% соответственно.
Несомненно, файлы данных меньшего размера не отражают средний белковый состав вида, а также более крупные.Мы также отмечаем, что эти файлы данных были созданы не генератором случайных чисел, а скорее специфическими интересами исследователей. По этой причине мы хотели быть максимально осторожными при интерпретации данных в небольших файлах данных. Файл данных, содержащий менее 50 последовательностей, не использовался. Кроме того, создание комбинированных файлов данных по родственным видам с большим количеством последовательностей было направлено на уменьшение стандартной ошибки.
Был проанализирован аминокислотный состав белков в файле данных, при этом общее количество 20 кодированных аминокислот составило 100%.Содержание цистеина (и любой другой аминокислоты) выражали как процент от общего количества аминокислот.
Корректировка данных аминокислотного состава для содержания ГХ по сравнению с содержанием AT кодирующей ДНК
Известно, что содержание GC по сравнению с содержанием AT кодирующих последовательностей варьируется в широком диапазоне у разных видов. Цистеин может кодироваться UGU или UGC. Следовательно, только содержание GC в положении первого и второго кодона влияет на появление цистеина.Общее содержание кодирующих GC и усредненное содержание GC первой и второй буквы кодона (значения выделены курсивом) видов, перечисленных в отчете, следующие: люди — 52,75%, 49,24% ; крупный рогатый скот — 52,86%, 48,37% ; мыши — 52,76%, 49,25% ; D. melanogaster — 54,53%, 48,95% ; C. elegans —42,37%, 43,94% ; кукуруза — 55,69%, 50,67% ; рис — 56,16%, 51,03% ; томаты — 42,74%, 45,26% ; С.cerevisae — 39,72%, 40,60% ; Цианобактерии — 32,36%, 41,8% ; E. coli — 51,37%, 49,60% ; R. sphaeroides — 67,86%, 57,69% ; P. aureginosa —64,06%, 55,09% ; H. marismortui — 63,69%, 55,00% ; T. aquaticus — 66,57%, 55,45 %; Сульфоархея —43,12%, 45,71%.
Ожидается, что увеличение содержания GC в положении первого кодона окажет отрицательное влияние на содержание цистеина в данном виде, поскольку первая буква кодона — U.Увеличение содержания GC второй буквы кодона должно иметь положительный эффект на содержание цистеина, потому что вторая буква кодона — G. Кроме того, (A + U) + (G + C) = 1 (где 1 — общее количество нуклеотидов. содержание вида). Поскольку (G + C) = 1 — (A + U), связь между вероятностью кодирования цистеина (Pcys) и содержанием (G + C) кодирующей ДНК может быть описана как Pcys = (G + C) * (1 — (G + C)). Поскольку кривая вероятности довольно плоская в диапазоне содержания GC от 40% до 60%, скорректированные значения никогда не отличаются от исходных данных более чем на 3.5%. В тексте и / или в подписях к рисункам указывается, были ли данные скорректированы с учетом фактического содержания GC для видов.
Анализ аминокислотного расстояния и гомологии белков
Вышеупомянутые файлы данных использовались для анализа встречаемости различных аминокислотных последовательностей. Анализировали наличие последовательности C- (X) n -C. C — однобуквенная метка для цистеина, X — любая другая аминокислота, а n — количество повторов, 0–22 в наших исследованиях.Поскольку тестовая последовательность C- (X) n -C может быть наложена на любую последовательность заданной длины еще один раз, чем тестовая последовательность C- (X) n +1 -C, соответствующая коррекция может осуществляться. Однако мы обнаружили, что полученная поправка не повлияла существенно на наши результаты, и по этой причине она была опущена.
Для последовательности C- (X) 2 -C мы также проанализировали наличие всех индивидуальных последовательностей в файлах данных людей, плодовых мух, E.coli, и Archea. Выравнивание аминокислотных последовательностей проводили в соответствии с методом, разработанным Myers and Miller (1988). Мы использовали структурную генетическую матрицу, основанную на работе Фенга, Джонсона и Дулиттла (1984) с ценой открытого пробела 10 и стоимостью единицы пробела 5.
Результаты
Встречаемость цистеина в белках различных видов
Сначала мы исследовали наличие цистеина в известных белках различных видов.Для этого были подсчитаны встречаемости 20 кодированных аминокислот в репрезентативных образцах (файлах данных) людей, крупного рогатого скота, мышей, плодовых мух, C. elegans, кукурузы, риса, томатов, дрожжей, Cyanobacteria, E. coli, R. sphaeroides, P. aeruginosa, H. marismortui, T. aquaticus, и Sulpho-archea. Сумма всех 20 кодированных аминокислот считалась 100%.
Цистеин — относительно редкая аминокислота в белках исследованных организмов (рис.1). Анализы белков человека, крупного рогатого скота и мыши выявили почти идентичные (2,26%) встречаемости цистеина. Белки плодовой мухи C. elegans содержали несколько меньше цистеина (1,90% и 1,97% соответственно). Белки кукурузы, риса и томатов содержат 1,62–1,69% цистеина. Среди исследованных эукариот дрожжи содержали меньше всего цистеина (1,21%).
Среди исследованных прокариот Cyanobacteria, E. coli, P. aeruginosa, и R. sphaeroides, содержали 1.3–1,13% цистеина, что несколько меньше, чем у S. cerevisiae.
Были изучены также представители недавно созданного ордена Archea (Woese, Gupta, 1981; Woese, Kandler, and Wheelis, 1990). Мы обнаружили, что содержание цистеина у крайнего галофила H. marismortui и термофила T. aquaticus было самым низким среди исследованных видов (0,49% и 0,41% соответственно). Точно так же низкое представительство цистеина очевидно у Halobacterium salinarium (данные не показаны) и членов группы Sulpho-archea .Все данные были скорректированы с учетом фактического содержания ГХ видов (использованного в качестве фоновой вероятности), как описано в «Материалы и методы».
Отметим, что фактический и скорректированный по ГХ уровни цистеина были почти идентичны для большинства видов. (Наибольшая разница между этими значениями была у S. cerevisiae, , для которых фактическое содержание цистеина составляло 1,25%, тогда как скорректированный GC был 1,21%.)
В то время как белки порядка Archea могут содержать от четырех до В пять раз меньше цистеина, чем в белках млекопитающих, кажется, что цистеин недостаточно представлен во всех исследованных организмах.Учитывая, что у этих организмов 61 смысловой кодон и два кодона отнесены к цистеину, (100/61) × 2 = 3,28%. Диапазон вероятности с поправкой на GC составляет 3,23–3,28% для изученных видов.
Мы также подсчитали количество белков с хотя бы одним остатком цистеина и без него у некоторых видов. На рисунке 2 показано, что около 92% белков человека содержат один или несколько остатков цистеина. Аналогичные числа были получены для белков плодовой мухи и дрожжей. Незначительное увеличение количества белков, не содержащих цистеин, очевидно для E.coli, , но более 50% известных белков H. marismortui не содержат ни одного остатка цистеина. Аналогичные проценты могут быть получены для других родственных видов, перечисленных на рисунке 1.
Отметим, что средние длины белков не равны в разных файлах данных (видах) (подробности см. В Материалы и методы ).
Наличие цистеина в рибосомных белках различных видов
Известно, что одна или несколько дисульфидных связей часто обнаруживаются в экскретируемых белках или белках плазматической мембраны.Напротив, цитозольные белки часто лишены дисульфидных связей. Известно, что цитозольные цистеины поддерживаются в тиольной форме системами глутаредоксина и тиоредоксина, и по этой причине нехватка дисульфидных мостиков в цитозольных белках может приводить или не приводить к снижению содержания цистеина в белках. Однако одна из гипотетических причин повышенного количества цистеина в белках эукариот, особенно у млекопитающих, может заключаться в том, что сложные организмы могут содержать более широкий спектр внеклеточных белков, богатых цистеином.Поэтому мы изучили, содержат ли известные рибосомные белки млекопитающих больше цистеина, чем белки менее развитых организмов. По-видимому, рибосомные белки содержат меньше остатков цистеина у людей, плодовых мушек, дрожжей и E. coli по сравнению со средним содержанием цистеина в их белках (рис. 3). Это не относится к H. maresmortui. Однако общая тенденция, то есть менее развитые организмы, содержащие меньше остатков цистеина, остается в силе.
Мы также выбрали 10 человеческих рибосомных белков, для которых могут быть получены родственные последовательности для дрожжей, E.coli, и H. marismortui (таблица 1). Мы обнаружили, что объединенные 10 рибосомных белков человека содержат 2404 аминокислоты и 30 цистеинов среди них. Таким образом, их содержание цистеина составляло 1,25%, что значительно меньше, чем среднее содержание цистеина в человеческих белках (2,26%). Однако среднее содержание цистеина в их родственных рибосомных белках в дрожжах составляло 0,42%, за ним следовали E. coli с 0,19% и H. maresmortui с 0,11%. Поправка на содержание GC для различных видов существенно не повлияла на данные.Рибосомные белки, перечисленные в таблице 1, показали 60-78% идентичности / сходства между людьми и дрожжами (RL6 является исключением; он показывает незначительную идентичность / сходство между людьми и дрожжами). Несмотря на это, два из трех цистеинов были введены недавно в рибосомные белки человека.
Цистеины в белках человека были обнаружены вместо аланина ( n = 8), треонина ( n = 4), серина ( n = 4), валина ( n = 4), изолейцина ( n = 1), глицин ( n = 1,) и глутамин ( n = 1) в дрожжах.Часто эти замены обнаруживались в хорошо консервативных областях рибосомных белков.
В заключение, рибосомные белки относительно бедны цистеином, но общая взаимосвязь между их содержанием цистеина у различных видов (рис. 3) аналогична общей тенденции, показанной на рис. 1. Из этих данных следует, что эволюционная тенденция способствует включению большего количества остатков цистеина в белки более сложных организмов.
Содержание GC по сравнению с содержанием AU кодирующих ДНК и их связь с наличием цистеинов
Простейшим объяснением низкого содержания цистеина в белках у представителей Archea может быть то, что содержание GC в ДНК коррелирует с наличием цистеина в белках различных видов.Поскольку многие представители Archea имеют ДНК с высоким содержанием GC, наличие аминокислот, которые кодируются триплетами, богатыми UA, не является предпочтительным. Однако цистеин может кодироваться триплетами UGU и UGC соответственно. Можно обнаружить сильную предвзятость в пользу использования C, а не U в положении третьего кодона для кодирования цистеина у представителей Archea и других видов, богатых GC (данные не показаны). Поскольку двумя важными кодонными буквами для цистеина являются U и G, содержание GC в первых двух положениях кодона было использовано для корректировки наших данных, как описано в «Материалы и методы».
Кроме того, мы изучили, следуют ли вхождения других аминокислот, кодируемых UA- или GC-богатыми триплетами, тенденциям, аналогичным таковому для цистеина у различных видов. Таблица 2 показывает, что ни фенилаланин (кодоны UUU и UUC), ни тирозин (UAU и UAC), ни изолейцин (AUU, AUC и AUA) не следуют тенденциям, аналогичным тенденциям цистеина среди изученных видов. То же самое верно и для других аминокислот (данные не показаны).
Неслучайное присутствие остатков цистеина в белках разных видов
Затем мы исследовали некоторые аспекты пространственного распределения цистеинов в белках различных видов.Чтобы ответить на вопрос, существуют ли какие-либо предпочтительные положения двух цистеинов относительно друг друга, мы провели системный поиск в репрезентативных файлах данных о белках различных видов. В качестве зонда применялась поисковая строка C- (X) n -C. Здесь X обозначает любую аминокислоту, тогда как n — целое число от 0 до 22. Поскольку файлы данных для разных видов были очень разного размера, числа, представляющие появление C- (X) n Последовательности -C в диапазоне n = 0–22 были усреднены и считались 1 для каждого вида.
На рис. 4 показано наличие последовательностей C- (X) n -C у различных видов в диапазоне n = 0–8. Мы обнаружили, что последовательность C- (X) 2 -C чаще встречается у всех исследованных видов, кроме растений. Таким образом, человеческие последовательности (другие млекопитающие демонстрируют аналогичные паттерны) содержат более чем в 1,5 раза больше мотивов C- (X) 2 -C, чем мотивов C-X-C или C- (X) 3 -C. По сути, такая же картина наблюдалась в D.melanogaster и C. elegans. Примерно каждый пятый белок содержал одну или несколько последовательностей C- (X) 2 -C у этих видов (555 из 2681 белка человека и 131 из 624 белков плодовой мухи). Интересно, что белки растений не содержали выдающегося количества последовательностей C- (X) 2 -C, как показано на примере кукурузы. Чтобы выяснить, все ли растения похожи на кукурузу, мы также изучили белки пшеницы, риса и томатов. Мы нашли аналогичные результаты (данные не показаны), подтверждающие, что растительные белки не имеют высокой репрезентативности последовательностей C- (X) 2 -C.Однако белки хлоропластов различных растений демонстрируют паттерны C- (X) 2 -C, аналогичные паттернам бактерий (данные не показаны).
Свободноживущий организм S. cerevisiae, , который имеет низкое содержание цистеина по сравнению с людьми (рис. 1), имеет более 5% общего содержания цистеина, расположенного в мотивах C- (X) 2 -C .
Относительное количество мотивов C- (X) 2 -C было дополнительно увеличено у E. coli и других эубактерий, но наиболее заметное увеличение было у представителей Archea. Из 1063 цистеинов, обнаруженных в 553 известных белках, 232 остатка цистеина были обнаружены в мотивах C- (X) 2 -C. Таким образом, более 21% цистеинов расположены по этой конкретной схеме.
Чтобы выяснить, расположена ли какая-либо другая аминокислота по схеме, подобной структуре цистеина, мы исследовали другие 19 аминокислот в файлах данных S. cerevisiae и E. coli . Наши результаты показали, что никакая другая аминокислота не показала распределение, подобное цистеину, в белках S.cerevisiae или E. coli (данные не показаны).
Затем мы проанализировали различные мотивы C- (X) 2 -C у людей, дрожжей, E. coli, и представителей Archea. Как и ожидалось, некоторые мотивы C- (X) 2 -C были более многочисленными, чем другие. У людей вместо X имеется много остатков глутаминовой кислоты (и других заряженных аминокислот). Белки цинковых пальцев, металлотионены и дегидрогеназы могут содержать несколько из этих мотивов. Однако 555 из 2681 исследованных белков человека содержат по крайней мере один мотив C- (X) 2 -C, и подробное описание и обсуждение их возможной взаимосвязи и сходства с их братьями и сестрами выходит за рамки настоящего отчета.Здесь достаточно заявить, что любая возможная комбинация аминокислот была найдена хотя бы один раз. Кроме того, наиболее распространенные мотивы C- (X) 2 -C в файлах данных людей, дрожжей, E. coli, и Archea различаются, хотя некоторые характерные композиционные особенности определенно присутствуют. Одним из таких случаев является отмеченное предпочтительное наличие полярных заряженных аминокислот у млекопитающих. Дрожжи, E. coli, и Archea , по-видимому, также содержат ряд остатков C-P-X-C или C-X-P-C.
Обсуждение
Цистеин — единственная кодируемая аминокислота, которая несет реактивную сульфгидрильную группу. Образуя внутри- и межцепочечные дисульфидные связи, он играет особую роль в структуре белка (Noiva 1994; Raina and Missiakas 1997). По-видимому, не менее важно, чтобы большинство цистеинов цитозольных белков поддерживалось в восстановленной тиоловой форме (Derman et al. 1993).
В данной работе мы изучали наличие цистеина у различных видов.Мы обнаружили, что представление цистеина в различных организмах имеет одну общую черту: цистеин недостаточно представлен в белках всех исследованных видов (рис. 1). Однако содержание цистеина в белках разных видов может составлять всего 0,4–0,5% в Archea, , тогда как белки млекопитающих обычно содержат около 2,26% остатков цистеина.
Более высокое содержание цистеина в белках более сложных организмов может частично объясняться большим количеством нецитозольных белков, богатых дисульфидными связями.Естественно, относительное отсутствие дисульфидных связей указывает, но не доказывает, что цитозольные белки относительно бедны цистеином. Тем не менее, наши результаты показывают, что рибосомные белки бедны цистеином по сравнению со средним содержанием цистеина в белках идентичных видов (рис. 3).
Однако увеличение содержания цистеина в белках сложных видов организмов справедливо и для рибосомных белков. Мы продемонстрировали, что родственные рибосомные белки имеют тенденцию включать больше цистеинов у более развитых видов (рис.3 и таблица 1). Например, несмотря на большое сходство между рибосомными белками человека и дрожжей, первый содержит почти в три раза больше остатков цистеина. Следовательно, нельзя не отметить взаимосвязь между повышенной сложностью и повышенным представлением цистеина (рис. 1).
Важно отметить, что эта тенденция уникальна для цистеина, поскольку другие аминокислоты не следуют той же тенденции. Мы объясняем описанные выше явления, предполагая, что эволюция использует преимущества более широкого использования цистеина.Уникальная способность цистеина формировать структуру белка, вероятно, чаще используется в развитых организмах.
Повышенное использование цистеина в развитых организмах может быть исследовано в свете теорий о распределении кодонов. Короче говоря, возможно, что даже примитивные древние организмы использовали кодовую таблицу, очень похожую на ту, что используется в современных организмах. В качестве альтернативы, древняя кодовая таблица могла кодировать менее 20 аминокислот, а нынешнее распределение кода может быть результатом прогрессивного деления кода (Wong 1975, 1976, 1988).Во время этого гипотетического процесса кодоны, назначенные данной аминокислоте, были общими с другими аминокислотами. Аргументы за и против этих теорий выходят за рамки настоящего отчета. С одной стороны, проблема с «теорией совместного использования кода» заключается в том, что новое распределение кодона — даже если замещающая аминокислота является физико-химически родственным братом — вызовет широко распространенные структурные и функциональные изменения.
С другой стороны, тот факт, что некоторые организмы содержат «аномальное» распределение кода, поддерживает гипотезы эволюции кода и совместного использования кода (Osawa et al.1990, 1992; Джукс и Осава 1993). Также Doring и Marliere (1998) показали, что мутантные тРНК, которые включают цистеин в положениях, соответствующих изолейцину или метионину, могут сохраняться в E. coli. Токсичность неправильного кодирования цистеина была низкой, что доказывает, что цистеин является приемлемой заменой в большинстве положений белка.
Наши результаты показывают, что введение цистеина происходило постепенно в процессе эволюции (рис. 1), а прогрессирующие мутации привели к сдвигу в сторону увеличения использования цистеина.Следовательно, наше наблюдение не обеспечивает прямой поддержки совместного использования кодонов, но указывает на возможность того, что цистеин мог появиться «поздно» по сравнению с другими аминокислотами.
Мы также обнаружили своеобразную неслучайность в расположении цистеинов; а именно, два цистеина, разделенные двумя другими аминокислотами, встречаются с исключительно высокой частотой. Домен C- (X) 2 -C чрезмерно представлен в белках ряда видов. Это чрезмерное представительство становится все более и более выраженным среди примитивных организмов, в результате чего более 21% от общего количества цистеинов находится внутри мотивов C- (X) 2 -C у членов порядка Archea .
Наше объяснение этого феномена состоит в том, что первый и четвертый аминокислотные остатки в альфа-спирали или в конформациях бета-витка наиболее близки друг к другу, соответственно. Обнаружено, что аминокислоты, которые наиболее распространены в β-поворотах, относятся к четко определенной части генетического кода. Поскольку эта группа аминокислот содержит биосинтетические предшественники других аминокислот, возможно, что эти аминокислоты и β-повороты были более многочисленны на ранней стадии эволюции (Jurka and Smith 1987).
C- (X) 2 -C мотивы являются важными доменами металл-связывающих белков и оксидоредуктаз (Shuber et al. 1986; Ammendola et al. 1992). Каммак, Холл и Рао (1971) предположили, что ферредоксины играли важную роль в ранней эволюции.
Очень высокая распространенность мотивов C- (X) 2 -C в примитивных организмах, вероятно, связана с относительной важностью короткодействующих взаимодействий внутриполипептидных цепей, в отличие от дальнодействующих взаимодействий внутриполипептидных цепей и интерполипептидных цепей. взаимодействия.В то время как первое было более важным для древних организмов, последние два типа взаимодействий становятся все более и более важными в дальнейшем в эволюции. Это может объяснить наблюдение, что увеличение содержания цистеина привело к относительному уменьшению количества цистеинов, присутствующих в мотивах C- (X) 2 -C.
Несмотря на относительное уменьшение количества цистеинов в мотивах C- (X) 2 -C, мы обнаружили 555 таких мотивов в 2681 изученном белке человека. Факторы транскрипции, подобные цинковому пальцу или цинковому пальцу, используются в ряде белков, которые возникли в многоклеточных организмах.К ним относятся различные рецепторы гормонов. Следовательно, эволюция привела ко многим новым применениям белков с доменами C- (X) 2 -C, но еще больше белков приобрели цистеины в различных других положениях.
Таблица 1 Цистеин в белках рибосом разных видов
Таблица 1 Цистеин в белках рибосом разных видов
Таблица 2 Встречаемость аминокислотных остатков Phe, Tyr, Ile и Cys в белках различных видов (%)
Таблица 2 Встречаемость аминокислотных остатков Phe, Tyr, Ile и Cys в белках различных видов (%) )
Рис.1. — Наличие цистеина в белках различных видов. Содержание цистеина выражается в процентах (ось Y). Сумма всех 20 кодированных аминокислот считалась 100%. Все данные были скорректированы на содержание ГХ по сравнению с содержанием АТ видов, как описано в «Материалы и методы». Поскольку цистеин имеет 2 кодона из 61 смыслового кодона, математическая вероятность появления цистеина составляет 3,28% (последний столбец). Диапазон скорректированных данных GC составляет 3,23–3,28% для различных видов
Рис.1. — Наличие цистеина в белках различных видов. Содержание цистеина выражается в процентах (ось Y). Сумма всех 20 кодированных аминокислот считалась 100%. Все данные были скорректированы на содержание ГХ по сравнению с содержанием АТ видов, как описано в «Материалы и методы». Поскольку цистеин имеет 2 кодона из 61 смыслового кодона, математическая вероятность появления цистеина составляет 3,28% (последний столбец). Диапазон скорректированных данных GC составляет 3,23–3,28% для различных видов
Рис.2. — Белки с по крайней мере одним остатком цистеина и без него у различных видов. Черная часть сложенного столбца представляет белки с цистеином, а белая часть представляет белки без единого остатка цистеина. Сумма всех проанализированных белков считалась 100% (ось Y).
Рис. 2. — Белки, содержащие по крайней мере один остаток цистеина и без него, у различных видов. Черная часть сложенного столбца представляет белки с цистеином, а белая часть представляет белки без единого остатка цистеина.Сумма всех проанализированных белков считалась 100% (ось Y)
.Рис. 3. — Содержание цистеина в рибосомных белках (черные столбцы) различных видов. Также показано общее содержание цистеина в белках (пустые столбцы) различных видов. Содержание цистеина выражается в процентах от 20 кодированных аминокислот (ось Y). Данные скорректированы по ГХ.
Рис. 3. — Содержание цистеина в рибосомных белках (черные столбцы) различных видов. Также показано общее содержание цистеина в белках (пустые столбцы) различных видов.Содержание цистеина выражается в процентах от 20 кодированных аминокислот (ось Y). Данные скорректированы по GC
Рис. 4. — Относительное положение цистеинов (закрашенные квадраты) и глицинов (пустые квадраты) на участке аминокислот ≤8 ( n ≤ 8). Встречаемость остатков цистеина и глицина была проанализирована для n = 0–22, и средняя встречаемость была принята за 1. Общие значения встречаемости составили 24,484 для человека, 7,475 для Drosophila, 877 для кукурузы, 9,602 для S.cerevisae, 4515 для E. coli, и 545 для H. maresmortui. Фактическое вхождение отображается на оси Y; n отображается по оси X. Данные скорректированы с помощью ГХ.
Рис. 4. Относительные положения цистеинов (закрашенные квадраты) и глицинов (пустые квадраты) на участке аминокислот ≤8 ( n ≤ 8). Встречаемость остатков цистеина и глицина анализировалась для n = 0–22, и средняя встречаемость принималась за 1.Общие значения встречаемости составили 24 484 для человека, 7 475 для Drosophila, 877 для кукурузы, 9 602 для S. cerevisae, 4515 для E. coli, и 545 для H. maresmortui. Фактическое вхождение отображается на оси Y; n отображается по оси X. Данные скорректированы по GC
Мы благодарим докторов наук. Дэвида М. Бедвелла, Миклоша Келлермайера, Иштвана Саймона и Дениса Н. Уитли за критическое прочтение рукописи. Мы благодарим Андраша Раба за техническую помощь.Работа поддержана грантом Министерства здравоохранения Венгрии (T-04 035/99).
цитированная литература
Аммендола С., К. А. Райя, К. Карузо, Л. Камарделла, С. Д’Аурия, М. Де Роса и М. Росси.
1992
. Термостабильная НАД (+) — зависимая алкогольдегидрогеназа из Sulfolobus solfataricus: определение последовательности генов и белков и связь с другими алкогольдегидрогеназами. Биохимия 31 : 12514–12523.Baumann, U., и Дж. Оро.
1993
. Три этапа эволюции генетического кода. Биосистемы 29 : 133–141.Каммак Р., Д. Холл и К. Рао.
1971
. Ферредоксины: это живые окаменелости? New Sci. 23 : 696–698.Дерман, А. И., В. А. Принц, Д. Белин и Дж. Беквит.
1993
. Мутации, которые позволяют образовывать дисульфидные связи в цитоплазме Escherichia coli. Наука 262 : 1744–1747.Доринг В. и П.Марлиер.
1998
. Термостабильная НАД (+) — зависимая алкогольдегидрогеназа из Sulfolobus solfataricus : определение последовательности генов и белков и связь с другими алкогольдегидрогеназами. Генетика 150 : 543–551.Фэн Д. Ф., М. С. Джонсон и Р. Ф. Дулиттл.
1984
. Прогрессивное выравнивание аминокислотных последовательностей и построение из них филогенетических деревьев.J. Mol. Evol.
21
:112
–125.Джукс, Т. Х. и С. Осава.
1993
. Эволюционные изменения генетического кода.Комп. Биохим. Physiol. B Комп. Биохим.
106
:489
–494.Юнгк, Дж. Р.
1978
. Генетический код как периодическая таблица.J. Mol. Evol.
2
:211
–224.Юрка Дж. И Т. Ф. Смит.
1987
. β превращается в раннюю эволюцию: хиральность, генетический код и биосинтетические пути. Симпозиумы Колд-Спринг-Харбор по количественной биологии.Vol. LII. Симпозиум Колд-Спринг-Харбор по количественной биологии, Колд-Спринг-Харбор, Нью-Йорк.Лоферер, Х. и Х. Хеннеке.
1994
. Белковые дисульфид-оксидоредуктазы у бактерий.Trends Biochem. Sci.
19
:169
–171.Мисета, А.
1989
. Роль молекул-предшественников аминокислот, связанных с белками, в организации генетических кодонов.Physiol. Chem. Phys.
21
:237
–242.Майерс, Э.W. и W. Miller.
1988
. Оптимальные выравнивания в линейном пространстве.Comput. Прил. Biosci.
4
:11
–17.Нойва, р.
1994
. Ферментативный катализ образования дисульфидов.Protein Expr. Purif.
5
:1
–13.Осава, С., Т. Х. Джукс, К. Ватанабэ и А. Муто.
1992
. Недавние доказательства эволюции генетического кода.Microbiol. Ред.
56
:229
–264.Осава С., А. Муто, Т. Х. Джукс и Т. Охама.
1990
. Эволюционные изменения генетического кода.Proc. R. Soc. Лондон. B Biol. Sci.
241
:19
–28.Райна С. и Д. Миссиакас.
1997
. Образование и разрыв дисульфидных связей.Annu. Rev. Microbiol.
51
:179
–202.Шубер, А. П., Э. К. Орр, М. А. Рекни, П. Ф. Шендель, Х. Д. Мэй, Н. Л. Шауэр и Дж. Г. Ферри.
1986
.Клонирование, экспрессия и нуклеотидная последовательность генов формиатдегидрогеназы из methanobacterium formicicum.J. Biol. Chem.
261
:12942
–12947.Стюарт, Э. Дж., Ф. Ослунд и Дж. Беквит.
1998
. Образование дисульфидной связи в цитоплазме Escherichia coli: изменение роли тиоредоксинов in vivo.EMBO J.
17
:5543
–5550.Вебер, А. Л., и Дж. К. Лейси.
1978
. Корреляции генетического кода: аминокислоты и их антикодоновые нуклеотиды.J. Mol. Evol.
2
:199
–210.Вёзе, К. Р. и Р. Гупта.
1981
. Архебактерии просто производные от «прокариот»? Природа 289 : 95–96.Вёзе, К. Р., О. Кандлер и М. Л. Уилис.
1990
. К естественной системе организмов: предложение о доменах Archaea, Bacteria и Eucarya. Proc. Natl. Акад. Sci. США 87 : 4576–4579.Вонг, Дж. Т. Ф.
1975
. Коэволюционная теория генетического кода.Proc. Natl. Акад. Sci. США 72 : 1909–1912.———.
1976
. Эволюция универсального генетического кода. Proc. Natl. Акад. Sci. США 73 : 2336–2340.———.
1988
. Эволюция генетического кода.Microbiol. Sci.
5
:174
–181.Чжун Л., Э. С. Арн-Эр, Дж. Люнг, Ф. Ослунд и А. Холмгрен.
1998
. Тиоредоксинредуктаза крысы и теленка гомологична глутатионредуктазе с удлинением на карбоксильном конце, содержащим консервативный каталитически активный предпоследний остаток селеноцистеина.J. Biol. Chem.
273
:8581
–8591. .

