Дыхательный контроль
В норме субстраты тканевого дыхания и О2 находятся в достаточном количестве и не лимитируют окислительное фосфорилирование. Активность окислительного фосфорилирования ограничивает только концентрация АДФ, которая обратно пропорциональна концентрации АТФ.
При нагрузке концентрация АТФ снижается, а АДФ увеличивается, что ускоряет дыхание и фосфорилирование. В состоянии покоя количество АТФ увеличивается, а АДФ снижается, что тормозит дыхание и фосфорилирование.
Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. В результате дыхательного контроля скорость синтеза АТФ соответствует потребностям клетки в энергии. Общее содержание АТФ в организме 30—50 г, но каждая молекула АТФ в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40—60 кг АТФ и столько же распадается.
Коэффициент окислительного фосфорилирования
Для оценки эффективности окислительного фосфорилирования используют коэффициент окислительного фосфорилирования (Р/О).
Коэффициентом окислительного фосфорилирования называют отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания.
При окисление молекулы НАДН2, е— по дыхательной цепи проходят 3 пункта сопряжения, что обеспечивает синтез 3 АТФ при затрате 3 Н3РО4 и 3 АДФ на 1 атом кислорода. Соответственно для НАДН2 Р/О=3.
При окисление молекулы ФАДН2, е— по дыхательной цепи проходят только 2 пункта сопряжения, что обеспечивает синтез 2 АТФ при затрате 2 Н3РО4 и 2 АДФ на 1 атом кислорода. Соответственно для ФАДН2 Р/О=2.
Эти величины Р/О отражают теоретический максимум синтеза АТФ, фактически эта величина меньше из-за затрат на транспорт.
23. Микросомальное окисление (МСО) –моно — и диоксигеназные пути использования кислорода в клетке: локализация редокс-цепи в эндоплазматическом ретикулуме(ЭПР), биологическое значение. Особенности строения и функции цитохром-p450-оксидазы и цитохром-b5-оксидазы, возрастные особенности и факторы индукции синтеза ферментов. Цитохром р450 в клинической практике.
Монооксигеназные реакции
Монооксигеназы это ферменты, которые включают в субстрат только один атом молекулы кислорода. Другой атом кислорода восстанавливается до воды с участием электронов и протонов НАДФН2, НАДН2,реже витамин С:
S-Н + О2 + RH2 → S-ОН + Н2О + R (где R = НАДФН2, НАДН2,витамин С)
Монооксигеназные реакции протекают на цитоплазматической поверхности гладкого ЭПР, их называют микросомальным окислением, и на внутренней поверхности внутренней мембраны митохондрии. Катализируют низкоспецифичные реакции.
Диоксигеназные реакции
Диоксигеназы это ферменты, которые включают в субстрат оба атома молекулы кислорода:
S + О2 → SО2
Таким путем окисляются циклические трудноокисляемые структуры, реакции идут с разрывом цикла. Диоксигеназные реакции протекают на цитоплазматической поверхности гладкого ЭПР.
Гомогентизатдиоксигеназа печени, содержит Fe2+, участвует в катаболизме тирозина
Цитохром Р450 – интегральный гемопротеин, содержит простетическую группу гем, имеет участки связывания для О 2 и субстрата. Открыто 150 генов, кодирующих различные изоформы цитохрома Р450. Каждая из изоформ Р450 имеет много субстратов и отличается от других изоформ Р450 только белковой частью.
Цитохром Р450 передает 2 электрона на 1 атом молекулы кислорода, который превращается в О2-, при взаимодействии с 2 протонами О2- дает воду. Второй атом молекулы кислорода включается в субстрат RH, образуя ROH.
Цитохром b5. Цитозольный домен содержит гем, гидрофобный домен фиксирует фермент в мембране. Цитохром b5 может передавать свои электроны на различные ферменты (цитохром Р450, Стеароил-КоА-десатуразу и т.д.), образуя различные ЦПЭ, при этом он участвует в десатурации и элонгации жирных кислот, в синтезе холестерина, плазминогенов и церамида.
24. Свободно-радикальное окисление (СРО): стадии и реакции образования активных форм О2 (супероксид, пероксид, гидроксид — радикал), факторы инициации. Значение в физиологии и патологии клетки пероксидазного и радикального пути использования кислорода.
Образование активных форм кислорода
АФК во многих клетках образуются в основном в ферментативных и неферментативных реакциях в результате последовательного присоединения е— к кислороду:
О2 + 1е— → О∙2 супероксидный анион-радикал (˙О::О:).
О∙2 +1е— → О2-2 пероксидный анион (:О::О:), он быстро протонируется с образованием перекиси водорода О2-2 + 2Н+
→ Н2О2 (Н:О::О:Н)Н2О2 + 1е— → НО∙ + ОН— гидроксильный радикал, ОН— протонируется с образованием воды ОН— + Н+ → Н2О
ОН∙ + 1е— → Н2О (Н:О:Н)
Ферментативные реакции образования АФК
Электроны, необходимые для образования АФК могут давать ЦПЭ. Утечка е— из ЦПЭ на кислород является основным путем образования АФК в большинстве клеток:
В цепи окислительного фосфорилирования Q принимая 1 е— превращается в свободный радикал семихинон НQ∙, который при реоксигенации ишемических тканей может непосредственно взаимодействовать с кислородом, образуя супероксидный анион-радикал: HQ· + O2 → Q+ О
в монооксигеназных реакциях е— с цитохрома Р450 переходит на кислород с образованием супероксидного анион-радикала, который иногда теряется с активного центра.
Аэробные дегидрогеназы (ФАД-зависимые оксидазы) переносят е— и Н+ с субстрата на кислород с образованием перекиси водорода. Примеры таких оксидаз — оксидазы аминокислот, супероксид дисмутаза, оксидазы, локализованные в пероксисомах.
Неферментативные реакции образования АФК
Электроны, необходимые для образования АФК могут давать:
1). Металлы переменной валентности. Наличие в клетках Fe2+ или ионов других переходных металлов катализирует образования АФК. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного анион-радикала.
Hb(Fe2+) + O2 → MetHb(Fe3+) + О∙2
2). Радикалы. АФК, обмениваясь электроном, легко переходят друг в друга: О∙2 + Н2О2 → О2 + НО∙ + ОН—
АФК также могут образовываться в организме неферметативно при гомолитическом разрыве связей под действием ионизирующего излучения. Ионизирующее излучение вызывает например, радиолиз воды с образованием Н2; Н2О2 и свободных радикалов: Н·, НО∙, О·.(фотостарение)
Кислородные радикалы, обладая высокой активностью, разрушают органические молекулы в реакциях свободно-радикального окисления (СРО). Большая часть этих реакций протекает с полиненасыщенными жирными кислотами липидов, и называется перекисным окислением липидов (
Значение в клетке:
studfiles.net
Дыхательный контроль
Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены.
Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ.
Выполнение клеткой работы с затратой АТФ приводит к уменьшению концентрации АТФ. = Происходит накопление АДФ.
Это активирует окисление субстратов и поглощение O2 митохондриями клетки.
Таким образом, клетки реагируют на интенсивность метаболизма и поддерживают соотношение АТФ/АДФ на необходимом уровне.
Дыхательный контроль – это зависимость интенсивности поглощения кислорода митохондриями от концентрации АДФ.
Ингибиторы цпэ.
Ингибиторы ЦПЭ подавляют активность ферментных комплексов (I, II, III и IV) = происходит замедление или даже полное прекращение работы ЦПЭ = происходит замедление или полное прекращение синтеза АТФ.
I комплекс: NADH-дегидрогеназа.
Ингибиторы: ротенон и барбитураты (амитал, аминобарбитал, нембутал, веронал и др.)
II комплекс: FAD-зависимая сукцинатдегидрогеназа.
Обратимый конкурентный ингибитор: малонат.
III
Ингибитор: Антимицин A.
IV комплекс: Цитохромоксидаза.
Ингибиторы: цианид-ионы (CN–): KCN, HCN и др.; угарный газ (CO), сероводород (H2S).
Антибиотик олигомицин не ингибирует саму ЦПЭ, но подавляет окислительное фосфорилирование, ингибируя АТФ-синтазу.
! При полном ингибировании in vitro любого из ферментных комплексов, который располагается на пути переноса электронов от дегидрируемого субстрата на O2, работа ЦПЭ прекращается и АТФ не синтезируется.
Примеры:
К суспензии митохондрий, где в качестве окисляемого субстрата использовали малат, добавили амитал Na. Как при этом изменится синтез АТФ?
Т.к. амитал Na ингибирует NADH-дегидрогеназу, которая расположена на пути переноса электронов от малата на O2, то скорость ЦПЭ замедляется = замедляется (или прекращается) синтез АТФ.
Смесь: малат + амитал + сукцинат.
Р/О 2, т.к. в этом случае будет окисляться сукцинат, для которого «не нужна» NADH-дегидрогеназа.
Смесь: сукцинат + малонат (избыток).
Синтез АТФ замедляется, т.к. малонат ингибирует сукцинатдегидрогеназу, которая располагается на пути электронов от сукцината на O2.
Смесь: сукцинат + малонат + изоцитрат.
Р/О 3, т.к. в этом случае будет окисляться изоцитрат, для которого «не нужна» сукцинатдегидрогеназа.
Смесь: малат (или сукцинат) + антимицин A.
Синтез АТФ замедляется, т.к. антимицин A ингибирует QH2-дегидрогеназу, которая располагается на пути электронов от этих субстратов на O2.
Если к 5) смеси добавить витамин C, то Р/О 1, так вит. C окисляет цитохром c (в переносе электронов не участвует QH2-дегидрогеназа).
CN– независимо от дегидрируемого субстрата необратимо ингибируют ЦПЭ у человека. Они присоединяются к Fe3+ цитохромоксидазы и полностью блокируют ЦПЭ.
(CN– – необратимый специфический ингибитор цитохромоксидазы).
Разобщение тканевого дыхания и окислительного фосфорилирования.
Некоторые химические вещества (протонофоры) могут переносить H+ из межмембранного пространства митохондрии через внутреннюю мембрану в матрикс, минуя протонные каналы АТФ-синтазы = снижается (или даже полностью исчезает) H+ и замедляется (прекращается) синтез АТФ.
Это явление называют разобщением тканевого дыхания и окислительного фосфорилирования.
В результате разобщения количество АТФ снижается, а АДФ увеличивается.
При этом, за счет дыхательного контроля, возрастает скорость поглощения O2 митохондриями и скорость работы ЦПЭ, но из-за нарушения работы АТФ-синтазы коэффициент Р/О резко снижается = энергия рассеивается в виде теплоты, что приводит к повышению t тела человека (пирогенное действие).
Разобщители – это гидрофобные в-ва, которые легко проходят через мембрану митохондрий в обоих направлениях.
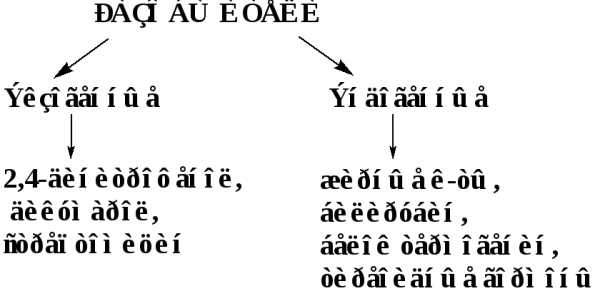
Некоторые эндогенные разобщители играют роль в поддержании постоянной t тела человека.
При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов.
В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо.
Образующиеся свободные жирные кислоты служат не только «топливом», но и важнейшим регулятором разобщения дыхания и фосфорилирования.
studfiles.net
Дыхательный контроль.
Зависимость дыхания в митохондриях от концентрации АДФ называется дыхательным контролем, т.е. скорость синтеза АТФ путем окислительного фосфорилирования определяется потребностью клеток в энергии. При расходовании АТФ повышается концентрация АДФ в клетке —► ускоряется дыхание и фосфорилирование, т.е. синтез АТФ.
Таким образом, клеточное дыхание включает в себя следующие процессы: ОДПВК, ЦТК и ЦПЭ.
Токсичное действие кислорода. Защита от токсичного действия кислорода.
О2 является неотъемлемой частью для нормальной деятельности организма, но О2 может образовывать высокоактивные формы, токсичные для организма. Т.к. О2 имеет 2 не спаренных электрона с одинаково ориентированными спинами, занимающие самостоятельные внешние орбитали . Присоединение одного электрона к О2 приводит к
образованию супероксидного аниона (O2). Присоединение второго электрона приводит к образованию пероксидного аниона (O22-).
О^может действовать как окислитель и как восстановитель. В результате присоединения электронов к О2 образуется НО.
O2—+ẽ+2H+ H2O
О2 может служить восстановителем, тогда образуется О^
O2— — ẽ O2
Возможна ситуация, когда один Од является окислителем, а другой — восстановителем, в результате образуется перекись водорода (пероксид) — малотоксичное для клеток вещество
O2—+ O2— + 2Н+ H2O2 + O2 (дисмутация)
Образовавшийся H2O2 может восстанавливаться О2 с образованием свободного гидроксильного радикала ОН , Ог и Н2О — это высокоактивные вещества, они могут взаимодействовать с нуклеиновыми кислотами, белками, липидами, лучше всего изучено их повреждающие действие на липидный слой мембраны (курс биорганики). В результате их действия повреждаются жирные кислоты, входящие в состав липидов, особенно этот процесс опасен для эритроцитов (это приводит к гемолизу — выходу содержимого эритроцитов). Поэтому организм выработал механизмы, защиты от токсичного действия кислорода (естественная защита), ферментативная.
во всех клетках содержится 2 фермента: 1 — супер-оксиддисмутаза — фермент, катализирующий реакцию дисмутации; 2 — каталаза, разлагает малотоксичную перекись до воды, т.е. эти два фермента защищают организм от накапления О2 и Н2О2
глутатионпероксидаза, находится больше всего в эритроцитах и в печени. Защищает мембраны эритроцитов от разрушения, но работает в комплексе с другими ферментами. Он катализирует восстановление перекиси водорода с образованием воды. (Восстановление — присоединение двух атомов водорода), донорами двух атомов водорода служат глутатион (трипептид, состоящий из глутаминовой кислоты, цистиина и глицина).
витамин Е — экзогенная защита, токоферол.
Он способен окисляться, т.е. отдавать один электрон с образованием малоактивного свободного радикала. Акцепторами электрона могут быть свободные радикалы жирных кислот (которые образуются в результате перекисного окисления липидов мембран). Т.е. витамин Е восстанавливает свободные радикалы жирных кислот и прерывает цепную реакцию перекисного окисления (антиоксидантная функция витамина Е).
studfiles.net
40.Регуляция цепи переноса электронов (дыхательный контроль). Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания
Дыхательный контроль Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз. Общее содержание АТФ в организме 30-50 г, но каждая молекула АТФ в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается. Увеличение концентрации АДФ немедленно приводит к ускорению дыхания и фосфорилирования.
Разобщение дыхания и фосфорилирования Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители — липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ — 2,4-динитрофенол, легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс. Примерами разобщителей могут быть также некоторые лекарства, например дикумарол — антикоагулянт или метаболиты, которые образуются в организме, билирубин — продукт катаболизма тема, тироксин — гормон щитовидной железы. Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Терморегуляторная функция ЦПЭ На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зимнес-пящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования — бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) — термогенин. Бурый жир имеется у новорождённых, но его практически нет у взрослого человека. В последние годы появились факты, свидетельствующие о существовании в митохондриях разных органов и тканей млекопитающих разобщающих белков, похожих по своей структуре на РБ-1 бурой жировой ткани. По своей структуре термогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями.На внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью АТФ/ АДФ-антипортера. При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо. Образующиеся свободные жирные кислоты служат не только «топливом», но и важнейшим регулятором разобщения дыхания и фосфорилирования.
13.Нарушения энергетического обмена: гипоэнергетические состояния как результат гипоксии, гипо-, авитаминозов и других причин. Возрастная характеристика энергетического обеспечения организма питательными веществами.
Все живые клетки постоянно нуждаются в АТФ для осуществления различных видов жизнедеятельности. Клетки мозга потребляют большое количество АТФ для синтеза нейромедиаторов, регенерации нервных клеток, поддержания необходимого градиента Na+ и К+, для проведения нервного импульса; почки используют АТФ в процессе реабсорбции различных веществ при образовании мочи; в печени происходит синтез гликогена, жиров, белков и многих других соединений; в миокарде постоянно совершается механическая работа, необходимая для циркуляции крови; скелетные мышцы в покое потребляют незначительные количества АТФ, но при физической нагрузке эти потребности возрастают в десятки раз. Вместе с тем запасов АТФ в клетках практически не существует. Так, в условиях прекращения синтеза АТФ в миокарде его запасы истощаются за несколько секунд. Как мы уже знаем, для постоянного синтеза АТФ клеткам необходим приток метаболитов как субстратов дыхания и кислорода как конечного акцептора электронов в реакциях окисления, сопряжённых с синтезом АТФ. Нарушения какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки. Состояния, при которых синтез АТФ снижен, объединяют термином «гипоэнергетические«. Причинами гипоэнергетических состояний могут быть голодание, гиповитаминозы В1, РР, В2; гипоксия. Гипоксия может возникнуть: при недостатке кислорода во вдыхаемом воздухе; при заболеваниях лёгких и нарушении лёгочной вентиляции; при нарушениях кровообращения, вызванных заболеваниями сердца, спазмом и тромбозом сосудов, кровопотерей. Причинами гипоксии могут быть также наследственные или приобретенные нарушения структуры гемоглобина . Частой причиной гипоэнергетических состояний могут быть нарушения процессов использования кислорода в клетках. Причинами этих нарушений могут быть:
действие ингибиторов и разобщителей в ЦПЭ;
железодефицитные анемии;
снижение уровня гемоглобина и других железосодержащих белков (цитохромов, FeS-белков), в результате чего нарушаются перенос электронов и синтез АТФ;
наследственные дефекты ферментов ЦПЭ и цитратного цикла
studfiles.net
40.Регуляция цепи переноса электронов (дыхательный контроль). Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания
Дыхательный контроль Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз. Общее содержание АТФ в организме 30-50 г, но каждая молекула АТФ в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается. Увеличение концентрации АДФ немедленно приводит к ускорению дыхания и фосфорилирования.
Разобщение дыхания и фосфорилирования Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители — липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ — 2,4-динитрофенол, легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс. Примерами разобщителей могут быть также некоторые лекарства, например дикумарол — антикоагулянт или метаболиты, которые образуются в организме, билирубин — продукт катаболизма тема, тироксин — гормон щитовидной железы. Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Терморегуляторная функция ЦПЭ На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зимнес-пящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования — бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) — термогенин. Бурый жир имеется у новорождённых, но его практически нет у взрослого человека. В последние годы появились факты, свидетельствующие о существовании в митохондриях разных органов и тканей млекопитающих разобщающих белков, похожих по своей структуре на РБ-1 бурой жировой ткани. По своей структуре термогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями.На внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью АТФ/ АДФ-антипортера. При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо. Образующиеся свободные жирные кислоты служат не только «топливом», но и важнейшим регулятором разобщения дыхания и фосфорилирования.
41.Нарушения энергетического обмена: гипоэнергетические состояния как результат гипоксии, гипо-, авитаминозов и других причин. Возрастная характеристика энергетического обеспечения организма питательными веществами.
Все живые клетки постоянно нуждаются в АТФ для осуществления различных видов жизнедеятельности. Клетки мозга потребляют большое количество АТФ для синтеза нейромедиаторов, регенерации нервных клеток, поддержания необходимого градиента Na+ и К+, для проведения нервного импульса; почки используют АТФ в процессе реабсорбции различных веществ при образовании мочи; в печени происходит синтез гликогена, жиров, белков и многих других соединений; в миокарде постоянно совершается механическая работа, необходимая для циркуляции крови; скелетные мышцы в покое потребляют незначительные количества АТФ, но при физической нагрузке эти потребности возрастают в десятки раз. Вместе с тем запасов АТФ в клетках практически не существует. Так, в условиях прекращения синтеза АТФ в миокарде его запасы истощаются за несколько секунд. Как мы уже знаем, для постоянного синтеза АТФ клеткам необходим приток метаболитов как субстратов дыхания и кислорода как конечного акцептора электронов в реакциях окисления, сопряжённых с синтезом АТФ. Нарушения какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки. Состояния, при которых синтез АТФ снижен, объединяют термином «гипоэнергетические«. Причинами гипоэнергетических состояний могут быть голодание, гиповитаминозы В1, РР, В2; гипоксия. Гипоксия может возникнуть: при недостатке кислорода во вдыхаемом воздухе; при заболеваниях лёгких и нарушении лёгочной вентиляции; при нарушениях кровообращения, вызванных заболеваниями сердца, спазмом и тромбозом сосудов, кровопотерей. Причинами гипоксии могут быть также наследственные или приобретенные нарушения структуры гемоглобина . Частой причиной гипоэнергетических состояний могут быть нарушения процессов использования кислорода в клетках. Причинами этих нарушений могут быть:
действие ингибиторов и разобщителей в ЦПЭ;
железодефицитные анемии;
снижение уровня гемоглобина и других железосодержащих белков (цитохромов, FeS-белков), в результате чего нарушаются перенос электронов и синтез АТФ;
наследственные дефекты ферментов ЦПЭ и цитратного цикла
studfiles.net
40.Регуляция цепи переноса электронов (дыхательный контроль). Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания
Дыхательный контроль Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз. Общее содержание АТФ в организме 30-50 г, но каждая молекула АТФ в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается. Увеличение концентрации АДФ немедленно приводит к ускорению дыхания и фосфорилирования.
Разобщение дыхания и фосфорилирования Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители — липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ — 2,4-динитрофенол, легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс. Примерами разобщителей могут быть также некоторые лекарства, например дикумарол — антикоагулянт или метаболиты, которые образуются в организме, билирубин — продукт катаболизма тема, тироксин — гормон щитовидной железы. Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Терморегуляторная функция ЦПЭ На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зимнес-пящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования — бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) — термогенин. Бурый жир имеется у новорождённых, но его практически нет у взрослого человека. В последние годы появились факты, свидетельствующие о существовании в митохондриях разных органов и тканей млекопитающих разобщающих белков, похожих по своей структуре на РБ-1 бурой жировой ткани. По своей структуре термогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями.На внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью АТФ/ АДФ-антипортера. При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо. Образующиеся свободные жирные кислоты служат не только «топливом», но и важнейшим регулятором разобщения дыхания и фосфорилирования.
41.Нарушения энергетического обмена: гипоэнергетические состояния как результат гипоксии, гипо-, авитаминозов и других причин. Возрастная характеристика энергетического обеспечения организма питательными веществами.
Все живые клетки постоянно нуждаются в АТФ для осуществления различных видов жизнедеятельности. Клетки мозга потребляют большое количество АТФ для синтеза нейромедиаторов, регенерации нервных клеток, поддержания необходимого градиента Na+ и К+, для проведения нервного импульса; почки используют АТФ в процессе реабсорбции различных веществ при образовании мочи; в печени происходит синтез гликогена, жиров, белков и многих других соединений; в миокарде постоянно совершается механическая работа, необходимая для циркуляции крови; скелетные мышцы в покое потребляют незначительные количества АТФ, но при физической нагрузке эти потребности возрастают в десятки раз. Вместе с тем запасов АТФ в клетках практически не существует. Так, в условиях прекращения синтеза АТФ в миокарде его запасы истощаются за несколько секунд. Как мы уже знаем, для постоянного синтеза АТФ клеткам необходим приток метаболитов как субстратов дыхания и кислорода как конечного акцептора электронов в реакциях окисления, сопряжённых с синтезом АТФ. Нарушения какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки. Состояния, при которых синтез АТФ снижен, объединяют термином «гипоэнергетические«. Причинами гипоэнергетических состояний могут быть голодание, гиповитаминозы В1, РР, В2; гипоксия. Гипоксия может возникнуть: при недостатке кислорода во вдыхаемом воздухе; при заболеваниях лёгких и нарушении лёгочной вентиляции; при нарушениях кровообращения, вызванных заболеваниями сердца, спазмом и тромбозом сосудов, кровопотерей. Причинами гипоксии могут быть также наследственные или приобретенные нарушения структуры гемоглобина . Частой причиной гипоэнергетических состояний могут быть нарушения процессов использования кислорода в клетках. Причинами этих нарушений могут быть:
действие ингибиторов и разобщителей в ЦПЭ;
железодефицитные анемии;
снижение уровня гемоглобина и других железосодержащих белков (цитохромов, FeS-белков), в результате чего нарушаются перенос электронов и синтез АТФ;
наследственные дефекты ферментов ЦПЭ и цитратного цикла
studfiles.net
40.Регуляция цепи переноса электронов (дыхательный контроль). Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания
Дыхательный контроль Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз. Общее содержание АТФ в организме 30-50 г, но каждая молекула АТФ в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается. Увеличение концентрации АДФ немедленно приводит к ускорению дыхания и фосфорилирования.
Разобщение дыхания и фосфорилирования Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители — липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ — 2,4-динитрофенол, легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс. Примерами разобщителей могут быть также некоторые лекарства, например дикумарол — антикоагулянт или метаболиты, которые образуются в организме, билирубин — продукт катаболизма тема, тироксин — гормон щитовидной железы. Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Терморегуляторная функция ЦПЭ На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зимнес-пящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования — бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) — термогенин. Бурый жир имеется у новорождённых, но его практически нет у взрослого человека. В последние годы появились факты, свидетельствующие о существовании в митохондриях разных органов и тканей млекопитающих разобщающих белков, похожих по своей структуре на РБ-1 бурой жировой ткани. По своей структуре термогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями.На внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью АТФ/ АДФ-антипортера. При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо. Образующиеся свободные жирные кислоты служат не только «топливом», но и важнейшим регулятором разобщения дыхания и фосфорилирования.
41.Нарушения энергетического обмена: гипоэнергетические состояния как результат гипоксии, гипо-, авитаминозов и других причин. Возрастная характеристика энергетического обеспечения организма питательными веществами.
Все живые клетки постоянно нуждаются в АТФ для осуществления различных видов жизнедеятельности. Клетки мозга потребляют большое количество АТФ для синтеза нейромедиаторов, регенерации нервных клеток, поддержания необходимого градиента Na+ и К+, для проведения нервного импульса; почки используют АТФ в процессе реабсорбции различных веществ при образовании мочи; в печени происходит синтез гликогена, жиров, белков и многих других соединений; в миокарде постоянно совершается механическая работа, необходимая для циркуляции крови; скелетные мышцы в покое потребляют незначительные количества АТФ, но при физической нагрузке эти потребности возрастают в десятки раз. Вместе с тем запасов АТФ в клетках практически не существует. Так, в условиях прекращения синтеза АТФ в миокарде его запасы истощаются за несколько секунд. Как мы уже знаем, для постоянного синтеза АТФ клеткам необходим приток метаболитов как субстратов дыхания и кислорода как конечного акцептора электронов в реакциях окисления, сопряжённых с синтезом АТФ. Нарушения какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки. Состояния, при которых синтез АТФ снижен, объединяют термином «гипоэнергетические«. Причинами гипоэнергетических состояний могут быть голодание, гиповитаминозы В1, РР, В2; гипоксия. Гипоксия может возникнуть: при недостатке кислорода во вдыхаемом воздухе; при заболеваниях лёгких и нарушении лёгочной вентиляции; при нарушениях кровообращения, вызванных заболеваниями сердца, спазмом и тромбозом сосудов, кровопотерей. Причинами гипоксии могут быть также наследственные или приобретенные нарушения структуры гемоглобина . Частой причиной гипоэнергетических состояний могут быть нарушения процессов использования кислорода в клетках. Причинами этих нарушений могут быть:
действие ингибиторов и разобщителей в ЦПЭ;
железодефицитные анемии;
снижение уровня гемоглобина и других железосодержащих белков (цитохромов, FeS-белков), в результате чего нарушаются перенос электронов и синтез АТФ;
наследственные дефекты ферментов ЦПЭ и цитратного цикла
studfiles.net


