Как укрепить иммунитет советует кандидат медицинских наук, аллерголог-иммунолог ЕвроМед
Вы обращали внимание, что некоторые люди могут спокойно сидеть на сквозняке, гулять в мороз в легкой куртке, купаться в холодной реке, общаться с простуженными друзьями, и при этом – не заболевают? В то время как другие берегутся изо всех сил, носят в период эпидемий марлевые маски, кутаются в теплые свитеры и шерстяные носки, и всё равно не вылезают из простуд? С чем это связано? Все дело в иммунитете!
Наш консультант: кандидат медицинских наук, аллерголог-иммунолог Юлия Борисовна СЕЛИХОВА.
Наш иммунитет – это основной механизм защиты организма от вирусов и бактерий. Развитие иммунной системы в процессе эволюции и обусловило саму возможность существования человека. Иммунитет бывает врожденный и адаптивный (приобретенный).
Врожденный иммунитет — это способность организма распознавать и обезвреживать различные бактерии и вирусы по общим признакам.
Признаки иммунного сбоя
- частые ОРЗ
- частые обострения хронический инфекционных заболеваний (тонзиллит, гайморит, бронхит, пиелонефрит, аднексит т. д.)
- частые рецидивы герпетических высыпаний
- гнойничковые поражения кожи
- боли в суставах и мышцах
- продолжительное повышение температуры или отсутствие температурной реакции при острых инфекционных заболеваниях
- увеличение лимфатических узлов
- плохое заживление ран
- злокачественные новообразования
- слабость
- синдром хронической усталости
Иммунная система формируется у человека еще в утробе матери, и немало зависит от наследственности. Но и весьма значительную роль в работе иммунитета играет образ жизни. И если с наследственностью мы сделать ничего не можем, то укрепить иммунитет, выполняя определенные правила, — в наших силах!
Но и весьма значительную роль в работе иммунитета играет образ жизни. И если с наследственностью мы сделать ничего не можем, то укрепить иммунитет, выполняя определенные правила, — в наших силах!
Как укрепить иммунитет?
Закаливание
Закаливание – это, по сути, тренировка иммунной системы. Главный принцип закаливания: умеренность, постепенность и регулярность.
Начните с малого: больше гуляйте, чаще проветривайте квартиру, ходите по дому босиком, обтирайтесь смоченными прохладной водой губкой или полотенцем, умывайтесь прохладной водой. Потом можно переходить к более серьезным процедурам: обливанию холодной водой, контрастному душу. Контрастный душ, кстати, очень полезен и для тренировки сердечно-сосудистой системы, улучшения состояния кожи, профилактики целлюлита. Только не забывайте про осторожность и постепенность! Если у вас уже есть проблемы с сердечно-сосудистой системой, предварительно проконсультируйтесь с вашим кардиологом.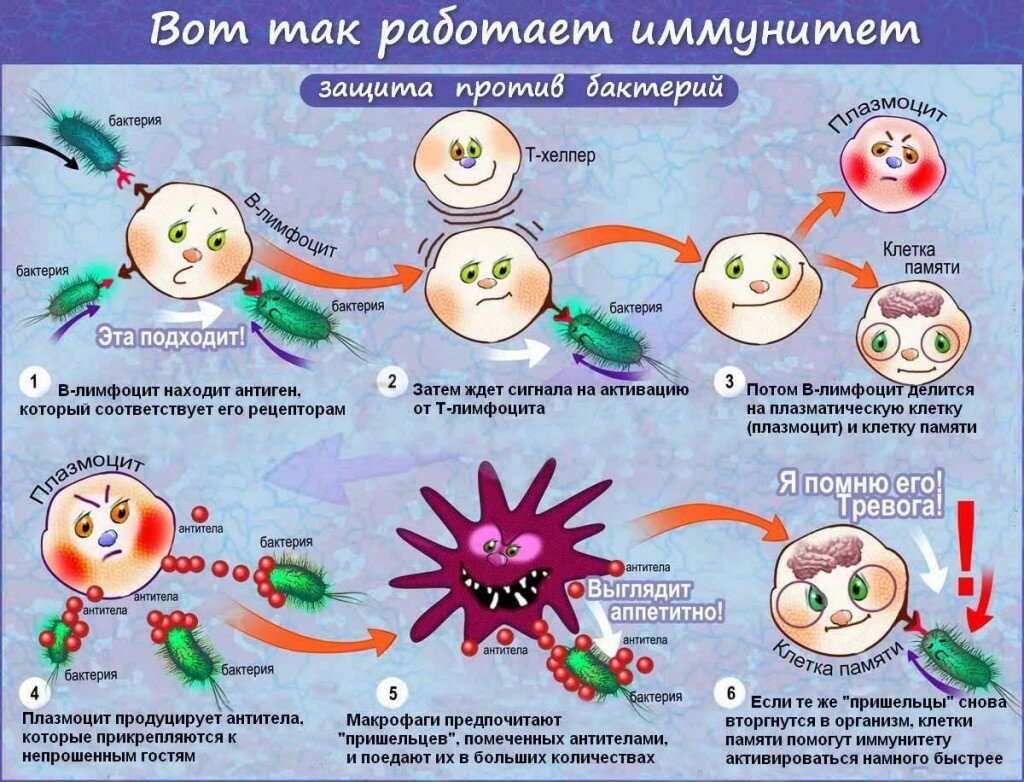
Очень важна регулярность закаливающих процедур, отсутствие между ними больших перерывов.
Начинать закаливающие процедуры можно только, если вы полностью здоровы. В идеале – после консультации с врачом.
Питание
Для укрепления организма необходимо сбалансированное питание, богатое витаминами и микроэлементами. Для того чтобы вы получали все необходимые вещества и микроэлементы, питание должно быть максимально разнообразным. Ежедневно в рационе должны присутствовать все основные группы продуктов: молочные, крахмалистые, овощи, фрукты, источники сложных углеводов, белка и жиров. Сложные углеводы содержатся в крупах, макаронах, картофеле, хлебе с отрубями и в бездрожжевых хлебцах из цельного зерна. Они долго усваиваются, в отличие от простых углеводов, которые содержатся в сахаре, печенье, тортах и прочих сладостях. Также человеку необходимы неперевариваемые углеводы – клетчатка или пищевые волокна. Они создают ощущение сытости, и, кроме этого, полезны для пищеварения.
Помимо этого нашему организму необходимы жиры, поскольку они помогают усваивать витамины А и Е. Если в организме недостаточное количество жиров, хуже выглядит кожа, страдает печень, перестают вырабатываться половые гормоны. Жиры бывают насыщенными и ненасыщенными. Последние лучше усваиваются, соответственно, они более полезны. Их хорошо получать из жирных сортов рыбы, авокадо, миндаля, оливкового масла. Разумеется, употребление продуктов, содержащих скрытые неполезные жиры, такие, как майонез, колбаса, торты, стоит ограничивать.
Источники белка – это рыба, мясо, молочные продукты, яйца, бобовые, орехи, грибы.
Ешьте как можно больше овощей и фруктов, желательно в термически необработанном виде для большей сохранности витаминов.
Витамины и пробиотики
Многочисленные исследования показывают, что в России, да и в других странах тоже, подавляющее большинство людей страдает от гиповитаминоза – нехватки витаминов. Как известно, витамины не образуются в организме человека, за исключением витамина D и витаминов, синтезируемых бактериями кишечника, поэтому должны постоянно присутствовать в составе пищи. Но даже при самом рациональном питании (а будем откровенны – у большинства из нас питание далеко не идеально сбалансированное) рацион человека сегодня «недоукомплектован» витаминами на 20–30%. Усвояемость витаминов из «искусственных» препаратов зачастую выше, чем из обычной еды.
Как известно, витамины не образуются в организме человека, за исключением витамина D и витаминов, синтезируемых бактериями кишечника, поэтому должны постоянно присутствовать в составе пищи. Но даже при самом рациональном питании (а будем откровенны – у большинства из нас питание далеко не идеально сбалансированное) рацион человека сегодня «недоукомплектован» витаминами на 20–30%. Усвояемость витаминов из «искусственных» препаратов зачастую выше, чем из обычной еды.
Соответственно, необходимо регулярно принимать поливитаминные препараты. В период болезней, стрессов, депрессий, повышенной нагрузки, беременности, при курении и злоупотреблении алкоголем, приеме антибиотиков потребность в витаминах возрастает. Продолжительность приема поливитаминов определяется врачом, и обычно составляет 1–3 месяца, курс желательно повторять 2–4 раза в год. Витамины лучше усваиваются, если суточную дозу разделить на несколько приемов, основной прием препаратов лучше назначить на первую половину дня, так как вечером и ночью обмен веществ в организме замедляется. Поскольку человек всегда получал витамины из пищи, лучше принимать витаминные препараты во время еды, так они усваиваются полнее.
Поскольку человек всегда получал витамины из пищи, лучше принимать витаминные препараты во время еды, так они усваиваются полнее.
Помимо витаминов, для укрепления иммунной системы важны пробиотики. Пробиотики – это лекарственные препараты или биологически активные добавки к пище, которые содержат в составе живые микроорганизмы, являющиеся представителями нормальной микрофлоры человека. Они призваны восстановить нарушенный баланс микроорганизмов, населяющих различные слизистые человека, и поэтому применяются для лечения и профилактики иммунодефицита, дисбактериозов и связанных с ними заболеваний.
Пробиотики стимулируют иммунную систему на всех уровнях, что доказано многочисленными клиническими исследованиями. Пробиотики и витамины не стоит назначать себе самостоятельно, лучше, если это сделает врач.
Режим и физическая активность
Для нормальной работы всего организма и хорошего самочувствия человека очень важен режим.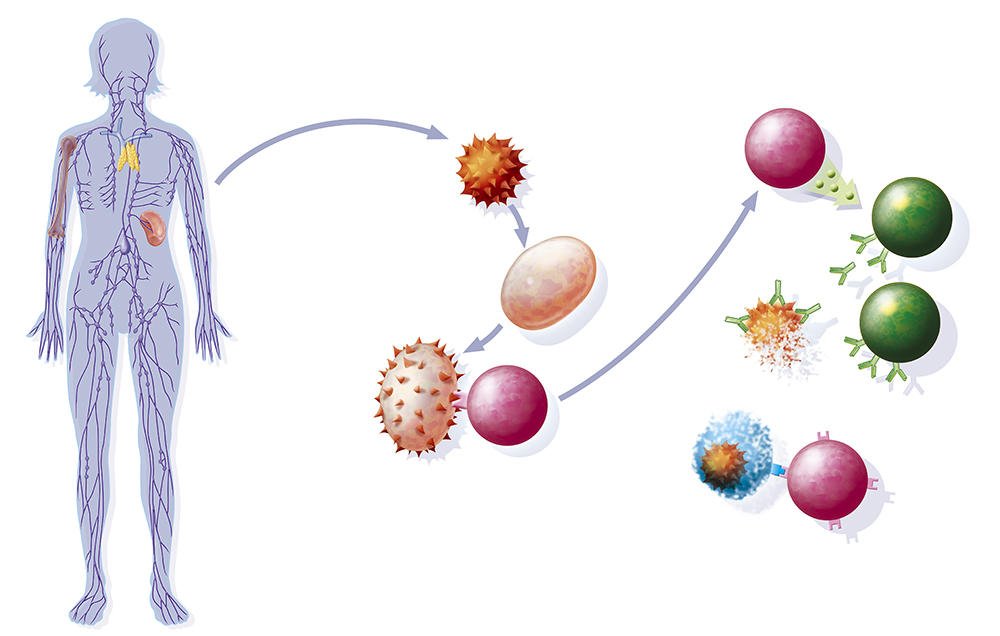
Старайтесь вставать и ложиться в одно и то же время, высыпаться. Больше отдыхать, гулять на свежем воздухе. Необходимо заниматься спортом, делать зарядку.
Регулярная физическая активность благотворно влияет на иммунитет. Во время активной физической нагрузки повышается общий тонус организма, улучшается настроение, что способствует большей активности и приливу энергии, кровь обогащается кислородом, улучшаются сон и аппетит. Физические нагрузки помогают избавиться от стресса, в организме вырабатываются эндорфины («гормоны счастья»).
И обязательно гуляйте на свежем воздухе. Если позволяет погода, постарайтесь проводить на улице не менее часа в день. В идеале – в светлое время суток, ведь солнце необходимо не только для выработки витамина D, без солнечного света понижается уровень серотонина (еще одного «гормона счастья») в крови, который отвечает за наше хорошее настроение. Осенью и зимой проблема нехватки солнечного света особенно актуальна – мы встаем затемно, выходим с работы уже после захода солнца.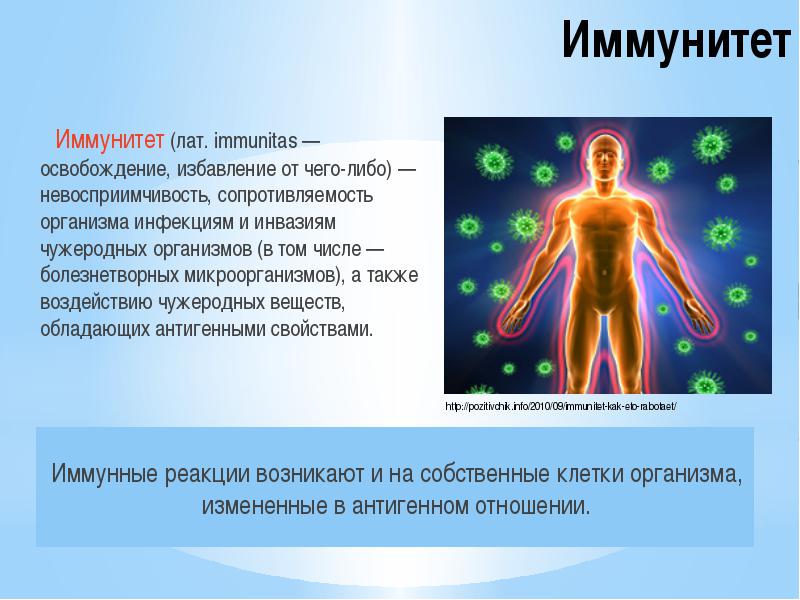
Отказ от вредных привычек
Вредные привычки – курение, алкоголь, злоупотребление лекарственными и наркотическими препаратами – очень сильно ослабляют иммунную систему организма, ухудшают функционирование многих органов, губят сосуды, мозг, легкие, повышают риск развития заболеваний. По сути, если вы постоянно себя травите курением, алкоголем и пр., сложно ожидать от организма хорошего состояния. Алкоголь и никотин угнетают иммунитет, в результате чего он перестает выполнять свои защитные функции. Кстати, ослаблять иммунитет могут и многие лекарственные препараты, поэтому, во-первых, не стоит бездумно принимать таблетки без назначения врача, во-вторых, если вы принимаете лекарства, усильте меры по укреплению иммунной системы.
Позитивный жизненный настрой
Между физической и эмоциональной составляющими у людей есть теснейшая взаимосвязь. Если человеку жизнь не приносит радость и удовольствие, то запускаются биологические механизмы самоуничтожения. Будьте позитивны, радуйтесь каждому дню — для этого всегда есть повод. Умение позитивно воспринимать любую действительность — это без преувеличения залог здоровья и долголетия.
Если человеку жизнь не приносит радость и удовольствие, то запускаются биологические механизмы самоуничтожения. Будьте позитивны, радуйтесь каждому дню — для этого всегда есть повод. Умение позитивно воспринимать любую действительность — это без преувеличения залог здоровья и долголетия.
Надеемся, что наши советы помогут вам стать более здоровыми, и предстоящий осеннее-зимний сезон принесет вам только радость, а не болезни!
Иммунитет и его значение для здоровья человека
Иммунитет и его значение для здоровья человека
- Опубликовано: 01.11.2019 11:15
Иммунитет человека – это состояние невосприимчивости к различным инфекционным и вообще инородным для генетического кода человека организмам и веществам. Иммунитет организма определяется состоянием его иммунной системы, которая представлена органами и клетками.  Лимфатические узлы и лимфоидная ткань в других органах (например, в миндалинах, в аппендиксе) – это периферические органы иммунной системы. Основная задача органов иммунной системы человека – выработка различных клеток, таких как Т- и В-лимфоциты, нейтрофилы, макрофаги, эозинофилы.
Лимфатические узлы и лимфоидная ткань в других органах (например, в миндалинах, в аппендиксе) – это периферические органы иммунной системы. Основная задача органов иммунной системы человека – выработка различных клеток, таких как Т- и В-лимфоциты, нейтрофилы, макрофаги, эозинофилы.
Различают иммунитет неспецифический (или врожденный) – например, работа нейтрофилов в любой реакции воспаления с образованием гнойного отделяемого и специфический (приобретенный) – например, выработка антител к вирусу гриппа. Кроме того различают виды иммунитета, связанные с медицинской деятельностью человека:
— естественный – появившийся в результате болезни человека, например, иммунитет после ветрянки,
— искусственный – появившийся в результате прививок, то есть введения ослабленного микроорганизма в организм человека, в ответ на это в организме вырабатывается иммунитет.
Хороший иммунитет – это состояние полной невосприимчивости к различным инородным агентам.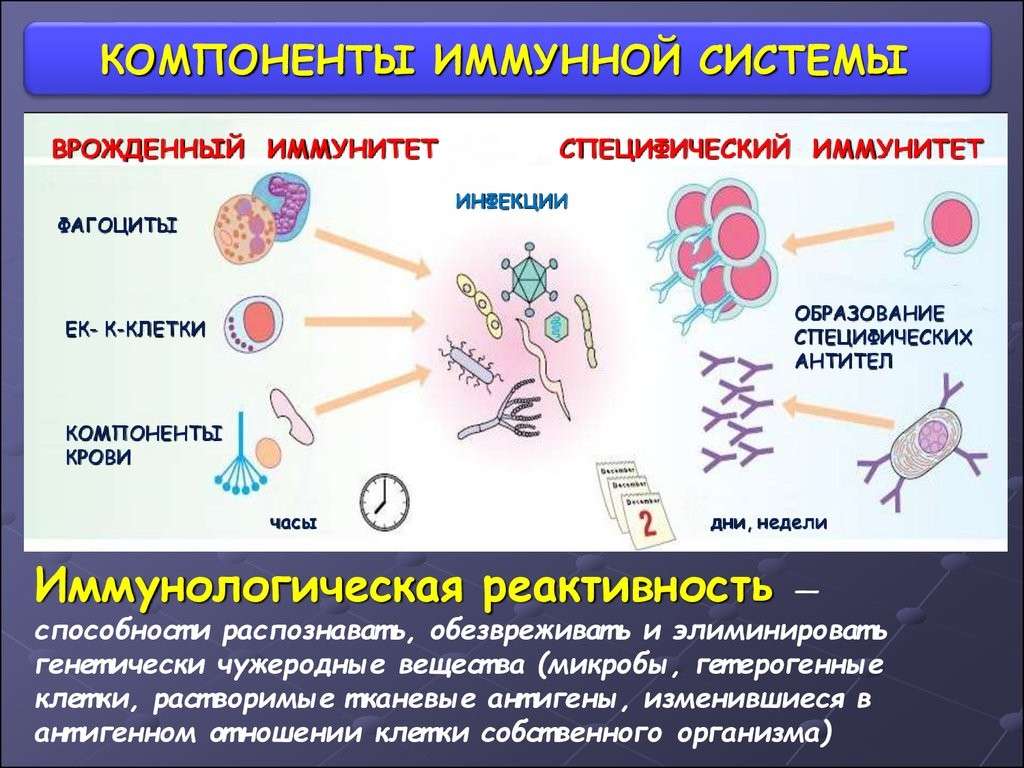 Внешне это проявляется отсутствием инфекционных заболеваний, здоровьем человека. Внутренне это проявляется полной работоспособностью всех звеньев клеточного и гуморального звена.
Внешне это проявляется отсутствием инфекционных заболеваний, здоровьем человека. Внутренне это проявляется полной работоспособностью всех звеньев клеточного и гуморального звена.
Слабый иммунитет – это состояние восприимчивости к инфекционным заболеваниям. Проявляется слабой реакцией того или иного звена, выпадением отдельных звеньев, неработоспособностью тех или иных клеток. Причин его снижения может быть довольно много. Следовательно, и лечить его надо, устраняя все возможные причины.
Причины и признаки снижения иммунитетаПричин, по которым происходит сбой иммунной системы, очень много. Это плохая экологическая среда проживания, прием антибиотиков, стрессы, плохое питание, недостаток витаминов в организме, физические и умственные нагрузки, недосыпание, инфекции, вредные привычки, паразиты, дисбактериоз. Большое влияние на иммунитет оказывает климат и смена времени года. Весна и осень — это тот период, когда организм нуждается в особой защите.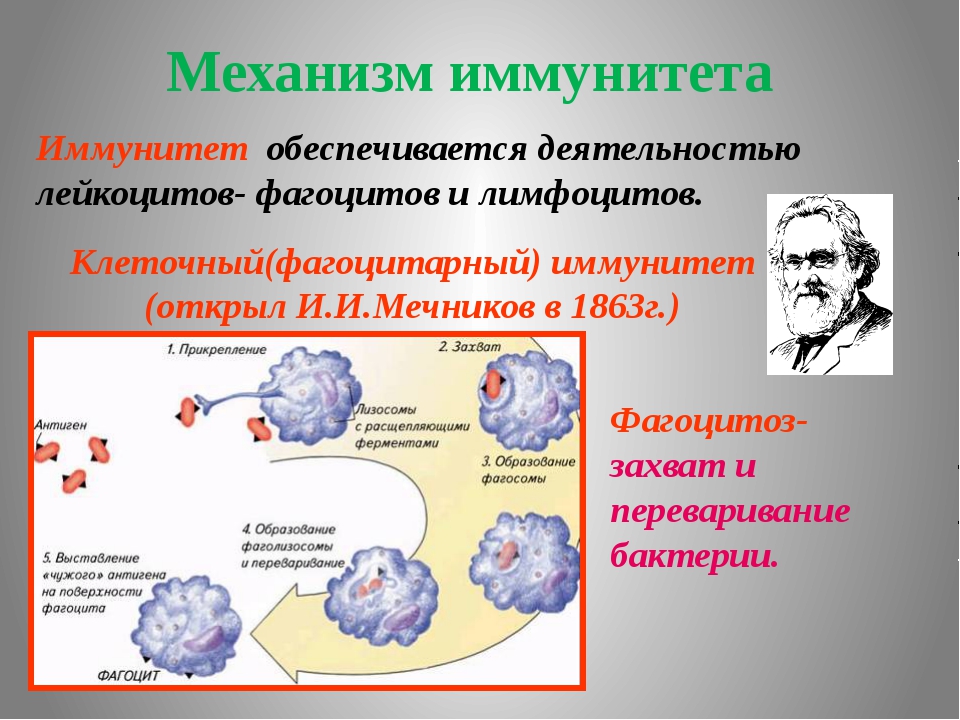 Для беременных, кормящих женщин, новорожденных детей и людям пожилого возраста поддержание иммунитета в это время особенно важно. К признакам снижения иммунитета относят: хроническую усталость, головные боли, сонливость, учащенные простудные заболевания, длительная субфебрильная температура тела 37-38 градусов.
Для беременных, кормящих женщин, новорожденных детей и людям пожилого возраста поддержание иммунитета в это время особенно важно. К признакам снижения иммунитета относят: хроническую усталость, головные боли, сонливость, учащенные простудные заболевания, длительная субфебрильная температура тела 37-38 градусов.
Вопрос о повышение иммунитета актуален среди любых контингентов населения, несмотря на то, взрослый это человек или ребенок, мужчина или женщина, так как крепкий иммунитет — это многофакторная защита от любого заболевания. Мало кто из нас соблюдает правильно питание, правильный режим дня, не все из нас имеют полноценный сон-отдых, но зато каждого из нас окружает одно — вредные привычки. Все это и является первопричинами снижения иммунитета, что в последующем приводит к различным заболеваниям. Чтобы этого избегать, достаточно придерживаться некоторых правил, рекомендаций, которые постепенно войдут в привычную жизнь и заметно улучшат работу иммунной системы.
Во-первых — это витаминизированное, сбалансированное правильное питание. Правильнее всего питаться дробно, но 4-5 раз в сутки, небольшими порциями. В питание должны быть включены преимущественно свежие фрукты, овощи, кисло-молочные продукты, фитонциды (лук, чеснок), зелень, морепродукты и сухофрукты. Следовало бы отказаться от постоянного приема полуфабрикатов, сосисок, колбас, жирного мяса и прочего. Лучше всего эти продукты заменить свежей рыбой.
Во-вторых — это полноценный отдых. У каждого человека должен быть 8-ми часовой ночной отдых, а также отдых в обед от 30 минут до 1 часа.
В-третьих — избегать стрессовых ситуаций, различного рода напряжений, загруженности на работе.
В-четвертых — нужно избавиться от вредных привычек, таких как бесконтрольный прием кофе, курение, алкоголизм, а в некоторых случаях — и наркомания. Параллельно с этим, следовало бы пролечить все хронические инфекционные и воспалительные заболевания в организме, которые приводят к снижению иммунитета.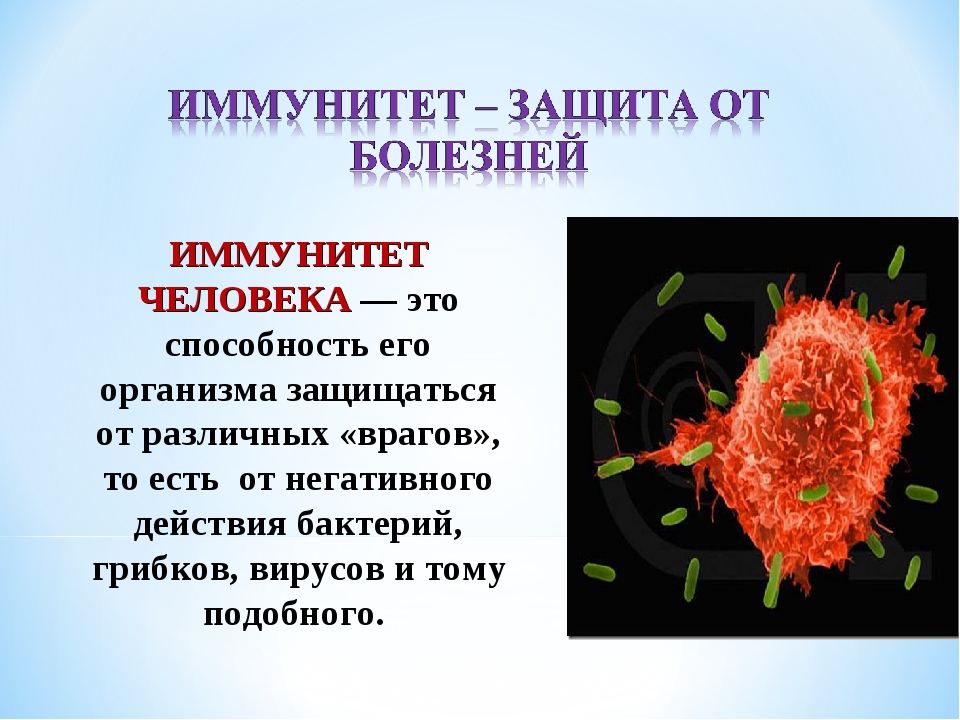
В-пятых – это активный образ жизни и занятие спортом. Даже небольшой комплекс физических упражнений позволит не только сохранить и укрепить иммунитет, но и значительно его повысить.
В-шестых – это закаливание. Закаливание известно уже очень давно, но необходимо помнить, что эффект начинает появляться только через месяц, а при прекращении процедур закаливания теряется уже на 5-7 день.
В седьмых – это – прививки. У маленьких детей детские инфекции способны привести к тяжелым и опасным для жизни осложнениям, поэтому ребенка следует прививать в соответствии с календарем прививок. При угрозе эпидемии гриппа и при поездке в опасные регионы также следует привиться.
Значение иммунитета для человека сложно переоценить. Нормально функционирующий иммунитет должен защищать организм от проникновения любых чужеродных тел и веществ. Эту задачу и выполняет иммунная система человека — специализированная система клеток, тканей и органов, чутко реагирующая на внедрение чужеродного агента.
Профессор Сизякина объяснила, как определить силу своего иммунитета
Почему одни люди болеют и даже сильно? А другие на морозе целый день — и хоть бы насморк подхватили! Об этом мы расспросили главного иммунолога-аллерголога Ростовской области, директора НИИ клинической иммунологии, Заслуженного врача России, профессора Людмилу Сизякину.
Как узнать, Людмила Петровна, сильный или слабый у человека иммунитет, стоит ли ему уповать на защитные силы своего организма?
Людмила Сизякина: Сбой в работе иммунной системы проявляется клинической картиной. Например, человек часто болеет респираторно-вирусными инфекциями.
Или у него есть очаги хронических заболеваний, которые часто обостряются. Например, бронхит по два раза в год, воспаление легких. Или тот же герпес любой локализации, различные фурункулы, гнойники. Это значит, что иммунная защита имеет брешь. Все это — клиническая верификация недостаточности работы иммунной системы. И нужно обязательно идти к врачу и найти, какое звено мешает нормально работать иммунитету.
И нужно обязательно идти к врачу и найти, какое звено мешает нормально работать иммунитету.
Если человека ничего не беспокоит и ведет он здоровый образ жизни, полноценно питается, то можно говорить о крепком иммунитете.
Что нужно, чтобы поддерживать это состояние?
Людмила Сизякина: Важно потребление большого количества белковой пищи. Поскольку белки это и есть тот субстрат, из которого синтезируются иммуноглобулины, защитные антитела. Поэтому те, кто стремится похудеть и ограничивает себя в полноценной пище, ставит организм в стрессовое состояние, а это пагубно воздействует на здоровье.
Важен в целом здоровый образ жизни, витамины и хорошие эмоции. Иммунная система очень подвержена негативным стрессам. Поэтому нужно устраивать маленькие праздники для себя, любоваться картинами, по возможности ходить на театральные постановки и выставки, общаться с друзьями. Нужно радоваться жизни и избегать стрессов.
В организме есть три кита иммунной устойчивости, которые поддерживают постоянство внутренней среды: нервная система, эндокринная и желудочно-кишечный тракт — колыбель многообразнейшего микробиома человека. Как только происходит перегрузка нервной система — человек живет в стрессовой ситуации, полон отрицательных эмоций- его иммунитет тут же падает.
Как только происходит перегрузка нервной система — человек живет в стрессовой ситуации, полон отрицательных эмоций- его иммунитет тут же падает.
Сегодня в аптеках продается множество волшебных иммуностимулирующих и иммуноукрепляющих снадобий. Стоит ли им верить? Выпил — и получил иммунитет?
Людмила Сизякина: На самом деле вмешиваться в работу иммунной системы очень опасно, это можно делать только по строгим показаниям, которые знают иммунологи.
Могу посоветовать лишь общеукрепляющие препараты — витамины, адаптогены, антиоксиданты, препараты, нормализующие микробиом кишечника. Не стоит заниматься самолечением, всегда обращайтесь к специалистам!
Все материалы сюжета «COVID-19. Мы справимся!» читайте здесь.
Как повысить иммунитет: поднятие иммунитета: закаливание, диета и другие способы укрепления организма
Благодаря иммунитету наше тело способно распознавать и блокировать любой чужеродный фактор, оказывающий влияние на наше здоровье. Иммунная система защищает нас от различных инфекций, позволяет эффективно противостоять болезням и быстрее выздоравливать, поддерживая организм в хорошей форме.
Иммунная система защищает нас от различных инфекций, позволяет эффективно противостоять болезням и быстрее выздоравливать, поддерживая организм в хорошей форме.
После первичного заражения иммунитет может навсегда защитить нас от целого ряда заболеваний. Например, от краснухи и кори. Именно поэтому поддержание высокого иммунного статуса — одна из приоритетных задач для каждого человека, заботящегося о своем здоровье.
Закаливание
Иммунная система человека состоит из различных звеньев: гуморального, клеточного, фагоцитарного. Недостаточное или избыточное функционирование даже одного из них может привести к серьезным нарушениями в работе всего организма. Сегодня существует множество способов укрепления иммунитета; одним из наиболее эффективных является закаливание.
Однако, практикуя этот метод, необходимо помнить главное правило: закаливание должно происходить постепенно. В противном случае мероприятия по поднятию иммунитета могут привести к прямо противоположному результату. Прежде чем начать процесс закаливания, нужно точно убедиться, что ваш организм готов к этому. Для начала нужно обливать холодной водой ноги, потом пояс, и только после этого можно принять холодный душ полностью.
Прежде чем начать процесс закаливания, нужно точно убедиться, что ваш организм готов к этому. Для начала нужно обливать холодной водой ноги, потом пояс, и только после этого можно принять холодный душ полностью.
Диета
Другой метод повышения иммунитета — это правильное и здоровое питание. Пища должна быть разнообразной и качественной. Нужно часто употреблять мясо и рыбу, так как эти продукты положительно влияют на иммунитет. Очень полезны овощи, фрукты, ягоды и зелень. Также для организма человека важны кисломолочные продукты, ведь они усиливают выработку интерферонов — белков, обеспечивающих защиту клеток от патогенных вирусов.
Укрепляющим воздействием на иммунитет обладает оливковое масло, поэтому следует время от времени включать его в рацион. Зеленый чай способствует выведению из организма радионуклидов. Негативное воздействие на иммунитет оказывают диеты, голодание, а также и избыточный вес. Вред организму наносят и продукты с высоким содержанием сахара.
Витамины для поднятия иммунитета
Помимо обычных продуктов, полезных для иммунной системы, существуют и специальные витамины для поднятия иммунитета. Витамины играют чрезвычайно важную роль в обеспечении защитной функции организма. Например, если в организме человека не хватает витамина А, снижается реакция на инородные белки. Витамин С также чрезвычайно важен для иммунитета, так как он регулирует скорость выработки антител, которые необходимы для защиты организма от инфекций.
Основные витамины для поднятия иммунитета — А, В5, F, C, PP, D. Это наиболее важные витамины, поэтому необходимо, чтобы организм не испытывал недостатка в них.
Приём аллерголога-иммунолога в наших клиниках
Как укрепить иммунитет в домашних условиях?
Врач отделения медицинской профилактики ГКБ N°11 Ольга Орлова рассказала об иммунитете и способах его укрепления в период сезонных заболеваний.
7 апреля отмечается Всемирный день здоровья.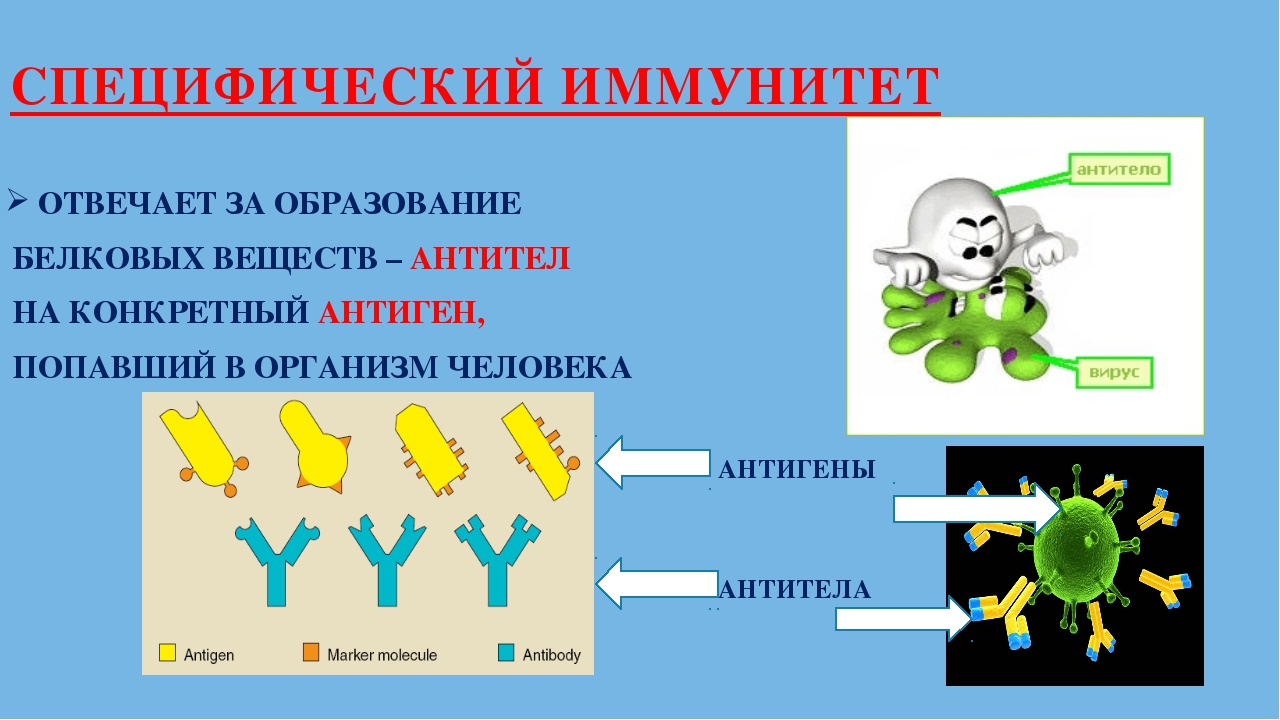 Праздник учредили в 1948 году по инициативе Всемирной организации здравоохранения (ВОЗ). Цель – напомнить людям о необходимости заботиться о своём здоровье. О том, что такое иммунитет и как его укрепить в период сезонных заболеваний, рассказывает врач отделения медицинской профилактики ГКБ N°11 Ольга Викторовна Орлова.
Праздник учредили в 1948 году по инициативе Всемирной организации здравоохранения (ВОЗ). Цель – напомнить людям о необходимости заботиться о своём здоровье. О том, что такое иммунитет и как его укрепить в период сезонных заболеваний, рассказывает врач отделения медицинской профилактики ГКБ N°11 Ольга Викторовна Орлова.
Иммунитет – это, с одной стороны, невосприимчивость организма к возбудителям инфекционных заболеваний, а с другой стороны, способность удалять чужеродную субстанцию из организма. Это относится не только к внешним врагам – бактериям, паразитам, вирусам, грибам и т.д. В определённых условиях собственные клетки могут стать опасными для организма, например, переродившись в раковые. Поэтому задачей иммунитета является защита организма от любой угрозы, независимо от того, откуда она исходит.
Если иммунитет находится в нормальном состоянии, то человек даже не замечает, что внутри его организма происходит «борьба». Однако если иммунитет ослаблен, то он просто не справляется с вирусами, и человек заболевает.
Однако если иммунитет ослаблен, то он просто не справляется с вирусами, и человек заболевает.
О снижении иммунитета человека можно судить по некоторым признаками:
- Быстрое утомление, слабость, чувство разбитости. После пробуждения утром человек не чувствует себя отдохнувшим.
- Частое повторение острых респираторных инфекций. Чаще чем 3-4 раз в год.
- Возникновение аллергических, аутоиммунных, онкологических заболеваний.
При появлении таких симптомов возникает вопрос: «Чем поднять иммунитет взрослому человеку?». Повысить иммунитет помогут специальные иммуноукрепляющие средства, но принимать их можно только после консультации с врачом. Существуют и другие дополнительные способы его поддержания.
Что укрепляет иммунитет человека, кроме иммуномодуляторов?
Правильное питание. Это очень важный фактор, который способствует улучшению защитных сил организма. Питание должно быть как минимум трёхразовым. Пища – разнообразной, для того чтобы в организм поступало достаточное количество витаминов и микроэлементов. Положительное влияние на работу иммунной системы оказывает употребление говяжьей печени, мёда, морепродуктов. Не забывайте про пользу пряностей, таких как имбирь, гвоздика, кориандр, корица, кардамон, хрен, лавровый лист.
Питание должно быть как минимум трёхразовым. Пища – разнообразной, для того чтобы в организм поступало достаточное количество витаминов и микроэлементов. Положительное влияние на работу иммунной системы оказывает употребление говяжьей печени, мёда, морепродуктов. Не забывайте про пользу пряностей, таких как имбирь, гвоздика, кориандр, корица, кардамон, хрен, лавровый лист.
Мультивитаминные комплексы помогут восполнить недостаток витаминов и минералов, но желательно их получать естественным путём. Например, витамин А содержится во всех красных и оранжевых фруктах и овощах. Витамином С богаты цитрусовые, шиповник, клюква, квашеная капуста. Источником витамина Е являются подсолнечное, оливковое или кукурузное масла. Витамины группы В содержатся в бобовых, крупах, яйцах, зелени и орехах. Наиболее необходимыми микроэлементами для иммунитета являются цинк и селен. Восполнить недостаток цинка можно употребляя рыбу, мясо, печень, орехи, фасоль и горошек. Источником селена являются рыба, морепродукты, чеснок. Пополнить организм минеральными веществами – железом, медью, магнием и цинком – можно, употребляя субпродукты, орехи, бобовые и шоколад.
Пополнить организм минеральными веществами – железом, медью, магнием и цинком – можно, употребляя субпродукты, орехи, бобовые и шоколад.
Никакие способы повышения иммунитета человека не принесут результата, если не бороться с вредными привычками. Как курение, так и употребление алкоголя очень негативно сказываются на состоянии иммунной системы.
Без полноценного и здорового сна невозможно хорошее самочувствие и поддержание высокого уровня иммунитета. Продолжительность сна должна быть не менее 7-8 часов в день, в зависимости от потребностей организма. От недосыпания может развиться «синдром хронической усталости», что становится причиной постоянной слабости, быстрой утомляемости, депрессий, плохого настроения. Такое состояние грозит резким снижением защитных функций организма.
Всем известно, что хорошо повышает иммунитет человека физическая активность. Движение особенно необходимо людям, которые имеют сидячую работу. Полезными будут пешие прогулки в быстром темпе. Замечательным средством для поддержания иммунной системы является йога.
Полезными будут пешие прогулки в быстром темпе. Замечательным средством для поддержания иммунной системы является йога.
Всем известный способ усиления иммунитета – закаливание. Самая простая форма – это контрастный душ. Но не следует сразу же обливаться ледяной водой, для начала достаточно чередования горячей и прохладной воды.
Стресс – главный враг иммунитета, который может спровоцировать возникновение сахарного диабета, сердечно-сосудистых заболеваний, вызвать гипертонический криз. Совет может быть только один: научитесь спокойно относиться ко всему, что бы ни происходило. Это особенно важно сейчас, когда огромное количество негативной, тревожной информации льётся с экранов телевизора и других средств массовой информации. Не паникуйте!
Занимайтесь любыми практиками, которые помогают снизить напряжение. Психологическая помощь, физическая активность, дыхательные практики, медитация, любые ритмичные, повторяющиеся действия (мытьё рук несколько раз в день тоже подойдёт).
Ищите поддержку. Сохраняйте связи с людьми. Если вы знаете, что кто-то из близких склонен паниковать, а вам сейчас и так нелегко, поищите кого-то более спокойного, кто будет готов выслушать вас (группы в социальных сетях могут быть более поддерживающими, чем разговор с тревожным родственником).
Занимайтесь тем, что вас увлекает. Это может быть работа или хобби, просмотр фильма, музыка, компьютерная игра, приготовление еды, что угодно, что вовлекает вас и удерживает внимание. Что бы ни случилось, не забывайте мудрую фразу с кольца царя Соломона: «Всё проходит, пройдет и это».
Иммунитет очень — странный предмет
Плохая экология, стрессы, неполноценное питание — всё это ослабляет защитные силы организма, делает его уязвимым, особенно в весенний период. В результате все мы быстрее устаем и чаще болеем. А для того, чтобы суметь противостоять всем этим негативным факторам жизни, необходимо иметь просто железное здоровье и хороший иммунитет.
Само слово «Иммунитет» происходит от латинского слова «immunitas» и означает – освобождение. Иммунитет – способность иммунной системы сохранять целостность и постоянство внутренней среды организма. Иммунная система отвечает за два важных процесса: замену трансформированных или поврежденных клеток различных органов тела и защиту от проникновения разного рода чужеродных агентов. Таким путем обеспечивается противоинфекционная, противоопухолевая защита и генетическая стабильность организма.
Начало весны – приятное и долгожданное время года, когда природа вокруг нас начинает оживать. Но не стоит забывать о том, что наш иммунитет, напряженно работая всю зиму, стоит в преддверии нового периода не менее серьезных испытаний. Ведь именно в это время, когда человеку нужны силы и энергия, в организме снижается обмен веществ, истощается запас витаминов и минеральных веществ, уменьшается сопротивляемость инфекциям. Иными словами, слабеет иммунитет.
Само слово «Иммунитет» происходит от латинского слова «immunitas» и означает «освобождение». Иммунитет – способность иммунной системы сохранять целостность и постоянство внутренней среды организма. Нашу способность к выживанию обеспечивает иммунная система, которая призвана защищать нас от различных бактерий, вирусов, аллергенов, а также сохраняет видовой иммунитет homo sapiens. Иммунная система – это миллиарды клеток, комплекс органов и тканей, разбросанных по всему организму. Главный орган этой системы – костный мозг. Ослабление иммунитета делает человеческий организм уязвимым даже для незначительной инфекции. Очень опасны для иммунной системы аутоиммунные заболевания – недуги, при которых иммунитет путается и начинает подвергать нападениям собственные клетки. К таким заболеваниям относятся сахарный диабет, отдельные болезни щитовидной железы и многие другие.
Иммунитет – способность иммунной системы сохранять целостность и постоянство внутренней среды организма. Нашу способность к выживанию обеспечивает иммунная система, которая призвана защищать нас от различных бактерий, вирусов, аллергенов, а также сохраняет видовой иммунитет homo sapiens. Иммунная система – это миллиарды клеток, комплекс органов и тканей, разбросанных по всему организму. Главный орган этой системы – костный мозг. Ослабление иммунитета делает человеческий организм уязвимым даже для незначительной инфекции. Очень опасны для иммунной системы аутоиммунные заболевания – недуги, при которых иммунитет путается и начинает подвергать нападениям собственные клетки. К таким заболеваниям относятся сахарный диабет, отдельные болезни щитовидной железы и многие другие.
Иммунная система отвечает за два важных процесса: замену трансформированных или поврежденных клеток различных органов тела и защиту от проникновения разного рода чужеродных агентов. Таким путем обеспечивается противоинфекционная, противо-опухолевая защита и генетическая стабильность организма.
Иммунитет можно назвать телохранителем организма, благодаря которому он противостоит огромному числу вирусов. А частые простуды, быстрая утомляемость, обострение существующих хронических заболеваний – это показатели снижения иммунитета. Это как раз та грань, когда человек, уставший от бесконечных проблем со здоровьем, начинает задумываться, как же повысить иммунитет.
Существует врожденный иммунитет – генетически наследуемая невосприимчивость к болезни, и приобретенный – накапливаемый в течение всей жизни после перенесенных недугов или прививок.
Признаки неполадок в иммунной системе – частые простудные заболевания, бронхиты, воспаления в носоглотке, длительная повышенная температура, расстройство работы желудочно-кишечного тракта, дисбактериозы. Если вы заподозрили у себя снижение иммунитета, обратитесь к врачу-иммунологу. В целом организм, и иммунитет в частности, укрепляют хорошее питание, здоровый сон, движение, отказ от курения и алкоголя, а также бережное отношение к своей психике и гигиена.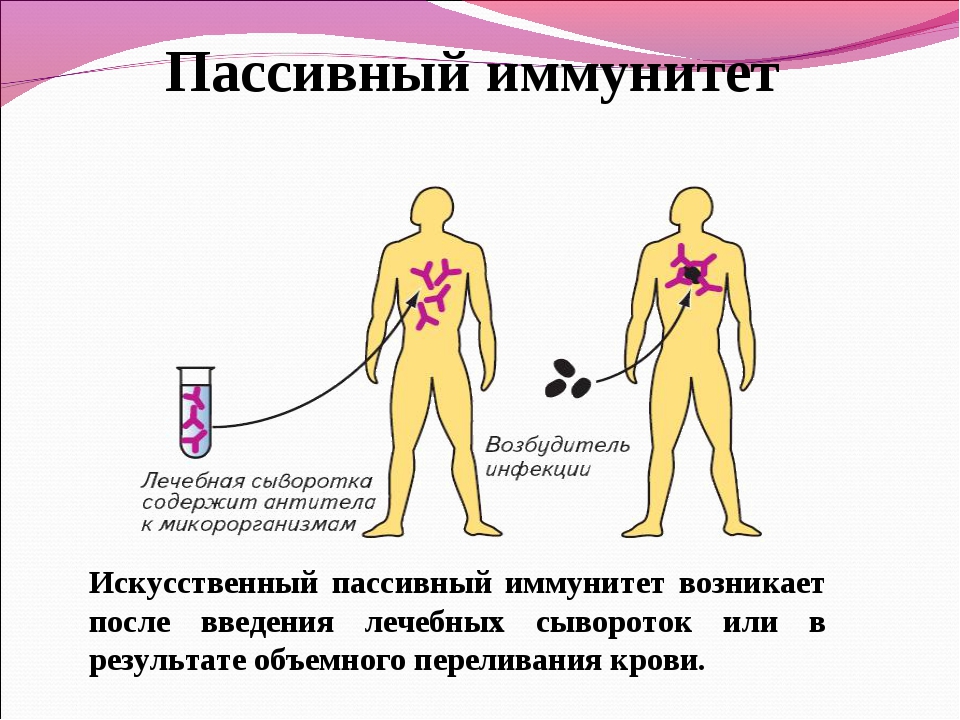 Именно гигиена закрывает «ворота» для инфекции – рот, нос, кожа, желудок. Однако неспецифические меры профилактики, повышающие иммунитет, в большинстве случаев не в состоянии защитить от инфекции. Чай с малиновым вареньем, конечно, серьезный аргумент в пользу борьбы с простудой, но он не заменит благотворного действия вакцины на здоровье. Вакцинация способствует созданию искусственного специфического иммунитета. Специалисты утверждают, что прививки надо делать обязательно, чтобы предупредить серьезные заболевания, летальный исход от которых высок.
Именно гигиена закрывает «ворота» для инфекции – рот, нос, кожа, желудок. Однако неспецифические меры профилактики, повышающие иммунитет, в большинстве случаев не в состоянии защитить от инфекции. Чай с малиновым вареньем, конечно, серьезный аргумент в пользу борьбы с простудой, но он не заменит благотворного действия вакцины на здоровье. Вакцинация способствует созданию искусственного специфического иммунитета. Специалисты утверждают, что прививки надо делать обязательно, чтобы предупредить серьезные заболевания, летальный исход от которых высок.
Нарушения в работе иммунной системы приводит к таким тяжелым нарушениям, как рак, аллергия, коллагенозы и другие. К сожалению, в условиях цивилизации иммунитет человека ослабевает и не всегда способен защитить его от всевозможных заболеваний.
Факторов, подрывающих иммунную систему, очень много: длительный стресс; голодание и нерациональное питание; дефицит витаминов и микроэлементов; физические перегрузки; перенесенные травмы, ожоги, операции; загрязнение окружающей среды; бесконтрольное употребление лекарств.
Одной из основополагающих причин снижения иммунитета современного человека является плохая экология (вода, воздух, инсектициды, гербициды, радионуклиды). Наши бабушки и дедушки жили в лучших экологических условиях, поэтому не простужались от открытой форточки и не «схватывали» ангину от глотка холодной воды.
Также в последнее время наблюдается активное распространение бактерий, вирусов, грибков и других паразитов и простейших. Даже бактерии, которые считались ранее условно патогенными, начали проявлять повышенную агрессивность.
И если вышеозначенные причины ослабления иммунитета имеют не зависящую от человека природу (однако вызваны именно его воздействием на природу), то следующие причины мы вполне можем контролировать самостоятельно.
Не секрет, что немалое значение для состояния иммунитета имеет питание, точнее, некачественная, искусственная пища, которую мы употребляем в пищу. Фастфуд, чипсы и подобное содержит более 1000 наименований консервантов, стабилизаторов, красителей и разрыхлителей, которые просто не могут пагубно не сказаться на здоровье. Продукты с высоким содержанием сахара, в свою очередь, ослабляют способность защитных свойств организма бороться с внешними факторами. Кислые, сладкие шипучие напитки с заменителями сахара разрушают наш гомеостаз (постоянство внутренней среды). Они отравляют водную среду клеточных и межклеточных пространств, разрушая иммунитет.
Продукты с высоким содержанием сахара, в свою очередь, ослабляют способность защитных свойств организма бороться с внешними факторами. Кислые, сладкие шипучие напитки с заменителями сахара разрушают наш гомеостаз (постоянство внутренней среды). Они отравляют водную среду клеточных и межклеточных пространств, разрушая иммунитет.
У женщин сокрушительный удар по иммунитету наносят голодания и вечные диеты. Вообще же, на иммунитете пагубно отражаются как избыточный вес, так и недостаточный. Так что не следует ни голодать, ни переедать.
Дефицит витаминов и микроэлементов, особенно базовых, жизненно-необходимых, которые участвуют в ферментативном обмене (таких, например, как цинк и селен), тоже приводит к ослаблению иммунной системы. Дефицит витамина A ослабляет иммунную реакцию организма на проникновение чужеродного белка. Витамины группы В помогают стимулировать иммунную активность в периоды физического стресса и упадка сил. При резком падении уровня витамина В способность организма вырабатывать антитела для уничтожения инфекции существенно понижается. Дефицит витамина C может иметь различное негативное влияние на иммунитет: ослаблять реакцию защитных свойств на сигнал о патологическом состоянии, уменьшать скорость выработки антител для борьбы с инфекцией.
Дефицит витамина C может иметь различное негативное влияние на иммунитет: ослаблять реакцию защитных свойств на сигнал о патологическом состоянии, уменьшать скорость выработки антител для борьбы с инфекцией.
Последние исследования врачей показали, что любой антибиотик, даже если он употребляется по назначению, понижает иммунитет организма на 50-75 процентов! Поэтому совет: ни в коем случае не занимайтесь самолечением и не приобретайте антибиотики в аптеках «на свой вкус», даже если они продаются без рецепта.
Часто причинами ослабления иммунитета называют постоянные стрессы, сопровождающие любого современного человека активного возраста. Стрессов не избежать – это факт. Но зато им можно научиться противостоять. Так же, как можно и нужно постараться таким образом организовать режим своей жизни, чтобы факторы, подобные физическим и умственным перегрузкам и хроническому недосыпанию, не имели возможность ослаблять наш иммунитет.
Семь мифов об иммунитете
Миф №1. Витамин C укрепляет иммунитет
Витамин C укрепляет иммунитет
Считается, что витамин C укрепляет иммунную систему, однако это не совсем так. Принимая аскорбинку ежедневно, нельзя избежать простуды, можно лишь незначительно ослабить некоторые симптомы заболевания.
Многие люди убеждены также в пользе цинка. На самом деле он не помогает при простуде и не укрепляет иммунитет так существенно, как считается.
По-настоящему эффективен витамин Д, который еще называют солнечным, поскольку он образуется в клетках кожи под влиянием ультрафиолетовых лучей. Под их воздействием защитные клетки организма активируются, что очень важно для иммунной системы. Возможно, именно поэтому мы особенно подвержены инфекциям в холодное время года, когда световые дни короткие, и недостаток солнечного света приводит к дефициту витамина Д, что ослабляет иммунитет. Много витамина Д содержится в рыбе, особенно в сардинах, лососе, семге и в рыбьем жире. В связи с этим для укрепления иммунитета рекомендуется есть рыбу, а после приема пищи обязательно совершать длительные пешие прогулки.
Миф №2. Прививки? Нет уж, ведь каждая болезнь создает свой иммунитет
Люди, которые выросли в больших семьях вместе с братьями и сестрами, заражавшими друг друга разными инфекциями, и те, кто провел детство в условиях сельской местности, впоследствии страдают от болезней значительно реже, чем единственные в семье дети, к тому же живущие в городских квартирах. Именно в раннем возрасте наша иммунная система нуждается в подобных вирусных тренировках, чтобы, становиться устойчивыми к опасным патогенным возбудителям.
Отказываться от прививок ни в коем случае нельзя. Их делают, прежде всего, от смертельно опасных и вызывающих серьезные осложнения болезней. Согласно статистике, при отсутствии иммунитета риск осложнений значительно выше.
Миф №3. Спорт укрепляет иммунитет
Известно, что те, кто занимается спортом несколько раз в неделю, болеют реже, а заболев, быстрее выздоравливают. Дело в том, что регулярные занятия физической культурой активизируют и мобилизуют защитные силы организма.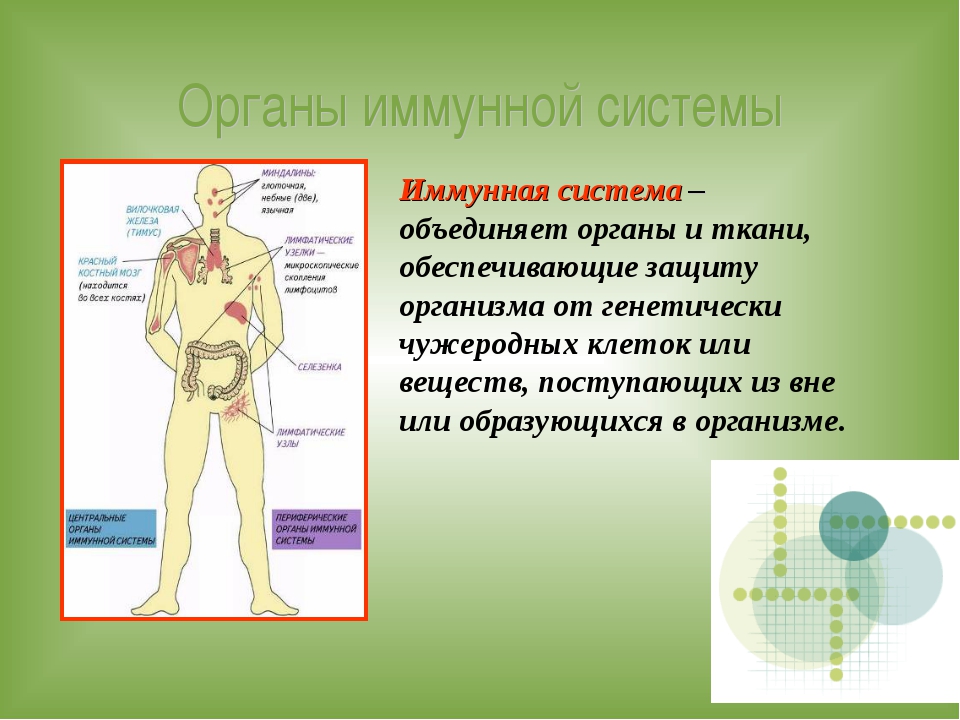 В равных условиях больные раком, занимающиеся спортом, несмотря на болезнь, имеют больше шансов выжить, чем те, кто из-за заболевания практически не двигается.
В равных условиях больные раком, занимающиеся спортом, несмотря на болезнь, имеют больше шансов выжить, чем те, кто из-за заболевания практически не двигается.
Однако надо соблюдать чувство меры, поскольку чрезмерно интенсивные тренировки вредят здоровью. В таких случаях спорт становится для организма стрессовым фактором, особенно если сопровождается психологическим давлением в виде конкуренции. В подобном состоянии человек особенно подвержен болезням. Доказано, что профессиональные спортсмены болеют чаще, чем любители.
Золотое правило для всех и каждого – во время болезни прекратить тренировки до полного выздоровления. Иначе даже обычная простуда может привести к смертельно опасным осложнениям, например, миокардиту. Спорт полезен для здоровья в разумных пределах.
Миф №4. При хорошем иммунитете прививки необязательны
Это не так. Существуют группы риска. Люди, которые в них входят, особо уязвимы для болезней и чаще страдают от осложнений./GettyImages-502865249-56840af95f9b586a9e060755.jpg) Так, сезонный грипп опасен для пожилых и хронических больных. Для ребенка, который еще ни разу не был привит, смертельным может стать коклюш. А вирус, вызывающий краснуху, при попадании в организм будущей мамы, вредит не столько ей самой, сколько еще не родившемуся малышу. Особенно опасно заболевание в первом триместре беременности, когда у плода развиваются врожденные уродства.
Так, сезонный грипп опасен для пожилых и хронических больных. Для ребенка, который еще ни разу не был привит, смертельным может стать коклюш. А вирус, вызывающий краснуху, при попадании в организм будущей мамы, вредит не столько ей самой, сколько еще не родившемуся малышу. Особенно опасно заболевание в первом триместре беременности, когда у плода развиваются врожденные уродства.
Зачастую люди являются переносчиками опасных микроорганизмов, и при этом сами не болеют. Поэтому специалисты советуют делать прививки не только тем, кто входит в группу риска, но и работающим или живущим рядом с ними.
Миф №5. Чем сильнее простуда, тем слабее иммунитет
В этом специалисты были убеждены долгое время, однако данное утверждение верно лишь отчасти. Например, при попадании в организм вируса гриппа чем меньше иммунная система противостоит возбудителю, тем сильнее человек болеет. Этого можно избежать при подготовленном и укрепленном вакцинацией иммунитете. Он защищает и от осложнений, которые нередко возникают вследствие тяжелого течения заболевания.
Миф №6. Если организм справился с заболеванием, то в дальнейшем оно не грозит
Это утверждение верно лишь частично. При попадании микроба в организм, иммунная система человека побеждает его, вырабатывая специфическую защиту против чужеродных агентов – антитела. При повторном проникновении возбудителя в организм эти активные частицы обезвреживают микроб, и человек остается здоровыми. Именно поэтому детскими инфекционными болезнями люди болеют один раз в жизни, получая к ним стойкий иммунитет.
Но респираторные инфекции могут вызывать различные возбудители, число которых доходит до 200. Это значит, что иммунная система способна не распознать один из них, и человек снова заболеет. А вирус гриппа мутирует с высокой скоростью, поэтому в период новой вспышки сезонного заболевания иммунитет на него не реагирует, и в результате развивается эпидемия.
Миф №7. Если иммунитет сильный, то высокой температуры не будет
Повышение температуры тела указывает на то, что организм старается справиться с болезнью. Вступает в действие иммунная реакция – начинает вырабатываться такой защитный фактор, как интерферон. Происходит это при температуре тела 38 градусов, поэтому «сбивать» ее не рекомендуется. Исключение делается только для тех, кто плохо переносит гипертермию. Эксперты считают, что у людей, которые болеют без повышения температуры, ослаблен иммунитет.
Однако очень высокая температура ослабляет организм и может стать опасной. Поэтому надо ориентироваться не только на показания термометра, но, в первую очередь, на самочувствие больного.
Ольга Карулина,
врач Областного центра медицинской профилактики
Иммунный ответ человека — ScienceDirect
- Содержание главы
- Содержание книги
Принципы и практика
2019, страницы 3-17.e1
Аннотация
Люди живут в море микробов, необходимых для здоровья. Иногда комменсальные микробы заменяются патогенами, что приводит к заболеванию. Иммунные системы развивались в первую очередь для защиты от таких атак. Человеческий иммунитет состоит из двух основных компонентов: врожденной и адаптивной иммунной системы.Врожденные системы широко распространены у многоклеточных видов, тогда как адаптивная система является особенностью эволюции позвоночных. Врожденный иммунитет во многом основан на распознавании молекул, общих у микробов, но не присутствующих в их хозяевах. Адаптивная иммунная система основана на различении «собственных» и чужеродных молекул (антигенов). Лимфоциты адаптивного иммунитета бывают двух основных типов: Т-клетки и В-клетки, которые отображают специфические рецепторы антигена: Т-клеточные рецепторы на Т-клетках и иммуноглобулины на В-клетках.Т-клетки отбираются во время созревания тимуса, чтобы отличать собственные молекулы от чужих. В-клетки секретируют иммуноглобулины в виде антител, тогда как Т-клетки секретируют молекулы (цитокины), которые могут усиливать или подавлять воспалительные реакции. Другие Т-клеточные ответы включают межклеточный контакт для уничтожения клеток-мишеней или для стимулирования продукции антител. Иммунологическая память, отличительная черта адаптивного иммунитета, представляет собой размножение клонов лимфоцитов с определенной антигенсвязывающей специфичностью, так что последующая встреча приводит к более сильному и быстрому ответу.Заболевания иммунной системы включают недостаточность, повышающую восприимчивость к инфекции, а также физиологические или нерегулируемые воспалительные реакции, включая аутоиммунитет.
Ключевые слова
Врожденный иммунитет
Адаптивный иммунитет
Т-клетки
В-клетки
Врожденные лимфоидные клетки
Презентация антигена
Иммуноглобулины
Цитокины
000800080008 Иммунологические 9000 9000 9000 9000 9000 Иммунологические 9000 9000 9000 9000 9000 Дефицитная память Рекомендуемые статьиЦитирующие статьи (0)
Copyright © 2019 Elsevier Ltd.Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Что иммунный ответ на коронавирус говорит о перспективах вакцины
В конце 1980-х 15 здоровых людей переехали в новые квартиры в Солсбери, Великобритания. На третий день каждого попросили нюхать раствор, содержащий коронавирус — один из нескольких вирусов, вызывающих простуду. Затем добровольцы провели три недели в карантине в отделении простуды, входящем в состав Совета по медицинским исследованиям, где исследователи наблюдали за рядом симптомов.Некоторые участники исследования сравнили пребывание в отделении простуды с отпуском — если это так, то это был отпуск с забором крови и промыванием носа.
Примерно через год 14 добровольцев вернулись, чтобы сделать это снова. На этот раз исследователи стремились узнать, сделало ли участников невосприимчивыми воздействие вируса. Ответ: вроде как. Хотя у них не было никаких симптомов, анализы показали, что почти все они заразились до того, как их иммунная система смогла запустить эффективную защиту. 1 .
Это был ранний намек на ответ на вопрос, который теперь не дает спать исследователям, врачам и политикам по ночам: может ли иммунная система человека обеспечить прочную защиту от пандемического вируса SARS-CoV-2? Ответ имеет решающее значение для понимания того, обеспечит ли вакцина адекватную защиту, смогут ли те, кто выздоровел от COVID-19 вернуться к докандемическому поведению, и насколько быстро мир может снизить угрозу, создаваемую этим заболеванием.
Исследователи рылись в результатах исследования общей простуды и других подобных ему исследований, пытаясь понять иммунный ответ человека на SARS-CoV-2 с использованием животных и клеточных культур, а также новейших молекулярных методов.Они каталогизировали ответы антител и иммунных клеток с необычной скоростью, определили, какие из них могут быть наиболее эффективными, и разработали вакцины и методы лечения, которые в исследованиях на животных и небольших исследованиях на людях вызывают по крайней мере краткосрочные иммунные ответы. Но не существует быстрого и простого эксперимента, который мог бы однозначно определить, будет ли иммунитет эффективным или стойким. Это слишком рано, чтобы знать.
«Только будущее может сказать нам», — говорит Райнхольд Фёрстер, иммунолог из Ганноверской медицинской школы в Германии.
Спорадические сообщения о повторном заражении — люди, выздоравливающие от COVID-19 только для того, чтобы снова дать положительный результат на болезнь, — вызвали опасения, что иммунитет может быть недолговечным. 24 августа появились новости о человеке в Гонконге, который был дважды инфицирован генетически различными вариантами SARS-CoV-2, хотя во второй раз у него не было никаких симптомов. На данный момент это наиболее документированный случай повторного заражения.
Средства массовой информации прислушиваются к подобным сообщениям и предлагают мрачные прогнозы относительно перспектив вакцины.Но ученые более осмотрительны. «Теперь мы знаем, что может произойти повторное заражение», — говорит Джон Уэрри, иммунолог из Пенсильванского университета в Филадельфии. «Остается неясным, насколько часто случается повторное инфицирование или какие особенности иммунного ответа связаны с повторным заражением».
Для иммунологов, глубоко разбирающихся в SARS-CoV-2, эти данные пока неудивительны — и это предвещает хорошее. «Мы наблюдаем отличный иммунный ответ и фантастически выглядящие антитела. Мы просто еще не знаем, как долго будет длиться этот ответ », — говорит Мехул Сутар, вирусный иммунолог из Университета Эмори в Атланте, штат Джорджия.«К сожалению, это займет время».
Антитела — профи иммунитета
Иммунная система имеет множество способов отражать вирусных захватчиков и удерживать их от возвращения. Он отбирает В-клетки, вырабатывающие антитела, способные связываться с вирусом. Он также убирает запас долгоживущих В-клеток памяти, которые производят эти антитела и вступают в действие, если вирус возвращается. Другая защита задействует Т-клетки, которые патрулируют организм, выявляя и уничтожая инфицированные клетки, чтобы нарушить способность вируса к репликации.Эти иммунные клетки также могут жить годами.
Длительный иммунитет может различаться в зависимости от типа и степени реакции. Разработчики вакцин часто надеются вызвать так называемый стерилизующий иммунитет — ответ, обычно опосредованный антителами, который может быстро предотвратить распространение возвращающегося вируса в организме. Но не все вакцины или инфекции вызывают выработку нейтрализующих антител, необходимых для стерилизации иммунитета. Например, ВИЧ редко индуцирует нейтрализующие антитела 2 , что усложняет попытки разработать вакцины против него.
Пока признаки SARS-CoV-2 обнадеживают. Несколько групп исследователей быстро выделили нейтрализующие антитела от людей, инфицированных вирусом 3 ; большинство из них может получить такой ответ антител в течение нескольких дней после положительного результата теста. И несколько вакцин-кандидатов против SARS-CoV-2 вызывают сильный ответ антител, что является положительным признаком того, что вакцины могут генерировать иммунитет.
Но некоторые ученые делают оговорки по поводу предварительных данных. Ответы антител, как правило, были самыми высокими у людей с наиболее тяжелой инфекцией.Те, у кого легкие инфекции, то есть большинство людей, переболевших COVID-19, иногда вырабатывают небольшие количества нейтрализующих антител. Эта закономерность часто наблюдается с вирусами: чем дольше и тяжелее инфекция, тем выше вероятность того, что она вызовет сильную и стойкую реакцию. Это одна из причин, по которой коронавирусы простуды иногда не вызывают длительного иммунитета, говорит Шейн Кротти, вирусолог из Института иммунологии Ла-Хойи в Калифорнии.
Уровни антител резко увеличиваются вскоре после заражения коронавирусом, но затем уменьшаются.Это может быть неплохо Фото: Алессандро Грассани / NYT / Redux / eyevine
Тогда возникает вопрос, как долго действуют антитела. Когда исследователи отслеживали пациентов с COVID-19 с течением времени, они обнаружили, что количество антител достигло пика в дни после появления симптомов, а затем начало снижаться. У некоторых участников исследования антитела практически не определялись в течение примерно трех месяцев 4 , 5 . Несколько крупных СМИ сообщили об этом как о потере иммунитета, заявив, что это осложнит попытки вакцинации.
Однако многие иммунологи сочли это заявление несколько преждевременным. Данные показали совершенно нормальную реакцию на вирусную инфекцию, говорит Луис Баррейро из Чикагского университета в Иллинойсе, изучающий эволюцию иммунных ответов на патогены. Когда вирус атакует, он стимулирует пролиферацию В-клеток, которые вырабатывают антитела, способные распознавать части вируса. Но как только инфекция проходит, уровень антител обычно снижается. «Существует много опасений», — говорит Майлз Кэрролл, специалист по инфекционным заболеваниям из Департамента общественного здравоохранения Англии из Портон-Дауна, Великобритания.«Но я думаю, что в целом это довольно устойчивый иммунный ответ».
Чтобы определить, насколько значительным может быть это угасание, исследователям все еще необходимо знать, сколько антител требуется для успешного отражения SARS-CoV-2. «Даже небольшое количество антител потенциально может быть защитным», — говорит Мала Майни, вирусный иммунолог из Университетского колледжа Лондона.
Им также необходимо дольше отслеживать уровни антител, чтобы выяснить, сохранятся ли они в конечном итоге на низком уровне — как это часто бывает при вирусных инфекциях — или продолжат быстро снижаться.Учитывая это, вирусолог Кэти Дур из Королевского колледжа Лондона, ведущий автор одного из исследований антител, говорит, что негативное освещение ее работы в прессе застало ее врасплох. «Кажется, все начали кричать:« Ага! », — говорит она. «Но мы не знаем, какой уровень антител необходим для защиты».
Планы B и T
Даже если уровни антител упадут до исчезающе низкого уровня, у иммунной системы часто есть запасной план. В-клетки памяти задерживаются в костном мозге до возвращения вируса, когда они приобретают новую идентичность как продуцирующие антитела плазматические клетки.Данные о роли В-клеток памяти в отражении COVID-19 неполны — клетки труднее обнаружить и подсчитать, чем антитела, — но пока данные свидетельствуют о том, что они размножаются, говорит Маркус Буггерт, иммунолог из Каролинского института. в Стокгольме. Одно недавнее исследование, которое еще не прошло рецензирование, показало, что В-клетки памяти способны вырабатывать нейтрализующие антитела, распознающие SARS-CoV-2, у людей, выздоровевших от COVID-19 в легкой форме 6 .
Кроме того, иммунитет не полностью зависит от антител.Т-клетки могут распознавать инфицированные вирусом клетки и уничтожать их, ограничивая распространение вируса в организме. Подобно В-клеткам памяти, Т-клетки сложнее исследовать, чем антитела, но исследования пока показывают, что они задействованы во время инфекции SARS-CoV-2. В одном недавнем исследовании изучался иммунный ответ у 36 человек, выздоравливающих от COVID-19, и были обнаружены Т-клетки, которые распознают коронавирус у всех из них 7 . «Это похоже на вирус, который очень стимулирует Т-клетки», — говорит иммунолог Дэнни Альтманн из Имперского колледжа Лондона.«У большинства людей очень хорошие Т-клеточные реакции на это».
Вакцины обещают
Исследования Т-клеток также сходятся во мнении о возможности перекрестной реактивности, при которой Т-клетки, распознающие другие коронавирусы, также распознают SARS-CoV-2. Несколько исследований 8 обнаружили Т-клетки, которые реагируют на SARS-CoV-2 в образцах крови людей, которые не подвергались воздействию вируса. И одна команда недавно сообщила, что некоторые из этих Т-клеток реагируют не только на SARS-CoV-2, но и на некоторые коронавирусы простуды 9 .Результаты показывают, что между этими холодными коронавирусами и SARS-CoV-2 может существовать устойчивый перекрестный иммунитет, что приводит к предположениям о том, что это может быть частично ответственно за дикие различия в тяжести симптомов COVID-19 между людьми.
Уроки, извлеченные из других вирусов, также дают основания для оптимизма в отношении того, что иммунитет к SARS-CoV-2 будет длительным. Т-клетки против вируса, вызывающего тяжелый острый респираторный синдром (SARS), были обнаружены через 17 лет после заражения. 7 .Кроме того, SARS-CoV-2, по-видимому, не мутирует так быстро, как вирусы гриппа, отмечает Баррейро, которые меняются так часто, что каждый год требуется новая вакцинация.
Исследование в отделении простуды не обнаружило никаких признаков надежды на стерилизацию иммунитета к простудному коронавирусу, но результаты также показали, что иммунитет может быть достаточно сильным, чтобы уменьшить или даже устранить симптомы. Стерилизация иммунитета от COVID-19 была бы идеальной, потому что это снизило бы риск широкого распространения инфекции среди людей с минимальными симптомами.Но на этом этапе вакцина, которая может снизить смертность, вероятно, все еще будет полезна, говорит Алессандро Сетте, иммунолог из Института иммунологии Ла-Хойи.
В целом, разнообразное и иногда разрушительное воздействие SARS-CoV-2 на организм и легкость его распространения сделали его необычным противником. Но реакция иммунной системы на вирус пока не преподносит сюрпризов, говорит Баррейро. В этом случае, добавляет он, «скучность» — хороший знак для длительного иммунитета. «Есть еще много вещей, о которых мы не знаем, но пока нет ничего действительно уникального.”
Прошлое и будущее человеческого иммунитета под вирусным эволюционным давлением
Иммунная система человека по своей природе изменчива, что позволяет ей противостоять новым вызовам, связанным с разнообразным набором патогенов в окружающей среде. Экология современного человека исторически уникальна, поскольку охватывает широкий спектр географических областей. Распространение патогенов из некогда дискретных сред из-за …
Иммунная система человека по своей природе изменчива, что позволяет ей противостоять новым вызовам, связанным с разнообразным набором патогенов в окружающей среде.Экология современного человека исторически уникальна, поскольку охватывает широкий спектр географических областей. Распространение патогенов из некогда дискретной среды из-за глобальных путешествий и изменения климата означает, что возникнут новые проблемы. Кроме того, могут возникнуть предсказуемые, но пока нереализованные зоонозные проблемы, которые бросят вызов и угрожают выживанию человеческой популяции.
Между вирусами и их хозяевами идет давняя эволюционная битва с вирусами, которые, как известно, разработали меры для противодействия иммунным ответам.В свою очередь, эта битва также значительно повлияла на эволюцию иммунных ответов хозяина и сформировала средства, с помощью которых иммунные клетки борются с патогенами. Древняя врожденная иммунная система встречается как у беспозвоночных, так и у позвоночных, в то время как адаптивная иммунная система челюстных позвоночных является более поздней разработкой. В настоящее время хорошо известно, что эти две системы связаны между собой, и предполагается, что врожденный иммунитет предоставил сырье для возникновения адаптивного иммунного ответа. Адаптивный иммунный ответ включает несколько семейств белков (включая рецепторы В- и Т-клеток, белки MHC и KIR, например), которые кодируются сложными и вариабельными участками генома.Эта сложность позволяет в иммунных клетках происходить ответные генетические изменения, такие как способность гипервариабельных участков генома в В-клетках рекомбинировать с целью продуцирования более специфических антител. Действительно, считается, что иммунная система человека постоянно развивается с помощью различных механизмов, таких как изменения генов, кодирующих иммунные рецепторы, и регуляторных последовательностей, контролирующих их экспрессию. Например, есть некоторые свидетельства того, что экзогенные вирусные инфекции могут изменять экспрессию эндогенных ретровирусов, некоторые из которых способствуют иммунному ответу.
Коэволюционные реакции человека и вируса происходят в масштабе всей жизни человека, но могут быть результатом длительного сосуществования вируса и человека на протяжении тысяч или миллионов лет или накопления случайного или случайного воздействия людей вирусным «пассажирам». По мере развития технологий высокопроизводительного секвенирования мы можем строить более точные гипотезы и лучше понимать потенциальную роль «невидимых» вирусов (тех, которые не вызывают серьезных заболеваний) в отношении их вклада в иммунитет человека и патофизиологию.
В этой теме исследования мы стремимся изучить эволюционную историю врожденного и адаптивного иммунитета человека в свете вирусных проблем. Мы хотим рассмотреть, как вирусные инфекции привели и приведут к изменению и / или диверсификации иммунных ответов, исследуя взаимодействие человека-хозяина и вируса не только механически, но и в свете эволюции. Мы ищем статьи, в которых обсуждается генетическое разнообразие врожденной и адаптивной иммунной систем человека, включая элементы этих систем, которые демонстрируют изменчивость и чувствительность к новым вирусным угрозам.Например, белки, такие как HLA и KIR, которые кодируются областями генома, которые проявляют разнообразие в человеческой популяции. Как такое разнообразие бросает вызов новым вирусным инфекциям и влияют ли эти реакции на генетику иммунной системы? Кроме того, есть ли признаки вирусной инфекции в иммунитете человека? Мы также заинтересованы в изучении взаимодействия иммунитета с экологическими и эпидемиологическими факторами человека, включая иммуно-математические модели и симуляции, которые учитывают взаимодействие иммунитета хозяина-вирус в человеческой популяции.
Мы приветствуем отправку оригинальных исследовательских и обзорных статей, в которых рассматриваются аспекты эволюции вирусной иммунной системы человека в эту тему исследования. Рассматриваются следующие аспекты, но не ограничиваются ими:
1. Генетические эволюционные механизмы в иммунных клетках в ответ на вирусную нагрузку.
2. Модуляция экспрессии антивирусных генов в иммунных клетках.
3. Выбор подтипов NK-клеток при вирусных инфекциях.
4. Палеовирология и иммунитет человека.
5. Реагирование на новые вирусные угрозы, такие как зоонозы.
6. Влияние вирусной иммуноэволюции на экоэпидемиологическую динамику.
7. Коэволюция вируса и человека в рамках иммунитета.
8. Методологии секвенирования нового поколения для понимания совместной эволюции вирусов и иммунных ответов человека.
9. Иммунотерапия и вирусная эволюция.
Важное примечание : Все материалы по данной теме исследования должны находиться в рамках того раздела и журнала, в который они были отправлены, как это определено в их заявлениях о миссии.Frontiers оставляет за собой право направить рукопись, выходящую за рамки объема, в более подходящий раздел или журнал на любом этапе рецензирования.
Пренатальное развитие иммунитета человека
Модельные системы на животных предоставили фундаментальные доказательства, которые формируют наше понимание онтогенетического гематопоэза. Исследования, проведенные на мышах, рыбках данио и цыплятах, установили, что развитие крови и иммунной системы происходит на разных анатомических участках (рис.1). Первые клетки крови являются внеэмбриональными, развиваются в тесной ассоциации с эндотелиальными клетками желточного мешка ( 1 ). Эмбриональные гемопоэтические стволовые клетки (HSC), способные повторно заселять взрослого хозяина в анализах трансплантата, происходят из области мезонефроса гонад аорты (AGM) ( 2 ). Печень и костный мозг плода (BM) впоследствии засеваются как предшественниками, происходящими из желточного мешка, так и происходящими из AGM HSCs ( 3 ). Однако временные рамки развития разных видов хронологически не идентичны.Например, тимус плода мыши заметно незрелый по сравнению с тимусом человека, который поддерживает полную дифференцировку наивных Т-клеток внутриутробно ( 4 ). Кроме того, некоторые маркеры, определяющие популяцию, плохо сохраняются, что затрудняет прямое применение результатов исследований на животных к людям. Все чаще признается влияние материнско-фетального микробного воздействия на иммунное развитие плода, и репертуар комменсальных и патогенных микробов различается у разных видов (см. Сопроводительные обзоры).Исследованиям, направленным на развитие иммунной системы человека, препятствовали доступ к тканям и экспериментальные ограничения, но одноклеточные мультикомные технологии ускорили получение новых результатов. В этом обзоре мы обсуждаем, как эти технологии предоставили беспрецедентную картину иммунитета в раннем возрасте. Мы описываем ключевые идеи о том, как иммунное развитие расслоено во времени и пространстве, и объясняем, как иммунные клетки готовят плод к антигену и принимают неканонические роли в развитии.
Развитие иммунной системы в пространстве и времени
В этом разделе мы проследим за развитием иммунной системы человека в пространстве и времени.Мы начнем с обсуждения типов клеток, когда они впервые появляются в желточном мешке или печени плода, прежде чем рассматривать тимус как ключевое место развития Т-клеток. Это не может быть исчерпывающим описанием иммунного состава, поскольку на сегодняшний день в этих тканях идентифицировано около 40 состояний иммунных клеток. Вместо этого мы сосредотачиваемся на том, как одноклеточные мультикомные подходы продвинули наше понимание иммунной системы человеческого плода (рис. 2).
Рис. 2 Обзор одноклеточных исследований, детализирующих развивающуюся иммунную систему человека.Разнообразные одноклеточные методы (показаны цветом) были применены для создания всеобъемлющего атласа развития иммунной системы человека. Во многих исследованиях для изучения миграции, адаптации и компартментализации иммунных клеток брали пробы из нескольких органов. (Исследования обозначены ссылочным номером, а пунктирные линии связывают различные органы, отобранные в каждом исследовании.)
Желточный мешок и AGM
Анализ человеческого эмбрионального желточного мешка демонстрирует присутствие HSC-подобных предшественников, макрофагов, тучных клеток. клетки (MCs), предшественники естественных киллеров (NK) и предшественники врожденных лимфоидных клеток (ILC) наряду с мегакариоцитами и эритроидными клетками с четырех недель после зачатия (PCW) ( 6 ).
Происхождение макрофагов интенсивно изучается, поскольку тканевые макрофаги возникают независимо от HSC и самообновляются в гомеостатических условиях на моделях мышей ( 10 ). Резидентные в тканях макрофаги в печени, легких, головном мозге и эпидермисе, как было показано картированием судеб, возникают из гематопоэза желточного мешка через предшественника эритромиелоида ( 11 , 12 ). Хотя вклад желточного мешка сохраняется в некоторых тканях (например, в печени, головном мозге и эпидермисе), макрофаги постепенно замещаются моноцитами, происходящими от HSC, в других местах (например,g., кишечник, легкие и сердце). Этот процесс частично зависит от того, насколько «открыта» ниша для циркулирующих клеток ( 10 ). У мышей точный вклад первой и второй волн гематопоэза желточного мешка и возникновение макрофагов из промежуточного моноцита остается нерешенным ( 10 ). При внутриутробном развитии человека тканеспецифические макрофаги наблюдаются с самых ранних временных точек ( 6 , 13 , 14 ). Одноклеточная диссекция человеческого AGM показала отчетливую гемогенную эндотелиальную популяцию, которая дает начало макрофагам ( 13 ).К 6 PCW эмбриональная поджелудочная железа насыщается макрофагами, микроглия сопровождает развивающийся мозг, а клетки Хофбауэра выстилают плаценту ( 7 , 14 , 15 ). Идентификация этих клеток в значительном количестве до начала кроветворения в печени плода на 6–9 PCW дает поддержку желточному мешку или производным AGM макрофагам, заселяющим периферические ткани. Попытки использовать транскрипционное сходство между макрофагами желточного мешка и макрофагами печени плода для анализа онтогенеза тканевых макрофагов недостаточно надежны из-за связанной с окружающей средой экспрессии генов после резидентства в ткани.Однако эти профили позволили охарактеризовать разнообразие макрофагов, необходимых для развития, например, макрофаги островков эритроида, обеспечивающие поддержку эритропоэза, и клетки Купфера с выраженной функцией очистки в печени плода ( 6 ).
Параллельно с макрофагами исследования картирования судеб показали, что тканевые MC возникают как из желточного мешка, так и из предшественников HSC у мышей, и что паттерны удержания MC в желточном мешке являются тканеспецифичными ( 16 , 17 ).В процессе развития человека четкая сигнатура MC присутствует как в желточном мешке, так и в печени плода ( 6 ). ТК соединительной ткани в коже и почках плода тесно связаны с ТК печени плода по профилю экспрессии одноклеточных генов ( 6 ). Столь ранняя преданность эмбриона производству MC вызывает недоумение. Наиболее охарактеризованной функцией MC является их участие в аллергических реакциях на связывание иммуноглобулина E (IgE) через высокоаффинный рецептор IgE ( 18 ). ТК печени и желточного мешка, по-видимому, плохо подготовлены к этой задаче, поскольку ни один из них не экспрессирует ген альфа-субъединицы рецептора IgE ( FCER1A ) ( 6 ).Ранняя продукция MC может происходить для оснащения развивающихся участков слизистой оболочки и соединительной ткани резидентными иммунными клетками или для обеспечения пула ассоциированных с патогенами молекулярных паттернов, реагирующих на врожденные эффекторы. Однако предсказываются дополнительные функции в поддержке ангиогенеза. У мышей MCs эмбриональной кожи экспрессируют гены, участвующие в формировании сосудистого и нервного паттерна ( 6 , 16 ). У взрослых млекопитающих MC поддерживают как физиологический, так и воспалительный ангиогенез ( 18 ). Роль MC в пренатальном развитии сосудов требует дальнейшего изучения.
NK-клетки, предшественники ILC и их общие лимфоидные предшественники могут быть идентифицированы из одноклеточного транскриптома желточного мешка и фетальной печени ( 6 , 19 ). На более поздних стадиях они обнаруживаются в виде более разнообразных и дифференцированных клеток во многих органах плода ( 9 , 20 ). В отличие от материнских децидуальных NK-клеток, роль которых во время беременности хорошо изучена ( 7 , 21 ), наше понимание функции NK-клеток плода на сегодняшний день ограничено.Хотя фетальные NK-клетки считаются незрелыми и гипореактивными по сравнению со взрослыми NK-клетками, они уже обладают киллерной активностью ( 22 , 23 ). Более того, NK-клетки плода или младенца напоминают своих взрослых аналогов на нескольких уровнях, что позволяет предположить, что они готовы реагировать, когда присутствуют правильные стимулы, такие как вирусные инфекции ( 23 ). Соответственно, NK-клетки в изобилии присутствуют в кишечнике младенца, снабжены цитолитическими гранулами и демонстрируют более высокую дегрануляционную активность по сравнению со взрослыми NK-клетками кишечника ( 20 ).В дополнение к NK-клеткам было показано, что у плода больше других ИЛЦ по сравнению с младенцами ( 24 ). Среди них клетки-индукторы врожденной лимфоидной ткани (LTi) играют решающую роль в формировании вторичных лимфоидных органов ( 25 , 26 ). Взаимодействуя со стромальными клетками, LTi-клетки вызывают положительную обратную связь для привлечения дополнительных LTi-клеток, а также других иммунных клеток, создавая лимфоидную среду ( 27 ). Таким образом, врожденные лимфоциты развиваются очень рано у человеческого эмбриона и участвуют как в защите тканей, так и в ремоделировании.
Эта самая ранняя волна гематопоэза в желточном мешке демонстрирует преданность иммунным клеткам, выполняющим структурные и физиологические роли, наряду с оснащением эмбриона основным репертуаром врожденных иммунных эффекторов. Точная роль этих клеток в развитии тканей и контрольные точки, которые предотвращают повреждающие иммунные ответы в утробе матери, требуют дальнейшего изучения.
Печень и BM
Окончательные HSC могут генерировать полный набор клонов эритроидных, мегакариоцитарных, миелоидных и лимфоидных клеток в печени плода, но нейтрофилы остаются отсутствующими до тех пор, пока не будет установлен кроветворение BM ( 28 ).
В отличие от макрофагов, моноциты и дендритные клетки (ДК) считаются HSC-зависимыми популяциями. У мышей оба они прослеживаются до клоногенного предшественника в BM, названного предшественником макрофага-DC ( 29 ). В развитии человека первые признаки продукции DC наблюдаются в печени плода примерно от 6 PCW ( 6 ). Обычные DC1, DC2 и плазмацитоидные DC обнаруживаются в тканях плода — включая легкие, селезенку, кожу и тимус — от 12 PCW и относительно многочисленны по сравнению с DC тканей взрослых ( 30 ).ДК плода, как и их взрослые аналоги, способны мигрировать, отвечать на лигирование Toll-подобных рецепторов и стимулировать пролиферацию и активацию Т-клеток ( 30 ). ДК плода обладают особой способностью индуцировать дифференцировку регуляторных Т-клеток, способствовать выработке Т-клетками интерлейкина-4 и ингибировать продукцию фактора некроза опухоли Т-α (TNFα) с помощью аргиназы 2 ( 30 ). Таким образом, ДК играют важную роль в поддержании толерантности в течение внутриутробной жизни.
Клон В-клеток впервые наблюдается в печени плода из 7 PCW в форме предшественников В-клеток; зрелые B-клетки присутствуют только после 9 PCW ( 6 ).Это частично объясняется изменением внутреннего потенциала HSC генерировать В-клетки и поддержки микроокружения печени для дифференцировки В-клеток ( 6 ). В середине беременности КМ становится основным источником В-клеток, а зрелые В-клетки в изобилии обогащены селезенкой ( 31 ). Хотя В-клетки плода достигают разнообразного репертуара с ранних стадий ( 24 , 32 ), образование зародышевых центров ослабляется до воздействия антигена после рождения, что сопровождается активной соматической гипермутацией ( 33 ).Сравнение кишечных В-клеток плодов во втором триместре с младенцами с помощью цитометрии единичной клеточной массы в сочетании с анализом репертуара рецепторов В-клеток убедительно продемонстрировало, что кишечные В-клетки плода являются в основном фолликулярными и переходными В-клетками, тогда как В-клетки плазмы у младенцев обогащены ( 24 ).
Еще один интересный аспект развития В-клеток, который интенсивно изучался на модели мышей, — это многоуровневое развитие врожденных клеток В-1, которые преобладают на ранних сроках беременности и сопровождаются обычными клетками В-2 ( 34 ) .Однако точная идентичность человеческих B-1-подобных клеток еще не решена ( 35 ). Будущие исследования по созданию одноклеточного атласа костного мозга плода человека и селезенки дадут лучшее представление об онтологии человеческих В-клеток, подчеркнув органоспецифические различия в факторах ниш, которые поддерживают дифференцировку В-клеток.
«Клинические последствия иммунного развития и функционирования плода выходят далеко за пределы жизни в утробе матери».
Тимус и периферические органы
Тимус обеспечивает среду, необходимую для развития Т-клеток.Ранние лимфоидные предшественники, происходящие из печени плода, мигрируют в тимус на 8 PCW, где они развиваются в наивные Т-клетки ( 36 ).
Развитие и созревание тимуса опосредуются взаимодействием между стромальными клетками тимуса и иммунными компартментами, что в значительной степени изучалось на моделях мышей. Комплексное профилирование одноклеточного транскриптома клеточных компонентов развивающегося тимуса человека показало обширную связь между эпителиальными клетками тимуса, мезенхимальными клетками, ранними предшественниками тимуса, развивающимися и зрелыми Т-клетками и другими иммунными клетками ( 4 , 19 ).Доля каждой клеточной популяции также показывает скоординированные изменения в процессе развития, что еще раз доказывает важность гармонии между множественными типами клеток для созревания органов ( 4 ).
Одноклеточные исследования печени и тимуса плода выявили подробные молекулярные сигнатуры, объясняющие переход от ранних предшественников тимуса к наивным Т-клеткам ( 4 , 6 , 19 ). Hu и его коллеги сосредоточили внимание на молекулярном профиле предшественников тимуса ( 19 ).Наша группа расширила этот анализ на более поздние стадии разработки ( 4 ). Вместе эти находки выявили непрерывную траекторию от ранних предшественников тимуса, развивающихся во множественные типы зрелых Т-клеток.
Наивные Т-клетки выходят из тимуса и мигрируют в другие ткани. Циркулирующие Т-клетки наблюдаются через 10–11 PCW после функционального развития тимуса ( 37 ). Отсутствие или присутствие микроорганизмов в среде плода остается предметом дискуссий (см. Сопроводительные обзоры).Хотя здоровая беременность, скорее всего, бесплодна, ненаследственные материнские аллоантигены и побочные продукты микробного происхождения могут потенциально активировать иммунную систему плода. Чтобы избежать нарушения аллореактивности, плод должен поддерживать толерогенный иммунитет. Следовательно, наивные Т-клетки, полученные от плода, с большей вероятностью приобретут судьбу регуляторных Т-клеток по сравнению со взрослыми наивными Т-клетками ( 38 ). Регуляторные Т-клетки плода подавляют пролиферацию и секрецию цитокинов других Т-клеток плода, которые потенциально являются самореактивными ( 39 ).
Т-клетки памяти были идентифицированы в кишечнике плода, что подчеркивает потенциал Т-клеток плода реагировать на чужеродные антигены ( 9 , 24 , 40 , 41 ). Исследования кишечных CD4 + Т-клеток с помощью одноклеточных методов в сочетании с секвенированием репертуара выявили существование популяций Т-клеток памяти и регуляторных Т-клеток с признаком клональной экспансии, подчеркивая баланс между активацией и подавлением адаптивного иммунного ответа в организме человека. плод ( 24 , 42 ).Кишечные CD4 + Т-клетки также могут играть роль в стимулировании развития, как показано для случая умеренной экспрессии TNFα ( 41 ). Таким образом, адаптивный иммунитет плода стал значительно более зрелым, чем предполагалось ранее. Активные области будущих исследований иммунной системы плода включают антигенные сигналы, лежащие в основе активации Т-клеток плода, и их роль в развитии и защите плода.
На этом снимке развития иммунной системы плода во времени и пространстве мы отмечаем появление как врожденных, так и адаптивных иммунных клеток с отличительными свойствами по сравнению с их взрослыми аналогами.Среди компонентов, отсутствующих в этом обзоре, — нейтрофилы. Текущие данные свидетельствуют о том, что около одной трети клеток костного мозга плода представляют собой нейтрофилы или их предшественники при 10–13 PCW, увеличиваясь до двух третей при 21 PCW ( 43 ). Младенцы, рожденные недоношенными или маленькими для гестационного возраста, имеют более низкое количество циркулирующих нейтрофилов, более низкий резерв нейтрофилов и более высокую смертность от сепсиса ( 44 ). Понимание того, как работает нейтрофильный компартмент плода, поможет понять, как можно поддерживать иммунную защиту в раннем возрасте.
Заключение
Multi-omics подвеска и пространственные технологии предоставили идеальные платформы для анализа и реконструкции развивающейся иммунной системы ( 4 , 6 , 9 , 13 , 19 , 24 , 41 , 42 ). Многие области неопределенности еще предстоит разгадать (рис. 3). Как кроветворные предшественники меняются в процессе развития? Как различные тканевые ниши, такие как желточный мешок, печень, костный мозг, тимус и селезенка, влияют на популяции предшественников и развивающиеся иммунные клетки? Как иммунные клетки мигрируют и адаптируются к периферическим нелимфоидным тканям? Как иммунная система общается, обучается и формирует память для будущих встреч?
Инжир.3 Ключевые вопросы, которые необходимо решить в будущих исследованиях развития иммунной системы.Диаграмма отображает соответствующие вопросы, касающиеся развития иммунной системы. Как HSC меняются в своем потенциале в процессе развития? Чем разные кроветворные ниши отличаются друг от друга? Что определяет миграцию иммунных клеток к органам-мишеням и как они адаптируются к новой тканевой среде? Методы одноклеточного профилирования и пространственного профилирования теперь дают ответы на эти вопросы, оценивая иммунную систему в целом и выявляя новые свойства коллектива.
КРЕДИТ: N. CARY / SCIENCE
Завершение разработки иммунного атласа путем сосредоточения внимания на органах и временных точках, которые в настоящее время отсутствуют, расширения анализов для сравнения со взрослыми иммунными клетками, а также системных и межвидовых сравнений предоставит дополнительные знания о том, как иммунная система человека развивалась, становилась и поддерживается. Клинические последствия иммунного развития и функционирования плода выходят далеко за рамки внутриутробной жизни. Плодоспецифические гематопоэтические клетки-предшественники в настоящее время признаны клетками, вероятно, являющимися источниками рака крови, включая острый мегакариобластный лейкоз, связанный с синдромом Дауна, ювенильный миеломоноцитарный лейкоз и острый лимфобластный лейкоз младенцев.На ранние первичные иммунодефициты с нарушенной реакцией на заражение патогенами и / или аутоиммунитет также могут влиять сигналы и изменения, связанные с развитием. В этих условиях аномальный гематопоэз также приводит к нарушению иммунной функции. Биологические открытия, основанные на глубоком понимании развивающейся иммунной системы, обещают в ближайшем будущем произвести революцию в трансплантации стволовых клеток и тканевой инженерии для иммунотерапии и регенеративной медицины.
Благодарности: Мы благодарим Дж.Элиасовой за графические изображения. Финансирование: Мы выражаем признательность за финансирование от Wellcome Human Cell Atlas Strategic Science Support (WT211276 / Z / 18 / Z). M.H. финансируется Wellcome (WT107931 / Z / 15 / Z), Институтом профилактической медицины Листера и Центром биомедицинских исследований NIHR Ньюкасла. СИДЕЛ. финансируется наградами Wellcome (WT206194), ERC Consolidator и EU MRG-GRammar, а также Инициативой Чана Цукерберга (CZF2019-002445). Б.Г. является исследователем Wellcome (206328 / Z / 17 / Z), а также получает финансовую поддержку от Wellcome и MRC Кембриджского института стволовых клеток.L.J. финансируется академической клинической лекцией NIHR. J.-E.P. поддерживается стипендией EMBO Advanced Fellowship (ALTF 623-2019). Конкурирующие интересы: За последние 3 года S.A.T. консультировал компании Biogen, GenenTech и Roche и является членом Научно-консультативного совета ForeSite Labs.
Инфекционные заболевания — вакцины и иммунитет человека
Приобретение иммунитета, вспоминая инфекции
Когда организм подвергается воздействию вирусов, бактерий, грибков или паразитов в результате инфекции или вакцинации, иммунная система вырабатывает антитела и иммунные клетки, которые инактивируют или уничтожают конкретный инфекционный организм.Если мы столкнемся с тем же самым организмом в будущем, иммунная система «запомнит» предыдущее воздействие и сможет обеспечить надежную защиту.
Мы получаем специфический иммунитет несколькими способами. Мы получаем временный иммунитет к некоторым заболеваниям, приобретая антитела непосредственно от матери, когда мы находимся в утробе матери. На протяжении всей жизни мы приобретаем специфический иммунитет, поскольку подвергаемся воздействию новых организмов. Инфекции создают клетки памяти, которые могут защитить нас от будущего заражения теми же или родственными организмами.Вакцины стимулируют тот же процесс.
ИНФЕКЦИЯ — Иммунная система распознает чужеродные белки или сложные сахара по их уникальной форме. Один из ключей к специфическому иммунитету заключается в способности организма вырабатывать большое количество антител, соответствующих каждой из этих форм. Антитела окружают инфекционные организмы, прикрепляясь к чужеродным организмам и блокируя способность организма прикрепляться к клеткам человека. Клетки иммунной системы используют прикрепленные антитела в качестве ручек для захвата инфекционных организмов для уничтожения или удаления.
ВАКЦИНАЦИЯ — Вакцины представляют иммунной системе белки или сложные сахара патогенного организма. Вакцина стимулирует естественный иммунный ответ, вырабатывая антитела и воспоминания об инфекции, не опасаясь реальной инфекции. Память помогает защитить нас, если мы когда-либо столкнемся с патогеном в будущем.
БУДУЩЕЕ ВОЗДЕЙСТВИЕ — Если человек подвергнется той же болезни в будущем, организм уже имеет память об инфекции и может быстро бороться с инфекцией.
| Зеленая линия показывает уровни антител в ответ на инфекцию и будущую повторную инфекцию. Красная линия показывает уровни антител в ответ на вакцинацию, а затем на будущую инфекцию. Линии похожи по форме и уровню. |
Раскрыта тайна того, как иммунные клетки человека развивают пожизненный иммунитет — новое исследование
Мы многое понимаем в том, как работает иммунная система, но, как показали недавние усилия по борьбе с COVID-19, ее явная сложность означает, что многие загадки все еще остаются.Например, то, как наша иммунная система учится запоминать прошлые инфекции, оказалось очень трудно изучить на людях. Но наше новое исследование приблизило нас на один шаг к пониманию того, как наш организм запоминает прошлые инфекции, чтобы мы могли бороться с ними в будущем. Мы обнаружили важную роль антител в создании долгоживущего иммунитета и то, что различные типы иммунных клеток, называемые В-клетками, могут влиять на тип генерируемой иммунной памяти.
Наше исследование было сосредоточено на так называемых зародышевых центрах, которые образуются во время инфекций в наших лимфатических узлах, селезенке и миндалинах.Они играют важную роль в нашей иммунной системе, так как именно там иммунные клетки собираются и взаимодействуют во время иммунных реакций. В них также создается наша «иммунная память», чтобы иммунная система могла «помнить», как защищаться от определенных патогенов в будущем.
Зародышевые центры состоят из разных иммунных клеток, и один тип, называемый В-клетками, особенно важен для создания иммунной памяти. Эти В-клетки вырабатывают антитела (белок) в ответ на инфекции или вакцинации, которые связываются с патогенами (такими как бактерии и вирусы) и либо уничтожают их, либо запускают другие иммунные клетки в действие.
На ранней стадии инфекции некоторые из В-клеток нашего организма реагируют высвобождением пакета антител, которые обеспечивают раннюю линию защиты от патогена. Но большинство этих В-клеток, высвобождаемых в этой первоначальной первой волне, недолговечны и умирают, когда инфекция проходит, что приводит к потере их антител. Однако некоторые В-клетки попадают в зародышевые центры, где они могут вырабатывать более сильные антитела и становиться долгоживущими клетками, которые защищают нас от инфекции в будущем.
Зародышевые центры
Хотя зародышевый центр невероятно важен для иммунной памяти, из-за его сложности ученым очень трудно полностью понять, как ведут себя В-клетки, находясь внутри них.Поэтому мы решили создать «дорожную карту» реакции зародышевого центра с использованием миндалин человека, чтобы понять, какие типы В-клеток присутствуют и как их поведение способствует созданию долговременного иммунитета. Знание этих факторов может иметь важное значение для разработки эффективных вакцин.
Мы использовали передовую технологию, называемую геномикой отдельных клеток, которая измеряет гены, экспрессируемые десятками тысяч отдельных клеток, и генетическую последовательность, которая производит их антитела. Гены, экспрессируемые каждой отдельной В-клеткой, говорят нам о поведении и функции клетки, а последовательность гена антитела показывает, как антитела изменяются в зародышевом центре.Этот подход позволил нам идентифицировать очень редкие типы В-клеток, которые были бы упущены с помощью других технологий.
Затем мы использовали эту информацию для реконструкции всего ответа зародышевого центра, который показал нам, как именно развиваются различные В-клетки с момента обнаружения патогена до формирования иммунной памяти.
Класс антител
Одно из наших ключевых открытий заключалось в том, что тип антитела, вырабатываемого В-клеткой, влияет на то, как она ведет себя и насколько вероятно, что она создаст долгоживущий иммунитет.В-клетки могут экспрессировать один из пяти классов антител, и каждый класс вызывает разные иммунные ответы. Например, антитела класса IgG вызывают сильные противовирусные иммунные ответы, тогда как класс IgA защищает кишечник и дыхательные пути.
Различные типы антител нацелены на определенные патогены. ustas7777777 / ShutterstockВсе В-клетки начинают вырабатывать антитела класса IgM, которые обеспечивают широкую иммунную защиту, но менее эффективны по сравнению с другими классами. Но B-клетки могут переключаться на другой класс, когда они активируются во время иммунного ответа.Ранее считалось, что этот процесс переключения классов происходит в зародышевом центре. Но недавние исследования на мышах показали, что В-клетки переключают свой класс антител до реакции зародышевого центра. Мы смогли подтвердить, что это происходит и с людьми. Мы также определили, какие гены экспрессируются В-клетками на этом важном этапе.
Мы также обнаружили, что В-клетки, которые переключились с выработки антител IgM на IgA или IgG, экспрессируют разные уровни определенных генов, включая гены, которые контролируют, становится ли В-клетка долгоживущей.Таким образом, то, переключает ли В-клетка свой класс антител перед тем, как попасть в зародышевый центр, влияет на то, разовьет ли она долгоживущий иммунитет к этому конкретному патогену. Однако мы до сих пор не до конца понимаем, почему B-клетки переключаются или нет.
Является ли В-клетка частью короткоживущей первой волны или помогает формировать зародышевый центр, также зависит от многих факторов, в том числе от того, как быстро удаляется патоген, возраст человека и тип инфекции. Поскольку В-клетки нуждаются в зародышевых центрах для развития иммунной памяти, чем больше мы узнаем об этих различных факторах, тем лучше мы понимаем нашу предрасположенность к различным заболеваниям.
Точное понимание того, как работают зародышевые центры, является ключом к разработке эффективных вакцин, обеспечивающих пожизненный иммунитет. В будущем объединение различных технологий, таких как те, которые мы использовали в нашем исследовании, с другими методами позволит нам напрямую сравнивать иммунные ответы на вакцины против многих инфекционных агентов, таких как коронавирус SARS-CoV-2, и понимать иммунную память в более общем плане.
Иммунитет человека к Toxoplasma gondii
Образец цитирования: Fisch D, Clough B, Frickel E-M (2019) Человеческий иммунитет к Toxoplasma gondii .PLoS Pathog 15 (12): e1008097. https://doi.org/10.1371/journal.ppat.1008097
Редактор: Йорн Коерс, Медицинский факультет Университета Дьюка, СОЕДИНЕННЫЕ ШТАТЫ
Опубликовано: 12 декабря 2019 г.
Авторские права: © 2019 Fisch et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана Институтом Фрэнсиса Крика, который получает основное финансирование от Cancer Research UK (FC001076), Совета медицинских исследований Великобритании (FC001076) и Wellcome Trust (FC001076). EMF был поддержан стипендией Wellcome Trust по развитию карьеры (091664 / B / 10 / Z). DF была поддержана стипендией Boehringer Ingelheim Fonds PhD. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Врожденный иммунный ответ и обнаружение
ToxoplasmaToxoplasma gondii ( Tg ) — апикомплексный паразит, способный проникать в любую ядросодержащую клетку теплокровных животных. Примерно 30% всех людей страдают хронической бессимптомной инфекцией [1]. Риски для здоровья включают тяжелый энцефалит у лиц с ослабленным иммунитетом, врожденные дефекты и заболевания глаз, распространенные в основном в Южной Америке [2].Кошачьи являются окончательным хозяином Tgs , а инфицирование человека происходит в основном при употреблении зараженной пищи или воды [3]. После приема внутрь в тканях, окружающих кишечник, развивается первоначальный очаг инфекции, вызывающий воспаление. Оттуда Tg распространяется через кровоток, вызывая хроническую инфекцию и попадая в иммунопривилегированные участки, включая мозг [4]. Поскольку люди являются тупиковыми хозяевами, взаимодействие между хозяином и паразитом отличается от взаимодействия грызунов, и удивительно, насколько мало известно о некоторых уровнях реакции человека на инфекцию [5,6].Следовательно, использование мышей в качестве модели может лишь частично способствовать изучению реакции человека на инфекцию Tg . В этом обзоре мы исследуем имеющиеся данные об иммунном ответе человека на инфекцию Tg- на системном уровне, в ответе отдельных клеток и на полный контроль над инфекцией. Мы также обсуждаем, что Tg проникает в иммунопривилегированные участки, вызывая заболевания у здоровых людей, и предлагаем области, представляющие интерес для будущих исследований.
Врожденная иммунная система первой реагирует на инфекцию выработкой интерлейкина (ИЛ) -12 нейтрофилами, дендритными клетками (ДК) и моноцитами, но не макрофагами, которые фагоцитируют Tg [7–9].Внутриклеточное восприятие отличается от мышиного, поскольку люди не имеют функциональных эквивалентов мышиным toll-подобным рецепторам (TLR) 11 и 12 [10,11]. Моноциты воспринимают Tg -инфекцию через Alarmin S100A11, секретируемый инфицированными клетками, что приводит к продукции хемокинового (мотив C-C) лиганда 2 (CCL2) [12]. Кроме того, цитозольное распознавание Tg в моноцитах частично зависит от пиринового домена семейства NLR, содержащего 1 ( NLRP1) и NLRP3 инфламмасому, что приводит к гибели клеток в более поздние моменты времени и ранней секреции IL-1β [13,14 ].Интересно, что нейтрофилы и макрофаги не воспринимают Tg -инфекцию таким же образом, поскольку они не проявляют пироптоз или секрецию IL-1β [14,15].
На основе моделей in vivo, , мыши и человека, , in vitro, , продукция цитокинов в воспаленной ткани запускает продукцию интерферона гамма (IFNγ) Т-хелперами (Th) 1 и клетками естественных киллеров (NK), что приводит к устойчивый адаптивный Th2-иммунный ответ на контроль инфекции Tg (см. рис. 1) [16,17].
Рис. 1. Системная и клеточная реакция человека на инфекцию Toxoplasma .
Слева: системный ответ на Tg -инфекцию: инфицированные клетки и клетки, которые фагоцитировали Tg паразитов в очаге инфекции, ощущают присутствие патогена через указанные PRR и защитные белки и реагируют путем продукции провоспалительных цитокинов и хемокины, такие как CCL2, IL-1β и IL-12. Это присутствие цитокинов запускает продукцию IFNγ Th2 и NK-клетками.Справа: клеточный ответ на Tg -инфекцию: IFNγ и потенциально другие цитокины запускают инфицированные клетки для создания внутренней защиты клетки от PV. Механизмы включают управляемую убиквитином неканоническую аутофагию всей PV и задержку роста; маркировку PV с помощью Ub, LAMP1 и адаптерных белков аутофагии NDP52 и p62 с последующим подкислением вакуолей и уничтожением паразита; рекрутирование GBP1 в вакуоли Tg для их разрушения и раскрытия паразита в пределах или ограничения роста Tg посредством GBP1 без перемещения в вакуоль; и гибель клетки-хозяина в ответ на открытые PV и утечку ассоциированных с патогенами молекулярных структур в цитозоль для обнаружения с помощью PRR.Точные механизмы сильно зависят от типа клеток и штамма Tg , инфицирующего клетки. AIM, отсутствует в меланоме 2; ASC, пятнистый белок, связанный с апоптозом, содержащий CARD; CASP, каспаза; CCL, хемокиновый (мотив C-C) лиганд; GBP, белок, связывающий гуанилат; ИЛ, интерлейкин; IFNγ, гамма-интерферон; LAMP, мембранный белок, связанный с лизосомами; NDP52, ядерный домен 10, белок 52; Н.К., естественный убийца; NLRP, нуклеотид-связывающий домен олигомеризации, богатый лейцином повтор и содержащий пириновый домен; PAMP, патоген-ассоциированные молекулярные структуры; PRR, рецептор распознавания образов; PV — паразитофорная вакуоль; Tg , Toxoplasma gondii; Th, Т-хелперная клетка; TNFα, фактор некроза опухоли α; Уб, убиквитин.
https://doi.org/10.1371/journal.ppat.1008097.g001
Клеточный ответ на инфекцию
ToxoplasmaКлеточный ответ человека на инфекцию Tg сильно зависит от типа клеток [18] и заражающего штамма Tg [19]. Интересно, что хотя основным цитокином, контролирующим Tg -инфекцию, является IFNγ, другие цитокины были вовлечены. Например, клетки микроглии мозга контролируют рост Tg за счет продукции фактора некроза опухоли α (TNFα) и IL-6 [20].Предполагается, что TNFα опосредует гибель Tg у пациентов с дефицитом рецептора 1 IFNγ ( IFNGR1 ), частично компенсируя отсутствие IFNγ-чувствительности [21]. Кроме того, сообщалось о IFNγ-независимом контроле Tg посредством кластера дифференцировки (CD) 40-индуцированной аутофагии паразитофорных вакуолей (PV) в макрофагах человека [22], с оговоркой, что Tg активирует рецептор эпидермального фактора роста ( EGFR) для борьбы с собственным аутофагическим клиренсом [23].Вероятно, что несколько различных путей ответа хозяина действуют согласованно, чтобы контролировать Tg -инфекцию. Однако для целей этого обзора мы сосредоточимся на роли механизмов защиты, индуцированных IFNγ (см. Рис. 1).
Недавно мы показали, что дозозависимое ограничение IFNγ инфекции Tg зависит от типа клеток, причем эпителиальные клетки проявляют резкий паразитицидный эффект, в отличие от макрофагов, фибробластов и эндотелиальных клеток, демонстрирующих дозозависимый ответ [24]. .Обычный начальный ответ — маркировать PV убиквитином [24–26], но убиквитинированный субстрат (ы) и лигазы E3, участвующие в этом процессе, еще предстоит определить. После убиквитинирования эпителиальные клетки контролируют паразитов посредством неполной аутофагии, включая привлечение адаптерных белков аутофагии p62 ( SQSTM1, ) и NDP52 ( CALCOCO2, ) и белка, связанного с аутофагией, белка 8 (Atg8), белка-1A, связанного с микротрубочками. легкая цепь 3 (LC3B), но она не созревает до аутофаголизосом [25].Эндотелиальные клетки следуют по этому пути вплоть до рекрутирования адаптерных белков, но затем отклоняются от него, либо перемещая меченые PV в эндолизосомный путь, либо непосредственно подкисляя PV [26]. Оба типа клеток поддерживают целостность ЛВ и ограничивают паразита внутри.
И наоборот, макрофаги способны открывать вакуоли Tg , как мы недавно продемонстрировали [27]. Это индуцирует атипичный путь апоптоза, основанный на зондировании ДНК при отсутствии в меланоме 2 ( AIM2 ) и осуществлении апоптоза через связанный с апоптозом пятнышкообразный белок, содержащий сигнальную ось CARD (ASC) -каспаза 8 ( CASP8) . [29], тогда как Tg способен блокировать апоптоз в других клетках человека [28].Этот фенотип клеточной гибели зависит от IFNγ-индуцированных гуанилатсвязывающих белков (GBP), из которых GBP1 перемещается в вакуоли Tg и высвобождает производные Tg молекулярные лиганды клеточных рецепторов [27]. Сходным образом GBP1 перемещается в вакуоли Tg в мезенхимальных стволовых клетках [29], но не в эпителиальные клетки [30]. В обоих типах клеток белок был способен ограничивать Tg независимо от его рекрутирования [29,30]. Таким образом, рекрутированный GBP1, по-видимому, однозначно вызывает гибель клеток-хозяев в макрофагах.В отличие от гибели макрофагов, IFNγ-примированные фибробласты умирают из-за нехарактерной формы гибели клеток [31].
Подобно функции GBP1 по ограничению роста Tg на расстоянии от PV, другие внутренние механизмы действуют на Tg на расстоянии: IFNγ-индуцированная индоламин-2,3-диоксигеназа 1 (IDO) может истощать клетки триптофана, который замедляет рост ауксотрофного триптофана Tg [32]. Этому механизму можно противодействовать с помощью ингибитора эффекторного белка Tg транскрипционной активности STAT1 ( Tg IST) [33], и было показано, что он незаменим в эндотелиальных клетках пупочной вены человека (HUVEC) [34].В общем, секретируемый фактор вирулентности Tg Tg IST способен отключать многие IFNγ-опосредованные ответы на инфекцию путем блокирования транскрипции IFNγ-индуцированных генов [35,36]. Более того, в отличие от клеток мыши, оксид азота не имеет отношения к ограничению Tg в HUVECs [34].
Паразиты, которые ускользают в течение нескольких часов после проникновения в клетки-хозяева, могут быть важным неизученным последствием IFNγ-зависимой рестрикции хозяина, как это наблюдалось в человеческих фибробластах и эндотелиальных клетках [31].Это явление трудно определить количественно, и оно может превышать 5–10%, о которых сообщают. Остается открытым вопрос, жизнеспособны ли сбежавшие паразиты Tg .
Взятые вместе, внутренняя защита клетки от Tg -инфекции не только сильно различается между видами, но также и между разными типами клеток, и требуется большая работа, чтобы раскрыть новые механизмы.
Распространение в инфицированном хозяине и проникновение в иммунные привилегированные участки
В то время как хозяин отвечает на Tg -инфекцию гибелью клеток и производством цитокинов в инфицированной ткани, некоторые паразиты покидают очаг первичной инфекции и распространяются в организме [ 4].Под давлением адаптивного иммунного ответа Tg переходит в стадию брадизоита и образует тканевые цисты, доживающие до смерти хозяина [37]. Tg , как полагают, перемещается к иммунопривилегированным участкам мозга и глаза, а также проникает через плаценту инфицированной женщины и врожденно заражает плод [4]. При первичных инфекциях это может привести к аборту или аномалиям плода, таким как гидроцефалия и ретинохориоидит [2,3].
Ретинохориоидит — наиболее распространенная форма врожденного токсоплазмоза, при которой инфекция приводит к увеличению экспрессии HIF1α и фактора роста эндотелия сосудов (VEGF), что приводит к усилению васкуляризации [38].Также было описано повышение уровня IL-1β, IL-6, фактора, стимулирующего гранулоциты-макрофаги-колонии (GM-CSF) и молекулы межклеточной адгезии (ICAM) -1, продуцируемых клетками пигментного эпителия сетчатки [39]. Внутриглазная жидкость глаз, инфицированных Tg , содержит повышенные уровни TGF-β [40,41], которые могут модулировать эффекты IFNγ, которые ингибируют репликацию Tg в первичных пигментных эпителиальных клетках сетчатки человека в результате триптофанового голодания [42]. Различия между клиническими случаями глазного токсоплазмоза во Франции и Колумбии подчеркивают важность понимания серьезности заболевания.Снижение внутриглазного IFNγ и IL-17 и более высокая экспрессия IL-13 и IL-6 были обнаружены у колумбийских пациентов [43], что позволяет предположить, что повышенная тяжесть глазных заболеваний, вызываемых южноамериканскими штаммами, может быть связана с ингибированием защиты, обеспечиваемой IFNγ. .
Заключительные замечания и будущие исследования
Иммунный ответ на Tg широко изучался на мышах. Поскольку мыши являются промежуточным хозяином для Tg , многие механизмы являются уникальными для этой пары хозяин-патоген и не могут быть экстраполированы на человека-хозяина.Основные направления будущих исследований:
- Пациенты с дефицитом IFNGR1 , возможно, не страдают от более высокой частоты заболеваний, передаваемых через Tg . Является ли IFNγ основным цитокином, ответственным за контроль Tg у людей во всех типах клеток?
- Южноамериканские атипичные штаммы Tg вызывают глазной токсоплазмоз, но другие штаммы не вызывают это заболевание. Что делает эти штаммы уникальными в качестве болезнетворных микроорганизмов?
- Вирулентность клональных штаммов Tg была определена на основе системы мышей и не может передаваться человеку-хозяину.Что такое факторы вирулентности Tg у человека и от каких штаммов они происходят?
- Различные типы клеток человека показывают разные ответы на инфекцию Tg . Почему нет единой стратегии защиты?
- Рекрутирование эффекторов хозяина в вакуоль составляет только 30% –50% в любой момент времени. Какие защитные механизмы хозяина действуют вне вакуоли?
- Сколько тахизоитов Tg избегают контроля острой фазы? Какая реакция хозяина заставляет паразитов покидать клетку и остаются ли они жизнеспособными?
Эти и другие открытые вопросы необходимо будет рассмотреть в будущих исследованиях, чтобы раскрыть новые механизмы реакции человека на инфекцию Tg .
Благодарности
Мы хотели бы поблагодарить Вей Лун Нга и Роберта Эванса за критическое прочтение рукописи и лабораторию Фрикеля за продуктивные обсуждения.
Ссылки
- 1. Папас Г., Руссос Н., Фалагас МЭ. Снимки токсоплазмоза: глобальный статус Toxoplasma gondii , серологическая распространенность и последствия для беременности и врожденного токсоплазмоза. Int J Parasitol. 1 октября 2009 г .; 39 [12]: 1385–94. pmid: 19433092
- 2.Сяо Дж., Йолкен Р.Х. Штаммовая гипотеза инфекции Toxoplasma gondii в результате болезней человека. Acta Physiol. 2015 Апрель; 213 [4]: 828–45.
- 3. Hill D, Dubey JP. Toxoplasma gondii : передача, диагностика и профилактика. Clin Microbiol Infect. 2002, 1 октября; 8 [10]: 634–40. pmid: 123
- 4. Харкер К.С., Уэно Н., Лодоэн МБ. Toxoplasma gondii распространение: путешествие паразита через инфицированного хозяина.Parasite Immunol. 2015 1 марта; 37 [3]: 141–9. pmid: 25408224
- 5. Газзинелли Р. Т., Мендонса-Нето Р., Лилуэ Дж., Ховард Дж., Шер А. Врожденная устойчивость против Toxoplasma gondii : эволюционная история мышей, кошек и людей. Клеточный микроб-хозяин. 2014 12 февраля; 15 [2]: 132–8. pmid: 24528860
- 6. Халдар А.К., Фольц С., Финети Р., Пиро А.С., Фили Э.М., Пилла-Моффет Д.М. и др. Системы убиквитина маркируют патоген-содержащие вакуоли как мишени для защиты хозяина с помощью белков, связывающих гуанилат.Proc Natl Acad Sci. 2015; 112 [41]: E5628–37. pmid: 26417105
- 7. Bliss SK, Marshall AJ, Zhang Y, Denkers EY. Полиморфноядерные лейкоциты человека продуцируют IL-12, TNF-α и хемокины макрофагально-воспалительный белок-1α и -1β в ответ на антигены Toxoplasma gondii . J Immunol. 1999, 15 июня; 162 [12]: 7369–7375. pmid: 10358188
- 8. Aldebert D, Durand F, Mercier C, Brenier-Pinchart M-P, Cesbron-Delauw M-F, Pelloux H. Toxoplasma gondii запускает секрецию интерлейкина-12, но низкий уровень интерлейкина-10 из линии моноцитарных клеток человека THP-1.Цитокин. 2007; 37 [3]: 206–11. pmid: 17512211
- 9. Tosh KW, Mittereder L, Bonne-Annee S, Hieny S, Nutman TB, Singer SM и др. Ответ ИЛ-12 первичных дендритных клеток и моноцитов человека на Toxoplasma gondii стимулируется фагоцитозом живых паразитов, а не инвазией клеток-хозяев. J Immunol. 2016, 1 января; 196 [1]: 345–56. pmid: 26597011
- 10. Яровинский Ф., Чжан Д., Андерсен Дж. Ф., Банненберг Г.Л., Серхан С.Н., Хайден М.С. и др. Активация TLR11 дендритных клеток простейшим профилин-подобным белком.Наука. 10 июня 2005 г .; 308 [5728]: 1626–1629. pmid: 15860593
- 11. Кобланский А.А., Янкович Д., О Х., Хиени С., Сунгнак В., Матур Р. и др. Распознавание профилина Toll-подобным рецептором 12 имеет решающее значение для устойчивости хозяина к Toxoplasma gondii . Иммунитет. 2013 24 января; 38 [1]: 119–30. pmid: 23246311
- 12. Сафронова А., Арауджо А., Каманзо Е.Т., Мун Т.Дж., Эллиотт М.Р., Бейтинг Д.П. и др. Алармин S100A11 инициирует хемокиновый ответ на человеческий патоген Toxoplasma gondii .Nat Immunol. 2019 Янв; 20 [1]: 64–72. pmid: 30455460
- 13. Witola WH, Mui E, Hargrave A, Liu S, Hypolite M, Montpetit A и др. NALP1 влияет на восприимчивость к врожденному токсоплазмозу человека, провоспалительный цитокиновый ответ и судьбу моноцитарных клеток, инфицированных Toxoplasma gondii . Заражение иммунной. 2011 февраль; 79 [2]: 756–66. pmid: 21098108
- 14. Губернатор Л., Шнайдер Калифорния, Лима Т.С., Пандори В., Лодоэн МБ. NLRP3 и отток калия вызывают быстрое высвобождение IL-1β из первичных моноцитов человека во время инфекции Toxoplasma gondii .J Immunol. 2017; 199 [8]: 2855–64. pmid: 286
- 15. Лима Т.С., Губернатор Л., Лодоэн МБ. Уклонение от опосредованной нейтрофилами человека защиты хозяина во время инфекции Toxoplasma gondii . MBio. 2018 13 февраля; 9 [1]: e02027–17. pmid: 29440572
- 16. Suzuki Y, Orellana MA, Schreiber RD, Remington JS. Гамма-интерферон: основной медиатор устойчивости к Toxoplasma gondii . Наука. 22 апреля 1988 г .; 240 [4851]: 516–518. pmid: 3128869
- 17. Даубенер В., Маккензи С., Хаддинг У.Создание Т-хелперов 1-го типа и Т-хелперов 2-го типа человека Toxoplasma антиген-специфических клонов Т-клеток. Иммунология. 1995 сентябрь; 86 [1]: 79–84. pmid: 7590886
- 18. Saeij JP, Frickel E-M. Exposing Toxoplasma gondii , скрывающаяся внутри вакуоли: роль GBPs, аутофагии и гибели клеток-хозяев. Curr Opin Microbiol. 2017; 40: 72–80. pmid: 29141239
- 19. Сэйдж JPJ, Бойл JP, Бутройд Дж. Различия между тремя основными штаммами Toxoplasma gondii и их специфические взаимодействия с инфицированным хозяином.Trends Parasitol. 1 октября 2005 г .; 21 [10]: 476–81. pmid: 16098810
- 20. Чао С.К., Геккер Г., Ху С., Петерсон П.К. Защита клеток микроглии человека от Toxoplasma gondii . Роль цитокинов. J Immunol. 1994, 1 февраля; 152 [3]: 1246–1252. pmid: 8301129
- 21. Янссен Р., ван Венген А., Верхард Э., де Бур Т., Зомердейк Т., Оттенхофф THM и др. Дивергентная роль TNF-α в индуцированном IFN-γ уничтожении Toxoplasma gondii и Salmonella typhimurium вносит свой вклад в избирательную восприимчивость пациентов с частичным дефицитом рецептора 1 IFN-γ.J Immunol. 2002, 1 октября; 169 [7]: 3900–3907. pmid: 12244188
- 22. Андраде Р.М., Вессендарп М., Губбелс М.-Дж., Стрипен Б., Субаусте CS. CD40 индуцирует активность макрофагов против Toxoplasma gondii путем запуска зависимого от аутофагии слияния патоген-содержащих вакуолей и лизосом. J Clin Invest. 2006, 1 сентября; 116 [9]: 2366–77. pmid: 16955139
- 23. Muniz-Feliciano L, Van Grol J, Portillo J-AC, Liew L, Liu B, Carlin CR и др. Toxoplasma gondii -индуцированная активация EGFR предотвращает опосредованную аутофагией гибель паразита.PLoS Pathog. 19 декабря 2013 г .; 9 [12]: e1003809 – e1003809. pmid: 24367261
- 24. Фиш Д., Якимович А., Клаф Б., Райт Дж., Буньян М., Хауэлл М. и др. Определение взаимодействий «хозяин-патоген» с использованием рабочего процесса искусственного интеллекта. Элиф. 2019 12 февраля; 8 e40560. pmid: 30744806
- 25. Селлек Е.М., Орчард Р.К., Лассен К.Г., Битти В.Л., Ксавье Р.Дж., Левин Б. и др. Неканонический путь аутофагии ограничивает рост Toxoplasma gondii штамм-специфическим образом в IFN-γ-активированных клетках человека.MBio. 2015 8 сентября; 6 [5]: e01157–15. pmid: 26350966
- 26. Клаф Б., Райт Дж. Д., Перейра П. М., Херст Е. М., Джонстон А. С., Энрикес Р. и др. K63-связанное убиквитинирование нацелено на Toxoplasma gondii для эндолизосомного разрушения в IFNγ-стимулированных клетках человека. PLoS Pathog. 2016; 12 [11]: e1006027. pmid: 27875583
- 27. Фиш Д., Бандо Х., Клаф Б., Хорнунг В., Ямамото М., Шеной А.Р. и др. Человеческий GBP1 является специфическим для микробов привратником апоптоза и пироптоза макрофагов.EMBO J. 31 мая 2019 г .; e100926. pmid: 31268602
- 28. Бестейро С. Toxoplasma Контроль апоптоза хозяина: искусство не кусать слишком сильно руку, которая вас кормит. Микробная клетка. 2015 30 мая; 2 [6]: 178–81. pmid: 28362004
- 29. Qin A, Lai D-H, Liu Q, Huang W, Wu Y-P, Chen X и др. Гуанилат-связывающий белок 1 [GBP1] способствует иммунитету мезенхимальных стромальных клеток человека против Toxoplasma gondii . Proc Natl Acad Sci. 2017 г. 114 [6]: 1365–1370.pmid: 28123064
- 30. Джонстон А.С., Пиро А., Клаф Б., Сью М., Виррейра Винтер С., Коерс Дж. И др. Человеческий GBP1 не локализуется в вакуолях патогенов, но ограничивает Toxoplasma gondii . Cell Microbiol. 2016 август; 18 [8]: 1056–64. pmid: 26874079
- 31. Niedelman W, Sprokholt JK, Clough B, Frickel E-M, Saeij JPJ. Гибель клеток человеческих фибробластов, стимулированных гамма-интерфероном, при инфицировании Toxoplasma gondii вызывает ранний выход паразита и ограничивает репликацию паразита.Заражение иммунной. 2013 декабрь; 81 [12]: 4341–9. pmid: 24042117
- 32. Pfefferkorn ER. Гамма-интерферон блокирует рост Toxoplasma gondii в человеческих фибробластах, побуждая клетки-хозяева разлагать триптофан. Proc Natl Acad Sci. 1984 Февраль; 81 [3]: 908–12. pmid: 6422465
- 33. Бандо Х., Сакагучи Н., Ли Й., Прадипта А., Ма Дж. С., Танака С. и др. Эффектор токсоплазмы TgIST нацелен на IDO1 хозяина, чтобы противодействовать IFN-γ-индуцированному антипаразитарному ответу в клетках человека.Vol. 9, Границы иммунологии. 2018. с. 2073. pmid: 30283439
- 34. Woodman JP, Dimier IH, Bout DT. Эндотелиальные клетки человека активируются IFN-гамма для ингибирования репликации Toxoplasma gondii . Механизм ингибирования отличается от механизма, существующего в макрофагах мыши и фибробластах человека. J Immunol. 1991, 15 сентября; 147 [6]: 2019–2023. pmid: 1909738
- 35. Олиас П., Этеридж Р.Д., Чжан Й., Хольцман М.Дж., Сибли Л.Д. Эффектор Toxoplasma рекрутирует комплекс Mi-2 / NuRD для репрессии транскрипции STAT1 и блокирования IFN-γ-зависимой экспрессии гена.Клеточный микроб-хозяин. 2016; 20 [1]: 72–82. pmid: 27414498
- 36. Гей Дж., Браун Л., Бренье-Пинчарт М.П., Воллер Дж., Жоссеран В., Бертини Р.-Л. и др. Toxoplasma gondii TgIST кооптирует репрессоры хроматина хозяина, подавляя STAT1-зависимую регуляцию гена и опосредованную IFN-γ защиту хозяина. J Exp Med. 2016; 213 [9]: 1779–98. pmid: 27503074
- 37. Дзерзинский Ф., Ниши М., Оуко Л., Роос Д.С. Динамика дифференцировки Toxoplasma gondii . Эукариотическая клетка.2004, 1 августа; 3 [4]: 992–1003. pmid: 15302832
- 38. Копье У., Чан Д., Коппенс I, Джонсон Р.С., Джачча А., Блейдер И.Дж. Фактор транскрипции клетки-хозяина, индуцируемый гипоксией фактор 1, необходим для роста и выживания Toxoplasma gondii при физиологических уровнях кислорода. Cell Microbiol. 2006 1 февраля; 8 [2]: 339–52. pmid: 16441443
- 39. Нагинени К.Н., Детрик Б., Хукс Дж. Дж. Toxoplasma gondii Инфекция индуцирует экспрессию гена и секрецию интерлейкина 1 [IL-1], IL-6, гранулоцитарно-макрофагального колониестимулирующего фактора и молекулы межклеточной адгезии 1 клетками пигментного эпителия сетчатки человека.Заражение иммунной. 2000 Янв; 68 [1]: 407–10. pmid: 10603418
- 40. Streilein JW, Wilbanks GA, Cousins SW. Иммунорегуляторные механизмы глаза. J Neuroimmunol. 1992, 1 августа; 39 [3]: 185–200. pmid: 1644895
- 41. Нагинени К.Н., Детрик Б., Хукс Дж. Дж. Экспрессия трансформирующего фактора роста-бета в клетках пигментного эпителия сетчатки человека усиливается за счет Toxoplasma gondii : возможная роль в иммунопатогенезе ретинохориоидита. Clin Exp Immunol. 2002 Май; 128 [2]: 372–8.pmid: 11985530
- 42. Нагинени К.Н., Пардхасаради К., Мартинс М.С., Детрик Б., Хукс Дж. Дж. Механизмы индуцированного интерфероном подавления репликации Toxoplasma gondii в клетках пигментного эпителия сетчатки человека. Заражение иммунной. 1996 Октябрь; 64 [10]: 4188–96. pmid: 8926087
- 43. де-ла-Торре А., Зауэр А., Пфафф А. В., Бурсье Т., Брюне Дж., Шпиг-Шатц С. и др. Тяжелый южноамериканский глазной токсоплазмоз связан со снижением уровня IFN-γ / IL-17α и повышением внутриглазных уровней IL-6 / IL-13.PLoS Negl Trop Dis. 2013 21 ноября; 7 [11]: e2541. pmid: 24278490


