Растереть на аминокислоты
«Нужно обязательно употреблять белки!» — подобные рекомендации хотя бы раз в жизни слышал каждый. По идее, эти вещества мы можем спокойно получить из пищи — организм тут же займется расщеплением для дальнейшего усвоения. А что делать людям, желудочно-кишечный тракт которых не способен переработать их самостоятельно? Или любителям спорта, не успевающим «заправиться» после активных упражнений?Несбалансированное питание является важной проблемой для организма. Недостаточное или избыточное употребление белков, жиров, углеводов, микроэлементов приводит к нарушению обмена веществ и тяжелым заболеваниям: сахарному диабету, болезням сердца и сосудов. Кроме того, люди нередко испытывают значительный дефицит микронутриентов (питательных веществ) — до 80 % населения РФ, как показывают исследования Роспотребнадзора.
— Немаловажное значение в регуляции обмена веществ играют аминокислоты и олигопептиды, — рассказывает старший научный сотрудник Института химии твердого тела и механохимии СО РАН кандидат химических наук Алексей Леонидович Бычков. — Аминокислоты — это органические соединения, из которых состоят все белки, а олигопептиды — промежуточные соединения, где находится до 7—10 аминокислот.
Заменимые аминокислоты способны синтезироваться в организме, а вот незаменимые человек получает только из пищи, содержащей полноценные белки. Однако желудок не всегда может расщеплять их до более коротких молекул из-за ряда расстройств или после хирургического вмешательства. Для этого и разрабатывается питание с уже разделенными на части белками.
Чтобы получить востребованный продукт должного качества, нужны консультации экспертов из других областей. Ученые ИХТТМ СО РАН сотрудничают с двумя организациями: кафедрой технологии организации пищевых производств Новосибирского государственного технического университета и Институтом экспериментальной ветеринарии Сибири и Дальнего Востока Россельхозакадемии. Уже были проведены предварительные эксперименты: исследователи извлекли и расщепили белки из гороха, пищевики сделали супы-пюре и хлебцы, а в ИЭВСиДВ продукты испытали на животных (спойлер — всё прошло хорошо).
— Человек не может синтезировать все аминокислоты самостоятельно: приходится искать их в пище, — поясняет Алексей Бычков. — Есть такая научная шутка: как химику узнать, из чего состоит рояль? Нужно его растворить! Однако проблема в том, что не все вещества могут растворяться и реагировать друг с другом с нужной скоростью. В таких случаях и помогает химия твердого тела: проводя механохимическую обработку, можно добиться повышения реакционной способности материала. Здесь прежде всего необходимо не измельчение, а более тонкие процессы, меняющие структуру объекта.
При механическом воздействии с помощью специальных мельниц-активаторов в твердом теле возникает напряжение: в результате появляется трещина и происходит разрыв, деформация. Кроме того, разрушается кристаллическая структура вещества, рвутся химические связи. «Перемешав» кристаллические решетки, какую-то часть связей легче порвать.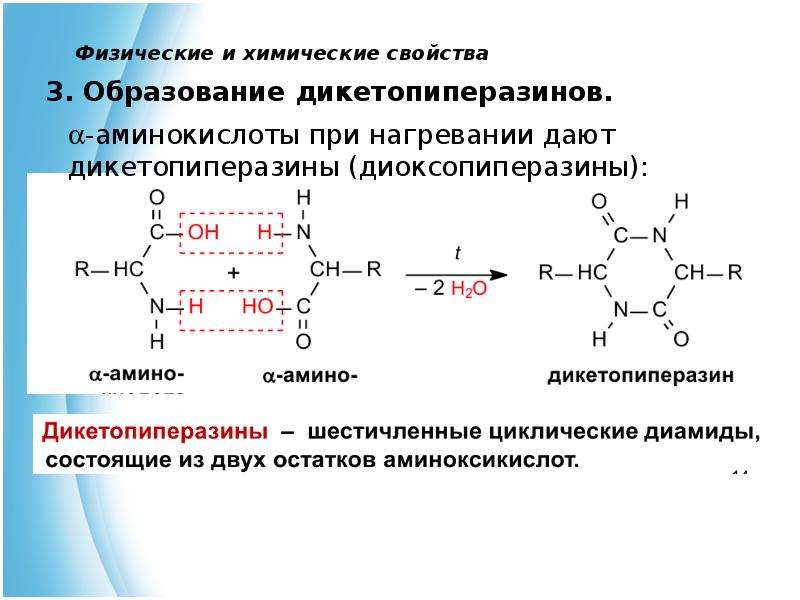 Структура аморфизуется, и ферменты относительно легко гидролизуют субстраты. Происходит химическая реакция, итог которой — образование новых соединений (в том числе необходимых аминокислот и олигопептидов).
Структура аморфизуется, и ферменты относительно легко гидролизуют субстраты. Происходит химическая реакция, итог которой — образование новых соединений (в том числе необходимых аминокислот и олигопептидов).
— Если смешать зеленый и красный пластилин и помять его, даже не измельчая, в итоге кусок станет разноцветным, — рассказывает Алексей Бычков. — То же с растительным сырьем: нам больше интересно не измельчение, а получаемая внутренняя структура: как упакованы полимеры, упорядочены они или нет, взаимодействуют они между собой. Это во многом определяет реакционную способность.
Сибирские исследователи направляют свои разработки на тех людей, у которых есть потребность в подобных продуктах по состоянию здоровья. Другой вариант — спортивное питание, ведь в России практически нет своих производств.
— Большая часть потребителей спортпита — люди, которые ходят в тренажерный зал, — добавляет ученый.
— В основном этот рынок представлен либо изолятами (белки, выделенные из сырья без расщепления), либо гидролизатами. Последние более эффективны, потому что в них молекулы расщеплены, но при этом дороже и не столь доступны обыкновенным спортсменам-энтузиастам.
На разработку ученых ИХТТМ выделен грант РНФ (в рамках президентской программы поддрежки исследований — прим. ред. сайта rscf.ru). Полученные данные позволят не только создавать компоненты продуктов функционального и лечебно-профилактического питания, но будут востребованы при решении проблем переработки других природных веществ — полимеров.
Белки – Наука – Коммерсантъ
Белки, с химической точки зрения, являются обыкновенными полимерами, такими же, как полиэтилен или ПВХ. Только если в полиэтилене полимерная цепочка составлена из одинаковых элементов — мономеров, в белках могут использоваться разные мономеры, соединенные в определенной последовательности.
Трехмерная структура белка. Чтобы белок заработал, его полипептидная цепочка должна правильным образом сложиться в пространстве (это правильное сложение соответствует минимуму энергии). Пока наука не может точно предсказать трехмерную структуру белка по его последовательности. Разделяется несколько уровней структуры белка.
 Первичной структурой называется последовательность аминокислот в полипептидной цепочке. Основными элементами вторичной структуры являются альфа-спирали и бета-слои. В случае альфаспирали, водородные связи между соседними аминокислотами в цепочке закручивают ее в плотную спираль. В случае бета-слоев, водородные связи между двумя пептидными цепочками соединяют эти цепочки в плоскую ленту. Третичная структура охватывает полную структуру полипептидной цепочки. Если несколько молекул объединяются, образуя функциональный белок (например, гемоглобин крови состоит из четырех полипептидных цепочек), то говорят о четвертичной структуре белка.
Первичной структурой называется последовательность аминокислот в полипептидной цепочке. Основными элементами вторичной структуры являются альфа-спирали и бета-слои. В случае альфаспирали, водородные связи между соседними аминокислотами в цепочке закручивают ее в плотную спираль. В случае бета-слоев, водородные связи между двумя пептидными цепочками соединяют эти цепочки в плоскую ленту. Третичная структура охватывает полную структуру полипептидной цепочки. Если несколько молекул объединяются, образуя функциональный белок (например, гемоглобин крови состоит из четырех полипептидных цепочек), то говорят о четвертичной структуре белка.
Строение белков
Среди органических веществ белки, или протеины, — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. На их долю приходится
Молекулы белков имеют большие размеры, поэтому их называют макромолекулами.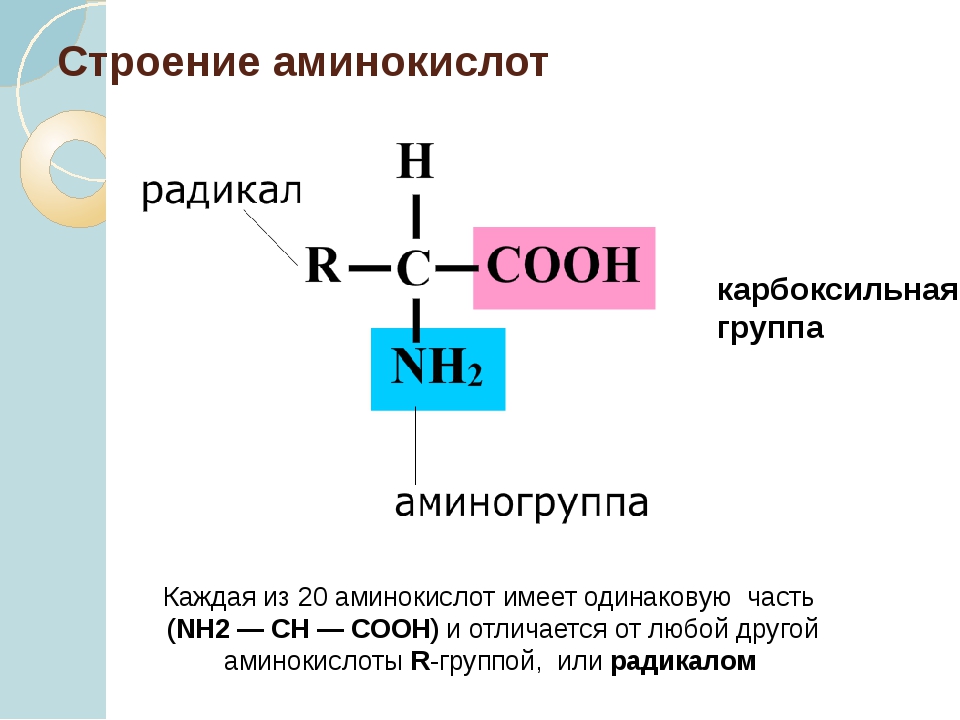 Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо. Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты (рис. 1)
Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо. Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты (рис. 1)
Бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде:
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (—NH2) с основными свойствами, другая — карбоксильной группой ( —COOH) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение. Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их высокую реакционную способность. через эти группы происходит соединение аминокислот при образовании белка. При этом возникает молекула воды, а освободившиеся электроны образуют пептидную связь. Поэтому белки называют полипептидами.
При этом возникает молекула воды, а освободившиеся электроны образуют пептидную связь. Поэтому белки называют полипептидами.
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции.
Большинство белков имеют вид спирали в результате образования водородных связей между
Третичная структура — трехмерная пространственная «упаковка» полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация — глобула. Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
Четвертичная структура характерна не для всех белков. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул белка.
Такая сложность структуры белковых молекул связана с разнообразием функций, свойственных этим биополимерам.
Этот процесс частично обратим: если не нарушена первичная структура, то денатурированный белок способен восстанавливать свою структуру. Отсюда следует, что все особенность строение макромолекулы белка определяются его первичной структурой.
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные белки
Другие заметки по биологии
Строение белков — урок. Химия, 8–9 класс.
Белки являются обязательной составной частью любого живого организма и играют важнейшую роль в обеспечении процессов жизнедеятельности.
В состав белков обязательно входят четыре химических элемента: углерод, водород, кислород и азот. Многие белки содержат серу. В состав некоторых входит фосфор. Есть белки, содержащие атомы металлов.
Белки — природные высокомолекулярные вещества (полимеры), состоящие из остатков аминокислот.
Аминокислотные остатки соединены в макромолекулах белков пептидной группой −NH−CO−, поэтому белки относят к полипептидам.
В состав белков входят двадцать аминокислот строения Nh3−C|H−COOHR. Аминокислотные остатки соединяются в макромолекулы белков в различной последовательности. Число аминокислотных остатков в молекулах тоже может быть разное. Поэтому многообразие белков практически безгранично. Каждый организм на Земле имеет свой собственный неповторимый набор белков.
Поэтому многообразие белков практически безгранично. Каждый организм на Земле имеет свой собственный неповторимый набор белков.
Белковые молекулы могут содержать от одного до нескольких сотен и даже тысяч аминокислотных остатков, поэтому их относительные молекулярные массы изменяются от десятков тысяч до нескольких миллионов. Так, относительная молекулярная масса гемоглобина равна \(68 000\), яичного белка — \(44 000\), а вируса гриппа — \(32 000 000\).
Свойства белка в первую очередь определяются порядком соединения аминокислотных остатков в полипептидной цепи.
Последовательность аминокислотных остатков в макромолекуле называется первичной структурой белка.
Первичная структура
Существуют вторичная (спираль) и третичная (клубок) структуры белковых молекул. Они образуются в результате внутримолекулярного взаимодействия частей полипептидной цепи.
Вторичная структура
Третичная структура
Несколько белковых молекул могут соединяться друг с другом и образовывать четвертичную структуру.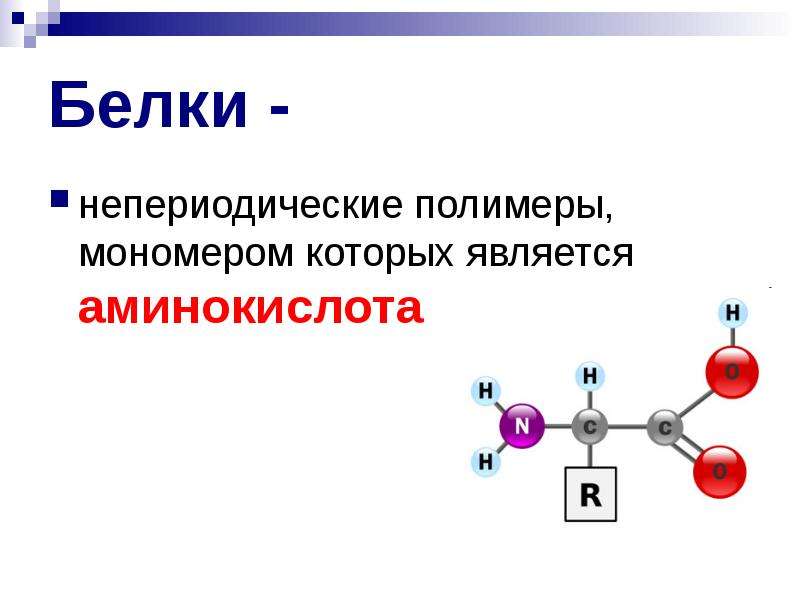
Четвертичная структура
Источники:
Рудзитис Г. Е., Фельдман Ф. Г. Химия. 9 класс. М.: Просвещение, 2009. — 170 с.
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2011. — 226 с.
Вишневская Е. И., Ельницкий А. П. и др. Химия. 9 класс. Минск: Нар. асвета, 2012. — 199 с.
Аминокислоты для здоровья | Гомельский областной ЦГЭ и ОЗ
В природе существует более 500 различных аминокислот, из них всего 20 входят в состав белка. Аминокислотами называют гетерофункциональные соединения, содержащие одновременно амино- и карбоксильную группы в составе одной молекулы. Они хорошо растворимы в воде и нерастворимы в органических растворителях.
Аминокислоты участвуют во всех жизненных процессах. Это те самые кирпичики из которых состоит белок. В человеческом теле практически все органы состоят из белков – это и мышцы, и различные соединительные ткани, внутренние органы, железы, ногти, волосы, кожа, кости и жидкости.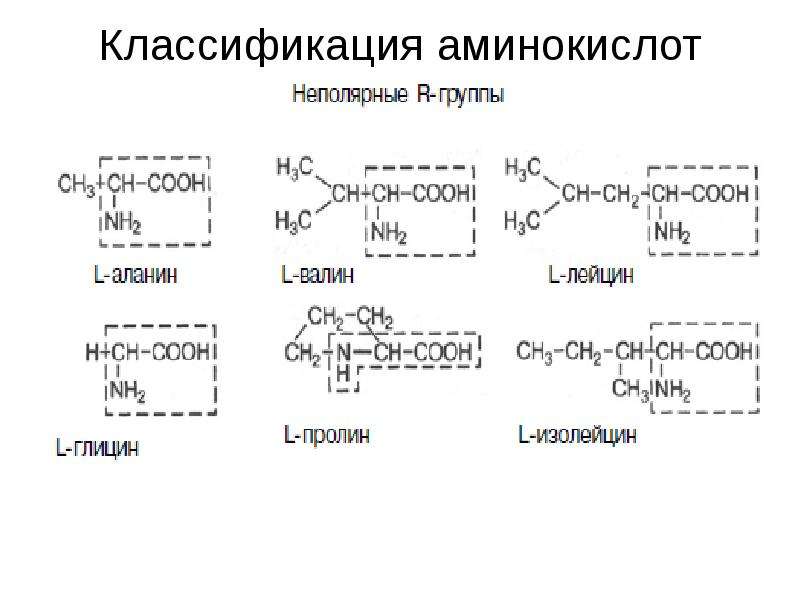 Некоторые белки содержат все незаменимые аминокислоты в количестве, достаточном для организма человека и животных. Такие белки называются биологически полноценными.
Некоторые белки содержат все незаменимые аминокислоты в количестве, достаточном для организма человека и животных. Такие белки называются биологически полноценными.
Организм синтезирует аминокислоты самостоятельно. Но есть целая группа аминокислот, которых организм сам синтезировать не может. Эти аминокислоты являются незаменимыми. Всего насчитывается 8 незаменимых аминокислот: лейцин, валин, изолейцин, лизин, фенилаланин, треонин, метионин и триптофан. Такие аминокислоты должны поступать в организм извне. В случае отсутствия или недостатка в рационе питания незаменимых аминокислот в организме нарушается белковый синтез.
Условно-незаменимые аминокислоты синтезируются в организме в небольшом количестве. Этого недостаточно для здорового функционирования организма, поэтому они должны дополнительно поступать либо с пищей, либо с пищевыми добавками. К этой группе относятся аргинин и гистидин.
Аргинин – аминокислота, которая вырабатывается организмом здорового взрослого человека самостоятельно, но у младенцев и пожилых людей синтез этого вещества существенно снижен.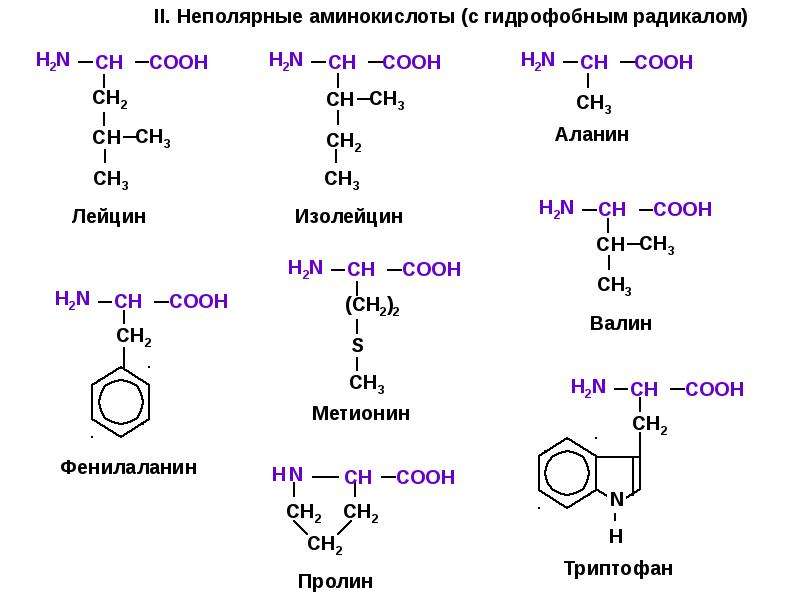 Аргинин выступает стимулятором роста у детей и подростков, а также может быть показан при беременности при малом весе плода. Основная функция аргинина состоит в его способности повышать уровень оксида азота, т.е. он обеспечивает гибкость сосудов, поддерживает их тонус, улучшает циркуляцию крови, что приводит к лучшему снабжению тканей и органов (орехи, особенно арахис и кедровые орехи, тыквенные и кунжутные семечки, немного меньше его в рыбе, птице, в мясных и молочных продуктах).
Аргинин выступает стимулятором роста у детей и подростков, а также может быть показан при беременности при малом весе плода. Основная функция аргинина состоит в его способности повышать уровень оксида азота, т.е. он обеспечивает гибкость сосудов, поддерживает их тонус, улучшает циркуляцию крови, что приводит к лучшему снабжению тканей и органов (орехи, особенно арахис и кедровые орехи, тыквенные и кунжутные семечки, немного меньше его в рыбе, птице, в мясных и молочных продуктах).
Гистидин способствует восстановлению поврежденных тканей, образованию лейкоцитов и эритроцитов, строительству миелиновых оболочек клеток. Эта аминокислота необходима в период с рождения до двадцати одного года, а также в периоды восстановления после перенесенных тяжелых заболеваний и травм. Дефицит гистидина может спровоцировать проблемы со слухом, а избыток – развитие неврозов и даже психозов (орехи, семечки, бананы, сухофрукты, бобовые, молочные продукты (особенно сыр), рыба (особенно лосось и тунец), мясе домашней птицы, говядине (филе), свинине (вырезка).
В отдельную группу выделяют условно-заменимые аминокислоты – цистеин и тирозин, их синтез осуществляется при наличии незаменимых аминокислот. При недостатке предшественников эти аминокислоты могут стать незаменимыми.
Цистеин в организме производится из незаменимой аминокислоты метионин и при его недостатке также может стать незаменимой аминокислотой. Цистеин необходим организму для производства таурина, который регулирует работу нервной системы, и глутатиона, отвечающего за иммунную систему организма. Цистеин входит в состав коллагена, кератина, инсулина, при необходимости может трансформироваться в глюкозу, наполняя организм энергией, регулирует давление, снижает холестерин в крови, выводит из организма токсические вещества.
Тирозин вырабатывается в здоровом организме из незаменимой аминокислоты фенилаланин. Он регулирует синтез гормонов щитовидной железы, надпочечников, гипофиза. Улучшает мыслительные процессы, памяти, помогает противостоять стрессовым ситуациям, а также поддерживает хорошее настроение.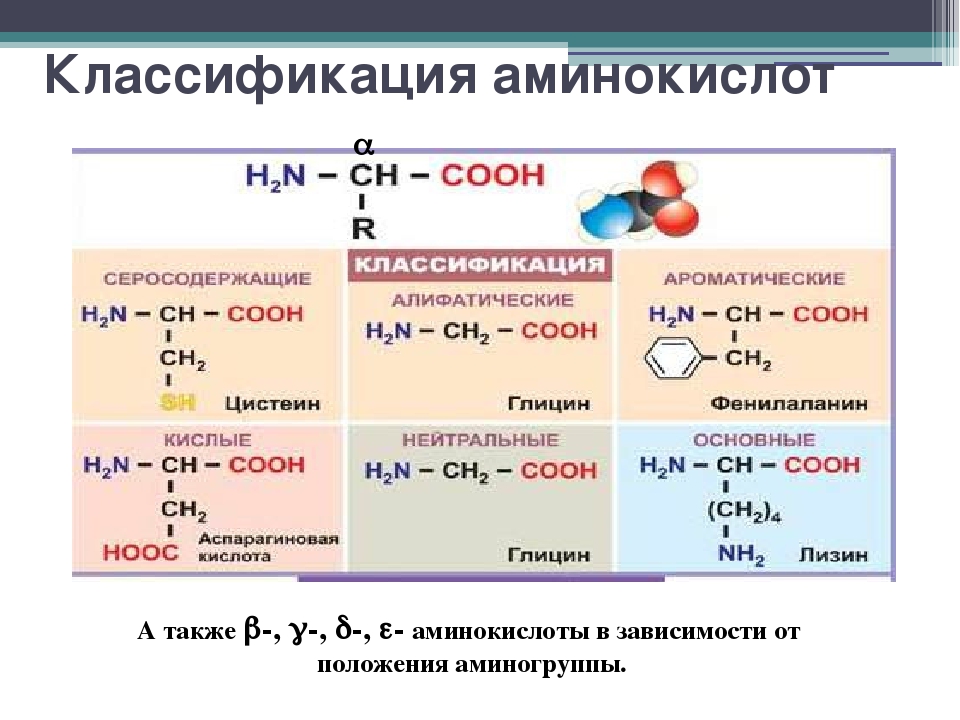 Отвечает за выработку пигмента меланина, благодаря которому мы имеет тот или иной цвет волос, кожи. Для спортсменов важно также, что тирозин участвуя в синтезе белка, способствует росту мышечных тканей, ускоряет восстановление после тяжелой физической нагрузки.
Отвечает за выработку пигмента меланина, благодаря которому мы имеет тот или иной цвет волос, кожи. Для спортсменов важно также, что тирозин участвуя в синтезе белка, способствует росту мышечных тканей, ускоряет восстановление после тяжелой физической нагрузки.
Незаменимые аминокислоты
| Аминокислота | Значение | Содержание |
| Лейцин | выработка инсулина, строительный материал для белка мышц | соевый белок, молочный белок – казеин и сывороточный белок. |
| Изолейцин | в меньшей степени активирует рост мышечной ткани, в большей снабжает их глюкозой, участвует в синтезе гемоглобина, для усвоение изолейцина и лейцина необходим биотин (витамин B7) | миндаль, кешью, куриное мясо, нут, яйца, рыба, чечевица, печень, мясо, рожь, большинство семян, сои. |
| Метионин | необходим для выработки и таурина, для синтеза креатина, коллагена, участвует в синтезе серотонина, а также способствует выработке адреналина. помогает печени в переработке жиров, выведению тяжелых металлов, метионин снижает уровень гистамина в крови помогает печени в переработке жиров, выведению тяжелых металлов, метионин снижает уровень гистамина в крови | бразильские орехи, говядина, свинина, курица, кролик, морская рыба, бобовые, яйцах, творог, молоко, кефир, сыр твердых сортов |
| Фенилаланин | тирозин вырабатывается только из фенилаланина, образует дофамин и другие катехоламины, снижает депрессивные симптомы, продукты метаболизма фенилаланина обладают токсическим эффектом и при значительном избытке этой аминокислоты возможно негативное влияние на нервную систему | белки сои, сыр твердых сортов, орехи и семена растений, мясо (говядина, птица) и рыба (тунец), яйца, молочные продукты, фасоль и зерновые культуры |
| Триптофан | триптофан (точнее примерно 1 % от общего количества, поступающего с пищей) перерабатывается в серотонин, часть которого преобразуется в мелатонин (гормон сна). При недостатке сокращается синтез белков и ниацина (витамин B3), как следствие может развиться пеллагра. Серотонин способен повышать болевой порог и снимать состояния тревожности, беспокойства, а мелатонин понижает интенсивность многих физиологических процессов и способствует наступлению глубокого и спокойного сна. Серотонин способен повышать болевой порог и снимать состояния тревожности, беспокойства, а мелатонин понижает интенсивность многих физиологических процессов и способствует наступлению глубокого и спокойного сна. | икра (красная и черная), голландский сыр, арахис и другие орехи, соевые бобы и другие бобовые (фасоль, горох), мясо курицы, кролика и индейки, кальмары, ставрида, сельдь, лосось и треска, а также куриные яйца, творог (и другие молочные продукты) и шоколад. |
| Треонин | необходим для синтеза серина и глицина, треонин входит в состав зубной эмали, избыток приводит к накоплению мочевой кислоты | мясо, птица, яйца, сыр, жирная морская рыба, морепродукты, грибах, чечевица, фасоль, пшеница, рожь, гречка, орехи. |
| Лизин | синтез почти всех видов белков, он выполняет важнейшие функции в организме – в частности, обеспечивает работу иммунной системы, составляя существенную часть коллагена, поддерживает необходимый баланс азота, участвует в усвоении кальция в пищеварительном тракте, без лизина невозможен синтез многих гормонов, ферментов | бобовые, куриц, сом говядина, молоко и молочные продукты, яйца, семечки и орехи |
| Валин | участвует в синтезе белка, защищает миелиновые оболочки нервных волокон, улучшает нервные процессы, участвует в азотистом обмене, защищает миелиновые оболочки нервных волокон, препятствует снижению уровня серотонина, участвует в азотистом обмене. | яйца, сыр, икра красная, соя (зерно), чечевица, арахис, горбуша, фисташки, молоко сухое. |
Толкачёва Екатерина Александровна,
отдел общественного здоровья государственного учреждения
«Гомельский областной центр гигиены, эпидемиологии и общественного здоровья»
Всем ли нужен дополнительный коллаген и где его брать?
ЧТО ТАКОЕ КОЛЛАГЕН
Коллаген – это белок, состоящий преимущественно из трех аминокислот: глицина, пролина и гидроксипролина, а также гидроксилизина. Глицин и пролин мы синтезируем сами, а вот лизин должны употреблять с пищей. Это незаменимая аминокислота.
Гидроксипролин и гидроксилизин делают в уже синтезированном протоколагене ферменты гидроксилазы. Для этой реакции нужна аскорбиновая кислота, то есть витамин С. Вне клеток-фибробластов коллагеновые волокна проходят сборку и сочетаются поперечными сшивками, которые обеcпечивают упругость и прочность каркаса.
Коллаген в коже разрушается и заменяется новым. Его образование поддерживают половые гормоны: эстрогены у женщин, тестостерон у мужчин. Коллаген может портиться в результате свободнорадикальных процессов в коже, а также благодаря действию ультрафиолета. Последний процесс называется фотостарением и имеет достаточно длительный эффект. Включаются гены разрушения коллагена, и подавляются гены синтеза.
Итак, чтобы в коже или других органах был коллаген, нужны незаменимые аминокислоты, витамин С, определенный уровень половых гормонов и отсутствие длительного воздействия ультрафиолета. Незаменимые аминокислоты можно употребить не только в добавках коллагена, а коллаген из крема, даже его пептиды, если они не величиной с 2–3 аминокислоты, в кожу не проникнут. И точно не встроятся.
КАКИЕ СУЩЕСТВУЮТ ДОКАЗАТЕЛЬСТВА ЭФФЕКТИВНОСТИ ПРИМЕНЕНИЯ ДОБАВОК КОЛЛАГЕНА?
При остеоартрите (ОА), когда разрушается внутренняя поверхность суставов, протокол советует местное применение нестероидных противовоспалительных препаратов. О коллагене и других «хондропротекторах» речь не идет. Однако метаанализ исследований, когда люди с ОА принимали коллаген, сообщает, что они какое-то время испытывают меньшую боль, но ничего не восстанавливается. В долгосрочной перспективе добавки совсем не спасают. Сейчас только подтверждено, что никакие добавки неэффективны в качестве лекарства от ОА. Поэтому если вы бегаете, и вам советуют пить коллаген, потому что «стираются колени», не соглашайтесь. Пока у вас нормальный индекс массы тела и здоровый рацион, остеоартрит вам не грозит.
О коллагене и других «хондропротекторах» речь не идет. Однако метаанализ исследований, когда люди с ОА принимали коллаген, сообщает, что они какое-то время испытывают меньшую боль, но ничего не восстанавливается. В долгосрочной перспективе добавки совсем не спасают. Сейчас только подтверждено, что никакие добавки неэффективны в качестве лекарства от ОА. Поэтому если вы бегаете, и вам советуют пить коллаген, потому что «стираются колени», не соглашайтесь. Пока у вас нормальный индекс массы тела и здоровый рацион, остеоартрит вам не грозит.
Ревматоидный артрит (РА) – хроническое, связанное с воспалением, аутоиммунное заболевание, когда в суставах разрушается хрящ. Протокол лечения РА также не предусматривает применения коллагена. Но уже не первое десятилетие исследуют влияние добавок с коллагеном на состояние пациентов. Некоторые работы показали улучшение состояния суставов и уменьшение боли и отека, но при условии, что у пациентов нет аутоантител к коллагену. То есть не каждый случай РА сопровождается разрушением коллагена.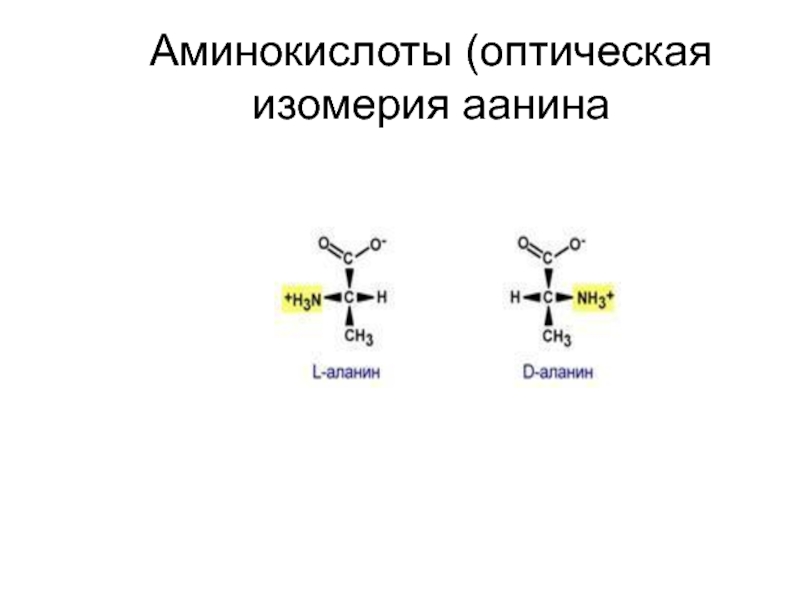
Заживление ран. Коллаген коров и нильской тилапии – эффективный новейший материал для покрытия ран. Локальное применение коллагеновой сетки активирует работу фибробластов – клеток дермы, которые образуют коллаген и другие компоненты матрикса и участвуют в заживлении ран. Это не добавки, это – новые материалы и случай, когда коллаген находит применение в медицине.
Упругость и целостность кожи. Коллаген является источником аминокислот. Войдут ли они в состав нового коллагена, зависит от гормонального фона, наших энергозатрат, пребывания на солнце и потребности кожи в восстановлении. Некоторые исследования действительно показали, что люди, которые на протяжении нескольких месяцев ежедневно употребляли коллаген, имели более упругую кожу, а пролин из пептидов коллагена эффективно доходит до кожи.
Интересную сторону вопроса открывают пептиды коллагена. Его расщепление в кишечнике может быть неполным, и ди-, три- или даже чуть большие пептиды (фрагменты белка из двух, трех или более аминокислот) проникают в кровь. Пептиды могут активировать фибробласты кожи и способствовать образованию ими гиалуроновой кислоты и эластана, а также брать на себя удар свободных радикалов и тем самым защищать кожу от некоторых аспектов фотостарения.
Пептиды могут активировать фибробласты кожи и способствовать образованию ими гиалуроновой кислоты и эластана, а также брать на себя удар свободных радикалов и тем самым защищать кожу от некоторых аспектов фотостарения.
Люди с пролежнями. Рандомизированные исследования, проведенные в нескольких клинических центрах, показали эффективность дополнения рациона больных с пролежнями 10 граммами пептидов коллагена, железом и витамином С.
ГДЕ ВЗЯТЬ КОЛЛАГЕН
Исследования, проведенные еще в 1980-е, доказали, что коллаген успешно расщепляют ферменты нашего желудка и поджелудочной железы. Но дальнейшие работы показали, что если пить частично расщепленный (гидролизованный) коллаген, то уровень аминокислот в крови растет быстрее. В конце концов они все равно попадают в кровоток. Всем известен частично гидролизованный коллаген – желатин. Вы можете его добавлять к фруктовым пюре и делать желе – это соединит витамин С, флавоноиды с аминокислотами коллагена. Коллаген или его аминокислоты есть в ухе и студне, поэтому можете время от времени готовить студенистые блюда. Хотя это все равно не гарантирует, что аминокислоты достанутся фибробластам кожи, а не станут источником энергии или мышцами, например.
Коллаген или его аминокислоты есть в ухе и студне, поэтому можете время от времени готовить студенистые блюда. Хотя это все равно не гарантирует, что аминокислоты достанутся фибробластам кожи, а не станут источником энергии или мышцами, например.
Вы можете пить коллаген или его пептиды. Если не болит желудок и хорошо происходит пищеварение, никто этого не запрещает. В исследованиях на мышиной модели старения фигурируют дозы 400–800 мг/кг. То есть если перевести на людей, лицу весом 60 кг следует ежедневно есть по крайней мере 24 грамма коллагена. Это как большая пачка желатина и половина дневной порции белка – многовато. Людям советуют есть его 5–15 граммов в сутки. В исследованиях на людях преимущественно использовали дозу 3–8 граммов в сутки в течение нескольких месяцев.
Источник
D-аминокислоты: не только в Зазеркалье
По до сих пор неизвестным причинам в состав белков живых организмов входят преимущественно L-энантиомеры (оптические изомеры) аминокислот, — за довольно редкими и разрозненными исключениями вроде пептидных веществ, образующихся в грибах и бактериях путём нерибосомного синтеза.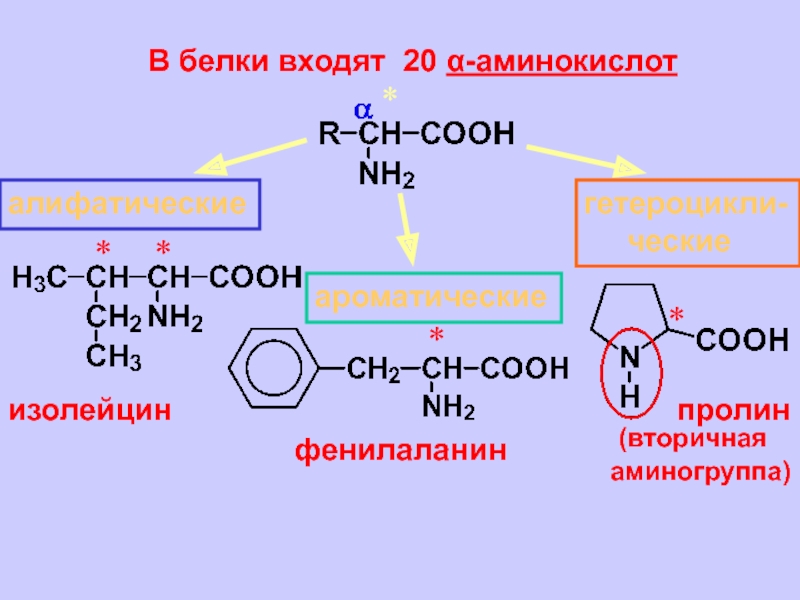 (Зато сахара находятся преимущественно в D-форме.) Новое исследование выводит D-аминокислоты из «зазеркалья»: обнаружено, что некоторые бактерии — в частности, холерный вибрион и сенная палочка, — синтезируют D-формы аминокислот. Они используются бактериями как связующий компонент пептидогликанового слоя, а также регулируют работу ферментов, ответственных за армирование клеточных стенок.
(Зато сахара находятся преимущественно в D-форме.) Новое исследование выводит D-аминокислоты из «зазеркалья»: обнаружено, что некоторые бактерии — в частности, холерный вибрион и сенная палочка, — синтезируют D-формы аминокислот. Они используются бактериями как связующий компонент пептидогликанового слоя, а также регулируют работу ферментов, ответственных за армирование клеточных стенок.
Верно ли, что Оспод и Погг, не ограничиваясь обычным загрязнением беззащитной, пустынной планеты, решили, по пьяному делу, учинить на ней, самым бесстыдным и возмутительным образом, биологическую эволюцию, какой еще свет не видывал? <…> Верно ли, что эти безобразники, лишенные всякого чувства приличия и нравственных тормозов, вылили на скалы безжизненной Земли шесть бочек заплесневелого желатинового клея и два ведра испорченной альбуминовой пасты, подсыпали туда забродившей рыбозы, пентозы и левуллозы и, словно им мало было всех этих гадостей, добавили три больших бидона с раствором прокисших аминокислот, а получившееся месиво взболтали угольной лопатой, скособоченной влево, и кочергой, скрученной в ту же сторону, в результате чего белки всех будущих земных существ стали ЛЕВОвращающими?!
С.Лем,
«Звездные дневники Ийона Тихого. Путешествие восьмое» (1966 г.)
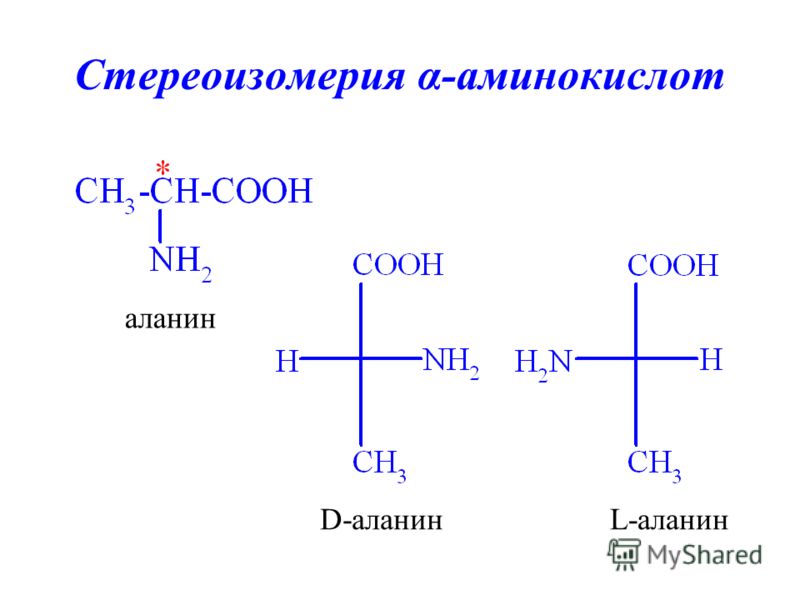
Вступив из своей комнаты в загадочный мир зазеркалья, маленькая героиня Льюиса Кэррола — английская девочка Алиса — узнала, что эти два мира, на первый взгляд выглядящие столь похожими, на самом деле существенно отличаются. Алиса интуитивно чувствует, что даже молоко в мире-отражении совсем не такое, как тот вкусный и полезный напиток, которым она привыкла наслаждаться у себя в Англии: «Впрочем, не знаю, можно ли пить зазеркальное молоко? Не повредит ли оно тебе, Китти…» [1]. И правда: то ли Кэррол (то есть, конечно, Чарльз Лютвидж Доджсон) уже знал о стереохимических свойствах органических соединений, то ли предвосхитил это знание, — но так или иначе, подавляющее большинство биологических молекул может существовать в виде двух зеркальных отражений друг друга, не совмещаемых простым наложением. Девятнадцать из 20 природных аминокислот (кроме глицина) являются хиральными, — то есть, расположение заместителей вокруг центрального атома углерода (Cα) может дать две зеркально-симметричные молекулы, похожие друг на друга как перчатки с левой и правой руки. Пары таких молекул называются стереоизомерами (или оптическими изомерами, или энантиомерами), и по одной из классификаций обозначаются L- и D-аминокислотами (см. рисунок в заглавии).
Пары таких молекул называются стереоизомерами (или оптическими изомерами, или энантиомерами), и по одной из классификаций обозначаются L- и D-аминокислотами (см. рисунок в заглавии).
Одной из самых интересных загадок зарождения жизни является преимущественное использование в качестве «строительных блоков» белков именно L-аминокислот, в то время как их D-аналоги долгое время считались чуть ли не биохимическим недоразумением, которым можно с чистой совестью пренебречь [2–4]. (Впрочем, определённые соображения на этот счет все же есть: см. эпиграф. — А. Ч.) Однако, время не стоит на месте: в журнале Science появилась статья, авторы которой бросают вызов этому устаревшему представлению и показывают, что D-аминокислоты играют важную роль в жизни бактерий, управляя их реакцией на различные пищевые стимулы [5].
Если вернуться к Алисе, то её сомнения насчет молока были отнюдь не беспочвенными: ведь пара «зеркальных» молекул, хотя во многих отношениях и идентична (например, молекулярная масса, углы и длины связей у них равны), может иметь разительно отличающиеся биологические характеристики. В частности, Алисе вряд ли удалось бы переварить молоко, белки которого состоят исключительно из D-аминокислот. Такое смещение «равновесия» в сторону L-аминокилот, безусловно, ставит вопрос: а играют ли D-аминокислоты какую-то роль в природе? Исследование Губерта Лэма (Hubert Lam) [5] — учёного из Гарварда и Института Ховарда Хьюза в США, — а также его коллег, показывает, что неизвестное — не значит «не существующее»: согласно их данным, D-аминокислоты управляют у бактерий таким важным процессом как «сборка» клеточной стенки.
В частности, Алисе вряд ли удалось бы переварить молоко, белки которого состоят исключительно из D-аминокислот. Такое смещение «равновесия» в сторону L-аминокилот, безусловно, ставит вопрос: а играют ли D-аминокислоты какую-то роль в природе? Исследование Губерта Лэма (Hubert Lam) [5] — учёного из Гарварда и Института Ховарда Хьюза в США, — а также его коллег, показывает, что неизвестное — не значит «не существующее»: согласно их данным, D-аминокислоты управляют у бактерий таким важным процессом как «сборка» клеточной стенки.
Клеточная стенка является, по сути, «крепостной стеной» бактериальной клетки, защищая её от разнообразных неблагоприятных факторов окружающей среды. Состоит она главным образом из пептидогликана — эластичного полимера, в котором сахара и аминокислоты «сшиваются» между собой подобно сетке и охватывают бактериальную мембрану целиком. Одна из ролей D-аминокислот здесь — образовывать поперечные пептидные сшивки между длинными углеводными тяжами пептидогликанов; эти сшивки обогащены D-аланином и D-глутаминовой кислотой, роль которых предположительно заключается в противостоянии расщеплению клеточной стенки враждебными ферментами-гидролазами, «настроенными» только на L-аминокислоты.
Для успешного роста и процветания микроорганизмов пептидогликан должен обладать незаурядной пластичностью: ведь бактерии, оказавшись в богатой питательными веществами среде, немедленно начинают делиться, и клеточная стенка должна делиться вместе с ними, чтобы не оставить потомство без защиты. В период сомнений и тягостных раздумий стресса же пептидогликан должен, наоборот, становиться жёстче, чтобы максимально усилить защиту бактерии. Однако факторы, управляющие этими сложными превращениями при переходе от «довольства» к голоданию, практически не были известны.
Одним из объектов, с которым работала команда Лэма, является бактерия Vibrio cholerae, или холерный вибрион, являющийся возбудителем острой кишечной инфекции. Исследователи отметили, что состояние клеточной стенки бактерии меняется в зависимости от содержания в питательной среде определённых аминокислот. К удивлению учёных, D- (а не L-!) энантиомеры метионина и лейцина вызывали замедление синтеза пептидогликана и смену «режима» образования поперечных сшивок в клеточной стенке. Роль этих аминокислот в перестройке клеточной стенки была дополнительно подтверждена открытием у холерного вибриона нового фермента, синтезирующего эти D-аминокислоты. Что интересно, в аналогичный процесс у грамположительной бактерии Bacillus subtilis (сенной палочки) оказались также вовлечены две D-аминокислоты, но другие: D-тирозин и D-фенилаланин.
Роль этих аминокислот в перестройке клеточной стенки была дополнительно подтверждена открытием у холерного вибриона нового фермента, синтезирующего эти D-аминокислоты. Что интересно, в аналогичный процесс у грамположительной бактерии Bacillus subtilis (сенной палочки) оказались также вовлечены две D-аминокислоты, но другие: D-тирозин и D-фенилаланин.
Как именно под действием D-аминокислот происходит перестройка клеточной стенки, пока в точности не ясно. По-видимому, увеличение их содержания как-то влияет на частоту и/или длину сшивок пептидогликана и, следовательно, на прочность и гибкость. Нельзя исключить также возможность, что D-аминокислоты регулируют активность периплазматических ферментов, синтезирующих и перестраивающих клеточную стенку.
Постепенно накапливаются и другие примеры функциональной важности D-аминокислот. У некоторых видов бацилл образование вегетативных клеток из спор регулируется именно относительным содержанием в среде L- и D-аминокислот, которые, соответственно, индуцируют или замедляют проращивание посредством взаимодействия со специальными рецепторами на поверхности спор [6]. На поверхности капсулы B. anthracis — возбудителя сибирской язвы — находятся полимеры с высоким содержанием D-глутаминовой кислоты, что, по-видимому, защищает бактерию от действия протеаз [7]. D-аминокислоты во множестве содержатся в природных антибиотиках, иммуносупрессорных лекарствах и противоопухолевых веществах [8].
На поверхности капсулы B. anthracis — возбудителя сибирской язвы — находятся полимеры с высоким содержанием D-глутаминовой кислоты, что, по-видимому, защищает бактерию от действия протеаз [7]. D-аминокислоты во множестве содержатся в природных антибиотиках, иммуносупрессорных лекарствах и противоопухолевых веществах [8].
Хотя еще совсем недавно D-аминокислоты считались исключительно «артефактом» бактерий и грибов, появляются данные и о роли этих веществ у эукариот. Эндогенный D-серин выполняет в мозгу млекопитающих функцию нейротрансмиттера [9]. D-аспарагиновая кислота найдена в нейроэндокринных тканях млекопитающих, где она модулирует гормональную секрецию [10].
Возвращаясь напоследок снова к Алисе — точнее, к её создателю Чарлзу Доджсону, — можно высказать предположение, что он (Доджсон) всё-таки знал о вопросах, возникающих в стереохимии, поскольку Луи Пастер (знаменитый химик и микробиолог) был его современником. Пастер к тому моменту уже опубликовал несколько работ по хиральным свойствам винной кислоты, найденной на дне бутылки во многих восхитительных яствах по эту сторону зеркального стекла, — например, в винах и некоторых фруктах и растениях.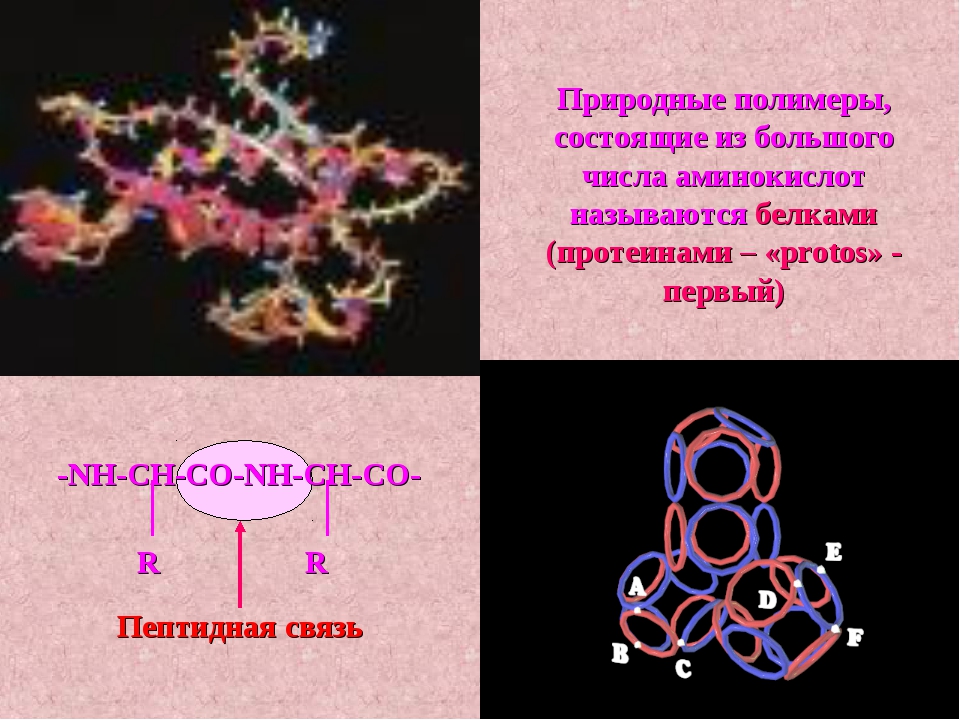
Открытия новых функций D-аминокислот, несомненно, продолжатся, и несправедливой дискриминации этих неплохих, в сущности, соединений недолго ещё осталось жить на Земле 🙂
По материалам рубрики «Перспектива» Science [11].
- Кэррол Л. Сквозь зеркало и что там увидела Алиса, или Алиса в Зазеркалье. М.: «Наука», 1991;
- Victor S Lamzin, Zbigniew Dauter, Keith S Wilson. (1995). How nature deals with stereoisomers. Current Opinion in Structural Biology. 5, 830-836;
- Stephen F. Mason. (1984). Origins of biomolecular handedness. Nature. 311, 19-23;
- V Prelog. (1976). Chirality in chemistry. Science. 193, 17-24;
- H. Lam, D.-C. Oh, F. Cava, C. N. Takacs, J. Clardy, et. al.. (2009). D-Amino Acids Govern Stationary Phase Cell Wall Remodeling in Bacteria. Science. 325, 1552-1555;
- M.
 T. McKevitt, K. M. Bryant, S. M. Shakir, J. L. Larabee, S. R. Blanke, et. al.. (2007). Effects of Endogenous D-Alanine Synthesis and Autoinhibition of Bacillus anthracis Germination on In Vitro and In Vivo Infections. Infection and Immunity. 75, 5726-5734;
T. McKevitt, K. M. Bryant, S. M. Shakir, J. L. Larabee, S. R. Blanke, et. al.. (2007). Effects of Endogenous D-Alanine Synthesis and Autoinhibition of Bacillus anthracis Germination on In Vitro and In Vivo Infections. Infection and Immunity. 75, 5726-5734; - J. W. Ezzell, S. L. Welkos. (1999). The capsule of Bacillus anthracis, a review. J Appl Microbiol. 87, 250-250;
- J. Grunewald, M. A. Marahiel. (2006). Chemoenzymatic and Template-Directed Synthesis of Bioactive Macrocyclic Peptides. Microbiology and Molecular Biology Reviews. 70, 121-146;
- Aude Panatier, Dionysia T. Theodosis, Jean-Pierre Mothet, Bastien Touquet, Loredano Pollegioni, et. al.. (2006). Glia-Derived d-Serine Controls NMDA Receptor Activity and Synaptic Memory. Cell. 125, 775-784;
- A. S. Huang. (2006). D-Aspartate Regulates Melanocortin Formation and Function: Behavioral Alterations in D-Aspartate Oxidase-Deficient Mice.
 Journal of Neuroscience. 26, 2814-2819;
Journal of Neuroscience. 26, 2814-2819; - S. R. Blanke. (2009). Expanding Functionality Within the Looking-Glass Universe. Science. 325, 1505-1506.
Как производятся аминокислоты | Улучшение жизни с помощью аминокислот | О нас | Глобальный веб-сайт Ajinomoto Group
Аминокислоты производятся из растительных ингредиентов. Ферментированные продукты, такие как мисо и соя, производятся путем ферментации сои или пшеницы с использованием культуры коджи. В процессе ферментации белок расщепляется и превращается в аминокислоты. Мисо и соя — примеры того, как аминокислоты давно стали частью японской диеты и как японцы пытались приготовить вкусную еду. Аминокислоты, используемые в аминокислотных продуктах, в основном производятся путем ферментации растительных ингредиентов таким же образом, как и мисо и соевый соус.
При ферментации аминокислот аминокислоты производятся путем ферментации ингредиентов с помощью микроорганизмов (например, пробиотических бактерий).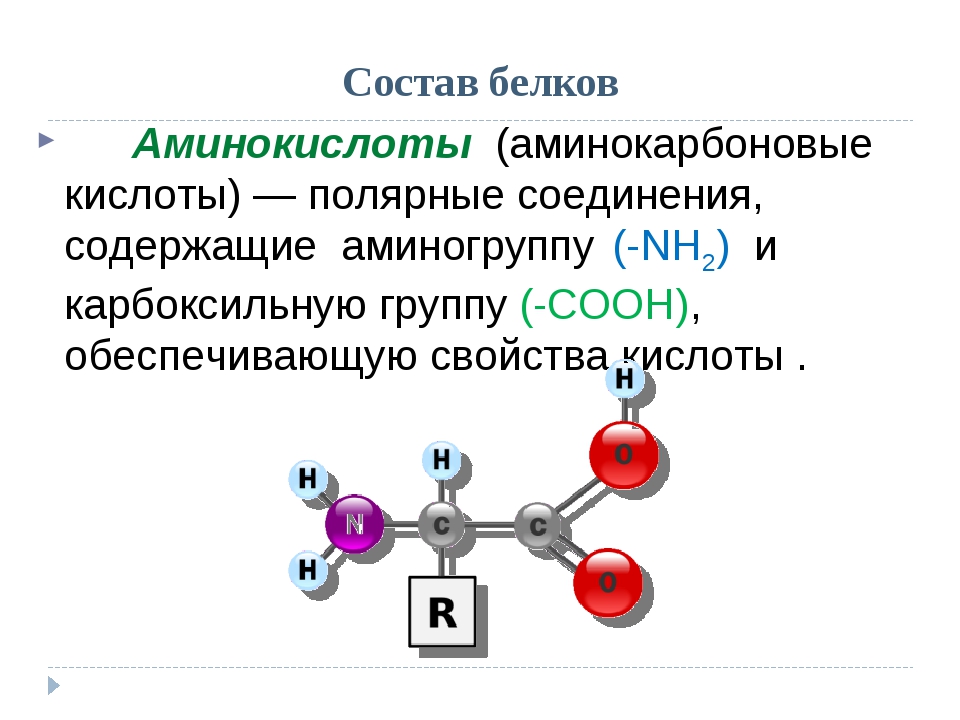 Эти микроорганизмы превращают ингредиенты в пищу и другие вещества, в которых нуждаются микроорганизмы. При ферментации такие ингредиенты, как патока, добавляются в среду, в которой культивируются микроорганизмы. Это помогает микроорганизмам размножаться и производить аминокислоты. Микроорганизмы содержат ферменты, которые ускоряют реакции расщепления и синтеза новых веществ. Процесс ферментации представляет собой серию реакций с участием примерно от 10 до 30 типов ферментов.
Эти микроорганизмы превращают ингредиенты в пищу и другие вещества, в которых нуждаются микроорганизмы. При ферментации такие ингредиенты, как патока, добавляются в среду, в которой культивируются микроорганизмы. Это помогает микроорганизмам размножаться и производить аминокислоты. Микроорганизмы содержат ферменты, которые ускоряют реакции расщепления и синтеза новых веществ. Процесс ферментации представляет собой серию реакций с участием примерно от 10 до 30 типов ферментов.
Чтобы производить аминокислоты с помощью микроорганизмов, мы сначала должны найти микроорганизмы, которые обладают сильным потенциалом для производства аминокислот. В одном грамме естественной почвы содержится около 100 миллионов микроорганизмов. Исходя из этого, мы должны определить, какие микроорганизмы наиболее эффективны.
Когда найден нужный микроорганизм, необходимо разработать его лучшие штаммы, чтобы получить микроорганизмы с наилучшим потенциалом. Количество производимых аминокислот зависит от количества и качества ферментов. Можно производить больше аминокислот, если ферменты, необходимые для производства нужных аминокислот, содержатся в идеальных условиях.Однако при отсутствии этих условий можно сделать меньше. Допустим, у микроорганизма есть метаболический путь A → (a) → B → (b) → C → (c) → D, где (a), (b) и (c) — ферменты. Чтобы производить большие количества аминокислоты C, ферменты (a) и (b) должны быть более активными, а фермент (c) не должен быть активным. Это может быть достигнуто путем создания улучшенных сортов с помощью различных методов.
Можно производить больше аминокислот, если ферменты, необходимые для производства нужных аминокислот, содержатся в идеальных условиях.Однако при отсутствии этих условий можно сделать меньше. Допустим, у микроорганизма есть метаболический путь A → (a) → B → (b) → C → (c) → D, где (a), (b) и (c) — ферменты. Чтобы производить большие количества аминокислоты C, ферменты (a) и (b) должны быть более активными, а фермент (c) не должен быть активным. Это может быть достигнуто путем создания улучшенных сортов с помощью различных методов.
Для производства аминокислот бродильные чаны заполняются патокой и сахарными ингредиентами, такими как сахарный тростник, кукуруза и маниока.Достигнуты идеальные условия для перемешивания, подачи кислорода, температуры и уровня pH. Затем из этого ферментированного бульона очищают желаемые аминокислоты.
Помимо ферментации, существуют и другие способы получения аминокислот, например ферментативная реакция, экстракция и синтез.
В процессе ферментативной реакции один или два типа ферментов используются для превращения предшественника аминокислоты в нужную аминокислоту. В этом методе нет необходимости размножать микроорганизмы путем преобразования определенной аминокислоты, и нет длительного процесса, начинающегося с глюкозы.Процесс ферментативной реакции идеален, если вещество-предшественник имеет низкую стоимость.
В этом методе нет необходимости размножать микроорганизмы путем преобразования определенной аминокислоты, и нет длительного процесса, начинающегося с глюкозы.Процесс ферментативной реакции идеален, если вещество-предшественник имеет низкую стоимость.
Аминокислоты могут быть получены путем расщепления белков, известного как метод экстракции. Однако количество аминокислот в исходном белке ограничивает количество производимых аминокислот. Экстракция не подходит для получения массовых количеств определенных аминокислот.
Synthesis использует химические реакции для производства аминокислот и широко использовался на ранних этапах разработки способов получения аминокислот. Проблема с синтезом состоит в том, что в результате химических реакций образуются равные количества L- и D-аминокислот.В результате полученные D-аминокислоты должны затем превращаться в L-аминокислоты. Следовательно, этот более дорогостоящий метод требует дополнительных этапов обработки и оборудования, поэтому его производство постепенно прекращалось. Однако он все еще используется для производства глицина, которого нет в D- и L-формах, и для аминокислот, где нет разницы, являются ли они D- или L-формами при использовании.
Однако он все еще используется для производства глицина, которого нет в D- и L-формах, и для аминокислот, где нет разницы, являются ли они D- или L-формами при использовании.
Преимущество ферментации заключается в том, что она позволяет нам производить массовые количества аминокислот по низкой цене с относительно небольшими производственными мощностями.Использование ферментации для производства аминокислот помогло расширить рынок аминокислот. В 1960-е годы производство глутамата перешло от экстракции к ферментации, а затем последовало производство других аминокислот.
Аминокислоты — обзор
3.25.3.5.1 Аминокислоты и белки
Содержание свободных аминокислот в зеленых кофейных зернах варьируется от 0,001% для метионина в робусте до 0,1% для глутаминовой кислоты в арабике. Зеленые бобы арабики и робусты по половине свободных аминокислот значительно различаются.В обжаренном кофе свободные аминокислоты не обнаруживаются.
Аминокислоты входят в состав пептидов и белков; их индивидуальный вклад может быть проанализирован как «общее количество аминокислот» после соответствующего аналитического гидролиза. 137 Сумма аминокислот примерно соответствует содержанию белка.
137 Сумма аминокислот примерно соответствует содержанию белка.
Содержание белка требуется для деклараций пищевой ценности пищевых продуктов, 138 , что фактически является необязательным.
Традиционное определение протеина в пище путем пересчета общего азота в содержание протеина с легальным (!) Эмпирическим коэффициентом 6.25 (метод азота Кьельдаля) не дает правильных значений белка для кофе, если не были внесены несколько поправок — для азота кофеина и тригонеллина, для другого небелкового азота и для тех компонентов, которые в случае обжаренного кофе не достигают напиток потребителей. В таблице 8 приведены результаты определения свободных и общих аминокислот зеленого кофе арабика и робуста, взятые из двух докторских диссертаций; добавлены данные об общем количестве жареного и вареного кофе Арабика.Траутвайн использовал образцы разного происхождения; в каждом наборе данных был обнаружен большой разброс, 139 , что не очевидно в общем среднем.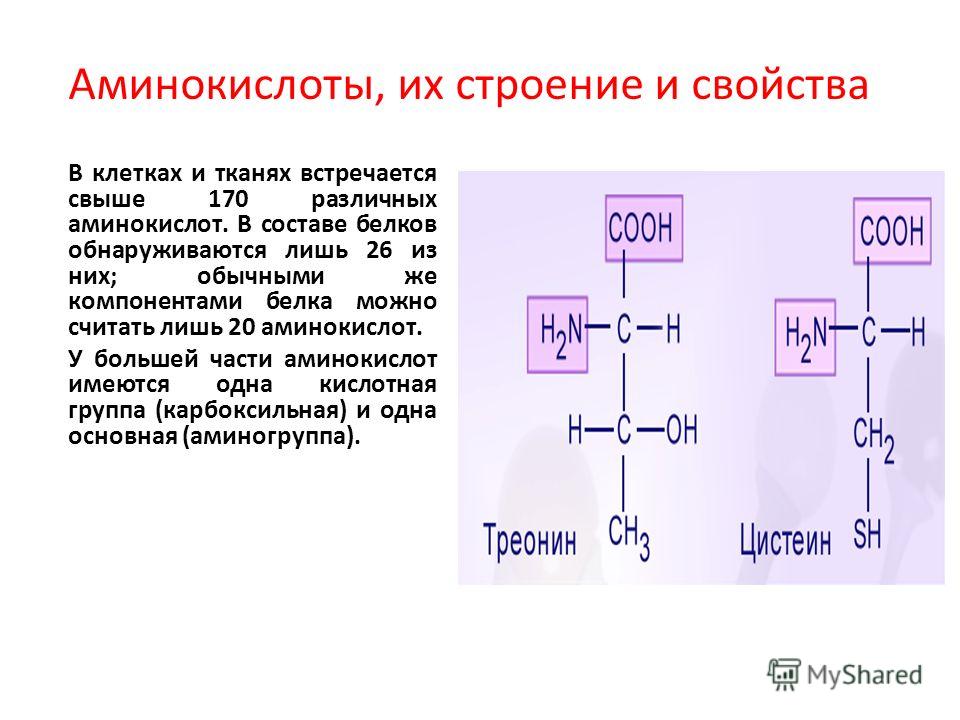 По общему количеству аминокислот результаты арабики и робусты широко перекрываются, как показывает Таблица 8 .
По общему количеству аминокислот результаты арабики и робусты широко перекрываются, как показывает Таблица 8 .
Таблица 8. Общее содержание свободных и свободных аминокислот в кофе, зеленом, жареном, пиве, из разных источников
| Аминокислоты | Зеленая арабика без AA a | Зеленая робуста без AA a | Всего зеленая робуста AA a | Зеленая арабика всего AA b | Обжарка арабики всего AA b | Варка арабики всего AA b | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| % DW | % DW | %.DW | % DW | % DW | % DW | |||||||||||
| Аланин | 0,025 | 0,034 | 0,53 | 0,58 | 0,61 | 035 | ||||||||||
| Аргинин | 0,008 | 0,018 | 0,72 | 0,64 | 0,00 | 0,00 | ||||||||||
| Аспарагиновая кислота | 0,033 | 0,033 | 1,03 | 1,22 | 1,15 | 0.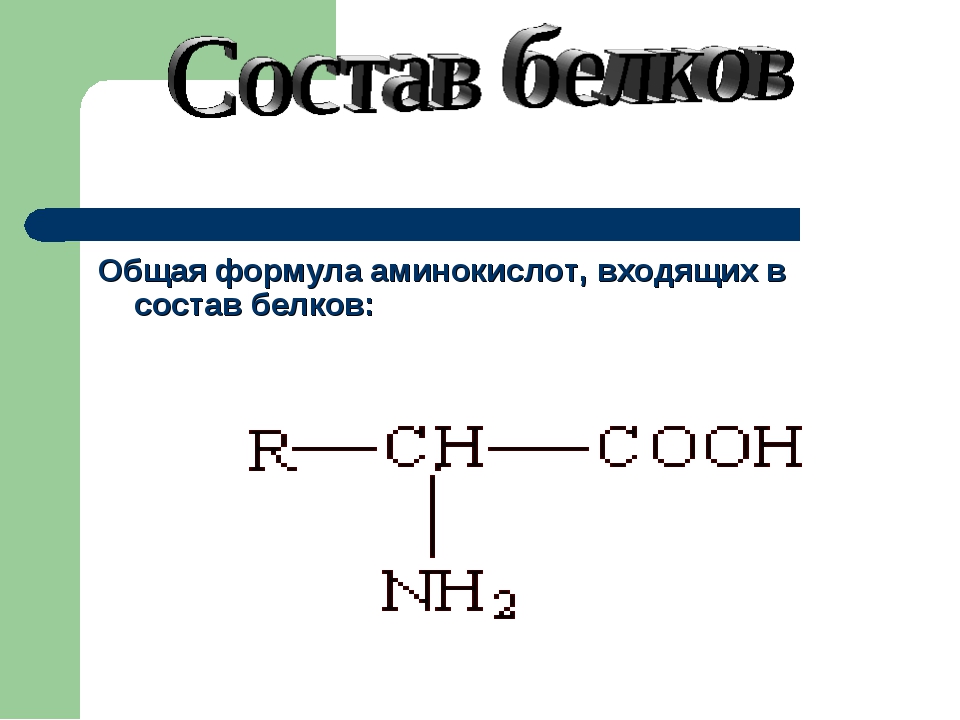 73 73 | ||||||||||
| Цистеин | н.о. | нет данных | 0,26 | н.о. | нет данных | нет данных | ||||||||||
| гамма-аминомасляная кислота | 0,028 | 0,047 | 0,05 | |||||||||||||
| Глутаминовая кислота | 0,102 | 0,047 | 2,20 | 2,43 | 2,47 | 2,06 | 2,43 | 2,47 | 2,06 | 0003 | 0,006 | 0.69 | 1,14 | 103 | 0,71 | |
| Гистидин | 0,004 | 0,004 | 0,35 | 0,29 | 0,24 | 0,15 | ||||||||||
| Илейцин | 0,005 | 0,008 | 0,45 | 0,50 | 0,26 | |||||||||||
| Лейцин | 0,006 | 0,010 | 0,93 | 1,09 | 1,11 | 0,57 | ||||||||||
| Лизин | 0.006 | 0,011 | 0,69 | 0,81 | 0,11 | 0,00 | ||||||||||
| Метионин | 0,002 | 0,001 | 0,14 | 0,11 | 0,07 | |||||||||||
| Фенилаланин | 0,017 0,60 | 0,61 | 0,63 | 0,32 | ||||||||||||
| Пролин | 0,64 | 0,62 | 0,45 | |||||||||||||
| Серин | 0. 017 017 | 0,016 | 0,57 | 0,49 | 0,24 | 0,15 | ||||||||||
| Треонин | 0,003 | 0,005 | 0,40 | 044 | 0,27 | 0,12 | 9002||||||||||
| Триптофан | 9016 | нет данных | нет данных | |||||||||||||
| Тирозин | 0,005 | 0,011 | 0,43 | 0,34 | 0,28 | 0,18 | ||||||||||
| Валин | 0.009 | 0,017 | 0,58 | 0,65 | 0,72 | 0,28 | ||||||||||
| Сумма | 0,27 | 0,29 | 10,5 | 12,0 | 10,1 | 6,4 | ||||||||||
| Среднее значение | 0,02 | 0,0 | 0,66 | 0,75 | 0,63 | 0,40 |
nd не обнаруживается; АК, аминокислоты.
Свободные аминокислоты зеленого кофе в значительной степени трансформируются при обжарке.Они принимают участие в реакции Майяра, в результате чего образуются компоненты, которые определяют вкус и цвет кофейного напитка. В обжаренном кофе остается лишь незначительное количество. 140
В обжаренном кофе остается лишь незначительное количество. 140
- —
Аминокислоты серы, цистин, цистеин и метионин в зеленом кофе, в основном связанные с белками, разлагаются при обжарке и взаимодействуют с редуцирующими сахарами и промежуточными продуктами Майяра с образованием сильно ароматических летучих веществ, например фурфурилтиола. , соединение, влияющее на аромат, с очень низким пороговым значением аромата, а также тиофены и тиазолы.
- —
Гидроксиламинокислоты серин и треонин реагируют с сахарозой с образованием летучих гетероциклических соединений, среди прочего, алкилпиразинов.
- —
Пролин и гидроксипролин реагируют с промежуточными продуктами Майяра с образованием пирролов, пирролизинов и пиридинов, а также алкил-, ацил- и фурфурилпирролов.
- —
Триптофан превращается в серотонин в последние недели развития зерна.
Содержание белка в зеленом кофе составляет около 10–13%. Белковый профиль кофе изменяется во время обжарки; белки и фрагментированы, и полимеризованы, и интегрированы в меланоидины. В конечном итоге их концентрация в пиве составляет около 6–7%, и эта цифра актуальна для расчета пищевой ценности. 137
Белковый профиль кофе изменяется во время обжарки; белки и фрагментированы, и полимеризованы, и интегрированы в меланоидины. В конечном итоге их концентрация в пиве составляет около 6–7%, и эта цифра актуальна для расчета пищевой ценности. 137
Основной белок зеленого кофе — запасной белок типа 11S. Он биосинтезируется в эндосперме 141 во время созревания и составляет около половины содержания белка. 142 Белок 11S имеет α- и β-ветви разной длины с дисульфидным мостиком и позволяет ковалентно связываться с хлорогеновыми кислотами на более реакционноспособной β-ветви 143 при обжарке.Сообщалось также о белках 7S- и 2S-типов. Сам белок 11S и ДНК, кодирующие его экспрессию, являются объектами европейских и американских патентов. 144
Что такое аминокислоты? | Chemistry Review [видео]
Аминокислоты
Что вы называете кислотой с отношением? Средняя кислота.
Аминокислоты классные! Они играют огромную роль в функционировании нашего тела. Они функционируют как строительные блоки для белков , и как промежуточные звенья в метаболических реакциях.
Они функционируют как строительные блоки для белков , и как промежуточные звенья в метаболических реакциях.
В белках содержится 20 различных типов аминокислот, а это означает, что существует огромное количество химических вариаций. Другими словами, наличие 20 различных аминокислот означает, что ваше тело может делать больше разных полезных для вас вещей; потому что в гене есть последовательности оснований, которые кодируют разные типы белков, и эта последовательность определяет точное содержание аминокислот, а также конкретный порядок или последовательность этих аминокислот. Что ж, это конкретное секвенирование аминокислот определяет конкретную трехмерную структуру белка, а трехмерная структура белка определяет конкретную роль или функцию этого белка.
Что ж, в нашем организме множество различных функций, которым необходимы аминокислоты. Фактически, белки, состоящие из аминокислот, используются почти для каждой реакции в наших живых клетках , и они контролируют почти все клеточные процессы.
Давайте посмотрим на девять важных функций аминокислот:
Структурная функция — Все ваши кости, мышцы, кожа и все ткани вашего тела построены вместе белками, и все белки состоят из аминокислот.Коллаген, например, является самым распространенным структурным белком в нашем организме.
Иммунная функция — В нашей иммунной системе есть клетки, которые борются с злоумышленниками в нашем организме, они называются защитными клетками. Все наши защитные клетки состоят из белков. Однако, прежде чем наши защитные клетки смогут даже атаковать этих плохих парней, они должны быть проинформированы о том, что есть плохие парни, которых можно атаковать. Это работа сигнальных белков, которые также состоят из белков.
Гормональная функция — Все гормоны в вашем организме состоят из аминокислот.Гормоны играют в организме несколько разных ролей. Они управляют всеми процессами обмена веществ, ростом, функцией щитовидной железы, менструальным циклом женщины и даже такими вещами, как адреналин.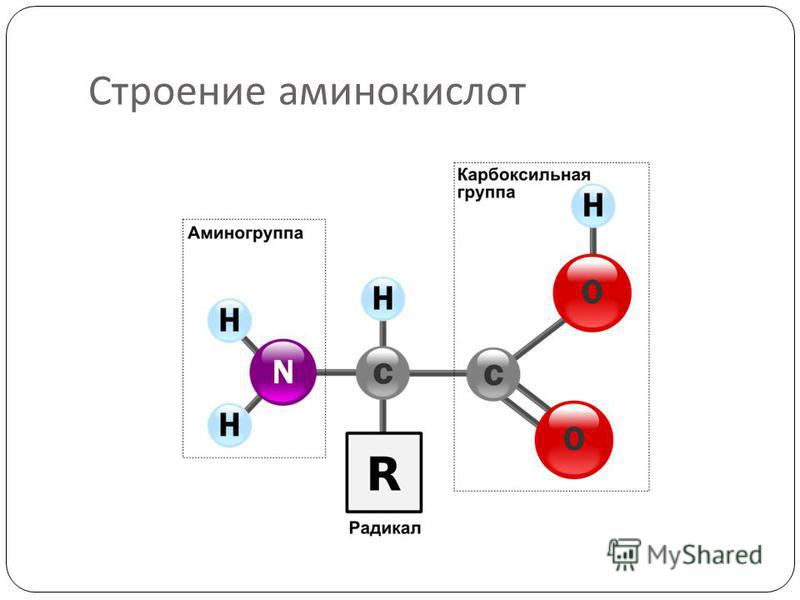
Функция обмена : Белки также работают как обменник. Например, если в одной клетке чего-то не хватает, белки могут вызвать обмен или замену от одной клетки к другой; такие как факторы обмена нуклеотидов.
Функция движения — Возможно, вы знакомы с актином и миозином.Актин и миозин — это сократительные белки, которые связываются друг с другом и фактически создают силу для движения мышцы. Также существуют регуляторные белки, которые помогают включать и выключать сокращение мышц.
Функция транспортера — Возможно, вы слышали о белках-носителях. Белки-переносчики — это то, что транспортирует вещи по всему телу. Наиболее распространенным типом белка-носителя может быть гемоглобин. Гемоглобин — это белок, который переносит кислород из наших легких в остальные части нашего тела.Затем он высвобождает кислород в другие части тела для обеспечения различных функций нашего тела.
Пищеварительная функция : Все пищеварительные ферменты являются белками. Эти пищеварительные ферменты позволяют нашему организму фактически поглощать питательные вещества из пищи, которую мы едим. Часто люди, которые крайне истощены, не могут усваивать питательные вещества из пищи, которую они едят, потому что им не хватает аминокислот, необходимых для образования этих пищеварительных ферментов.
Клеточная функция : Клеточное дыхание — это метаболическая функция, которая в основном производит энергию в форме АТФ, которую наш организм использует для всех остальных функций.Нашему организму нужны аминокислоты, чтобы клеточное дыхание могло даже происходить.
Функция кровообращения : Нашему организму нужны аминокислоты для правильного кровообращения. Например, L-аргинин — это аминокислота, которая способствует выработке оксида азота (NO). NO — одна из основных молекул-посредников, участвующих в регуляции сосудов. Сосудистая регуляция — это то, что помогает крови течь правильно.
Из 20 аминокислот наш организм может производить только 10 из них. Все остальные аминокислоты должны поступать в наш организм с пищей.10 аминокислот, которые не производятся нашим организмом, называются незаменимыми аминокислотами. Если наш организм не получит хотя бы одну из незаменимых аминокислот, в организме произойдет расщепление белка. Позвольте мне повторить, что вы можете получать 9 из 10 аминокислот каждый день, но недостаток этой незаменимой аминокислоты БУДЕТ привести к расщеплению белка в вашем организме.
Наше тело может накапливать избыток таких вещей, как жир и крахмал, чтобы использовать его для получения энергии, но наше тело НЕ накапливает избыток аминокислот.10 незаменимых аминокислот необходимо восполнять каждый день.
10 незаменимых аминокислот включают:
Аргинин
Гистидин
Изолейцин
Лейцин
Лизин
Метионин
Фенилаланин
Треонин
Триптофан
Валин 9 Аланин
Аспарагин
Аспарагиновая кислота
цистеин
Глутаминовая кислота
Глютамин
Глицин
Пролин
Серин
Тирозин
Я надеюсь, что это видео об аминокислотах было для вас полезным.Если вам понравилось, не забудьте нажать эту кнопку и подписаться на наш канал, чтобы смотреть другие видео.
Увидимся в следующий раз!
Определение аминокислот и примеры
Аминокислоты важны в биологии, биохимии и медицине. Они считаются строительными блоками полипептидов и белков.
Узнайте об их химическом составе, функциях, сокращениях и свойствах.
Аминокислоты
- Аминокислота — это органическое соединение, характеризующееся наличием карбоксильной группы, аминогруппы и боковой цепи, присоединенных к центральному атому углерода.
- Аминокислоты используются в качестве предшественников других молекул в организме. При связывании аминокислот вместе образуются полипептиды, которые могут стать белками.
- Аминокислоты производятся из генетического кода в рибосомах эукариотических клеток.
- Генетический код — это код белков, производимых внутри клеток. ДНК транслируется в РНК. Три основания (комбинации аденина, урацила, гуанина и цитозина) кодируют аминокислоту. Для большинства аминокислот существует более одного кода.
- Некоторые аминокислоты не могут быть произведены организмом.Эти «незаменимые» аминокислоты обязательно должны присутствовать в рационе организма.
- Кроме того, другие метаболические процессы превращают молекулы в аминокислоты.
Определение аминокислот
Аминокислота — это тип органической кислоты, которая содержит карбоксильную функциональную группу (-COOH) и аминогруппу (-NH 2 ), а также боковую цепь (обозначенную как R), специфичную для отдельной аминокислоты. . Элементы, содержащиеся во всех аминокислотах, — это углерод, водород, кислород и азот, но их боковые цепи могут содержать и другие элементы.
Сокращенное обозначение аминокислот может быть трехбуквенным или однобуквенным. Например, валин может обозначаться буквой V или val; гистидин — это H или его.
Аминокислоты могут действовать сами по себе, но чаще действуют как мономеры с образованием более крупных молекул. Соединение нескольких аминокислот вместе образует пептиды, а цепь из многих аминокислот называется полипептидом. Полипептиды можно модифицировать и объединять в белки.
Создание белков
Процесс производства белков на основе шаблона РНК называется трансляцией.Встречается в рибосомах клеток. В производстве белка участвуют 22 аминокислоты. Эти аминокислоты считаются протеиногенными. Помимо протеиногенных аминокислот, есть некоторые аминокислоты, которые не встречаются ни в одном белке. Примером может служить нейромедиатор гамма-аминомасляная кислота. Обычно небелковые аминокислоты участвуют в метаболизме аминокислот.
Трансляция генетического кода включает 20 аминокислот, которые называются каноническими аминокислотами или стандартными аминокислотами.Для каждой аминокислоты серия из трех остатков мРНК действует как кодон во время трансляции (генетический код). Две другие аминокислоты, содержащиеся в белках, — это пирролизин и селеноцистеин. Они специально кодируются, обычно кодоном мРНК, который в противном случае функционирует как стоп-кодон.
Распространенные орфографические ошибки: ammino acid
Примеры аминокислот: лизин, глицин, триптофан.
Функции аминокислот
Поскольку аминокислоты используются для создания белков, большая часть человеческого тела состоит из них.Их численность уступает только воде. Аминокислоты используются для создания множества молекул и используются в транспорте нейромедиаторов и липидов.
Хиральность аминокислот
Аминокислоты обладают хиральностью, когда функциональные группы могут находиться по обе стороны от связи C-C. В естественном мире большинство аминокислот являются L-изомерами. Есть несколько примеров D-изомеров. Примером является полипептид грамицидин, который состоит из смеси D- и L-изомеров.
Одно- и трехбуквенные сокращения
Чаще всего запоминаются и встречаются в биохимии аминокислоты:
- Глицин, Gly, G
- Валин, Вал, В
- Лейцин, Лей, L
- Изоецин, лей, L
- Proline, Pro, P
- Треонин, Thr, T
- Цистеин, Cys, C
- Метионин, Met, M
- Фенилаланин, Phe, F
- Тирозин, Тир, Y
- Триптофан, Trp, W
- Аргинин, Арг, R
- Аспартат, Asp, D
- Глутамат, Glu, E
- Aparagine, Asn, N
- Глютамин, Gln, Q
- Aparagine, Asn, N
Свойства аминокислот
Характеристики аминокислот зависят от состава их боковой R-цепи.Используя однобуквенные сокращения:
- Полярные или гидрофильные: N, Q, S, T, K, R, H, D, E
- Неполярные или гидрофобные: A, V, L, I, P, Y, F, M, C
- Содержат серу: C, M
- Водородная связь: C, W, N, Q, S, T, Y, K, R, H, D, E
- Ионизируемый: D, E, H, C, Y, K, R
- Циклический: P
- Ароматические: F, W, Y (также H, но не проявляет большого поглощения УФ)
- Алифатические: G, A, V, L, I, P
- Образует дисульфидную связь: C
- Кислый (положительно заряженный при нейтральном pH): D, E
- Основной (отрицательно заряженный при нейтральном pH): K, R
Общие сведения об аминокислотах
Общие сведения об аминокислотах
Обзор
Аминокислоты — это химические единицы или «строительные блоки», из которых состоят белки.Они также являются конечными продуктами переваривания белков или гидролиза. Аминокислоты содержат около 16 процентов азота. Химически это то, что отличает их от двух других основных питательных веществ, сахаров и жирных кислот, которые не содержат азота.
Чтобы понять, насколько жизненно важны аминокислоты, вы должны понимать, насколько важны белки для жизни. Это белок, который обеспечивает структуру всего живого. Каждый живой организм, от самого крупного животного до мельчайшего микроба, состоит из белка.И в различных формах белок участвует в жизненно важных химических процессах, поддерживающих жизнь.
Люди часто не осознают свою потребность в аминокислотах, потому что не осознают, насколько загружен человеческий организм.
• Каждую секунду костный мозг производит 2,5 миллиона эритроцитов.
• Каждые четыре дня происходит замена большей части слизистой оболочки желудочно-кишечного тракта и тромбоцитов.
• Большая часть белых клеток заменяется за десять дней.
• Человек имеет эквивалент новой кожи за двадцать четыре дня и костного коллагена через тридцать лет.
Для всех этих постоянных ремонтных работ требуются аминокислоты.
Есть ли у вас дефицит аминокислот или проблемы с перевариванием аминокислот?
Обратитесь в клинику ISM для консультации по вопросам здоровья для разработки индивидуальной оздоровительной программы.
Белки — необходимая часть каждой живой клетки тела. Наряду с водой, белок составляет большую часть веса нашего тела.
- В организме человека белковые вещества составляют мышцы, связки, сухожилия, органы, железы, ногти, волосы и многие жизненно важные жидкости организма и необходимы для роста костей.
- Ферменты и гормоны, которые катализируют и регулируют все процессы в организме, являются белками.
- Белки помогают регулировать водный баланс организма и поддерживать надлежащий внутренний pH. Они способствуют обмену питательных веществ между межклеточными жидкостями и тканями, кровью и лимфой. Дефицит белка может нарушить водный баланс организма, вызывая отек.
- Белки составляют структурную основу хромосом, через которую генетическая информация передается от родителей к потомству.Генетический «код», содержащийся в ДНК каждой клетки, на самом деле является информацией о том, как производить белки этой клетки.
После переваривания белка в желудке аминокислоты попадают в кровь. Попадая в кровь, аминокислоты переносятся как эритроцитами, так и жидкой частью крови, называемой плазмой. Таким образом, аминокислоты распределяются по всем тканям организма, где различные клетки тела берут то, что им необходимо для восстановления и преобразования необходимых им белковых структур.
В крови постоянно содержатся аминокислоты. Пост не очищает их, а диета с высоким содержанием белка не увеличивает их существенно. Организм постоянно нуждается в белках и аминокислотах, и он поддерживает довольно однородный баланс.
(a) Аминокислоты как белковый субстрат
Белки представляют собой цепочки аминокислот, связанных вместе так называемыми пептидными связями. Каждый отдельный тип белка состоит из определенной группы аминокислот в определенном химическом расположении.Именно особые аминокислоты и способ их последовательного соединения придают белкам, из которых состоят различные ткани, их уникальные функции и свойства. Каждый белок в организме адаптирован для определенных нужд; белки не взаимозаменяемы.
Белки, входящие в состав человеческого тела, не получают напрямую с пищей. Скорее диетический белок расщепляется на составляющие его аминокислоты, которые затем организм использует для создания необходимых ему белков.Таким образом, незаменимыми питательными веществами являются аминокислоты, а не белок.
(b) Аминокислоты в метаболизме организма
Существуют и другие аминокислоты, которые важны для метаболических функций.
- Некоторые, такие как цитрулин, глутатион, орнитин и таурин, могут быть подобны (или побочными продуктами) аминокислотам, строящим белок.
- Некоторые действуют как нейротрансмиттеры или как предшественники нейротрансмиттеров, химических веществ, передающих информацию от одной нервной клетки к другой.Таким образом, мозгу необходимы определенные аминокислоты для получения и отправки сообщений.
- Аминокислоты также позволяют витаминам и минералам правильно выполнять свою работу. Даже если витамины и минералы усваиваются и усваиваются организмом, они не могут быть эффективными, если не присутствуют необходимые аминокислоты. Например, низкий уровень аминокислоты тирозина может привести к дефициту железа.
Как мы классифицируем аминокислоты?
Существует приблизительно двадцать восемь общеизвестных аминокислот, которые комбинируются различными способами для создания тысяч различных типов белков, присутствующих во всех живых существах.В организме человека печень производит около 80 процентов необходимых аминокислот. Остальные 20 процентов должны быть получены из рациона. Их называют незаменимыми аминокислотами. Незаменимые аминокислоты, которые должны поступать в организм с пищей:
- гистидин
- изолейцин
- лейцин
- лизин
- метионин
- фенилаланин
- треонин
- триптофан
- валин
Незаменимые аминокислоты, которые могут быть произведены в организме из других аминокислот, полученных из пищевых источников, включают:
- аланин
- глутамин
- аспарагин
- глицин
- цитруллин
- орнитин
- цистеин
- пролин
- цистин
- серин
- гамма-аминомасляная кислота
- таурин
- глутаминовая кислота
- тирозин
Тот факт, что они названы «несущественными», не означает, что они не нужны, только то, что они не обязательно должны поступать с пищей, потому что организм может производить их по мере необходимости.А заменимые аминокислоты могут стать «незаменимыми» при определенных условиях. Например, заменимые аминокислоты цистеин и тирозин производятся из незаменимых аминокислот метионина и фенилаланина. Если метионин и фенилаланин недоступны в достаточных количествах, цистеин и тирозин становятся незаменимыми в рационе.
Процесс сборки аминокислот / белков
Процессы сборки аминокислот для производства белков и расщепления белков на отдельные аминокислоты для использования организмом являются непрерывными.Когда нам нужно больше ферментных белков, организм производит больше ферментных белков; когда нам нужно больше клеток, организм производит больше белков для клеток. Эти разные типы белков производятся по мере необходимости. Если в организме истощатся запасы какой-либо из незаменимых аминокислот, он не сможет производить белки, которым требуются эти аминокислоты. Недостаточное количество даже одной незаменимой аминокислоты может препятствовать синтезу и снижению уровня необходимых белков в организме. Кроме того, все незаменимые аминокислоты должны присутствовать в рационе одновременно, чтобы другие аминокислоты использовались.
Как могла возникнуть такая ситуация? Проще, чем вы думаете. Многие факторы могут способствовать дефициту незаменимых аминокислот, даже если вы придерживаетесь хорошо сбалансированной диеты, содержащей достаточно белка. Нарушение всасывания, инфекции, травмы, стресс, употребление наркотиков, возраст и дисбаланс других питательных веществ могут повлиять на доступность незаменимых аминокислот в организме. Недостаточное потребление витаминов и минералов, особенно витамина С, может нарушить абсорбцию аминокислот в нижней части тонкого кишечника.Витамин B6 также необходим для транспорта аминокислот в организме.
Если ваша диета не сбалансирована должным образом, то есть, если она рано или поздно не обеспечивает достаточное количество незаменимых аминокислот, это станет очевидным как физическое расстройство. Однако это не означает, что диета, содержащая огромное количество белка, является ответом. На самом деле это вредно для здоровья. Избыток белка создает чрезмерную нагрузку на почки и печень, которым приходится перерабатывать продукты жизнедеятельности белкового обмена.Почти половина аминокислот в пищевом белке превращается печенью в глюкозу и используется для обеспечения клеток необходимой энергией. В результате этого процесса образуется аммиак. Аммиак токсичен для организма, поэтому организм защищает себя, заставляя печень превращать аммиак в гораздо менее токсичное соединение, мочевину, которая затем переносится через кровоток, отфильтровывается почками и выводится из организма.
аминокислот | Encyclopedia.com
CONCEPT
Аминокислоты — это органические соединения, состоящие из углерода, водорода, кислорода, азота и (в некоторых случаях) серы, связанных в характерные образования.Нити аминокислот составляют белки, которых существует бесчисленное множество разновидностей. Из 20 аминокислот, необходимых для производства белков, необходимых человеческому организму, организм сам производит только 12, а это означает, что мы должны удовлетворять наши потребности в остальных восьми за счет питания. Это всего лишь один пример важности аминокислот для жизнедеятельности. Другой предостерегающей иллюстрацией силы аминокислот является спектр заболеваний (в первую очередь серповидно-клеточная анемия), которые ухудшают или уносят жизни тех, чьи аминокислоты находятся вне последовательности или работают со сбоями.Когда-то использовавшиеся для датировки объектов из далекого прошлого, аминокислоты существовали на Земле как минимум три миллиарда лет — задолго до появления первых настоящих организмов.
КАК ЭТО РАБОТАЕТ
«Карта» аминокислот
Аминокислоты — это органические соединения, то есть они содержат углерод и водород, связанные друг с другом. Помимо этих двух элементов, они включают азот, кислород и, в некоторых случаях, серу. Основная структура молекулы аминокислоты состоит из атома углерода, связанного с аминогруппой (-NH 2 ), карбоксильной группы (-COOH), атома водорода и четвертой группы, которая отличается от одной аминокислоты до другой, который часто называют группой — R или боковой цепью.Группа- R , которая может варьироваться в широких пределах, отвечает за различия в химических свойствах.
Это объяснение звучит немного техническим и требует знания химии, которое выходит за рамки этого эссе, но позвольте нам его несколько упростить. Представьте, что молекула аминокислоты похожа на циферблат компаса с атомом углерода в центре. Из центра в четырех направлениях компаса расходятся линии, представляющие химические связи с другими атомами или группами атомов.Эти направления основаны на моделях, которые обычно используются для представления молекул аминокислот, хотя север, юг, восток и запад, используемые на следующей иллюстрации, являются просто терминами, упрощающими визуализацию молекулы.
К югу от атома углерода (C) находится атом водорода (H), который, как и все другие атомы или группы, соединен с углеродным центром химической связью. К северу от углеродного центра находится так называемая аминогруппа (-NH 2 ). Дефис в начале указывает, что такая группа обычно не стоит отдельно, но обычно присоединена к какому-либо другому атому или группе.На востоке находится карбоксильная группа, представленная как -COOH. В аминогруппе два атома водорода связаны друг с другом, а затем с азотом, тогда как карбоксильная группа имеет два отдельных атома кислорода, натянутых между атомом углерода и атомом водорода. Следовательно, они не представлены как O 2 .
Наконец, на западе находится группа R , которая может сильно различаться. Это как если бы другие части аминокислоты вместе образовали стандартный суффикс в английском языке, такой как -tion. В начале этого суффикса могут быть прикреплены всевозможные термины, взятые из корневых слов, например, , воспитывать, или , удовлетворять, , или , восстание, — отсюда, образование, удовлетворение, и революция. Термины, прикрепленные к передней части, очень разнообразны, но хвостовая часть, -tion, представляет собой единую формацию. Аналогично, углерод, водород, аминогруппа и карбоксильная группа в аминокислоте более или менее постоянны.
НЕСКОЛЬКО ДОПОЛНИТЕЛЬНЫХ ТОЧЕК.
Название аминокислота фактически происходит от аминогруппы и кислотной группы, которые являются наиболее химически активными частями молекулы. Каждая из распространенных аминокислот имеет, помимо химического названия, более знакомое название и трехбуквенное сокращение, которое часто используется для ее идентификации. В данном контексте нас не интересуют эти сокращения. Молекулы аминокислот, которые содержат аминогруппу и карбоксильную группу, не ведут себя как обычные молекулы. Вместо того, чтобы плавиться при температуре выше 392 ° F (200 ° C), они просто разлагаются.Они вполне растворимы или способны растворяться в воде, но нерастворимы в неполярных растворителях (масла и все продукты на масляной основе), таких как бензол или эфир.
ПРАВАЯ И ЛЕВАЯ ВЕРСИИ.
Все аминокислоты в организме человека, за исключением глицина, являются правосторонними или левосторонними версиями одной и той же молекулы, что означает, что в некоторых аминокислотах положения карбоксильной группы и R -группы совпадают. переключился. Интересно, что почти все аминокислоты, встречающиеся в природе, являются левыми версиями молекул или L-формами.(Следовательно, модель, которую мы описали, на самом деле является левой, хотя различия между «правым» и «левым», в том числе с направлением поляризации света, слишком сложны, чтобы обсуждать здесь.)
Правые версии (D-формы) не встречаются в белках высших организмов, но они присутствуют в некоторых низших формах жизни, например, в клеточных стенках бактерий. Они также содержатся в некоторых антибиотиках, среди которых стрептомицин, актиномицин, бацитрацин и тетрациклин.Эти антибиотики, некоторые из которых широко известны широкой публике, могут убивать бактериальные клетки, препятствуя образованию белков, необходимых для поддержания жизни и воспроизводства.
Аминокислоты и белки
Химическая реакция, характерная для аминокислот, включает образование связи, называемой пептидной связью, между карбоксильной группой одной аминокислоты и аминогруппой второй аминокислоты. Таким образом, очень длинные цепи аминокислот могут соединяться вместе, образуя белки, которые являются основными строительными блоками всего живого.Конкретные свойства каждого вида белка во многом зависят от вида и последовательности аминокислот в нем. Другие аспекты химического поведения белковых молекул обусловлены взаимодействиями между амино и карбоксильными группами или между различными R -группами вдоль длинных цепочек аминокислот в молекуле.
НОМЕРА И СОЧЕТАНИЯ.
Аминокислоты действуют как мономеры или отдельные звенья, которые соединяются вместе с образованием больших цепочечных молекул, называемых полимерами, которые могут содержать от двух до 3000 аминокислотных единиц.Группы, состоящие только из двух аминокислот, называются дипептидами, а три аминокислоты, связанные вместе, называются трипептидами. Если в цепи более 10, они называются полипептидами, а если их 50 или более, они называются белками.
Все миллионы различных белков в живых организмах образуются путем связывания всего 20 аминокислот, образующих длинные полимерные цепи. Подобно 26 буквам алфавита, которые соединяются в разные слова, в зависимости от того, какие буквы используются и в какой последовательности, 20 аминокислот могут соединяться вместе в различных комбинациях и сериях для образования белков.Но в то время как в словах обычно всего около 10 или меньше букв, белки обычно состоят из всего лишь от 50 до 3000 аминокислот. Поскольку каждую аминокислоту можно использовать много раз в цепи и нет ограничений на длину цепи, количество возможных комбинаций для образования белков действительно огромно. Существует около двух квадриллионов различных белков, которые могут существовать, если каждая из 20 аминокислот, присутствующих в организме человека, используется только один раз. Однако так же, как не все последовательности букв имеют смысл, не все последовательности аминокислот производят функционирующие белки.Как мы увидим, некоторые другие последовательности могут функционировать и, тем не менее, вызывать нежелательные эффекты.
ПРИМЕНЕНИЯ В РЕАЛЬНОЙ ЖИЗНИ
ДНК (дезоксирибонуклеиновая кислота), молекула во всех клетках, которая содержит генетические коды для наследования, создает закодированные инструкции для синтеза аминокислот. В 1986 году американский ученый-медик Таддеус Р. Драйя (1940-) использовал аминокислотные последовательности для идентификации и выделения гена типа рака, известного как ретинобластома, факт, который иллюстрирует важность аминокислот в организме.
Аминокислоты также присутствуют в гормонах, химических веществах, которые необходимы для жизни. Среди этих гормонов есть инсулин, который регулирует уровень сахара в крови и без которого человек умер бы. Другой — адреналин, который контролирует кровяное давление и дает животным внезапный прилив энергии, необходимый в ситуации сильного стресса — убегая от хищника на лугах или (используя пример человека) лицом к лицу с грабителем в переулке или с хулиганом на детская площадка. Биохимические исследования аминокислотных последовательностей в гормонах сделали это возможность для ученых изолировать и искусственно производить эти и другие гормоны, в том числе гормон роста человека.
Аминокислоты и питание
Так же, как белки образуются, когда аминокислоты соединяются в длинные цепи, они могут расщепляться с помощью реакции, называемой гидролизом , — обратной реакции образования пептидной связи. Именно это происходит в процессе пищеварения, когда специальные пищеварительные ферменты в желудке позволяют разрушить пептидную связь. (Ферменты — это тип белка — см. Ферменты.) Аминокислоты, снова разделенные, попадают в тонкий кишечник, откуда они попадают в кровоток и разносятся по всему организму.Каждая отдельная клетка организма может затем использовать эти аминокислоты для сборки новых и различных белков, необходимых для ее конкретных функций. Таким образом, жизнь представляет собой непрерывный цикл, в котором белки расщепляются на отдельные аминокислотные единицы, и из этих аминокислот создаются новые белки.
ОСНОВНЫЕ АМИНОКИСЛОТЫ.
Из многих тысяч возможных аминокислот человеку требуется только 20 различных видов. Два других появляются в телах некоторых видов животных, и около 100 других можно найти в растения.Учитывая огромное количество аминокислот и возможных комбинаций, существующих в природе, количество незаменимых для жизни аминокислот чрезвычайно мало. Однако из 20 аминокислот, необходимых человеку для производства белка, только 12 могут вырабатываться в организме, тогда как остальные восемь — изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин — должны быть получены с пищей. . (Кроме того, взрослые способны синтезировать аргинин и гистидин, но эти аминокислоты считаются необходимыми для растущих детей, а это означает, что дети не могут производить их самостоятельно.)
Полный белок — это белок, который содержит все незаменимые аминокислоты в количествах, достаточных для роста и восстановления тканей тела. Большинство белков животного происхождения, за исключением желатина, содержат все незаменимые аминокислоты и поэтому считаются полноценными белками. С другой стороны, многие растительные белки не содержат всех незаменимых аминокислот. Например, в кукурузе, рисе и пшенице отсутствует лизин, в кукурузе также отсутствует триптофан, а в рисе — треонин.В соевых бобах отсутствует метионин. Веганы или вегетарианцы, которые не потребляют в своем рационе животные белки (то есть не содержат яиц, молочных продуктов и т.п.), подвержены риску недоедания, поскольку они могут не усвоить одну или несколько незаменимых аминокислот.
Аминокислоты, здоровье и болезни
Аминокислоты можно использовать для лечения всех видов заболеваний. Например, тирозин можно использовать при лечении болезни Альцгеймера, состояния, характеризующегося началом деменции или умственного ухудшения, а также симптомов алкогольной абстиненции.Таурин вводят для контроля эпилептических припадков, лечения высокого кровяного давления и диабета, а также для поддержки работы печени. Многие другие аминокислоты используются при лечении множества других заболеваний. Иногда само заболевание связано с проблемой производства или функционирования аминокислот. В эссе «Витамины» обсуждается пеллагра — заболевание, возникающее в результате дефицита витамина группы B, известного как ниацин. Пеллагра является результатом диеты, богатой кукурузой, в которой, как мы уже отмечали, не хватает лизина и триптофана.Его симптомы часто описываются как «три Ds»: диарея, дерматит (или воспаление кожи) и деменция. Благодаря большему пониманию питания и здоровья пеллагра в значительной степени искоренена, но все еще существует состояние с почти идентичными симптомами: болезнь Хартнупа, генетическое заболевание, названное в честь британской семьи в конце 1950-х годов, которая страдала от нее.
Болезнь Хартнупа характеризуется неспособностью транспортировать аминокислоты от почек к остальным частям тела.Симптомы сначала, казалось, подсказывали врачам, что болезнь, которая присутствует у одного из примерно 26 000 живорождений, — это пеллагра. Тесты показали, что у больных не было недостаточного уровня триптофана, как в случае с пеллагрой. С другой стороны, около 14 аминокислот было обнаружено в избытке в моче больных болезнью Хартнупа, что указывает на то, что вместо того, чтобы правильно транспортировать аминокислоты, их тела просто выделяют их. Это потенциально очень серьезное заболевание, но его можно лечить с помощью никотинамида витамина B, который также используется для лечения пеллагры.Добавление триптофана в рацион также показало положительные результаты у некоторых пациентов.
СЕРПОВАЯ КЛЕТОЧНАЯ АНЕМИЯ.
Также возможны небольшие ошибки в аминокислотной последовательности в организме. В то время как эти ошибки иногда допускаются в природе без серьезных проблем, в других случаях одна неверно размещенная аминокислота в полимерной цепи может вызвать чрезвычайно серьезное состояние нарушения функции белка. Примером этого является серповидно-клеточная анемия, смертельное заболевание, в конечном итоге вызванное единственной ошибкой в аминокислотной последовательности.В организме людей, страдающих серповидноклеточной анемией, которые обычно являются выходцами из Африки к югу от Сахары или их потомками в Соединенных Штатах или где-либо еще, глутаминовая кислота заменяется валином в шестой позиции от конца белковой цепи в молекуле гемоглобина. (Гемоглобин — это железосодержащий пигмент красных кровяных телец, который отвечает за транспортировку кислорода к тканям и удаление из них углекислого газа.) Это небольшое различие делает молекулы серповидно-клеточного гемоглобина чрезвычайно чувствительными к недостатку кислорода.В результате, когда красные кровяные тельца выделяют кислород в ткани, как это делают все красные кровяные тельца, они не могут повторно насыщаться кислородом в нормальном режиме и вместо этого скручиваются в форму. это дало название серповидно-клеточной анемии. Это вызывает закупорку кровеносных сосудов. До разработки лечения препаратом гидроксимочевина в середине 1990-х годов средняя продолжительность жизни человека с серповидно-клеточной анемией составляла около 45 лет.
Аминокислоты и далекое прошлое
В эссе «Эволюция» обсуждается несколько типов датирования — термин, относящийся к научным усилиям, направленным на определение возраста конкретного предмета или явления.Методы датировки могут быть относительными (т. Е. Сравнительными и обычно основанными на пластах или слоях горных пород) или абсолютными. В то время как относительное датирование не включает фактических оценок возраста в годах, абсолютное датирование включает. Одним из первых разработанных методов абсолютного датирования была аминокислотная расимизация, представленная в 1960-х годах. Как отмечалось ранее, существуют «левые» l-формы и «правые» d-формы всех аминокислот. Практически все живые организмы (за исключением некоторых микробов) включают только l-формы, но после смерти организма l-аминокислоты постепенно превращаются в зеркальные d-аминокислоты.
На скорость конверсии влияет множество факторов, и хотя аминокислотный рацимизация была популярна как форма свидания в 1970-х годах, с этим есть проблемы. Например, процесс протекает с разной скоростью для разных аминокислот, и на скорость дополнительно влияют такие факторы, как влажность и температура. Из-за неопределенностей с аминокислотным расимизацией он был в значительной степени заменен другими методами абсолютного датирования, такими как использование радиоактивных изотопов.
Конечно, сами аминокислоты дали важные ключи к пониманию далекого прошлого планеты.Открытие в 1967 и 1968 годах осадочных пород, содержащих следы аминокислот возрастом более трех миллиардов лет, оказало огромное влияние на изучение биологической истории Земли. Здесь впервые было конкретное свидетельство жизни — по крайней мере, в очень простой химической форме — существовавшей за миллиарды лет до появления первого настоящего организма. Открытие этих образцов аминокислот сильно повлияло на размышления ученых об эволюции, особенно на самых ранних стадиях, на которых были заложены химические основы жизни.
ГДЕ ПОДРОБНЕЕ
«Аминокислоты». Институт химии, факультет биологии, химии и фармации, Свободный университет, Берлин (веб-сайт).
Гудселл, Дэвид С. Наша молекулярная природа: двигатели, машины и сообщения тела. Нью-Йорк: Коперник, 1996.
«Введение в аминокислоты». Отделение кристаллографии Бирбекского колледжа (веб-сайт).
Михал, Герхард. Биохимические пути: атлас биохимии и молекулярной биологии. Нью-Йорк: Джон Вили и сыновья, 1999.
Ньюстром, Харви. Каталог питательных веществ : витамины, минералы, аминокислоты, макроэлементы — полезное использование, помощники, ингибиторы, источники пищи, рекомендации по потреблению и симптомы чрезмерного или недостаточного употребления. Джефферсон, Северная Каролина: МакФарланд и Компания, 1993.
Орнштейн, Роберт Э., и Чарльз Свенсионис. Исцеляющий мозг: научный читатель. New York: Guilford Press, 1990.
Справочное руководство по аминокислотам (веб-сайт).
Сильверстайн, Элвин, Вирджиния Б. Сильверстайн и Роберт А. Сильверстайн. Белков. Рис. Энн Каневари Грин. Brookfield, CT: Millbrook Press, 1992.
Springer Link: Amino Acids (веб-сайт).
КЛЮЧЕВЫЕ ТЕРМИНЫ
АМИНОКИСЛОТ:
Органические соединения, состоящие из углерода, водорода, кислорода, азота и (в некоторых случаях) серы, связанных в характерные образования. Нити аминокислот составляют белки.
AMINO GROUP:
Химическое образование NH 2 , входящее в состав всех аминокислот.
БИОХИМИЯ:
Область биологических наук, связанная с химическими веществами и процессами в организмах.
КАРБОКСИЛЬНАЯ ГРУППА:
Образование COOH, общее для всех аминокислот.
СОЕДИНЕНИЕ:
Вещество, в котором атомы более чем одного элемента химически связаны друг с другом.
ДИПЕПТИД:
Группа, состоящая всего из двух аминокислот.
ДНК:
Дезоксирибонуклеиновая кислота, молекула во всех клетках и многих вирусах, содержащая генетические коды для наследования.
ФЕРМЕНТ:
Белковый материал, ускоряющий химические реакции в организме растений и животных.
ОСНОВНЫЕ АМИНОКИСЛОТЫ:
Аминокислоты, которые не могут вырабатываться организмом и поэтому должны быть получены с пищей. Белки, содержащие незаменимые аминокислоты, известны как полных белков.
GENE:
Единица информации о конкретном наследуемом (способном наследоваться) признаке, которая передается от родителей к потомству, хранящаяся в молекулах ДНК, называемых хромосомами .
ГОРМОН:
Молекулы, продуцируемые живыми клетками, которые посылают сигналы в точки, удаленные от точки их происхождения, и вызывают специфические эффекты на деятельность других клеток.
МОЛЕКУЛА:
Группа атомов, обычно, но не всегда представляющая более одного элемента, объединенная в структуру. Соединения обычно состоят из молекул.
ОРГАНИЧЕСКИЙ:
Одно время химики использовали термин органический только в отношении живых существ. Теперь это слово применяется к соединениям, содержащим углерод и водород.
ПЕПТИДНАЯ СВЯЗЬ:
Связь между карбоксильной группой одной аминокислоты и аминогруппой второй аминокислоты.
ПОЛИМЕРЫ:
Большие цепочечные молекулы, состоящие из множества субъединиц, известных как мономеров.
ПОЛИПЕПТИД:
Группа от 10 до 50 аминокислот.
БЕЛКИ:
Большие молекулы, состоящие из длинных цепочек из 50 или более аминокислот. Белки выполняют функции стимулирования нормального роста, восстановления поврежденных тканей, поддержки иммунной системы организма и выработки ферментов.
РНК:
Рибонуклеиновая кислота, молекула, транслируемая с ДНК в ядре клетки, управляющем центре клетки, которая направляет синтез белка в цитоплазме или пространстве между клетками.
СИНТЕЗ:
Для химического производства, как в теле.
ТРИПЕПТИД:
Группа из трех аминокислот.
Почему 20 аминокислот? | Feature
Для многих исследователей изучение химического происхождения жизни — это побочный проект — это то, чем они занимаются в перерывах между финансируемой за счет грантов работой по изучению причин и лечению болезней человека. Но понимание эволюции на химическом уровне — их страсть, даже когда финансирование скудно. Как химия могла привести нас к сложной жизни, вызывает много открытых вопросов.Один из фундаментальных вопросов — почему жизнь основана на наборе 20 аминокислот. Почему 20, а не 10 или 30? А почему именно эти 20? За последние несколько десятилетий увлеченные химики и молекулярные биологи, которые не могут оставить эти вопросы в покое, начали собирать воедино некоторые убедительные объяснения.
От аланина (A) до тирозина (Y), 20 «протеиногенных» аминокислот, каждая из которых обозначается аббревиатурой с разными буквами, составляют алфавитный суп жизни. Они являются строительными блоками для белков, макромолекул «рабочей лошадки» биологии, которые обеспечивают структуру и функции всех организмов.Но почему аминокислоты? Бернд Моосманн, эксперт по окислительно-восстановительной медицине из Университета Йоханнеса Гутенберга в Майнце в Германии, предполагает, что первые аминокислоты были использованы для закрепления мембран в структурах РНК: «Вы можете увидеть это даже в современной жизни: ДНК и РНК в бактериях и митохондриях всегда прикреплены изнутри к мембране. » Большинство исследователей полагают, что это могло произойти по крайней мере 4 миллиарда лет назад в ‘мире РНК’, где молекулы РНК были первыми саморепликаторами, а также выполняли каталитическую роль, которую играют белки. Cегодня.
Как протеиногенные аминокислоты появились на Земле — еще один важный вопрос. Знаменитый эксперимент Миллера-Юри 1952 года показал, что с помощью электрических искр, имитирующих молнию, простые соединения, такие как вода, метан, аммиак и водород, образуют более 20 различных аминокислот. 1 Они также встречаются в метеоритах: анализ метеорита Меричисон, приземлившегося в Австралии в 1969 году, обнаружил по крайней мере 86 аминокислот, цепи заместителей, содержащие до девяти атомов углерода, а также дикарбоксильные и диамино-функциональные группы. 2 Может быть, эти в общем простые и легко доступные аминокислоты были первыми, кого насильно заставили жить?
Эндрю Дойг, химический биолог из Манчестерского университета в Великобритании, размышлял о химии эволюции, когда не проводил свои исследования болезни Альцгеймера. У него другой взгляд на этот вопрос: «[Протеиногенные аминокислоты] были выбраны в мире РНК, где миллионы лет существовали жизнь и метаболизм, которые уже генерировали огромное количество органических молекул.«Если бы аминокислоты были продуктом метаболизма РНК, это бы значительно увеличило их концентрацию в окружающей среде», — утверждает он.
Но выбор из 20 аминокислот, используемых в биологии, явно связан с развитием белков. Путем полимеризации аминокислот в длинных полипептидных цепях белки могут складываться в растворимые структуры с плотно упакованными ядрами и упорядоченными связывающими карманами. Появление белков и, в конечном итоге, принятие 20 стандартных аминокислот, вероятно, было большим эволюционным шагом.
Но, по словам Дойга, это все домыслы. «У нас вообще нет прямых доказательств». Из сравнения геномов организмов сегодня мы знаем, что 3,5–3,8 миллиарда лет назад наш общий предок, известный как последний универсальный общий предок, использовал 20 общих для всех аминокислот. живые существа.
Замерзшая авария?
Так почему именно этот набор из 20 аминокислот, а не какие-либо другие? «Очевидным недостатком является способность проводить окислительно-восстановительные реакции», — объясняет Дойг.«Они не были выбраны из-за способности выполнять катализ напрямую». Сегодня белки образуют ферменты для биологического катализа, но первыми биологическими катализаторами в мире РНК, вероятно, были то, что мы сейчас называем кофакторами — ионы металлов или небелковые органические молекулы. (коферменты), которые помогают ферментам в катализе реакций и часто состоят из витаминов.
Наблюдалась тенденция рассматривать выбор из 20 аминокислот как произвольный — как в «теории замороженной аварии», предложенной британским молекулярным биологом Фрэнсисом Криком в 1960-х годах, которая предполагала, что другая группа из 20 была бы столь же хорошей.«Я продолжал читать это и понимал, что это неправильно, — говорит Дойг. Это побудило его изложить свои мысли в недавней статье, где он утверждает, что есть причины, по которым выбор каждой аминокислоты делает их почти идеальной группой. 3 Факторы, которые он учел, включали атомы компонентов каждой аминокислоты, функциональные группы и стоимость биосинтеза.
Для формирования растворимых, стабильных белковых структур с плотно упакованными ядрами и упорядоченными связывающими карманами требовалось то разнообразие аминокислот, которое мы видим сегодня, — объясняет Дойг.Необходимы множественные гидрофобные белки. «Ядро белка — это трехмерная головоломка — если у вас много разных гидрофобных аминокислот, это дает вам больше возможностей построить ядро без каких-либо промежутков».
Тот факт, что гидрофобные аминокислоты имеют тенденцию к разветвленным боковым цепям, также можно объяснить. Внутри белкового ядра молекула больше не может вращаться и теряет часть связанной с ней энтропии. «Если у вас есть разветвленные аминокислоты, такие как валин, лейцин и изолейцин, вы теряете меньше энтропии, когда закапываете их, поэтому эволюция выбрала гидрофобные аминокислоты не только потому, что они гидрофобны, но и потому, что они разветвленные», — объясняет Дойг.«Если вы хотите, чтобы аминокислоты входили в ядро белка, вы делаете его разветвленным и гидрофобным, если вы хотите, чтобы он был на поверхности, вы делаете его с прямой цепью и полярным, как аргинин и глутаминовая кислота».
Химическое пространство
Стивен Фриланд, астробиолог из Университета Мэриленда в США, разработал метод, показывающий, что аминокислоты, принятые биологией, не были выбраны случайным образом. Он позаимствовал идею химического пространства из открытия лекарств, где молекулы нанесены в трехмерное пространство, чтобы помочь обнаружить бреши, которые могут открыть новые молекулы лекарств.Фриланд и его команда исследовали три параметра: размер, заряд и гидрофобность. «Они не идеальны, — признает Фриланд, — но в качестве приблизительных показателей того, что делают аминокислоты и почему они это делают, эти три довольно хороши». Гидрофобность, очевидно, играет ключевую роль в том, как белки складываются, заряд важен в реакциях и Активные сайты и размер интуитивно понятны, говорит Фриланд.
«Мы обнаружили, что набор, который используется биологией, обладает рядом удивительно неслучайных свойств, которые очень четко выделяются», — говорит Фриланд.Аминокислоты были широко распределены по своему химическому пространству, но также показали равномерность в этом распределении — как будто пытались охватить как можно больше различных наборов свойств. 4 ‘То, что мы обнаруживаем с [протеиногенными] аминокислотами, — это момент, когда вы добавляете оба этих фактора [гидрофобность и заряд], почти каждый тест, который вы можете провести с ними, говорит, что они неслучайны — не только они покрывают хороший диапазон, но они не сгущаются в крайности ».
Итак, если этот неслучайный набор аминокислот был выбран по уважительной причине, можно ли создать порядок, в котором они были включены в биологию? «Сейчас все согласны с тем, что не все они пришли сразу, что, на мой взгляд, подавляюще», — говорит Фриланд.Попытка составить исчерпывающий заказ была предпринята израильским молекулярным биофизиком Эдвардом Трифоновым, который сейчас работает в Институте эволюции Хайфского университета. Трифонов открыл множество новых кодов в ДНК и в начале 2000-х обратил свое внимание на аминокислоты.
Размещение простейших по химическому составу аминокислот в первую очередь может показаться очевидным, но Трифонов пошел дальше. Он рассмотрел несколько критериев, включая энергетическую стоимость их синтеза, тип молекул транспортной РНК, используемых для их транспортировки, и количество кодонов (последовательность из трех нуклеотидов РНК, которая соответствует определенной аминокислоте), используемых в синтезе белка; аминокислоты с несколькими кодонами, вероятно, старше, чем с одним.Он усреднил данные и предложил временной порядок, начиная с аланина и глицина. 5
Freeland также рассмотрел, как шаблоны могут изменяться в зависимости от аминокислот, которые, как предполагается, были приняты раньше и позже. Используя только первые 10 в химическом пространстве, он обнаружил неслучайные свойства в отличие от изучения всех возможных аминокислот, доступных на пребиотической земле (от Миллера-Юри или метеоритов). Затем он добавил полный набор из 20. «Более поздние из них расширяют химическое пространство первых таким образом, чтобы максимизировать диапазон и равномерность, и для моих денег наиболее интересным является то, что они, кажется, закрывают область химического пространства, которая была раньше. малонаселенный, между тем, где сидят самые ранние, и тем, где будут сидеть димеры ранних », — говорит он.«Совершенно логично, что именно сюда можно подключать».
Oxygen расширяет код
Мы, конечно, знаем, что белки могут быть получены из гораздо меньшего набора аминокислот. Японская группа, возглавляемая Сатоши Аканума из Университета Васэда, недавно показала, что алфавит из 13 аминокислот может создавать свернутые, растворимые, стабильные и каталитически активные «белки», хотя и не такие активные или стабильные, как исходные белки, на которых они основаны. 6 Итак, что могло побудить к добавлению дополнительных аминокислот? По словам Моосманна, молекулярный кислород заставил жизнь включить последние шесть новых аминокислот.
Предполагаемые последние шесть аминокислот (гистидин, фенилаланин, цистеин, метионин, триптофан и тирозин) химически «мягче» — они сильно поляризуемы и связываются ковалентно. «Скорее всего, это адаптация, а не совпадение или дрейф», — говорит Мосманн. Эта идея пришла к Мосманну во время исследований тканей мозга мышей (его «повседневная работа» включает исследования нейродегенеративных заболеваний). Он заметил, что некоторые аминокислоты гораздо более склонны к окислительной деградации — те, которые, как считается, были приняты позже.
Если эти аминокислоты были добавлены в биологию из-за их окислительно-восстановительной активности, он догадывался, что эти адаптации связаны с повышением уровня молекулярного кислорода на Земле. Считается, что кислород стал частью окружающей среды Земли около 2,5 миллиардов лет назад в результате так называемого «великого окислительного события», но Моосманн говорит, что основная причина местного образования низких доз кислорода, вероятно, старше. Согласно недавнему исследованию эволюции ферментов, участвующих в фотосинтезе, Танай Кардона из Имперского колледжа Лондона в Великобритании предположил, что происхождение оксигенного фотосинтеза было 3.6 миллиардов лет назад. 7
Он решил продолжить исследование, изучив пробелы Homo – Lumo для всех биологических аминокислот. Энергетическая щель между самой высокой занятой молекулярной орбиталью и самой низкой незанятой молекулярной орбиталью предсказывает реакционную способность соединения по отношению к переносу электрона. 8 «Разрывы Homo – Lumo [из всех 20 аминокислот] имели закономерность, просто падая в той самой точке (номер 14), когда проявились« адаптивные »свойства, и это совпадение, вероятно, не совпадение!»
Значительно меньшие пробелы, обнаруженные для более поздних аминокислот, предполагают, что их основная функция заключалась в прохождении окислительно-восстановительных реакций, и Мосманн утверждает, что это было необходимо в среде, где могли образовываться свободные радикалы кислорода, которые особенно разрушительны для липидов.«Более мягкие» и более окислительно-восстановительные аминокислоты были способны защищать клетки: «Эти [новые аминокислоты] могут поддерживать целостность липидного бислоя в присутствии повышающихся концентраций кислорода или в присутствии химических воздействий, которые имеют тенденцию атаковать или разлагают ненасыщенные жирные кислоты », — говорит Мосманн. «Для последних трех [метионин, триптофан и тирозин] есть неопровержимые доказательства реакции на кислород».
Тогда возникает один вопрос: содержал ли наш последний универсальный общий предок полный набор аминокислот.Исследование 2016 года выявило набор из 355 генов, предположительно присутствующих в организме, который стал известен как Лука. 9 Моосман говорит, что Лука датируется периодом от 3,7 до 2,9 миллиарда лет назад, так что, возможно, кислород был доступен. «Следствием этого действительно является то, что Лука (если он когда-либо существовал) имел менее 20 аминокислот.» Он предполагает, что более поздние добавления генетического кода могли быть распределены латерально по всем современным линиям: «Я думаю, что у Луки было 17– 18 АК, без метионина, триптофана и, возможно, тирозина.’
Зачем останавливаться на 20?
Адаптация к насыщенному кислородом мире может объяснить расширение кода до 20 аминокислот, но зачем останавливаться на достигнутом? «Я бы сказал, посмотрите, на что способны 20», — говорит Фриланд. «Похоже, 20 — этого достаточно для почти каждого живого организма, чтобы приспособиться к невообразимому количеству сред обитания за всю историю жизни».
На самом деле в организмах используются по крайней мере две дополнительные аминокислоты, хотя только одна из них содержится в человеческих белках — селенсодержащий селеноцистеин.Он обнаружен в активных центрах 25 белков человека, но включается более сложным механизмом, чем нормальный синтез белка. «Это показывает, что процесс не остановился, он достиг точки, когда внедрение новых аминокислот чрезвычайно сложно», — говорит Луис Рибас, молекулярный биолог из Института исследований биомедицины, Барселона, Испания. «Если вы хотите это сделать, вам нужно найти очень оригинальные решения».
Ограничение в распознавании тРНК
Чтобы ответить на вопрос «Почему 20?», Риблас внимательно изучил механизм синтеза белка — трансляцию.Процесс осуществляется в рибосоме клетки, очень большом комплексе молекул РНК и белка. Каждая аминокислота переносится специальной молекулой транспортной РНК (тРНК), присоединенной через гидроксильную группу с образованием сложного эфира. Затем он вступает в реакцию с концевой аминокислотой растущей белковой цепи. Правильная аминокислотная последовательность транслируется из молекул информационной РНК посредством спаривания оснований Уотсона – Крика с молекулами тРНК. Каждая тРНК содержит последовательности из трех оснований, специфичных для одной из 20 аминокислот — кодона.
Учитывая, что каждая аминокислота кодируется последовательностью из трех оснований, вы можете предположить, что будет 64 возможных комбинации (из четырех возможных оснований). Хотя три кодона используются в качестве инструкций для остановки синтеза белка, остается 61 — так зачем же останавливаться на 20 уникальных аминокислотах? «Ограничение заключается в распознавании тРНК», — говорит Рибас. Каждая молекула тРНК имеет четко определенную третичную структуру, которая распознается ферментом аминоацил тРНК синтетазой, который добавляет правильную аминокислоту.Изучая структуры тРНК, Рибас пришел к выводу, что проблема заключается в поиске способов создания новых молекул тРНК, которые могли бы распознавать новую аминокислоту, не подбирая существующие. 10 Возможные структуры ограничены, так как они также должны соответствовать существующим механизмам трансляции белков.
‘Это как если бы у вас был очень простой тип замка, где вы могли бы заменить только три или четыре штифта, вы подошли к точке, где вы не сможете создавать новые ключи, потому что новый ключ откроет замок, который у вас уже есть используется, и это противоречит цели », — поясняет он.Момент, когда природа не смогла создать новые уникальные тРНК, которые нельзя было бы принять за другие, по-видимому, находился на уровне 20 аминокислот. В современной биологии это позволяет кодировать большинство аминокислот более чем одним кодоном — избыточность помогает более точной трансляции (по оценкам, ошибки включения аминокислот возникают один раз на 1000–10 000 кодонов).
Расширение кода аминокислоты
Рибас говорит, что его работа также имеет значение для синтетических биологов, которые пытаются продвинуть генетический код на шаг вперед, включив в него неестественные аминокислоты и, возможно, однажды улучшив природу.В 2011 году группа, в состав которой входил гарвардский биолог-синтетик Джордж Черч, удалила один из трех стоп-кодонов из бактерий E. coli , чтобы его можно было заменить альтернативной непротеиногенной аминокислотой, а другие лаборатории включили такие аминокислоты в белки.
Эволюционная теория говорит нам, что набор, который у нас есть, — это микрокосм возможного.
Но Рибас не уверен, что это будет успешная стратегия для синтетических биологов.«Если вы попытаетесь разработать систему in vivo для генерации белков с неприродными аминокислотами, она окажется не очень эффективной, низкая эффективность и часто возникают проблемы со специфичностью», — говорит он. Рибас объясняет это трудностью создания новых молекул тРНК в рамках существующего механизма трансляции белков. «Я не думаю, что есть способ обойти это, [без] обширной модернизации всего оборудования», хотя, добавляет он, в настоящее время это делается.
Даже если это станет возможным, Фриланд считает, что преимуществ будет мало.«Все в эволюционной теории говорит нам, что набор, который у нас есть, — это микрокосм того, что возможно». Окажется ли полезное применение у расширения жизненного репертуара аминокислот, еще предстоит увидеть, но сейчас есть много доказательств того, 20 аминокислот Life были выбраны правильно, а не «замороженной случайностью».
Но Фриланд предостерегает от понимания, которое стремится аккуратно упорядочить химическую эволюцию. Скорее всего, когда-то это было намного сложнее, с вовлечением множества различных типов молекул и механизмов, которые, возможно, теперь были заменены.« Так заманчиво продвигаться от ничего к чему-то, потому что именно это происходит, когда химик садится со стаканом дистиллированной воды и пытается вызвать реакцию — но это не то, что происходит во Вселенной, Вселенная полон беспорядочной химии ».


 — Аминокислоты — это органические соединения, из которых состоят все белки, а олигопептиды — промежуточные соединения, где находится до 7—10 аминокислот.
— Аминокислоты — это органические соединения, из которых состоят все белки, а олигопептиды — промежуточные соединения, где находится до 7—10 аминокислот.
 Лем,
Лем,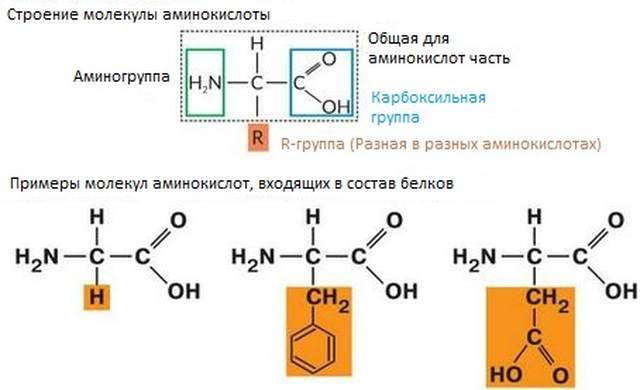 T. McKevitt, K. M. Bryant, S. M. Shakir, J. L. Larabee, S. R. Blanke, et. al.. (2007). Effects of Endogenous D-Alanine Synthesis and Autoinhibition of Bacillus anthracis Germination on In Vitro and In Vivo Infections. Infection and Immunity. 75, 5726-5734;
T. McKevitt, K. M. Bryant, S. M. Shakir, J. L. Larabee, S. R. Blanke, et. al.. (2007). Effects of Endogenous D-Alanine Synthesis and Autoinhibition of Bacillus anthracis Germination on In Vitro and In Vivo Infections. Infection and Immunity. 75, 5726-5734; Journal of Neuroscience. 26, 2814-2819;
Journal of Neuroscience. 26, 2814-2819;