Что такое иммунитет, как он устроен, принцип его работы?
Что такое иммунитет, как он устроен, принцип его работы?
Что такое иммунитет? Как он работает? Можно ли его контролировать? Мы рассказываем об устройстве и механизмах функционирования иммунной системы.
Иммунитет – это способность организма сохранять невосприимчивость к чужеродным для него микроорганизмам и веществам, которая определяется активностью иммунной системы, представленной задействованными в этом процессе органами и клетками.
Внимание! Процесс работы иммунитета можно воочию засвидетельствоватьпри заживлении ран, выздоровлении при инфекционных заболеваниях. Даже то, что в теле человека нет опухолей, является результатом его деятельности. То есть это широкое понятие, не ограничивающееся противостоянием организма вирусам, бактериям и грибкам.
Как устроен иммунитет?
Даже самая примитивная схематичная модель иммунной системы включает десятки групп клеток с сотнями различных рецепторов, которые выполняют астрономически большой перечень задач – от удаления занозы до разрушения раковых тканей.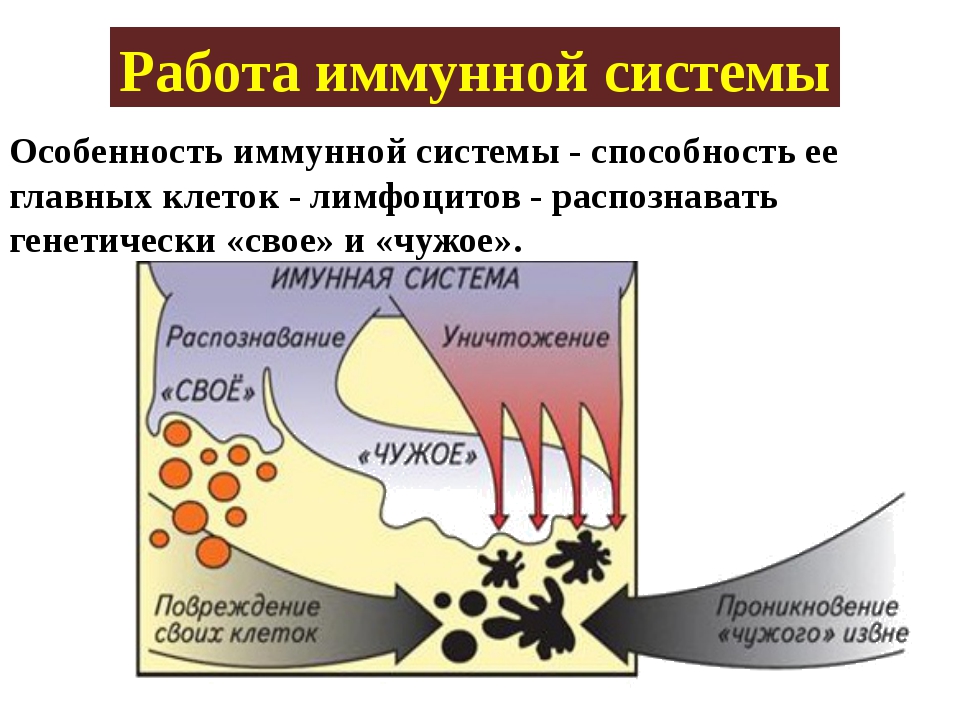
Ее центром являются вилочковая железа, красный костный мозг, селезенка. К периферическим отделам относят лимфатические сосуды и лимфоидную ткань. Роль всех органов и структур – продуцирование иммунных клеток. Их виды и значение перечислены в таблице:
|
Название иммунных клеток |
Основные подвиды |
Кратко о функциях |
|
Т-лимфоциты |
Т-киллеры |
Уничтожают микроорганизмы |
|
Т-хелперы |
Помогают распознавать чужеродные организмы и вещества |
|
|
Т-супрессоры |
Регулируют силу иммунного ответа |
|
|
В-лимфоциты |
Наивные Активированные Плазматические |
Вырабатывают антитела и отвечают за иммунную память. |
|
Нейтрофилы |
Миелоциты Метамиелоциты Палочкоядерные Сегментоядерные |
Поглощают чужеродные клетки и разрушают их вместе с собой, что сопровождается появлением гноя. |
|
Макрофаги |
Альвеолярные Гистиоциты Купферовские Дендритные Селезеночные Перитонеальные Лимфатические |
Поглощают вредоносные клетки и разрушают их, но сами остаются невредимы. |
Есть и другие клетки, выполняющие узконаправленные функции. В таблице перечислены лишь основные.
Как работает иммунитет: подробный пример
Рассмотрим принцип работы иммунитета на примере. Допустим, у юноши появились бородавки, возбудителем которых является вирус папилломы. Как будет происходить защита его организма:
- Вирус папилломы проник через царапину в верхние слои кожи, а затем и в более глубокие. Раньше больной не страдал от этой болезни, поэтому иммунная система не знакома с ее возбудителем.
- Вирусные клетки встроились в генетический материал клеток-хозяев. В результате нарушился их рост, и они начали принимать неправильные формы. Так сформировалась бородавка.
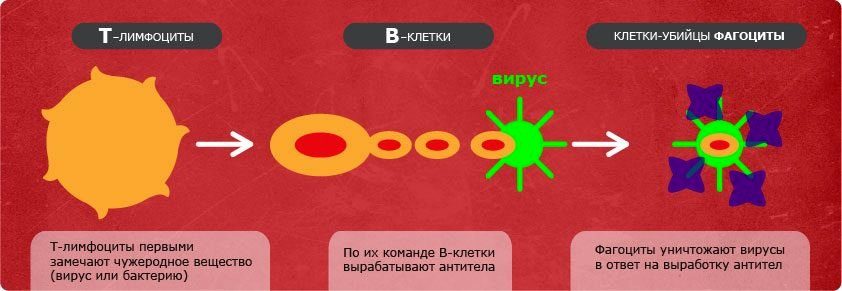
- «Узнав» о вражеской атаке на организм активировались Т-хелперы. Они распознали вирусные частицы и считали с них информацию.

- Т-клетки передают информацию В-клеткам, которые активно вырабатывают антитела.
- Последние транспортируются с кровью к пораженным клеткам, проникают в них и соединяются с вирусными частицами, обезвреживая их. Затем весь комплект нападающих и обороняющихся клеток выводится из организма.
- Т-лимфоциты делятся информацией о нападавших с макрофагами. Они активируются и начинают поглощать и ликвидировать изуродованные клетки кожи. На освободившемся месте формируются новые.
Описанный процесс может длиться от двух недель до нескольких лет. Скорость восстановления внутреннего баланса в организме зависит от активности иммунитета и общего состояния здоровья.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами.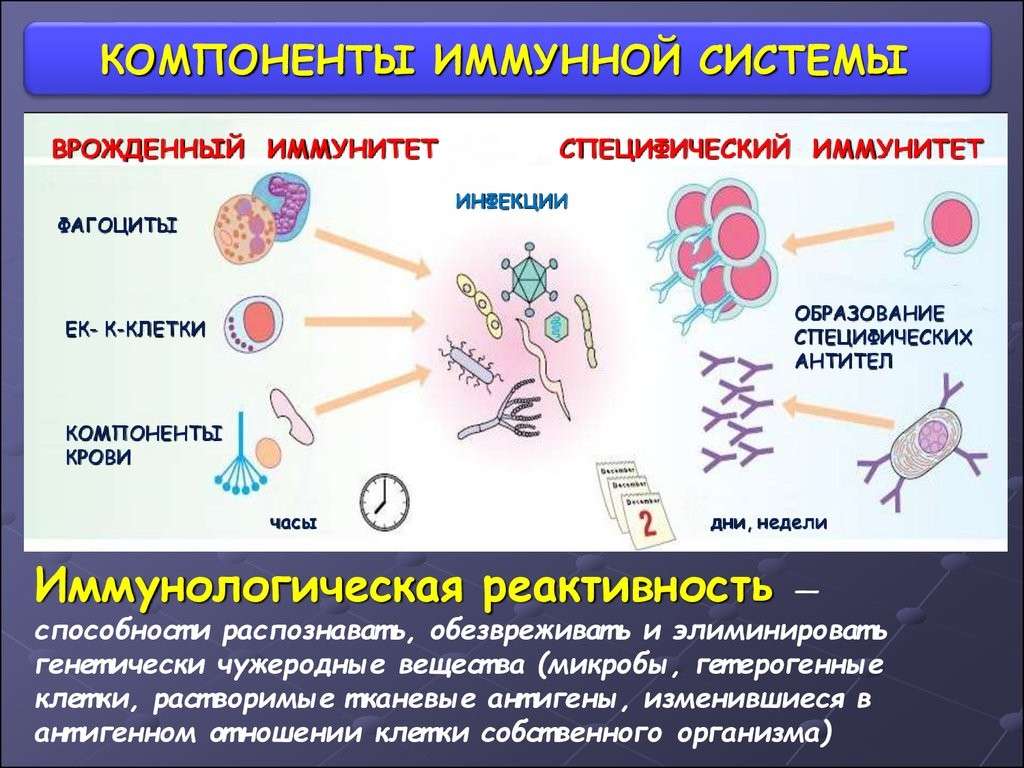 Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Как работает иммунитет и почему снижается. Иммунитет против вирусов
Иммунитет — это одна из систем организма, которая защищает его от патологического воздействия микроорганизмов. Пока известны следующие виды микроорганизмов, которые вызывают иммунный ответ у человека: вирусы, микробы, грибки, гельминты (глисты).
Пока известны следующие виды микроорганизмов, которые вызывают иммунный ответ у человека: вирусы, микробы, грибки, гельминты (глисты).
Все эти организмы живут вместе с нами на планете, вокруг нас, а значит, и в нас. То есть человеческий организм представляет собой многоквартирный дом, в котором живем не только мы, но и все эти формы жизни. И они имеют право там жить.
Но! Они не должны вредить нашему телу — своему дому! Вот именно за этим и следит иммунная система. Она напоминает полицейского, который ходит по коридорам этого многоквартирного дома и контролирует соблюдение порядка: чтобы все жили в своих квартирах и не пытались занять чужие.
И если кто-то начинает усиленно размножаться и пытаться занять чужое жилье, он реагирует и утихомиривает захватчика, заставляя вернуться в свою территорию. Примерно так все устроено.
Из этого следует важный вывод: нельзя без необходимости выселять кого-либо из жильцов! Ибо освободившееся место сразу захватит кто-нибудь другой, что позволит ему размножиться, стать сильнее и уже не подчиняться полицейскому — иммунитету.
Именно поэтому лечение антибиотиками или противоглистными, противовирусными препаратами целесообразно проводить лишь тогда, когда действительно имеется избыток бактерий, гельминтов или вирусов, когда они начинают захватывать чужие квартиры.
Тканевый и гуморальный иммунитет: что это такое?
Так что же такое иммунитет, где он находится и как работает? Реализуется иммунный ответ человеческого организма через иммунные клетки — тех самых полицейских, которые при необходимости вступают в схватку с распоясывающимися микроорганизмами.
Медицина выделяет два вида иммунитета: тканевой и гуморальный. Это одни и те же типы клеток, но расположенные в разных местах. Поскольку инфекция у нас может поселиться везде, то, соответственно, это иммунные клетки в тканях (тканевой иммунитет) и такие же в крови (гуморальный иммунитет). Когда полицейские в тканях не справляются с размножающимися там микроорганизмами, к ним на помощь бросаются гуморальные полицейские — увеличивается приток крови к нужному месту.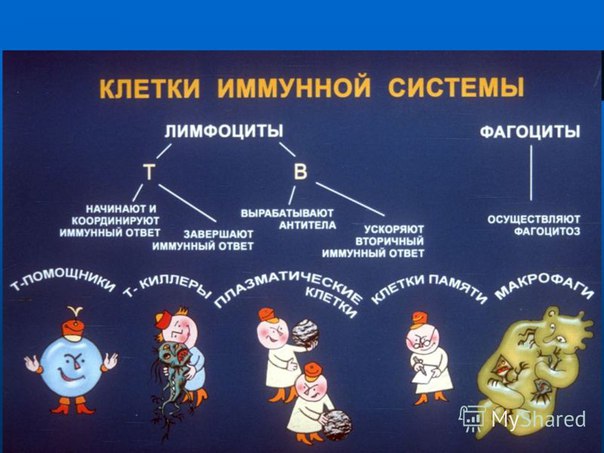
Если есть воспаление, значит иммунитет работает
Реализуется этот процесс с помощью воспаления. Воспаление — универсальная реакция организма в ответ на любое запредельное внешнее воздействие: на инфекцию, травму, ожог, обморожение и т.д. Смысл воспалительной реакции состоит в том, чтобы помочь местному тканевому иммунитету за счет притока гуморальной помощи справиться с опасными чужаками.
Поэтому и реализуется воспаление всегда через пять факторов. Это:
- отек,
- краснота,
- боль,
- увеличение количества лейкоцитов в этом месте
- и выход форменных элементов из крови в ткани.
Краснота вызывается рефлекторным расширением сосудов для увеличения притока крови (гуморального иммунитета). Экссудация (выделение жидкости) и пролиферация (разрастание тканей путём размножения клеток) вызывают отек, смысл которого в том, чтобы затруднить проникновение к проблемному месту других чужаков, ограничить очаг инфекции.
Какие органы отвечают за иммунитет
Иммунные клетки, составляющие тканевой и гуморальный иммунитет, вырабатываются в специальных органах нашего тела. Основным таким органом является красный костный мозг, располагающийся во всех губчатых костях тела: в грудине, костях таза, позвонках, ребрах. Именно там растут и развиваются иммунные клетки.
Участвуют в работе иммунной системы и такие органы, как селезенка, печень, лимфатические узлы и железы. А управляет всеми иммунными процессами организма вилочковая железа — тимус. Именно от ее работы зависят сила и качество работы иммунной системы.
Современная медицина считает, что вилочковая железа есть только у маленьких детей, что якобы она ко взрослому возрасту полностью редуцируется. Это не так. Так почему она уменьшается? Чтобы это понять, нужно заглянуть в современный роддом.
Как связаны иммунитет и роды
Сразу после того как женщина родила, акушеры перерезают пуповину. При этом половина пуповинной крови достается ребенку, а половина остается в плаценте в матке женщины. И после отхождения плаценты вместе с ней используется в фармацевтической или косметической промышленности в качестве очень дорогого и ценного ингредиента. А ребенок, получивший лишь половину причитавшейся ему пуповинной крови, остается ослабленным и с низким иммунитетом.
При этом половина пуповинной крови достается ребенку, а половина остается в плаценте в матке женщины. И после отхождения плаценты вместе с ней используется в фармацевтической или косметической промышленности в качестве очень дорогого и ценного ингредиента. А ребенок, получивший лишь половину причитавшейся ему пуповинной крови, остается ослабленным и с низким иммунитетом.
Именно поэтому практически все дети до школы постоянно болеют. Раньше же, когда бабка-повитуха принимала роды, она сразу после рождения ребенка, не трогая пуповину, клала его на живот матери. И он лежал там до тех пор, пока не начинала отслаиваться плацента. Тогда он начинал испытывать недостаток кислорода, делал первый вздох и кричал. И только затем повитуха обрезала пуповину. Таким образом, вся кровь доставалась ребенку.
В результате таких родов иммунитет снижается, и тимус вынужден увеличивать свои размеры для того, чтобы хоть как-то спасти ребенка от инфекций. Поэтому вилочковая железа в детстве большая, а со временем постепенно уменьшается. Но никогда не атрофируется полностью.
Но никогда не атрофируется полностью.
Помимо непосредственно иммунных клеток в реализации защиты тела от различных микроорганизмов участвуют лимфатические узлы, которые располагаются по ходу лимфатических сосудов. Дело в том, что лимфа — канализация организма — несет в себе жидкость из разных мест нашего тела. И там часто находятся те самые чужаки. Вот именно для устранения избыточного количества чужеродных микроорганизмов и нужны лимфатические узлы, которые их убивают и инактивируют.
Почему снижается иммунитет
Отчего же люди болеют? Почему вдруг снижаются возможности иммунитета? Как мы уже говорили, иммунитет бывает общий и местный.
Состояние местного зависит от количества энергии в конкретном месте тела. На физическом уровне энергия — это кровь; соответственно, иммунитет зависит и от достаточного кровоснабжения тканей. Стало быть, то, что в определенном участке тела нарушает приток или отток крови, снижает и местный иммунитет. Конкретно это может быть, например, передавливание артерии перенапряженной мышцей или отеком.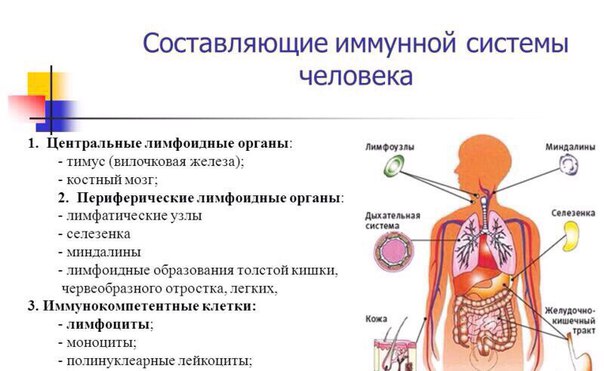
Общий иммунитет зависит от общей энергетики тела и от качества работы тимуса и иммунных клеток. И может снижаться при каких-то нарушениях в их работе.
Очень часто общий иммунитет снижается при стрессе. Реализуется этот процесс в теле через увеличение количества гормона стресса — кортизола. Это один из механизмов проявления известной поговорки: «Все болезни от нервов».
Как работает иммунитет – и почему укреплять его не получается. Иммунные клетки
Где бы мы ни находились, эти твари преследуют нас по пятам. Они сидят на дверных ручках, на компьютерных клавиатурах, на лестничных перилах и, не в последнюю очередь, на нашей коже. Имеются в виду возбудители болезней — бактерии, вирусы и грибки, бoльшая часть которых для нас не опасна благодаря иммунитету — врожденному и приобретенному. Как он работает и есть ли необходимость «повышать иммунитет»?
Стоит поблагодарить иммунную систему за то, что микробы не завоевывают весь наш организм, а некоторые из них даже сосуществуют с нами в некоем симбиозе. Именно иммунитет обеспечивает мирный паритет между нашими потребностями и потребностями этих крошечных попутчиков.
Именно иммунитет обеспечивает мирный паритет между нашими потребностями и потребностями этих крошечных попутчиков.
Если бы армия нашего тела — так без преувеличения можно назвать иммунную систему — не оказывала постоянного сопротивления всем возбудителям болезней, с которыми мы соприкасаемся, мы бы довольно быстро заработали воспаление сердечной мышцы или кучу других болезней.
Однако иммунная система работает не только против чуждых организму нарушителей спокойствия, но и против наших собственных клеток, если те вырождаются или становятся злокачественными. Разумеется, это всячески приветствуется: должен же кто-то в хозяйстве заботиться о порядке. Но иногда наша армия перегибает палку и атакует здоровые структуры — тогда говорят об аутоиммунных заболеваниях.
Различают два вида иммунитета — врожденный и приобретенный. Задача у них одна — защищать организм от распространения в нем возбудителей болезней, атакующих ткани и органы. Но в том, как они это делают, есть существенные отличия.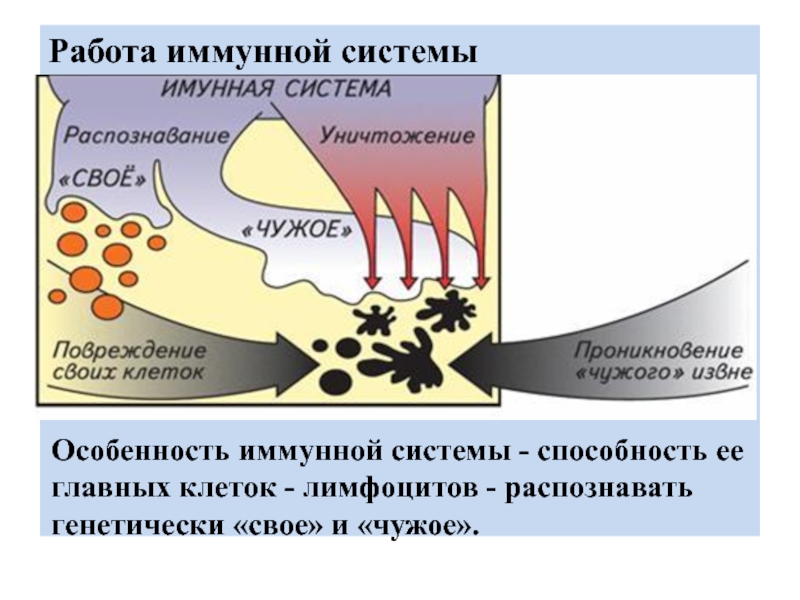
Как работает врожденный иммунитет
Врожденный иммунитет передается нам от матери при рождении, как явствует из самого названия. Пример врожденного иммунитета — кислотная мантия кожи, ведь на кислой поверхности возбудители болезней едва ли выживут. Или лизоцим в слюне — антибактериальный фермент, который встречает непрошеных гостей уже в полости рта.
Скользкие покровы слизистых оболочек, содержащие антибактериальные вещества, — тоже действенный инструмент обороны организма, относящийся к врожденному иммунитету. Кто же без специального снаряжения залезет на стену, покрытую слизью?
Армия иммунных клеток защищает нас изо дня в день. Как и в настоящем войске, в ней есть особые подразделения и воины, специализирующиеся на определенных задачах.
На передней линии фронта сражаются гранулоциты. Как и прочие иммунные клетки, они входят в число белых кровяных телец, или лейкоцитов. От своих красных собратьев последние отличаются тем, что у них есть клеточное ядро, но нет гемоглобина, удерживающего кислород.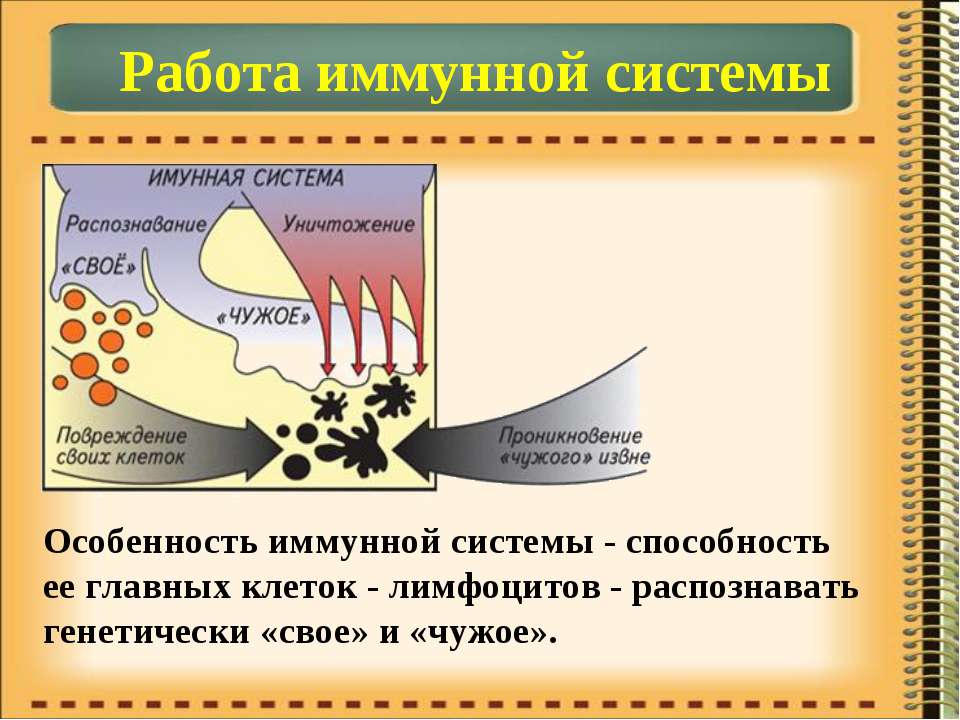
Если во время «контрольного обхода» гранулоциты обнаруживают, что в организме завелись возбудители заболеваний, они тут же оповещают об этом сородичей, которые дружно выстраиваются цепью и беспощадно уничтожают каждого попадающегося на их пути захватчика с помощью отравляющих веществ.
С уцелевшими возбудителями моментальную расправу на месте учиняют огромные пожирающие клетки — макрофаги. В случае инфекции — то есть вторжения болезнетворных микробов в организм — к месту событий их направляют регуляторные белки, и макрофаги, не мешкая, поедают все лишнее, что находят. Если им требуется подкрепление, они в мгновение ока вызывают его с помощью хитроумной системы связи.
Эти механизмы вырабатывались в течение миллионов лет эволюции, но и сейчас они не перестают приспосабливаться к духу времени и к актуальным требованиям. У врожденного иммунитета есть свои «внутренние дознаватели» — их именуют природными клетками-убийцами. Неплохое звание, верно? В противоположность сотрудникам полиции они действуют весьма жестко, этакие Рэмбо.
Задача клеток-убийц — обнаружить и обезвредить больные клетки, тем самым еще на начальной стадии препятствуя их разрастанию в злокачественную опухоль. Для этого они безжалостно вынуждают дегенерировавшие или пораженные болезнетворными возбудителями клетки к самоубийству, что называется апоптозом.
Определенная часть клеток нашего организма постоянно готова мутировать, то есть изменять наследственную информацию. Тогда при следующем делении возникает поколение больных клеток. Если бы клетки-убийцы не распознавали и не обезвреживали их в кратчайшие сроки, это могло бы для нас очень плохо кончиться.
Армия иммунных клеток непрерывно пополняется новобранцами. Она находит их с помощью специальных нейромедиаторов — интерлейкинов, которые, помимо прочего, способствуют тому, чтобы белые кровяные тельца подрастали, созревали, делились и в конце концов активизировались.
Складывается впечатление, будто наша армия непобедима, но оно обманчиво. Да, врожденный иммунитет очень быстро реагирует на незваных гостей, но что касается методов борьбы с ними, то он скорее консерватор.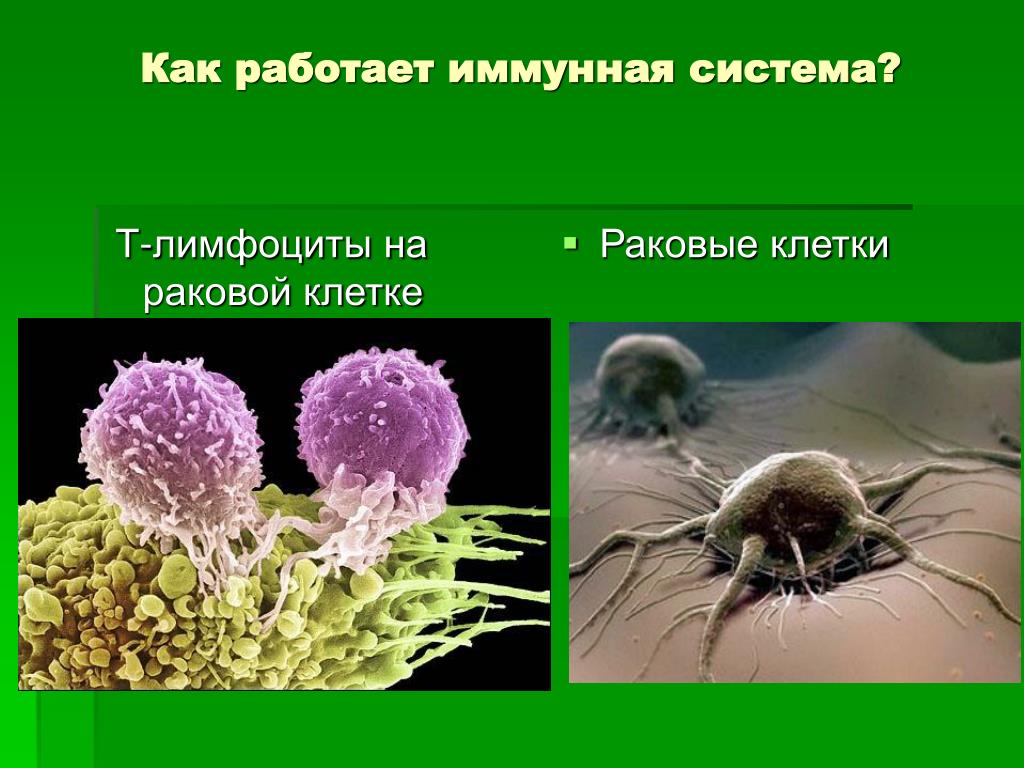 Когда инфекцию вызывает один и тот же возбудитель — неважно, в первый или в сотый раз, — врожденный иммунитет неизменно реагирует одинаково. Если принятые им меры помогают, проблем нет, но если этого оказывается недостаточно — срочно нужна поддержка.
Когда инфекцию вызывает один и тот же возбудитель — неважно, в первый или в сотый раз, — врожденный иммунитет неизменно реагирует одинаково. Если принятые им меры помогают, проблем нет, но если этого оказывается недостаточно — срочно нужна поддержка.
Приобретенный иммунитет: что это такое?
Вот мы и подошли к приобретенному иммунитету. Он значительно изобретательнее врожденного, потому что обладает способностью к обучению. Каждый завоеватель несет на себе характерные знаки отличия, и клетки приобретенного иммунитета могут их распознавать.
Уничтожить опасных микробов — это еще не все: тут клетки ведут себя как индейцы в вестернах — они не просто безжалостно расправляются с противником, а скальпируют его и выставляют скальп на всеобщее обозрение в качестве трофея. Так характерные признаки врага запечатлеваются в памяти других иммунных клеток минимум на пару лет.
Если клетки приобретенного иммунитета хотя бы раз сталкивались с конкретным возбудителем болезни, то потом обязательно об этом вспомнят. Иммунитет вырабатывает так называемые клетки памяти, которые при следующей встрече с тем же возбудителем мгновенно реагируют. Для этого они пользуются услугами В-лимфоцитов и Т-лимфоцитов.
Иммунитет вырабатывает так называемые клетки памяти, которые при следующей встрече с тем же возбудителем мгновенно реагируют. Для этого они пользуются услугами В-лимфоцитов и Т-лимфоцитов.
Задача В-лимфоцитов состоит в целенаправленной защите организма от возбудителей болезней и других чуждых веществ. С этой целью они производят антитела, которые незамедлительно реагируют на типичные признаки известного микроба (вспомним о скальпе), привязываются к нему и тем самым обезвреживают. Как своего рода наручники.
Хотите немного подробнее? Хорошо. Когда неактивные В-лимфоциты, шныряя по крови, встречают чужеродное вещество — так называемый антиген, они не мешкая захватывают его, разделывают и выставляют фрагменты на своей поверхности. Это сигнал для другой формы лимфоцитов, хелперных Т-клеток, немедленно высвободить регуляторные протеины.
«Т» здесь, кстати, обозначает орган, в котором эти клетки созревают, — тимус, или вилочковую железу, расположенную за грудиной. Она важна для нас прежде всего в детстве и в подростковом возрасте. Позднее она меньше используется для созревания Т-клеток и постепенно атрофируется, пока не останется только крохотный и почти неактивный жировик.
Позднее она меньше используется для созревания Т-клеток и постепенно атрофируется, пока не останется только крохотный и почти неактивный жировик.
Теперь протеины Т-клеток активируют В-лимфоциты, те незамедлительно отправляются в лимфатические узлы и селезенку, где стремительно делятся. В процессе они, руководствуясь девизом «больше — лучше», производят различные антитела до тех пор, пока не получится антитело, идеально подходящее для борьбы с поступившим возбудителем болезни. Небольшая часть этих В-лимфоцитов развивается дальше, превращаясь в упомянутые выше клетки памяти, которые надолго запомнят захватчика.
На последнем этапе созревания В-лимфоциты становятся наконец клетками плазмы. У них больше нет охоты размножаться, и с этих пор они производят только те самые антитела, подходящие для борьбы с определенным возбудителем. Почти как пожилой человек, который в солидном возрасте продолжает с удовольствием работать, но детей уже иметь не хочет.
Как видите, иммунная система устроена довольно сложно. Иммунитет должен уметь безошибочно отличать собственные клетки от чужеродных и моментально распознавать возбудителей болезней. Если бы оборонительная армия столь мастерски не сдерживала натиск врагов, которые постоянно угрожают нашим кровеносным сосудам, сердцу, другим органам и тканям, и не обезвреживала их, мы бы долго не прожили.
Иммунитет должен уметь безошибочно отличать собственные клетки от чужеродных и моментально распознавать возбудителей болезней. Если бы оборонительная армия столь мастерски не сдерживала натиск врагов, которые постоянно угрожают нашим кровеносным сосудам, сердцу, другим органам и тканям, и не обезвреживала их, мы бы долго не прожили.
17 фактов об иммунитете, которые надо знать
Факт №1: иммунные клетки распознают «чужих» на генетическом уровне
Выражаясь простым языком, иммунитет – способ защиты организма от генетически чужеродного. Иммунные клетки на генетическом уровне распознают «своих» и «чужих». Как только в организм проникают «непрошенные гости» – бактерии, вирусы, паразиты, грибы, чужеродные ткани (трансплантированные органы), он начинает их атаковать. Главная задача иммунитета – защитить от вторжения. Распознавание «свой-чужой» возможно благодаря наличию на каждой клетке рецепторов – именно с них «считывается» информация.
Иммунная система также защищает от онкологии и аутоиммунных патологий. Если клетка нашего организма мутировала, ведет себя агрессивно или просто постарела и не выполняет свою функцию, рецептор у нее либо изменяется, либо исчезает с поверхности. Иммунитет понимает: с ней что-то не так. И поглощает ее (фагоцитоз) или запускает в ней процесс саморазрушения (апоптоз).
Если клетка нашего организма мутировала, ведет себя агрессивно или просто постарела и не выполняет свою функцию, рецептор у нее либо изменяется, либо исчезает с поверхности. Иммунитет понимает: с ней что-то не так. И поглощает ее (фагоцитоз) или запускает в ней процесс саморазрушения (апоптоз).
Факт №2: недостаток сна снижает иммунитет
Работа иммунной системы напрямую зависит от режима «сон-бодрствование» и питания. Эти два фактора очень важны. Объясняется их значимость просто: для нормального функционирования иммунных клеток (как и любых других) нужен «строительный материал», который поступает вместе с пищей. Их обновление происходит во время сна, а если его недостаточно, «фабрика» дает сбой. Важен именно ночной сон – образование клеток в костном мозге происходит в этот период.
Самое распространенное изменение при неправильной работе иммунной системы – снижение количества клеток, что приводит к более частым и тяжелым инфекционным заболеваниям.
Факт №3: важно знать свой иммунный статус
Иммунный статус – количественная и качественная оценка основных факторов иммунитета.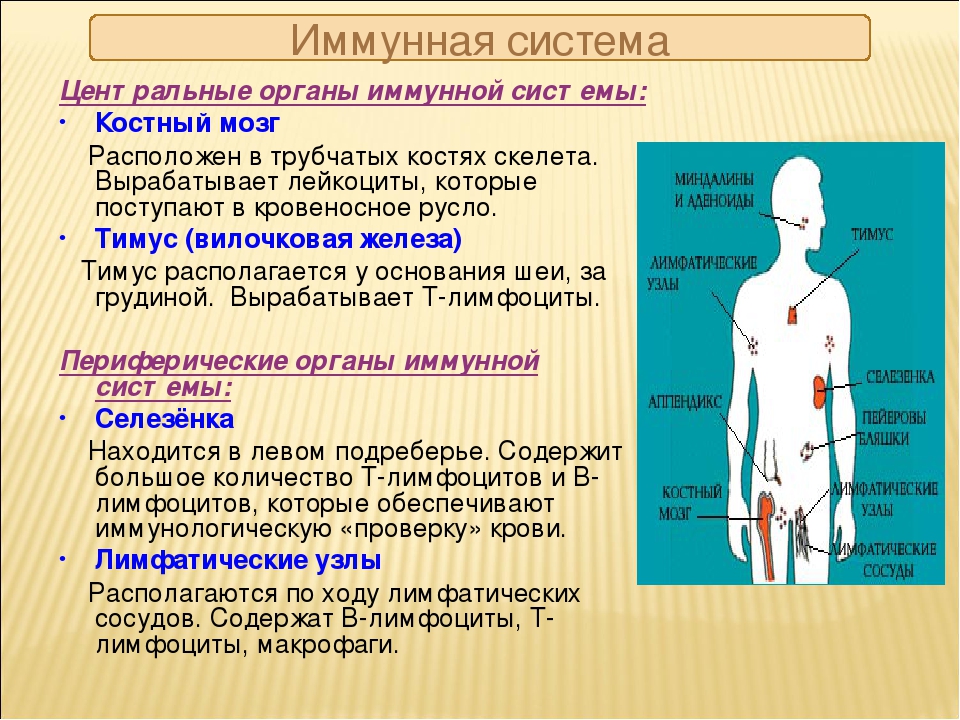 Данный анализ позволяет: узнать количество клеток иммунной системы (лейкоцитов и лимфоцитов) и их соотношение, оценить фагоцитарную активность лейкоцитов (способность клеток поглощать бактерии) и их способность синтезировать антитела. Оценка иммунного статуса крайне важна для аллергиков, часто и тяжело болеющих людей, страдающих аутоиммунными заболеваниями, пациентов с онкопатологиями, а также при выявлении патологий при беременности.
Данный анализ позволяет: узнать количество клеток иммунной системы (лейкоцитов и лимфоцитов) и их соотношение, оценить фагоцитарную активность лейкоцитов (способность клеток поглощать бактерии) и их способность синтезировать антитела. Оценка иммунного статуса крайне важна для аллергиков, часто и тяжело болеющих людей, страдающих аутоиммунными заболеваниями, пациентов с онкопатологиями, а также при выявлении патологий при беременности.
Назначить и расшифровать анализ может только врач. По его результатам определяется группа патологического состояния: без существенных изменений иммунного статуса, с недостаточностью иммунной системы (иммунодефициты), с повышенной активацией иммунных клеток (аутоиммунные заболевания, аллергия, воспаление).
Анализ на иммунный статус дает возможность диагностировать конкретное заболевание, определить его патогенез и причину, подобрать алгоритм индивидуальной иммунотерапии и проконтролировать ее эффективность.
Факт №4: иммунные клетки могут начать работать «против» нашего организма
Это происходит при аутоиммунных заболеваниях. В таких случаях они выступают против собственных тканей или органов, поражая их также, как и генетически чужеродные объекты. Специалисты пока не научились на 100% управлять иммунными клетками. Частично сделать это можно с помощью вакцинации – сегодня такое направление активно развивается в терапии онкологических заболеваний. Вакцины «тренируют» клетки иммунной системы бороться с опухолями. С помощью факторов роста можно простимулировать увеличение количества тех или иных клеток. Вот на таких уровнях мы пока научились вмешиваться в иммунитет. Но для проведения таких манипуляций должны быть серьезные показания.
В таких случаях они выступают против собственных тканей или органов, поражая их также, как и генетически чужеродные объекты. Специалисты пока не научились на 100% управлять иммунными клетками. Частично сделать это можно с помощью вакцинации – сегодня такое направление активно развивается в терапии онкологических заболеваний. Вакцины «тренируют» клетки иммунной системы бороться с опухолями. С помощью факторов роста можно простимулировать увеличение количества тех или иных клеток. Вот на таких уровнях мы пока научились вмешиваться в иммунитет. Но для проведения таких манипуляций должны быть серьезные показания.
Факт №5: некоторые иммуномодуляторы действительно работают
Иммуномодуляторы – препараты, стимулирующие функцию иммунитета. Они действительно существуют. Но те из них, которые работают по-настоящему, требуют серьезных показаний, могут иметь побочные эффекты и противопоказания. Их применяют в стационарах.
Иммуномодуляторы, активно продвигающиеся в нашей стране и отпускающиеся без рецепта, не применяются в Европе и США – серьезной доказательной базы их эффективности нет.
Не могу на 100% утверждать, что они неэффективны. В моей практике есть немало случаев, когда большое количество иммуномодуляторов и комбинация нескольких препаратов приводили к «манифесту» аллергических реакций и развитию аутоиммунных заболеваний. Я их не использую по двум причинам: не доказанная эффективность, риск возникновения осложнений.
Факт №6: вакцинация способствует формированию иммунологической памяти
Последние несколько лет на тему прививок ведутся ожесточенные споры. Я – сторонник вакцинации. Она формирует иммунологическую память. Этот процесс хорошо изучен с точки зрения доказательной медицины. Я и все члены моей семьи вакцинированы. Мы делаем это каждые 10 лет. Вопрос в том, что проводить вакцинацию нужно с умом, учитывая противопоказания, наличие аллергии и другие индивидуальные особенности.
Факт №7: аллергия – гиперреакция иммунной системы
Существует мнение, что у каждого есть свой аллерген. Я так не считаю. Действительно аллергия – очень распространенное явление. Есть несколько теорий, почему от нее стали страдать гораздо чаще. Суть самой популярной заключается в следующем. Несколько веков назад «процветали» паразитарные инфекции, и иммунная система была направлена на борьбу с ними. Сейчас условия жизни совсем другие: мы хорошо питаемся, живем в чистых помещениях, хорошо обрабатываем пищу.
Есть несколько теорий, почему от нее стали страдать гораздо чаще. Суть самой популярной заключается в следующем. Несколько веков назад «процветали» паразитарные инфекции, и иммунная система была направлена на борьбу с ними. Сейчас условия жизни совсем другие: мы хорошо питаемся, живем в чистых помещениях, хорошо обрабатываем пищу.
Наш организм практически не встречается с паразитами, и все силы иммунной системы направляются на борьбу с другими объектами, распознающимися ею, как чужеродные.
В доказательство этой теории приводится статистика: в неразвитых странах с низким уровнем жизни аллергия встречается гораздо реже, чем у жителей Европы.
Факт №8: грудное вскармливание способствует формированию иммунитета
Этот факт давно доказан и обжалованию не подлежит. Вместе с грудным молоком мама передает малышу антитела – способствует защите ребенка в первые месяцы жизни (его собственная иммунная функция низкая). Кроме того, у грудного молока прекрасный состав – благоприятно влияет на функцию кишечника. Если он «заселен» нормальной микробиотой и хорошо работает, иммунная защита функционирует отлично. Специалисты рекомендуют при возможности кормить ребенка хотя бы до года.
Если он «заселен» нормальной микробиотой и хорошо работает, иммунная защита функционирует отлично. Специалисты рекомендуют при возможности кормить ребенка хотя бы до года.
Факт №9: иммунитет напрямую связан с работой ЖКТ
Функция ЖКТ связана с иммунной системой по нескольким причинам. Во-первых, в кишечнике широко представлена лимфоидная ткань, в которой находятся иммунные клетки.
Во-вторых, там много слизистых оболочек – иммунные клетки активно взаимодействуют именно с ними. В-третьих, в кишечнике находится много микроорганизмов как полезных, так и не очень. Баланс флоры оказывает серьезное влияние на иммунитет. Если переваривание в кишечнике происходит неполноценно, это может стать причиной аллергии и других иммунопатологий.
Факт №10: антибиотики могут влиять на иммунитет
Некоторые виды антибиотиков могут подавлять рост и дифференцировку клеток иммунной системы. В общем анализе крови это проявляется в виде снижения лейкоцитов, лимфоцитов или нейтрофилов. После отмены препарата их количество восстанавливается.
После отмены препарата их количество восстанавливается.
Нельзя использовать антибиотики без строгих показаний – так мы лишаем иммунную систему возможности самостоятельно бороться с инфекцией и формировать иммунологическую память.
Не стоит забывать и о резистентности микроорганизмов – сегодня это серьезная проблема.
Факт №11: понять, что у тебя снижен иммунный статус – просто
Мы знаем, с чем борется иммунная система, поэтому определить снижение иммунного статуса просто. Частые инфекционные заболевания – главный признак того, что «оборона» дала сбой. И это не просто ОРВИ. При снижении иммунитета, вирусная инфекция часто заканчивается бактериальными осложнениями.
Факт №12: реально работающий способ самостоятельно поднять иммунитет – правильный образ жизни
Хочется пошутить, что реальный способ поднять иммунитет – поехать в отпуск. На самом деле, для этого нужно вести правильный образ жизни. Если человек соблюдает режим и дает иммунной системе восстанавливаться и нормально функционировать, проблем нет.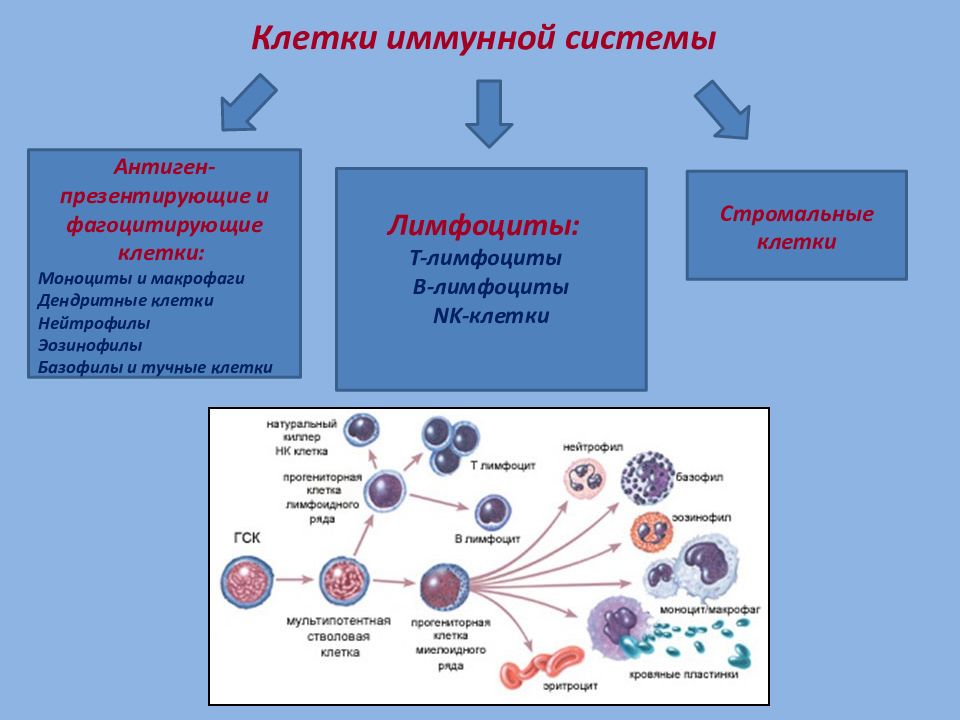 Другое дело, если есть какая-то генетическая «поломка» или иммунопатология. Тут уже без препаратов и помощи специалиста не обойтись.
Другое дело, если есть какая-то генетическая «поломка» или иммунопатология. Тут уже без препаратов и помощи специалиста не обойтись.
Факт №13: тяжелый комбинированный иммунодефицит лечится
Тяжелый комбинированный иммунодефицит – генетическое заболевание, относящееся к первичным иммунодефицитам. Оно характеризуется полной или частичной неспособностью в достаточном количестве образовывать лимфоциты. Когда нет защитных антител, ребенок тяжело болеет инфекционными заболеваниями. Единственный способ лечения, показывающий хорошие результаты, – трансплантация гемопоэтических стволовых клеток.
Факт №14: аутоиммунным заболеваниям чаще всего подвержены женщины
Аутоиммунные заболевания – состояния, когда агрессивные к собственным тканям клетки иммунной системы не были отбракованы костным мозгом или тимусом и поступили в периферическое кровообращение. Они моментально начинают атаковать! «Мишенью» может стать все, что угодно: соединительная ткань, щитовидная железа. Лечатся такие заболевания препаратами-иммуносупрессорами, подавляющими функцию иммунной системы.
Лечатся такие заболевания препаратами-иммуносупрессорами, подавляющими функцию иммунной системы.
Достаточно часто встречающееся явление во время терапии – вирусные инфекции. Увы, но другого лечения пока не придумали.
Некоторым аутоиммунным заболеваниям чаще всего подвержены женщины. Это связано с тем, что женские половые гормоны увеличивают количество антител, в том числе и аутоагрессивных.
Провоцирующие факторы: подростковый период и беременность.
Факт №15: для поддержания иммунитета нужен витамин D
В последнее время появилось много исследований витамина D – он гормоноподобный и принимает участие во многих процессах, в том числе и в работе иммунной системы, активируя ее. Способствует адекватному иммунному ответу.
Факт №16: есть врожденный и приобретенный иммунитет
Эволюционно врожденный иммунитет был представлен гораздо раньше. Приобретенный появляется позже. У них разные клетки и белковые факторы. Врожденный иммунитет – первая линия защиты. На уровне слизистых в первые часы после попадания инфекции активируются нейтрофилы, эозинофилы, базофилы, макрофаги, белки острой фазы, теплового шока, работающие здесь и сейчас. У врожденного иммунитета нет памяти.
На уровне слизистых в первые часы после попадания инфекции активируются нейтрофилы, эозинофилы, базофилы, макрофаги, белки острой фазы, теплового шока, работающие здесь и сейчас. У врожденного иммунитета нет памяти.
Приобретенный иммунитет у нас разный – зависит от того, кто с какими инфекциями сталкивались. Это очень разумная система, представленная Т и В-лимфоцитами. Белковый фактор приобретенного иммунитета – антитела. У него, в отличие от врожденного, есть иммунологическая память. Столкнувшись с инфекцией однажды, в следующий раз при попадании ее в организм, иммунный ответ будет реализован в первые сутки, а не через 5-7 дней.
Факт №17: беременность зависит от иммунитета
Более того, она возможна благодаря иммунитету! Беременность – сложный процесс, во время которого иммунная система играет важную роль. Интересный факт: ребенок – чужеродный объект для организма матери, но иммунные клетки не трогают его, а наоборот – окружают плод защитными антителами. Они не допускают к плоду агрессивные иммунные клетки – Т-киллеры – через плаценту. Параллельно запускается процесс снижения числа агрессивных защитных клеток, чтобы они не смогли «прорвать оборону». Именно поэтому беременность сопровождается легким иммунодефицитом, который длится до 38-40 недели. Дальше антитела начинают разрушаться, агрессивных защитных клеток станет больше, они начнут атаковать плаценту – это начало родов.
Параллельно запускается процесс снижения числа агрессивных защитных клеток, чтобы они не смогли «прорвать оборону». Именно поэтому беременность сопровождается легким иммунодефицитом, который длится до 38-40 недели. Дальше антитела начинают разрушаться, агрессивных защитных клеток станет больше, они начнут атаковать плаценту – это начало родов.
Иммунитет: что подтачивает силы организма и как помочь иммунной системе | Лекарственный справочник | Здоровье
Наша справка
Иммунитет – это способность организма сопротивляться внешним негативным воздействиям, обеспечивая себе защиту от всех чужеродных веществ, в том числе от инфекций.
В систему «обороны» от чуждых нам микробов и бактерий входят костный мозг, вилочковая железа, селезенка, лимфатические узлы, лимфоидные бляшки кишечника… Все они связаны между собой сетью кровеносных и лимфатических сосудов.
Важно
Вирусы, бактерии и прочие возбудители инфекций являются чужеродными для нас агентами – антигенами. Как только антигены попадают в организм, иммунная система вырабатывает антитела, которые вступают в борьбу с антигенами и их обезвреживают.
Как только антигены попадают в организм, иммунная система вырабатывает антитела, которые вступают в борьбу с антигенами и их обезвреживают.
При хорошем иммунитете организм успешно защищается, и человек или вообще не заболевает, или быстро справляется с болезнью. При сниженном иммунитете организм отбивается от инфекции вяло, болезнь берет верх, и человек болеет долго.
Имейте в виду
Сниженный иммунитет может достаться по наследству. У определенного процента людей есть врожденные формы иммунодефицита. Их организм вырабатывает мало иммуноглобулинов класса А, которые в норме в большом количестве находятся на слизистых оболочках носа и рта, в секрете верхних дыхательных путей, в кишечном тракте. Иммуноглобулин А – первый заслон для инфекции, проникающей в наш организм из окружающей среды. Люди с такой недостаточностью часто болеют.
Но у большинства людей снижение иммунитета – это явление временное, обратимое, такого можно избежать самым простым способом – правильным образом жизни. Иммунную систему подрывают стрессы, недосыпание, плохая экология, неправильное питание.
Иммунную систему подрывают стрессы, недосыпание, плохая экология, неправильное питание.
Кстати
Для построения иммуноглобулинов организму необходим полноценный белок, поэтому, если вы хотите иметь хороший иммунитет, в рационе обязательно должны быть мясо и рыба. Особенно полезны крольчатина и телятина.
Нерафинированные растительные масла снабжают организм полиненасыщенными жирными кислотами, которые необходимы для хорошей работы иммунной системы.
Витамины из фруктов, овощей, свежевыжатых соков улучшают обменные процессы и тоже обеспечивают хороший иммунитет. Во время болезни надо принимать поливитаминные препараты, так как потребность в витаминах в это время увеличивается.
На заметку
При снижении иммунитета человек заболевает, а после болезни иммунитет снижается еще больше. Как разорвать порочный круг? Чтобы восстановить иммунитет, надо:
- больше спать;
- есть не реже 4 раз в сутки;
- отдавать предпочтение здоровому питанию и принимать витаминные препараты;
- много гулять на свежем воздухе.

Любопытно
Иммунная система ребенка созревает постепенно, она не готова сразу работать так, как работает система взрослого человека. Новорожденные, например, очень слабо вырабатывают некоторые антитела. Их защищают материнские антитела, которые поступили к ним когда-то через плаценту, но это наследство быстро расходуется.
Если мама кормит младенца грудью, с ее молоком он получает еще какую-то часть антител-иммуноглобулинов класса А, которые защищают от инфекций кишечник. Вот почему врачи советуют мамам не бросать кормление летом, когда в жару мы более уязвимы для кишечных инфекций.
Иммуноглобулины класса G дети начинают вырабатывать в полной мере только к двум годам. А целиком иммунная система созревает годам к пяти. Лишь к этому возрасту дети начинают реагировать на вирусы и бактерии так же, как взрослые.
Как укрепить иммунитет ребенка и не навредить его здоровью →
К врачу!
Признаком ослабленного иммунитета являются частые простудные заболевания, затяжные течения банальной простуды, часто повторяющийся герпес, фурункулез, грибковые заболевания. Однако, прежде чем направлять к иммунологу, врач, лечащий основное заболевание, должен быть уверен, что он сделал все возможное. Порой дело вовсе не в плохой работе иммунной системы, а в неэффективном лечении, которое приводит к хронизации заболевания.
Однако, прежде чем направлять к иммунологу, врач, лечащий основное заболевание, должен быть уверен, что он сделал все возможное. Порой дело вовсе не в плохой работе иммунной системы, а в неэффективном лечении, которое приводит к хронизации заболевания.
В любом случае иммунолог назначит вам специальный анализ – иммунограмму. Его зачастую повторяют несколько раз, чтобы убедиться, что в показателях иммунитета действительно есть стойкое, а не сиюминутное изменение.
Иммунограмма, что это →
В этом случае на усмотрение доктора может быть назначен препарат из группы иммуномодуляторов. Самостоятельно принимать такие препараты нельзя. Дело в том, что какие-то из этих лекарств повышают активность лимфоцитов, которые убивают клетки, зараженные вирусами, а какие-то – повышают активность фагоцитов, которые пожирают бактерии, попавшие на слизистые оболочки…
Есть препараты, которые можно принимать в самый разгар болезни, а есть, которые только к концу, когда кризис миновал. Есть также иммуномодуляторы, которые принимают, только когда болезнь уже отступила. В общем, без помощи врача препарат вам не выбрать.
Есть также иммуномодуляторы, которые принимают, только когда болезнь уже отступила. В общем, без помощи врача препарат вам не выбрать.
Если снижение иммунитета временное, организм рекомендуется поддерживать при помощи витаминных комплексов и БАД. Но и в этом случае настоятельно рекомендуется предварительная консультация врача.
Помните, самолечение опасно для жизни, за консультацией по поводу применения любых лекарственных препаратов обращайтесь к врачу.
Печатную версию справочника покупайте в киосках вашего города или закажите в редакции по тел +7 (495) 646-57-57 или по электронной почте [email protected] с пометкой ЛС (в письме укажите ФИО, почтовый адрес и телефон).
Иммунная система — Википедия
Имму́нная систе́ма — система органов, существующая у позвоночных животных и объединяющая органы и ткани, которые защищают организм от заболеваний, идентифицируя и уничтожая опухолевые клетки и патогены. Иммунная система распознаёт множество разнообразных возбудителей — от вирусов до паразитических червей — и отличает их от биомолекул собственных клеток. Распознавание возбудителей усложняется их адаптацией и эволюционным развитием новых методов успешного инфицирования организма-хозяина.
Распознавание возбудителей усложняется их адаптацией и эволюционным развитием новых методов успешного инфицирования организма-хозяина.
Конечной целью иммунной системы является уничтожение чужеродного агента, которым может оказаться болезнетворный микроорганизм, инородное тело, ядовитое вещество или переродившаяся клетка самого организма. Этим достигается биологическая индивидуальность организма.
В иммунной системе развитых организмов существует множество способов обнаружения и удаления чужеродных агентов: этот процесс называется иммунным ответом. Все формы иммунного ответа можно разделить на врождённые и приобретённые реакции. Основное различие между ними в том, что приобретённый иммунитет высокоспецифичен по отношению к конкретному типу антигенов и позволяет быстрее и эффективнее уничтожать их при повторном столкновении. Антигенами называют молекулы, воспринимаемые как чужеродные агенты и вызывающие специфические реакции организма. Например, у перенёсших ветрянку, корь, дифтерию людей часто возникает пожизненный иммунитет к этим заболеваниям. В случае аутоиммунных реакций антигеном может служить молекула, произведённая самим организмом.
В случае аутоиммунных реакций антигеном может служить молекула, произведённая самим организмом.
Некоторые вещества, вырабатываемые иммунной системой, активно влияют на работу центральной нервной системы[1].
Эволюция иммунных механизмов
Защитные механизмы, направленные на распознавание и обезвреживание возбудителей, существуют даже у прокариот: например, ряд бактерий обладает ферментными системами, которые предотвращают заражение бактерии вирусом. Другие базовые иммунные механизмы развились в процессе эволюции у древних эукариот и сохранились у их современных потомков, в том числе у растений и животных. К таким механизмам относятся антимикробные пептиды, дефензины, рецепторы распознавания специфических последовательностей и система комплемента.
Короткие фрагменты РНК, которые избирательно синтезируются только в клетках половых органов (открыты в 2000-х годах), способны подавлять активность транспозонов (могут вызывать мутации при перемещении по геному) и передаются по материнской линии потомству.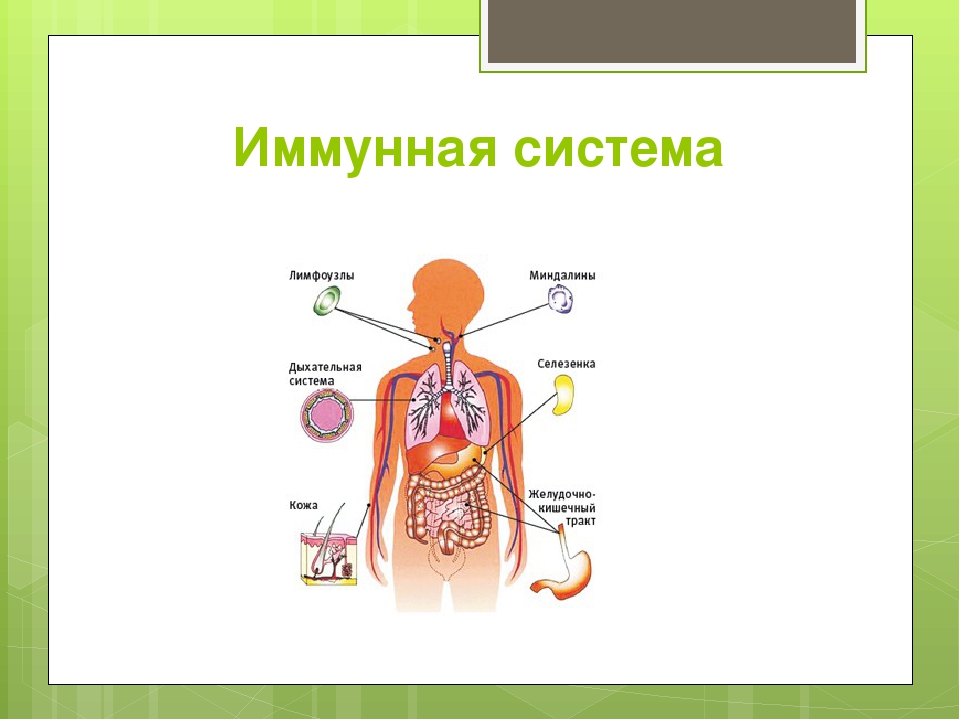 Потомство дрозофил получает в комплекте с ДНК такой молекулярный переключатель, который подавляет активность вредных генетических элементов[2].
Потомство дрозофил получает в комплекте с ДНК такой молекулярный переключатель, который подавляет активность вредных генетических элементов[2].
Более сложные механизмы развились относительно недавно, в ходе эволюции позвоночных[3].
Иммунная система у позвоночных (например, у человека) состоит из множества видов белков, клеток, органов и тканей, взаимодействия между которыми сложны и динамичны. Благодаря такой усовершенствованной иммунной реакции система позвоночных со временем приспосабливается, и распознавание конкретных чужеродных веществ или клеток становится более эффективным. В процессе адаптации создаётся иммунологическая память, которая позволяет ещё более эффективно защищать организм при следующей встрече с этими возбудителями. Такой вид приобретённого иммунитета лежит в основе методик вакцинации.
У теплокровных сохранение гомеостаза уже обеспечивается двумя иммунными механизмами (разными по времени эволюционного появления): температура (общее воздействие) и антитела (избирательное воздействие).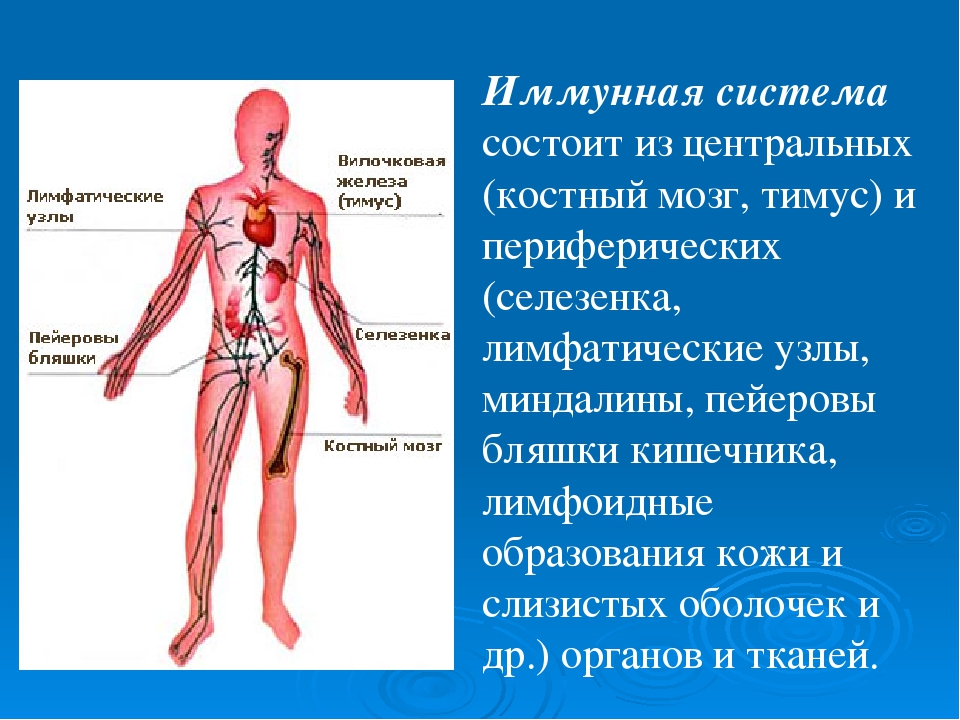
Морфология иммунной системы
Иммунная система человека и других позвоночных представляет из себя комплекс органов и клеток, способных выполнять иммунологические функции. Прежде всего иммунный ответ осуществляют лейкоциты. Бо́льшая часть клеток иммунной системы происходит из кроветворных тканей. У взрослых людей развитие этих клеток начинается в костном мозге. Лишь T-лимфоциты дифференцируются внутри тимуса (вилочковой железы). Зрелые клетки расселяются в лимфоидных органах и на границах с окружающей средой, около кожи или на слизистых оболочках.
Организм животных, обладающих механизмами приобретённого иммунитета, производит множество разновидностей специфических иммунных клеток, каждая из которых отвечает за какой-то определённый антиген. Наличие большого количества разновидностей иммунных клеток необходимо для того, чтобы отражать атаки микроорганизмов, способных мутировать и изменять свой антигенный состав. Значительная часть этих клеток завершает свой жизненный цикл, так и не приняв участие в защите организма, например, не встретив подходящих антигенов.
Многоэтапность иммунной защиты
Иммунная система защищает организм от инфекции в несколько этапов, при этом с каждым этапом повышается специфичность защиты. Самая простая линия защиты представляет собой физические барьеры, которые предотвращают попадание возбудителей инфекции — бактерий и вирусов — в организм. Если возбудитель проникает через эти барьеры, промежуточную неспецифическую реакцию на него осуществляет врождённая иммунная система. Врождённая иммунная система обнаруживается у всех растений и животных[4]. На случай, когда возбудители успешно преодолевают воздействие врождённых иммунных механизмов, у позвоночных существует третий уровень защиты — приобретённая иммунная защита. Эта часть иммунной системы адаптирует свою реакцию во время инфекционного процесса, чтобы улучшить распознавание чужеродного биологического материала. Такой улучшенный ответ сохраняется после уничтожения возбудителя в виде иммунологической памяти. Она позволяет механизмам приобретённого иммунитета развивать более быструю и более сильную ответную реакцию при каждом появлении такого же возбудителя[5].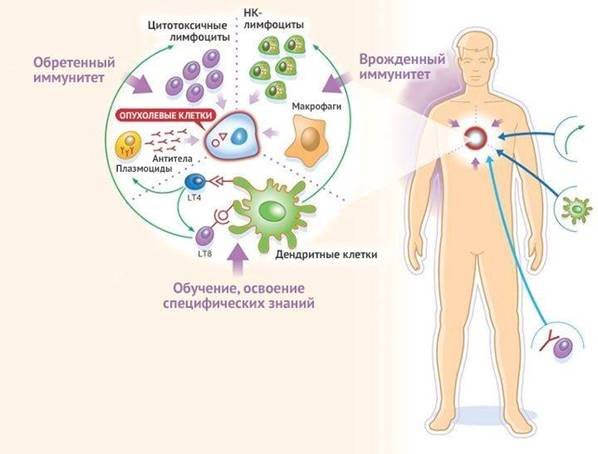
| Врождённый иммунитет | Приобретённый иммунитет |
|---|---|
| Реакция неспецифична | Специфическая реакция, привязанная к чужеродному антигену |
| Столкновение с инфекцией приводит к немедленной максимальной реакции | Между контактом с инфекцией и максимальным ответом латентный период |
| Клеточные и гуморальные звенья | Клеточные и гуморальные звенья |
| Не обладает иммунологической памятью | Столкновение с чужеродным агентом приводит к иммунологической памяти |
| Обнаруживается практически у всех форм жизни | Обнаружена только у некоторых организмов |
Как врождённый, так и приобретённый иммунитет, зависят от способности иммунной системы отличать свои молекулы от чужих. В иммунологии под своими молекулами понимают те компоненты организма, которые иммунная система способна отличить от чужеродных[6].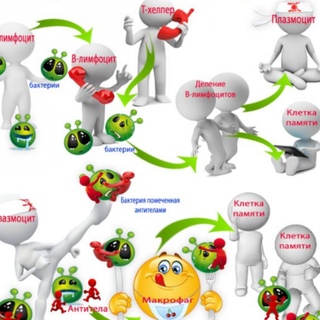 Напротив, чужими называют молекулы, которые распознаются как чужеродные. Один из классов «чужих» молекул называют антигенами (термин произошёл от сокращения англ. antibody generators — «вызывающие антитела») и определяют как вещества, связываемые со специфическими иммунными рецепторами и вызывающие иммунный ответ[7].
Напротив, чужими называют молекулы, которые распознаются как чужеродные. Один из классов «чужих» молекул называют антигенами (термин произошёл от сокращения англ. antibody generators — «вызывающие антитела») и определяют как вещества, связываемые со специфическими иммунными рецепторами и вызывающие иммунный ответ[7].
Поверхностные барьеры
Организмы защищены от инфекций рядом механических, химических и биологических барьеров. Примерами механических барьеров, служащих первым этапом защиты от инфекции, могут служить восковое покрытие многих листьев растений, экзоскелет членистоногих, скорлупа яиц и кожа[8]. Однако организм не может быть полностью отграничен от внешней среды, поэтому существуют и другие системы, защищающие внешние сообщения организма — дыхательную, пищеварительную и мочеполовую системы. Эти системы можно разделить на постоянно действующие и включающиеся в ответ на вторжение. Пример постоянно действующей системы — крохотные волоски на стенках трахеи, называемые ресничками, которые совершают быстрые движения, направленные вверх, удаляя частицы пыли, пыльцу растений или другие мелкие инородные объекты, чтобы они не могли попасть в лёгкие.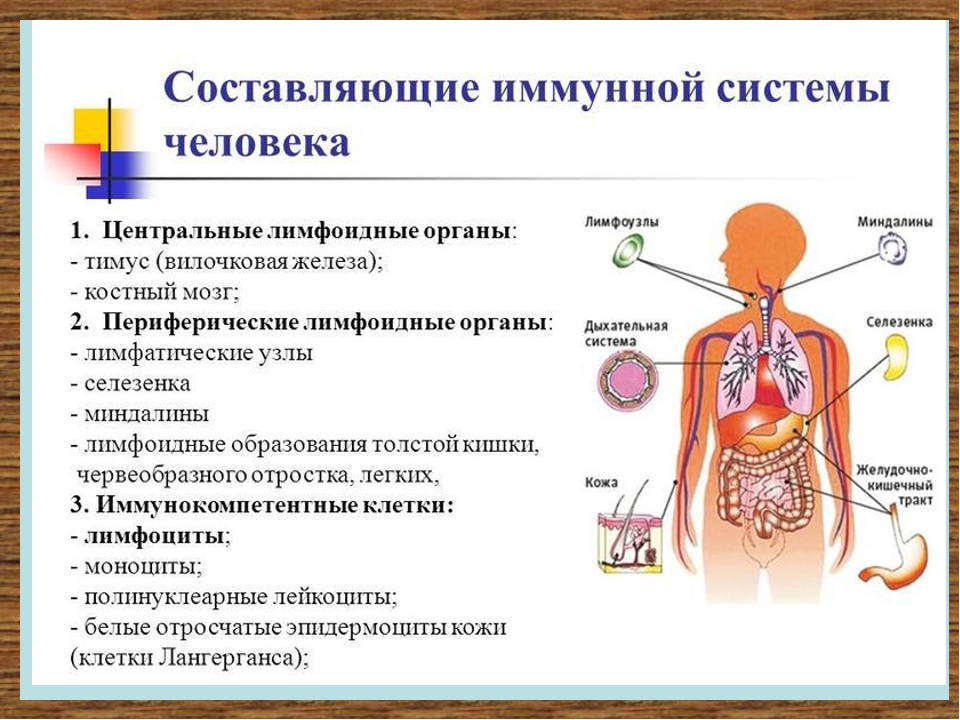 Аналогичным образом, изгнание микроорганизмов осуществляется при помощи промывного действия слёз и мочи. Слизь, секретируемая в дыхательную и пищеварительную систему, служит для связывания и обездвиживания микроорганизмов[9].
Аналогичным образом, изгнание микроорганизмов осуществляется при помощи промывного действия слёз и мочи. Слизь, секретируемая в дыхательную и пищеварительную систему, служит для связывания и обездвиживания микроорганизмов[9].
Если постоянно действующих механизмов оказывается недостаточно, то включаются «аварийные» механизмы очистки организма, такие как кашель, чихание, рвота и диарея.
Помимо этого, существуют химические защитные барьеры. Кожа и дыхательные пути выделяют антимикробные пептиды, например бета-дефензины[10]. Такие ферменты, как лизоцим и фосфолипаза A, содержатся в слюне, слезах и грудном молоке, и также обладают антимикробным действием[11][12]. Выделения из влагалища служат химическим барьером после начала менструаций, когда они становятся слабокислыми. Сперма содержит дефензины и цинк для уничтожения возбудителей[13][14]. В желудке соляная кислота и протеолитические ферменты служат мощными химическими защитными факторами в отношении попавших с пищей микроорганизмов.
В мочеполовом и желудочно-кишечном трактах существуют биологические барьеры, представленные дружественными микроорганизмами — комменсалами. Приспособившаяся к обитанию в этих условиях неболезнетворная микрофлора конкурирует с патогенными бактериями за пищу и пространство, и, в ряде случаев, изменяя условия обитания, в частности pH или содержание железа[15]. Это снижает вероятность достижения болезнетворными микробами достаточных для возникновения патологии количеств. Поскольку большая часть антибиотиков неспецифически воздействует на бактерии, и, зачастую, не затрагивает грибы, антибактериальная терапия может приводить к чрезмерному «разрастанию» грибковых микроорганизмов, что вызывает такие заболевания, как молочница (кандидоз)[16]. Есть убедительные сведения, подтверждающие, что введение пробиотической флоры, например чистых культур лактобацилл, которые содержатся, в частности, в йогурте и других кисломолочных продуктах, помогает восстановить нужный баланс микробных популяций при кишечных инфекциях у детей. Также существуют обнадёживающие данные в исследованиях применения пробиотиков при бактериальном гастроэнтерите, воспалительных заболеваниях кишечника, инфекциях мочевыводящих путей и послеоперационных инфекциях[17][18][19].
Врождённый иммунитет
Если микроорганизму удаётся проникнуть через первичные барьеры, он сталкивается с клетками и механизмами системы врождённого иммунитета. Врождённая иммунная защита неспецифична, то есть её звенья распознают и реагируют на чужеродные тела независимо от их особенностей[8]. Эта система не создаёт длительной невосприимчивости к конкретной инфекции. Система врождённого иммунитета осуществляет основную защиту у большинства живых многоклеточных организмов[4].
Гуморальные и биохимические факторы
Воспаление
Воспаление — одна из наиболее ранних реакций иммунной системы на инфекцию[20]. К симптомам воспаления относятся покраснение и отёк, что свидетельствует об усилении притока крови к вовлечённым в процесс тканям. В развитии воспалительной реакции важную роль играют эйкозаноиды и цитокины, высвобождаемые повреждёнными или инфицированными клетками. К эйкозаноидам относятся простагландины, вызывающие повышение температуры и расширение кровеносных сосудов, и лейкотриены, которые привлекают определённые виды белых кровяных телец (лейкоцитов)[21][22]. К наиболее распространённым цитокинам относятся интерлейкины, отвечающие за взаимодействие между лейкоцитами, хемокины, стимулирующие хемотаксис, и интерфероны, обладающие противовирусными свойствами, в частности способностью угнетать синтез белка в клетках макроорганизма[23]. Кроме того, могут играть роль выделяемые факторы роста и цитотоксические факторы. Эти цитокины и другие биоорганические соединения привлекают клетки иммунной системы к очагу инфекции и способствуют заживлению повреждённых тканей путём уничтожения возбудителей[24].
Система комплемента
Система комплемента представляет собой биохимический каскад, который атакует мембрану чужеродных клеток. В него входят более 20 различных белков. Комплемент является основным гуморальным компонентом врождённого иммунного ответа[25][26]. Система комплемента имеется у многих видов, в том числе у ряда беспозвоночных[27].
У человека этот механизм активируется путём связывания белков комплемента с углеводами на поверхности микробных клеток, либо путём связывания комплемента с антителами, которые прикрепились к этим микробам (второй способ отражает взаимосвязь механизмов врождённого и приобретённого иммунитета). Сигнал в виде прикреплённого к мембране клетки комплемента запускает быстрые реакции, направленные на разрушение такой клетки[28]. Скорость этих реакций обусловлена усилением, возникающим вследствие последовательной протеолитической активации молекул комплемента, которые сами по себе являются протеазами. После того, как белки комплемента прикрепились к микроорганизму, запускается их протеолитическое действие, что, в свою очередь, активирует другие протеазы системы комплемента, и так далее. Таким образом возникает каскадная реакция, усиливающая исходный сигнал при помощи управляемой положительной обратной связи[29]. В результате каскада образуются пептиды, привлекающие иммунные клетки, усиливающие проницаемость сосудов и опсонизирующие поверхность клетки, помечая её «к уничтожению». Кроме того, отложение факторов комплемента на поверхности клетки может напрямую разрушать её посредством разрушения цитоплазматической мембраны[25].
Существуют три пути активации комплемента: классический, лектиновый и альтернативный. За неспецифическую реакцию врождённого иммунитета без участия антител отвечают лектиновый и альтернативный пути активации комплемента. У позвоночных комплемент также участвует в реакциях специфического иммунитета, при этом его активация обычно происходит по классическому пути[7].
Клеточные факторы врождённого иммунитета
Лейкоциты (белые кровяные тельца) часто ведут себя подобно независимым одноклеточным организмам, и представляют собой главное клеточное звено врождённого (гранулоциты и макрофаги) и приобретённого (в первую очередь лимфоциты, но их действия тесно связаны с клетками врождённой системы) иммунитета. К клеткам, воплощающим неспецифическую («врождённую») иммунную реакцию, относятся фагоциты (макрофаги, нейтрофилы и дендритные клетки), тучные клетки, базофилы, эозинофилы и естественные киллеры. Эти клетки распознают и уничтожают чужеродные частицы путём фагоцитоза (заглатывания и последующего внутриклеточного переваривания) либо, в случае крупных чужеродных тел (например, паразитов или крупных опухолевых клеток), путём выделения разрушительных частиц при непосредственном контакте[27]. Кроме того, осуществляющие неспецифический иммунитет клетки являются важными посредниками в процессе активации механизмов приобретённого иммунитета[5].
Фагоциты
Активация NK-клетки отсутствием комплекса ГКГС-I на инфицированной клетке.Фагоцитоз представляет собой важную особенность клеточного звена врождённого иммунитета, которую осуществляют клетки, называемые фагоцитами, которые «переваривают» чужеродные микроорганизмы или частицы. Фагоциты обычно циркулируют по организму в поисках чужеродных материалов, но могут быть призваны в определённое место при помощи цитокинов[8]. После поглощения чужеродного микроорганизма фагоцитом он оказывается в ловушке внутриклеточного пузырька, который называется фагосомой. Фагосома сливается с другим пузырьком — лизосомой, в результате чего формируется фаголизосома. Микроорганизм погибает под воздействием пищеварительных ферментов, либо в результате дыхательного взрыва, при котором в фаголизосому высвобождаются свободные радикалы[30][31]. Фагоцитоз эволюционировал из способа получения захвата питательных веществ, но эта роль у фагоцитов была расширена, став защитным механизмом, направленным на разрушение патогенных возбудителей[32]. Фагоцитоз, вероятно, представляет собой наиболее старую форму защиты макроорганизма, поскольку фагоциты обнаруживаются как у позвоночных, так и у беспозвоночных животных[33].
К фагоцитам относятся такие клетки, как мононуклеарные фагоциты (в частности — моноциты и макрофаги), дендритные клетки и нейтрофилы. Фагоциты способны связывать микроорганизмы и антигены на своей поверхности, а затем поглощать и уничтожать их. Эта функция основана на простых механизмах распознавания, позволяющих связывать самые разнообразные микробные продукты, и относится к проявлениям врождённого иммунитета. С появлением специфического иммунного ответа мононуклеарные фагоциты играют важную роль в его механизмах путём представления антигенов T-лимфоцитам. Для эффективного уничтожения микробов фагоцитам требуется активация.
Нейтрофилы и макрофаги представляют собой фагоциты, которые путешествуют по организму в поисках проникших сквозь первичные барьеры чужеродных микроорганизмов[34]. Нейтрофилы обычно обнаруживаются в крови и представляют собой наиболее многочисленную группу фагоцитов, обычно представляющую около 50 %-60 % общего количества циркулирующих лейкоцитов[35]. Во время острой фазы воспаления, в частности, в результате бактериальной инфекции, нейтрофилы мигрируют к очагу воспаления. Этот процесс называется хемотаксисом. Они обычно являются первыми клетками, реагирующими на очаг инфекции. Макрофаги представляют собой клетки многоцелевого назначения, обитающие в тканях и производящие широкий спектр биохимических факторов, включая ферменты, белки системы комплемента и регуляторные факторы, например интерлейкин-1[36]. Кроме того, макрофаги выполняют роль уборщиков, избавляя организм от изношенных клеток и другого мусора, а также роль антиген-презентирующих клеток, активирующих звенья приобретённого иммунитета[5].
Дендритные клетки представляют собой фагоциты в тканях, которые соприкасаются с внешней средой, то есть расположены они, главным образом, в коже, носу, лёгких, желудке и кишечнике[37]. Они названы так, поскольку напоминают дендриты нейронов наличием многочисленных отростков, однако дендритные клетки никоим образом не связаны с нервной системой. Дендритные клетки служат связующим звеном между врождённым и приобретённым иммунитетом, поскольку они представляют антиген T-клеткам, одному из ключевых типов клеток приобретённого иммунитета[37].
Вспомогательные клетки
Вспомогательными клетками считаются тучные клетки, базофилы, эозинофилы, тромбоциты. Также в иммунной защите участвуют соматические клетки различных тканей организма. Тучные клетки находятся в соединительной ткани и слизистых оболочках и участвуют в регуляции воспалительной реакции[38]. Они очень часто связаны с аллергией и анафилаксией[35]. Они во многом напоминают базофилы — одну из малочисленных подгрупп зернистых лейкоцитов. Базофилы и эозинофилы родственны нейтрофилам. Эозинофилы секретируют биохимические медиаторы, которые участвуют в защите от крупных многоклеточных паразитов, а также играют роль в аллергических реакциях, например при бронхиальной астме[39]. Естественные киллеры (или натуральные, или нормальные, от англ. Natural killer) представляют собой лейкоциты группы лимфоцитов, которые атакуют и уничтожают опухолевые клетки, или инфицированные вирусами клетки[40].
Приобретённый иммунитет
Система приобретённого иммунитета появилась в ходе эволюции низших позвоночных. Она обеспечивает более интенсивный иммунный ответ, а также иммунологическую память, благодаря которой каждый чужеродный микроорганизм «запоминается» по уникальным для него антигенам[41]. Система приобретённого иммунитета антигенспецифична и требует распознавания специфических чужих («не своих») антигенов в процессе, называемом презентацией антигена. Специфичность антигена позволяет осуществлять реакции, которые предназначены конкретным микроорганизмам или инфицированным ими клеткам. Способность к осуществлению таких узконаправленных реакций поддерживается в организме «клетками памяти». Если макроорганизм инфицируется микроорганизмом более одного раза, эти специфические клетки памяти используются для быстрого уничтожения такого микроорганизма.
Лимфоциты
Клетки иммунной системы, на которые возложены ключевые функции по осуществлению приобретённого иммунитета, относятся к лимфоцитам, которые являются подтипом лейкоцитов. Большая часть лимфоцитов отвечает за специфический приобретённый иммунитет, так как могут распознавать возбудителей инфекции внутри или вне клеток, в тканях или в крови.
Основными типами лимфоцитов являются B-клетки и T-клетки, которые происходят из плюрипотентных гемопоэтических стволовых клеток; у взрослого человека они образуются в костном мозге[27], а T-лимфоциты дополнительно проходят часть этапов дифференцировки в тимусе. B-клетки отвечают за гуморальное звено приобретённого иммунитета, то есть вырабатывают антитела, в то время как T-клетки представляют собой основу клеточного звена специфического иммунного ответа.
В организме предшественники лимфоцитов непрерывно продуцируются в ходе дифференциации стволовых кроветворных клеток, при этом вследствие мутаций генов, кодирующих вариабельные цепи антител, возникает множество клеток, чувствительных к множеству потенциально существующих антигенов. На этапе развития лимфоциты проходят отбор: остаются только значимые с точки зрения защиты организма, а также те, которые не несут угрозы собственным тканям организма. Параллельно с этим процессом лимфоциты разделяются на группы, способные выполнять ту или иную функцию защиты. Существуют разные виды лимфоцитов. В частности, по морфологическим признакам их разделяют на малые лимфоциты и большие гранулярные лимфоциты (БГЛ). По структуре внешних рецепторов среди лимфоцитов выделяют, в частности, B-лимфоциты и T-лимфоциты.
Как B-, так и T-клетки несут на своей поверхности рецепторные молекулы, которые распознают специфические мишени. Рецепторы представляют из себя как бы «зеркальный отпечаток» определённой части чужеродной молекулы, способный присоединяться к ней. При этом одна клетка может содержать рецепторы только для одного вида антигенов.
T-клетки распознают чужеродные («не-свои») мишени, такие как патогенные микроорганизмы, только после того, как антигены (специфические молекулы чужеродного тела) будут обработаны и презентированы в сочетании с собственной («своей») биомолекулой, которая называется молекулой главного комплекса гистосовместимости (англ. major histocompatibility complex, MHC). Среди T-клеток различают ряд подтипов, в частности, Т-киллеры, Т-хелперы и регуляторные Т-клетки.
T-киллеры распознают только антигены, которые объединены с молекулами главного комплекса гистосовместимости I класса, в то время как T-хелперы распознают только антигены, расположенные на поверхности клеток в сочетании с молекулами главного комплекса гистосовместимости II класса. Это различие в презентации антигена отражает разные роли указанных двух типов T-клеток. Другим, менее распространённым подтипом T-клеток, являются γδ T-клетки, которые распознают неизменённые антигены, не связанные с рецепторами главного комплекса гистосовместимости[42].
У T-лимфоцитов круг задач весьма широк. Часть из них — регуляция приобретённого иммунитета с помощью специальных белков (в частности, цитокинов), активация B-лимфоцитов для образования антител, а также регуляция активации фагоцитов для более эффективного разрушения микроорганизмов. Эту задачу выполняет группа T-хелперов. За разрушение собственных клеток организма путём выделения цитотоксичных факторов при непосредственном контакте отвечают T-киллеры, которые действуют специфически.
В отличие от T-клеток, B-клетки не нуждаются в обработке антигена и экспрессии его на поверхности клетки. Их рецепторы к антигену представляют собой фиксированные на поверхности B-клетки антителоподобные белки. Каждая прошедшая дифференцировку линия B-клеток экспрессирует уникальное только для неё антитело, и никакое другое. Таким образом, полный набор антигенных рецепторов всех B-клеток организма представляет все антитела, которые организм может вырабатывать[27]. Функция B-лимфоцитов заключается прежде всего в выработке антител — гуморального субстрата специфического иммунитета, — действие которых направлено прежде всего против внеклеточно расположенных возбудителей.
Кроме того, существуют лимфоциты, неспецифически проявляющие цитотоксичность — естественные киллеры.
T-киллеры
Цитотоксическая Т-клетка распознает антиген, представленный комплексом ГКГС-I инфицированной клетки.Т-киллеры представляют собой подгруппу T-клеток, функцией которых является разрушение собственных клеток организма, инфицированных вирусами или другими патогенными внутриклеточными микроорганизмами[43], либо клеток, которые повреждены или неверно функционируют (например, опухолевые клетки). Как и B-клетки, каждая конкретная линия T-клеток распознает только один антиген. T-киллеры активируются при соединении своим T-клеточным рецептором (ТКР) со специфическим антигеном в комплексе с рецептором главного комплекса гистосовместимости I класса другой клетки. Распознавание этого комплекса рецептора гистосовместимости с антигеном осуществляется при участии расположенного на поверхности T-клетки вспомогательного рецептора CD8. В лабораторных условиях T-клетки обычно выявляют именно по экспрессии CD8. После активации T-клетка перемещается по организму в поисках клеток, на которых белок I класса главного комплекса гистосовместимости содержит последовательность нужного антигена. При контакте активированного T-киллера с такими клетками он выделяет токсины, образующие отверстия в цитоплазматической мембране клеток-мишеней, в результате ионы, вода и токсин свободно перемещаются в клетку-мишень и из неё: клетка-мишень погибает[44]. Разрушение собственных клеток T-киллерами важно, в частности, для предотвращения размножения вирусов. Активация T-киллеров жёстко управляется и обычно требует очень сильного сигнала активации от комплекса белка гистосовместимости с антигеном, либо дополнительной активации факторами T-хелперов[44].
T-хелперы
Т-хелперы регулируют реакции как врождённого, так и приобретённого иммунитета, и позволяют определять тип ответа, который организм окажет на конкретный чужеродный материал[45][46]. Эти клетки не проявляют цитотоксичности и не участвуют в уничтожении инфицированных клеток или непосредственно возбудителей. Вместо этого, они управляют иммунным ответом, направляя другие клетки на выполнение этих задач.
Активация иммунного ответа.T-хелперы экспрессируют T-клеточные рецепторы (ТКР), которые распознают антигены, связанные с молекулами II класса главного комплекса гистосовместимости. Комплекс молекулы главного комплекса гистосовместимости с антигеном также распознается корецептором клеток-хелперов CD4, который привлекает внутриклеточные молекулы T-клетки (например, Lck), ответственные за активацию T-клетки. T-хелперы обладают меньшей чувствительностью к комплексу молекулы главного комплекса гистосовместимости и антигена, чем T-киллеры, то есть для активации T-хелпера требуется связывание гораздо большего количества его рецепторов (около 200—300) с комплексом молекулы гистосовместимости и антигена, в то время как T-киллеры могут быть активированы после связывания с одним таким комплексом. Активация T-хелпера также требует более продолжительного контакта с антиген-презентирующей клеткой[47]. Активация неактивного T-хелпера приводит к высвобождению им цитокинов, которые оказывают влияние на активность многих видов клеток. Цитокиновые сигналы, создаваемые T-хелперами, усиливают бактерицидную функцию макрофагов и активность T-киллеров[8]. Кроме того, активация T-хелперов вызывает изменения в экспрессии молекул на поверхности T-клетки, в частности лиганда CD40 (также известного под обозначением CD154), что создаёт дополнительные стимулирующие сигналы, обычно требуемые для активации вырабатывающих антитела B-клеток[48].
Гамма-дельта T-клетки
5-10 % T-клеток несут на своей поверхности гамма-дельта-ТКР и обозначаются как γδ T-клетки.
B-лимфоциты и антитела
Дифференциация В-клетки в плазматическую клеткуВ-клетки составляют 5-15 % циркулирующих лимфоцитов и характеризуются поверхностными иммуноглобулинами, встроенными в клеточную мембрану и выполняющими функцию специфического антигенного рецептора. Этот рецептор, специфичный лишь для определённого антигена, называется антителом. Антиген, связываясь с соответствующим антителом на поверхности В-клетки, индуцирует пролиферацию и дифференцировку В-клетки до плазматических клеток и клеток памяти, специфичность которых такая же, как и специфичность исходной В-клетки. Плазматические клетки секретируют большое количество антител в виде растворимых молекул, распознающих исходный антиген. Секретируемые антитела имеют ту же специфичность, что и соответствующий В-клеточный рецептор.
Антигенпрезентирующие клетки
См. Дендритные клетки
Иммунологическая память
Иммунологическая память — это способность иммунной системы отвечать более быстро и эффективно на антиген (патоген), с которым у организма был предварительный контакт.
Такая память обеспечивается предсуществующими антигенспецифическими клонами как В-клеток, так и Т-клеток, которые функционально более активны в результате прошедшей первичной адаптации к определённому антигену.
Пока неясно, устанавливается ли память в результате формирования долгоживущих специализированных клеток памяти или же память отражает собой процесс рестимуляции лимфоцитов постоянно присутствующим антигеном, попавшим в организм при первичной иммунизации.
Иммунологические расстройства у человека
Иммунодефициты
Иммунодефициты (ИДС) — это нарушения иммунологической реактивности, которые обусловлены выпадением одного или нескольких компонентов иммунного аппарата или тесно взаимодействующих с ним неспецифических факторов.
Аутоиммунные процессы
Аутоиммунные процессы — это в значительной степени хронические явления, которые приводят к долговременному повреждению тканей. Это связано в первую очередь с тем, что аутоиммунная реакция постоянно поддерживается тканевыми антигенами.
Гиперчувствительность
Гиперчувствительность — это термин, используемый для обозначения иммунного ответа, который протекает в аггравированной и неадекватной форме, в результате чего происходит повреждение тканей.
Другие защитные механизмы макроорганизма
Иммунология опухолей
К аспектам иммунологии опухолей относятся три основных направления исследований:
- Использование методов иммунологии для диагностики опухолей, определения прогноза и выработки тактики лечения заболевания;
- Осуществление иммунотерапии в качестве дополнения к другим видам лечения и для иммунокоррекции — восстановления деятельности иммунной системы;
- Определение роли иммунологического наблюдения за опухолями у человека.
Управление иммунной системой
Физиологические механизмы
Применяемые в медицине методы воздействия
Существует несколько методов влияния на иммунный ответ для подавления нежелательных эффектов, вызываемых аутоиммунными заболеваниями, аллергиями, пересадкой органов, либо для стимулирования защитного ответа против определенных патогенов (иммунизация при помощи вакцин[49]) или отдельных видов опухолей.
Иммуносупрессия
Иммуносупрессия (иммунодепрессия) — угнетение иммунитета с помощью лекарственных препаратов (иммуносупрессоров) при аутоиммунных заболеваниях или воспалениях, при которых происходит избыточное повреждение тканей. Длительная постоянная иммуносупрессия необходима после пересадки органов для предотвращения отторжения органа[50][51].
Противовоспалительные лекарственные средства часто применяются для управления эффектами воспаления. Наиболее сильное действие среди них оказывают Глюкокортикоиды, однако они часто имеют нежелательные побочные эффекты, и их применение требует контроля.[52] В малых дозах противовоспалительные средства применяются вместе с цитотоксинами или иммуносупрессорами (например Метотрексат или Азатиоприн).
Цитотоксические препараты применяемые в химиотерапии подавляют иммунный ответ, препятствуя размножению определенных видов клеток, в частности, активированных T-лимфоцитов. Такие препараты воздействуют на все активно делящиеся клетки и органы, их содержащие, что вызывает серьезные побочные эффекты.[51] Некоторые иммуносупрессоры, например Циклоспорин, действует на Т-лимфоциты, подавляя некоторые пути передачи сигнала.[53]
Иммуностимуляция
Существует несколько видов иммунотерапии опухолей, при которой стимулируется атака иммунной системы против новообразований.
Вакцинация позволяет выработать иммунитет к ряду инфекционных заболеваний[49].
Механизмы обхода иммунитета возбудителями
История развития представлений об иммунной системе
В 1796 году английский учёный Эдвард Дженнер (1749—1823) разработал способ искусственной иммунизации против оспы путём заражения человека коровьей оспой[54].
Открытие Луи Пастера (1880) дало начало иммунологии как самостоятельной науке. Пастер обнаружил, что иммунизация кур старой холерной культурой создаёт у них устойчивость к заражению высоковирулентным возбудителем куриной холеры и сформулировал основной принцип создания вакцин, а также получил вакцины против сибирской язвы и против бешенства[54].
Илья Ильич Мечников открыл феномен фагоцитоза (1887) и создал клеточную или фагоцитарную теорию иммунитета[54].
Немецкий учёный Пауль Эрлих выдвинул гуморальную теорию иммунитета. С 1898 по 1899 год бельгийский учёный Жюль Борде и русский учёный Н. Н. Чистович обнаружили образование антител в ответ на введение чужеродных эритроцитов и сывороточных белков. Данное открытие положило начало неинфекционной иммунологии[54].
В 1900 году австрийский иммунолог Карл Ландштейнер сделал открытие групп крови человека. Он создал основу учения о тканевых изоантигенах[54].
См. также
Примечания
- ↑ Джонатан Кипнис. Седьмое чувство // В мире науки. — 2018. — № 10. — С. 4-12.
- ↑ Биологи изменили классические представления о наследственности
- ↑ Beck, Gregory; Gail S. Habicht (November 1996). «Immunity and the Invertebrates» (PDF). Scientific American: 60-66. Проверено 2007-01-01.
- ↑ 1 2 Litman G, Cannon J, Dishaw L (2005). «Reconstructing immune phylogeny: new perspectives.». Nat Rev Immunol 5 (11): 866-79. PMID 16261174.
- ↑ 1 2 3 Mayer, Gene Immunology — Chapter One: Innate (non-specific) Immunity. Microbiology and Immunology On-Line Textbook. USC School of Medicine (2006). Проверено 1 января 2007. Архивировано 23 августа 2011 года.
- ↑ Smith A.D. (Ed) Oxford dictionary of biochemistry and molecular biology. (1997) Oxford University Press. ISBN 0-19-854768-4
- ↑ 1 2 Ройт, Иммунология. 2000. ISBN 5-03-003305-X
- ↑ 1 2 3 4 Alberts, Bruce. Molecular Biology of the Cell; Fourth Edition. — New York and London : Garland Science, 2002. — ISBN ISBN 0-8153-3218-1.
- ↑ Boyton R, Openshaw P. «Pulmonary defences to acute respiratory infection.». Br Med Bull 61: 1—12. PMID 11997295.
- ↑ Agerberth B, Gudmundsson G. «Host antimicrobial defence peptides in human disease.». Curr Top Microbiol Immunol 306: 67—90. PMID 16909918.
- ↑ Moreau J, Girgis D, Hume E, Dajcs J, Austin M, O’Callaghan R (2001). «Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus.». Invest Ophthalmol Vis Sci 42 (10): 2347—54. PMID 11527949.
- ↑ Hankiewicz J, Swierczek E (1974). «Lysozyme in human body fluids.». Clin Chim Acta 57 (3): 205—9. PMID 4434640.
- ↑ Fair W, Couch J, Wehner N (1976). «Prostatic antibacterial factor. Identity and significance.». Urology 7 (2): 169—77. PMID 54972.
- ↑ Yenugu S, Hamil K, Birse C, Ruben S, French F, Hall S (2003). «Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli.». Biochem J 372 (Pt 2): 473—83. PMID 12628001.
- ↑ Gorbach S (1990). «Lactic acid bacteria and human health». Ann Med 22 (1): 37–41. PMID 2109988.
- ↑ Hill L, Embil J (1986). «Vaginitis: current microbiologic and clinical concepts.». CMAJ 134 (4): 321—31. PMID 3510698.
- ↑ Reid G, Bruce A (2003). «Urogenital infections in women: can probiotics help?». Postgrad Med J 79 (934): 428—32. PMID 12954951.
- ↑ Salminen S, Gueimonde M, Isolauri E (2005). «Probiotics that modify disease risk». J Nutr 135 (5): 1294–8. PMID 15867327.
- ↑ Reid G, Jass J, Sebulsky M, McCormick J (2003). «Potential uses of probiotics in clinical practice». Clin Microbiol Rev 16 (4): 658—72. PMID 14557292.
- ↑ Kawai T, Akira S (2006). «Innate immune recognition of viral infection». Nat Immunol 7 (2): 131-7. PMID 16424890.
- ↑ Miller, SB (2006). «Prostaglandins in Health and Disease: An Overview». Seminars in Arthritis and Rheumatism 36 (1): 37-49. PMID 16887467.
- ↑ Ogawa Y, Calhoun WJ. (2006). «The role of leukotrienes in airway inflammation.». J Allergy Clin Immunol. 118 (4): 789-98. PMID 17030228.
- ↑ Le Y, Zhou Y, Iribarren P, Wang J (2004). «Chemokines and chemokine receptors: their manifold roles in homeostasis and disease». Cell Mol Immunol 1 (2): 95-104. PMID 16212895.
- ↑ Martin P, Leibovich S (2005). «Inflammatory cells during wound repair: the good, the bad and the ugly.». Trends Cell Biol 15 (11): 599-607. PMID 16202600.
- ↑ 1 2 Rus H, Cudrici C, Niculescu F (2005). «The role of the complement system in innate immunity.». Immunol Res 33 (2): 103-12. PMID 16234578.
- ↑ Mayer, Gene Immunology — Chapter Two: Complement. Microbiology and Immunology On-Line Textbook. USC School of Medicine (2006). Проверено 1 января 2007. Архивировано 23 августа 2011 года.
- ↑ 1 2 3 4 Janeway CA, Jr. et al. Immunobiology.. — 6th ed. — Garland Science, 2005. — ISBN ISBN 0-443-07310-4.
- ↑ Liszewski M, Farries T, Lublin D, Rooney I, Atkinson J. «Control of the complement system.». Adv Immunol 61: 201-83. PMID 8834497.
- ↑ Sim R, Tsiftsoglou S (2004). «Proteases of the complement system.». Biochem Soc Trans 32 (Pt 1): 21-7. PMID 14748705.
- ↑ Ryter A (1985). «Relationship between ultrastructure and specific functions of macrophages.». Comp Immunol Microbiol Infect Dis 8 (2): 119-33. PMID 3910340.
- ↑ Langermans J, Hazenbos W, van Furth R (1994). «Antimicrobial functions of mononuclear phagocytes». J Immunol Methods 174 (1-2): 185-94. PMID 8083520.
- ↑ May R, Machesky L (2001). «Phagocytosis and the actin cytoskeleton». J Cell Sci 114 (Pt 6): 1061-77. PMID 11228151.
- ↑ Salzet M, Tasiemski A, Cooper E (2006). «Innate immunity in lophotrochozoans: the annelids». Curr Pharm Des 12 (24): 3043-50. PMID 16918433.
- ↑ Zen K, Parkos C (2003). «Leukocyte-epithelial interactions». Curr Opin Cell Biol 15 (5): 557-64. PMID 14519390.
- ↑ 1 2 Stvrtinová, Viera. Inflammation and Fever from Pathophysiology: Principles of Disease. — Computing Centre, Slovak Academy of Sciences : Academic Electronic Press, 1995.
- ↑ Bowers, William Immunology -Chapter Thirteen: Immunoregulation. Microbiology and Immunology On-Line Textbook. USC School of Medicine (2006). Проверено 4 января 2007. Архивировано 23 августа 2011 года.
- ↑ 1 2 Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S. «Antigen presentation and T cell stimulation by dendritic cells». Annu Rev Immunol 20: 621-67. PMID 11861614.
- ↑ Krishnaswamy G, Ajitawi O, Chi D. «The human mast cell: an overview.». Methods Mol Biol 315: 13-34. PMID 16110146.
- ↑ Kariyawasam H, Robinson D (2006). «The eosinophil: the cell and its weapons, the cytokines, its locations». Semin Respir Crit Care Med 27 (2): 117-27. PMID 16612762.
- ↑ Middleton D, Curran M, Maxwell L (2002). «Natural killer cells and their receptors». Transpl Immunol 10 (2-3): 147-64. PMID 12216946.
- ↑ Pancer Z, Cooper M. «The evolution of adaptive immunity». Annu Rev Immunol 24: 497-518. PMID 16551257.
- ↑ Holtmeier W, Kabelitz D. «gammadelta T cells link innate and adaptive immune responses». Chem Immunol Allergy 86: 151-83. PMID 15976493.
- ↑ Harty J, Tvinnereim A, White D. «CD8+ T cell effector mechanisms in resistance to infection». Annu Rev Immunol 18: 275-308. PMID 10837060.
- ↑ 1 2 Radoja S, Frey A, Vukmanovic S (2006). «T-cell receptor signaling events triggering granule exocytosis». Crit Rev Immunol 26 (3): 265-90. PMID 16928189.
- ↑ Abbas A, Murphy K, Sher A (1996). «Functional diversity of helper T lymphocytes». Nature 383 (6603): 787-93. PMID 8893001.
- ↑ McHeyzer-Williams L, Malherbe L, McHeyzer-Williams M. «Helper T cell-regulated B cell immunity». Curr Top Microbiol Immunol 311: 59–83. PMID 17048705.
- ↑ Kovacs B, Maus M, Riley J, Derimanov G, Koretzky G, June C, Finkel T (2002). «Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation». Proc Natl Acad Sci U S A 99 (23): 15006-11. PMID 12419850.
- ↑ Grewal I, Flavell R. «CD40 and CD154 in cell-mediated immunity». Annu Rev Immunol 16: 111-35. PMID 9597126.
- ↑ 1 2 ВОЗ | Иммунизация
- ↑ Janeway CA, Jr. Immunobiology. — 6th. — Garland Science, 2005. — ISBN 0-443-07310-4.
- ↑ 1 2 (Oct 2005) «Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy». Critical Reviews in Oncology/Hematology 56 (1): 23–46. DOI:10.1016/j.critrevonc.2005.03.012. PMID 16039869.
- ↑ (Mar 2006) «Corticosteroids: the drugs to beat». European Journal of Pharmacology 533 (1-3): 2–14. DOI:10.1016/j.ejphar.2005.12.052. PMID 16436275.
- ↑ (Jul 2003) «The mosaic of immunosuppressive drugs». Molecular Immunology 39 (17-18): 1073–7. DOI:10.1016/S0161-5890(03)00075-0. PMID 12835079.
- ↑ 1 2 3 4 5 Иммунология — статья из Большой советской энциклопедии.
Ссылки
Можно ли повысить иммунную систему?
Иммунная система защищает организм от инфекции. Хотя большую часть времени он работает эффективно, иногда наша иммунная система дает сбой, и мы заболеваем. Есть ли способы укрепить нашу иммунную систему и предотвратить болезни? Узнаем.
Поделиться на Pinterest Наша иммунная система защищает нас от инфекций и болезней, но есть ли способ улучшить ее функционирование?Иммунная система — это сеть особых клеток, тканей, белков и органов, которые работают вместе, чтобы защитить тело от потенциально опасных чужеродных захватчиков и болезней.
Когда наша иммунная система функционирует должным образом, она обнаруживает угрозы, такие как бактерии, паразиты и вирусы, и запускает иммунный ответ для их уничтожения. Нашу иммунную систему можно условно разделить на две части: врожденную и адаптивную.
Врожденный иммунитет — это естественная защита, с которой мы родились, и наша первая линия защиты от инфекции. При обнаружении инфекции наша врожденная реакция действует быстро, чтобы попытаться избавиться от захватчика, производя дополнительную слизь или проворачивая термостат, чтобы вызвать лихорадку.
Адаптивный иммунитет — это защита, которую мы получаем на протяжении всей жизни, поскольку мы подвержены болезням или защищаемся от них с помощью вакцинации. Адаптивная система обнаруживает врага и производит определенное оружие или антитела, необходимые для уничтожения и уничтожения захватчика из тела.
Адаптивной системе может потребоваться от 5 до 10 дней, чтобы определить необходимые антитела и произвести их в количестве, необходимом для успешной атаки захватчика. В это время врожденная система сдерживает патоген и предотвращает его размножение.
Таким образом, врожденный иммунитет нельзя «повысить», и вы бы этого не хотели. Если бы врожденная реакция была стимулирована, вы бы постоянно чувствовали недомогание из-за насморка, лихорадки, летаргии и депрессии.
Эффективность адаптивного ответа можно повысить с помощью вакцинации. Вакцина содержит безвредную версию микроба, от которого вам нужна защита. Адаптивная система запоминает захватчика, поэтому в следующий раз, когда он вступит в контакт с микробом, он может действовать быстро и начать атаку.
Поделиться на PinterestИммунная система содержит много разных типов клеток, которые реагируют на разные микробы.Хотя многие продукты утверждают, что повышают иммунитет, эта концепция не имеет большого научного смысла. Попытки стимулировать клетки любого вида не обязательно хорошо и могут привести к серьезным побочным эффектам.
Иммунная система, в частности, содержит несколько различных типов клеток, которые по-разному реагируют на различные микробы. Какие клетки вы бы увеличили и до какого количества? Это вопрос, на который ученые в настоящее время не знают ответа.
Что действительно известно исследователям, так это то, что организм постоянно вырабатывает иммунные клетки, которые называются лейкоцитами или лейкоцитами, и генерирует гораздо больше клеток адаптивной системы, известных как лимфоциты, которые созревают в В-клетки и Т-клетки, чем необходимо. .
Избыточные клетки разрушают себя в результате естественной гибели клеток, называемой апоптозом. Неизвестно, какое сочетание клеток или оптимальное количество является наилучшим, чтобы иммунная система работала наилучшим образом.
У многих людей иммунная система хорошо регулируется и не нуждается в помощи.Однако у некоторых людей лекарства или нарушения иммунной системы вызывают повышенную или низкую активность иммунной системы.
- Первичные иммунодефицитные расстройства обычно проявляются с рождения и вызваны отсутствием определенных частей иммунной системы.
- Вторичные иммунодефицитные расстройства возникают в результате нарушения иммунной системы факторами окружающей среды, включая ВИЧ, тяжелые ожоги, недоедание или химиотерапию.
- Аллергия и астма развиваются, когда иммунная система реагирует на вещества, которые не являются вредными.
- Аутоиммунные заболевания — это состояния, такие как волчанка, ревматоидный артрит, воспалительное заболевание кишечника, рассеянный склероз и диабет 1 типа, при которых иммунная система ошибочно атакует клетки и ткани организма.
Нарушения иммунной системы лечат специальными лекарствами, которые устраняют симптомы и связанные с ними инфекции.
Основные компоненты иммунной системы включают лимфатические узлы, миндалины, селезенку, костный мозг и тимус.
Поделиться на Pinterest Многие факторы, включая диету, упражнения и сон, могут повлиять на иммунный ответ.Однако еще многое предстоит узнать о взаимосвязях и тонкостях иммунного ответа. Чтобы хорошо функционировать, вся система требует гармонии и баланса. Иммунная система — это не единое целое или силовое поле, которое требует исправления для правильной работы.
Прямых связей между образом жизни и усилением иммунного ответа выявлено не было, но исследователи изучили влияние таких факторов, как упражнения, диета и стресс, на реакцию иммунной системы.
Лучшее, что вы можете сделать для поддержания своей иммунной системы, — это принять стратегии здорового образа жизни, которые принесут пользу всему организму, включая вашу иммунную систему. Эти стратегии могут включать:
- соблюдение диеты, богатой фруктами и овощами
- регулярные физические упражнения
- поддержание здорового веса
- отказ от курения
- умеренное употребление алкоголя
- получение достаточного количества сна
- предотвращение заражения путем регулярного мытья рук
- снижение стресса
Сбалансированное питание и употребление рекомендованного количества питательных веществ помогут поддерживать нормальную иммунную функцию.
Витамины A, C и D, а также минералы, включая цинк, играют роль в функционировании иммунной системы. Если вы придерживаетесь сбалансированной диеты, вам не нужно будет принимать добавки, содержащие эти витамины и минералы, и дополнительный прием не особенно поможет вашей иммунной системе.
Известно, что недоедающие люди более восприимчивы к инфекциям, и есть некоторые свидетельства того, что недостаток определенных питательных микроэлементов влияет на иммунные реакции.
Витамины и минералы
Например, было продемонстрировано, что дефицит цинка, который может способствовать развитию хронических заболеваний, отрицательно влияет на то, как иммунная система реагирует на воспаление у пожилых людей.
Поделиться на Pinterest Соблюдение здоровой и сбалансированной диеты важно для поддержания иммунной функции.Добавки витамина D связаны с изменениями в поведении иммунной системы. Прием добавок витамина D во время беременности — в период, когда иммунная система находится в постоянном движении — может изменить иммунную систему новорожденного таким образом, чтобы защитить его от респираторных инфекций и астмы.
Исследования показывают, что витамин D активирует Т-клетки, которые могут идентифицировать и атаковать раковые клетки, а также защищать от колоректального рака у некоторых людей.У пожилых людей витамин D также снижает респираторные инфекции.
Продукты, влияющие на иммунный ответ
Исследования были сосредоточены на том, как определенные продукты питания или диеты могут влиять на иммунный ответ.
Растворимая клетчатка переключает иммунные клетки с провоспалительных на противовоспалительные, что помогает нам быстрее излечиться от инфекции.
Птеростильбен и ресвератрол, , обнаруженные в чернике и красном винограде, соответственно, помогают повысить экспрессию гена антимикробного пептида кателицидина человека (CAMP), который участвует в иммунной функции.Ген CAMP играет жизненно важную роль в врожденной иммунной системе.
Пробиотики могут помочь противодействовать побочным эффектам антибиотиков широкого спектра действия, поддерживая готовность иммунной системы к реагированию на новые инфекции.
Рыбий жир , богатый DHA, повышает активность В-клеток, что может быть многообещающим для людей с ослабленной иммунной системой.
Длительное голодание было связано с регенерацией стволовых клеток старых и поврежденных иммунных клеток.
Куркумин , содержащийся в карри и куркуме, может помочь иммунной системе очистить мозг от бета-амилоидных бляшек, наблюдаемых при болезни Альцгеймера.
Диеты с высоким содержанием жиров и калорий вызывают реакцию иммунной системы, аналогичную бактериальной инфекции. Исследователи предполагают, что употребление нездоровой пищи делает защитные силы организма более агрессивными спустя долгое время после перехода на здоровую диету, что может способствовать развитию таких заболеваний, как артериосклероз и диабет.
Так же, как и здоровое питание, регулярная физическая активность способствует хорошему здоровью в целом и, следовательно, здоровой иммунной системе. Физические упражнения способствуют эффективному кровообращению, что заставляет клетки иммунной системы двигаться, чтобы они могли эффективно выполнять свою работу.
Одно исследование показало, что всего 20 минут умеренных упражнений стимулировали иммунную систему, которая, в свою очередь, вызвала противовоспалительный клеточный ответ.
Исследователи отметили, что их открытие имеет обнадеживающие последствия для людей с хроническими заболеваниями, включая артрит и фибромиалгию, а также с ожирением.
Другое исследование показало, что лучший способ избежать неблагоприятных изменений иммунной системы и помочь организму восстановиться после интенсивных упражнений — это потреблять углеводы во время или после.
Авторы статьи предполагают, что от 30 до 60 граммов углеводов каждый час во время физической активности могут помочь поддерживать нормальную иммунную функцию.
Помимо сбалансированной диеты и регулярных упражнений, ученые обнаружили доказательства наличия других факторов, которые могут влиять на реакцию иммунной системы.
Хроническое недосыпание может снизить реакцию иммунной системы и циркуляцию лейкоцитов, в то время как адекватный медленноволновой сон — или глубокий сон — укрепляет память иммунной системы о патогенных микроорганизмах, с которыми ранее встречались. Доказано, что пребывание на улице на солнце приносит пользу иммунной системе.
Выход на улицу на солнце может принести пользу иммунной системе. Исследователи обнаружили, что солнечный свет заряжает энергией борющиеся с инфекцией Т-клетки, которые играют ключевую роль в иммунитете.В частности, синий свет, обнаруживаемый в солнечных лучах, заставляет Т-клетки двигаться быстрее, что может помочь им добраться до места инфекции и быстрее отреагировать.
Снижение стресса также может помочь поддерживать нормальную работу иммунной системы.
Исследование показало, что ожидание счастливого или забавного события увеличивает уровень эндорфинов и других гормонов, которые вызывают состояние расслабления. Хронический стресс может подавить реакцию иммунной системы и ее способность бороться с болезнями; поэтому снижение стресса может помочь предотвратить инфекции и другие расстройства.
Сообщается, что пение в хоре в течение 1 часа снижает стресс, улучшает настроение и повышает уровень иммунных белков у больных раком и лиц, ухаживающих за ними. Результаты исследования показывают, что такая простая вещь, как пение, может помочь уменьшить подавление иммунной системы, связанное со стрессом.
Одиночество также было определено как фактор стресса, который может повлиять на иммунную систему.
Исследования показали, что люди, которые были одинокими, вырабатывали более высокие уровни белков, связанных с воспалением, в ответ на стресс, чем те, кто чувствовал себя социально связанным.
Белки, связанные с воспалением, связаны с такими состояниями, как диабет 2 типа, ишемическая болезнь сердца, болезнь Альцгеймера и артрит.
Хотя остается много вопросов о функции иммунной системы, ясно, что здоровое питание, регулярные упражнения, достаточный сон и снижение стресса будут иметь большое значение для поддержания вашего иммунитета.
Как работает иммунная система?
Иммунная система — это естественная система защиты организма.Он не находится в какой-то одной части тела — скорее, он состоит из сети клеток, молекул, тканей и органов, работающих вместе, чтобы защитить тело. Каждый из этих элементов играет ключевую роль в том, как работает иммунная система и ее функции в целом, что имеет решающее значение для предотвращения инфекции или заболевания, включая рак.
Мощная иммунная система организма может защитить нас от рака и устранять образовавшиеся опухоли. Иммунотерапия — это класс лечения, в котором задействована сила иммунной системы.Таким образом, иммунотерапия может позволить иммунной системе нацеливаться и потенциально излечивать все типы рака, в конечном итоге спасая больше жизней.
Есть две ветви иммунной системы: врожденная иммунная система и адаптивная иммунная система. Врожденная иммунная система обеспечивает общую защиту от распространенных патогенов (любых бактерий, вирусов или других болезнетворных микроорганизмов), поэтому она также известна как неспецифическая иммунная система. Адаптивная иммунная система нацелена на конкретные угрозы и учится запускать точные реакции против вирусов или бактерий, с которыми организм уже вступил в контакт.Различные компоненты иммунной системы работают вместе, обеспечивая оба типа защиты.
Клетки иммунной системы
Несколько разных клеток работают вместе в иммунной системе, чтобы бороться с инфекциями и болезнями. Каждый тип клеток играет важную роль в идентификации, маркировке и уничтожении вредных клеток, которые проникают или развиваются в организме.
В-клетки выделяют антитела для защиты от вредоносных вторгающихся клеток. Каждая В-клетка запрограммирована на выработку одного определенного типа антител — например, одна В-клетка может отвечать за выработку антител, защищающих от вируса простуды.Опухолевые антитела могут связываться с раковыми клетками, нарушая их активность, а также стимулируя иммунные ответы против них.
CD4 + Т-хелперы посылают «вспомогательные» сигналы другим иммунным клеткам (таким как Т-клетки-киллеры CD8 + ), чтобы лучше направлять их ответ и гарантировать, что они уничтожают вредные клетки как можно быстрее и эффективнее . Эти клетки также связываются с В-клетками, продуцирующими антитела.
CD8 + Т-клетки-киллеры ежедневно уничтожают тысячи инфицированных вирусом клеток в организме.Эти клетки также могут напрямую нацеливаться и уничтожать раковые клетки.
Дендритные клетки переваривают чужеродные или раковые клетки и представляют свои белки на своей поверхности, где другие иммунные клетки могут лучше распознавать и затем уничтожать вредоносные клетки.
Макрофаги известны как «большие пожиратели» иммунной системы. Макрофаги поглощают и уничтожают бактерии и другие вредные клетки. Подобно дендритным клеткам, они представляют антигены другим клеткам иммунной системы для идентификации и разрушения.
Регуляторные Т-клетки обеспечивают систему сдержек и противовесов, чтобы иммунная система не реагировала слишком остро. Хроническая чрезмерная иммунная реакция известна как аутоиммунное заболевание.
Молекулы иммунной системы
Антитела — это белки, которые связываются со специфическими маркерами, известными как антигены вредных захватчиков, таких как микробы, вирусы или опухолевые клетки. Антитела также маркируют эти вредоносные клетки для атаки и разрушения, которое осуществляется другими клетками иммунной системы.
Цитокины — это молекулы-мессенджеры, которые помогают иммунным клеткам работать вместе для координации правильного иммунного ответа на любого конкретного захватчика, инфекцию или опухоль.
Ткани и органы иммунной системы
Как иммунная система работает за пределами клеточного и молекулярного уровней? Существует также сложная система тканей и органов, которые взаимодействуют друг с другом для защиты организма от вредных клеток и борьбы с болезнями, включая рак. Эти ткани и органы, включая аппендикс, костный мозг, лимфатические узлы, кожу, селезенку и вилочковую железу, обеспечивают более широкую основу, в которой развиваются и действуют отдельные компоненты иммунной системы.
Приложение представляет собой тонкую трубку, расположенную в правом нижнем углу живота. Точная функция аппендикса в иммунной системе неизвестна, и многие люди живут без него. По одной из теорий, аппендикс действует как место хранения «хороших» пищеварительных бактерий (микробиома).
Костный мозг — это мягкий губчатый материал, находящийся внутри кости и являющийся важной частью иммунной системы. Он содержит незрелые клетки, которые либо делятся с образованием стволовых клеток (клетки-предшественники, которые могут при необходимости пополнять другие типы клеток), либо созревают в красные кровяные тельца (клетки, транспортирующие кислород и углекислый газ), белые кровяные тельца (которые включают В-клетки и Т-клетки. ) и тромбоциты (клетки крови, которые образуют сгустки, чтобы остановить кровотечение).
Лимфатические узлы — это небольшие железы, расположенные по всему телу, которые отфильтровывают вирусы, бактерии и раковые клетки, которые затем разрушаются специализированными лейкоцитами. Лимфатические узлы также являются местом, где Т-клетки «учатся» уничтожать вредных захватчиков в организме.
Кожа является самым большим органом тела и служит защитным барьером, защищающим от патогенов и токсинов. Он также обладает собственными иммунными клетками и лимфатическими сосудами.
Селезенка — это орган, расположенный слева от желудка, который фильтрует кровь и обеспечивает хранение тромбоцитов и лейкоцитов. Селезенка также является местом, где ключевые иммунные клетки (например, В-клетки) размножаются, чтобы бороться с инвазивными чужеродными клетками.
Вилочковая железа — это небольшая железа, расположенная в верхней части грудной клетки, под грудиной. Он предоставляет место ключевым иммунным клеткам (например, Т-клеткам), чтобы превратиться в клетки, которые могут бороться с инфекциями и раком.
Важность иммунной системы в иммунотерапии
Каждый элемент и процесс в иммунной системе важны для общей способности организма защищаться от болезней и вредных патогенов. Мощная координация и коммуникация иммунной системы таковы, что ее можно усилить для борьбы со многими видами рака с помощью таких методов лечения, как иммунотерапия. Узнайте больше о том, почему исследования в области иммунотерапии важны и как инновационный подход Института исследований рака повлиял на прогресс в лечении рака.Вы можете внести свой вклад в постоянный прорыв в исследованиях рака и вариантах лечения, сделав пожертвование в Институт исследования рака сегодня.
Иммунные ответы на вирусы | Британское общество иммунологии
Через цитотоксические клетки
Когда вирус заражает человека (хозяина), он проникает в клетки своего хозяина, чтобы выжить и размножаться. Оказавшись внутри, клетки иммунной системы не могут «видеть» вирус и, следовательно, не знают, что клетка-хозяин инфицирована.Чтобы преодолеть это, клетки используют систему, которая позволяет им показывать другим клеткам, что внутри них — они используют молекулы, называемые белками главного комплекса гистосовместимости класса I (или MHC class I , для краткости) для отображения фрагментов белка изнутри. клетка на клеточной поверхности. Если клетка инфицирована вирусом, эти фрагменты пептида будут включать фрагменты белков, производимых вирусом.
Особая клетка иммунной системы, называемая Т-клеткой , циркулирует в поисках инфекций.Один тип Т-клетки называется цитотоксической Т-клеткой , поскольку она убивает клетки, инфицированные вирусами с токсичными медиаторами. Цитотоксические Т-клетки имеют на своей поверхности специализированные белки, которые помогают им распознавать инфицированные вирусом клетки. Эти белки называются рецепторами Т-клеток ( TCRs ). Каждая цитотоксическая Т-клетка имеет TCR, который может специфически распознавать определенный антигенный пептид, связанный с молекулой MHC. Если рецептор Т-клетки обнаруживает пептид вируса, он предупреждает свою Т-клетку об инфекции.Т-клетка высвобождает цитотоксических факторов , чтобы убить инфицированную клетку и, следовательно, предотвратить выживание вторгающегося вируса ( Рисунок 1 ).
Вирусы легко адаптируются, и они разработали способы избежать обнаружения Т-клетками. Некоторые вирусы не позволяют молекулам MHC попадать на поверхность клетки для отображения вирусных пептидов. В этом случае Т-клетка не знает, что внутри инфицированной клетки есть вирус.
Однако другая иммунная клетка специализируется на уничтожении клеток, которые имеют уменьшенное количество молекул MHC класса I на своей поверхности — эта клетка является естественной клеткой-киллером или NK-клеткой для краткости.Когда NK-клетка обнаруживает клетку с меньшим количеством молекул MHC, чем нормальные, она выделяет токсичные вещества, аналогично цитотоксическим Т-клеткам, которые убивают инфицированную вирусом клетку.
Цитотоксические клетки вооружены предварительно сформированными медиаторами. Цитотоксические факторы хранятся внутри отсеков, называемых гранулами , как в цитотоксических Т-клетках, так и в NK-клетках, до тех пор, пока контакт с инфицированной клеткой не вызовет их высвобождение. Одним из этих медиаторов является перфорин , белок, который может образовывать поры в клеточных мембранах; эти поры позволяют проникать в клетку-мишень другим факторам, чтобы облегчить разрушение клетки.Ферменты, называемые гранзимами , также хранятся в гранулах и высвобождаются из них. Гранзимы проникают в клетки-мишени через отверстия, сделанные перфорином.
Оказавшись внутри клетки-мишени, они инициируют процесс, известный как запрограммированная смерть клетки или апоптоз , вызывая гибель клетки-мишени. Другой высвобождаемый цитотоксический фактор — это гранулизин , который напрямую атакует внешнюю мембрану клетки-мишени, разрушая ее путем лизиса. Цитотоксические клетки также синтезируют и высвобождают другие белки, называемые цитокинами , после контакта с инфицированными клетками.Цитокины включают , интерферон-g, и фактор некроза опухоли , а , и передают сигнал от Т-клетки к инфицированной или другим соседним клеткам для усиления механизмов уничтожения.
Через интерфероны
Вирусно-инфицированные клетки продуцируют и выделяют небольшие белки, называемые интерферонами , , которые играют роль в иммунной защите от вирусов. Интерфероны предотвращают репликацию вирусов, напрямую влияя на их способность к репликации в инфицированной клетке.Они также действуют как сигнальные молекулы, которые позволяют инфицированным клеткам предупреждать соседние клетки о присутствии вируса — этот сигнал заставляет соседние клетки увеличивать количество молекул MHC класса I на своей поверхности, так что Т-клетки, исследующие область, могут идентифицировать и устранять вирусную инфекцию. как описано выше.
Через антитела
Вирусы также могут быть удалены из организма с помощью антител , прежде чем они получат шанс заразить клетку. Антитела — это белки, которые специфически распознают вторгшиеся патогены и связываются (прилипают) к ним.Это связывание служит многим целям в искоренении вируса:
- Во-первых, антитела нейтрализуют вирус, что означает, что он больше не способен инфицировать клетку-хозяин.
- Во-вторых, многие антитела могут работать вместе, заставляя вирусные частицы слипаться в процессе, называемом агглютинацией . Агглютинированные вирусы являются более легкой мишенью для иммунных клеток, чем отдельные вирусные частицы.
- Третий механизм, используемый антителами для уничтожения вирусов, — это активация фагоцитов.Связанное с вирусом антитело связывается с рецепторами, называемыми Fc-рецепторами, на поверхности фагоцитарных клеток и запускает механизм, известный как фагоцитоз , с помощью которого клетка поглощает и уничтожает вирус.
- Наконец, антитела могут также активировать систему комплемента, которая опсонизирует и способствует фагоцитозу вирусов. Комплемент также может повредить оболочку (бислой фосфолипидов), которая присутствует на некоторых типах вируса .
Иммунные ответы на вирусы © Авторские права на эту работу принадлежат автору
Как работает ваша иммунная система, образцы эссе
3 страницы, 1150 слов
Как работает иммунная система Иммунная система защищает организм от нападения «захватчиков», признанных чужеродными.Это чрезвычайно сложная система, основанная на сложной и динамичной сети связи, которая существует среди множества различных типов клеток иммунной системы, патрулирующих организм. В основе системы лежит способность распознавать вещества, называемые антигенами, и реагировать на них, независимо от того, являются ли они инфекционными агентами или частью тела, которые называются самоантигенами. Т- и В-клетки Большинство клеток иммунной системы — это белые кровяные тельца, которых существует много типов. Лимфоциты — это один из типов лейкоцитов, а два основных класса лимфоцитов — это Т-клетки и В-клетки.Т-клетки являются критически важными клетками иммунной системы, которые помогают уничтожать инфицированные клетки и координируют общий иммунный ответ. На поверхности Т-клетки есть молекула, называемая рецептором Т-клетки.
Этот рецептор взаимодействует с молекулами, называемыми MHC или главным комплексом гистосовместимости. Молекулы MHC находятся на поверхности большинства других клеток тела и помогают Т-клеткам распознавать фрагменты антигена. В-клетки наиболее известны тем, что вырабатывают антитела. Антитело связывается с антигеном и маркирует антиген для разрушения другими клетками иммунной системы.Другие типы лейкоцитов включают макрофаги и нейтрофилы. Макрофаги и нейтрофилы Макрофаги и нейтрофилы циркулируют в крови и исследуют организм на предмет инородных веществ. Когда они обнаруживают чужеродные антигены, такие как бактерии, они «поглощают» и уничтожают их.
1 страница, 340 слов
Эссе о теле дождевого червя из трубок крови
ЗЕМЛЯНЫЙ ЧЕРВ: Царство животных Тип Annelida Класс Oligochaete Дождевой червь — самый известный представитель типа Annelida, сегментированных червей.Аннелиды двусторонне симметричны, а их тела как внешне, так и внутренне разделены на сегменты. Они имеют структуру корпуса «труба в трубе». Внешняя трубка — это стенка тела, а внутренняя — пищеварительный тракт. Полость …
Макрофаги и нейтрофилы разрушают чужеродные антигены, создавая токсичные молекулы, такие как реактивные промежуточные молекулы кислорода. Если производство этих токсичных молекул продолжается бесконтрольно, разрушаются не только чужеродные антигены, но также разрушаются ткани, окружающие макрофаги и нейтрофилы.Например, у людей с аутоиммунным заболеванием, которое называется гранулематоз Вегенера, сверхактивные макрофаги и нейтрофилы, проникающие в кровеносные сосуды, производят много токсичных молекул и способствуют повреждению кровеносных сосудов. При ревматоидном артрите реактивные промежуточные молекулы кислорода и другие токсичные молекулы образуются сверхпродуктивными макрофагами и нейтрофилами, проникающими в суставы. Токсичные молекулы способствуют воспалению, которое проявляется в виде тепла и припухлости, и участвуют в повреждении сустава.MHC и ко-стимулирующие молекулы Молекулы MHC находятся на всех поверхностях клеток и являются активной частью защитной команды организма. Например, когда вирус заражает клетку, молекула MHC связывается с частью вируса или антигена и отображает антиген на поверхности клетки.
Клетки, способные отображать антиген с помощью MHC, называются антигенпрезентирующими клетками. Каждая молекула MHC, отображающая антиген, распознается подходящим или совместимым рецептором Т-клеток. Таким образом, антигенпрезентирующая клетка способна сообщать Т-клетке о том, что может происходить внутри клетки.Однако для того, чтобы Т-клетка ответила на чужеродный антиген на МНС, другая молекула на антигенпрезентирующей клетке должна послать второй сигнал Т-клетке. Соответствующая молекула на поверхности Т-клеток распознает второй сигнал. Эти две вторичные молекулы антигенпрезентирующей клетки и Т-клетки называются костимулирующими молекулами.
Существует несколько различных наборов костимулирующих молекул, которые могут участвовать во взаимодействии антигенпрезентирующей клетки с Т-клеткой.Как только MHC и рецептор Т-клетки взаимодействуют, а костимуляторные молекулы взаимодействуют, существует несколько возможных путей, по которым может идти Т-клетка. К ним относятся активация, толерантность или гибель Т-клеток. Последующие шаги частично зависят от того, какие костимуляторные молекулы взаимодействуют и насколько хорошо они взаимодействуют. Поскольку эти взаимодействия настолько важны для реакции иммунной системы, исследователи интенсивно изучают их, чтобы найти новые методы лечения, которые могли бы контролировать или останавливать атаку иммунной системы на собственные ткани и органы.Цитокины и хемокины Один из способов ответа Т-клеток после взаимодействия МНС и Т-клеточного рецептора и взаимодействия костимулирующих молекул — это секретирование цитокинов и хемокинов. Цитокины — это белки, которые могут вызывать активацию, рост или гибель окружающих клеток иммунной системы. Они также могут влиять на ткани неиммунной системы.
5 страниц, 2035 слов
Курсовая работа о последних достижениях в области лекарственной обработки иммунной системы
ВВЕДЕНИЕ Чтобы предоставить подробный анализ недавних фармакологических разработок, касающихся иммунной системы человека, в первую очередь необходимо представить врожденный и адаптивный иммунные ответы.Иммунодепрессанты и иммуномодуляторы будут различаться, и будет предоставлен выбор новых и часто экспериментальных препаратов, принадлежащих к каждой категории. Конкретные препараты будут …
Например, некоторые цитокины могут способствовать утолщению кожи, которое происходит у людей со склеродермией. Хемокины — это небольшие молекулы цитокинов, которые привлекают клетки иммунной системы. Избыточное производство хемокинов способствует инвазии и воспалению органа-мишени, которое возникает при аутоиммунных заболеваниях.Например, избыточное производство хемокинов в суставах людей с ревматоидным артритом может привести к вторжению в суставное пространство деструктивных клеток иммунной системы, таких как макрофаги, нейтрофилы и Т-клетки. Антитела В-клетки — еще один важный тип клеток иммунной системы. Они участвуют в удалении чужеродных антигенов из организма, используя поверхностную молекулу для связывания антигена или создавая специфические антитела, которые могут искать и уничтожать специфические чужеродные антигены. Однако В-клетка может вырабатывать антитела только тогда, когда она получает соответствующий командный сигнал от Т-клетки.Как только Т-клетка сигнализирует В-клетке о типе цитокина, который действует как молекула-мессенджер, В-клетка может продуцировать уникальное антитело, нацеленное на конкретный антиген.
Иммунные комплексы и система комплемента Когда многие антитела связываются с антигенами в кровотоке, они образуют большую решетчатую сеть, называемую иммунным комплексом. Иммунные комплексы вредны, когда они накапливаются и вызывают воспаление в мелких кровеносных сосудах, которые питают ткани. Иммунные комплексы, иммунные клетки и воспалительные молекулы могут блокировать кровоток и в конечном итоге разрушать такие органы, как почки.Это может произойти у людей с системной красной волчанкой. Группа специализированных молекул, образующих систему комплемента, помогает удалить иммунные комплексы. Различные типы молекул системы комплемента, которые находятся в кровотоке и на поверхности клеток, делают иммунные комплексы более растворимыми. Молекулы комплемента предотвращают образование и уменьшают размер иммунных комплексов, чтобы они не накапливались в неправильных местах, таких как органы и ткани тела.
3 страницы, 1180 слов
Очерк сердечно-сосудистой и иммунной / лимфатической систем
1.Какие признаки и симптомы проявлял Грег, когда он был в доме? Некоторыми признаками и симптомами, которые испытал Грег, были жажда, головокружение и тургор. 2. Прав ли миссис Майрон, когда сказала, что Грег обезвожен? Какие признаки и симптомы согласуются с этим представлением? Миссис Майрон считала, что обращаться за медицинской помощью нет необходимости. Как вы думаете, она была права? Я считаю, что миссис Майрон была …
В редких случаях некоторые люди наследуют дефектные гены молекулы комплемента от своих родителей.Поскольку эти люди не могут производить нормальное количество или тип молекулы комплемента, их иммунная система неспособна предотвратить отложение иммунных комплексов в различных тканях и органах. У этих людей развивается заболевание, которое не является аутоиммунным, но напоминает красную волчанку. Генетические факторы Генетические факторы могут влиять на иммунную систему человека и ее реакцию на чужеродные антигены несколькими способами. Гены определяют разнообразие молекул MHC, которые люди переносят в свои клетки.Гены также влияют на потенциальный массив Т-клеточных рецепторов, присутствующих на Т-клетках.
Фактически, некоторые гены MHC связаны с аутоиммунными заболеваниями. Однако гены — не единственные факторы, влияющие на предрасположенность человека к аутоиммунному заболеванию. Например, у некоторых людей, несущих в своих клетках ассоциированные с заболеванием молекулы MHC, не разовьется аутоиммунное заболевание.
.