Обмен аминокислот Функции аминокислот:
Структурная – синтез белков организма (до 400 г/сут). (Кол-во белков взрослого человека ~ 12-15 кг).
Анаболическая – предшественники биологически активных соединений (гормоны, нуклеотиды, гем, креатин, карнитин, фосфолипиды, нейромедиаторы и др.)
Энергетическая – источники энергии в экстремальных условиях (длительное голодание, избыточное потребление белков с пищей).
Источники свободных аминокислот в клетках:
Белки пищи (основной источник), распад собственных белков тканей, синтез аминок-т из глюкозы и метаболитов ОПК.
Биологическая роль аминокислот:
Пул свободных
аминокислот организма составляет 30—100
г, содержание их в крови — в среднем
35—65 мг/дл.
Азотистый баланс
~95% всего азота организма содержат аминокислоты.
Поэтому, состояние белкового и аминокислотного обмена оценивается по азотистому балансу.
Азотистый баланс – это разница между кол-вом азота, поступающим с пищей, и выводимым из организма.
N выводится из организма в виде мочевины и аммонийных солей почками.
Нулевой (азотистое равновесие) – количество азота, поступающего в сутки с пищей равно количеству азота, выводимого из организма.
Характерен для взрослого здорового человека при сбалансированном питании.
Положительный – количество азота, поступающего в сутки с пищей больше, чем выводится из организма.
Характерен для
детей, а также для людей, выздоравливающих
после тяжелого заболевания. Также
встречается при обильном белковом
питании; в период беременности.
Также
встречается при обильном белковом
питании; в период беременности.
Кроме того, характерен при восстановлении после предшествующего голодания.
Отрицательный – количество азота, выводимого в сутки из организма превышает его поступление с пищей.
Характерен при тяжелом заболевании, при старении, а также при голодании.
Для поддержания азотистого равновесия: минимальное кол-во белков в пище ~ 30—50 г/сут; при большой физической нагрузке ~ 120—150 г/сут.
Пищевая ценность белков
Выделяют 4 группы, на которые делятся все аминокислоты по возможности синтеза в организме:
Заменимые аминокислоты – синтезируются в организме в кол-ве достаточном для нужд организма: Ала, Про, Гли, Сер, Асн, Асп, Глн, Глу
Незаменимые аминокислоты – не синтезируются в организме: Вал, Лей, Иле, Мет, Фен, Три, Тре, Лиз
Частично-заменимые аминокислоты – синтезируются в организме, но в кол-ве, недостаточном для нужд организма: Арг, Гис
Условно-заменимые аминокислоты – синтезируются из незаменимых аминокислот: Цис (из Мет), Тир (из Фен)
Пищевая ценность
белков определяется способностью
перевариваться в ЖКТ и содержанием
незаменимых аминокислот.
Например, белки яиц, молока, мяса перевариваются полностью;
Растительные белки, особенно злаков, полностью, как правило, не перевариваются.
Фибриллярные белки (волос, шерсти, ногтей и т.п.) не перевариваются.
Белки, способные перевариваться в ЖКТ, по пищевой ценности делятся на:
Полноценные – белки, в которых содержатся все незаменимые и частично заменимые аминокислоты.
(Многие животные белки: белки мяса, яичный альбумин, казеин молока)
Неполноценные – белки, в которых нет хотя бы одной незаменимой аминокислоты.
(В основном, растительные белки, в которых редко встречаются: Мет, Лиз, Три, Тре)
Глава 23. Обмен аминокислот. Динамическое состояние белков организма
Глава 23. Обмен аминокислот. Динамическое состояние белков организма
Обмен аминокислот. Динамическое состояние белков организма
Значение аминокислот для организма в первую очередь заключается в том, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и внешней средой. Аминокислоты непосредственно участвуют в биосинтезе большого количества других биологически активных соединений, регулирующих процессы обмена веществ в организме, таких как нейромедиаторы и гормоны. Аминокислоты служат донорами азота при синтезе всех азотсодержащих небелковых соединений, в том числе нуклеотидов, гема, креатина, холина и др.
Рис. 23.1. Общая схема метаболизма аминокислот в организме
Катаболизм аминокислот является источником энергии для синтеза АТФ. Энергетическая функция аминокислот становится значимой при голодании, некоторых патологических состояниях (сахарный диабет). Именно обмен аминокислот осуществляет взаимосвязь многообразных химических превращений в живом организме.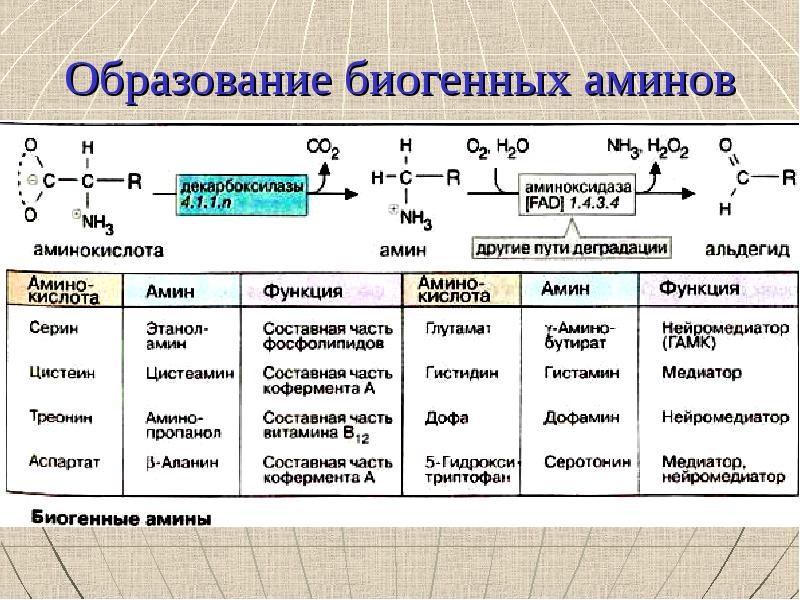
Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека составляет примерно 15 кг.
Какой-либо специальной формы депонирования аминокислот и белков, подобно глюкозе или жирным кислотам не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Период полураспада белков различен – от нескольких минут до нескольких суток. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируется только углеродная часть молекулы, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
Показателем, отражающим интенсивность аминокислотного обмена, является азотистый баланс – разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей).
Переваривание белков в желудочно-кишечном тракте
Переваривание белков начинается в желудке под действием ферментов желудочного сока. За сутки его выделяется до 2,5 литров и он отличается от других пищеварительных соков сильно кислой реакцией, благодаря присутствию свободной соляной кислоты, секретируемой обкладочными клетками слизистой желудка.
Секреция соляной кислоты представляет активный транспорт, осуществляемый протонной АТФ-азой с затратой АТФ.
Роль соляной кислоты:
1. денатурирует белки;
2. стерилизует пищу;
3. вызывает набухание труднорастворимых белков;
4. активирует пепсиноген;
5. создает рН-оптимум для действия пепсина;
6. способствует всасыванию железа;
7. вызывает секрецию секретина в двенадцатиперстной кишке.
В желудочном соке содержатся протеолитические ферменты пепсин, гастриксин и реннин. Главным из них является пепсин. Он вырабатывается главными клетками слизистой желудка в виде профермента пепсиногена. Активация его осуществляется соляной кислотой (медленная) и аутокаталитически пепсином (быстрая) путем отщепления фрагмента полипептидной цепи с N-конца (частичный протеолиз). При этом происходит изменение конформации молекулы и формирование активного центра. Пепсин действует при значениях рН 1,5–2,5 и является эндопептидазой с относительной специфичностью действия, расщепляющей пептидные связи внутри белковой молекулы.
Активация его осуществляется соляной кислотой (медленная) и аутокаталитически пепсином (быстрая) путем отщепления фрагмента полипептидной цепи с N-конца (частичный протеолиз). При этом происходит изменение конформации молекулы и формирование активного центра. Пепсин действует при значениях рН 1,5–2,5 и является эндопептидазой с относительной специфичностью действия, расщепляющей пептидные связи внутри белковой молекулы.
Кроме пепсина в желудочном соке содержится фермент гастриксин, проявляющий протеолитическую активность при рН 3,0–4,0. По-видимому, именно он начинает переваривание белков.
В желудочном соке грудных детей содержится фермент реннин, который имеет большое значение для переваривания белков у грудных детей, т.к. катализирует створаживание молока (превращение растворимого казеиногена в нерастворимый казеин), в результате чего замедляется продвижение нерастворимого казеина в двенадцатиперстную кишку и он дольше подвергается действию протеаз.
Образовавшиеся в результате действия пепсина в желудке полипептиды поступают в двенадцатиперстную кишку, куда выделяется сок поджелудочной железы.
В панкреатическом соке содержатся протеолитические ферменты трипсин, химотрипсин, карбоксипептидаза и эластаза, которые вырабатываются также в виде проферментов. Трипсиноген активируется энтерокиназой (вырабатывается клетками слизистой двенадцатиперстной кишки), переходит в активный трипсин, который активирует все остальные ферменты поджелудочного и кишечного сока. Клетки поджелудочной железы защищены от действия протеаз тем, что ферменты желудочного сока образуются в виде неактивных предшественников, а в панкреас синтезируется особый белок-ингибитор трипсина. В полости ЖКТ протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами.
Переваривание продуктов протеолиза пищевых белков в тонком кишечнике осуществляется с помощью амино-, ди-, и трипептидаз, которые функционируют преимущественно пристеночно.
Таким образом, конечными продуктами переваривания белков в ЖКТ являются свободные аминокислоты, которые всасываются.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесОбмен белков в организме — анализы на белки, симптомы, лечение
directions
Белки являются одними из сложнейших веществ организма и служат основой протоплазмы клеток. В их состав помимо углерода, кислорода, водорода и азота входят и аминокислоты. Последние дают основу для построения молекул белков. Они играют огромную роль в человеческом организме и отвечают за важнейшие функции: дыхание, выделения, пищеварение, движение, защитную, обеспечивают организм необходимой энергией и восполняют компоненты клетки. Нарушение обмена белка развивается в том случае, если в организм поступает его большее либо меньшее количество. На этой почве могут возникать различные опасные заболевания, поэтому при малейшем подозрении необходимо своевременно сделать все тесты.
Последние дают основу для построения молекул белков. Они играют огромную роль в человеческом организме и отвечают за важнейшие функции: дыхание, выделения, пищеварение, движение, защитную, обеспечивают организм необходимой энергией и восполняют компоненты клетки. Нарушение обмена белка развивается в том случае, если в организм поступает его большее либо меньшее количество. На этой почве могут возникать различные опасные заболевания, поэтому при малейшем подозрении необходимо своевременно сделать все тесты.
Врачи-специалисты
Старшая медицинская сестра
Медицинская сестра
Медицинская сестра эндоскопического кабинета
Врач-терапевт
Медицинская сестра процедурной
Анализ на коронавирус методом ПЦР. Результат в течение суток
Результат в течение суток
Наши клиники в Санкт-Петербурге
Медицентр Юго-ЗападПр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону +7 (812) 640-55-25
Анализы на белки
Альбумин является основным белком плазмы крови. Его синтез происходит в печени. Главная задача, которую выполняет альбумин, заключается в поддержании давления плазмы относительно объёма крови. Вместе с этим он осуществляет доставку различных веществ и их депонирование. Его сниженный уровень говорит о протекании в организме патологических процессов.
Его синтез происходит в печени. Главная задача, которую выполняет альбумин, заключается в поддержании давления плазмы относительно объёма крови. Вместе с этим он осуществляет доставку различных веществ и их депонирование. Его сниженный уровень говорит о протекании в организме патологических процессов.
Белковые фракции – комплексный анализ, позволяющий оценить наличие в плазме крови альбумина и глобулинов. Исследование назначается при патологии почек и печени, онкологических и системных заболеваниях, нарушениях питания, а так же хронических и острых воспалительных заболеваниях.
Креатинин представляет собой конечный продукт обмена белков. Принимает участие в энергетическом обмене тканей. Из организма выводится вместе с мочой, поэтому по анализу можно судить о состоянии почек. Высокий уровень указывает на наличие почечной недостаточности, обезвоживании организма, мясной диете.
Мочевая кислота занимается выведение азота из организма. Нарушение её обмена напрямую связано со сбоем в работе почек.
Нарушение её обмена напрямую связано со сбоем в работе почек.
Мочевина вырабатывается в печени. Во время её синтеза обезвреживается аммиак. Анализ мочевины в крови может выявить наличие множество опасных заболеваний, требующих срочного лечения, таких как: злокачественные опухоли, заболевания почек, ожоги, лейкоз, почечная недостаточность, цирроз, гепатит, печёночная недостаточность.
Общий белок – органический полимер, который состоит из аминокислот. Его определение в плазме крови позволяет судить о заболеваниях почек, печени, нарушении питания и онкологических заболеваниях.
Тимоловая проба позволяет дать характеристику работе печени. Повышение результатов исследования возникает в случаях, когда у человека: гепатит А, малярия, токсический гепатит, вирусные инфекции, цирроз печени.
Во время беременности очень часто встречается отличное от нормы значение анализов на белки в организме.
Какие симптомы нарушения обмена белков?
Различают несколько видов нарушения содержания белков в плазме крови: гиперпротеинемия означает увеличение его количества, а гипопротеинемия – уменьшение. Повышенное содержание белка может быть как наследственным, так и приобретённым заболеванием. При нарушении в обмене нуклеиновых кислот возникает подагра.
Повышенное содержание белка может быть как наследственным, так и приобретённым заболеванием. При нарушении в обмене нуклеиновых кислот возникает подагра.
Симптомы нарушений обмена белка:
- Избыточное потребление белка может проявляться в виде:
- запора либо поноса;
- отвращения к еде;
- повышенного содержания белков в плазме крови;
- дисбактериоза кишечника;
- Низкое потребление белка может проявляться в виде двух различных заболеваний:
- Квашиоркор – это несбалансированный алиментарный недостаток белка в человеческом организме. К симптомам заболевания можно отнести: отёки, вялость, апатию, низкую массу тела, асцит, задержку развития, иммунодефицит, пониженное содержание белков в крови. Прогноз при возникновении этого заболевания неблагоприятный и очень часто больные умирают. Чаще всего развивается у детей от 1го до 4-х лет.
 Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами.
Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами. - Алиментарная дистрофия – сбалансированная недостаточность. Симптомы возникновения заболевания: отёки, содержание белка в крови на нижней границе, низкая масса тела, иммунодефицит, повышенное содержание кетоновых тел. Для алиментарной дистрофии нехарактерна задержка физического и умственного развития. В отличие от квашиоркора при дистрофии прогноз для заболевших наиболее благоприятный, однако так же встречаются случаи со смертельным исходом. Наблюдается у детей в возрасте до одного года.
- Для несбалансированного питания, при котором происходит дефицит незаменимых аминокислот, характерна: низкая масса тела, нарушение развития и роста, плохой аппетит. В случае недостаточного содержания в организме какой-либо аминокислоты симптомы могут носить специфический характер, влияющий на различные органы и провоцирующий появление заболеваний.

- Избыточное содержание аминокислот так же плохо влияет на организм. Оно проявляется в виде снижения аппетита и массы тела, нарушения вкусовых рецепторов, а так же питания тканей и органов.
Как лечится нарушение обмена белков?
После точной постановки диагноза лечение назначается специалистом для каждого пациента индивидуально. В случае алиментарной дистрофии в первые дни необходимо соблюдать абсолютный покой. Не должно возникать психических и физических нагрузок. Питание при этом должно быть полноценным, богатым витаминами и белками. Вместе с тем расширение рациона происходит постепенно, чтобы организм смог адаптироваться к новому режиму приёма пищи. Вводятся белковые препараты и назначаются анаболические стероидные гормоны. При подагрическом артрите применяются противовоспалительные препараты.
735,1312,1307,871,1272,1269
Локотош Сергей Владимирович 06. 01.2021
22:19
01.2021
22:19 medi-center.ru
Хочу выразить благодарность Вашей клинике и доктору Герасименок Григорию Александровичу. Первый раз записался в Вашу клинику и не пожалел о своём выборе. Доктор был мне назначен Герасименок Г.А -выслушал, осмотрел внимательно, быстро установил диагноз,назначил правильное лечение. А сотрудники клиники по телефону интересовались состоянием здоровья (впервые встречаю такое отношение к пациентам). Большое спасибо сотрудникам клиники и особенно доктору Герасименок Григорию Александровичу.
Добрый день !
Хочу всех поздравить с наступившим Новым годом, пожелать всем хочу здоровья и благополучия.Но особенно хочу поздравить доктора клиники в Мурино , на Охтинской аллее-это доктор Султанга Валерия Дмитриевна.
Уважаемая Валерия Дмитриевна!
Хочу выразить Вам свою огромную благодарность за колоссальную помощь, за отзывчивость, за качественное лечение, за врачебную этику и за профессионализм своего дела. В нелегкий для моей жизни момент мне очень повезло встретить мудрого и чуткого специалиста. Спасибо Вам огромное за поддержку и профессиональное лечение.
Спасибо Вам за Вашу бесконечную доброту и теплое отношение. Желаю Вам всего самого наилучшего и только благодарных пациентов.От всей души хочу сказать Вам «большое спасибо». Вы — врач от Бога.Благодарю Вас за Ваше доброе сердце , за оказанную помощь, за возможность полноценной жизни и за добрую надежду моей души. Желаю Вам достатка и здоровья в Новом году , сил и безграничных возможностей, подаренных судьбой.
Очень хотелось бы , что бы руководство клиники замечала таких докторов и каким то образом премировала таких уникальных по своей доброте людей , ведь такие доктора как Валерия Дмитриевна-уникальны , несмотря на то что это молодой доктор- она к каждому пациенту относится как к родному, со своим подходом, и восхищает своей самоотдачей любимому делу!
Еще раз благодарю доктора и от всей души ей всех благ и сил и терпения.
В нелегкий для моей жизни момент мне очень повезло встретить мудрого и чуткого специалиста. Спасибо Вам огромное за поддержку и профессиональное лечение.
Спасибо Вам за Вашу бесконечную доброту и теплое отношение. Желаю Вам всего самого наилучшего и только благодарных пациентов.От всей души хочу сказать Вам «большое спасибо». Вы — врач от Бога.Благодарю Вас за Ваше доброе сердце , за оказанную помощь, за возможность полноценной жизни и за добрую надежду моей души. Желаю Вам достатка и здоровья в Новом году , сил и безграничных возможностей, подаренных судьбой.
Очень хотелось бы , что бы руководство клиники замечала таких докторов и каким то образом премировала таких уникальных по своей доброте людей , ведь такие доктора как Валерия Дмитриевна-уникальны , несмотря на то что это молодой доктор- она к каждому пациенту относится как к родному, со своим подходом, и восхищает своей самоотдачей любимому делу!
Еще раз благодарю доктора и от всей души ей всех благ и сил и терпения. С уважением Анна Н.
С уважением Анна Н.
medi-center.ru
Искренне от всей души хочу поблагодарить врача Азизова Магомеда Алиевича Долгие годы страдала от варикоза вен Не знала к какому врачу обратиться Стала искать в интернете специалистов Мне очень повезло, отличный врач Магомед Алиевич, скорее всего врач от бога И я очень довольна лечением, что попала именно к этому врачу Лечение проходило безболезненно.и аккуратно Все понятно обьяснил, комментировал каждое движение Ответил на все интересующиеся вопросы Спасибо за профессионализм и чуткое отношение к пациентам
Здравствуйте!
Выражаю благодарность всем сотрудникам медцентра и лично Поддубной Анастасии Михайловне за работу в такое непростое время, хорошие и результативные рекомендации по лечению. Переболел COVID, благодаря вам иду на поправку!
Переболел COVID, благодаря вам иду на поправку!
Добры день всем, хочу выразить благодарность врачу-неврологу Братановой Ирине Валерьевне. На прием пришел с параличом лицевого нерва, левая сторона лица была практически парализована. Как оказалось, иглорефлексотерапия вполне успешно лечит такие болезни, спустя пару сеансов были заметны изменения в лучшую сторону, а на 8-9-м все пришло в норму, считаю это не только своей заслугой, но и врача :). Цены на ИРТ по району кстати довольно умеренные, а клиника на ул.Поликарпова 6 произвела хорошее впечатление.
Здравствуйте! Обратилась сегодня в травмпункт на Поликарпова с непонятной болью в ноге. Начиная с работы администратора и заканчивая работой врача-все на высшем уровне: персонал вежливый,внимательный и с хорошим чувством юмора. Доктор подробно расспросил,провел диагностику и в деталях рассказал,какая у меня проблема и что делать дальше. Назначили лечение.никакого высокомерия и мрачности(как это обычно бывает в других больницах). Обратилась к незнакомым людям,а расстались добрыми друзьями. Спасибо Медицентр! Теперь только к вам!
Обратилась к незнакомым людям,а расстались добрыми друзьями. Спасибо Медицентр! Теперь только к вам!
Применение кетокислот при хронической болезни почек » Библиотека врача
ГБОУ ВПО «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации, кафедра внутренних болезней с основами общей физиотерапии № 2
В обзоре проведен анализ крупных исследований, оценивавших эффективность назначения кетокислот с целью торможения хронической болезни почек (ХБП). Проведена оценка влияния кетокислот на снижение скорости клубочковой фильтрации, продемонстрировано преимущество кетокислот перед эссенциальными аминокислотами. Отмечено, что применение кетокислот способствует сохранению нормального уровня альбумина крови и регрессу параметров белково-энергетической недостаточности и метаболического ацидоза. Сделан вывод о том, что применение кетокислот в комплексной терапии больных с ХБП способствует лучшему контролю факторов риска, ассоциирующихся с повышенной смертностью.
Почка принимает активное участие в обмене аминокислот. В течение дня выделяется и реабсорбируется в проксимальных канальцах почек порядка 300 ммоль аминокислот. Почечное повреждение существенным образом влияет на белковый обмен, определяя высокий риск развития белково-энергетической недостаточности при хронической болезни почек (ХБП), а также вызывая ретенцию в организме конечных продуктов обмена белка, что вносит существенный вклад в развитие уремической интоксикации [22].
В комплексной терапии больных ХБП 3Б–5-й ст. применяются кетоаналоги аминокислот (кетокислоты) при малобелковой (МБД) или строгой низкобелковой диете (НБД) [3]. С учетом широкого распространения лечебного питания представляется целесообразным рассмотреть мотивы и обстоятельства этой терапии.
Кетокислоты применяются уже более 40 лет в лечении больных хронической почечной недостаточностью (ХПН). В 1975 г. исследование М. Walser, продемонстрировавшее способность НБД в сочетании с кетоаналогами аминокислот замедлять прогрессирование ХПН, явилось толчком для активизации исследований в данной области [46]. Это в последующем привело к организации и проведению Национальным институтом здоровья США исследования Modification of Diet in Renal Disease (MDRD).
Кетокислоты получаются искусственным путем вследствие преобразования аминокислот. В процессе получения кетокислот первым этапом служит трансаминирование, включающее удаление аминогруппы (Nh3) с заменой на кето- или оксигруппу. Кетокислоты, полученные в процессе трансаминирования, могут подвергаться деградации путем окисления [37]. Также возможен обратный процесс трансамирования кето- и гидроксикислот за исключением лизина и треонина с преобразованием их обратно в аминокислоты. Процесс трансаминирования кето- и гидроксикислот дозозависим, соответственно, концентрация аминокислот в крови повышается после введения в организм кето- и гидроксикислот [41]. В этом процессе участвуют циркулирующие аминогруппы, тем самым предупреждается их инкорпорирование в мочевину и потенциально токсичные нитросоединения.
Большинство препаратов кето/аминокислот включает кетоаналоги валина, лейцина, изолейцина, фенилаланина, а также гидроксианалоги триптофана, гистидина, треонина и лизина.
На международном рынке широко известен препарат Кетостерил, который содержит в одной таблетке:
- изолейцина α-кетоаналог (DL-метил-оксо-2-кальций валеринат) – 67 мг;
- лейцина α-кетоаналог (метил-4-оксо-2-кальций валеринат) – 101 мг;
- фенилаланина α-кетоаналог (оксо-2-фенил-3-кальций пропионат) – 68 мг;
- валина α-кетоаналог (метил-оксо-2-кальций бутират) – 86 мг;
- метионина α-гидроксианалог (DL-гидрокси-2-кальций метилбутират) – 59 мг;
- L-лизина моноацетат – 105 мг;
- L-треонин – 53 мг;
- L-триптофан – 23 мг;
- L-гистидин – 38 мг;
- L-тирозин – 30 мг.
Говоря о дозе кетокислот, следует отметить, что она должна составлять 0,28–0,3 г/кг/сут. Именно…
М.М. Батюшин
Внутриклеточный обмен аминокислот. Общие пути катаболизма : Farmf
ВНУТРИКЛЕТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ
ОБЩИЕ ПУТИ КАТАБОЛИЗМА АМИНОКИСЛОТ
Реакции переаминирования
Распад большинства аминокислот начинается с переаминирования. Эти реакции не высвобождают аммиак, а переносят аминогруппу с аминокислоты на кетокислотный акцептор. Трансаминазы используют пиридоксальфосфат в качестве коэнзима. Это главный
путь удаления азота у аминокислот. Существуют трансаминазы для большинства аминокислот. После поступления пищевых аминокислот из воротной вены печень трансаминирует значительную часть аминокислот. Исключением являются аминокислоты с разветвленным углеводородным радикалом, для них в печени нет соответствующей трансаминазы. Концентрация таких аминокислот в крови, оттекающей от печени, выше, чем в системе воротной вены.
Стратегия реакции переаминирования — перенос аминогруппы от различных групп донорных аминокислот на ограниченное число альфа-кетокислотных акцепторов, что позволяет выделить центральный путь метаболизма аминокислот. Большинство трансаминаз использует альфа-кетоглутаровую кислоту как основной акцептор аминогруппы. Трансаминазы обычно называют по аминокислотам, которые служат донором аминогруппы.
Субстратная специфичность трансаминаз. Каждая трансаминаза специфична для одного или нескольких аминокислотных доноров.
Акцептором аминогруппы для большинства трансаминаз является -кетоглутаровая кислота. Однако оксалоацетат и ПВК также можно рассматривать в качестве важных акцепторов аминогрупп.
Реакции дезаминирования
Отщепление аминогруппы у аминокислоты называют дезаминированием. Различают два типа реакций: прямое и непрямое дезаминирование. Имеется несколько типов прямого дезаминирования. Эти реакции генерируют свободный аммиак — токсическое соединение, подлежащее связыванию и обезвреживанию.
Прямое дезаминирование:
Выделены ферменты, катализирующие окислительное дезаминирование с участием флавиновых коферментов. Эти ферменты обладают выраженной специфичностью к D- и
L-аминокислотам. Они получили название оксидаз аминокислот из-за их способности взаимодействовать с молекулярным кислородом с образованием пероксида водорода. Особо высокой активностью в клетках обладают оксидазы D-аминокислот. Окислительное дезаминирование L-аминокислот при помощи оксидаз аминокислот у большинства млекопитающих обнаружено только в печени и почках. Некоторые из этих реакций не играют важной роли у человека, а некоторые аминокислоты дезаминируются при помощи специальных реакций.
Окислительное дезаминирование глутаминовой кислоты с образованием -кетоглу-тарата и аммиака:
Эта реакция протекает с участием НАД+ или НАДФ+. Фермент — глутаматдегидрогеназа присутствует в митохондриальном матриксе в высоких концентрациях и обладает высокой активностью. Аммиак, полученный в печеночных митохондриях, используется для синтеза мочевины.
Пути обезвреживания аммиака в организме — синтез глутамина и мочевины.
1. Синтез глутамина. Реакция катализируется глутаминсинтетазой:
Распределение и субклеточная локализация. Реакция протекает в цитозоле клеток всех тканей, но особенно выражена в мозге, где аммиак наиболее токсичен, и мышцах, где обмен белков мышц сопровождается образованием значительных количеств аммиака.
Функции глутамина:
a) во всех тканях глутамин является донором азота для синтеза важных молекул, в частности, для пуринового и пиримидинового синтеза;
б) является нетоксичной формой транспорта аммиака из разных тканей к клеткам печени, где он превращается в мочевину;
в) в кишечнике служит источником энергии для энтероцитов;
г) в почках участвует в поддержании кислотно-щелочного равновесия. Гидролиз амидной группы в боковой цепи глутамина глутаминазой позволяет связывать протоны. Это особенно важно в условиях метаболического ацидоза.
2. Синтез мочевины. Печень — единственный орган, клетки которого содержат все ферменты синтеза мочевины и, следовательно, являются главным местом ее синтеза. Участвуют митохондриальные ферменты и ферменты цитозоля.
Суммарная реакция синтеза мочевины:
Энергетический баланс. 3 молекулы АТФ расходуется на синтез каждой молекулы мочевины.
- Синтез карбамоилфосфата (происходит в митохондриях):
2. Орнитиновый цикл мочевинообразования:
Реакции декарбоксилирования
Синтез серотонина:
Биологическая роль серотонина:
1. Центральное действие (ЦНС) — повышение аппетита, регуляция памяти, настроения, поведения, функций сердечно-сосудистой и эндокринной систем.
2. Периферическое действие — активирует перистальтику, повышает агрегацию тромбоцитов, проницаемость мелких сосудов, оказывает радиопротекторное действие.
Синтез гистамина:
Биологическая роль гистамина: повышает тонус гладкой мускулатуры, расширяет капилляры, снижает АД, повышает секрецию желудка и выделение желчи, участвует в развитии воспаления и развитии боли.
Синтез γ-аминомасляной кислоты (ГАМК):
Биологическая роль ГАМК: медиатор торможения.
Синтез дофамина, норадреналина и адреналина:
Биологическая роль катехоламинов: увеличивают потребление кислорода клетками, органами и организмом; повышают активность ферментов цикла Кребса, дыхательной цепи; стимулируют синтез АТФ; повышают АД.
Биохимики РФ выяснили, что при недостатке кислорода в мозге беременных нарушается обмен аминокислот
Российские биохимики обнаружили, что при недостатке кислорода в мозге беременных нарушается обмен аминокислот, что может оказать влияние на весь организм, сообщает РИА Новости. Результаты исследования опубликованы в журнале Cells.
Каждая десятая беременность осложнена недостаточным снабжением организма матери и плода кислородом. Сопутствующие патологии развития эмбриона активно изучаются, но до последнего времени мало что было известно про влияние этого фактора на организм матери.
Чтобы понять, каким образом можно снизить чувствительность женщины к недостатку кислорода, российские ученые из Московского государственного университета исследовали и описали клеточные процессы, протекающие в мозге беременных крыс, и выяснили, что ключевую роль в этих процессах играют аминокислоты. Исследования поддержаны Российским научным фондом (РНФ).
Мозг — сложный природный объект, в котором аминокислоты — составные части белков, и их производные — служат для передачи и регуляции сложнейших сигналов. Даже небольшие изменения в уровне этих веществ в мозге могут повлиять на весь организм.
Например, при возникновении опасности должны срабатывать определенные защитные механизмы, однако недостаток аминокислот, «включающих» эти системы, может привести к неадекватной реакции и даже гибели организма. Известно также, что изменения уровней и нарушения превращений аминокислот в мозге приводят к неврологическим расстройствам, поскольку эти молекулы служат для передачи сигналов между клетками мозга.
Ученые разработали подход, позволяющий измерить содержание в мозге аминокислот и описать их участие в разных клеточных процессах. Они изучили, как меняется уровень этих веществ у 17 беременных и 25 небеременных крыс после того, как их помещали в барокамеру, где концентрацию кислорода понижали с обычных 21 процента до 5 процентов. Устойчивость крыс к нехватке кислорода определяли по времени, в течение которого животные могли находиться в таких условиях, не теряя сознание.
Затем исследователи анализировали клетки мозга крыс на содержание и состав аминокислот. Для этого они разделили аминокислоты между собой, окрасив их специальными красителями, и определяли концентрацию каждой молекулы в исследуемых растворах.
Оказалось, что при недостатке кислорода у небеременных крыс уровень 7 из 15 аминокислот в мозге повышался. Это было реакцией организм на изменение условий. Однако в мозге беременных крыс их содержание оставалось на прежнем уровне. Поэтому такие крысы плохо адаптировались к изменившимся условиям и смогли недолго продержаться в камере с низкой концентрацией кислорода.
«В предыдущих исследованиях мы показали, что содержание и превращение аминокислот в мозге крыс тесно связаны с их содержанием в крови. Поэтому, чтобы перейти от исследования мозга животных к медицине, можно изучать соответствующие биохимические параметры в крови людей. Такие проекты помогут развитию персонифицированной медицины и будут иметь значение для широкого спектра патологических воздействий», — приводятся в пресс-релизе РНФ слова руководителя исследования Виктории Буник, ведущего научного сотрудника Научно-исследовательского института физико-химической биологии им. А. Н. Белозерского, профессора факультета биоинженерии и биоинформатики МГУ им. М. В. Ломоносова и профессора Медицинского университета им. И. М. Сеченова.
Роль, обмен и антагонизм разветвлено-цепочечных аминокислот в кормлении животных
10.01.2017Роль, обмен и антагонизм разветвлено-цепочечных аминокислот в кормлении животных
Основные сведения
• Аминокислоты с разветвленными цепочками — лейцин, изолейцин и валин являются строительным материалом для синтеза белков в организме.
• Кроме того, аминокислоты с разветвленными цепочками выполняют важные физиологические функции, в том числе участвуют в поддержке и росте скелетной мускулатуры, в регуляции синтеза белков в организме посредством активации мишени рапамицинового комплекса; служат источником азота для синтеза аланина и глютамина при глюконеогенезе и источником энергии для различных тканей и мускулатуры.
• В отличие от других аминокислот, которые распадаются в печени, аминокислоты с разветвленными цепочками подвергаются распаду (на первой стадии катаболизма) в основном в мышечной ткани. Два первых этапа катаболизма всех трех аминокислот с разветвленными цепочками одинаковые, и в них участвуют одни и те же ферменты.
• Избыток одной из этих аминокислот, особенно лейцина, может привести к эффекту антагонизма, который характеризуется снижением потребления корма и скорости роста как у свиней, так и у птицы. Из-за избытка лейцина в рационе может ускориться катаболизм других аминокислот с разветвленными цепочками, т.к. активируются ферменты распада, и, как следствие, снижается доступность изолейцина и валина для животных.
Введение
Аминокислоты лейцин (Leu), изолейцин (Ile) и валин (Val) имеют уникальную химическую структуру в виде разветвленной цепи, и поэтому их часто называют разветвлено-цепочечными аминокислотами. Подобно другим незаменимым аминокислотам, основная роль данных аминокислот заключается в участии в синтезе белков в организме. Поскольку аминокислоты с разветвленными цепочками не могут синтезироваться в организме животного, они должны поступать с кормом. Данные аминокислоты выполняют важные физиологические функции, особенно велика их роль в синтезе белков мускулатуры.
Обмен разветвлено-цепочечных аминокислот уникален и отличается от обмена других аминокислот тем, что все три аминокислоты с разветвленными цепями имеют сходные два первых этапа катаболизма, в которых участвуют одни и те же ферменты. В отличие от других аминокислот, которые распадаются преимущественно в печени, первый этап катаболизма аминокислот с разветвленными цепочками происходит в скелетной мускулатуре. Углеродный скелет аминокислот с разветвленными цепями используется в различных частях тела, в том числе в мозге и мышцах.
Хотя аминокислоты с разветвленными цепочками необходимы для нормального роста, избыток одной из них, особенно Leu, может привести к эффекту антагонизма. Известно, что антагонизм аминокислот с разветвленными цепочками снижает потребление корма и продуктивность у некоторых видов животных, в том числе у свиней и птицы. Особенно остро проблема подавления роста из-за эффекта антагонизма (избыток Leu) стоит при использовании клеток крови, высушенных методом распыления, в которых содержится очень много Leu и совсем мало Ile, в рационе поросят. Важно понять основные механизмы для того, чтобы выработать оптимальные стратегии кормления. Из-за избытка лейцина в рационе может ускориться катаболизм других аминокислот с разветвленными цепочками, т.к. активируются ферменты распада, и, как следствие, снижается доступность изолейцина и валина для животных. Таким образом, данная обзорная статья посвящена описанию функций и обмена аминокислот с разветвленными цепочками в кормлении животных и обсуждению основных механизмов, лежащих в основе их антагонизма.
Функции и обмен разветвлено-цепочечных аминокислот
Аминокислоты с разветвленными цепочками имеют сходную структуру, при этом в их катаболизме участвуют одни и те же ферменты. Химическая структура таких аминокислот показана на рис. 1.
Рис. 1. Химическая структура аминокислот с разветвленными цепочками
Функции аминокислот с разветвленными цепочками
Поскольку разветвлено-цепочечные аминокислоты являются незаменимыми, их основная функция заключается в участии в синтезе белков организма. Синтез белка в клетке — это сложный контролируемый процесс. В мышечных клетках данный процесс регулируется комплексом мишени рапамицина (mTOR) (Hornberger et al., 2004). На mTOR передается сигнал от внеклеточных молекул, который активирует или подавляет синтез белка (Miyazaki and Esser). Инсулин и инсулиноподобный фактор роста 1 (IGF-1) (Hay and Sonenberg, 2004) могут также запускать синтез белков. IGF-1 — это гормон, сходный по строению с инсулином. Известно, что IGF-1 стимулирует рост свиней (Taylor et al., 1992).
Было показано, что из всех аминокислот с разветвленными цепочками в большей степени Leu вовлечен в регуляцию синтеза белков, проводя сигнал стимуляции синтеза мышечных белков посредством активации mTOR, хотя данный механизм изучен не до конца (Anthony et al., 2000). Было предположено, что другая роль Leu заключается во взаимодействии с инсулином, после чего последний активирует синтез белков мускулатуры, в случае если доступны аминокислоты и энергия корма (Garlick, 2005). Аминокислоты с разветвленными цепочками составляют 40% всех незаменимых аминокислот сыворотки крови и используются скелетной мускулатурой как источник энергии при голодании, во время длительных мышечных нагрузок, для синтеза молока и функционирования молочной железы (Richert et al., 1996; Norton and Layman, 2006). У крыс увеличивается обмен аминокислот с разветвленными цепочками при снижении уровня аденозинтрифосфата (ATP) в мышцах (Shimomura et al., 1995). Таким образом, данные аминокислоты играют важную роль в поддержании и росте скелетной мускулатуры.
Известно, что аминокислоты с разветвленными цепочками являются источником азота (N) для синтеза глутамата и глютамина (Gln) и последующего глюконеогенеза в печени (Matthews et al., 1981; Harper et al., 1984). Глютамин является важным питательным веществом для большинства быстроделящихся клеток, особенно желудочно-кишечного тракта и иммунной системы, но он не стабилен в растворах. Поэтому у людей, часто употребляющих жидкую пищу, наблюдается атрофия желудочно-кишечного тракта. Эту проблему можно решить, вводя парэнтерально питательные вещества, обогащенные аминокислотами с разветвленными цепочками, которые способствуют высвобождению Gln из скелетных мышц и увеличению концентрации Gln в плазме у крыс и человека (McCauley et al., 1990; Abumrad et al., 1982).
Разветвлено-цепочечные аминокислоты также играют важную роль в мозге, являясь источником азота для синтеза глутамата и глютамина (Gln) и источником энергии (Chuang et al., 1995). Глютамин практически не доставляется кровью в мозг. Поэтому мозг должен сам синтезировать Gln. В мозге от 30 до 50% всех α-аминогрупп глутамата и Gln получены только из Leu (Kanamori et al., 1998). Еще одна особенность аминокислот с разветвленными цепями заключается в их плохой растворимости, и поэтому они почти изолированы от водной фракции белков, но хорошо взаимодействуют с другими гидрофобными молекулами, например липидами. Поэтому они являются важным субстратом для синтеза мембранных структур, которые в основном являются гидрофобными (Brosnan and Brosnan, 2006).
Пути обмена аминокислот с разветвленными цепочками
Обмен разветвлено-цепочечных аминокислот отличается от обмена других аминокислот, которые распадаются преимущественно в печени после всасывания через стенки кишечника. Первый этап катаболизма аминокислот с разветвленными цепочками проходит в скелетной мускулатуре (Matthews et al., 1981). Пути катаболизма показаны на рис. 2. Все три аминокислоты имеют сходные два первых этапа катаболизма, в которых участвуют одни и те же ферменты. На первом этапе катаболизма происходит обратимое трансаминирование посредством трансаминазы (BCAT), что приводит к образованию кетокислот на разветвленных цепях (BCKA). BCKA Leu, Ileи Val являются α-кетоизокапроат (KIC), α-кето-β-метилвалерат (KMV) и α-кетоизовалерат (KIV) соответственно.
Рис. 2. Пути катаболизма аминокислот с разветвленными цепями (по данным Brosnan and Brosnan, 2006)
Аффинность трансаминазы к аминокислоте с разветвленными цепями определяется константой Михаэлиса (Km), значение которой зависит от определенной аминокислоты. Значение (Km) самое высокое для Val (самая низкая аффинность), из-за этого данная аминокислота имеет пониженный уровень клиренса из сыворотки крови (Staten et al., 1984; Wiltafsky et al., 2010). Активность трансаминазы аминокислот с разветвленными цепями самая низкая в печени, средняя в сердце, почках и мускулатуре и самая высокая в желудке, поджелудочной железе и молочной железе (Harper et al., 1984; Wiltafsky et al., 2010). Низкая активность трансаминазы в печени приводит к накоплению аминокислот с разветвленными цепями в скелетной мускулатуре (высокая активность трансаминазы), где в основном и происходит катаболизм данных аминокислот. Образованные здесь кетокислоты на разветвленных цепях принимают участие в следующем этапе катаболизма или выбрасываются в кровь и доставляются в печень, где могут быть окислены или использованы в обратном синтезе разветвлено-цепочечных аминокислот (Holecek, 2002).
На следующем этапе катаболизма происходит необратимое окислительное декарбоксилирование дегидрогеназой кетокислот на разветвленных цепях (BCKDH). Этот этап происходит главным образом в печени, т.к. активность BCKDH печени сама высокая, самая низкая — в мускулатуре, мозге и жировой ткани Средний уровень активности BCKDH наблюдается в почках и сердце (Harper et al., 1984; Wiltafsky et al., 2010). Активность BCKDH строго регулируется фосфорилированием (инактивация) и дефосфорилированием (активация) (Shimomura et al., 1990). На данном этапе все кетокислоты разветвленных цепей превращаются в тиоэфиры α-кетоацил-КоA (см. рис. 2). Конечными продуктами Leu являются ацетил-КоА и ацетоацетат, Ile — пропионил-КоА и ацетил-КоА, Val — пропионил-КоА (см. рис. 2). Некоторые кетокислоты разветвленных цепей могут участвовать в цикле Кребса (в форме ацетил-КоА и сукцинил-КоА), где подвергаются окислению или используются в глюконеогенезе в печени. Глюкоза, образованная в печени, выбрасывается в кровь и доставляется в мышцы, где завершается цикл распада (Baker and Mavromichalis, 2000).
Антагонизм разветвлено-цепочечных аминокислот у животных с однокамерным желудком
Антагонизм — это особое взаимоотношение аминокислот, при котором избыток одной аминокислоты приводит к росту потребности в структурно схожей аминокислоте. Хорошо известен антагонизм разветвлено-цепочечных аминокислот и особенно эффект подавления роста при избытке Leu. Полный обзор данной проблемы ранее предоставлен Harper et al. (1984).
Было показано, что избыток Leu в рационе свиней, птицы и крыс приводит к снижению уровня Ile и Val и их α-кетокислот в сыворотке крови (что обусловлено активацией дегидрогеназы кетокислот на разветвленных цепях — BCKDH) и, как следствие, к повышенной деградации Ile и Val (D’Mello and Lewis, 1970; Oestemer et al., 1973; D’Mello, 1975; Smith and Austic, 1978; Edmonds and Baker, 1987; Langer et al., 2000). Основной причиной антагонизма является высокая концентрация α-кетоизокапроата (соответствующая кетокислота на разветвленных цепях Leu), приводящая к усилению катаболизма других аминокислот с разветвленными цепями по средствам активации BCKDH (Harper et al., 1984). По сравнению с Leu, Ile и Val незначительно влияют на активность BCKDH. Например, введение Val или Ile крысам не приводило к активации BCKDH (Aftring et al., 1986).
По данным Edmonds and Baker (1987), потребление корма и прирост живой массы у поросят-отъемышей снижались при скармливании им рациона, содержащего 6, а не 4% Leu. Gatnau et al. (1995) также сообщает о негативном эффекте увеличения содержания Leu в рационе с 1,12 до 3,12% (но не до 2,24%) на потребление корма и прирост живой массы поросят-отъемышей. В данном исследовании отрицательный эффект избытка Leu на продуктивность свиней был менее значителен. Однако проблема антагонизма аминокислот с разветвленными цепями, возникающего при использовании высушенных клеток крови главным образом в рационе свиней, и вопрос оптимального уровня аминокислот с разветвленными цепями в рационе с низким содержанием сырого протеина особенно актуальны в последнее время. Это обусловлено тем, что такие компоненты рациона, как высушенные клетки крови, кровяная мука и кукурузная клейковина, содержат большое количество Leu и ничтожное количество Ile (AMINODat® 4.0, 2010). Если данные компоненты используются как источник белка в рационе, это может привести к антагонизму аминокислот с разветвленными цепями. Действительно, в последние годы были опубликованы данные о замедленном росте свиней при избытке Leu в рационе, в который включены высушенные клетки крови (уровень Leu составлял 4–5% и выше) (Kerr et al., 2004; Fu et al., 2006; Hinson et al., 2007; Fruge et al., 2009). Это связано с тем, что добавление высушенных клеток крови приводит к избытку Leu в рационе и снижению содержания Ile. Однако содержание L-Ile в рационе на уровне стандартизированной илеальной доступности данного белка (содержание лизина 62–66%, доля высушенных клеток крови в рационе — от 6 до 7,5%) не оказывало негативного влияния на продуктивность поросят-отъемышей.
Yin et al. (2010) опубликовал данные о том, что при добавлении L-Leu в рацион поросят-отъемышей (в возрасте 21–35 дней) с низким содержанием белка (содержание сырого белка 16,9%) для увеличения содержания Leu с 1,34 до 1,61% наблюдалось повышение скорости роста на 1,88%, в то время как потребление корма не изменялось. По сравнению с контрольной группой, которая получала высокие концентрации Leu (1,88%) в течение 2 недель, было отмечено увеличение скелетной мускулатуры, печени, сердца, почек, поджелудочной железы, селезенки и желудка. При подробном изучении состава рациона обнаружили, что содержание Val (соотношение Val:Lys — 78%) и Ile (Ile:Lys — 70%) было также значительно выше минимально требуемых норм (NRC, 1998). Из этого можно сделать вывод, что добавление L-Leu в рацион стимулирует синтез белков в организме в том случае, если корм содержит достаточное количество Val и Ile, что позволит избежать антагонизма аминокислот с разветвленными цепями. Однако требуются дальнейшие исследования, чтобы лучше понять эффект высокого содержания аминокислот с разветвленными цепями в корме на продуктивность свиней.
Исследования показали, что у птицы наблюдается взаимодействие аминокислот с разветвленными цепями. Например, опубликованы данные о снижении потребления корма и скорости прироста у цыплят бройлеров из-за скармливания высоких доз Leu (Burnham et al., 1992; Farran et al., 2003). Увеличение количества Val и Ile в рационе приводило к восстановлению потребления корма и скорости роста. Как и у свиней, избыток Leu в рационе приводит к недостатку Val и/или Ile в организме птицы (Allen and Baker, 1972; Smith and Austic, 1978; D’Mello and Lewis, 1970; D’Mello, 1975). D’Mello (1975) также показал, что потребность индеек в Ile и Val увеличивается пропорционально увеличению количества Leu.
Однако другие ученые (например Barbour and Latshaw, 1992; Kidd et al., 2004) не обнаружили негативного влияния повышенного содержания Leu в рационе птицы. Хотя при детальном изучении данных этих авторов выяснилось, что в контрольных рационах содержались повышенные количества Ile, Leu и Val по сравнению с предлагаемыми соотношениями, используемыми в концепции идеального протеина. При скармливании рационов с содержанием Ile, Leu и Val, превышающим соотношение идеального белка к лизину, Waldroup et al. (2002) обнаружил снижение потребления корма и скорости прироста у бройлеров только при самом высоком уровне Leu (3,7%). По данным Erwan et al. (2009), масса тушки не изменяется при увеличении содержания L-Leu в рационе до 2,06%, однако снижается при уровне Leu 2,34%. Согласно Smith and Austic (1978), негативное влияние избытка Leu на рост и концентрацию Ile и Val в крови, которое наблюдается в первые 8 дней эксперимента, в последующем нивелируется, что говорит о возможной способности цыплят приспосабливаться к высоким дозам Leu, что не наблюдалось у свиней. В целом по сравнению со свиньями отрицательные эффекты избытка Leu в рационе птицы не такие значительные или серьезные. Однако некоторые данные можно частично опровергнуть, поскольку в различных экспериментах изучали разные уровни Ile и Val. Снижение продуктивности свиней и птицы из-за антагонизма аминокислот с разветвленными цепочками частично обусловлено снижением потребления корма (Calvert et al., 1982; Fu et al., 2006). Поскольку аминокислоты с разветвленными цепями конкурируют с триптофаном за транспорт через гематоцеребральный барьер в мозг, избыток аминокислот с разветвленными цепями связывают со снижением концентрации триптофана в мозге, что приводит к нарушению синтеза серотонина (нейромедиатора, участвующего в контроле потребления корма) и, как следствие, к нарушению питания свиней и птицы (Harrison and D’Mello, 1986; Henry et al., 1996). Еще одной причиной снижения потребления корма может быть недостаток одной или нескольких незаменимых аминокислот из-за избытка Leu в рационе. Из-за того, что избыток Leu приводит к недостатку Ile и Val, дефицит Ile и/или Val может снижать потребление корма. Кроме того, было выдвинуто предположение, что эффект снижения скорости роста при избытке Leu может быть частично обусловлен нарушением функционирования гормона роста IGF-1 (Sanderson and Naik, 2000).
В случае антагонизма аминокислот с разветвленными цепями повышается потребность в Ile из-за увеличения катаболизма аминокислот с разветвленными цепями как у свиней, так и у птицы (D’Mello, 1975; Fu et al., 2006). У свиней избыток Leu не так сильно влияет на использование Val по сравнению с Ile (Langer and Fuller, 2000), и повышенное количество Leu не оказывало никакого эффекта на продуктивность животных, если они получали с кормом необходимое количество Val (Gloaguen et al., 2010). Как и у свиней, переизбыток Ile и Val в рационе птицы менее важен, чем избыток Leu. Избыток Ile или Val приводит к незначительному снижению концентрации двух других аминокислот с разветвленными цепями в крови, в то время как избыток Leu вызывает серьезное сокращение содержания Ile и Val в крови птицы (Smith and Austic, 1978). По данным D’Mello and Lewis (1970), избыток Val не оказывает негативного влияния на рост птицы. Эти данные подтверждены Burnham et al. (1992), который показал, что избыток Val не влияет на рост птицы, обусловленный содержанием Ile в рационе. Исходя из этих данных, можно предположить, что избыток Leu значительнее влияет на использование Ile, чем Val, как у свиней, так и у птицы.
Список литературы
Abumrad, N., R. Robinson, B. Gooch, and W. Lacy (1982): The effect of leucine infusion on substrate flux across the human forearm. Journal of Surgical Research 32: 453–463.
Aftring, R.P., K.P. Block, and M.G. Buse (1986): Leucine and isoleucine activate skeletal muscle branched-chain α-keto acid dehydrogenase in vivo. American Journal of Physiology 250: E599–604.
Allen, N.K. and D.H. Baker (1972): Quantitative efficacy of dietary isoleucine and valine for chick growth as influenced by variable quantities of excess dietary leucine. Poultry Science, 51: 1292–1298.
AMINODat® 4.0. Platinum version, (2010): Evonik Degussa GmbH, Hanau-Wolfgang, Germany.
Anthony, J.C., T.G. Anthony, S.R. Kimball, T.C. Vary and L.S. Jefferson (2000): Orally administered leucine stimulates protein synthesis in skeletal muscle of post-absorptive rats in association with increased eIF4F formation. Journal of Nutrition 130: 139–145.
Baker, D.H. and I. Mavromichalis (2000): The role of branched-chain amino acids in swine and poultry nutrition. Biokyowa Technical Review 12: 1–20.
Barbour, G. and J.D. Latshaw (1992): Isoleucine requirement of broiler chicks as affected by the concentrations of leucine and valine in practical diets. British Poultry Science 33: 561–568.
Burnham, D., G.C. Emmans and R.M. Gous (1992): Isoleucine requirement of the chicken: the effect of excess leucine and valine on the response to isoleucine. British Poultry Science 33: 71–87.
Brosnan, J.T. and M.E. Brosnan (2006): Branched-Chain Amino Acids: Enzyme and Substrate Regulation. Journal of Nutrition 136: 207S–211S.
Calvert, C.C., K.C. Klasing, and R.E. Austic (1982): Involvement of food intake and amino acid catabolism in the branched-chain amino acid antagonism in chicks. Journal of Nutrition 112: 627–635.
Chuang, D.T., J.R. Davie, R.M. Wynn, J.L. Chuang, H. Koyata, and R.P. Cox (1995): Molecular basis of maple syrup urine disease and stable correction by retroviral gene transfer. Journal of Nutrition 125: S1766–S1772.
D’Mello, J.P.F. (1975): Amino acid requirements of the young turkey: Leucine, isoleucine and valine. British Poultry Science 16: 607–615.
D’Mello, J.P.F. and D. Lewis (1970): Amino acid interactions in chick nutrition. 2. Interrelationships between leucine, isoleucine and valine. British Poultry Science 11: 313–323.
Edmonds, M.S. and D.H. Baker (1987): Amino acid excesses for young pigs: effects of excess methionine, tryptophan, threonine, or leucine. Journal of Animal Science 64: 1664–1671.
Erwan, E., A.R. Alimon, A.Q. Sazili, H. Yaakub and M. Hilmi (2009): Effect of L-Leucine supplementation on growth performance and carcass characteristics of grower-broiler chickens fed Low protein diets. American Journal of Animal and Veterinary Sciences 4: 95–100.
Farran, M.T., E.K. Barbour, and V.M. Ashkarian (2003): Effect of excess leucine in low protein diet on ketosis in 3-week-old male broiler chicks fed different levels of isoleucine and valine. Animal Feed Science and Technology 103: 171–176.
Fruge, E.D., T.D. Bidner, and L.L. Southern (2009): Effect of incremental levels of red blood cells on growth performance and carcass traits of finishing pigs. Journal of Animal Science 87: 2853–2859.
Fu, S.X., R.W. Fent, G.L. Allee, and J.L. Usry (2006): Branched chain amino acid interactions increase isoleucine requirement in late-finishing pigs. Journal of Animal Science 84 (Suppl. 1): 283–284.
Garlick, P.J. (2005): The role of leucine in the regulation of protein metabolism. Journal of Nutrition 135: 1553S–1556S.
Gatnau, R., D.R. Zimmerman, S.L. Nissen, M. Wannemuehlert, and R.C. Ewan (1995): Effects of excess dietary leucine and leucine catabolites on growth and immune responses in weanling pigs. Journal of Animal Science 73: 159–165.
Gloaguen, M., N. Le Floc’h, L. Brossard, Y. Primot, E. Corrent, and J. Van Milgen (2010): An excessive supply of leucine aggravates the effect of a valine deficiency in post-weaned piglets. Pages 609–610 in Energy and protein metabolism and nutrition, edited by G.M. Crovetto, Wageningen Academic Publishers, The Netherlands.
Harper, A.E., R.H. Miller and K.P. Block (1984): Branched-chain amino acid metabolism. Annual Review of Nutrition 4: 409–454.
Harrison, L.M. and J.P.F. D’Mello (1986): Large neutral amino acids in the diet and neurotransmitter concentrations in the chick brain. Proceedings of Nutrition Society 45: 72A. Hay, N. and N. Sonenberg (2004): Upstream and downstream of mTOR. Genes and Development 18: 1926–1945.
Henry, Y., B. Sève, A. Mounier, and P. Ganier (1996): Growth performance and brain neurotransmitters in pigs as affected by tryptophan, protein and sex. Journal of Animal Science 74: 2700–2710.
Hinson, R.B., G.L. Allee, and J.D. Crenshaw (2007): Use of spray-dried blood cells and isoleucine supplementation in pig starter diets. Journal of Animal Science 85 (Suppl. 2): 93.
Holecek, M. (2002): Relation between glutamine, branched-chain amino acids, and protein metabolism. Nutrition 18: 130–133.
Hornberger, T.A., R. Stuppard, K.E. Conley, M.J. Fedele, M.L. Fiorotto, E.R. Chin, K.A. Esser (2004): Mechanical stimuli regulate rapamycin-sensitive signalling by a phosphoinositide 3-kinase-, protein kinase B- and growth factorindependent mechanism. Biochemical Journal 380: 795–804.
Kanamori, K., B.D. Ross, and R.W. Kondrat (1998): Rate of glutamate synthesis form leucine in rat brain measured in vivo by 15N NMR. Journal of Neurochemistry 70: 1304–1315.
Kerr, B.J., M.T. Kidd, J.A. Cuaron, K.L. Bryant, T.M. Parr, C.V. Maxwell, and E. Weaver (2004): Utilization of spray-dried blood cells and crystalline isoleucine in nursery pig diets. Journal of Animal Science 82: 2397–2404.
Kidd, M.T., D.J. Burnham, and B.J. Kerr (2004): Dietary isoleucine responses in male broiler chickens. British Poultry Science 45: 67–75.
Langer, S., P.W.D. Scislowski, and D.S. Brown (2000): Interactions among the branched-chain amino acids and their effects on methionine utilization in growing pigs: effects on plasma amino- and keto-acid concentrations and branched-chain keto-acid dehydrogenase activity. British Journal of Nutrition 83: 49–58.
Langer, S. and M.F. Fuller (2000): Interactions among the branched-chain amino acids and their effects on methionine utilization in growing pigs: effects on nitrogen retention and amino acid utilization. British Journal of Nutrition 83: 43–48.
Matthews, D.E., D.M. Bier, M.J. Rennie, R.H. Edwards, D. Halliday, D.J. Millward, and G.A. Clugston (1981): Regulation of leucine metabolism in man: a stable isotope study. Science 4 (214): 1129–1131.
McCauley, R., C. Platell, J. Hall, and R. McCulloch (1990): The influence of branched-chain amino acids on colonic atrophy and anastomotic strength in the rat. Australian and New Zealand Journal of Surgery 61: 49–53.
Miyazaki, M. and K.A. Esser (2009): Cellular mechanisms regulating protein synthesis and skeletal muscle hypertrophy in animals. Journal of Applied Physiology 106: 1367–1373.
Norton, L.E. and D.K. Layman (2006): Leucine regulates translation initiation of protein synthesis in skeletal muscle after exercise. Journal of Nutrition 136: S533–S537.
NRC (1998): Nutrient Requirements of Swine, 10th revised edn. National Academy Press, Washington, DC.
Oestemer, G.A., L.E. Hanson and R.J. Meade (1973): Leucine-isoleucine interrelationship in the young pig. Journal of Animal Science 36: 674–678.
Richert, B.T., M.D. Tokach, R.D. Goodband, J.L. Nelssen, J.E. Pettigrew, R.D. Walker, and L.J. Johnston (1996): Valine requirement of the high-producing lactating sow. Journal of Animal Science 74: 1307–1313.
Sanderson, I.R. and S. Naik (2000): Dietary regulation of intestinal gene expression. Annual Review of Nutrition 20: 311–338.
Shimomura, Y., N. Nanaumi, M. Suzuki, K.M. Popov, and R.A. Harris (1990): Purification and partial characterization of branched-chain alpha-ketoacid dehydrogenase kinase from rat liver and rat heart. Archives of Biochemistry and Biophysics 283: 293–299.
Shimomura, Y., H. Fujii, M. Suzuki, T. Murakami, N. Fujitsuka, and N. Nakai (1995): Branchedchain alpha-keto acid dehydrogenase complex in rat skeletal muscle: regulation of the activity and gene expression by nutrition and physical exercise. Journal of Nutrition 125: 1762S–1765S.
Smith, T.K. and R.E. Austic (1978): The branched-chain amino acid antagonism in chicks. Journal of Nutrition 108: 1180–1191.
Staten, M.A., D.M. Bier, and D.E. Matthews (1984): Regulation of valine catabolism in man: a stable isotope study. American Journal of Clinical Nutrition 40: 1224–1234.
Taylor, J.A., D.N. Salter, W.H. Close, and G.H. Laswai (1992): Serum concentrations of insulinlike growth factor 1 and cholesterol in relation to protein and fat deposition in growing pigs. Animal Production 55: 257–264.
Waldroup, P.W., J.H. Kersey, and C.A. Fritts (2002): Influence of branched-chain amino acid balance in broiler diets. International Journal of Poultry Science 1(5): 136–144.
Wiltafsky, M.K., M.W. Pfaffl, and F.X. Roth (2010): The effects of branched-chain amino acid interactions on growth performance, blood metabolites, enzyme kinetics and transcriptomics in weaned pigs. British Journal of Nutrition 103: 964–76.
Yin, Y., K. Yao, Z. Liu, M. Gong, Z. Ruan, D. Deng, B. Tan, Z. Liuand G. Wu (2010): Supplementing L-leucine to a low-protein diet increases tissue protein synthesis in weanling pigs. Amino Acids 39: 1477–1486.
Количество показов: 3260
Автор: Т. Клименко, А. Клименко, А. Японцев, кандидаты с.-х. наук, менеджеры технического сервиса ООО «Эвоник Химия»
Источник: «Ценовик» Январь 2017
Компания: Эвоник Химия
Рейтинг: 3.3
Аминокислотный метаболизм — обзор
Аминокислотный метаболизм
Аминокислотный метаболизм (АК) играет важную роль в биосинтезе метаболитов, участвующих в нейротрансмиссии, и долгое время предполагалось, что он играет роль в РАС. 77 В ряде исследований сообщалось о повышенном соотношении глутамата к глутамину (Glu: Gln) в крови пациентов с РАС. 78,79 Aldred et al., 78 , сравнивая детей с РАС или синдромом Аспергера и их родителей, обнаружили, что все пациенты и их семьи имели более высокие, чем нормальные (соответствующие возрасту группы контроля состояния здоровья) концентрации глутаминовой кислоты, фенилалина, аспарагин, тирозин, аланин и лизин и более низкие концентрации глутамина.Было обнаружено, что транспорт АК и последующее производство нейротрансмиттеров (например, серотонина из триптофана и катехоламинов допамина и норэпинефрина из тирозина) изменяются в фибробластах, взятых у людей с различными физиологическими состояниями, включая шизофрению, биполярное расстройство и аутизм, а также в случае триптофана. и аланин, ADAH. 80–83 Фибробласты используют те же транспортеры AA, что и мозг, и поэтому считается, что измененный транспорт AA в фибробластах ex vivo отражает измененный транспорт BBB этих AA in vivo . 83 Ming et al. 84 , используя стратегии на основе МС для профилирования метаболитов в моче у 48 детей с РАС и 53 детей контрольной группы того же возраста, обнаружил 82 метаболита, измененных в образцах РАС. В частности, уровни АК (включая глицин, серин, треонин, аланин, гистидин, глутамиловые аминокислоты), а также органической кислоты и производного желчи таурина и карнозина были ниже в моче с РАС. Они также наблюдали измененные профили метаболитов кишечной микробиоты и маркеры окислительного стресса.
Превращение глутамата в глутамин является основным способом удаления отходов аммиака в головном мозге и имеет решающее значение для предотвращения токсичности аммиака и накопления избыточного глутамата в синапсах для минимизации эксайтотоксичности. 85 Повышенное соотношение Glu: Gln в крови, таким образом, может указывать на изменение детоксикации аммиака и цикличность глутамата в головном мозге пациентов с РАС, что может повлиять на поведение. 86 Эта токсичность аммиака может усугубляться только диетами с низким содержанием клетчатки и высоким содержанием белка, что приводит к увеличению системного вклада аммиака, полученного в результате ферментации аминокислот протеолитической микробиотой кишечника. 87 Микробный катаболизм диетической АК может повлиять на доступность АК и систематическую циркуляцию у млекопитающих или привести к образованию биологически активных соединений, таких как SCFA, жирные кислоты с разветвленной цепью и биогенные амины. 88 Как и при печеночной энцефалопатии, пребиотическая (в частности, лактулоза) модуляция кишечной микробиоты и бифидогенеза может действовать как приемник аммиака, производимого колонией, и облегчать неврологические симптомы отравления аммиаком. 89 Дипептид L-карнозин является предполагаемым нейропротектором и может усиливать функцию лобных долей. Одно исследование кормления человека показало, что прием 800 мг L-карнозина ежедневно в течение 8 недель у 31 ребенка с РАС улучшил показатели поведения (шкала оценки аутизма Гиллиама; общий балл, подшкалы поведения, социализации и общения и словарь восприимчивых изображений одним словом test) по сравнению с лечением плацебо. 90 Однако, хотя и многообещающие, эти исследования с тех пор не повторялись, проводились только на небольших популяциях, и достоверность некоторых из используемых поведенческих критериев может быть ограничена определенными состояниями в рамках РАС, такими как синдром Аспергера.
Уровни АК в крови и моче будут зависеть от многих факторов, включая абсорбцию АК из переваренной пищи, АК и деградацию белка, секрецию белка хозяина и выведение с калом. Изменения относительных пропорций этих АК также могут иметь побочные эффекты на продукты метаболических путей, в которых участвуют эти АК, включая продукцию или относительные соотношения различных нейротрансмиттеров.Большинство АК поступает с пищей или вырабатывается эндогенно, но микробиота кишечника также может влиять как на восстановление АК с пищей, так и на производство или катаболизм АК. 91,92 Недавние исследования также показали, что употребление L-аргинина или L-глутамина может изменять способность кишечных бактерий использовать другие пищевые АК. 93 Однако, как обсуждается ниже, мы мало знаем о факторах, управляющих метаболизмом аминокислот микробиотой кишечника и о том, как он может быть изменен другими пищевыми компонентами или о том, в какой степени АК, синтезируемые микробиотой, вносят вклад в питание человека.Точно так же β-аланин, обычный AA в мясе, ингибирует поглощение ГАМК кишечными клетками, такими как Caco2. 94 Интересно, что β-аланин также может образовываться in situ в кишечнике в результате реакции пропионата и аммиака, продуцируемого Candida albicans , хотя эти соединения также продуцируются многими другими микроорганизмами в кишечнике. 95 Shaw 96 сообщил о появлении 3- (3-гидроксифенил) -3-гидроксипропионовой кислоты (HPHPA), редкого метаболита м-тирозина, продуцируемого некоторыми видами клостридий.Сам по себе м-тирозин является продуктом окисления фенилаланина, который, как было показано, вызывает симптомы типа РАС у лабораторных животных. HPHPA также был обнаружен у людей с инфекцией Clostridium difficile и в чрезвычайно высоких концентрациях у пациентов с шизофренией во время острых психотических эпизодов. В одном случае психоз был успешно вылечен ванкомицином, и одновременно снизились уровни HPHPA в моче. Интересно, что ванкомицин, часто активный против Clostridium difficile в пероральной форме, улучшает когнитивные функции и социальные маркеры у детей с РАС. 97
В настоящее время мы мало знаем о видах микробов или даже о метаболических процессах, участвующих в биодоступности АК и биотрансформации кишечной микробиотой, и меньше о возможных последствиях для неврологической функции. Мы также мало знаем о том, как различные продукты питания и пищевые компоненты взаимодействуют, регулируя поглощение или метаболизм АК в кишечной микробиоте. Ранние исследования in vitro , проведенные Smith and Macfarlane 88 , показали, что ферментация АК кишечной микробиотой человека подавляется как низким pH, так и присутствием ферментируемых волокон / углеводов (резистентный крахмал).Однако мы не знаем, как этот процесс переводит in vivo на или как он изменяется в болезненных состояниях, таких как РАС, или после лечения антибиотиками. Из исследований на поросятах, модели, используемой для имитации детского питания человека, мы знаем, что добавление холестерина в детские смеси изменяет профиль АК в мозге, снижая концентрации глутамата, серина, глутамина, треонина, β-аланина, аланина, метионина, изолейцина. , лейцин и γ-аминобутират, при увеличении концентрации глицина и лизина.Докозагексаеновая кислота (DHA) имела аналогичный эффект, за исключением снижения уровня таурина и отсутствия эффекта на изолейцин и лизин. Уровни АК в печени, мышцах и плазме поросят также зависели от пищевых добавок холестерина или ДГК. DHA также снижает уровень карнозина в мышцах и аммиака в мышцах и головном мозге. 98 Существует мало информации о влиянии пищевой промышленности на профили AA в готовых к употреблению или полуфабрикатах. Hermanussen et al. 99 профилирование образцов АК в 17 широко потребляемых полуфабрикатах в Германии показало, что не только профили АК не совпадали с профилями на этикетках или упаковке пищевых продуктов, но и концентрации глутамата часто были намного выше тех, которые обычно сообщаются для пищевых продуктов, свободный цистеин обычно был низкий, вероятно, в результате термического лизиса во время обработки пищевых продуктов, а некоторые продукты, маркированные как содержащие мясо, не содержат обнаруживаемого карнозина.ГАМК обычно обнаруживается в относительно высоких концентрациях. Совсем недавно те же авторы сообщили, что промышленная переработка пищевых продуктов может радикально изменить профиль АК в пищевых продуктах на основе курицы, повысив концентрацию глутамата и исключив ансерин или карнозин, присутствующие в эквивалентном продукте домашнего приготовления. Аналогичные результаты были получены в овощных супах, где глутамат иногда составляет 96% всех свободных аминокислот. 100 В целом, хотя метаболизм АК, по-видимому, тесно связан с биологией РАС, четкое понимание основных механизмов или прямой связи с патологическими процессами в настоящее время отсутствует, и необходимы дальнейшие исследования в хорошо задокументированных когортах людей для дальнейшего изучения этого явления. связь между метаболизмом АК, питанием и кишечной микробиотой при РАС.Однако такие наблюдения имеют значение для того, как выбор продуктов питания или преобладающая диета в домашнем хозяйстве могут повлиять на доступность питательных веществ и метаболизм с последствиями для развития и функционирования мозга в раннем детстве.
нарушение обмена веществ | Определение, происхождение, типы и факты
Болезнь обмена веществ , любое заболевание или расстройство, нарушающее нормальный обмен веществ, процесс преобразования пищи в энергию на клеточном уровне. Тысячи ферментов, участвующих во множестве взаимозависимых метаболических путей, осуществляют этот процесс.Метаболические заболевания влияют на способность клетки выполнять важные биохимические реакции, которые включают переработку или транспорт белков (аминокислот), углеводов (сахаров и крахмалов) или липидов (жирных кислот).
Британская викторина
Болезни, расстройства и многое другое: медицинская викторина
Какое состояние вызвано отложением солей мочевой кислоты? Как еще называют перелом костей? Узнайте, что вы знаете о болезнях, расстройствах и многом другом.
Болезни обмена веществ обычно передаются по наследству, но большинство людей, страдающих ими, могут выглядеть здоровыми в течение нескольких дней, месяцев или даже лет. Симптомы обычно появляются, когда метаболизм в организме подвергается стрессу, например, после длительного голодания или во время лихорадочного заболевания. При некоторых нарушениях обмена веществ можно пройти пренатальный диагностический скрининг. Такой анализ обычно предлагается семьям, у которых ранее был ребенок с нарушением обмена веществ или которые принадлежат к определенной этнической группе.Например, тестирование на болезнь Тея-Сакса относительно распространено среди еврейского населения ашкенази. Страны, которые проводят скрининг на метаболические заболевания при рождении, обычно проверяют до 10 различных состояний. Тандемная масс-спектрометрия — это новая технология, которая позволяет обнаруживать несколько аномальных метаболитов почти одновременно, что позволяет добавить около 30 расстройств к списку состояний, на которые могут быть проверены новорожденные. Если известно, что у младенца нарушение обмена веществ вскоре после рождения, соответствующая терапия может быть начата раньше, что может улучшить прогноз.Некоторые нарушения обмена веществ очень хорошо поддаются лечению, если лечение начинается в раннем возрасте. Однако у других нет эффективной терапии и они вызывают серьезные проблемы, несмотря на раннюю диагностику. В будущем генная терапия может оказаться успешной в лечении некоторых из этих заболеваний.
Заболевания обмена веществ довольно редки по отдельности, но относительно часто, если рассматривать их в группе. Частота конкретных метаболических нарушений варьируется от примерно 1 на 500 (или даже выше в изолированных популяциях) до менее 1 на 1000000.Было подсчитано, что в группе нарушения обмена веществ затрагивают примерно 1 из 1000 человек.
Истоки нарушения обмена веществ
Метаболические пути
В 1908 году британский врач сэр Арчибальд Гаррод предположил, что четыре унаследованных пожизненных состояния — алкаптонурия, пентозурия, альбинизм и цистинурия — были вызваны дефектами определенных биохимических путей из-за пониженной активности или полного отсутствия данного фермента. Он назвал эти нарушения «врожденными нарушениями обмена веществ».Хотя Гаррод ошибался в категоризации цистинурии, его идеи дали области биохимической генетики прочную основу, и список унаследованных врожденных ошибок метаболизма быстро увеличивался. Эта статья в первую очередь касается этих наследственных метаболических заболеваний, хотя другие нарушения, включая эндокринные заболевания (например, сахарный диабет и гипотиреоз) и недоедание (например, маразм и квашиоркор), также влияют на клеточный метаболизм.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчасПища расщепляется клеточными ферментами (белками, которые катализируют превращение соединений, называемых субстратами) в несколько этапов в продукты с другой биохимической структурой. Затем эти продукты становятся субстратом для следующего фермента метаболического пути. Если фермент отсутствует или имеет пониженную активность, путь блокируется, и образование конечного продукта оказывается недостаточным, что приводит к заболеванию. Низкая активность фермента может привести к последующему накоплению субстрата фермента, который может быть токсичным при высоких уровнях.Кроме того, незначительные метаболические пути, которые обычно бездействуют, могут активироваться при накоплении субстрата, возможно, с образованием атипичных, потенциально токсичных продуктов. Каждая клетка в организме содержит тысячи метаболических путей, все из которых в той или иной степени взаимосвязаны, так что единичная блокада может повлиять на множество биохимических процессов.
Последствия метаболического дисбаланса могут быть серьезными; умственная отсталость, судороги, снижение мышечного тонуса, органная недостаточность, слепота и глухота могут возникнуть в зависимости от того, какой фермент дисфункциональный.В последние годы стало очевидно, что даже некоторые состояния, связанные с множественными врожденными аномалиями (например, синдром Смита-Лемли-Опица), имеют метаболическую причину.
10: Метаболизм аминокислот
10: Метаболизм аминокислот — Химия LibreTexts Перейти к основному содержанию- Последнее обновление
- Сохранить как PDF
- 10.1: метаболизм белков
- 10.2: деградация аминокислот
- Обычно первым шагом в расщеплении аминокислот является удаление аминогруппы, обычно посредством реакции, известной как трансаминирование. Углеродные скелеты аминокислот подвергаются дальнейшим реакциям с образованием соединений, которые можно использовать либо для синтеза глюкозы, либо для синтеза кетоновых тел.
- 10.3: Цикл мочевины
- Еще одним важным для клеток циклическим путем является цикл мочевины (Рисунок 7.5.1). При реакциях, охватывающих цитоплазму и митохондрии, цикл мочевины происходит в основном в печени и почках. Цикл играет важную роль в балансе азота в клетках и обнаруживается у организмов, которые вырабатывают мочевину как способ выведения избытков аминов.
- 10.4: Синтез аминокислот
- У человека может быть синтезирована только половина стандартных аминокислот (Glu, Gln, Pro, Asp, Asn, Ala, Gly, Ser, Tyr, Cys), и они таким образом классифицировали заменимые аминокислоты.В этой группе первые три, глутамат, глутамин и пролин, имеют общий анаболический путь. Он начинается с глутаматдегидрогеназы, которая добавляет аммиак к α-кетоглутарату в присутствии НАДФН с образованием глутамата. Это ключевая реакция для синтеза всех аминокислот.
- 10.5: Связь путей метаболизма углеводов, белков и липидов
- Все катаболические пути углеводов, белков и липидов в конечном итоге связаны с гликолизом и путями цикла лимонной кислоты (см. Рисунок 7.6.2). Метаболические пути следует рассматривать как пористые, то есть вещества поступают по другим путям, а промежуточные продукты уходят по другим путям. Эти пути не являются закрытыми системами. Многие из субстратов, промежуточных продуктов и продуктов определенного пути являются реагентами других путей.
Аминокислоты: метаболизм, функции и питание
Baker DH (2008) Достижения в белково-аминокислотном питании птицы. Аминокислоты. DOI: 10.1007 / s00726-008-0198-3
Ban H, Shigemitsu K, Yamatsuji T et al (2004) Аргинин и лейцин регулируют киназу p70 S6 и 4E-BP1 в эпителиальных клетках кишечника.Int J Mol Med 13: 537–543
PubMed CAS Google Scholar
Blachier F, Mariotti F, Huneau JF, Tomé D (2007) Эффекты метаболитов просвета, производных от аминокислот, на эпителий толстой кишки и физиопатологические последствия. Аминокислоты 33: 547–562
PubMed CAS Статья Google Scholar
Brasse-Lagnel C, Fairand A, Lavoinne A, Husson A (2003) Глутамин стимулирует экспрессию гена аргининосукцинатсинтетазы посредством O -гликозилирования Sp1 в клетках Caco-2.J Biol Chem 278: 52504–52510
PubMed CAS Статья Google Scholar
Bronte V, Zanovello P (2005) Регулирование иммунных ответов метаболизмом l-аргинина. Nat Rev Immunol 5: 641–654
PubMed CAS Статья Google Scholar
Brosnan JT (2001) Аминокислоты тогда и сейчас — размышления о вкладе сэра Ганса Креба в метаболизм азота.IUBMB Life 52: 265–270
PubMed CAS Статья Google Scholar
Chen LX, Yin YL, Jobgen WS et al (2007) Окисление незаменимых аминокислот in vitro клетками слизистой оболочки кишечника растущих свиней. Livest Sci 109: 19–23
Статья Google Scholar
Chen L, Li P, Wang J et al (2009) Катаболизм незаменимых в питании аминокислот в развивающихся энтероцитах свиней.Аминокислоты. DOI: 10.1007 / s00726-009-0268-1
Clowes EJ, Aherne FX, Baracos VE (2005) Мобилизация белков скелетных мышц во время прогрессирования лактации. Am J Physiol Endocrinol Metab 288: E564 – E572
PubMed CAS Статья Google Scholar
Coeffier M, Claeyssens S, Hecketsweiler B et al (2003) Энтеральный глутамин стимулирует синтез белка и снижает уровень мРНК убиквитина в слизистой оболочке кишечника человека.Am J Physiol 285: G266 – G273
CAS Google Scholar
Corl BA, Odle J, Niu X et al (2008) Аргинин активирует кишечный p70 (S6k) и синтез белка при ротавирусном энтерите поросят. J Nutr 138: 24–29
PubMed CAS Google Scholar
Cox JD (1970) Термохимия органических и металлоорганических соединений. Academic Press, New York, pp 1–643
. Google Scholar
Curis E, Crenn P, Cynober L (2007) Цитруллин и кишечник.Curr Opin Clin Nutr Metab Care 10: 620–626
PubMed CAS Статья Google Scholar
Curthoys NP, Watford M (1995) Регулирование активности глутаминазы и метаболизма глутамина. Анну Рев Нутр 15: 133–159
PubMed CAS Статья Google Scholar
Дэвис Т.А., Фиоротто М.Л. (2009) Регулирование роста мышц у новорожденных. Curr Opin Clin Nutr Metab Care 12: 78–85
PubMed CAS Статья Google Scholar
Davis PK, Wu G (1998) Компартментация и кинетика ферментов цикла мочевины в энтероцитах свиней.Comp Biochem Physiol B 119: 527–537
PubMed CAS Статья Google Scholar
Dekaney CM, Wu G, Yin YL, Jaeger LA (2008) Регулирование экспрессии и активности гена орнитинаминотрансферазы с помощью полностью транс-ретиноевой кислоты в эпителиальных клетках кишечника Caco-2. J Nutr Biochem 19: 674–681
PubMed CAS Статья Google Scholar
Deng ZY, Zhang JW, Wu GY et al (2007) Пищевые добавки с полисахаридами из семени кассии усиливают выработку иммуноглобулинов и экспрессию гена интерлейкина у поросят на раннем отъеме.J Sci Food Agric 87: 1868–1873
CAS Статья Google Scholar
Deng D, Yin YL, Chu WY et al (2008) Нарушение активации инициации трансляции и снижение синтеза белка у поросят-отъемышей, получавших диету с низким содержанием белка. J Nutr Biochem. DOI: 10.1016 / j.jnutbio.2008.05.014
Эдмондс М.С., Бейкер Д.Х. (1987) Избыток аминокислот для молодых свиней: эффекты избытка метионина, триптофана, треонина или лейцина.J Anim Sci 64: 1664–1671
PubMed CAS Google Scholar
El Idrissi A (2008) Таурин увеличивает буферизацию кальция в митохондриях: роль в нейрозащите. Аминокислоты 34: 321–328
PubMed CAS Статья Google Scholar
Elango R, Ball RO, Pencharz PB (2009) Аминокислотные потребности человека: с особым упором на метаболическую доступность аминокислот.Аминокислоты. DOI: 10.1007 / s00726-009-0234-у
Эль-Кади С.В., Балвин Р.Л., Санни Н.Е. и др. (2006) Поставка кишечного белка изменяет метаболизм аминокислот, но не глюкозы в желудочно-кишечном тракте овцы. J Nutr 136: 1261–1269
PubMed CAS Google Scholar
Escobar J, Frank JW, Suryawan A et al (2005) Физиологическое повышение уровня лейцина в плазме стимулирует синтез мышечного белка у новорожденных свиней за счет усиления активации фактора инициации трансляции.Am J Physiol Endocrinol Metab 288: E914 – E921
PubMed CAS Статья Google Scholar
Escobar J, Frank JW, Suryawan A et al (2006) Регулирование синтеза белков сердечных и скелетных мышц отдельными аминокислотами с разветвленной цепью у новорожденных свиней. Am J Physiol Endocrinol Metab 290: E612 – E621
PubMed CAS Статья Google Scholar
Fang ZF, Luo J, Qi ZL et al (2009) Влияние 2-гидрокси-4-метилтиобутирата на плазменный поток в воротной вене и чистый внешний вид аминокислот в воротной вене у поросят.Аминокислоты 36: 501–509
PubMed CAS Статья Google Scholar
Field CJ, Johnson IR, Schley PD (2002) Питательные вещества и их роль в устойчивости организма к инфекции. J Leukoc Biol 71: 16–32
PubMed CAS Google Scholar
Фиркинс Дж. Л., Христов А. Н., Холл М. Б. и др. (2006) Интеграция метаболизма рубца у молочного скота. J Dairy Sci 89 (Приложение 1): E31 – E51
PubMed Статья Google Scholar
Flynn NE, Knabe DA, Mallick BK, Wu G (2000) Постнатальные изменения аминокислот в плазме у молочных поросят.J Anim Sci 78: 2369–2375
PubMed CAS Google Scholar
Flynn NE, Bird JG, Guthrie AS (2008) Глюкокортикоидная регуляция метаболизма аминокислот и полиаминов в тонком кишечнике. Аминокислоты. DOI: 10.1007 / s00726-008-0206-7
Frank JW, Escobar J, Hguyen HV et al (2007) Оральный прием N -карбамилглутамата увеличивает синтез белка в скелетных мышцах поросят.J Nutr 137: 315–319
PubMed CAS Google Scholar
Fu WJ, Haynes TE, Kohli R et al (2005) Пищевые добавки с l-аргинином уменьшают жировую массу у крыс с диабетом Цукера. J Nutr 135: 714–721
PubMed CAS Google Scholar
Фуллер М.Ф., Редес П.Дж. (1998) Цикл азота в кишечнике. Annu Rev Nutr 18: 385–411
PubMed CAS Статья Google Scholar
Galli F (2007) Модификация аминокислот и белков кислородом и азотом.Аминокислоты 32: 497–499
CAS Статья Google Scholar
Gao HJ, Wu G, Spencer TE et al (2009a) Выберите питательные вещества в просвете матки овцы: I. Аминокислоты, глюкоза и ионы в промывках просвета матки циклических и беременных овец. Биол Репрод 80: 86–93
PubMed CAS Статья Google Scholar
Gao HJ, Wu G, Spencer TE et al (2009b) Выбор питательных веществ в просвете матки овцы: II.Транспортеры глюкозы в матке и периимплантационной концепции. Биол Репрод 80: 94–104
PubMed CAS Статья Google Scholar
Gao HJ, Wu G, Spencer TE et al (2009c) Выбор питательных веществ в просвете матки овцы: III. Экспрессия переносчиков катионных аминокислот в матке овцы и периимплантационной концепции. Биол Репрод 80: 602–609
PubMed CAS Статья Google Scholar
Gao HJ, Wu G, Spencer TE et al (2009d) Выбор питательных веществ в просвете матки овцы: IV.Экспрессия переносчиков нейтральных и кислых аминокислот в матке овцы и периимплантационной концепции. Биол Репрод. DOI: 10.1095 / biolreprod.108.075440
Google Scholar
Gao HJ, Wu G, Spencer TE et al (2009e) Выберите питательные вещества в просвете матки овцы: V. Синтаза оксида азота, циклогидролаза GTP и декарбоксилаза орнитина в матке овцы и концепции периимплантации. Биол Репрод. DOI: 10.1095 / биолрепрод.108.075473
Google Scholar
Grillo MA, Colombatto S (2007) S -Аденозилметионин и радикальный катализ. Аминокислоты 32: 197–202
PubMed CAS Статья Google Scholar
Grimble RF (2006) Влияние потребления серосодержащих аминокислот на иммунную функцию человека. J Nutr 136: 1660S – 1665S
PubMed CAS Google Scholar
Ha EM, Choi CT, Bae YS, Lee WJ (2005) Прямая роль двойной оксидазы в кишечном иммунитете дрозофилы.Наука 310: 847–850
PubMed CAS Статья Google Scholar
Haynes TE, Li P, Li X et al (2009) l-глутамин или l-аланил-l-глутамин предотвращают вызванную оксидантами или эндотоксинами гибель энтероцитов новорожденных. Аминокислоты. DOI: 10.1007 / s00726-009-0243-x
He QH, Kong XF, Wu G et al (2008) Метаболомический анализ реакции растущих свиней на пищевые добавки с l-аргинином.Аминокислоты. DOI: 10.1007 / s00726-008-0192-9
Hill JO, Peters JC, Catenacci VA, Wyatt HR (2008) Международные стратегии борьбы с ожирением. Obes Rev 9 (Suppl 1): 41–47
PubMed Статья Google Scholar
Hu CA, Williams DB, Zhaorigetu S et al (2008a) Функциональная геномика и анализ SNP человеческих генов, кодирующих ферменты метаболизма пролина. Аминокислоты 35: 655–664
PubMed CAS Статья Google Scholar
Hu CA, Khalil S, Zhaorigetu S. et al (2008b) Δ 1 -пирролин-5-карбоксилатсинтаза человека: функция и регуляция.Аминокислоты 35: 665–672
PubMed CAS Статья Google Scholar
Huang YF, Wang YX, Watford M (2007) Глутамин напрямую снижает уровень белка глутаминсинтетазы в мышечных трубках скелетных мышц C2C12 мыши. J Nutr 137: 1357–1362
PubMed CAS Google Scholar
Jobgen WS, Fried SK, Fu WJ et al (2006) Регулирующая роль пути аргинина-оксида азота в метаболизме энергетических субстратов.J Nutr Biochem 17: 571–588
PubMed CAS Статья Google Scholar
Jobgen W, Meininger CJ, Jobgen SC et al (2009a) Добавка L-аргинина с пищей снижает прирост белого жира и увеличивает массу скелетных мышц и бурого жира у крыс с ожирением, вызванным диетой. J Nutr 139: 230–237
PubMed CAS Google Scholar
Jobgen W, Fu WJ, Gao H et al (2009b) Кормление с высоким содержанием жиров и диетические добавки l-аргинина по-разному регулируют экспрессию генов в белой жировой ткани крысы.Аминокислоты. DOI: 10.1007 / s00726-009-0246-7
John JPP, Oh JE, Pollak A, Lubec G (2008) Идентификация и характеристика арсенитной (+3 степени окисления) метилтрансферазы (AS3MT) в линии клеток нейробластомы мыши N1E-115. Аминокислоты 35: 355–358
PubMed CAS Статья Google Scholar
Катане М., Ханаи Т., Фуручи Т. и др. (2008) Гиперактивные мутанты d-аспартатоксидазы мыши: мутагенез серина остатка активного центра.Аминокислоты 35: 75–82
PubMed CAS Статья Google Scholar
Kilberg MS, Pan YX, Chen H, Leung-Pineda V (2005) Пищевой контроль экспрессии генов: как клетки млекопитающих реагируют на ограничение аминокислот. Анну Рев Нутр 25: 59–85
PubMed CAS Статья Google Scholar
Kim SW, Wu G (2004) Добавка аргинина в рацион усиливает рост молодняка свиней, выкармливаемых молоком.J Nutr 134: 625–630
PubMed CAS Google Scholar
Kim SW, Wu G (2008) Регулирующая роль аминокислот в росте молочных желез и синтезе молока. Аминокислоты. DOI: 10.1007 / s00726-008-0151-5
Kohli R, Meininger CJ, Haynes TE et al (2004) Добавка с пищей l-аргинина усиливает эндотелиальный синтез оксида азота у крыс с индуцированным стрептозотоцином диабетом. J Nutr 134: 600–608
PubMed CAS Google Scholar
Kong XF, Yin YL, He QH et al (2008) Пищевая добавка с порошком китайских трав повышает перевариваемость подвздошной кишки и концентрацию аминокислот в сыворотке молодых свиней.Аминокислоты. DOI: 10.1007 / s00726-008-0176-9
Kwon H, Spencer TE, Bazer FW, Wu G (2003a) Изменения в развитии аминокислот в жидкости плода овцы. Биол Репрод 68: 1813–1820
PubMed CAS Статья Google Scholar
Kwon H, Wu G, Bazer FW, Spencer TE (2003b) Изменения в развитии уровней полиаминов и синтеза в понятии овец. Биол Репрод 69: 1626–1634
PubMed CAS Статья Google Scholar
Kwon H, Wu G, Meininger CJ et al (2004) Изменения в развитии синтеза оксида азота в понятии овец.Биол Репрод 70: 679–686
PubMed CAS Статья Google Scholar
Leong HX, Simkevich C, Lesieur-Brooks A et al (2006) Кратковременная депривация аргинина приводит к крупномасштабной модуляции экспрессии печеночных генов как в нормальных, так и в опухолевых клетках: биоинформатический анализ микрочипов. Nutr Metab 3:37
Артикул CAS Google Scholar
Li P, Yin YL, Li DF, Kim SW, Wu G (2007) Аминокислоты и иммунная функция.Br J Nutr 98: 237–252
PubMed CAS Статья Google Scholar
Li P, Mai KS, Trushenski J, Wu G (2008) Новые разработки в аминокислотном питании рыб: в сторону функциональных и экологически ориентированных кормов для аквакультуры. Аминокислоты. DOI: 10.1007 / s00726-008-0171-1
Li X, Bazer FW, Gao H et al (2009) Аминокислоты и газовая передача сигналов. Аминокислоты. DOI: 10.1007 / s00726-009-0264-5
Liao XH, Majithia A, Huang XL, Kimmel AR (2008) Контроль роста с помощью передачи сигналов киназы TOR, внутриклеточного сенсора аминокислот и доступности энергии, с потенциалом перекрестных помех для метаболизма пролина.Аминокислоты 35: 761–770
PubMed CAS Статья Google Scholar
Lucotti P, Setola E, Monti LD et al (2006) Положительный эффект длительного перорального лечения l-аргинином, добавленного к гипокалорийной диете и программе физических упражнений у тучных, инсулинорезистентных пациентов с диабетом 2 типа. Am J Physiol Endocrinol Metab 291: E906 – E912
PubMed CAS Статья Google Scholar
Лупи А., Тенни Р., Росси А. и др. (2008) Человеческая пролидаза и дефицит пролидазы.Аминокислоты 35: 739–752
PubMed CAS Статья Google Scholar
Линч С.Дж., Хатсон С.М., Патсон Б.Дж. и др. (2002) Тканевые эффекты хронического приема добавок лейцина и норлейцина с пищей на синтез белка у крыс. Am J Physiol Endocrinol Metab 283: E824 – E835
PubMed CAS Google Scholar
Macchiarulo A, Camaioni E, Nuti R, Pellicciari RC (2008) Основные моменты катаболизма триптофана: обзор механизмов активации и регуляции индоламин-2,3-диоксигеназы (IDO), новой мишени в раковое заболевание.Аминокислоты. DOI: 10.1007 / s00726-008-0137-3
Maclennan PA, Brown RA, Rennie MJ (1987) Положительная взаимосвязь между скоростью синтеза белка и внутриклеточной концентрацией глутамина в перфузируемых скелетных мышцах крысы. FEBS Lett 215: 187–191
PubMed CAS Статья Google Scholar
Maclennan PA, Smith K, Weryk B et al (1988) Ингибирование распада белка глутамином в перфузируемых скелетных мышцах крысы.FEBS Lett 237: 133–136
PubMed CAS Статья Google Scholar
Manna P, Sinha M, Sil PC (2009) Таурин играет полезную роль в отношении вызванной кадмием окислительной почечной дисфункции. Аминокислоты 36: 417–428
PubMed CAS Статья Google Scholar
Mannick JB (2007) Регулирование апоптоза с помощью нитрозилирования белка S .Аминокислоты 32: 523–526
PubMed CAS Статья Google Scholar
Manso Filho HC, Costa HE, Wu G et al (2009) Конская плацента экспрессирует глутаминсинтетазу. Vet Res Commun 33: 175–182
PubMed Статья Google Scholar
Marliss EB, Chevalier S, Gougeon R et al (2006) Повышение уровня метиларгининов в плазме при ожирении и старении связано с чувствительностью к инсулину и скоростью обмена белков.Диабетология 49: 351–359
PubMed CAS Статья Google Scholar
Martin PM, Sutherland AE, Van Winkle LJ (2003) Транспорт аминокислот регулирует имплантацию бластоцисты. Биол Репрод 69: 1101–1108
PubMed CAS Статья Google Scholar
Mateo RD, Wu G, Bazer FW et al (2007) Добавка L-аргинина в рацион улучшает репродуктивную способность свинок.J Nutr 137: 652–656
PubMed CAS Google Scholar
Mateo RD, Wu G, Moon HK et al (2008) Влияние добавок аргинина в рацион во время беременности и лактации на продуктивность кормящих первородящих свиноматок и кормящих поросят. J Anim Sci 86: 827–835
PubMed CAS Статья Google Scholar
Meijer AJ (2003) Аминокислоты как регуляторы и компоненты небелковых путей.J Nutr 133: 2057S – 2062S
PubMed CAS Google Scholar
Meijer AJ, Dubbelhuis PF (2004) Передача сигналов аминокислот и интеграция метаболизма. Biochem Biophys Res Commun 313: 397–403
PubMed CAS Статья Google Scholar
Melchior D, Le Floc’h N, Seve B (2003) Влияние хронического воспаления легких на метаболизм триптофана у поросят.Adv Exp Med Biol 527: 359–362
PubMed CAS Google Scholar
Montanez R, Rodriguez-Caso C, Sanchez-Jimenez F, Medina MA (2008) Анализ катаболизма аргинина in silico как источника оксида азота или полиаминов в эндотелиальных клетках. Аминокислоты 34: 223–229
PubMed CAS Статья Google Scholar
Morris SM Jr (2007) Метаболизм аргинина: границы наших знаний.J Nutr 137: 1602S – 1609S
PubMed CAS Google Scholar
Nakashima K, Yakabe Y, Ishida A et al (2007) Подавление миофибриллярного протеолиза в скелетных мышцах кур с помощью α-кетоизокапроата. Аминокислоты 33: 499–503
PubMed CAS Статья Google Scholar
Newsholme P, Brennnan L, Rubi B, Maechler P (2005) Новые взгляды на метаболизм аминокислот, функцию бета-клеток и диабет.Clin Sci 108: 185–194
PubMed CAS Статья Google Scholar
Novelli A, Tasker RAR (2008) Возбуждающие аминокислоты при эпилепсии: от клиники к лаборатории. Аминокислоты 32: 295–297
Статья CAS Google Scholar
Орландо Г.Ф., Вольф Г., Энгельманн М. (2008) Роль нейрональной синтазы оксида азота в регуляции нейроэндокринной стрессовой реакции у грызунов: выводы от мутантных мышей.Аминокислоты 35: 17–27
PubMed CAS Статья Google Scholar
Ou DY, Li DF, Cao YH et al (2007) Пищевые добавки с оксидом цинка снижают экспрессию фактора стволовых клеток в тонком кишечнике поросят-отъемышей. J Nutr Biochem 18: 820–826
PubMed CAS Статья Google Scholar
Palii SS, Kays CE, Deval C et al (2008) Специфичность регулируемой аминокислотами экспрессии гена: анализ гена, подвергнутого либо полной, либо единственной аминокислотной депривации.Аминокислоты. DOI: 10.1007 / s00726-008-0199-2
Perta-Kajan J, Twardowski T, Jakubowski H (2007) Механизмы токсичности гомоцистеина у людей. Аминокислоты 32: 561–572
Статья CAS Google Scholar
Phang JM, Donald SP, Pandhare J, Liu Y (2008) Метаболизм пролина, как субстрата стресса, модулирует канцерогенные пути. Аминокислоты 35: 681–690
PubMed CAS Статья Google Scholar
Platten M, Ho PP, Youssef S. et al (2005) Лечение аутоиммунного нейровоспаления синтетическим метаболитом триптофана.Наука 310: 850–855
PubMed CAS Статья Google Scholar
Ptolemy AS, Lee R, Britz-McKibbin P (2007) Стратегии комплексного анализа аминокислотных биомаркеров окислительного стресса. Аминокислоты 33: 3–18
PubMed CAS Статья Google Scholar
Rees WD, Wilson FA, Maloney CA (2006) Метаболизм серных аминокислот во время беременности: влияние метионина в рационе матери.J Nutr 136: 1701S – 1705S
PubMed CAS Google Scholar
Rhoads JM, Wu G (2008) Передача сигналов глутамина, аргинина и лейцина в кишечнике. Аминокислоты. DOI: 10.1007 / s00726-008-0225-4
Rhoads JM, Argenzio RA, Chen WN et al (1997) l-глутамин стимулирует пролиферацию кишечных клеток и активирует митоген-активируемые протеинкиназы. Am J Physiol Gastrointest Liver Physiol 272: G943 – G953
CAS Google Scholar
Rhoads JM, Niu X, Odle J, Graves LM (2006) Роль передачи сигналов mTOR в миграции кишечных клеток.Am J Physiol Gastrointest Liver Physiol 291: G510 – G517
PubMed CAS Статья Google Scholar
Rhoads JM, Niu XM, Surendran S. et al (2008) Аргинин стимулирует миграцию кишечных эпителиальных клеток посредством механизма, требующего передачи сигналов как оксида азота, так и p70s6k. J Nutr 138: 1652–1657
PubMed CAS Google Scholar
Rider JE, Hacker A, Mackintosh CA et al (2007) Спермин и спермидин опосредуют защиту от окислительного повреждения, вызванного перекисью водорода.Аминокислоты 33: 231–240
PubMed CAS Статья Google Scholar
Riedijk MA, Stoll B, Chacko S et al (2007) Трансметилирование и транссульфурация метионина в желудочно-кишечном тракте поросят. Proc Natl Acad Sci USA 104: 3408–3413
PubMed CAS Статья Google Scholar
Sahai A, Pan XM, Paul R et al (2006) Роль фосфатидилинозитол-3-киназы и остеопонтина в стеатозе и высвобождении аминотрансферазы гепатоцитами, обработанными средой с дефицитом метионин-холина.Am J Physiol Gastrointest Liver Physiol 291: G55 – G62
PubMed CAS Статья Google Scholar
Sancak Y, Peterson TR, Shaul YD et al (2008) ГТФазы Rag связываются с хищником и опосредуют передачу сигналов аминокислот с mTORC1. Наука 320: 1496–1501
PubMed CAS Статья Google Scholar
Сарбасов Д., Гертин Д., Али С., Сабатини Д. (2005) Фосфорилирование и регуляция Akt / PKB комплексом rictor-mTOR.Science 307: 1098–1101
PubMed CAS Статья Google Scholar
Scolari MJ, Acosta GB (2007) d-серин: новый мир в глутааматергическом нейроглиальном языке. Аминокислоты 33: 563–574
PubMed CAS Статья Google Scholar
Self JT, Spencer TE, Johnson GA et al (2004) Синтез глутамина в развивающейся плаценте свиньи. Биол Репрод 70: 1444–1451
PubMed CAS Статья Google Scholar
She P, Reid TM, Bronson SK et al (2007) Нарушение BCATm у мышей приводит к увеличению расхода энергии, связанного с активацией цикла бесполезного обмена белка.Cell Metab 6: 181–194
PubMed CAS Статья Google Scholar
Shi W., Meininger CJ, Haynes TE et al (2004) Регулирование синтеза и биодоступности тетрагидробиоптерина в эндотелиальных клетках. Cell Biochem Biophys 41: 415–433
PubMed CAS Статья Google Scholar
Smith SB, Kawachi H, Choi CB et al (2008) Клеточная регуляция развития и состава внутримышечной жировой ткани крупного рогатого скота.J Anim Sci. DOI: 10.2527 / jas.2008-1340
Google Scholar
Stipanuk MH, Ueki I, Dominy JE et al (2008) Цистеиндиоксигеназа: надежная система для регулирования клеточных уровней цистеина. Аминокислоты. DOI: 10.1007 / s00726-008-0202-y
Столл Б., Генри Дж., Ридс П.Дж. и др. (1998) Катаболизм доминирует в кишечном метаболизме первого прохождения незаменимых аминокислот у поросят, получавших молочный белок.J Nutr 128: 606–614
PubMed CAS Google Scholar
Suenaga R, Tomonaga S, Yamane H et al (2008) Внутрицеребровентрикулярная инъекция l-аргинина вызывает седативные и снотворные эффекты при остром стрессе у новорожденных цыплят. Аминокислоты 35: 139–146
PubMed CAS Статья Google Scholar
Sugita Y, Takao K, Toyama Y, Shirahata A (2007) Повышение кишечной абсорбции макромолекул спермином у крыс.Аминокислоты 33: 253–260
PubMed CAS Статья Google Scholar
Sun YP, Nonobe E, Kobayashi Y et al (2002) Характеристика и экспрессия оксидазы l-аминокислот в мышином молоке. J Biol Chem 277: 19080–19086
PubMed CAS Статья Google Scholar
Suryawan A, O’Connor PMJ, Bush JA et al (2008a) Дифференциальная регуляция синтеза белка аминокислотами и инсулином в периферических и висцеральных тканях новорожденных свиней.Аминокислоты. DOI: 10.1007 / s00726-008-0149-z
Suryawan A, Jeyapalan AS, Orellana RA et al (2008b) Лейцин стимулирует синтез белка в скелетных мышцах новорожденных свиней, усиливая активацию mTOR1. Am J Physiol Endocrinol Metab 295: E868 – E875
PubMed CAS Статья Google Scholar
Tan BE, Li XG, Kong XF et al (2008a) Добавка в рацион L-аргинина усиливает иммунный статус у поросят на раннем отъеме.Аминокислоты. DOI: 10.1007 / s00726-008-0155-1
Tan BE, Yin YL, Liu ZQ et al (2008b) Добавка с пищей L-аргинина увеличивает прирост мышечной массы и снижает жировую массу тела у свиней на доращивании и откорме. Аминокислоты. DOI: 10.1007 / s00726-008-0148-0
Tischler ME, Desautels M, Goldberg AL (1982) Регулирует ли лейцин, лейцил-переносящая РНК или какой-либо метаболит лейцина синтез и распад белка в скелетных и сердечных мышцах? J Biol Chem 257: 1613–1621
PubMed CAS Google Scholar
Tujioka K, Okuyama S, Yokogoshi H et al (2007) Пищевая гамма-аминомасляная кислота влияет на скорость синтеза белка в головном мозге молодых крыс.Аминокислоты 32: 255–260
PubMed CAS Статья Google Scholar
Van Brummelen R, du Toit D (2007) L-метионин как добавка для поддержки иммунитета: клиническая оценка. Аминокислоты 33: 157–163
PubMed Статья CAS Google Scholar
Van Goudoever JB, Stoll B, Henry JF et al (2000) Адаптивная регуляция метаболизма лизина в кишечнике.Proc Natl Acad Sci USA 97: 11620–11625
PubMed Статья Google Scholar
Wang X, Qiao SY, Yin YL et al (2007) Дефицит или избыток диетического треонина снижает синтез белка в тощей кишке и скелетных мышцах молодых свиней. J Nutr 137: 1442–1446
PubMed CAS Google Scholar
Wang JJ, Chen LX, Li P et al (2008a) Экспрессия генов изменяется в тонком кишечнике поросят при отъеме и добавлении глутамина в рацион.J Nutr 138: 1025–1032
PubMed CAS Google Scholar
Wang WW, Qiao SY, Li DF (2008b) Аминокислоты и функция кишечника. Аминокислоты. DOI: 10.1007 / s00726-008-0152-4
Wang JJ, Wu G, Zhou HJ, Wang FL (2008c) Новые технологии исследования аминокислотного питания в постгеномную эру. Аминокислоты. DOI: 10.1007 / s00726-008-0193-8
Wang X, Ou D, Yin J et al (2009) Протеомный анализ выявляет измененную экспрессию белков, связанных с метаболизмом глутатиона и апоптозом в тонком кишечнике поросят с добавкой оксида цинка.Аминокислоты. DOI: 10.1007 / s00726-009-0242-y
Watford M, Wu G (2005) Метаболизм глутамина у урикотелических видов: изменение глутаминсинтетазы в скелетных мышцах, глутаминазы, уровней глутамина и скорости синтеза белка. Comp Biochem Physiol B 140: 607–614
PubMed Статья CAS Google Scholar
Willis A, Beander HU, Steel G, Valle D (2008) Варианты PRODH и риск шизофрении.Аминокислоты 35: 673–679
PubMed CAS Статья Google Scholar
Wu G (1995) Синтез мочевины в энтероцитах развивающихся свиней. Biochem J 312: 717–723
PubMed CAS Google Scholar
Wu G (1997) Синтез цитруллина и аргинина из пролина в энтероцитах постнатальных свиней. Am J Physiol 272: G1382 – G1390
PubMed CAS Google Scholar
Wu G (1998) Катаболизм аминокислот слизистой оболочки кишечника.J Nutr 128: 1249–1252
PubMed CAS Google Scholar
Wu G, Knabe DA (1994) Свободные и связанные с белком аминокислоты в молозиве и молоке свиноматки. J Nutr 124: 415–424
PubMed CAS Google Scholar
Wu G, Meininger CJ (2002) Регулирование синтеза оксида азота диетическими факторами. Анну Рев Нутр 22: 61–86
PubMed CAS Статья Google Scholar
Wu G, Meininger CJ (2009) Оксид азота и сосудистая инсулинорезистентность.Биофакторы 35: 21–27
Статья PubMed CAS Google Scholar
Wu G, Morris SM Jr (1998) Метаболизм аргинина: оксид азота и не только. Biochem J 336: 1–17
PubMed CAS Google Scholar
Wu G, Thompson JR (1987) Кетоновые тела ингибируют разложение лейцина в скелетных мышцах цыплят. Int J Biochem 19: 937–943
PubMed CAS Статья Google Scholar
Wu G, Thompson JR (1990) Влияние глутамина на обмен белка в скелетных мышцах цыплят in vitro.Biochem J 265: 593–598
PubMed CAS Google Scholar
Wu G, Bazer FW, Tuo W (1995) Изменения в развитии концентраций свободных аминокислот в фетальных жидкостях свиней. J Nutr 125: 2859–2868
PubMed CAS Google Scholar
Wu G, Meier SA, Knabe DA (1996a) Пищевые добавки с глутамином предотвращают атрофию тощей кишки у свиней-отъемышей. J Nutr 126: 2578–2584
PubMed CAS Google Scholar
Wu G, Bazer FW, Tuo W et al (1996b) Необычное содержание аргинина и орнитина в аллантоисной жидкости свиньи.Биол Репрод 54: 1261–1265
PubMed CAS Статья Google Scholar
Wu G, Knabe DA, Flynn NE et al (1996c) Расщепление аргинина в развивающихся энтероцитах свиней. Am J Physiol Gastrointest Liver Physiol 271: G913 – G919
CAS Google Scholar
Wu G, Bazer FW, Cudd TA et al (2004a) Питание матери и развитие плода. J Nutr 134: 2169–2172
PubMed CAS Google Scholar
Wu G, Fang YZ, Yang S. et al (2004b) Метаболизм глутатиона и его значение для здоровья.J Nutr 134: 489–492
PubMed CAS Google Scholar
Wu G, Knabe DA, Kim SW (2004c) Аргининовое питание новорожденных свиней. J Nutr 134: 2783S – 2790S
PubMed CAS Google Scholar
Wu G, Bazer FW, Hu J et al (2005) Синтез полиамина из пролина в развивающейся плаценте свиньи. Биол Репрод 72: 842–850
PubMed CAS Статья Google Scholar
Wu G, Bazer FW, Wallace JM, Spencer TE (2006) Задержка внутриутробного развития: последствия для наук о животных.J Anim Sci 84: 2316–2337
PubMed CAS Статья Google Scholar
Wu G, Bazer FW, Davis TA et al (2007a) Важные роли аминокислот семейства аргинина в питании и производстве свиней. Livest Sci 112: 8–22
Статья Google Scholar
Wu G, Bazer FW, Cudd TA et al (2007b) Фармакокинетика и безопасность добавок аргинина для животных.J Nutr 137: 1673S – 1680S
PubMed CAS Google Scholar
Wu G, Collins JK, Perkins-Veazie P et al (2007c) Пищевые добавки с соком арбузных жмыхов увеличивают доступность аргинина и улучшают метаболический синдром у крыс с диабетом Цукера. J Nutr 137: 2680–2685
PubMed CAS Google Scholar
Wu G, Bazer FW, Datta S. et al (2008a) Метаболизм пролина в концепте: последствия для роста и развития плода.Аминокислоты 35: 691–702
PubMed CAS Статья Google Scholar
Wu G, Bazer FW, Davis TA et al (2008b) Метаболизм аргинина и питание в росте, здоровье и болезнях. Аминокислоты. DOI: 10.1007 / s00726-008-0210-у
Xia Y, Wen HY, Young ME et al (2003) Рапамицин и передача сигналов протеинкиназы A у млекопитающих опосредуют транскрипционный ответ сердца на глутамин.J Biol Chem 278: 13143–13150
PubMed CAS Статья Google Scholar
Yan GR, He QY (2008) Функциональная протеомика для идентификации критических белков в путях передачи сигнала. Аминокислоты 35: 267–274
PubMed CAS Статья Google Scholar
Yao K, Yin YL, Chu WY et al (2008) Добавка аргинина в рацион увеличивает сигнальную активность mTOR в скелетных мышцах новорожденных свиней.J Nutr 138: 867–872
PubMed CAS Google Scholar
Zeng XF, Wang FL, Fan X et al (2008) Добавление аргинина в рацион на ранних сроках беременности увеличивает выживаемость эмбрионов у крыс. J Nutr 138: 1421–1425
PubMed CAS Google Scholar
Регуляторные механизмы, лежащие в основе координации катаболизма аминокислот и глюкозы у Escherichia coli
Вывод динамики потока из профилей экзо-метаболома
В качестве примера сложной питательной среды мы культивировали E.coli дикого типа BW25113 в минимальной среде M9 с глюкозой (5 г / л) и казаминовыми кислотами (CAA) (2 г / л), неопределенной смесью аминокислот и олигопептидов из переваренного молочного белка 23 . Культура демонстрировала классическую кривую роста партии с 4-часовым ростом, колеблющимся около максимальной экспоненциальной скорости роста, с последующим непрерывным снижением скорости роста (рис. 1а и дополнительный рис. 1). Чтобы определить условия питания, которые лежат в основе изменений скорости роста, мы собрали аликвоты культурального супернатанта в десяти временных точках кривой роста.Чтобы максимизировать охват метаболитов в среде и масштабировать этот подход к измерениям динамических изменений экзо-метаболома с высоким разрешением во времени 24 , мы контролировали относительное содержание 8091 иона с помощью времени пролета потока-инъекции. -спектрометрия (FIA-TOFMS) 21 . 427 из этих ионов могут быть предположительно аннотированы как депротонированные метаболиты, что соответствует почти 40% метаболитов, представленных в модели в масштабе генома E. coli 25 , и 61% при рассмотрении только метаболитов с известным активным или пассивный транспортный механизм (рис.1б). Сто шестьдесят семь из 427 обнаруженных метаболитов уже присутствовали в среде, демонстрируя, что CAA является потенциально сложным источником альтернативных питательных веществ помимо аминокислот. В частности, мы обнаружили несколько предшественников нуклеотидов (дополнительный рис. 2). Чтобы проверить, присутствуют ли эти соединения в соответствующих физиологических концентрациях, мы показали, что CAA может поддерживать рост нокаутов гена E. coli , которые являются ауксотрофными по уридину, GMP, биотину и ксантину (дополнительный рис.3). Из 427 метаболитов, обнаруженных в отработанной среде, 35% только потреблялись, а 34% секретировались (рис. 1c). Последние метаболиты предположительно являются результатом избыточного метаболизма, выходящего за рамки центрального метаболизма 26,27 , и вовлекают периферические пути, такие как метаболизм нуклеотидов, что согласуется с более ранними наблюдениями 28 (дополнительный рис. 4a). Остальные метаболиты, такие как промежуточные продукты цикла трикарбоновой кислоты (ТСА) (дополнительный рис. 4b), демонстрируют более сложные модели секреции и потребления.
Рис. 1Профиль экзо-метаболома. a Оптическая плотность (OD 600 ; синяя линия) и мгновенная скорость роста, т. Е. OD 600 разница между двумя смежными временными точками, разделенная на временной интервал (красная линия), выращиваемой культуры E. coli в минимальной среде глюкозы M9 с добавлением казаминовых кислот (CAA). Точки представляют собой моменты времени для отбора аликвот супернатанта для анализа экзо-метаболома. Сплошная линия представляет собой среднее значение для четырех биологических повторов, а заштрихованная область представляет собой среднее значение ± стандартное отклонение. b Процент обнаруженных метаболитов по отношению к аннотированным соединениям в модели в масштабе генома E. coli 25 : метаболиты, которые могут обмениваться с внешней средой (белый и желтый), и метаболиты, которые ограничены быть внутриклеточными (красными и черными). c Процент обнаруженных метаболитов, демонстрирующих сложные (желтый) или монотонный профиль, т.е. мгновенное производное во времени всегда отрицательно (зеленый — потребляется) или положительно (синий — секретируется). d Общий входящий поток углерода в каждый данный момент времени рассчитывается путем умножения количества атомов углерода для каждого соединения на соответствующий оцененный поток поглощения. Сообщается относительный процент. Перечислены только те метаболиты, на долю которых приходится не менее 2% общего поступающего углерода. Остальные соединения сгруппированы (т.е.различны в легенде). Соответствие между идентификаторами метаболитов в легенде и названиями метаболитов можно найти в дополнительных данных 1
В то время как наша платформа метаболомики выявила неожиданно сложную динамику экзо-метаболома, предполагающую широко распространенную секрецию метаболитов как гомеостатический механизм, полученные относительные изменения концентрации не учитывают прямой вывод внутриклеточных потоков в рамках классической структуры FBA 8,15,29 .Чтобы интегрировать такие нецелевые, прямые метаболомические измерения потока-инъекции 21 в модель в масштабе генома для оценки динамического потока, мы использовали моделирование на основе ограничений и разработали структуру, которая состоит из трех основных шагов. Сначала мы определили абсолютные концентрации для обильных компонентов среды, а именно глюкозы, ацетата и 20 аминокислот (дополнительные данные 1). Глюкозу и ацетат измеряли с использованием существующих наборов ферментов, а для аминокислот мы построили калибровочные кривые на нашей нецелевой масс-спектрометрической платформе (см. Дополнительные методы).Качество этого нецелевого количественного определения аминокислот сравнимо с качеством стандартного метода жидкостной хроматографии высокого давления (ВЭЖХ) 30 (дополнительный рисунок 5), но имеет в несколько раз более высокую пропускную способность и чувствительность. Во-вторых, зависящие от времени профили всех обнаруженных метаболитов, включая глюкозу, ацетат, аминокислоты и оставшиеся 407 метаболитов, обнаруженных с помощью FIA-TOFMS (дополнительные данные 1), были интерполированы с использованием многомерных сплайнов адаптивной регрессии (MARS) 31 .Модели MARS основаны на кусочной регрессии и автоматически определяют количество базовых сплайновых функций и местоположений узлов без необходимости ручного управления 31 . Чтобы оценить вариативность подгонки оценок из-за шума в измерениях, мы использовали подход бутстрэппинга. Для каждого метаболита мы повторили подборку 1000 раз, используя только 90% данных. Оценки ошибок были рассчитаны как стандартное отклонение для подгонки, полученной из данных с субдискретизацией (например, серая заштрихованная область на рис.2в). Затем мы оценили относительные мгновенные скорости поглощения и секреции, вычислив разницу уровней метаболитов между двумя последовательными временными точками, разделенную на изменение оптической плотности (OD 600 ) и умноженную на мгновенную скорость роста (дополнительные данные 1). В-третьих, мы включили предполагаемые скорости поглощения и секреции в подход, основанный на ограничениях, чтобы разрешить динамические внутриклеточные метаболические реакции на изменения в доступности питательных веществ. Подобно другим подходам к динамическому моделированию FBA 8,17,32 , рост бактерий был разделен на N интервалов с равноудаленными оптическими плотностями (OD), и потоки предполагались постоянными в пределах этих интервалов.Абсолютные и относительные скорости потребления / секреции используются в качестве мягких ограничений для уменьшения объема возможных решений по потокам. Чтобы учесть изменчивость расчетных скоростей, в модель включены нижняя и верхняя границы для каждого обменного потока (т. Е. Среднее ± стандартное отклонение, определяемое методом бутстрэппинга). Поскольку изменения OD 600 можно регулярно измерять с высоким временным разрешением и точностью с помощью стандартных планшет-ридеров, экспериментально измеренные скорости роста используются в качестве жесткого ограничения в модели.Следовательно, не нужно прибегать к максимизации целевого показателя биомассы. Для метаболитов без внешней калибровки мы вводим вспомогательную не зависящую от времени переменную, представляющую коэффициент пропорционального масштабирования ( c ) между измеренной интенсивностью МС и фактическими концентрациями. Вместо решения потоков ( v ( t )) в каждый момент времени независимо 33 , наш метод сформулирован как одношаговая глобальная задача линейной оптимизации для создания зависимых от времени карт потоков.Модель на основе одного ограничения содержит сети в масштабе генома ( S ) для каждой временной точки, временные границы потоков поглощения и секреции, оцененные на основе абсолютных измерений глюкозы, ацетата и аминокислот в супернатанте (\ (\ tilde v (t) \)), и только для обменных потоков с относительными оценками скоростей потребления / секреции ( u ( t )) вектор не зависящих от времени масштабных коэффициентов c .
Рис. 2Прогнозирование метаболических потоков в зависимости от времени. a Процент неактивных (фиолетовый) и активных (зеленый) реакций на протяжении всего периода времени и реакций, которые переносят поток в течение ограниченного времени (желтый). b z — нормализованные значения зависящих от времени потоков для переходных реакций с прогнозируемым потоком, превышающим 1 ммоль / гДВт / ч, по крайней мере, в один момент времени. c Прогнозируемые зависящие от времени потоки через НАД- и НАДФ-зависимые яблочные ферменты MaeA и MaeB, соответственно. d Среднее значение ± стандартное отклонение в четырех повторностях скорости роста у дикого типа E.coli (WT), ΔmaeA и ΔmaeB в минимальной среде для глюкозы M9 и M9 + CAA (*** p — значение ≤ 0,001, двусторонний парный тест t ). e Среднее ± стандартное отклонение в четырех повторах скоростей роста в E. coli (WT) дикого типа, ΔmaeA и ΔmaeB в минимальной среде глюкозы M9 с повышением концентрации аспартата по сравнению с M9 без аспартата (** p — значение ≤ 0,01, двусторонний парный t -тест)
Чтобы вывести неизвестные v ( t ) и c , мы последовательно минимизировали три цели: (i) расстояние L1-нормы между прогнозируемыми ( v ( t )) и расчетный (\ (\ tilde v (t) \)) обменные потоки по абсолютным измерениям метаболитов, (ii) расстояние L1-нормы между прогнозируемым v ( t ) и расчетным относительные обменные курсы ( и ( t )) и (iii) сумма абсолютных потоков за весь временной ход (\ (\ mathop {\ sum} \ limits_t {| v \ left (t \ right) | } \)).Объединение набора ограничений, сгенерированных в каждый момент времени в одной задаче глобальной оптимизации, позволяет нам решать вектор масштабных коэффициентов ( c ) и зависящие от времени потоки ( v ( t )) одновременно, так что решения потоков для каждого временного интервала зависят друг от друга.
Для проверки неопределенности оценок потоков мы выполнили анализ изменчивости потоков (FVA) оптимального решения потоков: для каждой реакции мы вычислили максимальную и минимальную сумму потоков во времени.Мы обнаружили, что для подавляющего большинства (81%) метаболических реакций изменчивость потока была в пределах 10% от сообщенного раствора потока (дополнительный рис. 6). 738 реакций (29%) из 2583 в модели были активны на протяжении большей части времени, в основном представляя реакции, необходимые для производства энергии и биомассы. Особый интерес представляют те реакции (8%), которые были активными только временно и, следовательно, могут отражать специфические адаптивные механизмы, лежащие в основе изменений доступности питательных веществ (рис.2а). Большинство этих реакций были вовлечены в транспорт, обмен и катаболизм аминокислот, предшественников нуклеотидов и промежуточных продуктов центрального метаболизма (рис. 2b).
Среди временно активных реакций мы обнаружили НАД- и НАДФ-зависимые яблочные ферменты, которые катализируют анаплеротическую реакцию, превращающую малат в пируват (рис. 2c и дополнительный рис. 7). Хотя эти анаплеротические реакции неактивны в минимальной среде глюкозы 34 , зависящие от времени оценки потока через яблочные ферменты MaeA и MaeB предполагают раннюю временную активацию потока от малата к пирувату в присутствии CAA (рис.2в). Чтобы подтвердить это предсказание и проверить функциональность яблочных ферментов в сложной среде, мы отслеживали рост двух отдельных мутантов с нокаутом яблочного фермента Δ maeA и Δ maeB в M9 + CAA. В соответствии с предсказаниями модели более ранней и более сильной активации НАД-зависимого фермента MaeA (рис. 2c), мы наблюдали, что максимальные скорости роста были аналогичны дикому типу глюкозы M9, в то время как Δ maeA демонстрирует значительно более низкий максимум. темп роста в M9 + CAA (двусторонний парный t -тест, p -значение ≤ 0.001) (рис. 2г). Поскольку малат близок к точке входа аспартата / аспарагина, а аспартат является известным аллостерическим активатором обоих яблочных ферментов 35,36 , мы предположили, что яблочные ферменты особенно важны в опосредовании использования C4-субстратов, таких как аспартат. Чтобы проверить эту возможность, мы повторили анализ роста в среде глюкозы M9, дополненной различными концентрациями аспартата (рис. 2e). Этот эксперимент подтвердил нашу гипотезу и показал, что в присутствии аспартата Δ maeA имеет пониженную скорость роста по сравнению с диким типом.В целом, мы продемонстрировали, что ограничение модели FBA комбинацией абсолютных и относительных измерений концентраций метаболитов в супернатанте позволяет оценить динамические перестройки внутриклеточного потока во время последовательного использования и истощения питательных веществ в сложной среде.
Динамическая координация потребления аминокислот и глюкозы
Наш модельный анализ выявил в основном две фазы роста, примерно до и после того, как культура достигает OD 600 , равного 1.Первая фаза характеризуется катаболизмом аминокислот, таких как аспартат, глицин, глутамат и серин, которые обеспечивают большую часть углерода (~ 40%) и азота (70-80%) для быстрого роста в течение первых ~ 3 часов ( Рис. 1d и дополнительные рисунки 8 и 9). Во время этой фазы культура демонстрировала низкое поглощение глюкозы, высокое перетекание ацетата и избыточное потребление азота (фиг. 1d и 3 и дополнительные фиг. 8 и 9). Предполагается, что это избыточное потребление азота уравновешивается секрецией аммиака, явление также наблюдается в присутствии больших количеств глутамина 37 .Около 20% углерода, необходимого для образования биомассы, было получено из метаболитов, отличных от аминокислот и глюкозы, но ни один из метаболитов не внес более 2% в общий углеродный баланс (рис. 1d). Примечательно, что на самой первой фазе роста модельный анализ данных экзо-метаболома предсказал высокие катаболические потоки от 2 до 5 ммоль / гДВт / ч для глицина и серина в пируват и для аспартата в оксалоацетат (дополнительный рис. 10). После почти полного истощения этих аминокислот глюкоза и аммиак стали основными источниками углерода и азота соответственно (рис.1d и дополнительный рис. 9). На этой второй фазе поглощение глюкозы увеличилось примерно с 6 до 8 ммоль / гДТ / ч, а секреция ацетата снизилась примерно на 35% (рис. 3).
Рис. 3Расчетные скорости поглощения аминокислот. Измеренные концентрации аминокислот в супернатанте (крестики) и интерполированные значения (синие линии). Черная линия представляет рассчитанную мгновенную скорость поглощения, а серая заштрихованная область — доверительные интервалы. Потребность в потоке для биосинтеза белка (зеленая линия) оценивалась по стехиометрии состава биомассы, умноженной на мгновенную скорость роста.Области, заштрихованные красным, очерчивают нижнюю и верхнюю границы потребностей в аминокислотах для биосинтеза белка, оцененных на основе экспериментальных измерений содержания белка в E. coli , выращенных в богатой среде (время удвоения ~ 20 мин) и минимальной среде глюкозы (время удвоения ~ 60 мин) 43 . Пунктирные красные линии — это прямые линейные интерполяции от верхней и нижней границ, умноженные на мгновенную скорость роста. Экспериментально определенные скорости поглощения глюкозы и секреции ацетата (черная линия / серая область) сравниваются с оценками из анализа вариабельности моделирования моделей с ограничениями (красная область).Фоны диаграммы всех неразлагаемых аминокислот выделены желтым цветом, а цвет шрифта — красным. Аминокислоты, разложившиеся в один и тот же продукт, сгруппированы по разным цветам в соответствии с центральной схематической метаболической сетью
На протяжении этих двух фаз скорость потребления аминокислот варьировалась примерно на один порядок (рис. 3). Скорость поглощения для всех семи неразлагаемых аминокислот (рис. 3, области желтой диаграммы) была ниже или соответствовала теоретическим требованиям для биосинтеза белка при данной скорости роста.Похоже на поглощение метионина, которое ингибируется внутренними уровнями метионина 38 , похоже, что скорости поглощения всех неразлагаемых аминокислот жестко регулируются внутренними петлями обратной связи, возможно, чтобы избежать накопления токсичных промежуточных продуктов 39 . Напротив, более половины разлагаемых аминокислот (то есть 7 из 13), в частности серин, глицин, треонин, аспартат и глутамат, потреблялись с гораздо большей скоростью, чем требуется исключительно для биосинтеза белка.В соответствии с предыдущими данными 40 , мы обнаружили, что среднее количество аминокислоты, потребляемой на единицу изменения OD 600 (то есть начальная концентрация аминокислоты, деленная на OD 600 во время истощения), обратно пропорционально ее величине. метаболические затраты, определяемые как количество высокоэнергетических фосфатных связей, необходимых для биосинтеза 41 (рис. 4a, b). Таким образом, наши данные подтверждают гипотезу о том, что стоимость биосинтеза аминокислот оказывает избирательное давление, чтобы кодировать менее дорогие аминокислоты в очень распространенных белках 41,42 (дополнительный рис.11). Чтобы проверить, зависят ли наблюдаемые скорости поглощения аминокислот от их абсолютной или относительной концентрации в среде, мы дополнили среду семью смесями всех аминокислот в различных количествах и определили их индивидуальные средние скорости поглощения (рис. 4d). Для большинства аминокислот различные количества их концентраций в среде не повлияли на наши предыдущие выводы (дополнительные рисунки 11 и 12). Однако средние скорости поглощения некоторых аминокислот (например, глутамата, глицина и аспартата) демонстрируют более высокую дисперсию, чем другие, в зависимости от условий (рис.4d и дополнительные данные 2). Мы стремились найти потенциальные регуляторные зависимости между аминокислотами, коррелируя скорости поглощения между всеми парами аминокислот в семи условиях (рис. 4e-g). В среднем серин и аспартат демонстрируют наиболее сильную корреляцию со скоростью поглощения других аминокислот, что свидетельствует о заметной роли этих аминокислот в регуляции потребления питательных веществ (рис. 4e). Мы обнаружили наиболее сильную положительную корреляцию между валином и изо- / лейцином и подтвердили функциональную взаимосвязь между этими аминокислотами, показав, что если лейцин или изолейцин истощаются раньше валина, рост бактерий сильно подавляется (рис.4f и дополнительный рисунок 13), что согласуется с предыдущими выводами 39 .
Рис. 4Расход против стоимости аминокислот. a Каждая точка представляет одну аминокислоту, а красная линия — мгновенная скорость роста клеток. Для каждой аминокислоты начальная концентрация связана с OD 600 , при котором аминокислота была истощена из среды. b Для каждой аминокислоты ее метаболическая стоимость, т. Е. Количество высокоэнергетических фосфатных связей, необходимых для биосинтеза 41 , сравнивается с соотношением между исходной концентрацией аминокислоты и OD культуры 600 во время показанного истощения. в — . c Для каждой аминокислоты ее метаболическая стоимость 41 сравнивается со средней оценкой ее скорости поглощения, рассчитанной как начальная концентрация аминокислоты, деленная на часы и грамм культуры сухой биомассы (gDW) на момент получения аминокислоты. истощение. d Распределение средней скорости поглощения аминокислот по семи средам, содержащим различные исходные количества аминокислот (см. Также дополнительный рис. 12). e Тепловая карта парной корреляции между средней скоростью поглощения аминокислот в семи тестируемых условиях.Коробчатая диаграмма парной корреляции для каждой аминокислоты. Края прямоугольника соответствуют 25-му и 75-му процентилям, усы включают крайние точки данных, а выбросы показаны красными знаками плюс. f Средние показатели поглощения валина по сравнению с изо- / лейцином. г Средняя скорость поглощения аспарагина по сравнению с глутамином
В целом, наши данные показывают, что аминокислоты, которые «дешевы» в производстве, такие как серин, глицин, треонин и аспартат, усваиваются с гораздо большей скоростью и разлагаются. тем самым потенциально снижая потребность в глюкозе как в источнике углерода и энергии (рис.1г). Примечательно, что несколько недорогих аминокислот, которые потреблялись со скоростью, не превышающей потребности для биосинтеза белка, а именно пролин, аргинин, глутамин и аспарагин, не могут быть непосредственно разложены, но сначала их необходимо преобразовать в глутамат или аспартат. Остальные аминокислоты, которые могут быть непосредственно разложены, но вместо этого поглощаются с относительно низкой скоростью, — это аланин, триптофан и лизин. Однако, в отличие от других аминокислот, аланин также является важным компонентом пептидогликана клеточной стенки, а триптофан и лизин имеют высокие биосинтетические затраты (рис.4б, в). В совокупности эти результаты предполагают сложный компромисс между стоимостью разложения аминокислот, т. Е. Риском потери дорогостоящих ресурсов, таких как метионин 43 или триптофан 41 , и потенциальной выгодой удовлетворения спроса на углерод и азот.
Роль пирувата в координации катаболизма глюкозы
Выше мы обнаружили, что некоторые аминокислоты катаболизируются и даже снижают катаболизм глюкозы на ранних стадиях роста. В то время как основанная на глюкозе катаболитная репрессия менее предпочтительных субстратов относительно хорошо охарактеризована в E.coli 40,44,45,46 , гораздо меньше известно о влиянии других питательных веществ на потребление глюкозы 47,48 . Таким образом, мы затем исследовали, как E. coli координирует катаболизм аминокислот и глюкозы. В качестве ключевого регулятора поглощения и катаболизма углерода фактор транскрипции Crp регулирует экспрессию многих альтернативных систем захвата субстрата и генов, участвующих в деградации аминокислот и катаболизме углерода в E. coli 44 .Измеряя активность Crp с помощью репортерной плазмиды GFP, мы подтвердили, что глюкоза сильно подавляет активность Crp 44 и что добавление аминокислот не влияет на эту репрессию (рис. 5a). Таким образом, наши результаты предполагают, что регуляция транскрипции с помощью Crp не отвечает за снижение потребления глюкозы.
Рис. 5Координация катаболизма глюкозы и аминокислот. a Среднее ± стандартное отклонение активности Crp в различных питательных средах: минимальная среда с глюкозой (GLC) или сукцинатом (SUC в зеленом цвете, положительный контроль) и среда с минимальным содержанием глюкозы с добавлением казаминокислот (CAA), смесь синтетических аминокислот (SAA), SAA, лишенная аминокислот, которые могут расщепляться на пируват: (i) треонин, глицин и серин (STG) или (ii) треонин, глицин, серин, триптофан, цистеин и аланин (STGTCA), или α- кетоглутарат: (iii) глутамат, глутамин, пролин и аргинин (GGPA) или оксалоацетат: (iv) аспартат и аспарагин (AA) и минимальная среда глюкозы с 0.125 г / л глутамата (GLT). b Динамические изменения соотношения между фосфоенолпируватом и пируватом при добавлении САА. c Динамические относительные изменения содержания пирувата (синий), оксалоацетата (красный) и α-кетоглутарата (желтый) при добавлении различных смесей аминокислот и глюкозы в качестве основного источника углерода. d Относительные изменения содержания пирувата через 30 минут после добавления аминокислоты в зависимости от соотношения между секрецией ацетата и потреблением глюкозы. e Активность PtsI in vitro в присутствии только реагента фосфоенолпирувата (PEP) или PEP с добавлением глутамата (GLT), аланина (ALA), аспартата (ASP), бис-фосфата фруктозы (FBP), сукцината (SUC), глиоксилат (GOX), α-кетоглутарат (AKG), оксалоацетат (OXA) и оксамат (OXM). Столбчатые диаграммы показывают среднее значение ± стандартное отклонение для трех повторов.
Альтернативный механизм для более быстрого контроля поглощения глюкозы основан на изменении активности переносчика посредством фосфорилирования 49 или связывания малых молекул 5 .Дефосфорилирование первой стадии сахарно-фосфоенолпируватфосфотрансферазной системы (PTS), EIIA Glc , приводит к ингибированию транспорта нескольких источников углерода, не относящихся к PTS. Согласно существующей модели, быстрое увеличение соотношения между уровнями фосфоенолпирувата и пирувата будет соответствовать повышенному фосфорилированию EIIA Glc 49 и, следовательно, снижению поглощения глюкозы. Мы отслеживали немедленные изменения внутриклеточного соотношения между фосфоенолпируватом и пируватом после добавления CAA, используя метод целевой жидкостной хроматографии-масс-спектрометрии (ЖХ-МС) 50 (рис.5b, дополнительный рисунок 14 и дополнительные данные 2). Мы наблюдали быстрое увеличение внутриклеточного пирувата и почти постоянный уровень фосфоенолпирувата (рис. 5b), который, согласно текущей рабочей гипотезе, может вызывать дефосфорилирование EIIA Glc и способствовать поглощению глюкозы 49 . Хотя у нас нет прямых экспериментальных доказательств, снижение фосфорилирования EIIA Glc кажется неправдоподобным, потому что EIIA Glc уже полностью дефосфорилирован в присутствии глюкозы 49 .Более того, даже более высокое дефосфорилирование EIIA Glc соответствовало бы дополнительному увеличению поглощения глюкозы, вопреки нашим наблюдениям. Таким образом, совокупные данные свидетельствуют о том, что координация катаболизма глюкозы и аминокислот достигается за счет внутриклеточных сигнальных метаболитов; наиболее экономным объяснением является модуляция поглощения глюкозы продуктами разложения катаболизма аминокислот.
Чтобы проверить эту гипотезу и идентифицировать предполагаемые эффекторные метаболиты, мы добавили E.coli во время среднеэкспоненциального роста на минимальной среде с глюкозой с восемью различными смесями аминокислот. Каждая смесь лишена одного класса аминокислот, которые катаболизируются в любой из трех конечных продуктов разложения, а именно в α-кетокислоты: пируват, α-кетоглутарат или оксалоацетат. В каждом эксперименте мы определяли скорость роста, поглощения глюкозы и секреции ацетата и измеряли динамический ответ внутриклеточного метаболома до 90 мин после добавления аминокислот с помощью нецелевого FIA-TOFMS 51 (дополнительный рис.15 и дополнительные данные 2). Как правило, добавление аминокислот влияло на потребление глюкозы и секрецию ацетата (таблица 1) и вызывало большие изменения концентрации промежуточных продуктов центрального метаболизма, в первую очередь пирувата и оксалоацетата (см. Дополнительное обсуждение и дополнительный рис. 15). Относительные изменения концентрации, определенные с помощью FIA-TOFMS, соответствовали предыдущим измерениям абсолютной концентрации с помощью ЖХ-МС (дополнительные рисунки 14–16). Чтобы идентифицировать метаболиты-кандидаты, которые потенциально могут регулировать катаболизм глюкозы, мы коррелировали относительные изменения метаболитов через 15, 30, 60 и 90 минут после добавления аминокислот со скоростью роста, скоростью поглощения глюкозы, скоростью секреции ацетата и соотношением разделения секреции ацетата по сравнению спотребление глюкозы. По крайней мере, для одной временной точки четыре метаболита коррелировали с долей секретируемого ацетата относительно потребленной глюкозы, восемь — с секрецией ацетата и один — со скоростью роста, соответственно (дополнительный рисунок 17 и дополнительные данные 2) (абсолютное кратное изменение ≥ 2 и корреляция p — значение ≤ 0,001). В то время как в культурах с добавлением CAA концентрация большинства этих метаболитов неуклонно увеличивалась в течение 90 минут (дополнительный рисунок 15), уровни пирувата достигли пика через 30 минут и демонстрировали самую сильную корреляцию с соотношением между секрецией ацетата и поглощением глюкозы во всех добавках. смеси аминокислот (рис.5в, г). Мы обнаружили аналогичную корреляцию в ранее опубликованных данных 52 мониторинга метаболитов и изменений потока у мутантов с делецией генов (дополнительный рис. 18), предполагая, что связь между уровнями пирувата и поглощением / метаболизмом углерода не ограничивается конкретными условиями, протестированными здесь.
Таблица 1 Скорость роста, потребление глюкозы и скорости секреции ацетата культур клеток, выращенных на среде с глюкозой M9 и смесях SAA, лишенных определенных групп аминокислотБыстрое накопление и последующее истощение внутриклеточных уровней пирувата при добавлении CAA было совместимо с начальная фаза роста, во время которой потребление глюкозы снижалось, и последующая фаза после истощения дешевых аминокислот, характеризующаяся повышенным поглощением глюкозы и сниженной секрецией ацетата (рис.4а и 5в). В средах, в которых отсутствуют аминокислоты, такие как серин, глицин, треонин, триптофан, цистеин и аланин, которые расщепляются до пирувата, мы не наблюдали подавления поглощения глюкозы (таблица 1), показывая, что уровни пирувата изменяются в ответ на катаболизм аминокислот. Более того, предыдущие результаты экспериментов с хемостатом показали, что увеличение поглощения глюкозы соответствует повышенным внутриклеточным уровням пирувата 53 , что противоположно отрицательной корреляции (т. Е., Корреляция Пирсона = -0,7), обнаруженная здесь между уровнями пирувата и поглощением глюкозы. Следовательно, изменения пирувата вряд ли могут быть просто косвенным следствием изменений поглощения глюкозы.
Собранные данные свидетельствуют о том, что пируват является кандидатом на регулирование поглощения глюкозы и секреции ацетата. Активация секреции ацетата пируватом уже была известна, поскольку пируват является сильным активатором фосфотрансацетилазы, катализируя обратимое взаимное превращение ацетил-КоА и ацетилфосфата 54 .Более того, E. coli относительно медленно растет на пирувате, но с очень высокой секрецией ацетата> 30% от потребляемого углерода 34 , и аналогичный метаболизм переполнения наблюдается у других бактерий 55 . Более того, пируват подавляет активность PdhR, регулятора транскрипции, который негативно регулирует образование комплекса пируватдегидрогеназы (PDHc). Мы обнаружили, что, хотя делеция pdhR не влияет на рост M9 + CAA, скорость роста Δ pdhR умеренно (9%), но значительно снижена в глюкозе M9 (двусторонний парный t -тест, p -значение = 0.0045, дополнительный рисунок 19). Эти результаты предполагают, что остаточная активность PdhR в глюкозе M9 полностью устраняется, когда в среду добавляются аминокислоты, а внутриклеточные уровни пирувата увеличиваются до 20 раз. Комбинированное повышение уровней пирувата и снижение активности PdhR может потенциально поддерживать более высокий поток в ацетил-КоА и, возможно, в ацетат.
Чтобы проверить, может ли пируват также напрямую регулировать поглощение глюкозы, мы очистили PtsI, компонент системы PTS, который катализирует фосфорилирование глюкозы до глюкозо-6-фосфата с фосфоенолпируватом (PEP) в качестве донора фосфата.Мы определили активность PtsI in vitro в присутствии девяти различных промежуточных продуктов центрального метаболизма, используя известный ингибитор α-кетоглутарат в качестве положительного контроля 5,56 . Поскольку пируват является одним из продуктов реакции и показаниями анализа, для исследования ингибирования пируватом необходимо было использовать оксамат аналога пирувата (рис. 5e). В соответствии с нашей гипотезой, мы обнаружили, что соединения со сходными химическими свойствами с пируватом, такие как оксамат, оксалоацетат и α-кетоглутарат, но не глиоксилат, ингибируют PtsI (двусторонний парный t -тест, p -значение ≤ 0 .05), в то время как другие промежуточные продукты центрального метаболизма, такие как глутамат, аланин, аспартат, бисфосфат фруктозы и сукцинат, не проявляли ингибирующей активности (рис. 5e). Помимо непосредственного воздействия пирувата на PtsI, анализируя ранее опубликованные данные протеомики 57 , мы обнаружили, что пируват может вызывать множественные конформационные изменения во всех белковых субъединицах системы PTS (т.е. PtsG, Crr, PtsH и PtsI), что указывает на возможность того, что пируват влияет не только на PtsI, но и на стабильность всего белкового комплекса (дополнительный рис.20).
Чтобы дополнительно продемонстрировать, что повышенное содержание пирувата может избирательно ингибировать систему поглощения PTS, мы проверили потенциальный эффект ингибирования роста путем добавления внеклеточного пирувата к E. coli , растущим с глюкозой из источника углерода PTS или источника углерода, не являющегося источником углерода PTS сукцинат. Поскольку катаболическая репрессия, опосредованная Crp, может предотвратить поглощение пирувата во время экспоненциального роста глюкозы, мы сначала вырастили E. coli в среде с глюкозой M9 в течение ночи до стационарной фазы, когда активность Crp высока, что позволило поглощать альтернативные источники углерода.Затем ночные культуры из сред с глюкозой М9 или сукцината М9 разводили от 1 до 100 в той же минимальной среде с добавлением 20 или 40 мМ пирувата. В соответствии с подавлением пирувата гипотезы системы PTS, мы наблюдали, что добавление пирувата вызывало более низкие скорости роста во время адаптации к повторному появлению глюкозы (рис. 6a). Напротив, внеклеточный пируват облегчил адаптацию к сукцинату, что привело к более быстрому росту (рис. 6b). В соответствии с этими данными, потребление сукцината также сильно снижается при добавлении аминокислот (рис.6c), уровни пирувата снижены (рис. 6d). В отличие от глюкозы, где активность Crp уже подавлена, поглощение сукцината напрямую контролируется Crp 58 , и добавление аминокислот совпадает с пропорциональным снижением активности Crp (рис. 5a). Таким образом, совокупные данные свидетельствуют о том, что быстрый катаболизм серина, глицина и аспартата снижает катаболизм глюкозы и увеличивает секрецию ацетата за счет накопления α-кетокислот, в основном пирувата и оксалоацетата. С другой стороны, в то время как катаболизм аминокислот модулирует поглощение глюкозы посредством посттрансляционной регуляции, транскрипционная адаптация, по-видимому, лежит в основе регуляции глобального потока углерода в присутствии источника углерода, не относящегося к PTS.
Рис. 6Координация катаболизма сукцината и аминокислот. a Изменения мгновенной скорости роста E. coli в глюкозе M9 (черный), с 20 (синий) или 40 (красный) мМ пирувата. b Изменения мгновенной скорости роста E. coli в сукцинате M9 (черный) с 20 (синий) или 40 (красный) мМ пирувата. c Относительные скорости поглощения сукцината E. coli в сукцинате M9, дополненном 2 г / л САА или синтетической смесью аминокислот (САА), состоящей из тех же аминокислот, и концентрации, измеренные в 2 г / л САА.Планки погрешностей представляют собой 95% доверительный интервал от анализа подбора трех биологических повторов (см. Дополнительный рисунок 21). d Динамические относительные изменения содержания пирувата (синий), оксалоацетата (красный) и α-кетоглутарата (коричневый) при добавлении смесей аминокислот и сукцината в качестве основного источника углерода
Метаболизм аминокислот — Lecturio Online Medical Библиотека
Изображение: «Структура белка NOTCh3». пользователя Emw.Лицензия: CC BY-SA 3.0
.Определение аминокислот
Изображение: Общая структура аминокислоты. Автор: Ppfk, лицензия: CC BY-SA 3.0
Аминокислоты являются частью строительных блоков, из которых состоят белки. Аминокислоты образуют полимеры с пептидными связями . Эти полимеры более известны как белки и представляют собой, наряду с углеводами и жирами, жизненно важные питательные вещества и компоненты организма. Поскольку аминокислоты, как следует из их названия, включают азотистую аминогруппу в их основной каркас (Nh3, NH, N), белки являются важным донором азота .Азот необходим для многих соединений и функций. Вот почему белки, хотя и являются важным пищевым компонентом, лишь частично представляют интерес для снабжения энергией (хотя они по-прежнему обеспечивают значительную часть общего количества энергии). Скорее, они нужны организму как поставщик аминокислот. Новые белки могут быть построены с аминокислотами, поставляемыми белками, и теми, которые присутствуют в организме.
Белки
Функции белков
Белки служат:
- Строительный материал: эл.g., кератин пальцев рук и ног, ткани, мышцы, кости и волосы на коже
- Транспортные средства: например, альбумин в кровообращении, они придают клеткам их форму
- Сигнальные вещества: например, G-белок в передаче сигнала
- Инструменты: например, ферменты для синтеза и разрушения структур
Белки настолько просты, что руководство по их построению закодировано в дезоксирибонуклеиновой кислоте (ДНК) нашей генетической структуры.Только с их помощью можно построить функционирующий и оперативный организм, потому что необходимые инструменты и строители всегда являются белками. Они составляют не менее 20% человеческого тела. Аминокислоты настолько важны, что их нельзя растрачивать. Следовательно, постоянный распад, сопровождающийся процессами восстановления организма, требует оригинальной системы утилизации: метаболизма аминокислот.
Синтез протеиногенных аминокислот
Изображение: Селеноцистеин.Автор Teuteul, лицензия: общественное достояние
Существует не менее 1000 различных белков, но для человеческого организма важны в основном протеиногенные аминокислоты. Протеиногенные аминокислоты, состоящие из 20–21 аминокислоты, образуют основные модули белков. Иногда полузаменимая аминокислота , селеноцистеин также считается протеиногенной аминокислотой, что составляет число 21. В следующей таблице выделены 20 протеиногенных аминокислот с основными включенными характеристиками:
Белок | Характеристика |
| Лизин | Положительно заряженный |
| Аргинин | Положительно заряженный |
| аспартат | Отрицательно заряжено |
| Глутамат | Отрицательно заряжено |
| Серин | Полярный |
| Треонин | Полярный |
| аспарагин | Полярный |
| Глютамин | Полярный |
| Гистидин | Полярный |
| Тирозин | Полярный |
| Аланин | гидрофобный |
| Валин | гидрофобный |
| лейцин | гидрофобный |
| Изолейцин | гидрофобный |
| Пролин | гидрофобный |
| фенилаланин | гидрофобный |
| Триптофан | гидрофобный |
| Цистеин | гидрофобный |
| метионин | гидрофобный |
| Глицин | Без боковой цепи |
Подобно алфавиту, где различные комбинации букв образуют новые слова, эта 21 аминокислота может образовывать множество различных белков, которые выполняют множество различных задач.Аминокислоты попадают в организм в виде белков, например, в сое, молоке или мясе.
Транспортные белки
Посредством механизмов пищеварения аминокислоты расщепляются и попадают в кровоток на определенных транспортерах. Затем они направляются в клетки тела снова с помощью транспортных белков . Специфические транспортные белки облегчают диффузию или активно транспортируют определенные вещества в организме через мембраны. Транспортные белки могут быть каналом / порами, которые делают отверстия в мембранах, или носителями, открывающими одну сторону мембраны.Метаболизация аминокислот, поступающих после приема пищи, происходит в основном в печени и почках. Кроме того, регулярное разрушение физиологических структур (например, мышечного белка) постоянно обеспечивает свободные аминокислоты, так что всегда присутствует постоянный пул свободных аминокислот. Для аминокислоты из аминокислотного пула существует 3 возможности перемещения:
- Интеграция в структурные и тканевые белки для регенерации тканевых структур
- Катаболизм: дезаминирование (удаление аминогруппы) и окисление углеродного каркаса с высвобождением диоксида углерода (CO2) и аденозинтрифосфата (АТФ) или преобразование в запасы энергии, такие как гликоген или липиды, и синтез мочевины из аминогруппы
- Анаболизм: синтез азотистых соединений, таких как пуриновые основания, креатин или адреналин
3 наиболее важных реакции в метаболизме аминокислот — это трансаминирование , дезаминирование, и декарбоксилирование .В зависимости от текущего состояния метаболизма существующие аминокислоты либо перегруппировываются, либо полностью разрушаются.
Трансаминирование аминокислот
Одна из центральных реакций метаболизма аминокислот — переаминирование. Как следует из названия, переаминирование относится к переносу из аминогруппы . Процесс трансаминирования происходит с помощью ферментов аминотрансфераз, которые могут быть специфичными для одной аминокислоты или могут обслуживать несколько аминокислот, которые похожи по своему химическому составу.Аминокислота, которая в настоящее время не нужна, может быть преобразована в другую аминокислоту, которая в настоящее время необходима. Перераспределение аминогруппы происходит через альфа-кетокислоту, которая имеет структуру, аналогичную альфа-аминокислотам . Альфа-кетокислоты отличаются от альфа-аминокислот только наличием кетогруппы вместо аминогруппы.
Изображение: Аминотрансферная реакция между аминокислотой и альфа-кетокислотой. Автор Alcibiades, лицензия: общественное достояние
Изображение: Общая структура Imine.Автор: Jü, лицензия: общественное достояние
Трансаминирование превращает альфа-кетокислоту в новую аминокислоту, доступную для метаболизма. Ответственный фермент называется аминотрансферазой (или трансаминазой) . Аминотрансферазе, однако, нужен помощник для выполнения своей работы: пиридоксальфосфат (PLP) . Это кофермент, вырабатываемый из витамина B6 (пиридоксина) путем фосфорилирования. PLP имеет альдегидную группу (H-C = O), которая реагирует при трансаминировании с аминогруппой аминокислоты (с отщеплением h3O).При этом формируется база Шиффа (R-Nh3) . Эта реакция дестабилизирует аминокислоту, и атом водорода начинает мигрировать, что, в свою очередь, приводит к сдвигу двойной связи, и кетамин (R-C = O) появляется из бывшего альдимина (H-C = O).
Затем через эту двойную связь добавляют воду, что завершает образование альфа-кетокислоты. PLP восстанавливается до PMP (пиридоксаминфосфат). Обратная реакция также является обычным вариантом для получения другой аминокислоты: фосфат пиридоксамина реагирует с другой альфа-кетокислотой, и PLP восстанавливается.
Две наиболее важные трансаминазы — это аланинтрансаминаза (сокращенно ALT или ALAT ) и аспартаттрансаминаза (сокращенно AST или ASAT ). ALAT катализирует перенос аминогруппы от аланина к альфа-кетоглутарату, образуя пируват и глутамат (что дает его прежнее название глутамат-пируват-трансаминаза, GPT). ASAT переносит аминогруппу от аспартата к альфа-кетоглутарату, образуя оксалоацетат и глутамат.Обе трансаминазы являются важными диагностическими маркерами: повышенные значения в полном анализе крови указывают на распад клеток в печени (ALAT) и сердце (ASAT и ALAT).
Пиридоксальфосфат
Пиридоксальфосфат, или короткий PLP, является наиболее важным коферментом в метаболизме аминокислот. PLP — это биологически активная форма пиридоксаля, альдегидная форма витамина B6. Витамин B6 также присутствует в виде амина (пиридоксамина) и спирта (пиридоксина). Производные витамина B6 могут превращаться друг в друга.Они попадают в организм и содержатся в продуктах питания животного происхождения (пиридоксаль и пиридоксин), а также в продуктах питания растительного происхождения (пиридоксин).
Изображение: Пиридоксальфосфат. Автор NEUROtiker, лицензия: общественное достояние
Зародыши пшеницы относительно богаты витамином B6. PLP как кофермент участвует в метаболизме аминокислот в реакциях переаминирования, декарбоксилирования (например, образование биогенных аминов) и дезаминирования. PLP связывается с остатком лизина на основе фермента, участвующего в реакции, например.g., аланинтрансаминаза (ALT), и создает основание Шиффа с аминокислотой. Азот PLP, содержащийся в пиримидиновом кольце, обладает сильным электрофильным эффектом, который приводит к смещению связей. В этой реакции образуется токсичный аммиак; концентрация последнего всегда должна быть минимальной, и не рекомендуется утилизировать азот. Таким образом, цикл мочевины происходит и приводит к дезаминированию аминокислот.
Дезаминирование аминокислот
Когда существует избыток азота в форме аминокислот, его необходимо где-то утилизировать. Дезаминирование — это процесс разложения аминокислот. Однако этот процесс высвобождает свободный цитотоксический аммиак, который должен быстро метаболизироваться до мочевины. Этот синтез мочевины, требующий большого количества энергии, происходит в печени. Чтобы это произошло, избыток азота должен транспортироваться с периферии в печень. В этом транспорте участвуют три центральные аминокислоты: аланин (синтезируется из пирувата), глутамин (синтезируется из аспартата) и аспартат (синтезируется из оксалоацетата).
Изображение: дезаминирование D-аминокислоты оксидазой D-аминокислоты. Автор: Kuebi, лицензия: общественное достояние
Дезаминирование можно разделить на 3 различные реакции:
- Окислительное дезаминирование
- Гидролитическое дезаминирование
- Устранение дезаминирования
Окислительное дезаминирование
Как и при трансаминировании, основание Шиффа образуется дегидрогеназой; более конкретно, окисление превращает аминогруппу в иминогруппу (C = N) .Акцепторами электронов являются коферменты NAD + или NADP + , которые восстанавливаются в этом процессе до NADH / H или NADPH / H соответственно. При добавлении воды иминогруппа превращается в альфа-кетогруппу, которая выделяет аммиак (NH 3 ).
Пример : Реакция глутаматдегидрогеназы с глутаматдегидрогеназой: глутамат — иминовая кислота — альфа-кетоглутарат. В печени глутамат из цитозоля попадает в митохондрии, где происходит окислительное дезаминирование под действием фермента L-глутаматдегидрогеназы , расположенного в матриксе митохондрий.
Гидролитическое дезаминирование
При гидролитическом дезаминировании вода реагирует с аминогруппой. Таким образом, гидроксильная группа (ОН-группа) необратимо присоединяется, а аминогруппа удаляется в виде аммиака. В реакции глутаминазы от глутамина к глутамату ответственный фермент — глутаминаза. Та же самая реакция происходит от аминокислоты аспарагина до аспартата (ответственный фермент по совпадению называется аспарагиназой).
Устранение дезаминирования
Небольшие аминокислоты, такие как серин или цистеин, также могут высвобождаться за счет элиминирующего дезаминирования их азота (в форме аммиака) и за счет удаления воды или сероводорода на сернистые аминокислоты.Для этой реакции PLP снова необходим как партнер. Эта гидратация создает двойную связь и после следующего гидролиза другую альфа-кетокислоту.
Декарбоксилирование аминокислот
Когда карбоксильная группа отщепляется от аминокислоты, 1 амин и CO 2 выделяются как побочные продукты. Реакция катализируется ферментом декарбоксилаза с использованием PLP в качестве партнера. Полученные амины выполняют важные функции в организме, поэтому их называют биогенными аминами .
Хорошо известным представителем является гистамин , который образуется в результате декарбоксилирования из основной аминокислоты гистидина. Ответственный фермент называется гистидиндекарбоксилазой. Гистамин является важным медиатором и играет жизненно важную роль, например, в реакциях гиперчувствительности немедленного типа. Другими хорошо известными биогенными аминами, имеющими отношение к метаболизму, являются, например, ГАМК (гамма-аминомасляная кислота из глутаминовой кислоты) и дофамин (из 3,4-дигидроксифенилаланина).
Центральные аминокислоты
Есть 4 аминокислоты и их кетокислоты, которые можно охарактеризовать как центральный узел метаболизма аминокислот, поскольку они имеют особое значение, и наиболее важные метаболические пути проходят через эти аминокислоты:
- Глутамат и альфа-кетоглутарат
- Глутамин и альфа-кетоглутарат
- Аланин и пируват
- Аспартат и оксалоацетат
Глутамин, глутамат и альфа-кетоглутарат
Изображение: Структура глутамина.Автор NEUROtiker, лицензия: общественное достояние
Глютамин — это аминокислота, которая чаще всего встречается в плазме крови. Глютамин транспортирует азот ко всем клеткам организма, которые в нем нуждаются, например, синтез пурина и пиримидина в биосинтезе нуклеотидов. Глютамин также необходим как донор аминокислот; он дезаминируется в почках, чтобы получить свободный аммиак.
Аммиак секретируется в проксимальных канальцах и нейтрализует кислоты в моче, тем самым образуя ионы аммония (Nh5 + ).В этом процессе альфа-кетоглутарат, который может быть напрямую направлен в цикл лимонной кислоты, образуется из глутамина через глутамат. Это убивает 2 зайцев одним выстрелом, поскольку альфа-кетоглутарат восполняет цикл лимонной кислоты, когда оксалоацетат извлекается из него для глюконеогенеза.
Аланин и пируват
Изображение: Строение пируват. Автор NEUROtiker, лицензия: общественное достояние
Аминокислота аланин является аналогом пирувата альфа-кетокислоты, т.е.к его соли (пировиноградная кислота, альфа-кетопропионовая кислота). Аминокислоты могут направляться в цикл лимонной кислоты и разлагаться на CO 2 и энергию через пируват и аланин. Другая возможность — синтез глюкозы из пирувата в глюконеогенезе или метаболизм пирувата в лактат в анаэробных условиях.
аланин — пируват
1) CO 2 + ATP
Или 2) Глюкоза
Или 3) Лактат
Когда аланин расщепляется в мышцах, он сначала попадает с кровотоком в печень.Там в глюконеогенезе происходит синтез глюкозы на основе пирувата, полученного при переаминировании. Глюкоза проходит через кровоток к мышцам и обеспечивает снабжение мышечными клетками энергией за счет расщепления глюкозы при гликолизе.
Это снова дает пируват. Пируват получает аминогруппу аминокислоты в результате распада мышечного белка в результате реакции трансаминирования. Аланин поступает в печень, где снова трансаминируется в пируват и теперь доступен для синтеза глюкозы в процессе глюконеогенеза.Фермент, который отвечает за перенос аминогрупп туда и обратно, называется аланинаминотрансферазой (ALT, ALAT) .
Аспартат и оксалоацетат
Другой важной реакционной парой является набор из 2 аминокислот, аспартата, и оксалоацетата (альфа-кетопировиноградная кислота) . Их трансформация катализируется ферментом аспартатаминотрансферазой (AST, ASAT), концентрация которого также может быть определена как диагностический маркер при анализе крови.ASAT катализирует перенос аминогруппы от аспартата к альфа-кетоглутарату с образованием оксалоацетата и глутамата. Вот почему этот фермент ранее был известен как глутаматоксалоацетаттрансаминаза (GOT).
Изображение: Патофизиология нарушений обмена фенилаланина и тирозина. Автор LHcheM, лицензия: CC BY-SA 3.0
Повышение уровня АСАТ в крови может указывать на заболевания печени и сердца, поскольку этот фермент присутствует в больших количествах в гепатоцитах и клетках сердечной мышцы.Итак, когда эти клетки разрушаются из-за патологических изменений, присутствие АСАТ в крови увеличивается. Оксалоацетат может участвовать в цикле лимонной кислоты или глюконеогенезе. Глутамат может быть далее преобразован в альфа-кетоглутарат или, например, использоваться в окислительном дезаминировании для синтеза аммиака в почках.
Семейство серинов
Два основных пути ведут к серину:
1. Из 3-фосфоглицерата (связь с гликолизом)
Изображение Lecturio
2.Обмен углерода на глицин и фолаты (важно для переработки фолиевой кислоты)
Изображение Lecturio
| Метаболизм цистеина | Различные способы получения цистеина | Первичные средства, связанные с катаболизмом метионина |
Катаболизм метионина
Метаболизм цистеина и здоровье
Гомоцистинурия — это генетическое заболевание. Чаще всего это связано с мутацией цистатионин-β-синтазы.Проблемы могут включать:
- Аномалии опорно-двигательного аппарата
- Аномалии глаз: катаракта, глаукома, отслойка сетчатки
- Умственная отсталость
- Изъятия
- Болезни сосудов
- Цистинурия — неродственное генетическое заболевание
- Неспособность почек реабсорбировать цистеин приводит к высокому уровню цистеина, орнитина и аргинина в моче
- Также встречаются частые камни в почках
Другой метаболизм цистеина
Изображение Lecturio
Метаболизм селеноцистеина
- Иногда называют 21-й аминокислотой
- Не указано непосредственно в генетическом коде
- Использует стоп-кодон необычной структуры
- Синтезирован из серина при переносе рибонуклеиновой кислоты (тРНК)
Изображение Lecturio
Семья аспартатов
- Все члены семьи происходят от аспартата
- Из одного из них можно получить аспартат — аспарагин
- Многочисленные пути приводят к аспартату
Изображение Lecturio
Метаболизм аспарагина
Изображение Lecturio
Метионин метаболизм
- Распад перекрывается с метаболизмом цистеина
- Сложный синтез из аспартата
Шаги к процессу
- Фосфорилирование
- Окисление и дефосфорилирование
- Окисление
- Создает гомосерин
- Сукцинилирование
- Цистеиновый заменитель сукцината
- Потеря пирувата и иона аммония
- Это создает гомоцистеин
- Метилирование гомоцистеина N5-метилфолатом дает метионин (требуется витамин B 12 )
Гомоцистеин можно превратить в метионин альтернативным путем справа.
- Метионин, модифицированный в бактериях для использования в переводе
- Возникает после воздействия метионина на тРНК инициатора
Изображение Lecturio
Метаболизм треонина
Первые 3 шага аналогичны метаболизму метионина, образуя гомосерин
Изображение Lecturio
Метаболизм лизина
- Первые 2 реакции такие же, как для треонина и метионина
- Всего девять ступеней
- Лизин — одна из наиболее посттрансляционно модифицированных аминокислот, особенно в гистонах
- Гидроксилирование лизина важно для выработки сильного коллагена
- Дефицит одного из ферментов пути распада лизина, α-аминоадиповой полуальдегидсинтазы, приводит к гиперлизинемии — накоплению лизина в крови
Семейство ароматических веществ
Триптофан
- Интересная регуляция синтеза у бактерий
- Аттенуация — все 5 генов на 1 оперон
- При высоком уровне триптофана транскрипция оперона прерывается рано
- При низком уровне триптофана транскрипция оперона продолжается по всем генам
Молекулы, состоящие из триптофана
| Мелатонин | Ниацин |
Изображение Lecturio | Изображение Lecturio |
|
|
| Серотонин | Ауксины |
Изображение Lecturio | Изображение Lecturio |
|
|
Фенилаланин (PHE)
- Незаменимая аминокислота и предшественник тирозина
- PHE гидроксилаза катализирует образование тирозина из PHE
- Дефицит фермента ПГЭ-гидроксилазы вызывает фенилкетонурию
- Высокий уровень PHE вызывает повреждение головного мозга
- Поддается лечению снижением уровня PHE
- Nutrasweet содержит PHE
Тирозин (TYR)
- Не имеет значения при наличии ПТО
- Предшественник катехоламинов — L-допа, L-дофамин, норадреналин и адреналин
- Отдает электроны для восстановления хлорофилла в фотосистеме 2
- Образует радикал в рибонуклеотидредуктазе
Изображение Lecturio
Метаболизм тирозина
| L-ДОПА | норэпинефрин |
Изображение Lecturio | Изображение Lecturio |
|
|
| Дофамин | Адреналин (адреналин) |
Изображение Lecturio | Изображение Lecturio |
|
|
Тирозин является предшественником гормонов щитовидной железы:
Изображение: Синтез гормонов щитовидной железы.Автор Häggström, Mikael, лицензия: CC0
Метаболизм и болезнь тирозина
Изображение Lecturio
Тирозинемия — проблемы с катаболизмом тирозина
- Тип 1
- Тип 2
- Тип 3
- Алькаптонурия — болезнь черной мочи
Процедуры
- Ограниченная диета TYR / PHE
- Пересадка печени
Семья пирувата
Метаболизм аланина
- Наиболее легко получить из пирувата — переаминирование
- Побочный продукт катаболизма валина, лейцина и изолейцина
- Глюкозо-аланиновый цикл
Изображение: цикл глюкоза-аланин — важен для удаления аммиака.Автор Lecturio
Метаболизм лейцина (LEU) / валина (VAL) / изолейцина (ILE)
- Аминокислоты с разветвленной цепью (BCAA)
- Несколько общих шагов
- Начать с декарбоксилирования и присоединения 2 углеродных элементов к TPP (тиаминпирофосфат)
- Валиновые и лейциновые пути включают присоединение 2 углеродных частей к пирувату
- Путь изолейцина включает присоединение 2 углеродных частиц к α-кетобутирату
- Предпоследние продукты — α-кетоизокапроат (LEU), α-кетоизовалерат (VAL) и α-кето-β-метилвалерат (ILE), каждый из которых трансаминируется с образованием конечной аминокислоты
Изображение: Обратная связь синтеза регулируется посредством треониндезаминазы.Автор Lecturio
- Распад BCAA происходит через комплекс дегидрогеназы α-кетокислот с разветвленной цепью
- Мутации, изменяющие этот комплекс, могут привести к болезни мочи кленового сиропа
Метаболизм гистидина (HIS)
- Самая сложная из аминокислот
- Перекрывается метаболизм нуклеотидов с рибозо-5-фосфатом и PRPP (фосфорибозилпирофосфатом)
- Десять шагов на пути
- Второй фермент обратной связи пути (АТФ-фосфорибозилтрансфераза) ингибируется гистидином
Нарушения обмена аминокислот
Относительно частым генетическим нарушением обмена веществ является фенилкетонурия, PKU (прибл.Поражен 1 из 10 000 новорожденных). Каждого новорожденного проверяют на ФКУ (например, с помощью теста Гатри ), потому что большинства последствий болезни можно избежать, соблюдая строгую диету.
Из-за дефекта фермента фенилаланингидроксилазы аминокислота фенилаланин накапливается в ткани. Вместо этого организм превращает фенилаланин в фенилпируват кетокислоты. Этот продукт частично выделяется, что объясняет термин фенилкетонурия, но частично подвергается дальнейшему метаболизму, образуя цитотоксические субстраты.Они вызывают повреждение, особенно миелиновых оболочек центральной нервной системы (ЦНС). Это нарушает нормальное развитие мозга. Этому в основном способствует избыточное количество фенилаланина по сравнению с концентрацией других аминокислот, переносимых через гематоэнцефалический барьер, что приводит к дефициту необходимых метаболитов. Следствие этого заболевания — умственная отсталость. Скрининг новорожденных направлен на выявление пораженных людей и предоставление им особой диеты с низким содержанием фенилаланина и богатой тирозином (тирозин становится незаменимой аминокислотой для пострадавшего).Таким образом можно предотвратить или, по крайней мере, избежать повреждений.
Другое генетически связанное заболевание катаболизма фенилаланина — это алкаптонурия, вызванная дефектным ферментом, известным как гомогентизатдиоксигеназа. Это менее смертельно, чем фенилкетонурия. У этого состояния меньше симптомов, хотя большое количество гомогентизата выводится с мочой, и лабораторные тесты подтверждают его присутствие, когда образец мочи становится черным после окисления. Пациенты с алькаптонурией также склонны к развитию артрита.
Биохимия: обмен аминокислот
Переваривание пищевых белков
Переваривание пищевых белков начинается в желудке. Секреция HCl активирует образование пепсина из пепсиногена, который гидролизует пептидные связи пищевых белков с высвобождением ароматических аминокислот. Точно так же в тонком кишечнике продолжается пищеварение. Зимогены активируются для разрушения пептидных связей с высвобождением аминокислот, которые абсорбируются в тонком кишечнике.
Аминокислотное дезаминирование
Трансаминирование — это процесс, посредством которого аминогруппа передается кетокислоте с образованием кетокислоты исходной аминокислоты и новой аминокислоты, катализируемой аминотрансферазами. Глутамат окислительно дезаминируется в митохондриях и выделяет аммиак.
Цикл мочевины
Этот циклический путь происходит в печени, частично в митохондриях и частично в цитозоле.Существует взаимосвязь между циклом мочевины и циклом лимонной кислоты. Фумарат цикла мочевины поглощается циклом лимонной кислоты. Карбамоилфосфатсинтетаза I является регуляторным ферментом.
Метаболический распад отдельных аминокислот
Катаболизм аминокислот дает начало промежуточным соединениям цикла лимонной кислоты. Аланин, серин, цистеин и аспарагин превращаются в оксалоацетат. Глутамин, пролин, аргинин и гистидин превращаются в α-кетоглутарат через глутамат.Сукцинил-КоА является отправной точкой для неполярных аминокислот, таких как метионин, валин и изолейцин. Лейцин разлагается до ацетил-КоА и ацетоацетата. Триптофан, лизин, лейцин, фенилаланин, тирозин и изолейцин отдают свои атомы углерода ацетил-КоА. Наблюдаются различные нарушения катаболизма аминокислот из-за дефектных ферментов. Триптофан, тирозин, глицин и глутамат являются предшественниками некоторых биологически важных соединений. Биотин, тетрагидрофолат или S-аденозилметионин являются кофакторами ферментов при катаболизме, которые переносят соединения углерода.
Биосинтез аминокислот
Заменимые аминокислоты образуются из промежуточных продуктов углеводного обмена. Аланин образуется из пирувата, а аспартат — из оксалоацетата. Аспарагин образуется из аспартата. Глутамат образуется из α-кетоглутарата, а глутамин — из глутамата. Глутамат является предшественником пролина и аргинина. Цистеин синтезируется из 3 — фосфоглицерата. Во время этого процесса серин является промежуточным соединением, которое дает глицин.
Треонин — незаменимая аминокислота. Он образован из β-аспартата. У метионина и лизина также есть общий предшественник.


