ТОП 5 лучший комплексный протеин 2016
Комплексный протеин – это белковая смесь, которая включает сывороточный протеин с добавлением яичного, соевого белка или казеина. Благодаря разной скорости усвоения основных компонентов, мышцы на протяжении длительного времени получают подпитку аминокислотами. Это активизирует рост мышечной ткани, ускоряет процесс восстановления, а также предотвращает развитие катаболической реакции. Комплексный протеин содержит минимальный процент углеводов, что позволяет сформировать качественную мускулатуру без капли жира.
В 2016 году были проведены исследования, в результате которых составлен ТОП лучших комплексных протеинов по мнению спортсменов:
1. BSN Syntha-6, 2.27 кг
2. MusclePharm Combat, 1.8 кг
3. Syntrax Matrix 5.0, 2.27 кг
4. USP Labs Modern Protein, 1.83 кг
5. Muscletech Phase8, 2.1 кг
BSN Syntha-6, 2.27 кг – многокомпонентная белковая добавка, обеспечивающая мышцы важными аминокислотами, нормализующая азотистый баланс и увеличивающая объемы мышечной ткани. Препарат включает 6 видов белка с разной скоростью усвоения, благодаря чему в течение длительного времени сохраняется анаболическая реакция и высокая концентрация аминокислот. За счет низкого содержания жиров и углеводов, спортивная добавка не вызывает увеличение жировых отложений.
MusclePharm Combat, 1.8 кг – высококачественный комплексный протеин, включающий яичный, сывороточный протеин (изолят, концентра и гидролизат) и казеин. Разная скорость расщепления компонентов обеспечивает подпитку мышц аминокислотами на протяжении 6-9 часов. Минимальная концентрация углеводов не приведет к увеличению жировой ткани, что позволит сформировать сухую, качественную мускулатуру. Комплексный протеин дополнен глютамином и аминокислотами ВСАА, благодаря чему он оказывает антикатаболическое действие и ускоряет процесс восстановления.
Syntrax Matrix 5. 0, 2.27 кг – комплексный протеин, который отличается высокой эффективностью и приятным вкусом готового напитка. Мощный состав, который включает очищенный яичный, сывороточный протеин и казеин, помогает сформировать качественную мускулатуру и сухие плотные мышцы без капли жира. Благодаря аминокислотной матрице и минеральным добавкам, спортивная добавка улучшает общее самочувствие спортсмена, нормализует работу сердечно-сосудистой системы, укрепляет иммунитет и ускоряет процесс восстановления.
0, 2.27 кг – комплексный протеин, который отличается высокой эффективностью и приятным вкусом готового напитка. Мощный состав, который включает очищенный яичный, сывороточный протеин и казеин, помогает сформировать качественную мускулатуру и сухие плотные мышцы без капли жира. Благодаря аминокислотной матрице и минеральным добавкам, спортивная добавка улучшает общее самочувствие спортсмена, нормализует работу сердечно-сосудистой системы, укрепляет иммунитет и ускоряет процесс восстановления.
USP Labs Modern Protein, 1.83 кг – спортивная добавка, включает три вида белка (изолят молочного и сывороточного протеина , гидролизованный изолят), которые имеют разную скорость расщепления, что обеспечивает постоянное высвобождение аминокислот и нутриентов, необходимых для роста мышц и защиты их от катаболической реакции.
Muscletech Phase8, 2.1 кг – комплексный протеин, включающий белок молочного происхождения. Спортивная добавка обеспечивает подпитку мышц протеином и аминокислотами на протяжении длительного времени, что ускоряет анаболизм и предотвращает развитие катаболической реакции.
Купить высококачественный комплексный протеин вы можете в нашем интернет-магазине спортивного питания «Fitness Shop». Для оформления заказа свяжитесь с менеджером по телефону или оформите заявку в режиме онлайн. Мы обеспечим оперативную доставку протеина в любой уголок Украины.
Рейтинг лучших протеинов — Спортивное питание Atleticshop.ru
Syntha-6 от BSN — идеальное соотношение цены и качества, занимает первое место с ощутимым отрывом. Сходный состав и столь же высокое качество имеет Nitro Core 24 от Optimum Nutrition (к тому же Nitro Core 24 содержит пищевые волокна и энзимы для лучшего усвоения белка).
Matrix от Syntrax — отличное соотношение цена/качество, доступный и эффективный комплексный протеин.
Protein 80 Plus от Weider — хороший выбор, по доступной цене.
Elite Fusion 7 от Dymatize — качественный продукт, стал доступен в России относительно недавно
Elite 12 Hour Protein от Dymatize — бюджетный вариант, один из самых недорогих белков, однако имеет плохой вкус и растворимость.
Elite Gourmet Protein от Dymatize — один из самых дешевых комплексных протеинов.
Probolic-SR от MHP — пожалуй, самый лучший комплексный белок по вкусовым и органолептическим свойствам, однако высокая цена и соевый белок в составе сдвигают его на последнее место.
Примечание: в составе Syntha-6 имеются углеводы и жиры в довольно больших количествах, что часто вызывает беспокойство. Однако углеводы представлены главным образом целлюлозной камедью и полидекстрозой, которая добавляется для регуляции усвоения протеина и улучшения свойств продукта, сама по себе она не усваивается организмом. Простых сахаров минимальное количество. Жиры представлены полиненасыщенным маслом и среднецепочечными триглицеридами, которые, как было доказано, способствуют сжиганию жира. Их также называют полезными жирами.
Лучший медленный протеин Править
Читайте основную статью: Медленный протеин
100% Casein Protein от Optimum Nutrition
Muscle Milk от CytoSport
Lipotropic Protein от LG Sciences
100% Casein от Dymatize
Сывороточный протеин Править
Читайте основную статью: Быстрый протеин
Данная категория обладает максимальным анаболическим эффектом и наилучшим образом подходит для набора мышечной массы и создания рельефа, хотя может применяться и во время похудения для сохранения мышц.
Концентраты:
100% Whey Gold Standard — смесь изолятов и концентратов, наилучшее соотношение цены и качества.
100% Pure Platinum Whey (SAN)- соотношение сывороточных фракций в высокой концентрации и при этом обладает хорошим вкусом
ProStar Whey Protein от Ultimate Nutrition — аналогичен двум предыдущим
Elite Whey Protein от Dymatyze — лучший протеин (как экономный вариант)
Изоляты
Zero Carb от VPX — высококачественный изолят с высокой скоростью усвоения, с хорошим вкусом.
ISO-100 от Dymatize — хороший изолят по относительно низкой стоимости.
Iso Sensation от Ultimate Nutrition — вариант аналогичный предыдущему.
Varcil R2 — высококачественный изолят от бельгийской компании Nanox — на рынке недавно, но за счет высоких европейский стандартов качества также успел завоевать популярность среди профессионалов и любителей.
Рейтинг протеина по версии различных магазинов Править
Рейтинг лучших протеинов по версии 5lb.ru
Elite Whey (Dym)
100% Pure Platinum Whey (SAN)
100% Whey Gold Standard
VP2 (AST)
Zero Carb (VPX)
Рейтинг лучших протеинов по версии mysupplementstore.com
Whey Protein Isolate
100% Whey Gold Standard by Optimum
Complete Whey Protein by Cyto sport
100% Whey Protein by EAS
Muscle Milk E.TD by Cytosport
Zero Carb Protein by VPX Sports
Рейтинг лучших протеинов по версии bodybuilding.com
Optimum 100% Whey Protein
BSN Syntha-6
CytoSport Muscle Milk
Optimum 100% Casein Protein
Muscle Tech Nitro-Tech Hardcore
ЛУЧШИЕ КОМПЛЕКСНЫЕ ПРОТЕИНЫ — Спортивное Питание в Геленджике
100% Whey Gold Standard от компании Optimum Nutrition
Информация: спорт-вики – википедия научного бодибилдинга
ОЦЕНКА
Экспертиза качества
Сывороточный протеин 100% Whey Gold Standard от компании Optimum Nutrition — является классикой жанра среди сывороточных протеинов, одним из самых известных и популярных в своем сегменте. Во многих рейтингах спортивного питания этот протеин занимает лидирующие позиции.
Считается, что именно 100% Whey Gold Standard привёл к успеху Optimum Nutrition как производителя. 100% Whey Gold Standard – номер 8 в топ 20 сывороточного протеина по версии

Ну а теперь посмотрим, чем еще отличается 100% Whey Gold Standard, кроме позитивных имиджевых моментов.
Самые распространенные версии фасовки 100% Whey Gold – банки по 0,9 и 2,3кг, мешки по 4,5кг; производится продукт в США. Наибольший спектр вкусов доступен в упаковках, в банках.
Состав: 100% Whey Gold Standard состоит из изолята и концентрата сывороточного протеина, сывороточных пептидов. Утверждается, что изолят – это основной компонент. Важными составляющими являются Аминоген и Лактаза – компоненты, которые практически исключают возникновение проблем с пищеварением при приеме продукта. В качестве подсластителя используется ацесульфам. Плюс к этому, естественно, в составе имеются ароматизаторы и еще лецитин. Вот и все, ничего лишнего. Содержание пищевых нутриентов в порошке: белок – 82%, жир – 3%, углеводы – 10%. В порции 24 г протеина. Более 5 гр BCAA в каждой порции.
Вкус: Существующая на рынке линейка 100% Whey Gold Standard представлена 22 вкусами (шоколадная мята, белый шоколад, банановый крем, тропический пунш, двойной шоколад, соленая карамель, клубника-банан и т. д.), а также 3 вкуса без искусственных ароматизаторов, красителей, подсластителей (Natural: шоколад, ваниль и клубника). В России проблематично найти магазин, где представлено в наличии всё многообразие, да и поставки очень нерегулярные. Вкус, как правило, слабо выраженный. Явный плюс то, что он ненавязчивый.
Растворимость: Растворяется в шейкере прекрасно (в любой жидкости
Усваиваемость: С этим абсолютно никаких трудностей, даже у чувствительных к лактозе.
Результаты экспертизы «Росконтроля»
Согласно свидетельству о государственной регистрации, эта белковая смесь является специализированным пищевым продуктом для питания спортсменов. По проверенным показателям продукт соответствует требованиям ТР ТС 027/2012 «О безопасности отдельных видов специализированной пищевой продукции, в том числе диетического лечебного и диетического профилактического питания». Экспертиза показала, что в составе исследуемого образца нет опасных и вредных вещества — тяжелых металлов (кадмия, свинца, ртути), мышьяка, афлатоксина и антибиотиков.
Экспертиза показала, что в составе исследуемого образца нет опасных и вредных вещества — тяжелых металлов (кадмия, свинца, ртути), мышьяка, афлатоксина и антибиотиков.
Кроме того, в образце нет каких-либо посторонних растительных компонентов белковой и углеводной природы. В составе образца — практически идеальное соотношение аминокислот. Кроме того, в 100%
Whey Gold Standard содержится препарат «Aminogen», представляющий собой фермент (комплекс пептидаз микробиального происхождения), улучшающий усвоение аминокислот и расщепление белков и способствующий наиболее эффективному их усвоению.Описание Производителя
ON 100% WHEY GOLD STANDARD это чистый сывороточный белок с минимальным содержанием жиров, насыщенных жиров, холестерина, лактозы и других углеводов.
Подобно предшественникам, Optimum Nutrition 100% WHEY GOLD STANDARD содержит в себе первоклассные оптимальные пищевые добавки, составляющие протеиновую смесь:
Состав:
Порция 30,4 г
- Энергетическая ценность 120 ккал
- Белки (протеин) 24 г
- Углеводы 3 г
- Холестерин 30 мг
- Кальций 140 мг
- Натрий 60 мг
- Калий 150 мг
- Смесь энзимов 25 мг
Аминокислоты
- Л-триптофан 405 мг
- Л-валин 1422 мг
- Л-треонин 1654 мг
- Л-изолейцин 1573 мг
- Л-лейцин 2531 мг
- Л-лизин 2233 мг
- Л-фенилаланин 748 мг
- Л-метионин 492 мг
- Л-аргинин 505 мг
- Л-цистеин 494 мг
- Л-тирозин 703 мг
- Л-гистидин 423 мг
- Л-пролин 1509 мг
- Л-глютаминовая кислота 4082 мг
- Л-аспарагиновая кислота 2508 мг
- Л-серин 3753 мг
- Л-глицин 1373 мг
- Л-аланин 1180 мг
В зависимости от вкуса вес порции может меняться (от 29,4 до 33 грамм), при этом несущественно может меняться и состав (количество углеводов, холестерина, натрия, железа и др. ) при неизменном количестве белка в порции – 24 грамма. Вследствие этого количество порций протеина в одинаковых по весу упаковках для разных вкусов будет различаться.
) при неизменном количестве белка в порции – 24 грамма. Вследствие этого количество порций протеина в одинаковых по весу упаковках для разных вкусов будет различаться.
Таким образом, каждая порция 100% Whey Gold Standard даст Вам чистейший сывороточный протеин, минимум жиров, минимум холестерина и лактозы. При этом можно выделить основные особенности данного бренда:
- Высокое содержание протеина в каждой порции 100% Whey Gold Standard (24 гр.)
- Комплекс содержит специальные пищеварительные ферменты для лучшего усвоения сывороточного белка
- Быстро растворяется
- В каждой порции комплекса содержится 5 граммов аминокислот ВСАА и более 4 граммов глютамина
- Данный протеин подходит людям, которым не рекомендуются продукты с лактозой
Несколько коктейлей в день дадут вам востребованную порцию белка и незаменимых аминокислот, требуемых для роста ваших мышечных объёмов. Минимальное содержание углеводов не позволит откладываться жировой прослойке, при этом белковый компонент активно работает на прирост чистой мышечной ткани.
Состояние перетренированности знакомо многим спортсменам. Это происходит после чрезвычайно интенсивных физических нагрузок. При этом мышечные волокна получают микроповреждения, которые срастаются во время отдыха. Именно поэтому периоды восстановления очень важны, и как раз в этот период повреждённым тканям необходимы аминокислоты, ВСАА, минералы и витамины. Всем этим и обеспечивает организм 100% Whey Gold Standard. А приём смеси перед тренировкой поможет не только эффективно наращивать мускулы, но и защитит их от перетренированности и катаболизма.
Как принимать Whey Gold Standard
100% Whey Protein Gold Standard от Optimum Nutrition рекомендуется принимать 2 раза в дни тренировок (первый прием утром, второй – через 30 минут после занятий) и один раз в дни отдыха (утром, либо же между приемами пищи). Можно принимать больше 2 порций, а можно и меньше, все зависит от количества употребляемого вами белка, для роста мышечной массы атлету требуется от 1. 5 до 2 г белка на 1 кг массы тела, рассчитывайте нужно количество порций протеина Голд Стандарт Whey исходя из этой формулы. Для приготовления белкового коктейля, нужно размешать 1 порцию добавки с 0.3л любой жидкости (вода, молоко, сок), не стоит размешивать более 3 скупов протеина за один раз.
5 до 2 г белка на 1 кг массы тела, рассчитывайте нужно количество порций протеина Голд Стандарт Whey исходя из этой формулы. Для приготовления белкового коктейля, нужно размешать 1 порцию добавки с 0.3л любой жидкости (вода, молоко, сок), не стоит размешивать более 3 скупов протеина за один раз.
Optimum Nutrition 100% Whey Gold Standard против Syntha-6, что выбрать?
100% Whey Protein Gold Standard от Optimum Nutrition является лучшим протеиновым порошком в мире. Но многие не знают, что и Optimum Nutrition и BSN принадлежат одной и той же материнской компании, молочного гиганта Glanbia.Тем не менее, Whey Gold удивительно отличается от Syntha 6 и это пример фантастического способа того, как выпускаются продукты по сути одной компанией, которые не конкурируют напрямую между собой.
Несмотря на это, многие всё же хотели бы сравнить оба продукта между собой, чтобы узнать, какой из них лучше…
- 100% Whey Gold Standard против Syntha 6 – ИНГРЕДИЕНТЫ:
Whey Gold является гораздо более простым продуктом. Его белковая смесь состоит из изолята сывороточного белка и концентрата сывороточного протеина. Единственные другие ингредиенты – это ароматизаторы и пищеварительные ферменты.
С другой стороны, Syntha-6 является гораздо более сложным протеиновым порошком. Он содержит белковую смесь, состоящую из концентрата сывороточного протеина, изолята сывороточного белка, казеината кальция, мицеллярного казеина, изолята молочного белка, яичного альбумина и глютамин-пептидов. Как и Whey Gold, Syntha-6 содержит некоторые пищеварительные ферменты, но его диапазон ароматизаторов и добавок гораздо обширнее.
Победитель: ничья. Иначе трудно выбрать, так как это зависит от ваших конкретных потребностей в продукте. Смесь, которая используется в Whey Gold превосходно подходит для восстановления после тренировки, благодаря своим быстро действующим белкам. Однако Syntha-6 обеспечивает более длительный, более устойчивый профиль высвобождения, что делает его многоцелевым белком. Когда дело доходит до качества, оба продукта сделаны одной и той же материнской компанией, используя один и тот же источник сырья.
Однако Syntha-6 обеспечивает более длительный, более устойчивый профиль высвобождения, что делает его многоцелевым белком. Когда дело доходит до качества, оба продукта сделаны одной и той же материнской компанией, используя один и тот же источник сырья.
- 100% Whey Gold Standard против Syntha 6 – ДОЗИРОВКА:
Whey Gold обеспечивает 24 г. белка на порцию. Syntha-6 обеспечивает 22 г белка на порцию. Однако на этом сходство заканчивается. Порция 100% Whey Gold Standard может быть как 29,4 г (в зависимости от вкуса) по сравнению с 47 г порции для Syntha-6. Другими словами в Whey Gold до 81,6% белка, в то время как в Syntha-6 всего лишь около 47% белка, с углеводами жирами и клетчаткой, составляющих основную часть остатка. Whey Gold содержит всего 2 г углеводов и 1 г жира на порцию, в то время, как Syntha-6 содержит около 15 г углеводов и 6 г жира. Хотя эти макроэлементы, конечно, имеют своё место в диете (например, гейнеры), они не особенно благоприятны в протеинах.
Победитель: Optimum Nutrition 100% Whey Gold Standard
- 100% Whey Gold Standard против Syntha 6 – ЭФФЕКТИВНОСТЬ:
Когда дело доходит до эффективности, оба продукта имеют свои достоинства. Оба обеспечивают высокое качество белков для активных людей. Какой из них более эффективный, зависит от ваших конкретных целей.
Победитель: ничья. При этом, если Вам нужен чистый белок, то Whey Gold является лучшим выбором. Однако, если вы хотите некоторые дополнительные калории или что-то ближе к заменителям пищи, то Syntha-6 является лучшим выбором.
- 100% Whey Gold Standard против Syntha 6 – ВКУС И СМЕШИВАНИЕ:
Оба продукта обладают разнообразием вкусов, начиная от обязательных шоколада и ванили, до экзотических. Тем не менее, следует сказать, что Whey Gold имеет больше вкусов на выбор. Смешиваемость отличная у обоих продуктов. Текстура Whey Gold намного плотнее, чем у воды, в то время как у Syntha-6 консистенция схожая с коктейлем.
Тем не менее, следует сказать, что Whey Gold имеет больше вкусов на выбор. Смешиваемость отличная у обоих продуктов. Текстура Whey Gold намного плотнее, чем у воды, в то время как у Syntha-6 консистенция схожая с коктейлем.
Когда дело доходит до вкуса, Syntha-6 лучший выбор, поскольку обладает более насыщенным вкусом, по сравнению с довольно мягким Whey Gold.
Победитель: BSN Syntha-6
- 100% Whey Gold Standard против Syntha 6 – ЦЕНА И КАЧЕСТВО:
На первый взгляд Whey Gold и Syntha-6, кажется, не слишком отличаются по стоимости. Однако, учитывая значительно большее содержание белка и размер порции в Whey Gold в отношении стоимости, Whey Gold явный победитель.
Победитель: Optimum Nutrition 100% Whey Gold Standard
100% Whey Gold Standard против Syntha 6 – ОБЩИЙ ПОБЕДИТЕЛЬ:
Whey Gold бьёт Syntha-6 в сегменте дозирования и количества белка на порцию. Syntha-6 получила победу в категории вкуса. В категории «ингредиенты и эффективность» — ничья. Это означает, что победителем является Optimum Nutrition 100% Whey Gold Standard
Необходимо отметить, что результаты вышеприведённого сравнения не могут быть согласованы всеми и, поскольку мнения между людьми могут различаться, они должны быть использованы при выборе одного или второго продукта только в качестве ориентира
Атлеты, оставляя свои отзывы об 100% Whey Protein Gold Standard на различных интернет площадках, делятся своим опытом употребления данной спортивной добавки:
Антон * * * * *
Купил две банки. В принципе доволен. Употребляю на протяжении года. Личный рейтинг вкуса по убыванию: 1)Тропический пунш; 2) Клубника; 3) Дабл. шоколад; 4) Ваниль Айс крим. Худшим оказался (мороженное) Rocky Road, довольной резкий и противный запах, еле выпил и то через силу. Раньше мешал с водой…
шоколад; 4) Ваниль Айс крим. Худшим оказался (мороженное) Rocky Road, довольной резкий и противный запах, еле выпил и то через силу. Раньше мешал с водой…
Достоинства: Хороший прирост мышечной массы, разнообразность вкусов
Недостатки: Смущает отсутствие мембраны под крышкой. Над крышкой простой черной пленкой запаяно. Друг привозил из-за бугра банку этой фирмы, на ней очень плотно была прилеплена фирменная мембрана ON. Советую
Виктор * * * * *
Один из лучших протеинов, для меня в том числе. Очень рекомендую!!
Макс * * * * *
Самый лучший протеин
Достоинства: Хорошо усваивается, вкус отличный
Недостатки: Цена
Алексей * * * * *
Порывшись в сети нашел информацию, что этот протеин 8 лет назад занимал 1-е место в мире. Купил. Честно Вам скажу – ДОВОЛЕН. Проблем с усвоением не было, вкус супер. Печенье-крем всем советую. У меня даже супруга начала пить протеин. Говорит: «Вкусненько»
Достоинства: Качество, вкус
Недостатки: Нет
Влад * * * *
Брал вкус Double Rich Chocolate, на молоке, если делать, похож на какао. До этого пил соленую карамель (брал не здесь), тоже интересный вкус, даже на воде.
Достоинства: Оригинал USA
Недостатки: Нет
Гость * * * * *
50% пользователей считают этот отзыв полезным
Протеин отличный. Запах приятный, вкус тоже. Чтобы хорошо размешать в молоке с ложкой придется постоять пару тройку минут
Достоинства: Запах, вкус, качество
Недостатки: Пока не нашел
Руслан Слободанюк* * * * *
100% пользователей считают этот отзыв полезным
Фишка этого прота, что это комплекс. Сам пртеин .аминокислоты и глютамин. Поэтому он лучше работает.
Сам пртеин .аминокислоты и глютамин. Поэтому он лучше работает.
Николай
Не факт, взял как-то мешок, разница конкретная – и во вкусе и в результатах. Очень многое зависит от того у кого покупаешь, нужно брать у проверенного поставщика.
Константин * * * * *
100% пользователей считают этот отзыв полезным
Искал оригинальный продукт — нашёл. в общем, голограмма есть, банка запечатана. это именно американский, не европейский протеин. поживём-увидим каким будет эффект. брал в первый раз, поэтому немного удивил размер банки, реально большая. рекомендация — при отправке упаковывать надо в белую непрозрачную плёнку, зачем, чтобы всё отделение новой почты видело, что Вы получаете
Достоинства: лучший протеин, если верить рейтингам
nachdiv
Заказываю его через этот [реклама вырезана]. Проверял на сворачиваемость — все в норме! Пью с молоком. Разводится прекрасно. Даже вообще идеально. Пробовал все шоколадные вкусы, лучший, пожалуй, — двойной кофе мокко. Консистенция тоже получается приятная. Другие теперь даже не использую. Хотя, хочу еще синту попробовать
Рейтинг лучших протеинов 2018 по качеству и цене
Содержание:
Введение
Любой тяжелоатлет рано или поздно задумывается о необходимости употреблять протеин в виде спортивной добавки. Сегодня его принимают как спортсмены, так и люди, следящие за своей физической формой. Он является самой безопасной и эффективной добавкой в наборе и восстановлении мышечной массы, поэтому пользуется популярностью среди бодибилдеров.
Виды протеина
Наиболее распространены 3 вида протеина, каждый из которых имеет разное назначение:
- Сывороточный (быстрый) – усваивается за 1-2 часа, потому подходит для приема утром и после тренинга, когда нужно быстро восполнить недостаток питательных компонентов.

- Казеин (медленный) – на его усвоение требуется несколько часов, в течение которых аминокислоты поступают в мускулатуру постепенно. Позволяет поддержать оптимальный уровень протеина в мышцах на протяжении долгого времени. Оптимальное время приема – перед сном. Казеиновый протеин подходит людям, не переносящим лактозу.
- Комплексный – смесь нескольких видов белка с пролонгированным действием. Сначала усваивается быстрый протеин, обеспечивая мышечные волокна максимальным количеством белка, затем — медленный, который питает мышцы длительное время. Такие добавки могут использоваться в процессе рабочего дня, когда мышцы нуждаются в белке, а прием белковой пищи планируется нескоро.
Рейтинг на основе продаж Атлетик-Фуд
Прежде чем купить протеин, следует обратить внимание на его состав. Основным критерием является процентное соотношение белка в добавке. Составляя ТОП рейтинг протеинов 2018, мы подобрали основные добавки, сочетающие в себе идеальное соотношение качества и цены.
1. RPS Whey Isolate 100% — очищенный изолят сывороточного протеина, который ускоряет рост мышц и защищает их от катаболизма. В каждой порции содержит 25,3 г белка.
2. QNT Metapure Zero Carb – эталонный сывороточный изолят с 91% содержанием белка. С каждым коктейлем спортсмен получает 25,2 г протеина и 5,5 г БЦАА.
3. Dymatize ISO-100 – легкоусвояемый, эффективный и вкусный сывороточный гидролизат, который имеет относительно невысокую стоимость. В порции продукта содержится 25 г протеина.
4. Optimum Nutrition 100% Whey Gold – протеин премиум класса на основе концентрата и ионозамещенного изолята с высоким содержанием незаменимых аминокислот (более 5 г в одном коктейле). В порции содержится 24 г чистого белка и не менее 4 г глутаминовой кислоты.
 Хорошо усваивается и отличается приятным вкусом. Имеет много престижных наград и пользуется среди спортсменов заслуженной популярностью.
Хорошо усваивается и отличается приятным вкусом. Имеет много престижных наград и пользуется среди спортсменов заслуженной популярностью.5. BioTech Iso Whey Zero – в каждой порции содержит 22 г сывороточного изолята, обогащенного ВСАА аминокислотами без трансжиров и сахара.
6. Nutrabolics Hyperwhey – протеин на основе концентрата и изолята, который идеально подходит для набора сухой массы. На порцию приходится 22 г протеина и 8,4 г BCAA аминокислот.
7. BSN Syntha-6 EDGE 5 Lang – лучший многокомпонентный протеин, содержащий несколько форм белка (24 г белка на порцию). Добавка обогащена комплексом BCAA аминокислот (для повышения азотистого баланса), глютаминовыми пептидами (для ускорения восстановления), MCTs (для повышения уровня энергии) и клетчаткой — для лучшего усвоения добавки. Не вызывает проблем с желудком и может употребляться несколько раз в день. Имеет приятный вкус.
Какой протеин лучше для набора мышечной массы?
Как видно, рейтинг протеинов для набора мышечной массы возглавляют сывороточные протеины. При доступной стоимости они оказывают наибольшее анаболическое действие, так как содержат в своем составе полный комплекс ценных аминокислот и имеют высокую биологическую ценность. Существуют такие виды сывороточного протеина, как изолят, концентрат и гидролизат. Самым эффективным, недорогим и приятным на вкус считается изолят. Он подходит как для наращивания мышечной массы, так и для формирования рельефного тела.
плюсы и минусы, рейтинг лучших брендов
Все, кто хоть раз посещал зал, слышали о протеине. Чаще всего, функции протеиновых коктейлей преувеличены, это происходит из-за неосведомленности начинающих спортсменов, ставящих белок «на одну полку» со стероидными препаратами. Поскольку протеиновые порошки – это продукты для дополнительного приема белков (протеинов), предусмотрены как заменители пищи, каждый из видов протеина изготовлен из определенных продуктов. Одним из разновидностей протеиновых добавок является многокомпонентный протеин.
Одним из разновидностей протеиновых добавок является многокомпонентный протеин.
Содержание
Что такое многокомпонентный протеин?
Многокомпонентный или комплексный протеин – это белковая добавка спортивного питания, в состав которой входит несколько видов растительных и животных белков, обладающих разным аминокислотным составом и скоростью усвоения для поддержания и наращивания мышечной массы в течение дня и ночи, при условии получения достаточной физической нагрузки.
Типы белка, чаще всего используемые в многокомпонентных протеинах, – это молочные белки (сывороточный белок, казеин), также соевый и яичный белок. Существуют и другие многокомпонентные порошки, которые дополнительно используют источники белка из риса, люпина, но это редко встречается и производится специально для групп людей, которые не едят мясо.
Плюсы и минусы многокомпонентного протеина
Многокомпонентный белок особенно необходим при тренировках, направленных на увеличение мышечной массы, потому что он содержит короткие и длинные цепочки белка. Это означает, что белки с длинной цепочкой, например, казеин, дольше усваиваются и насыщают организм аминокислотами на протяжении длительного времени. Особенно, это необходимо в ночное время, в процессе сна мышечные волокна восстанавливаются, для роста им необходимо питание. Также, такой вид белка необходим для предотвращения катаболизма в ночное время и при нагрузках.
Сывороточный белок является самым «чистым» продуктом, содержит меньше жиров и молочного сахара, быстро усваивается и предотвращает мышцы от разрушения. Этот белок необходим сразу после сна и тренировок.
Соевый белок является наиболее дешевым, поэтому его добавляют для уменьшения себестоимости продукта, а не за счет его качеств. Это растительный белок, и не обладает таким аминокислотным составом, который необходим для полноценного роста новых клеток.
Комплексный протеин показан при наборе массы, а тем, кто собирается подсушиться, этот протеин лучше заменить на сывороточный изолят. Состав комплексного протеина содержит много сахара и белок сои, который плохо усваивается. Следовательно, в этот период лучше отказаться от таких продуктов.
Состав комплексного протеина содержит много сахара и белок сои, который плохо усваивается. Следовательно, в этот период лучше отказаться от таких продуктов.
Как принимать многокомпонентный протеин
В день принимается две порции.
- Одна порция перед тренировкой за 40 минут, чтобы обеспечить долгое расщепление белка в течение тренировки, или после.
- Вторая принимается перед сном, для высвобождения белка в течение ночи до самого утра.
Рейтинг многокомпонентных протеинов
- IronMaxx Protein 90, 2350 г. Диетическая белковая добавка из 9-компонентной белковой смеси с превосходным аминокислотным составом для поддержания и роста мышц.
- Multipower Formula 80 Evolution, 510 г. Добавка с низким содержанием жира, без сахара. Отличный источник белка для тренировки и перед сном, с несколькими вкусами в линейке.
- Weider Protein 80 Plus, 500 г. Диетическая добавка, полученная из изолята молочного белка, сывороточного белка и яичного белка.
- Optimum Nutrition Pro Complex. Состав смеси: сывороточный изолят и яичный белок. Также в составе содержаться незаменимые аминокислоты и витамины. Две мерные ложки содержат 60 г белка, 1 г жира и 5 г углеводов.
- Scitec Nutrition Protein Delite, 1000 г. Вкусный протеиновый коктейль, в линейке предлагается несколько вкусов на выбор.
Заключение
Комплексный белок, как и любая добавка, не наращивает мышцы волшебным образом, здесь еще играет роль физическая нагрузка, сон и сбалансированная диета, с учетом потребностей не только в белках, но и жирах с углеводами. А разнообразить и дополнить рацион белком поможет комплексный протеиновый коктейль на любой вкус.
Девушкам, и всем, кто сушится, прием такого вида продукта нецелесообразен.
Заменить такой порошок так же можно двумя видами белка, купив отдельно сывороточный протеин и казеин, хотя это будет немного дороже, зато избавит от таких бессмысленных компонентов, как соевые и другие растительные белки.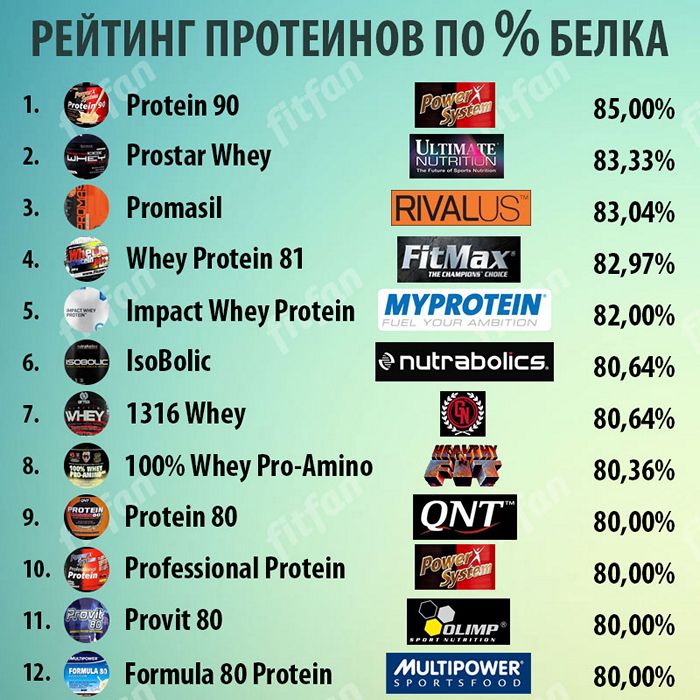
Полезное видео о комплексном протеине
О том, что такое BCAA, узнайте в этой статье →
Лучший многокомпонентный протеин: рейтинг :: SYL.ru
Большинство современных атлетов, для того чтобы восполнить дефицит израсходованных аминокислот, пьют специальные высокобелковые смеси. Также они способствуют росту и развитию мускулатуры хорошего качества. Для начала следует разобраться, каким образом протеин способствует росту мышечной массы. Протеины являются не только основными компонентами мышечной массы. Помимо этого, они способствуют тому, что тренинг проводится на более высоком уровне – повышается выносливость, когнитивная активность, ускоряется восстановление.
Что в основе протеинов?
Протеины могут иметь в своей основе растительные или животные белки, обладающие медленным или быстрым усвоением. Лучше всего приобрести сразу несколько разных упаковок смесей, однако не каждому спортсмену удобна такая схема применения. Не очень выгодно это и с точки зрения бюджета. Именно поэтому комплексный протеин представляется собой самый популярный вариант белкового спортивного питания. В данной статье мы постараемся как можно подробней изучить, что представляет собой многокомпонентный протеин, как его выбрать.
Что представляет собой такой протеин?
Этот вид белковой смеси имеет одну отличительную особенность – в своем составе он содержит матрицы компонентов, имеющих различную скорость абсорбции. К компонентам многокомпонентного протеина относятся следующие:
- Сывороточный белок, который обеспечивает незамедлительный анаболический отклик. Чаще всего представлен сывороточным изолятом или многокомпонентной протеиновой сывороткой.
 Последняя представляет собой изолированную, гидролизованную и концентрированную вытяжку.
Последняя представляет собой изолированную, гидролизованную и концентрированную вытяжку. - Яичный альбумин. Занимает промежуточное место в таблице, отражающей скорость абсорбции, и находится между медленными белками и сывороткой. Довольно хорошо усваивается.
- Казеин. Его аминокислоты транспортируются постепенно, питание массы происходит до 8 часов. Особую пользу в процессе похудения многокомпонентный протеин оказывает в том случае, если содержит в своем составе кальция казеинат. Именно он позволяет снизить аппетит, способствует предохранению мышц от катаболизма в периоды покоя и при отсутствии обычного питания.
- Соевый белок. Обладает относительно невысокой ценой, имеет массу свойств антиоксидантного характера. Соевый белок – медленная низкокалорийная добавка.
Отличия от сывороточного протеина
Многокомпонентный протеин может быть использован в процессе достижения абсолютно любых фитнес-целей. Он одинаково эффективен, если принимать его с целью набора качественной мышечной массы или с целью снижения веса, а также для того, чтобы компенсировать затраты питательных веществ в результате силовых или чрезмерно интенсивных тренировок.
Они настолько же востребованы, как и любые другие представители смесей этого типа. Определить, какой из них лучше – сывороточный или многокомпонентный протеин – весьма сложно. Если рассматривать саму суть протеина и его функции, то эти два продукта полностью равноценны.
Основным отличием многокомпонентного протеина от сывороточного является то, что второй способен мгновенно и полноценно удовлетворить белковый голод, который возникает непосредственно после интенсивной тренировки. Первый же обеспечивает поддержку мышцам и антикатаболическую защиту в течение длительного времени.
Как выбрать лучший многокомпонентный протеин? Об этом далее.
Способ применения комплексных протеинов
Для того чтобы получить от протеина максимальную фитнес-пользу, необходимо знать основные правила его правильного употребления.
Употреблять многокомпонентный протеин целесообразнее за тридцать минут перед тренировкой. Это позволит обеспечить полноценный заряд протеинами на все время тренировки. Сывороточный протеин лучше пить после тренировки. Именно в этот период организму требуется увеличенное количество быстрых и чистых ферментов для того, чтобы удовлетворить белковый голод, а также активировать рост мышц.
Как принимать комплексные протеины?
Для того чтобы защита от катаболизма в состоянии покоя была качественной, специалисты рекомендуют принимать комплексные протеиновые смеси перед сном, на ночь.
На рабочем месте или в поездке зачастую спортсмены в течение длительного времени обходятся без нормального рациона. Подобные периоды слишком негативно сказываются на мышечной массе, которая не получает своевременной и столь необходимой для роста, восстановления и энергообмена подпитки. В связи с этим тренеры часто советуют своим подопечным употреблять комплексный протеин спустя 20 минут после завтрака, то есть утром.
Рейтинг многокомпонентных протеинов
Для того, чтобы подобрать качественный протеин, можно предварительно изучить их рейтинг, который составлен по отзывам тренеров и спортсменов. Он разработан также с учетом их качества и цены.
- «Syntha-6 BSN» – в категории многокомпонентных протеинов считается самым лучшим в соотношении его цены и качества.
- Matrix Syntrax – представляет собой эффективный многокомпонентный протеин по весьма привлекательной цене.
- Combat Powder MusclePharm – данная смесь разместилась на третей строчке рейтинга только из-за того, что атлеты отмечают ее не очень высокие вкусовые качества. В остальном является отличной белковой формулой, которая имеет отменную эффективность действия. Это еще не весь рейтинг лучших многокомпонентных протеинов.
- Protein 80 Plus Weider – данный протеин имеет достаточно высокую стоимость, однако он заслуженно занимает четвертую строчку рейтинга благодаря наличию мощнейшей белковой матрице, состоящей из четырех белков.

- Elite 12 Hour Protein Dymatize – данная протеиновая смесь имеет достаточно низкую растворимость, вкус его не совсем приятен. Но если рассматривать самые бюджетные варианты многокомпонентных протеинов, то он является лучшим из них.
- Professional Protein Power System – содержит в одной матрице пять видов белка. Главное его достоинство – ярко выраженное продолжительное анаболическое действие.
- Probolic-SR MHP – из всех предложенных является самым вкусным комплексным протеином. Как и все товары этого бренда, он обладает наивысшим качеством. К сожалению, стоимость его достаточно высокая.
Мы рассмотрели рейтинг наиболее популярных протеинов. Выбор за вами!
Рейтинг лучших протеинов на рынке спортивного питания
Чтобы выбрать лучший протеин из представленных на рынке, составим так называемый рейтинг. Он отражает отзывы потребителей о продукте, а также учитывает такой параметр как соотношение цена/качество.
Лучший комплексный протеин
Перечень лучших комплексных протеинов, представленных на рынке спортивного питания:
- Syntha-6 от BSN – по праву занимает первое место в нашем рейтинге. Данный протеин идеален по соотношению цена/качество, усвоению (за счет включения в состав энзимов и пищевых волокон) и действию на организм.
- Matrix от Syntrax – доступный комплексный протеин, хорошее сочетание цены и качества.
- Protein 80 Plus от Weider – доступная цена в сочетании с нормальным качеством продукта.
В составе комплекса Syntha-6 можно обнаружить некоторые количества жиров и углеводов, однако данный факт не должен вызывать беспокойства. Жиры здесь представлены исключительно ненасыщенными маслами и среднецепочечными триглицеридами, которые являются полезными и способствуют сжиганию собственной жировой ткани. Углеводы же представлены целлюлозной камедью и полидекстрозой, которые выполняют роль регуляторов усвоения и улучшений свойств продукта. К тому же, они не усваиваются организмом.
Лучший медленный протеин (казеин)
В настоящее время на рынке спортивного питания можно выделить следующие продукты на основе медленного протеина:
- 100% Casein Protein от Optimum Nutrition
- Lipotropic Protein от LG Sciences
- 100% Casein от Dymatize
Данные медленные протеины являются оптимальными с точки зрения состава, отзывов потребителей и соотношения цены к качеству.
Лучший сывороточный протеин
Сывороточный протеин является лучшим вариантом для набора мышечной массы. Представим список лучших протеинов, представленных на рынке спортивного питания.
Лучшие концентраты сывороточного белка:
- 100% Whey Gold Standard – бесспорный лидер среди аналогичных продуктов. Содержит смесь изолятов и концентратов сывороточного белка, лучшее качество за приемлемые деньги.
- 100% Pure Platinum Whey (SAN) – изготовлен на основе сывороточных фракций высокой концентрации, обладает отличными вкусовыми качествами.
- Elite Whey Protein от Dymatize – лучший из недорогих вариантов.
Лучшие изоляты:
- Zero Carb от VPX – качественный изолят белка с отличным вкусом.
- SO-100 от Dymatize – лучший из недорогих.
- Iso Sensation от Ultimate Nutrition – хороший вариант за относительно небольшие деньги.
Структурная классификация белковых комплексов
Образец цитирования: Леви Э.Д., Перейра-Леал Дж. Б., Чотиа С., Тейхманн С.А. (2006) 3D-комплекс: структурная классификация белковых комплексов. PLoS Comput Biol 2 (11): e155. https://doi.org/10.1371/journal.pcbi.0020155
Редактор: Burkhard Rost, Колумбийский университет, Соединенные Штаты Америки
Поступила: 26 июня 2006 г .; Принята к печати: 5 октября 2006 г .; Опубликовано: 17 ноября 2006 г.
Авторские права: © 2006 Levy et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Мы благодарим Совет по медицинским исследованиям и Программу молодых исследователей EMBO за поддержку этой работы.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Сокращения: PDB, Банк данных белков; PQS, Четвертичная структура белка; QS, Четвертичная структура; QSF, Семейство четвертичных структур; QST, Топология четвертичной структуры
Введение
Большинство белков взаимодействуют с другими белками и образуют белковые комплексы для выполнения своих функций [1].Недавний обзор около 2000 дрожжевых белков показал, что более 80% белков взаимодействуют по крайней мере с одним партнером [2]. Это отражает важность взаимодействия белков внутри клетки. Поэтому очень важно понимать физико-химические свойства, а также эволюцию взаимодействий между белками.
Банк данных по белкам (PDB) [3] предоставляет доступ к большому количеству структур, которые эффективно обеспечивают молекулярный снимок белков и их взаимодействий с гораздо большим уровнем детализации, чем другие экспериментальные методы.В этом исследовании мы сосредоточены на рентгеновских кристаллографических структурах, которые представляют подавляющее большинство всех структур. Поскольку половина кристаллографических структур представляет собой гомо- или гетеромерные белковые комплексы, кристаллографические данные представляют собой важный источник информации для изучения молекулярных основ белок-белковых взаимодействий и, в более общем плане, образования белковых комплексов.
Чтобы облегчить понимание и доступ к постоянно растущему объему доступной информации о структурах белков, необходима иерархическая классификация белковых комплексов, так же как SCOP [4] и CATH [5] обеспечивают классификацию белковых доменов.Мы подходим к этому, организуя комплексы сначала в терминах топологических классов, в которых каждая полипептидная цепь представлена в виде точки, и рассматривается только образец интерфейсов между цепями. Затем мы подразделяем эти классы, рассматривая структуры, а затем последовательности отдельных субъединиц.
Насколько нам известно, все предыдущие классификации рассматривали части структур, а не целые комплексы. Например, в SCOP [4] и CATH [5] белки делятся на их структурные (CATH) и эволюционные (SCOP) домены, которые впоследствии классифицируются в соответствии с их структурной гомологией с другими доменами.Поскольку домены взаимодействуют друг с другом, как внутри, так и между полипептидными цепями, интерфейсы домен-домен классифицируются в таких базах данных, как SCOPPI [6], 3did [7], iPfam [8], PSIBASE [9] и PIBASE [10].
Белковые комплексы, однако, часто содержат более двух доменов: они могут содержать несколько полипептидных цепей, и каждая цепь может содержать более одного домена. Следовательно, свойства, которые зависят от всего белкового комплекса, нельзя изучать, рассматривая только пары взаимодействующих доменов.Такими свойствами белковых комплексов являются размер, симметрия, эволюция и путь сборки. Были проведены исследования вручную подобранных подмножеств, которые касаются таких вопросов, как эволюция олигомеров [11,12], биохимические и геометрические свойства белковых комплексов [13] или пути сборки в мультисубъединичных белках [14,15]. Самый большой набор комплексов в любой из этих ссылок, по-видимому, составляет около 455 в Бринде и Вишвешваре, поэтому ни одно из этих исследований не фокусировалось на всех известных структурах с точки зрения цельного белкового комплекса .
По историческим, медицинским или другим научным причинам PDB является избыточным, и некоторые структуры, такие как лизоцим фага T4, присутствуют в сотнях копий. Насколько нам известно, ни один метод не позволяет устранить избыточность среди белковых комплексов. Доступные методы разбивают их на неизбыточные наборы доменов (ASTRAL) [16], полипептидные последовательности (ASTRAL) или пары доменов (SCOPPI, 3did). Следовательно, ни один из этих методов не позволяет нам ответить на такой простой вопрос, как «Сколько различных белковых комплексов содержится в PDB?»
Наша структурная классификация целых белковых комплексов (рис. 1) включает новую стратегию визуализации и сравнения комплексов (рис. 2).Мы используем упрощенное графическое представление каждого комплекса, в котором каждая полипептидная цепь является узлом в графе, а цепи с интерфейсом соединены ребрами. Мы сравниваем комплексы с настраиваемой процедурой сопоставления графов, которая учитывает топологию графа, которая представляет собой образец интерфейсов цепочка-цепочка, а также сходство структуры и последовательности между составляющими цепочками. Мы используем эти свойства для создания иерархической классификации белковых комплексов.Он предоставляет неизбыточный набор белковых комплексов, который можно использовать для получения объективной статистики. Мы проиллюстрируем это, опираясь на разные уровни классификации, чтобы ответить на вопросы, связанные с топологией, симметрией и эволюцией белковых комплексов.
Рисунок 1. Иерархия белковых комплексов известной трехмерной структуры
Иерархия имеет 12 уровней, а именно сверху вниз: топология QS, семейство QS, QS, QS20, QS30… QS100. На вершине иерархии расположено 192 топологии QS.Одна конкретная топология QS (оранжевый кружок) с четырьмя субъединицами раскрыта ниже. Он включает в себя 161 семейств QS, всего , два из которых подробно описаны: E. coli lyase и H. sapiens гемоглобин γ 4 . Все комплексы семейства QS E. coli кодируются одним геном и, следовательно, соответствуют одному QS. Однако семейство QS для гемоглобина содержит два QS: один с одним геном, гемоглобин γ 4 , и один с двумя генами, гемоглобин α 2 β 2 из H.сапиенс. Последний уровень иерархии указывает количество структур в полном наборе (PDB). Существует 30 повторяющихся комплексов, соответствующих лиазе QS, четыре — гемоглобину γ 4 QS и 80 — гемоглобину α 2 β 2 QS. Мы также видим, что существует 9 978 мономеров, 6 803 димеров, 814 треугольных тримеров и т. Д. Обратите внимание, что существуют промежуточные уровни с использованием пороговых значений идентичности последовательностей (с четвертого по двенадцатый уровень) между уровнем QS и полным набором, которые здесь подробно не показаны. .
coli кодируются одним геном и, следовательно, соответствуют одному QS. Однако семейство QS для гемоглобина содержит два QS: один с одним геном, гемоглобин γ 4 , и один с двумя генами, гемоглобин α 2 β 2 из H.сапиенс. Последний уровень иерархии указывает количество структур в полном наборе (PDB). Существует 30 повторяющихся комплексов, соответствующих лиазе QS, четыре — гемоглобину γ 4 QS и 80 — гемоглобину α 2 β 2 QS. Мы также видим, что существует 9 978 мономеров, 6 803 димеров, 814 треугольных тримеров и т. Д. Обратите внимание, что существуют промежуточные уровни с использованием пороговых значений идентичности последовательностей (с четвертого по двенадцатый уровень) между уровнем QS и полным набором, которые здесь подробно не показаны. .
https://doi.org/10.1371/journal.pcbi.0020155.g001
Рис. 2. Представление белковых комплексов в виде графиков
(A) Каждый белковый комплекс преобразован в граф, где узлы представляют полипептидные цепи, а края — биологические интерфейсы. между цепями.
(B) Все комплексы сравниваются друг с другом с использованием специальной процедуры сопоставления графиков. Комплексы с одинаковой топологией графа сгруппированы, чтобы сформировать верхний уровень иерархии, как показано зелеными прямоугольниками.Если, кроме того, структуры субъединиц связаны своей архитектурой домена SCOP, они группируются на втором уровне, показанном красными полями. Структуры были визуализированы с помощью VMD [51].
https://doi.org/10.1371/journal.pcbi.0020155.g002
Результаты / Обсуждение
Набор данных белковых комплексов
Мы извлекли все биологические единицы из PDB (октябрь 2005 г.), которые, по словам кураторов PDB, представляют собой белковые комплексы в их физиологическом состоянии.Эта информация достигается за счет комбинации утверждений авторов структур, литературных источников и автоматических прогнозов, сделанных сервером четвертичной структуры белка (PQS) [17,18]. Биологическая единица PDB более подробно описана в Протоколе S1. Вывод биологической единицы из кристаллографической структуры — сложный и подверженный ошибкам процесс [17,19,20]. В Ponstingl et al. (2003), по оценкам, автоматический метод прогнозирования имеет частоту ошибок в 16%. Позже мы обсудим, как наша классификация белковых комплексов может облегчить этот процесс и как мы использовали ее для выявления возможных ошибок в биологических единицах.
Биологическая единица PDB более подробно описана в Протоколе S1. Вывод биологической единицы из кристаллографической структуры — сложный и подверженный ошибкам процесс [17,19,20]. В Ponstingl et al. (2003), по оценкам, автоматический метод прогнозирования имеет частоту ошибок в 16%. Позже мы обсудим, как наша классификация белковых комплексов может облегчить этот процесс и как мы использовали ее для выявления возможных ошибок в биологических единицах.
Мы отфильтровали биологические единицы в соответствии со следующими критериями: мы рассматривали только структуры, представленные в SCOP 1.69 [4], потому что наша методология требует присвоения SCOP надсемейных доменов. Мы удалили вирусные капсиды и любой комплекс, содержащий более 62 белковых цепей, потому что файлы PDB не могут обрабатывать более 62 ссылок на отдельные цепи (a – z, A – Z, 0–9), а также из-за высокой стоимости вычислений. Мы отказались от структур, которые были разделены на два или более комплексов при удалении небиологических интерфейсов, как определено в следующем разделе.Когда две или более копии комплекса присутствуют в асимметричной единице, кураторы PDB создают множество копий одной и той же биологической единицы. В этих случаях мы сохраняем только одну копию.
После применения этих фильтров мы получили 21 037 структур, которые мы используем в этом исследовании.
Извлечение фундаментальных структурных особенностей из белковых комплексов
Предпосылкой для создания иерархической классификации белковых комплексов является быстрый способ сравнения комплексов друг с другом.Полное атомное представление непрактично, потому что автоматическая структурная суперпозиция трудна, если не невозможна, для расходящихся пар структур [21]. Вместо этого нам нужно обобщить фундаментальные структурные особенности белковых комплексов в представление, которым легче манипулировать.
Какой набор функций мы выберем? Естественный способ разбить комплекс — на составляющие его цепи, каждая из которых является продуктом гена. Характер взаимодействия между цепями определяет QS и, следовательно, функцию комплекса.В отличие от крупномасштабных протеомных экспериментов, где комплексы состоят из списка составляющих субъединиц, структуры PDB предоставляют нам QS: точную стехиометрию субъединиц и паттерн интерфейсов между ними. QS часто играет роль в регуляции функции белков, и ее нарушение может быть связано с заболеваниями [22,23]. Например, в случае супероксиддисмутазы нарушение QS дестабилизирует белок и связано с невропатологией [23].
Характер взаимодействия между цепями определяет QS и, следовательно, функцию комплекса.В отличие от крупномасштабных протеомных экспериментов, где комплексы состоят из списка составляющих субъединиц, структуры PDB предоставляют нам QS: точную стехиометрию субъединиц и паттерн интерфейсов между ними. QS часто играет роль в регуляции функции белков, и ее нарушение может быть связано с заболеваниями [22,23]. Например, в случае супероксиддисмутазы нарушение QS дестабилизирует белок и связано с невропатологией [23].
Для извлечения паттерна интерфейсов из структур мы вычисляем контакты между парами атомных групп.Мы определяем границу раздела белок-белок пороговым значением не менее десяти находящихся в контакте остатков, где количество остатков является суммой остатков, внесенных в границу раздела обеими цепями. Контакт остаток-остаток считается, если какая-либо пара атомных групп ближе, чем сумма их ван-дер-ваальсовых радиусов плюс 0,5 Å [24]. Мы исследовали эффект изменения порога в десять остатков на границе раздела и обнаружили, что это имеет лишь незначительное влияние на классификацию. Пожалуйста, обратитесь к Таблице S1 для получения подробной информации.
Поскольку одна из наших целей состоит в том, чтобы сравнить эволюционную консервацию белковых цепей как внутри, так и между комплексами, мы должны включить информацию, которая позволяет нам связывать цепи друг с другом. Для этого мы используем структурную информацию, определенную доменами суперсемейства SCOP, а также информацию о последовательности. Порядок N- и C-концевых доменов суперсемейства SCOP позволяет нам обнаруживать отдаленные отношения, в то время как сходство последовательностей позволяет проводить сравнения на более тонком уровне, например, фильтрацию идентичных цепочек.
Мы выбрали архитектуру цепного домена, последовательность и контакты цепь-цепь для представления белковых комплексов, потому что это универсальные атрибуты комплексов. Напротив, другие атрибуты, такие как присутствие каталитического сайта или временный или обязательный характер интерфейса, не являются универсальными и не всегда доступны из структуры. Однако эти атрибуты можно легко спроецировать на нашу схему классификации, чтобы увидеть, как они соотносятся между белковыми комплексами, имеющими эволюционно связанные цепи.
Однако эти атрибуты можно легко спроецировать на нашу схему классификации, чтобы увидеть, как они соотносятся между белковыми комплексами, имеющими эволюционно связанные цепи.
К этому базовому представлению мы добавляем информацию о симметрии, которая уточняет описание расположения субъединиц за пределами паттерна взаимодействия. Мы обрабатываем симметрию каждого комплекса, используя метод исчерпывающего поиска. Вкратце, мы центрируем координаты комплекса по его центру масс; Затем мы генерируем 600 равномерно расположенных осей, проходящих через центр масс. Мы проверяем, накладывается ли комплекс, повернутый на разные углы вокруг каждой из осей, на неповращенный комплекс.Отсюда выводим тип симметрии. Более подробное описание см. В разделе «Методы» и на рисунке S1.
График прост и хорошо подходит для хранения и визуализации этой информации (рис. 2A). Сам граф обеспечивает то, что мы называем топологией комплекса, то есть количество полипептидных цепей (узлов) и их структуру интерфейсов (ребер). Метка на графике несет информацию о симметрии. Метка на каждом краю указывает количество остатков на границе раздела.С каждым узлом на графике связаны еще две части информации: аминокислотная последовательность и архитектура домена SCOP цепи. Эти два атрибута предоставляют информацию о последовательности, структурном сходстве и эволюционных отношениях между цепями. Затем мы сравниваем графические представления комплексов для построения иерархической классификации.
Обратите внимание, что мы также включаем в классификацию мономерные белки и представляем их одним узлом. Хотя мономерные белки не являются комплексами, их включение позволяет нам сравнивать их частоту и другие свойства с характеристиками белковых комплексов.
Сравнение комплексов и обзор классификации
Преимущество графического представления состоит в том, что оно позволяет быстро и легко сравнивать с использованием алгоритма сопоставления графов. Поскольку графы несут определенные атрибуты, касающиеся структуры и последовательности цепочек, а также симметрии комплекса, нам пришлось реализовать настроенную версию процедуры сопоставления графов, чтобы учесть эту информацию. Подробные сведения об алгоритмах см. В разделе «Методы».
Подробные сведения об алгоритмах см. В разделе «Методы».
Важно отметить, что наша процедура сопоставления графов позволяет учитывать различные атрибуты, как показано в Таблице 1 с тегами «Y» и «N». Таблица показывает, что 12 уровней иерархической классификации создаются с использованием одного или нескольких из следующих пяти критериев для сравнения комплексов друг с другом: (i) топология, представленная количеством узлов и их схемой контактов, (ii) ) структуру каждой составляющей цепи в форме архитектуры домена SCOP, (iii) количество неидентичных цепей на архитектуру домена в каждом комплексе, (iv) аминокислотную последовательность каждой составляющей цепи для сравнения между комплексами, и (v ) симметрия комплекса.
С помощью этих пяти критериев мы разрабатываем все более строгие определения сходства между комплексами, как показано в таблице 1. Первое определение, которое является наиболее мягким, основано исключительно на топологии графов. Это означает, что любые два комплекса с одинаковым количеством цепочек (узлов) и одинаковым рисунком контактов (ребер) принадлежат к одной и той же группе, даже если их цепи структурно не связаны. Мы используем это определение для создания групп, которые образуют верхний уровень классификации, и мы называем эти группы топологиями четвертичной структуры (топологиями QS или QST), и мы находим 192 из них в текущем наборе данных.
Начиная со второго уровня классификации и ниже, мы включаем информацию об эволюционных отношениях. Определение эволюционной взаимосвязи, которое мы используем на этом уровне, заключается в том, что пары совпадающих узлов (полипептидов) между двумя графами должны иметь похожие трехмерные структуры, то есть одну и ту же архитектуру домена SCOP. Это означает, что две совпадающие полипептидные цепи иногда имеют небольшую идентичность последовательностей или совсем не идентичны, но имеют только структурное сходство, т.е. они отдаленно гомологичны. Группы комплексов на этом уровне классификации называются семействами QS, и мы находим 3151 из них в PDB.
На следующем уровне мы дополнительно требуем, чтобы два совпадающих комплекса имели одинаковое количество генов, кодирующих каждую архитектуру домена. Это проиллюстрировано на рисунке 1, где семейство QS гемоглобина делится на две группы: одна содержит гемоглобин γ 4 , образованный одним геном, и одна, содержащая гемоглобин α 2 β 2 , образованный двумя гомологичными генами. Мы называем группы на этом уровне СМО. На протяжении всего исследования мы используем этот уровень, состоящий из 3 236 QS , в качестве эталонного набора неизбыточных белковых комплексов .Обратите внимание, что наш выбор использования этого уровня в качестве неизбыточного набора связан с нашим интересом к событиям дупликации генов, но могут использоваться и другие уровни, в зависимости от заданного вопроса.
Начиная с четвертого уровня и ниже, мы группируем белковые комплексы в соответствии с сходством последовательностей между совпадающими полипептидами двух комплексов, от 20% идентичности на четвертом уровне до 100% на двенадцатом уровне. Мы называем эти группы QS20 / 30/40 и т. Д. По мере ужесточения порога сходства последовательностей 3 236 QS-групп распадаются на более мелкие подгруппы, от 4 452 QS20 на четвертом уровне до 12 231 QS100 на двенадцатом уровне.
В дополнение к четырем критериям, описанным выше, мы можем наложить требование, что два комплекса должны иметь один и тот же тип симметрии, чтобы быть частью одной и той же группы. Поскольку этот выбор сделан для всех уровней, доступны две классификации: одна, в которой симметрия используется в процессе сравнения, и другая, где она не используется. Когда используется симметрия, мы разделяем любую группу белковых комплексов на две или несколько групп, чтобы все комплексы в группе имели одинаковую симметрию. Однако, как мы покажем позже, только несколько групп пришлось разделить в соответствии с симметрией.
Иерархическая классификация проиллюстрирована на рисунке 1. Первые три уровня соответствуют определениям с 1 по 3 в таблице 1. Обратите внимание, что на рисунке 1 «QS20 — QS100» представляет подуровни QS, которые не показаны, но будут обсуждаться ниже. Последний уровень соответствует полному набору данных PDB. В следующих трех разделах мы опишем первые три уровня более подробно и проиллюстрируем их полезность для решения различных вопросов о белковых комплексах.
Первые три уровня соответствуют определениям с 1 по 3 в таблице 1. Обратите внимание, что на рисунке 1 «QS20 — QS100» представляет подуровни QS, которые не показаны, но будут обсуждаться ниже. Последний уровень соответствует полному набору данных PDB. В следующих трех разделах мы опишем первые три уровня более подробно и проиллюстрируем их полезность для решения различных вопросов о белковых комплексах.
Топологии четвертичных структур (уровень 1)
ТопологииQS представляют количество субъединиц (узлов) в комплексе и структуру интерфейсов (ребер) между ними и, таким образом, являются только топологическим уровнем.С математической точки зрения топология QS — это непомеченный связный граф. Количество возможных графов для заданного количества узлов N может быть вычислено и резко увеличивается с N [25] . Одна топология QS существует для N = 1 или N = 2, в то время как существует 6 топологий QS для N = 4 и 261 080 для N = 9. Для сравнения, мы наблюдаем небольшое число, 192 Всего топологий QS, на которые приходится 21 037 белковых комплексов.Это низкое число предполагает, что одни топологии QS предпочтительнее других во вселенной белков. Все топологии QS, содержащие до девяти цепочек, показаны на рисунке 3, а число над каждым QST указывает количество QS (неизбыточных структур), которому оно соответствует. Визуальный осмотр QST предлагает три основных ограничения, ограничивающих их количество.
Рисунок 3. Примеры топологий четвертичной структуры
(A) Показаны все QST для комплексов, содержащих до девяти субъединиц, что составляет более 96% неизбыточного набора QS и более 98% всех комплексов в PDB.Топологии, совместимые с симметричным комплексом, помечаются аннотациями s, , а топологии, в которых все подблоки имеют одинаковое количество интерфейсов (ребер), отмечены звездочкой (*).
(B) Примеры больших комплексов, которые являются единственными представителями своих соответствующих топологий (QST). Приведены коды PDB. 1pf9, E. coli GroEL-GroES-ADP; 1eaf, синтетическая конструкция, пируватдегидрогеназа; 1shs, малый белок теплового шока Methanococcus jannaschii; 1b5s, дигидролипоилтрансацетилаза Bacillus stearothermophilus; 1j2q, альфа-кольцо протезом Archaeoglobus fulgidus 20S.Интересно отметить, что макеты графов напоминают пространственное расположение субъединиц.
Приведены коды PDB. 1pf9, E. coli GroEL-GroES-ADP; 1eaf, синтетическая конструкция, пируватдегидрогеназа; 1shs, малый белок теплового шока Methanococcus jannaschii; 1b5s, дигидролипоилтрансацетилаза Bacillus stearothermophilus; 1j2q, альфа-кольцо протезом Archaeoglobus fulgidus 20S.Интересно отметить, что макеты графов напоминают пространственное расположение субъединиц.
(C) Вероятные ошибки в биологических единицах PDB: QST гомомеров с различным количеством контактов между субъединицами. Количество ошибочных QS в каждой топологии указано над каждым графиком.
https://doi.org/10.1371/journal.pcbi.0020155.g003
Первое, как показано на рисунке 4, состоит в том, что большинство комплексов содержат небольшое количество цепочек и поэтому могут принимать очень ограниченное количество топологий.В наборе PDB мы наблюдаем резкое уменьшение доли комплексов по мере увеличения числа их цепей, так что 94% структур содержат четыре цепи или меньше и обнаруживаются только в десяти QST.
Рис. 4. Распределение размеров белковых комплексов в иерархии
Гистограмма количества субъединиц на белковый комплекс. Комплексы меньшего размера более многочисленны, чем более крупные комплексы, а комплексы с четным числом субъединиц имеют тенденцию быть более многочисленными, чем комплексы с нечетным числом субъединиц, на обоих уровнях иерархии.
https://doi.org/10.1371/journal.pcbi.0020155.g004
Второе ограничение, ограничивающее количество топологий QS, заключается в составе PDB, которая состоит в основном из гомоолигомерных комплексов, то есть образованных комплексов несколькими копиями одного и того же белка. Поскольку границы раздела белок-белок часто являются гидрофобными [26,27], различное количество интерфейсов в двух идентичных белках означает, что гидрофобная поверхность подвергается воздействию растворителя в одном из них, что было бы неблагоприятно для стабильности белка.Итак, в гомомерных комплексах мы ожидаем, что все цепи будут иметь одинаковое количество интерфейсов. Исключая мономеры, мы наблюдаем, что это имеет место для 96% гомомерных комплексов, которые представляют 41% всей PDB. В 4% случаев, когда этот критерий не выполняется, мы наблюдаем большую долю ошибочных QS, как обсуждается ниже. Тогда чисто гомомерные комплексы очень ограничены по своей топологии, потому что для комплекса с N цепями ( N ≥ 3) существует только N- 2 топологии с таким же количеством интерфейсов на цепь . Например, только семь топологий удовлетворяют этому критерию для N = 9, небольшое число по сравнению с 261 080 возможными. На рис. 3A показано, что наиболее часто используемые топологии — это те, для которых все субъединицы имеют одинаковый рисунок контактов, и они отмечены звездочкой.
Исключая мономеры, мы наблюдаем, что это имеет место для 96% гомомерных комплексов, которые представляют 41% всей PDB. В 4% случаев, когда этот критерий не выполняется, мы наблюдаем большую долю ошибочных QS, как обсуждается ниже. Тогда чисто гомомерные комплексы очень ограничены по своей топологии, потому что для комплекса с N цепями ( N ≥ 3) существует только N- 2 топологии с таким же количеством интерфейсов на цепь . Например, только семь топологий удовлетворяют этому критерию для N = 9, небольшое число по сравнению с 261 080 возможными. На рис. 3A показано, что наиболее часто используемые топологии — это те, для которых все субъединицы имеют одинаковый рисунок контактов, и они отмечены звездочкой.
Третье ограничение, ограничивающее количество QST, состоит в том, что 85% комплексов в PDB являются симметричными. Эта тенденция отражена на Рисунке 4, показывая, что предпочтение отдается комплексам с четным числом субъединиц, но становится более явным при взгляде на QST на Рисунке 3.Графическое представление отражает возможность наличия или отсутствия симметрии. Для любого количества субъединиц наиболее часто встречаются топологии QS, совместимые с симметричным комплексом (отмечены буквой «s»). Например, у тетрамеров обнаружено шесть топологий QS, причем четыре наиболее распространенных совместимы с симметрией, а две менее распространенные — нет.
Таким образом, топологии QS позволяют исследовать организацию цепей в белковых комплексах. Лучше всего это иллюстрируют большие белковые комплексы, показанные на рисунке 3B, где графическое представление намекает на трехмерную структуру.Это представление подчеркивает, что белковые комплексы в PDB обычно удовлетворяют трем критериям: они преимущественно маленькие, гомомерные и симметричные, что резко ограничивает топологии QS по сравнению со всеми возможными топологиями графов. Этот результат обладает потенциальной предсказательной силой и может использоваться в качестве ограничений для предсказания топологии больших сборок [28]. Также ниже мы оценим, в какой степени этот результат, наблюдаемый на подмножестве белков, присутствующих в PDB, может быть распространен на белки SwissProt [29].
Также ниже мы оценим, в какой степени этот результат, наблюдаемый на подмножестве белков, присутствующих в PDB, может быть распространен на белки SwissProt [29].
Семейства четвертичной структуры (уровень 2)
Когда мы рассматриваем структурное сходство в форме идентичности доменной архитектуры между парами совпадающих субъединиц двух комплексов, 192 QSTs распадаются на 3151 семейство четвертичных структур (QSFs) (Table 1, definition 2). Например, на рисунке 1 оранжевый кружок выделяет тетрамерный QST, который распадается на 161 QSF , , два из которых показаны: лиаза Escherichia coli и гемоглобин Homo sapiens.
На следующем уровне классификации, уровне QS (уровень 3), будет добавлено ограничение на количество генов на архитектуру домена (таблица 1, определение 3).Например, QSF гемоглобина H. sapiens распадается на два QS: (i) гемоглобины γ 4 (образованные четырьмя копиями одного гена) и (ii) гемоглобины α 2 β 2 (образован двумя копиями двух гомологичных генов). Однако все структуры, присутствующие в QSF E. coli, состоят только из одного гена, и, следовательно, QSF содержит единственный QS.
Уровень QSF может использоваться для ответа на вопросы, связанные с эволюцией белковых комплексов, в частности, с ролью дупликации генов.Каждый QSF, соответствующий двум или более QS, указывает на комплексы со сходной структурой, но с разным числом генов, т.е. комплексы, подвергшиеся внутренней дупликации генов [30–33]. Этот тип события редко встречается в PDB: 83 QSF соответствуют двум QS, как для гемоглобинов, и один QSF соответствует трем QS, в то время как другие 3070 QSF соответствуют одному QS.
Четвертичные конструкции (уровень 3)
Выше мы видели, что существует несколько QSF, которые соответствуют нескольким QS, так что количество QS аналогично количеству QSF.В PDB 3 236 QS. Некоторые из них соответствуют множественным избыточным структурам в PDB. Например, на рисунке 1 показано, что 30 структур соответствуют QS E. coli, четыре соответствуют гемоглобину γ 4 QS, а 80 соответствуют гемоглобину α 2 β 2 QS. В таблице 2 мы перечисляем 12 QS, содержащих наибольшее количество избыточных белковых комплексов в PDB. Иммуноглобулины и протеазы ВИЧ-1 являются наиболее избыточными с 281 и 202 комплексами, соответственно, в полной PDB.Уровень QS представляет собой неизбыточную версию PDB, где случаи, подобные показанным в таблице 2, сокращены до одной записи.
coli, четыре соответствуют гемоглобину γ 4 QS, а 80 соответствуют гемоглобину α 2 β 2 QS. В таблице 2 мы перечисляем 12 QS, содержащих наибольшее количество избыточных белковых комплексов в PDB. Иммуноглобулины и протеазы ВИЧ-1 являются наиболее избыточными с 281 и 202 комплексами, соответственно, в полной PDB.Уровень QS представляет собой неизбыточную версию PDB, где случаи, подобные показанным в таблице 2, сокращены до одной записи.
В структурной классификации белков SCOP считается, что белки с одними и теми же доменами суперсемейства произошли от общего предка и, таким образом, связаны эволюционным родством. Точно так же в классификации 3D-комплексов белковые комплексы, сгруппированные в одном и том же QS, имеют общие эволюционно связанные белки. Однако неизвестно, связаны ли целые комплексы эволюционно, т.е.е., взаимодействовали ли их предковые белки таким же образом. Поэтому важно отметить, что в пределах одной и той же QS белки двух разных комплексов, даже если они эволюционно связаны, в принципе могут взаимодействовать по-разному, то есть с интерфейсами на разных поверхностях структуры. Одним из примеров являются различные режимы димеризации лектинов, обсуждаемые в [34]. Однако, если кто-то действительно хочет минимизировать различия в геометрии интерфейсов, мы предлагаем два способа достижения этого: ограничение по схожести последовательностей или по симметрии.Для комплексов с идентичностью последовательностей от 30% до 40% недавняя работа предполагает, что различия в геометрии интерфейса будут редкими [35]. Уровни ниже уровня QS используют сходство последовательностей для сравнения комплексов и обсуждаются в следующем разделе.
Отметим также, что группирование белков с разными режимами взаимодействия не влияет на использование QS в качестве неизбыточного представления PDB. Напротив, группы, сформированные на уровне QS, могут быть использованы для изучения сохранения взаимодействий в белковых комплексах в зависимости от их размера, места, формы или химической природы. В этой статье мы проиллюстрируем использование QS в качестве неизбыточного набора для обзора распределения размеров белковых комплексов, а также относительной распространенности их топологий, как описано выше. Мы также будем использовать его позже для сравнения распределения размеров гомоолигомеров в PDB и в базе данных SwissProt. Могут быть проведены многие другие исследования; например, этот уровень может быть использован для изучения разнообразия олигомерных состояний на семейство доменов или доменную архитектуру.
В этой статье мы проиллюстрируем использование QS в качестве неизбыточного набора для обзора распределения размеров белковых комплексов, а также относительной распространенности их топологий, как описано выше. Мы также будем использовать его позже для сравнения распределения размеров гомоолигомеров в PDB и в базе данных SwissProt. Могут быть проведены многие другие исследования; например, этот уровень может быть использован для изучения разнообразия олигомерных состояний на семейство доменов или доменную архитектуру.
Добавление информации о сходстве последовательностей в классификацию (уровни с 4 по 12)
Чтобы добавить ограничения на сходство последовательностей, нам требуется порог идентичности последовательностей для сопоставления пар белков в наших критериях сопоставления графиков от уровня 4 до уровня 12, как указано в таблице 1.Мы начинаем с 20% порога идентичности, что дает 4 452 группы, и увеличиваем его с шагом 10%, чтобы достичь 12 231 группы при пороге 100% идентичности. Мы называем группы QS N, , где N обозначает используемый процентный порог идентичности.
Количество групп для разных уровней классификации показано на рисунке 5A. Увеличение от 3 236 QS до 21 037 комплексов в общем наборе не является линейным; вместо этого его можно разделить на четыре фазы: (i) всплеск количества групп между QS (3236) и QS30 (5136), (ii) постепенное увеличение между QS30 и QS90 (7713), (iii) резкое увеличение между QS90 и QS100 (12 231), и (iv) резкий скачок между QS100 и всем набором PDB (21 037).
Рисунок 5. Избыточность в банке данных белков на нескольких уровнях сходства последовательностей
(A) Количество структур на каждом уровне базы данных 3D Complex, от 192 QST до общего количества структур в PDB (21 037). Отметки на линии под графиком указывают на последовательные пары уровней, которые нанесены на график (B – E).
(B) Количество QS30 на QS. Обратите внимание, что семейства QS почти идентичны QS. Первый столбец на гистограмме показывает, что около 2500 QS соответствуют одному QS30; вторая полоса представляет 250 QS, которые соответствуют двум QS30.
Первый столбец на гистограмме показывает, что около 2500 QS соответствуют одному QS30; вторая полоса представляет 250 QS, которые соответствуют двум QS30.
(C) Количество QS90 на QS30.
(D) Количество QS100 на QS90.
(E) Количество комплексов в комплекте на QS100.
Все дистрибутивы демонстрируют безмасштабное поведение в том смысле, что большая часть групп идентична на любых двух последовательных уровнях, тогда как небольшое количество очень избыточно. Добавление информации о симметрии не меняет эту тенденцию, как показано в таблице 1.
https://doi.org/10.1371/journal.pcbi.0020155.g005
На рис. 5B – 5E показано распределение избыточности между этими четырьмя парами уровней. Например, на рисунке 5B показано, что ~ 2500 QS соответствуют одному QS30, ~ 300 QS разделены на два QS30, ~ 150 QS разделены на три QS30, два QS разделены на пятнадцать QS30 и т. Д. Это показывает, что большинство белковых комплексов сгруппированы вместе в одни и те же QS на основе структурного сходства показывают уровни сходства последовательностей выше 30% для всех своих цепей, в то время как некоторые показывают более низкие уровни сходства последовательностей.Поразительно, что распределение избыточности между последующими парами уровней QS, такими как от QS30 до QS90 и от QS90 до QS100, отражает распределение избыточности между QS и QS30, даже несмотря на то, что источники избыточности не связаны. Например, распределение между QS30 и QS90 отражает умеренное расхождение последовательностей между родственными комплексами. Избыточность, наблюдаемая между QS90 и QS100, по существу соответствует искусственным точечным мутациям. Наконец, избыточность, наблюдаемая между QS100 и всей PDB, является максимальной: почти половина белковых комплексов в PDB соответствует по крайней мере одной другой структуре с идентичной последовательностью составляющих субъединиц.
Добавление информации о симметрии в классификацию: альтернативная иерархия
Знание симметрии комплекса дает информацию о трехмерном расположении субъединиц, которая не обеспечивается графическим представлением. Например, есть два симметричных способа расположения субъединиц гомотетрамера. Один из них имеет циклическую симметрию, в которой четыре субъединицы связаны одной 4-кратной осью, называемой симметрией C4, как показано на рисунке 6. Другой — двугранной симметрией, в которой четыре субъединицы связаны тремя двукратными связями. оси, называемые симметрией D2 (рис. 6).Априори нельзя отличить два типа симметрии только от графического представления. Чтобы оценить, достаточно ли графического представления для объяснения пространственного расположения субъединиц, мы спросили, могут ли QS содержать комплексы с разной симметрией.
Например, есть два симметричных способа расположения субъединиц гомотетрамера. Один из них имеет циклическую симметрию, в которой четыре субъединицы связаны одной 4-кратной осью, называемой симметрией C4, как показано на рисунке 6. Другой — двугранной симметрией, в которой четыре субъединицы связаны тремя двукратными связями. оси, называемые симметрией D2 (рис. 6).Априори нельзя отличить два типа симметрии только от графического представления. Чтобы оценить, достаточно ли графического представления для объяснения пространственного расположения субъединиц, мы спросили, могут ли QS содержать комплексы с разной симметрией.
Рис. 6. Циклическая и двугранная симметрии
(C2) Циклическая симметрия: две субъединицы связаны одной двойной осью, показанной пунктирной линией. Эллипс на конце оси симметрии отмечает ось 2-го порядка.Почти все гомодимеры обладают симметрией C2. Симметрия C2 обозначена термином «2» в кристаллографической номенклатуре Германа-Могена, показанной красным цветом под C2.
(C4) Циклическая симметрия: четыре субъединицы связаны одной 4-кратной осью. Квадрат на конце оси симметрии отмечает ось 4-го порядка.
(D2) Диэдральная симметрия: четыре субъединицы связаны тремя осями 2-го порядка. Симметрия D2 может быть построена из двух димеров C2. Обратите внимание на разницу между симметриями D2 и C4: два типа симметрии, каждый из которых имеет четыре субъединицы.
(D4) Двугранная симметрия: восемь субъединиц связаны друг с другом одной 4-кратной осью и двумя 2-кратными осями. Обратите внимание, что симметрия D4 может быть построена путем наложения двух тетрамеров C4, как показано, или четырех димеров C2 (не показано).
https://doi.org/10.1371/journal.pcbi.0020155.g006
Мы рассчитали симметрии и псевдосимметрии для всех структур, как кратко описано выше и подробно в разделе «Методы». Мы классифицируем комплексы на две категории, связанные с симметрией.Мы различаем комплексы, которые могут быть или не могут быть симметричными, на основе состава их полипептидной цепи. Например, гомодимеры могут быть симметричными, а гетеродимеры негомологических цепей — нет. Это более подробно объясняется в разделе «Методы». Более того, СМО с множественными комплексами могут содержать несколько разных типов симметрии, тогда как СМО с одним комплексом явно не могут.
Например, гомодимеры могут быть симметричными, а гетеродимеры негомологических цепей — нет. Это более подробно объясняется в разделе «Методы». Более того, СМО с множественными комплексами могут содержать несколько разных типов симметрии, тогда как СМО с одним комплексом явно не могут.
Ниже мы увидим, что только небольшая часть СМО содержит комплексы с различной симметрией, что обеспечивает поддержку нашего использования представления двумерного графа для сравнения трехмерных комплексов.Другими словами, в большинстве случаев один QS-граф представляет собой комплексы, имеющие один и тот же тип симметрии.
Графическое представление как средство правильной идентификации биологических единиц
Во-первых, мы искали разногласия в симметрии среди комплексов в пределах QS, чтобы идентифицировать ошибки или необычные комплексы. Среди 841 СМО с возможной симметрией, содержащих множественные комплексы, мы обнаружили, что 109 СМО (13%) содержали смешанные типы симметрии. Ручная проверка показала, что 93 из этих случаев на самом деле связаны с наличием и отсутствием симметрии в комплексах каждой QS.Причина отсутствия симметрии либо биологическая, например, из-за конформационного изменения (16 случаев), либо из-за ошибки в биологической единице PDB (42 случая). Также было два случая ложноотрицательного результата в нашей процедуре поиска симметрии и 33 неоднозначных случая, которые мы не смогли разрешить. Есть еще 16 QS с двумя разными типами симметрии. Из них семь являются истинными биологическими случаями, пять — ошибками в биологической единице PDB, а три — неразрешенными. Коды PDB вероятных ошибочных биологических единиц представлены в таблицах S2A и S2B.
Помимо смешанной симметрии, дополнительные критерии для фильтрации ошибок могут быть получены из представления белкового комплекса в виде графика. Например, в гомомерных комплексах, в которых все субъединицы идентичны, ожидается, что все цепи будут иметь одинаковое количество интерфейсов. Графическое представление позволило выявить случаи, когда это требование не выполняется.
Графическое представление позволило выявить случаи, когда это требование не выполняется.
Различие в количестве интерфейсов субъединиц внутри гомомерного комплекса может быть биологическим и в большинстве случаев связано с конформационными изменениями.Примером является гексамерный прокариотический фактор терминации транскрипции Rho (PDB 1pv4), который образует открытое кольцо, приводящее к топологии линейного графа в его несвязанном состоянии [36]. Кольцо замыкается при связывании РНК, и поэтому предположительно в этом состоянии все субъединицы образуют два интерфейса.
Однако в некоторых случаях топология асимметричного графа гомомерных комплексов соответствует ошибке в определении биологической единицы PDB. На рисунке 3C мы показываем четыре различных топологии QS и количество неправильно определенных биологических единиц, связанных с ними.Мы предоставляем идентификаторы PDB ошибочных случаев в таблице S2C. В таблице S2D мы приводим идентификаторы 62 возможных дополнительных ошибок, обнаруженных во время описанного выше поиска, но для которых не было доступно литературных источников.
Сравнение биологических единиц PDB и PQS
PDB и серверы PQS — единственные ресурсы, которые предоставляют информацию о биологических единицах кристаллографических структур. Существенное различие между этими двумя ресурсами заключается в том, что биологические единицы PDB частично настраиваются вручную, тогда как единицы из PQS генерируются полностью автоматически.Поэтому интересно сравнить степень согласия между двумя базами данных.
Ручная проверка и отбор более 20 000 биологических единиц, присутствующих в обеих базах данных, занимает очень много времени. Однако мы можем выявить существенные различия, сравнив гораздо меньшее количество QST. Мы видели, что биологические единицы PDB соответствуют 192 QST. PQS дает немного большее количество 218 QST. При сравнении двух наборов мы находим 155 QST, общих для PDB и PQS, подразумевая 37 исключительных для PDB и 68 исключительных для PQS. Мы вручную отобрали структуры исключительно для каждой базы данных и обнаружили, что 19 из 40 QST, исключительных для PDB, и 42 из 68 QST, исключительных для PQS, являются вероятными ошибками. Коды доступа этих структур показаны в таблицах S2E и S2F. Часто ошибочная биологическая единица в одной базе данных верна в другой. Например, структура 2dhq, 3-дегидрохиназа, состоящая из 12 идентичных субъединиц [37], находится в правильном состоянии в PQS, но имеет только десять субъединиц в биологической единице PDB.Противоположный пример — фермент MenB из Mycobacterium tuberculosis (1q51), который состоит из гомогексамера [38]. Здесь биологическая единица PDB верна, в то время как в PQS фермент описывается как додекамер (12 субъединиц). Эти примеры показывают, что комбинация обоих ресурсов может быть ценным подходом для лечения биологических единиц.
Мы вручную отобрали структуры исключительно для каждой базы данных и обнаружили, что 19 из 40 QST, исключительных для PDB, и 42 из 68 QST, исключительных для PQS, являются вероятными ошибками. Коды доступа этих структур показаны в таблицах S2E и S2F. Часто ошибочная биологическая единица в одной базе данных верна в другой. Например, структура 2dhq, 3-дегидрохиназа, состоящая из 12 идентичных субъединиц [37], находится в правильном состоянии в PQS, но имеет только десять субъединиц в биологической единице PDB.Противоположный пример — фермент MenB из Mycobacterium tuberculosis (1q51), который состоит из гомогексамера [38]. Здесь биологическая единица PDB верна, в то время как в PQS фермент описывается как додекамер (12 субъединиц). Эти примеры показывают, что комбинация обоих ресурсов может быть ценным подходом для лечения биологических единиц.
Четвертичная структура гомо-олигомеров вне банка данных белков
В разделе о QST мы показали, что большинство комплексов в PDB небольшие, гомомерные и симметричные.Насколько общий результат? PDB — это ограниченный набор данных, в котором недостаточно представлены трансмембранные белки, регионы низкой сложности и неупорядоченные регионы [39,40], и в котором также наблюдались функциональные отклонения, хотя проекты структурной геномики сокращают разрыв [39]. Поэтому теперь мы сравниваем частоту гомомеров в полной PDB, уровень QS PDB, полный SwissProt и подмножества белков человека и E. coli в SwissProt.
Интересно, что тенденция PDB полностью согласуется с нашими наблюдениями в SwissProt, как показано на рисунке 7.В PDB мы наблюдаем 46% гомоолигомеров в полном наборе, 60% в неизбыточном наборе и от 71% до 73% в SwissProt. Таким образом, наш неизбыточный набор больше похож на SwissProt, чем на весь PDB. Согласованность есть даже на более подробном уровне во всех пяти наборах данных: среди комплексов размером четыре или более предпочтение отдается четному количеству субъединиц. Гомомеры с нечетным числом субъединиц могут принимать только циклическую симметрию, тогда как гомомеры с четными номерами с четырьмя или более субъединицами могут принимать либо диэдрическую, либо циклическую симметрию [41] (Рисунок 6). Следовательно, предпочтение четного числа субъединиц предполагает, что большинство этих комплексов обладают двугранной симметрией. Действительно, комплексы PDB размера четыре или более с четным числом субъединиц принимают двугранную симметрию в 80% случаев и циклические в 20%. Предположительно это связано с тем, что эволюция и стабильность диэдральных комплексов более благоприятны, чем циклических. Тесное соглашение между PDB и SwissProt поддерживает PDB как репрезентативный набор QST.
Следовательно, предпочтение четного числа субъединиц предполагает, что большинство этих комплексов обладают двугранной симметрией. Действительно, комплексы PDB размера четыре или более с четным числом субъединиц принимают двугранную симметрию в 80% случаев и циклические в 20%. Предположительно это связано с тем, что эволюция и стабильность диэдральных комплексов более благоприятны, чем циклических. Тесное соглашение между PDB и SwissProt поддерживает PDB как репрезентативный набор QST.
Рисунок 7.Размер гомомерных комплексов в банке данных по белкам и в SwissProt
Гистограмма показывает относительное содержание мономеров и гомоолигомеров разных размеров в PDB и SwissProt. Показаны два набора PDB: полный набор и неизбыточный набор QS. Показаны три набора SwissProt: полный набор SwissProt, а также подмножества Human и E. coli. Тенденция во всех наборах схожа и подчеркивает важность механизма самосборки, который связан со многими функциональными возможностями, обсуждаемыми в тексте.Олигомерное состояние белков в SwissProt было извлечено из поля аннотации субъединиц, и аннотации, выведенные на основе сходства, не учитывались.
https://doi.org/10.1371/journal.pcbi.0020155.g007
Все пять наборов данных показывают, что гомоолигомеризация очень широко распространена. Это может быть связано с тем, что он обеспечивает простые способы регулирования функции белка. Он может служить датчиком концентрации белка или pH, при котором происходит самосборка и запускается функция, как в случае протеазы гибели клеток каспазы-9 [42].Он может обеспечивать кооперативность через аллостерический механизм, как в случае с гемоглобином [43]. Он также может служить шаблоном для объединения белков и запуска функции, как в случае фактора некроза опухоли [44]. Это важное сообщение, поскольку недавние достижения в крупномасштабном картировании белковых комплексов с помощью масс-спектрометрии не учитывают стехиометрию субъединиц. Это может создать изображение клетки, в которой белки взаимодействуют только с другими белками, без учета важности гомоолигомеризации.
Интересно отметить очевидное противоречие между крупномасштабными данными протеомики и структурными данными. По данным протеомики, большинство белков связаны между собой в «гигантский компонент» [45], в то время как в PDB имеется несколько гетеромерных белковых комплексов, и большинство из них гомомерные. Это кажущееся противоречие проистекает из того факта, что небольшие стабильные комплексы легче всего кристаллизовать. С другой стороны, цель протеомных проектов — максимизировать охват и убрать все взаимодействия.Многие гомомерные комплексы того типа, который наблюдается в PDB, вероятно, лежат в основе более крупных мультипротеиновых комплексов, наблюдаемых в наборах данных протеомики. Например, протеасома 20S в PDB состоит из гомомерных колец [46] и образует каталитическое ядро комплекса 26S, которое содержит намного больше белков.
Комплексная база данных 3D и веб-сервер
Иерархическая классификация всех комплексов в PDB доступна в виде базы данных в Интернете по адресу http: // www.3Dcomplex.org. Мы предварительно рассчитали три классификации, каждая с информацией о симметрии и без нее. Обратите внимание, что даже без выбора симметрии в качестве критерия классификации информация о симметрии все равно отображается, так что можно увидеть, содержит ли группа одну или несколько симметрий. Две из предварительно вычисленных классификаций начинаются с топологии QS и различаются комбинацией уровней идентичности последовательностей. Третья предварительно рассчитанная классификация начинается на уровне QS, так что все QS можно просматривать на одной странице.
Также можно выбрать любую комбинацию уровней в классификации и просмотреть результат, вычисленный на лету. Объединение разных уровней в классификации дает разные наборы комплексов, которые можно рассматривать вместе. Например, при выборе только первого и последнего уровня топологии QS связываются со всеми структурами PDB. Это можно использовать, например, для обзора всех структур PDB, состоящих из четырех белков, связанных определенным образом.
В базе данных также можно искать по коду доступа PDB, по идентификатору суперсемейства SCOP или архитектуре домена, по ключевому слову и по типу симметрии.Примером применения средства поиска является запрос всех белковых комплексов, в которых участвует одно конкретное суперсемейство доменов, чтобы узнать об эволюции взаимодействий этого суперсемейства. Можно также искать комбинацию терминов, таких как трансферазы, которые имеют симметрию D2.
Помимо возможностей автоматического поиска и загрузки, ручной осмотр комплексов облегчается новым режимом визуализации, представляющим комплексы в виде графиков.Это позволяет анализировать и сравнивать многие аспекты комплексов с первого взгляда, которые гораздо труднее выделить из стандартных представлений трехмерных структур. Для всех, кто интересуется конкретной структурой, просмотр структуры в классификации 3D-комплекса позволяет быстро сравнить ее с другими комплексами. Например, можно быстро получить представление о размере и структуре интерфейсов в интересующем комплексе и связанных комплексах.
Выводы
Большинство белков действуют согласованно с другими белками, образуя постоянные или временные комплексы.Понимание этих взаимодействий на атомарном уровне возможно только путем анализа белковых структур. Здесь мы представили новый метод описания и сравнения структур белковых комплексов, который мы использовали для построения иерархической системы классификации.
Эта иерархическая классификация позволяет нам ответить на вопрос: «Сколько различных комплексов существует в PDB?» В зависимости от уровня детализации мы находим от 192 структур на верхнем уровне до 12 231 структур на нижнем уровне иерархии.Какой из этих уровней используется в анализе, будет зависеть от типа рассматриваемого вопроса.
Рассматривая верхний уровень иерархии, QST, мы видим сильное смещение в сторону небольших, гомомерных и симметричных комплексов, и мы показываем, что этот результат может быть обобщен на белки SwissProt. Мы заметили, что в SwissProt предпочтение отдается комплексам с четным числом субъединиц, что указывает на то, что двугранные симметрии встречаются чаще, чем циклические симметрии, точно так же, как и в PDB.Семейство QS и уровни QS являются подходящими неизбыточными наборами комплексов для многих типов анализа. Здесь мы используем уровень QS для сравнения со SwissProt, и мы обнаруживаем, что он находится в более близком соответствии, чем полный набор комплексов.
Мы заметили, что в SwissProt предпочтение отдается комплексам с четным числом субъединиц, что указывает на то, что двугранные симметрии встречаются чаще, чем циклические симметрии, точно так же, как и в PDB.Семейство QS и уровни QS являются подходящими неизбыточными наборами комплексов для многих типов анализа. Здесь мы используем уровень QS для сравнения со SwissProt, и мы обнаруживаем, что он находится в более близком соответствии, чем полный набор комплексов.
Остальные уровни охватывают гомологию последовательностей между комплексами в диапазоне от порога идентичности последовательностей 20% для QS20 до 100% для QS100 с 10% -ными интервалами идентичности последовательностей. Используя эти уровни, мы исследуем, как четыре типа сходства между комплексами (структурное, расхождение последовательностей, точечная мутация и идентичные комплексы) связаны друг с другом.На всех четырех уровнях мы наблюдаем одну и ту же тенденцию: многие комплексы уникальны, а некоторые сильно избыточны. Объединив эти уровни с информацией о симметрии, можно решить такие проблемы, как порог последовательности, при котором тип симметрии сохраняется или нарушается. Путем проецирования уровней друг на друга становится очевидным обилие гомологов на разных порогах идентичности последовательностей.
Мы описываем первую глобальную платформу для анализа белковых комплексов известной трехмерной структуры.Классификация станет отправной точкой для будущей работы, направленной на понимание структуры, эволюции и сборки белковых комплексов. Мы надеемся, что это будет способствовать лучшему пониманию пространства белковых комплексов точно так же, как SCOP и CATH сыграли важную роль в нашем понимании складчатого пространства [47]. Это особенно важно в эпоху структурной геномики, движущейся к решению более крупных комплексов белков (например, , 3D-репертуар, http: //www.3drepertoire.org) и с увеличением количества протеомических данных о белковых комплексах [2].
Обнаружение и ранжирование белковых комплексов: приложение к болезни Альцгеймера
Бадер Г. Д. и Хогью С.В. 2003 Автоматический метод поиска молекулярных комплексов в крупных сетях взаимодействия белков. BMC Bioinform. 4 1
Д. и Хогью С.В. 2003 Автоматический метод поиска молекулярных комплексов в крупных сетях взаимодействия белков. BMC Bioinform. 4 1
Артикул Google ученый
Bandyopadhyay S, Ray S., Mukhopadhyay A and Maulik U 2015 Многокритериальный подход к идентификации белковых комплексов и изучению их связи при множественных расстройствах. Алгоритмы Мол. Биол. 10 1
Артикул Google ученый
Becker E, Robisson B, Chapple CE, Guenoche A и Brun C 2012 Многофункциональные белки, выявленные путем перекрывающейся кластеризации в сети взаимодействия белков. Биоинформатика 28 84–90
CAS Статья Google ученый
Брохи С. и Ван Хелден Дж. 2006 Оценка алгоритмов кластеризации для сетей белок-белкового взаимодействия. BMC Bioinform. 7 1
Артикул Google ученый
Чен Ю., Жакемин Т., Чжан С. и Цзян Р. 2014 Приоритет белковых комплексов, участвующих в заболеваниях человека, путем оптимизации сети. BMC Syst. Биол. 8 S2
Артикул PubMed PubMed Central Google ученый
Chua HN, Ning K, Sung WK, Leong HW и Wong L 2008 Использование непрямых межбелковых взаимодействий для прогнозирования белковых комплексов. J. Bioinform. Comput. Биол. 6 435–466
CAS Статья PubMed Google ученый
Коэн Д., Чумаков И., Набирочкин С., Герассименко О., Грауденс Е. 2010 Новые средства диагностики болезни Альцгеймера. Патентное приложение США. 13 / 387,174
13 / 387,174
Эртен С., Ли Х, Бебек Г., Ли Дж., Коютюрк М. 2009 Филогенетический анализ модульности в сетях взаимодействия белков. BMC Bioinform. 10 333
Артикул Google ученый
Гамбетт П. и Генош Кластеризация начальной загрузки 2011 г. для разбиения графа. RAIRO Опер. Res. 45 339–352
Артикул Google ученый
Gavin AC, Aloy P, Grandi P, Krause R, Boesche M, Marzioch M, Rau C, Jensen LJ, Bastuck S, Dumpelfeld B, et al. 2006 Протеомное исследование показывает модульность механизма дрожжевых клеток. Природа 440 631–636
CAS Статья PubMed Google ученый
Guenoche Консенсус перегородок 2011: конструктивный подход. Adv. Data Anal. Classif. 5 215–229
Артикул Google ученый
H-InvDB 2012 PCDq Protein-Protein, Protein-Complex и Complex-Complex Interactive Viewer с интегративной аннотацией.http://hinvitational.jp/hinv/pcdq/
Иноуэ Х., Такахаши Р., Кондо Т., Ивата Н. и Асаи М. 2013 г. Метод скрининга терапевтических и / или профилактических средств для лечения болезни Альцгеймера. Заявка на патент США 14/385,990
Jung SH, Hyun B, Jang WH, Hur HY и Han DS 2010 Прогнозирование белкового комплекса на основе одновременной сети взаимодействия белков. Биоинформатика 26 385–391
CAS Статья PubMed Google ученый
Кашьяп Х., Ахмед Х.А., Хок Н., Рой С. и Бхаттачарья Д.К. 2016 Аналитика больших данных в биоинформатике: архитектуры, методы, инструменты и проблемы. Netw. Модель. Анальный. Здоровье Информ. Биоинформ. 5 28
Netw. Модель. Анальный. Здоровье Информ. Биоинформ. 5 28
Артикул Google ученый
Kaufman L, Rousseeuw PJ 2009 Поиск групп в данных: введение в кластерный анализ, том 344 (John Wiley & Sons, New York)
Google ученый
Kikugawa S, Nishikata K, Murakami K, Sato Y, Suzuki M, Altaf-Ul-Amin M, Kanaya S и Imanishi T 2012 PCDq: база данных белковых комплексов человека с индексом качества, который суммирует различные уровни доказательств белковых комплексов предсказано на основе интегративного набора данных H-приглашающих белок-белковых взаимодействий. BMC Syst. Биол. 6 1
Артикул Google ученый
King AD, Pržulj N and Jurisica I 2004 Прогнозирование белковых комплексов с помощью кластеризации на основе затрат. Биоинформатика 20 3013–3020
CAS Статья PubMed Google ученый
Le DH 2015 Новый метод определения белковых комплексов, связанных с заболеванием, на основе функционального сходства белковых комплексов. Алгоритмы Мол. Биол. 10 1
CAS Статья Google ученый
Leung HC, Xiang Q, Yiu SM and Chin FY 2009 Прогнозирование белковых комплексов на основе данных PPI: подход к ядру. J. Comput. Биол. 16 133–144
CAS Статья PubMed Google ученый
Li M, Chen Je, Wang Jx, Hu B и Chen G 2008a Модификация алгоритма DPClus для идентификации белковых комплексов на основе новых топологических структур. BMC Bioinform. 9 1
Артикул Google ученый
Ли М. , Ван Дж. И Чен Дж. 2008b Быстрый алгоритм агломерации для добычи функциональных модулей в сетях взаимодействия белков; in BioMedical Engineering and Informatics, 2008, BMEI 2008, International Conference on, IEEE, vol 1 , pp 3–7
, Ван Дж. И Чен Дж. 2008b Быстрый алгоритм агломерации для добычи функциональных модулей в сетях взаимодействия белков; in BioMedical Engineering and Informatics, 2008, BMEI 2008, International Conference on, IEEE, vol 1 , pp 3–7
Li XL, Foo CS и Ng SK 2007 Обнаружение белковых комплексов в плотных надежных окрестностях сетей взаимодействия белков in Comput Syst Bioinformatics Conf (Citeseer) vol 6, pp 157–168
Maere S, Heymans K и Kuiper M 2005 BinGO: плагин cytoscape для оценки чрезмерной представленности категорий генной онтологии в биологических сетях. Биоинформатика 21 3448–3449
CAS Статья PubMed Google ученый
Маулик М., Тинакаран Дж. И Кар С. 2013 Изменения в экспрессии генов у трансгенных мышей с мутантным белком-предшественником амилоида, у которых отсутствует белок с1 типа Ниманна-Пика. PloS one 8 e54, 605
Google ученый
Mayo Clinic 2016 Гены Альцгеймера: вы в группе риска? http: // www.mayoclinicorg / болезни-состояния / болезнь-альцгеймера / indepth / alzheimers-genes / art-20046552
Mazandu GK и Mulder NJ 2013 DaGO-fun: инструмент для функционального анализа на основе генной онтологии с использованием мер информационного содержания терминов. BMC Bioinform. 14 284
Google ученый
Moschopoulos CN, Pavlopoulos GA, Schneider R, Likothanassis SD and Kossida S 2009 Giba: инструмент кластеризации для обнаружения белковых комплексов. BMC Bioinform. 10 S11
Артикул Google ученый
Muller S, Filippakopoulos P и Knapp S 2011 Бромодомены в качестве терапевтических мишеней. Expert Rev. Mol. Med. 13 e29
Expert Rev. Mol. Med. 13 e29
Артикул PubMed PubMed Central Google ученый
Национальный институт старения, 2016 г. Исследовательские центры болезни Альцгеймера.https: //www.nianihgov/alzheimers/alzheimers-disease-research-centers
Непуш Т., Ю. Х. и Пакканаро А. 2012 Обнаружение перекрывающихся белковых комплексов в сетях взаимодействия белок-белок. Nat. Методы 9 471–472
CAS Статья PubMed PubMed Central Google ученый
Пескита С., Фариа Д., Фалькао А.О., лорд П. и Коуто FM 2009 Семантическое сходство в биомедицинских онтологиях. PLoS Comput. Биол. 5 e1000,443
Артикул Google ученый
Поббати А.В., Чан С.В., Ли И., Сонг Х. и Хонг В. 2012. Структурное и функциональное сходство между комплексами vgll1-tead и yap-tead. Структура 20 1135–1140
CAS Статья PubMed Google ученый
Пови С., Ловеринг Р., Бруфорд Э., Райт М., Лаш М. и Уэйн Х. 2001 Комитет по номенклатуре генов HUGO (HGNC). Hum. Genet. 109 678–680
CAS Статья PubMed Google ученый
Прасад Т.К., Гоэль Р., Кандасами К., Киртикумар С., Кумар С., Мативанан С., Теликичерла Д., Раджу Р., Шафрин Б., Венугопал А., и др. Обновление базы данных справочных данных о человеческих белках, 2009 г., 2009 г. Nucleic Acids Res. 37 D767 – D772
CAS Статья Google ученый
Рао В. С., Шринивас К., Кумар Г.С. и Суджин Г. 2013 Сеть взаимодействия белков для болезни Альцгеймера с использованием вычислительного подхода. Биоинформация 9 968
С., Шринивас К., Кумар Г.С. и Суджин Г. 2013 Сеть взаимодействия белков для болезни Альцгеймера с использованием вычислительного подхода. Биоинформация 9 968
Артикул PubMed Central Google ученый
Rappaport N, Nativ N, Stelzer G, Twik M, Guan-Golan Y, Stein T.I, Bahir I, Belinky F, Morrey CP, Safran M, et al. 2013 Malacards: интегрированный сборник болезней и их аннотации. База данных: bat018
Ребхан М., Чалифа-Каспи В., Прилуски Дж. И Ланцет Д. 1997 Генные карты: объединение информации о генах, белках и заболеваниях. Trends Genet. 13 163
CAS Статья PubMed Google ученый
Ruan J и ZhangW2008 Определение сетевых сообществ с высоким разрешением. Phys. Ред. E 77 016,104
Артикул Google ученый
Salwinski L, Miller CS, Smith AJ, Pettit FK, Bowie JU и Eisenberg D 2004 База данных взаимодействующих белков: обновление 2004 года. Nucleic Acids Res. 32 D449 – D451
CAS Статья PubMed PubMed Central Google ученый
Шарма П., Ахмед Х.А., Рой С. и Бхаттачарья Д.К. 2015 Неконтролируемые методы поиска белковых комплексов из сетей PPI. Netw. Модель. Анальный. Здоровье Информ. Биоинформ. 4 1–15
Артикул Google ученый
Srihari S, Ning K и Leong HW 2010 MCL-CAw: усовершенствование MCL для обнаружения дрожжевых комплексов из взвешенных сетей PPI путем включения структуры прикрепления ядра. BMC Bioinform. 11 1
Артикул Google ученый
Шиманский Д. Б. 2005 Разрыв волнового комплекса: острие трихом арабидопсиса. Curr. Opin. Plant Biol. 8 103–112
Б. 2005 Разрыв волнового комплекса: острие трихом арабидопсиса. Curr. Opin. Plant Biol. 8 103–112
CAS Статья Google ученый
Ван Донген С.М. 2001 Кластеризация графов с помощью потокового моделирования Университетская диссертация Утрехтский университет
Вануну О., Маггер О., Руппин Э., Шломи Т. и Шаран Р. 2010 Связывание генов и белковых комплексов с заболеванием через сетевое распространение. PLoS Comput. Биол. 6 e1000,641
Артикул Google ученый
Ван Х., Какарадов Б., Коллинз С. Р., Каротки Л., Фидлер Д., Шалес М., Шокат К. М., Вальтер Т. К., Кроган Н. Дж. И Коллер Д. 2009 Комплексная реконструкция интерактома saccharomyces cerevisiae. Мол. Клетка. Proteom. 8 1361–1381
CAS Статья Google ученый
Ван Дж.З., Ду Зи, Паяттакул Р., Филип С.И. и Чен С.Ф. 2007 Новый метод измерения семантического сходства терминов GO. Биоинформатика 23 1274–1281
CAS Статья PubMed Google ученый
Винкель Б.С. 2004 Метаболический канал в растениях. Анну Рев Завод Биол 55 85–107
CAS Статья PubMed Google ученый
Wu M, Li X, Kwoh CK и Ng SK 2009 Метод, основанный на прикреплении ядра, для обнаружения белковых комплексов в сетях PPI. BMC Bioinform. 10 1
Google ученый
Wu M, Yu Q, Li X, Zheng J, Huang JF и Kwoh CK 2013 Сравнительный анализ белковых комплексов человека для исследования систем, связанных с лекарствами, и оценки предсказанных белковых комплексов. PloS ONE 8 e53,197
PloS ONE 8 e53,197
CAS Статья Google ученый
Yi C и Deng XW 2005 Cop1 от фотоморфогенеза растений до туморогенеза млекопитающих. Trends Cell Biol. 15 618–625
CAS Статья PubMed Google ученый
Zhang XF, Dai DQ, Ou-Yang L и Yan H 2014 Обнаружение перекрывающихся белковых комплексов на основе генеративной модели с функциональными и топологическими свойствами. BMC Bioinform. 15 186
Артикул Google ученый
Обнаружение белковых комплексов на основе частично разделяемой многовидовой кластеризации | BMC Bioinformatics
В этом разделе мы сначала представляем источники данных, используемые в этом исследовании.Затем мы формулируем нашу проблему и описываем детали предлагаемой модели частично разделяемой многовидовой кластеризации (PSMVC).
Источники данных
В этом исследовании в эксперименте используются два источника данных о дрожжах, а именно данные PI и данные TAP. Данные PI собраны из базы данных BioGRID (версия 3.4.125) со всеми физическими взаимодействиями, определенными дрожжевыми двухгибридными анализами (Y2H) и анализом комплементации белков-фрагментов (PCA), а также всеми высококачественными бинарными взаимодействиями в базе данных HINT. (версия 21.08.2015).Данные PI содержат 19331 взаимодействие среди 5082 белков. Мы используем комбинированный набор очисток из двух независимых крупномасштабных скринингов в Saccharomyces cerevisiae [11, 38] в качестве наших данных TAP, которые состоят из 6 498 очисток с участием 2 996 белков приманки и 5 405 белков жертвы. В целом, данные PI и данные TAP охватывают 5 944 белка.
Два метода оценки, а именно FSWeight [25] и оценка PE [38], используются для оценки вероятности физических или сопряженных взаимодействий между белками. {(1)} \) описывает вероятность физического взаимодействия между белком i и белком j .
{(1)} \) описывает вероятность физического взаимодействия между белком i и белком j .
Схема оценки очищающего обогащения (PE), предложенная Collins et al. [7] использует логарифмические отношения фактических совпадений по отношению к ожидаемым на основе частот очистки белка. Они также использовали регрессию LOESS [39] и алгоритм смежных нарушителей пула [40], чтобы нормализовать оценки PE на интервал [0, 1]. Здесь мы используем нормализованные оценки, чтобы представить надежность сопряженных взаимодействий.{(m)} \) представляет собой наблюдаемую оценку сродства, согласно которой белок i и белок j могут принадлежать одним и тем же комплексам, мы могли бы вывести базовый образец A ( м ) по наблюдаемым данным W ( м ) за счет минимизации их разницы. Поскольку данные, полученные с помощью разных методов, могут охватывать разное количество белков, для каждого типа данных мы используем только информацию о покрытых белках.{(m)} \ right]. \ end {align} $$
(2)
Следовательно, мы можем вывести H ( м ) от Вт ( м ) путем минимизации уравнения. (2). В отличие от существующих алгоритмов обучения с несколькими представлениями, которые фокусируются на основных общих паттернах различных представлений (например, принуждение H (1) = H (2) ), наш алгоритм совместно использует свойства согласованности и дополнительности.{N \ times K} \) где К = К c + 2 × К с . Коэффициент общих множителей η = K c / K , диапазон значений от 0 до 1, измеряет, сколько согласованной информации встроено в несколько представлений. {(2)} \), мы принимаем альтернативную схему оптимизации.{(m)}}, \, \, m = 1,2 $$
{(2)} \), мы принимаем альтернативную схему оптимизации.{(m)}}, \, \, m = 1,2 $$
(5)
Здесь Θ ( м ) = θ ( м ) θ ( м ) T ∈ {0,1} N × N . Обратите внимание, что ⊙ и \ (\ frac {(\ cdot)} {(\ cdot)} \) представляют собой поэлементное умножение и деление. Из-за нехватки места подробности формулы обновления описаны в Дополнительном файле 1.{(m)} \) один раз равен O ( N 2 К c ) и O ( N 2 К с ). Если количество итераций составляет Iter , общие временные затраты PSMVC составляют O ( I т и r ( N 2 К c +2 N 2 К с )).
Оценочные данные и показатели
Белковые комплексы золотого стандарта
Чтобы измерить, соответствуют ли предсказанные комплексы известным экспериментально определенным белковым комплексам, мы используем три набора эталонных комплексов в качестве наших золотых стандартов. Они получены из CYC2008 [43], MIPS [44] и SGD [45] соответственно. В частности, CYC2008 состоит из 408 комплексов, MIPS состоит из 203 комплексов, а SGD состоит из 323 комплексов. Для всех эталонных наборов, чтобы избежать смещения выбора, мы отфильтровываем белки, которые не участвуют во входных данных PI и TAP. Более того, как предполагают Непуш и др. [27], мы рассматриваем только комплексы минимум с 3 белками. Наконец, CYC2008 содержит 235 комплексов, охватывающих 1329 белков, MIPS содержит 203 комплекса, охватывающих 1178 белков, а SGD содержит 235 комплексов, охватывающих 1153 белка. Поскольку большинство алгоритмов обнаружения сложных белков содержат некоторые параметры, которые необходимо настроить, мы будем использовать MIPS для проверки влияния параметров для каждого алгоритма. Для честного сравнения мы исключаем комплексы, присутствующие в MIPS из CYC2008 и SGD, и оцениваем производительность различных алгоритмов по отношению к этим двум отфильтрованным эталонным наборам.После этого процесса эталонный набор CYC2008 содержит 163 комплекса, охватывающий 767 белков, а эталонный набор SGD содержит 183 комплекса, охватывающий 961 белок. В дальнейшем, если не указано иное, CYC2008 и SGD относятся к отфильтрованным эталонным наборам.
Более того, как предполагают Непуш и др. [27], мы рассматриваем только комплексы минимум с 3 белками. Наконец, CYC2008 содержит 235 комплексов, охватывающих 1329 белков, MIPS содержит 203 комплекса, охватывающих 1178 белков, а SGD содержит 235 комплексов, охватывающих 1153 белка. Поскольку большинство алгоритмов обнаружения сложных белков содержат некоторые параметры, которые необходимо настроить, мы будем использовать MIPS для проверки влияния параметров для каждого алгоритма. Для честного сравнения мы исключаем комплексы, присутствующие в MIPS из CYC2008 и SGD, и оцениваем производительность различных алгоритмов по отношению к этим двум отфильтрованным эталонным наборам.После этого процесса эталонный набор CYC2008 содержит 163 комплекса, охватывающий 767 белков, а эталонный набор SGD содержит 183 комплекса, охватывающий 961 белок. В дальнейшем, если не указано иное, CYC2008 и SGD относятся к отфильтрованным эталонным наборам.
Оценочные метрики
В этой статье мы используем три независимых показателя качества для оценки сходства между набором прогнозируемых комплексов и набором эталонных комплексов. Первая метрика, которую мы используем, — это геометрическая точность (Acc), введенная Xie et al.[31], который представляет собой среднее геометрическое двух других показателей, а именно чувствительности (Sn) и положительной прогностической ценности (PPV). Дан эталонный комплекс б и и прогнозируемый комплекс q j , пусть н и обозначают количество белков в b и и T i , j обозначает количество белков, общих для b и и q j . \ ({Sn} _ {i} = \ frac {\ max _ {j} T_ {i, j}} {n_ {i}} \) отражает покрытие комплекса b и по его наиболее подходящему прогнозируемому комплексу и \ (Sn = \ frac {\ sum _ {i} n_ {i} {Sn} _ {i}} {\ sum _ {i} n_ {i}} = \ frac {\ sum _ {i} \ max _ {j} T_ {i, j}} {\ sum _ {i} n_ {i}} \) — средневзвешенное значение S n и по всем комплексам.\ ({PPV} _ {j} = \ frac {\ max _ {i} T_ {i, j}} {\ sum _ {i} T_ {i, j}} \) отражает надежность, с которой предсказанный комплекс q j предсказывает, что белок принадлежит к его наиболее подходящему комплексу, и \ (PPV = \ frac {\ sum _ {j} {PPV} _ {j} \ sum _ {i} T_ {i, j}} {\ sum _ {j} | \ cup _ {i} (b_ {i} \ cap q_ {j}) |} = \ frac {\ sum _ {j} \ max _ {i} T_ {i, j}} {\ sum _ {j} | \ cup _ {i} (b_ {i} \ cap q_ {j}) |} \) — это средневзвешенное значение P -П В j по всем кластерам (здесь | · | подсчитывает элементы в данном наборе, ∪ i ( b ) и ∩ q j ) обозначает соединение b и ∩ q j более и ).Acc определяется следующим образом:
\ ({Sn} _ {i} = \ frac {\ max _ {j} T_ {i, j}} {n_ {i}} \) отражает покрытие комплекса b и по его наиболее подходящему прогнозируемому комплексу и \ (Sn = \ frac {\ sum _ {i} n_ {i} {Sn} _ {i}} {\ sum _ {i} n_ {i}} = \ frac {\ sum _ {i} \ max _ {j} T_ {i, j}} {\ sum _ {i} n_ {i}} \) — средневзвешенное значение S n и по всем комплексам.\ ({PPV} _ {j} = \ frac {\ max _ {i} T_ {i, j}} {\ sum _ {i} T_ {i, j}} \) отражает надежность, с которой предсказанный комплекс q j предсказывает, что белок принадлежит к его наиболее подходящему комплексу, и \ (PPV = \ frac {\ sum _ {j} {PPV} _ {j} \ sum _ {i} T_ {i, j}} {\ sum _ {j} | \ cup _ {i} (b_ {i} \ cap q_ {j}) |} = \ frac {\ sum _ {j} \ max _ {i} T_ {i, j}} {\ sum _ {j} | \ cup _ {i} (b_ {i} \ cap q_ {j}) |} \) — это средневзвешенное значение P -П В j по всем кластерам (здесь | · | подсчитывает элементы в данном наборе, ∪ i ( b ) и ∩ q j ) обозначает соединение b и ∩ q j более и ).Acc определяется следующим образом:
$$ Acc = \ sqrt {Sn \ times PPV} $$
(6)
Использование Acc лучше, чем Sn и PPV по отдельности, поскольку оно может обеспечить сбалансированное представление о характеристиках прогнозирования. {2}} {| b_ {i} || q_ {j} |} \ geq \ omega \ ) (аналогично большинству методов обнаружения, мы устанавливаем ω равным 0.25 в наших экспериментах). Пусть TP (истинно положительный) будет количеством предсказанных комплексов, которые совпадают с известными комплексами, и FN, (ложноотрицательный) будет количеством известных комплексов, которые не совпадают с предсказанными комплексами, и FP ( ложноположительный) будет количество предсказанных комплексов минус TP . Тогда точность, отзыв и F-мера определяются следующим образом:
{2}} {| b_ {i} || q_ {j} |} \ geq \ omega \ ) (аналогично большинству методов обнаружения, мы устанавливаем ω равным 0.25 в наших экспериментах). Пусть TP (истинно положительный) будет количеством предсказанных комплексов, которые совпадают с известными комплексами, и FN, (ложноотрицательный) будет количеством известных комплексов, которые не совпадают с предсказанными комплексами, и FP ( ложноположительный) будет количество предсказанных комплексов минус TP . Тогда точность, отзыв и F-мера определяются следующим образом:
$$ \ begin {array} {@ {} rcl @ {}} && Recall = \ frac {TP} {TP + FN}, Precision = \ frac {TP} {TP + FP}, \\ && F- measure = \ frac {2 \ times Precision \ times Recall} {Precision + Recall}.\ end {array} $$
(7)
Отметим, что набор данных, использованный в нашем исследовании, содержит 5944 белка, в то время как три набора золотых стандартов (т.е. CYC2008, MIPS и SGD) охватывают 1329, 1178 и 1153 белка. То есть комплекты эталонных комплексов далеки от полноты. Следовательно, предсказанные белковые комплексы, которые не соответствуют эталонным комплексам, не обязательно являются нежелательными результатами, и они, вероятно, будут новыми белковыми комплексами [27, 31].Поскольку оптимизация точности и F-меры каким-то образом помешает нам обнаруживать новые комплексы, мы используем Recall в качестве второй метрики для оценки производительности различных методов (мы также перечисляем результаты оценки в отношении точности и F-меры в дополнительном файле 1) .
Третий показатель, который мы используем, — это доля согласованных комплексов (FRAC) [27], которая является индикатором для прогнозируемого охвата и измеряет процент эталонных комплексов, которые совпадают с прогнозируемыми комплексами.FRAC определяется следующим образом:
$$ FRAC = \ frac {| \ {b_ {i} | b_ {i} \ in B \ wedge \ exists q_ {j} \ in Q, q_ {j} \, \, соответствует \, \, b_ {i} \} |} {| B |}. $
$
(8)
, где B — это набор эталонных комплексов, а Q — набор прогнозируемых комплексов.
Три вышеуказанных показателя не зависят друг от друга и могут работать вместе для оценки эффективности подхода комплексного обнаружения. В связи с тем, что белковые комплексы золотого стандарта являются неполными, мы также проверяем функциональную однородность предсказанных комплексов, следуя методу Nepusz et al.[27]. Гипергеометрическое распределение используется для расчета P-значения биологической значимости для прогнозируемого комплекса и данного функционального члена. Предположим, что весь организм содержит | V | белки. Для заданного прогнозируемого комплекса q j и функциональная группа F , пусть | q j | и | F | обозначают количество белков в прогнозируемом комплексе и в категории соответственно.{x-1} \ frac {\ left (\ begin {array} {ll} | F | & \\ y & \ end {array} \ right) \ left (\ begin {array} {ll} | V | — | F | \\ | q_ {j} | — y \ end {array} \ right)} {\ left (\ begin {array} {ll} | V | \\ | q_ {j} | \ end {array} \ right)} $$
(9)
Меньшее значение P указывает на то, что предсказанный комплекс не накапливается случайным образом и является более значимым с биологической точки зрения, чем комплекс с большим значением P. Функциональная аннотация получается из Gene Ontology, которая предоставляет три типа аннотаций: молекулярная функция, биологический процесс и клеточный компонент [46].
Настройки параметров
В нашей модели есть три параметра: η , K и λ , где K — общее количество скрытых факторов, η — отношение общих факторов, а λ — элементы управления. эффекты ограничения низкого ранга. В этом исследовании значение η установлено равным 0,5, и мы не настраиваем значение η для конкретного источника данных (мы обсудим влияние η в разделе «Результаты и обсуждение»).Таким образом, ключевыми параметрами нашей модели являются K и λ . Как правило, количество комплексов может увеличиваться с увеличением размера входных данных. Поскольку обычно у нас нет никаких предварительных сведений о количестве комплексов в реальных ситуациях, трудно определить значение K . К счастью, мы ввели ограничение низкого ранга для автоматического выбора подходящего количества комплексов. Контролируя эффект этого члена регуляризации (т. Е., настроив значение λ ), мы можем отфильтровать несущественные размеры H . Если это так, мы можем подогнать нашу модель к большому значению K , поскольку наша модель способна определять количество комплексов адаптивно. Кроме того, для разных видов биологи уже собрали несколько белковых комплексов. Хотя количество известных белковых комплексов еще далеко не полное, мы можем использовать некоторые из известных комплексов для проверки влияния параметров. Поэтому в этом исследовании мы используем эталонный набор MIPS, чтобы проверить, как эти параметры влияют на производительность нашей модели.Обратите внимание, что большинство предыдущих алгоритмов детектирования белковых комплексов имеют несколько параметров, которые необходимо настроить. Мы также используем эталонный набор MIPS для выбора оптимальных параметров для этих алгоритмов.
эффекты ограничения низкого ранга. В этом исследовании значение η установлено равным 0,5, и мы не настраиваем значение η для конкретного источника данных (мы обсудим влияние η в разделе «Результаты и обсуждение»).Таким образом, ключевыми параметрами нашей модели являются K и λ . Как правило, количество комплексов может увеличиваться с увеличением размера входных данных. Поскольку обычно у нас нет никаких предварительных сведений о количестве комплексов в реальных ситуациях, трудно определить значение K . К счастью, мы ввели ограничение низкого ранга для автоматического выбора подходящего количества комплексов. Контролируя эффект этого члена регуляризации (т. Е., настроив значение λ ), мы можем отфильтровать несущественные размеры H . Если это так, мы можем подогнать нашу модель к большому значению K , поскольку наша модель способна определять количество комплексов адаптивно. Кроме того, для разных видов биологи уже собрали несколько белковых комплексов. Хотя количество известных белковых комплексов еще далеко не полное, мы можем использовать некоторые из известных комплексов для проверки влияния параметров. Поэтому в этом исследовании мы используем эталонный набор MIPS, чтобы проверить, как эти параметры влияют на производительность нашей модели.Обратите внимание, что большинство предыдущих алгоритмов детектирования белковых комплексов имеют несколько параметров, которые необходимо настроить. Мы также используем эталонный набор MIPS для выбора оптимальных параметров для этих алгоритмов.
Сложность белков | Proteintech Group
Как белки имеют такое функциональное разнообразие, основанное всего на 20 строительных блоках?
В организме более 20 000 различных белков (1). Откуда у белков такое большое функциональное разнообразие, основанное всего на 20 строительных блоках? Ответ кроется в сложности первичной, вторичной, третичной и четвертичной структуры (рис. 1).
1).
Рис. 1. Четыре уровня структуры белка.
Первичная структура
Первичная структура состоит из аминокислотной последовательности белка. Даже на этом уровне существует значительная биохимическая сложность, включая кислотность, размер, гидрофобность и заряд, придаваемые различными аминокислотами. Что касается кислотности, то есть три типа аминокислот; нейтральный (например, аланин), кислый (например, аспарагиновая кислота) и основной (например, аргинин).
Вторичная структура
Вторичная структура состоит из мелкомасштабных трехмерных структур, образованных взаимодействиями между амидными группами.Основные классы — это альфа-спирали и бета-листы. Альфа-спирали представляют собой спиральные структуры с правой стороны. Вариабельные группы обращены наружу, и структура удерживается вместе водородными связями между группой N-H одной аминокислоты и группой C = O 4-й аминокислоты. Например, миоглобин — это белок с множеством альфа-спиралей. Бета-листы представляют собой гофрированную структуру, образованную взаимодействием групп N-H и C = O соседних цепочек аминокислот. Фиброин, основной компонент шелка, почти полностью состоит из бета-листов (2).
Третичная структура
Третичная структура — это крупномасштабная трехмерная конформация белка, вызванная многочисленными взаимодействиями между боковыми цепями, альфа-спиралями и бета-слоями. Хотя вычислительные методы постоянно совершенствуются (3), рентгеновская кристаллография по-прежнему остается самым надежным методом определения формы белка (4).
Четвертичная структура
Наконец, четвертичная структура — это расположение нескольких белковых субъединиц в комплексе.Примеры комплексов с четвертичными структурами включают антитела и гемоглобин. Помимо этих четырех уровней структуры, функции белков могут быть изменены с помощью посттрансляционных модификаций. Узнайте больше в нашей статье в блоге.
Ссылки:
- Размер протеома человека: ширина и глубина
- Virtual Chembook Elmhurst University — вторичная структура
- Глобальный анализ сворачивания белков с использованием массового параллельного проектирования, синтеза и тестирования
- Достижения в дизайне белковых складок и сборок
Проверка и оценка качества макромолекулярных структур с использованием комплексного сетевого анализа

Клейвегт, Г. Дж. Проверка кристаллических структур белков. Acta Crystallogr. Разд. D Biol. Кристаллогр. 56 , 249–265 (2000).
CAS Статья Google ученый
Влодавер А., Минор В., Даутер З. и Яскольски М. Кристаллография белков для некристаллографов, или как получить максимум (но не больше) от опубликованных макромолекулярных структур. FEBS J. 275 , 1-21 (2008).
CAS Статья Google ученый
Рид, Р. Дж. и др. . Новое поколение инструментов кристаллографической проверки для банка данных белков. Структура 19 , 1395–1412 (2011).
CAS Статья Google ученый
Влодавер А. Стереохимия и проверка макромолекулярных структур. в Белковая кристаллография: методы и протоколы (ред. Влодавер, А., Даутер, З. и Яскольски, М.) 595–610, https://doi.org/10.1007/978-1-4939-7000-1_24 (Springer New York, 2017).
Терк Д. Коробки построения моделей и визуализации. в Белковая кристаллография: методы и протоколы (ред. Влодавер, А., Даутер, З. и Яскольски, М.) 491–548, https://doi.org/10.1007/978-1-4939-7000-1_21 ( Springer New York, 2017).
Строгац, С. Х. Исследование сложных сетей. Nature 410 , 268–276 (2001).
ADS CAS Статья Google ученый
Вишвешвара С., Бринда К. В. и Каннан Н. Структура белка: выводы из теории графов. J. Theor. Comput. Chem. 01 , 187–211 (2002).
CAS Статья Google ученый
Эстрада, Э. Универсальность в сетях белковых остатков. Biophys. J. 98 , 890–900 (2010).
ADS CAS Статья Google ученый

Грин, Л. Х. Структурные сети белков. Краткое. Функц. Геномика 11 , 469–478 (2012).
Артикул Google ученый
Баглер Г. и Синха С. Сетевые свойства белковых структур. Phys. Стат. Мех. его заявл. 346 , 27–33 (2005).
ADS CAS Статья Google ученый
Broder, A. et al. . Структура графа в сети. Comput. Сети 33 , 309–320 (2000).
ADS Статья Google ученый
Бхалла, США, и Айенгар, Р. Эмерджентные свойства сетей биологических сигнальных путей. Наука (80-.). 283 , 381 LP – 387 (1999).
ADS Статья Google ученый
Jeong, H., Tombor, B., Albert, R., Oltvai, Z. N. & Barabasi, A.-L. Масштабная организация метаболических сетей. Nature 407 , 651–654 (2000).
ADS CAS Статья Google ученый
Ньюман М. Э. Структура сетей научного сотрудничества. Proc. Natl. Акад. Sci. США 98 , 404–9 (2001).
ADS MathSciNet CAS Статья Google ученый
Вангикар, П. П., Тендулкар, А. В., Рамия, С., Мали, Д. Н. и Сараваги, С. Функциональные сайты в белковых семьях, обнаруженные с помощью объективного и автоматизированного теоретико-графического подхода. J. Mol. Биол. 326 , 955–978 (2003).
CAS Статья Google ученый
Тиберт, Б., Бредесен, Д. Э. и дель Рио, Г. Улучшенное предсказание критических остатков для функции белка на основе сетевого и филогенетического анализов. BMC Bioinformatics 6 , 213 (2005).
Артикул Google ученый

дель Соль, А., Фуджихаши, Х., Аморос, Д. и Нусинов, Р. Центральность остатков, функционально важные остатки и форма активного центра: анализ ферментных и неферментных семейств. Protein Sci. 15 , 2120–2128 (2006).
Артикул Google ученый
Гош, С., Гадиярам, В. и Вишвешвара, С. Проверка моделей структуры белка с использованием показателя сетевого сходства. Proteins Struct. Функц. Биоинформа. 85 , 1759–1776 (2017).
CAS Статья Google ученый
Атилган, А. Р., Акан, П. и Байсал, К. Связь остатков в малых масштабах и их значение для динамики белков. Biophys. J. 86 , 85–91 (2004).
CAS Статья Google ученый
Малод-Догнин, Н., Бан, К. и Пржуль, Н. Единое выравнивание сетей белок-белкового взаимодействия. Sci. Отчет 7 , 1–11 (2017).
CAS Статья Google ученый
Маулик У., Басу С. и Рэй С. Идентификация белковых комплексов в сети PPI с использованием некооперативной последовательной игры. Sci. Отчет 7 , 8410 (2017).
ADS Статья Google ученый
Гош, С., Кумар, Г. В., Басу, А. и Банерджи, А. Сетевой анализ с помощью теории графов показывает белковые пути, лежащие в основе гибели клеток после нейротропной вирусной инфекции. Sci. Отчет 5 , 1–12 (2015).
Google ученый
Вендрусколо, М., Дохолян, Н. В., Пачи, Э. и Карплюс, М. Взгляд на аминокислоты, играющие ключевую роль в сворачивании белков, с ограниченным миром. Phys. Преподобный Е. Стат. Нелин. Soft Matter Phys. 65 , 4 (2002).
Артикул Google ученый

Vendruscolo, M., Paci, E., Dobson, C. M. и Karplus, M. Три ключевых остатка образуют критическую контактную сеть в переходном состоянии сворачивания белка. Nature 409 , 641–645 (2001).
ADS CAS Статья Google ученый
Меничетти, Г., Фаризелли, П. и Ремондини, Д. Сетевые меры для распознавания состояния сворачивания белков. Sci. Отчет 6 , 1–8 (2016).
Артикул Google ученый
Guncar, G. et al. . Кристаллическая структура катепсина H свиньи, определенная с разрешением 2,1 A: расположение С-концевой карбоксильной группы мини-цепи определяет функцию аминопептидазы катепсина H. Структура 6 , 51–61 (1998).
CAS Статья Google ученый
Iwata, S., Kamata, K., Yoshida, S., Minowa, T. & Ohta, T. Состояние T. и R в кристаллах бактериальной L-лактатдегидрогеназы раскрывает механизм аллостерического контроля. Nat. Struct. Биол. 1 , 176–185 (1994).
CAS Статья Google ученый
Крыштафович, А. и др. . Методы оценки точности модели могут помочь выбрать лучшие модели из наборов ложных целей: Оценка оценок точности модели в CASP11. Белки 84 (Приложение 1), 349–369 (2016).
Артикул Google ученый
Джон Б. и Сали А. Сравнительное моделирование структуры белка путем итеративного выравнивания, построения модели и оценки модели. Nucleic Acids Res. 31 , 3982–3992 (2003).
CAS Статья Google ученый
Бенкерт П., Биазини М. и Шведе Т. К оценке абсолютного качества моделей структуры отдельных белков. Биоинформатика 27 , 343–350 (2011).
CAS Статья Google ученый
Zhou, H. & Zhou, Y. Измеренное по расстоянию конечное эталонное состояние идеального газа улучшает полученные от конструкции потенциалы средней силы для выбора конструкции и прогнозирования устойчивости. Protein Sci. 11 , 2714–2726 (2009).
Артикул Google ученый
Mishra, A., Iqbal, S. & Hoque, M. T. Отличите белковые ловушки от нативных, используя функцию оценки, основанную на повсеместных углах Phi и Psi, вычисленных для всех атомов. J. Theor. Биол. 398 , 112–121 (2016).
CAS Статья Google ученый
Hoque, M. T., Yang, Y., Mishra, A. & Zhou, Y. SDFIRE: Специфическая для последовательности статистическая функция энергии для предсказания структуры белка с помощью выбора приманки. J. Comput. Chem. 37 , 1119–1124 (2016).
CAS Статья Google ученый
Чжоу, Х. и Сколник, Дж. GOAP: обобщенный ориентированный, полностью атомный статистический потенциал для предсказания структуры белка. Biophys.J. 101 , 2043–2052 (2011).
ADS CAS Статья Google ученый
Cao, R. et al. . QAcon: оценка качества единой модели с использованием структурной и контактной информации белков с помощью методов машинного обучения. Биоинформатика 33 , 586–588 (2017).
CAS PubMed Google ученый
Узиела, К., Менендес Уртадо, Д., Шу, Н., Валлнер, Б. и Элофссон, А. ProQ3D: улучшенная оценка качества модели с использованием глубокого обучения. Биоинформатика 33 , 1578–1580 (2017).
CAS PubMed Google ученый

Jing, X., Wang, K., Lu, R. & Dong, Q. Сортировка белков-приманок с помощью машинного обучения по ранжированию. Sci. Отчет 6 , 1–11 (2016).
Артикул Google ученый
Цао, Р., Бхаттачарья, Д., Хоу, Дж. И Ченг, Дж. DeepQA: Улучшение оценки качества модели одного белка с помощью сетей глубоких убеждений. BMC Bioinformatics 17 , 1–9 (2016).
Артикул Google ученый
Чаттерджи, С., Гош, С. и Вишвешвара, С. Сетевые свойства ловушек и модели, предсказанные CASP: сравнение со структурами нативных белков. Мол. Биосист. 9 , 1774–1788 (2013).
CAS Статья Google ученый
Земла, А. LGA: Метод для поиска трехмерных сходств в структурах белков. Nucleic Acids Res. 31 , 3370–3374 (2003).
CAS Статья Google ученый
Sánchez, R. et al. . Моделирование структуры белков для структурной геномики. Nat. Struct. Биол. 7 , 986 (2000).
Артикул Google ученый
Abdoulaye, W. D. PGR: новый графовый репозиторий белковых 3D-структур. J. Data Mining Genomics Proteomics 06 , 3–6 (2015).
Артикул Google ученый
да Силвейра, К. Х. и др. . Сканирование с отсечкой белков: сравнительный анализ методов, зависимых от отсечки и без отсечки, для поиска контактов в белках. Proteins Struct. Функц. Биоинформа. 74 , 727–743 (2009).
Артикул Google ученый
Клейвегт, Г. Дж. Проверка моделей белков только на основе координат Calpha. J. Mol. Биол. 273 , 371–6 (1997).
CAS Статья Google ученый
Fox, N.K., Brenner, S.E. & Chandonia, J.-M. SCOPe: Структурная классификация белков — расширенная, интеграция данных SCOP и ASTRAL и классификация новых структур. Nucleic Acids Res. 42 , D304 – D309 (2014).
CAS Статья Google ученый
Чакрабарти, Б. и Парех, Н. NAPS: Сетевой анализ белковых структур. Nucleic Acids Res. 44 , W375 – W382 (2016).
CAS Статья Google ученый
Шумахер, М.А., Херлбурт, Б.К. и Бреннан, Р.G. Кристаллические структуры SarA, плейотропного регулятора генов вирулентности S. aureus. Nature 409 , 215–219 (2001).
ADS CAS Статья Google ученый
Liu, Y. et al. . Структурный и функциональный анализ глобального регуляторного белка SarA из Staphylococcus aureus. Proc. Natl. Акад. Sci. 103 , 2392–2397 (2006).
ADS CAS Статья Google ученый
Chen, Y.-J. и др. . Рентгеновская структура EmrE поддерживает модель двойной топологии. Proc. Natl. Акад. Sci. США 104 , 18999–9004 (2007).
ADS CAS Статья Google ученый
Пражникар, Дж., Афонин, П. В., Гунчар, Г., Адамс, П. Д. и Тюрк, Д. Усредненные карты ударов: меньше шума, больше сигнала и, вероятно, меньше смещения. Acta Crystallogr. Разд. D Biol. Кристаллогр. 65 , 921–931 (2009).
Артикул Google ученый
Terwilliger, T. C. et al. . Карты OMIT с итеративным построением: улучшение карты за счет итеративного построения и уточнения модели без смещения модели. Acta Crystallogr. Разд. D Biol. Кристаллогр. 64 , 515–524 (2008).
Acta Crystallogr. Разд. D Biol. Кристаллогр. 64 , 515–524 (2008).
CAS Статья Google ученый
Pražnikar, J. & Turk, D. Штрафной удар вместо перекрестной проверки при уточнении макромолекулярных кристаллических структур с максимальной вероятностью. Acta Crystallogr. Разд. D Biol. Кристаллогр. 70 , 3124–3134 (2014).
Артикул Google ученый
Дейкстра, Э. У. Заметка о двух проблемах, связанных с графами. Номер. Математика. 1 , 269–271 (1959).
MathSciNet Статья Google ученый
Границы | Последние тенденции в анализе белковых комплексов растений в контексте развития
Введение
Белки — основная рабочая сила биологических систем и задействованы во всех аспектах жизни.Они образуют молекулярные машины, отвечающие за основные клеточные функции, такие как транскрипция, трансляция, метаболизм и передача сигналов, а также за структурные особенности, такие как цитоскелет. Расширение этого базового репертуара белков позволяет выполнять более сложные функции, такие как обеспечение плана развития организма на протяжении всего его жизненного цикла или развертывание механизмов для восприятия стимулов окружающей среды и создания соответствующих ответов на эти стимулы. Эти клеточные реакции могут быть кратковременными и обратимыми, но они также могут включать в себя долгосрочные необратимые адаптации к плану развития организма для обеспечения его выживания.Чтобы иметь возможность выполнять все эти функции, белки не функционируют сами по себе, а скорее взаимодействуют друг с другом и организованы в сети белковых комплексов и сигнальных каскадов (Alberts, 1998). Изучение этих белок-белковых взаимодействий (PPI) и выявление их сложных сетей взаимодействия, таким образом, имеет фундаментальное значение для понимания не только основных клеточных процессов, но и сложных программ развития.
Элегантный пример того, как ИЦП играют фундаментальную роль в определении развития растений, — это определение состава органов цветка.Несмотря на огромное разнообразие форм, размеров и составов, почти все цветы построены с использованием только четырех специализированных типов листьев: чашелистиков, лепестков, тычинок и плодолистиков (Specht and Bartlett, 2009). Развитие этих различных типов органов определяется комбинаторной активностью цветочных MADS-box TF. Согласно модели ABC, TF типа A определяют идентичность чашелистика, A- и B-тип вместе определяют идентичность лепестка, B- и C-тип вместе определяют идентичность тычинок, а только C-тип определяет идентичность плодолистика (Coen and Meyerowitz, 1991). .Позднее эта модель была расширена до модели ABCDE, включая TF D-типа для спецификации яйцеклетки и TF E-типа для правильного развития всех четырех типов органов (Theißen et al., 2016; Thomson et al., 2017). Несколько линий доказательств показали, что эти разные типы TF собираются в тетрамерные белковые комплексы, так называемые цветочные квартеты (Bartlett, 2017). Хотя точные нисходящие транскрипционные сети цветочных квартетов до сих пор полностью не изучены (Thomson et al., 2017; Wils and Kaufmann, 2017), предполагается, что цветочные квартеты с различным составом регулируют альтернативные наборы целевых генов, что, в свою очередь, приводит к в спецификации определенного цветочного органа.
В настоящее время доступно несколько методов тестирования ИПП, таких как дрожжевой Y2H (Mravec et al., 2011), коиммунопреципитация с последующим вестерн-блоттингом (co-IP) (Albrecht et al., 2012) или анализы комплементации белковых фрагментов, такие как BiFC (Охад, Яловский, 2010). Четкой характеристикой этих методов является то, что они являются бинарными методами, позволяющими тестировать PPI только попарно. Это часто означает, что требуются некоторые предварительные знания, чтобы определить, какие комбинации тестировать. Хотя методы массового мультиплексирования Y2H, такие как CrY2H-seq (Trigg et al. , 2017), позволяют проводить скрининг ИПП на уровне протеома, эти методы не предоставляют информацию о членстве в совместных комплексах через непрямое взаимодействие. Дополнительным методом, который больше подходит для изучения членства в совместных комплексах, является AP / MS. AP / MS — это собирательное название для различных экспериментальных подходов, в которых конкретный белок, называемый приманкой, очищается из биологического образца в почти физиологических условиях, чтобы сохранить целостность ИПП. После очистки совместно очищенные белки идентифицируют масс-спектрометрией.Поскольку AP / MS не требует предварительного знания партнеров по взаимодействию, этот метод идеально подходит для получения нового понимания функции интересующего белка. Прекрасным примером этого является характеристика комплекса TPLATE у Arabidopsis (Gadeyne et al., 2014). Первоначально было обнаружено, что белок TPLATE участвует в закреплении клеточной пластинки во время позднего цитокинеза, но специфическое взаимодействие с клатрином предполагает более общую функцию клатрин-опосредованного эндоцитоза (Van Damme et al., 2006). Эксперименты AP / MS с использованием TPLATE в качестве белка-приманки выявили семь воспроизводимо взаимодействующих белков с ранее неизвестной функцией, которые вместе образуют стабильный мультибелковый комплекс, впоследствии названный комплексом TPLATE. Некоторые из этих взаимодействий были впоследствии подтверждены с использованием Y2H, BiFC и co-IP. Кроме того, реципрокные эксперименты AP / MS с использованием каждого из этих семи взаимодействующих белков в качестве белков-приманок расширили сеть вокруг TPLATE, выявив ассоциации с членами семейства динаминовых белков, субъединицами адапторного комплекса Arabidopsis AP2 и клатринового каркаса, что в конечном итоге привело к открытие специфической для растений адаптации к клатрин-опосредованному эндоцитозу.Более того, на интернализацию и локализацию транспортных белков ауксина и брассиностероидного рецептора BRI1, двух хорошо известных грузовых белков клатрин-опосредованного эндоцитоза, влияют дефекты в комплексе TPLATE, что указывает на важность TPLATE в развитии растений.
, 2017), позволяют проводить скрининг ИПП на уровне протеома, эти методы не предоставляют информацию о членстве в совместных комплексах через непрямое взаимодействие. Дополнительным методом, который больше подходит для изучения членства в совместных комплексах, является AP / MS. AP / MS — это собирательное название для различных экспериментальных подходов, в которых конкретный белок, называемый приманкой, очищается из биологического образца в почти физиологических условиях, чтобы сохранить целостность ИПП. После очистки совместно очищенные белки идентифицируют масс-спектрометрией.Поскольку AP / MS не требует предварительного знания партнеров по взаимодействию, этот метод идеально подходит для получения нового понимания функции интересующего белка. Прекрасным примером этого является характеристика комплекса TPLATE у Arabidopsis (Gadeyne et al., 2014). Первоначально было обнаружено, что белок TPLATE участвует в закреплении клеточной пластинки во время позднего цитокинеза, но специфическое взаимодействие с клатрином предполагает более общую функцию клатрин-опосредованного эндоцитоза (Van Damme et al., 2006). Эксперименты AP / MS с использованием TPLATE в качестве белка-приманки выявили семь воспроизводимо взаимодействующих белков с ранее неизвестной функцией, которые вместе образуют стабильный мультибелковый комплекс, впоследствии названный комплексом TPLATE. Некоторые из этих взаимодействий были впоследствии подтверждены с использованием Y2H, BiFC и co-IP. Кроме того, реципрокные эксперименты AP / MS с использованием каждого из этих семи взаимодействующих белков в качестве белков-приманок расширили сеть вокруг TPLATE, выявив ассоциации с членами семейства динаминовых белков, субъединицами адапторного комплекса Arabidopsis AP2 и клатринового каркаса, что в конечном итоге привело к открытие специфической для растений адаптации к клатрин-опосредованному эндоцитозу.Более того, на интернализацию и локализацию транспортных белков ауксина и брассиностероидного рецептора BRI1, двух хорошо известных грузовых белков клатрин-опосредованного эндоцитоза, влияют дефекты в комплексе TPLATE, что указывает на важность TPLATE в развитии растений.
В этом обзоре будут рассмотрены основные шаги и решения, которые необходимо принять при настройке эксперимента AP / MS. При этом мы выделяем две основные тенденции в экспериментах AP / MS для изучения развития растений: увеличение разрешения при развитии собранных тканей и переход от аффинной очистки к аффинному обогащению.Мы также обсуждаем некоторые недавние технологические достижения в этой области, которые, как мы ожидаем, могут иметь большое влияние на будущее AP / MS на заводах.
Повышение разрешения в развитии
Первый шаг в любом эксперименте AP / MS включает создание общего белкового экстракта, из которого должен быть очищен белок-приманка. Теоретически белок-приманка может быть очищен от любого типа ткани, в которой он экспрессируется. Это подчеркивает одно из основных преимуществ использования AP / MS, поскольку оно позволяет идентифицировать PPI, встречающиеся in vivo , в контексте выбора в контексте развития, тогда как для большинства других бинарных методов, таких как Y2H, часто требуются системы эктопической экспрессии, такие как дрожжевые клетки. для экспрессии белков как приманки, так и жертвы.
Использование клеточных культур
Культивируемые клетки традиционно были популярным источником биомассы для экспериментов AP / MS. В основном это связано с легкостью их трансформации и высокими темпами роста, что приводит к быстрому, относительно дешевому и почти бесконечному запасу биомассы. Суспензионная культура клеток PSB-D (дополнительная таблица S1) оказалась отличной системой культивирования клеток для целей AP / MS у растений. Он получен из культуры клеток MM2d, которая была первоначально получена из стволовых эксплантатов Arabidopsis thaliana Landsberg erecta (Menges and Murray, 2004).Эта культура PSB-D быстро размножается в темноте, используя сахарозу в качестве основного источника энергии, и имеет уровень плоидности 9C, ведущий к разнообразной экспрессии белков, часто накапливающейся на высоких уровнях. Первоначальный протокол для AP / MS с использованием этой культуры клеточной суспензии продемонстрировал свою ценность для изучения ИПП, регулирующих прогрессирование в клеточном цикле растений (Van Leene et al., 2007), что впоследствии привело к большому взаимодействию клеточного цикла, который картировал сети взаимодействия, окружающие примерно 100 белков ядра клеточного цикла (Van Leene et al., 2010). Поскольку у растений постэмбриональный рост в значительной степени определяется пролиферацией клеток из различных типов меристем, изучение клеточного цикла может дать ценную информацию о развитии органов. В самом деле, многие белки, участвующие в регуляции клеточного цикла и происходящие из интерактома клеточного цикла, как было показано, влияют на конечный размер листа, когда изменяется их экспрессия (Blomme et al., 2014). Например, выяснение взаимодействия клеточного цикла привело к первому описанию SAMBA, специфичного для растений регулятора комплекса, стимулирующего анафазу, / циклосомы (APC / C) E3 лигазы (Eloy et al., 2012). Было обнаружено, что SAMBA ассоциирован с субъединицами APC / C APC3b, APC7 и APC10 (Van Leene et al., 2010). В экспериментах с реципрокными AP / MS с использованием SAMBA в качестве белка-приманки в культурах клеток были идентифицированы почти все субъединицы корового комплекса APC, а также несколько известных регуляторов APC (Eloy et al., 2012). Проверка этих результатов Y2H показала, что SAMBA специфически взаимодействует с APC / C путем связывания с субъединицей APC3b. Роль SAMBA в качестве регулятора APC / C в развитии растений была изучена путем изучения фенотипа нокаут-мутантов samba , которые показали увеличенный размер семян, зародыша, площади розетки и длины корня.Более конкретно, было предположено, что SAMBA ингибирует пролиферацию клеток во время раннего развития растений, воздействуя на ЦИКЛИН А2 для APC / C-опосредованной протеасомной деградации.
Первоначальный протокол для AP / MS с использованием этой культуры клеточной суспензии продемонстрировал свою ценность для изучения ИПП, регулирующих прогрессирование в клеточном цикле растений (Van Leene et al., 2007), что впоследствии привело к большому взаимодействию клеточного цикла, который картировал сети взаимодействия, окружающие примерно 100 белков ядра клеточного цикла (Van Leene et al., 2010). Поскольку у растений постэмбриональный рост в значительной степени определяется пролиферацией клеток из различных типов меристем, изучение клеточного цикла может дать ценную информацию о развитии органов. В самом деле, многие белки, участвующие в регуляции клеточного цикла и происходящие из интерактома клеточного цикла, как было показано, влияют на конечный размер листа, когда изменяется их экспрессия (Blomme et al., 2014). Например, выяснение взаимодействия клеточного цикла привело к первому описанию SAMBA, специфичного для растений регулятора комплекса, стимулирующего анафазу, / циклосомы (APC / C) E3 лигазы (Eloy et al., 2012). Было обнаружено, что SAMBA ассоциирован с субъединицами APC / C APC3b, APC7 и APC10 (Van Leene et al., 2010). В экспериментах с реципрокными AP / MS с использованием SAMBA в качестве белка-приманки в культурах клеток были идентифицированы почти все субъединицы корового комплекса APC, а также несколько известных регуляторов APC (Eloy et al., 2012). Проверка этих результатов Y2H показала, что SAMBA специфически взаимодействует с APC / C путем связывания с субъединицей APC3b. Роль SAMBA в качестве регулятора APC / C в развитии растений была изучена путем изучения фенотипа нокаут-мутантов samba , которые показали увеличенный размер семян, зародыша, площади розетки и длины корня.Более конкретно, было предположено, что SAMBA ингибирует пролиферацию клеток во время раннего развития растений, воздействуя на ЦИКЛИН А2 для APC / C-опосредованной протеасомной деградации.
Помимо того, что они являются отличной моделью для деления тканей, культуры клеток также использовались для изучения белковых комплексов, участвующих в других клеточных процессах, таких как передача сигналов гормонов (Geerinck et al. , 2010; Pauwels et al., 2010; Fernández-Calvo et al. al., 2011; Antoni et al., 2013), вторичный метаболизм (Bassard et al., 2012) или внутриклеточный трафик (Nodzyński et al., 2013; Gadeyne et al., 2014). Особым преимуществом использования клеточных культур является легкость, с которой ими можно манипулировать с помощью химических веществ, таких как гормоны (Pauwels et al., 2010; Antoni et al., 2013) или синхронизирующих соединений (Menges and Murray, 2002). Также использовались культуры клеток других организмов, таких как рис (Zhong et al., 2003; Abe et al., 2008; Nallamilli et al., 2013) и табак (Nishikiori et al., 2011), но это гораздо менее популярны, чем культуры клеток арабидопсиса для целей AP / MS.Однако главное соображение, которое следует сделать при использовании клеточных культур, заключается в том, что они представляют собой культивируемые каллусные ткани, а это означает, что у них отсутствует какой-либо контекст развития. Это может привести к ложноотрицательным результатам при изучении более конкретных процессов развития, потому что эти процессы не активны в пролиферативных культивируемых клетках. Поэтому при изучении развития растений рекомендуется использовать целые проростки или, если это технически возможно, определенные органы или даже типы клеток.
, 2010; Pauwels et al., 2010; Fernández-Calvo et al. al., 2011; Antoni et al., 2013), вторичный метаболизм (Bassard et al., 2012) или внутриклеточный трафик (Nodzyński et al., 2013; Gadeyne et al., 2014). Особым преимуществом использования клеточных культур является легкость, с которой ими можно манипулировать с помощью химических веществ, таких как гормоны (Pauwels et al., 2010; Antoni et al., 2013) или синхронизирующих соединений (Menges and Murray, 2002). Также использовались культуры клеток других организмов, таких как рис (Zhong et al., 2003; Abe et al., 2008; Nallamilli et al., 2013) и табак (Nishikiori et al., 2011), но это гораздо менее популярны, чем культуры клеток арабидопсиса для целей AP / MS.Однако главное соображение, которое следует сделать при использовании клеточных культур, заключается в том, что они представляют собой культивируемые каллусные ткани, а это означает, что у них отсутствует какой-либо контекст развития. Это может привести к ложноотрицательным результатам при изучении более конкретных процессов развития, потому что эти процессы не активны в пролиферативных культивируемых клетках. Поэтому при изучении развития растений рекомендуется использовать целые проростки или, если это технически возможно, определенные органы или даже типы клеток.
Использование цельных растений и органов
Несколько протоколов, описывающих очистку белковых комплексов из проростков арабидопсиса, были опубликованы на протяжении многих лет (Rohila et al., 2004; Рубио и др., 2005; Ци и Катагири, 2009; Smaczniak et al., 2012b; Van Leene et al., 2015; Wendrich et al., 2017), в результате чего получена большая коллекция публикаций, полный обзор которых выходит за рамки настоящего обзора. В качестве выбранного примера здесь будет обсуждаться идентификация белков, взаимодействующих с bZIP29. bZIP29 был идентифицирован как белок, взаимодействующий с несколькими регуляторными белками клеточного цикла во взаимодействии клеточного цикла, что указывает на его роль в регуляции клеточного цикла (Van Leene et al. , 2010). bZIP29 является членом группы I растительных ТФ bZIP, о которых в основном сообщалось, что они играют роль в развитии сосудов и осмосенсорных реакциях. Следовательно, роль bZIP29 в развитии растений была дополнительно исследована, и было показано, что bZIP29 действительно преимущественно экспрессируется в пролиферирующих тканях, а не в тканях сосудов (Van Leene et al., 2016). Доминантно-отрицательная версия bZIP29 привела к фенотипу листа, характеризующемуся уменьшением количества клеток, которое было компенсировано увеличением размера клеток.Также были обнаружены дефекты гравитропного ответа и размера корневой меристемы. Для идентификации взаимодействующих белков bZIP29 очищали с помощью TAP как из клеточных культур, так и из проростков. Эти эксперименты выявили несколько др. BZIP TFs группы I как взаимодействующие белки (Van Leene et al., 2016), подтверждая предыдущее наблюдение, что bZIP TFs могут образовывать гомо- и гетеродимеры (Tsugama et al., 2014). Интересно, что хотя взаимодействующие белки bZIP, обнаруженные в культуре клеток, также были идентифицированы в проростках, дополнительные белки bZIP были идентифицированы в проростках.Более того, сравнивая профили экспрессии взаимодействующих bZIPs, можно предположить определенные тканеспецифические гетеродимеры. Напр., Перекрытие профиля экспрессии bZIP69 с профилем bZIP29 показало, что они экспрессируются вместе только в зачатках боковых корней, указывая на то, что этот гетеродимер может быть специфичным для этой ткани (Van Leene et al., 2016). Это подчеркивает важность включения данных экспрессии транскриптов в данные AP / MS, чтобы помочь в биологической интерпретации данных и предположить, в каких конкретных тканях могут происходить обнаруженные взаимодействия при использовании целых проростков в качестве входных данных биомассы вместо изолированных тканей.
, 2010). bZIP29 является членом группы I растительных ТФ bZIP, о которых в основном сообщалось, что они играют роль в развитии сосудов и осмосенсорных реакциях. Следовательно, роль bZIP29 в развитии растений была дополнительно исследована, и было показано, что bZIP29 действительно преимущественно экспрессируется в пролиферирующих тканях, а не в тканях сосудов (Van Leene et al., 2016). Доминантно-отрицательная версия bZIP29 привела к фенотипу листа, характеризующемуся уменьшением количества клеток, которое было компенсировано увеличением размера клеток.Также были обнаружены дефекты гравитропного ответа и размера корневой меристемы. Для идентификации взаимодействующих белков bZIP29 очищали с помощью TAP как из клеточных культур, так и из проростков. Эти эксперименты выявили несколько др. BZIP TFs группы I как взаимодействующие белки (Van Leene et al., 2016), подтверждая предыдущее наблюдение, что bZIP TFs могут образовывать гомо- и гетеродимеры (Tsugama et al., 2014). Интересно, что хотя взаимодействующие белки bZIP, обнаруженные в культуре клеток, также были идентифицированы в проростках, дополнительные белки bZIP были идентифицированы в проростках.Более того, сравнивая профили экспрессии взаимодействующих bZIPs, можно предположить определенные тканеспецифические гетеродимеры. Напр., Перекрытие профиля экспрессии bZIP69 с профилем bZIP29 показало, что они экспрессируются вместе только в зачатках боковых корней, указывая на то, что этот гетеродимер может быть специфичным для этой ткани (Van Leene et al., 2016). Это подчеркивает важность включения данных экспрессии транскриптов в данные AP / MS, чтобы помочь в биологической интерпретации данных и предположить, в каких конкретных тканях могут происходить обнаруженные взаимодействия при использовании целых проростков в качестве входных данных биомассы вместо изолированных тканей.
Поскольку чувствительность масс-спектрометров увеличилась благодаря развитию масс-спектрометров с орбитальной ловушкой, количество биомассы, необходимое для успешной очистки, уменьшилось. Это позволило исследователям начать рассечение органов проростков арабидопсиса и приблизить интересующий их контекст развития. Например, сбор урожая меристем соцветий позволил Smaczniak et al. (2012a) для успешной идентификации сетей взаимодействия, окружающих пять основных гомеотических белков MADS-домена в развитии соцветий.Здесь представители классов A, B, C и E ТФ MADS-домена были отобраны в качестве белка-приманки для экспериментов с «pull-down», идентифицируя множество PPI между разными TF MADS-домена, подтверждая формирование цветочных квартетов in planta. . Кроме того, были идентифицированы взаимодействия с членами нескольких других семейств TF, что указывает на то, что цветочные квартеты действуют не в одиночку, а совместно с другими TF для достижения точной регуляции развития цветков. Например, APETALA1 (AP1), TF MADS-домена A-типа, как было показано, взаимодействует с TF гомеодомена BELLRINGER (BLR), KNOTTED-LIKE 3 (KNAT3) и BEL1-LIKE HOMEODOMAIN 1 (BLh2), а также с подавителем сверхэкспрессии константов 1 (SOC1), который является основным регулятором перехода цветков.Наконец, также были идентифицированы многие связи с ремоделированием хроматина, показывающие, что TF MADS-домена могут рекрутировать базовый аппарат ремоделирования хроматина на свои гены-мишени.
Это позволило исследователям начать рассечение органов проростков арабидопсиса и приблизить интересующий их контекст развития. Например, сбор урожая меристем соцветий позволил Smaczniak et al. (2012a) для успешной идентификации сетей взаимодействия, окружающих пять основных гомеотических белков MADS-домена в развитии соцветий.Здесь представители классов A, B, C и E ТФ MADS-домена были отобраны в качестве белка-приманки для экспериментов с «pull-down», идентифицируя множество PPI между разными TF MADS-домена, подтверждая формирование цветочных квартетов in planta. . Кроме того, были идентифицированы взаимодействия с членами нескольких других семейств TF, что указывает на то, что цветочные квартеты действуют не в одиночку, а совместно с другими TF для достижения точной регуляции развития цветков. Например, APETALA1 (AP1), TF MADS-домена A-типа, как было показано, взаимодействует с TF гомеодомена BELLRINGER (BLR), KNOTTED-LIKE 3 (KNAT3) и BEL1-LIKE HOMEODOMAIN 1 (BLh2), а также с подавителем сверхэкспрессии константов 1 (SOC1), который является основным регулятором перехода цветков.Наконец, также были идентифицированы многие связи с ремоделированием хроматина, показывающие, что TF MADS-домена могут рекрутировать базовый аппарат ремоделирования хроматина на свои гены-мишени.
Как и следовало ожидать, увеличение разрешения развития собранного исходного материала увеличивает разрешение эксперимента AP / MS. Хорошим примером, иллюстрирующим это, является серия экспериментов AP / MS, которые были выполнены с использованием ANGUSTIFOLIA3 / GRF-INTERACTING FACTOR1 (AN3 / GIF1) в качестве белка-приманки. AN3 был первоначально идентифицирован как транскрипционный коактиватор, взаимодействующий с TF регулирующего рост фактора1 (GRF1) с использованием Y2H-скрининга (Kim and Kende, 2004).GRF1 является частью специфичного для растений семейства ТФ GRF, которые, как было показано, играют ключевую роль в развитии стеблей и листьев, но также участвуют в развитии цветов, семян и корней (Hoe Kim and Tsukaya, 2015; Omidbakhshfard et al. , 2015). Во многих последующих экспериментах с Y2H это взаимодействующее партнерство распространилось почти на всех членов семейств белков GRF и GIF (Kim and Kende, 2004; Horiguchi et al., 2005; Liang et al., 2014). Молекулярный механизм, с помощью которого этот модуль GRF-GIF выполняет свою функцию, был впервые выяснен с использованием TAP с AN3 в качестве белка-приманки (Vercruyssen et al., 2014). Здесь было показано, что AN3 взаимодействует с комплексами ремоделирования хроматина SWI / SNF. Однако очистка AN3 из клеточных культур и целых проростков не привела к идентификации белков GRF, которые, как уже было показано, являются истинными взаимодействующими с AN3. Напротив, когда AN3 был очищен с использованием извлечения из развивающихся соцветий, были идентифицированы как комплексы SWI / SNF, так и GRF3 и GRF5 (Debernardi et al., 2014). Это указывает на то, что взаимодействие GRF-GIF представляет собой взаимодействие с низким содержанием, которое слишком разбавлено в экстракте цельного проростка, чтобы его можно было обнаружить с помощью масс-спектрометрии.Кроме того, в недавней публикации описывается ТАР-очистка AN3 из тканей листьев кукурузы (Nelissen et al., 2015). Лист кукурузы — отличная модель для изучения перехода от деления клеток к размножению клеток (Rymen et al., 2010), в которой модуль GRF-GIF также играет важную роль (Hoe Kim and Tsukaya, 2015). Изучение этого перехода в развитии во время развития листа у Arabidopsis очень сложно, потому что лист Arabidopsis на этой стадии развития имеет размер около 1 мм (Andriankaja et al., 2012). Однако развивающийся лист кукурузы содержит в своем основании зону роста размером в несколько сантиметров и линейную организацию делящихся и разрастающихся клеток в зонах пролиферации и разрастания соответственно. Эти две ткани можно легко отделить друг от друга и использовать в качестве входного материала для экспериментов AP / MS для сравнения динамики белковых комплексов в этих двух контекстах развития (Rymen et al., 2010).
, 2015). Во многих последующих экспериментах с Y2H это взаимодействующее партнерство распространилось почти на всех членов семейств белков GRF и GIF (Kim and Kende, 2004; Horiguchi et al., 2005; Liang et al., 2014). Молекулярный механизм, с помощью которого этот модуль GRF-GIF выполняет свою функцию, был впервые выяснен с использованием TAP с AN3 в качестве белка-приманки (Vercruyssen et al., 2014). Здесь было показано, что AN3 взаимодействует с комплексами ремоделирования хроматина SWI / SNF. Однако очистка AN3 из клеточных культур и целых проростков не привела к идентификации белков GRF, которые, как уже было показано, являются истинными взаимодействующими с AN3. Напротив, когда AN3 был очищен с использованием извлечения из развивающихся соцветий, были идентифицированы как комплексы SWI / SNF, так и GRF3 и GRF5 (Debernardi et al., 2014). Это указывает на то, что взаимодействие GRF-GIF представляет собой взаимодействие с низким содержанием, которое слишком разбавлено в экстракте цельного проростка, чтобы его можно было обнаружить с помощью масс-спектрометрии.Кроме того, в недавней публикации описывается ТАР-очистка AN3 из тканей листьев кукурузы (Nelissen et al., 2015). Лист кукурузы — отличная модель для изучения перехода от деления клеток к размножению клеток (Rymen et al., 2010), в которой модуль GRF-GIF также играет важную роль (Hoe Kim and Tsukaya, 2015). Изучение этого перехода в развитии во время развития листа у Arabidopsis очень сложно, потому что лист Arabidopsis на этой стадии развития имеет размер около 1 мм (Andriankaja et al., 2012). Однако развивающийся лист кукурузы содержит в своем основании зону роста размером в несколько сантиметров и линейную организацию делящихся и разрастающихся клеток в зонах пролиферации и разрастания соответственно. Эти две ткани можно легко отделить друг от друга и использовать в качестве входного материала для экспериментов AP / MS для сравнения динамики белковых комплексов в этих двух контекстах развития (Rymen et al., 2010). При применении этой экспериментальной установки к AN3 было показано, что AN3 стабильно связывается с комплексом ремоделирования хроматина SWI / SNF на протяжении всего развития листа, но по-разному взаимодействует с белками GRF в зонах деления и размножения клеток, что идеально коррелирует с лежащими в их основе паттернами экспрессии.Более того, когда белковые комплексы AN3 были очищены из развивающихся колосьев кукурузы, были идентифицированы другие GRF по сравнению с таковыми, выделенными из тканей листа (Nelissen et al., 2015). Этот пример демонстрирует преимущества выполнения экспериментов AP / MS на конкретных органах или даже тканях подорганов, а также необходимость переноса AP / MS в другие модельные системы, такие как определенные виды сельскохозяйственных культур, которые могут быть лучше подходят, как было проиллюстрировано лист кукурузы. Аналогичные комплексные стратегии очистки были продемонстрированы для рисового листа (Dedecker et al., 2016). Использование альтернативных систем моделей может также потребоваться при изучении специализированных процессов разработки. Например, AP / MS был перенесен на модельный вид бобовых Medicago truncatula , который является хорошо известным модельным видом для изучения эндосимбиотических взаимодействий и специализированного вторичного метаболизма (Goossens et al., 2016).
При применении этой экспериментальной установки к AN3 было показано, что AN3 стабильно связывается с комплексом ремоделирования хроматина SWI / SNF на протяжении всего развития листа, но по-разному взаимодействует с белками GRF в зонах деления и размножения клеток, что идеально коррелирует с лежащими в их основе паттернами экспрессии.Более того, когда белковые комплексы AN3 были очищены из развивающихся колосьев кукурузы, были идентифицированы другие GRF по сравнению с таковыми, выделенными из тканей листа (Nelissen et al., 2015). Этот пример демонстрирует преимущества выполнения экспериментов AP / MS на конкретных органах или даже тканях подорганов, а также необходимость переноса AP / MS в другие модельные системы, такие как определенные виды сельскохозяйственных культур, которые могут быть лучше подходят, как было проиллюстрировано лист кукурузы. Аналогичные комплексные стратегии очистки были продемонстрированы для рисового листа (Dedecker et al., 2016). Использование альтернативных систем моделей может также потребоваться при изучении специализированных процессов разработки. Например, AP / MS был перенесен на модельный вид бобовых Medicago truncatula , который является хорошо известным модельным видом для изучения эндосимбиотических взаимодействий и специализированного вторичного метаболизма (Goossens et al., 2016).
Очевидно, что увеличение разрешения развития собранного исходного материала дает результаты AP / MS с более высоким содержанием онтогенеза и позволяет глубже проникнуть в интерактомы, окружающие белок приманки.В принципе, AP / MS можно проводить на любой ткани из любого организма, пока доступны специфические антитела к белку-приманке или может быть достигнута стабильная экспрессия слитого белка в выбранной ткани или организме. Поскольку каждый источник биомассы имеет свои преимущества и недостатки (рис. 1), выбор исходного материала для использования следует оценивать в каждом конкретном случае и адаптировать к экспериментальной установке и биологическому вопросу.
РИСУНОК 1. Сравнение доступных источников биомассы для экспериментов AP / MS.Преимущества и недостатки различных источников биомассы оцениваются по пяти параметрам. Культуры клеток являются наиболее экономичным и экономичным средством получения биомассы для экспериментов AP / MS. Они также обеспечивают максимальную экспериментальную гибкость из-за легкости, с которой ими манипулируют химические соединения. Саженцы арабидопсиса — лучший универсальный источник биомассы, предлагающий наилучшие характеристики для стандартных экспериментов AP / MS. При изучении более конкретных процессов развития лучше подойдут саженцы сельскохозяйственных культур.Однако они отнимают больше времени и часто допускают меньшую экспериментальную гибкость из-за своего размера. Хотя изолированные органы и ткани обеспечивают высшую степень контекста развития, определение оптимальной ткани и стадии развития для сбора биомассы увеличивает сложность экспериментальной установки и необходимое время.
Введение в различные подходы к AP / Ms
Чтобы иметь возможность специфически очищать белок от общего белкового экстракта, белок приманки должен быть захвачен и иммобилизован на аффинной смоле.Это позволяет вымывать невзаимодействующие белки, в то время как взаимодействующие белки остаются иммобилизованными. После удаления невзаимодействующих белков взаимодействующие белки могут быть элюированы со смолы и идентифицированы с помощью масс-спектрометрии (Morris et al., 2014). Очистка белка-приманки может быть выполнена в протоколе очистки с одинарной или двойной аффинностью (рис. 2А). При одностадийной очистке обычно используют антитело, специфичное для белка-приманки, или обычное антитело против аффинной метки, слитой с белком-приманкой.Поэтому эти методы часто называют иммунопреципитацией. Однако одностадийную очистку также можно проводить без необходимости в специфических антителах, например, с использованием стрептавидин-связывающей пептидной метки или His-метки, которые позволяют улавливать стрептавидин или смолы Ni2 + соответственно. Поэтому мы предпочитаем использовать термин «вытягивание вниз» как общий термин для одностадийной аффинной очистки. В качестве альтернативы очистка, выполняемая с использованием двухэтапного протокола аффинной очистки, называется ТАР.В этом подходе белок-приманка сливается с TAP-тегом, который содержит два разных аффинных тега, которые часто разделены сайтом расщепления протеазой (рис. 2B). После иммобилизации белка-приманки с использованием первого аффинного домена и последующей промывки этот домен отщепляется путем инкубации с протеазой, которая специфически распознает белковые последовательности, связывающие оба аффинных домена. Эта стадия расщепления позволяет мягко элюировать иммобилизованную приманку и открывает второй аффинный домен для связывания со следующей аффинной смолой, позволяя дальнейшее удаление неспецифических белков с помощью дополнительной стадии промывки.
Поэтому мы предпочитаем использовать термин «вытягивание вниз» как общий термин для одностадийной аффинной очистки. В качестве альтернативы очистка, выполняемая с использованием двухэтапного протокола аффинной очистки, называется ТАР.В этом подходе белок-приманка сливается с TAP-тегом, который содержит два разных аффинных тега, которые часто разделены сайтом расщепления протеазой (рис. 2B). После иммобилизации белка-приманки с использованием первого аффинного домена и последующей промывки этот домен отщепляется путем инкубации с протеазой, которая специфически распознает белковые последовательности, связывающие оба аффинных домена. Эта стадия расщепления позволяет мягко элюировать иммобилизованную приманку и открывает второй аффинный домен для связывания со следующей аффинной смолой, позволяя дальнейшее удаление неспецифических белков с помощью дополнительной стадии промывки.
РИСУНОК 2. Обзор различных подходов AP / MS (A) и доступных тегов TAP (B) . Теги TAP: (1) тег TAPi; (2) бирка GSrhino; (3) бирка GS желтая . CBP, кальмодулин-связывающий белок; FP, ложное срабатывание; FN, ложноотрицательный; ProtA, домен протеина A; ProtG, домен белка G; 2x Rhino, сайт двойного узнавания для протеазы Rhinovirus 3C; TEV, сайт узнавания протеазы вируса травления табака; SBP, стрептавидин-связывающий пептид; YFP, желтый флуоресцентный белок.
Эксперименты с понижением частоты с использованием антитела, специфичного для белка-приманки, позволяют очистить эндогенный белок, экспрессируемый с его нативного промотора. Следовательно, нет необходимости создавать трансгенные линии, экспрессирующие белок-приманку, слитый с аффинной меткой. Хотя этот подход успешно применялся на растениях (Qi and Katagiri, 2009; König et al., 2014; Pertl-Obermeyer et al., 2014), он не получил большой популярности в этой области. В основном это связано с ограниченным количеством доступных антител к растительным белкам в сочетании с тем фактом, что разработка специфических антител может быть трудоемкой и дорогостоящей задачей. Кроме того, специфичность этих антител необходимо оценивать в каждом конкретном случае, в то время как общие антитела часто специфичны и хорошо охарактеризованы, что позволяет использовать общие протоколы очистки. Таким образом, использование аффинных тегов в настоящее время является стандартной практикой в экспериментах с AP / MS. Множество различных аффинных тегов было разработано и оценено на протяжении многих лет на растениях (Dedecker et al., 2015). В общем, флуоресцентные белковые метки, такие как GFP, являются наиболее популярными для экспериментов с пониженным содержанием.Это в основном связано с доступностью трансгенных линий растений, сверхэкспрессирующих слияния GFP, в сочетании с существованием высококачественных антител против GFP. Более того, флуоресцентная белковая метка также может использоваться для выполнения анализа локализации белка. С другой стороны, для экспериментов с TAP наиболее широко используются теги TAPi (Rohila et al., 2004) и GS (Van Leene et al., 2008). Недавно разработанная желтая метка TAP GS (рис. 2В) сочетает в себе свойства обоих типов меток, объединяя флуоресцентный белок цитрин YFP с высокоэффективной пептидной меткой, связывающей стрептавидин, в метку с двойным сродством (Besbrugge et al., 2018).
Кроме того, специфичность этих антител необходимо оценивать в каждом конкретном случае, в то время как общие антитела часто специфичны и хорошо охарактеризованы, что позволяет использовать общие протоколы очистки. Таким образом, использование аффинных тегов в настоящее время является стандартной практикой в экспериментах с AP / MS. Множество различных аффинных тегов было разработано и оценено на протяжении многих лет на растениях (Dedecker et al., 2015). В общем, флуоресцентные белковые метки, такие как GFP, являются наиболее популярными для экспериментов с пониженным содержанием.Это в основном связано с доступностью трансгенных линий растений, сверхэкспрессирующих слияния GFP, в сочетании с существованием высококачественных антител против GFP. Более того, флуоресцентная белковая метка также может использоваться для выполнения анализа локализации белка. С другой стороны, для экспериментов с TAP наиболее широко используются теги TAPi (Rohila et al., 2004) и GS (Van Leene et al., 2008). Недавно разработанная желтая метка TAP GS (рис. 2В) сочетает в себе свойства обоих типов меток, объединяя флуоресцентный белок цитрин YFP с высокоэффективной пептидной меткой, связывающей стрептавидин, в метку с двойным сродством (Besbrugge et al., 2018).
В эксперименте AP / MS природа совместно очищенных белков зависит от метода очистки, выбора метки и положения метки (Keilhauer et al., 2015). Добавление значительного белкового домена к белку-приманке, что особенно характерно для больших флуоресцентных белковых меток, может вызвать нарушение функции белка. Поэтому рекомендуется проводить эксперименты AP / MS с N- и C-концевыми слияниями метки с белком-приманкой.
Работа с ложноположительными и ложноотрицательными результатами
Собственная природа протоколов AP / MS, в ходе которых клетки лизируются, белки солюбилизируются и белки-приманки очищаются, налагает создание как ложноположительных, так и ложноотрицательных взаимодействий.Разрушая клетки, содержимое различных клеточных компартментов высвобождается в белковый экстракт, что позволяет белку-приманке или его взаимодействующим элементам вступать в контакт с белками, с которыми он обычно не может взаимодействовать. С другой стороны, при экстракции и очистке белка возникают ложные отрицательные результаты. Солюбилизируя белки в буфере для экстракции белков, белки разбавляются, изменяя их концентрацию и кинетику связывания. Последующая очистка белка-приманки требует связывания с аффинной смолой, удаления несвязанных белков и повторяющихся этапов промывки для уменьшения неспецифического связывания со смолой.Эти шаги навязывают потенциальные ложноотрицательные взаимодействия, потому что истинно взаимодействующие белки, которые демонстрируют слабое взаимодействие с белком-приманкой, теряются на этапе разбавления экстракта белка или во время различных этапов очистки. В следующих разделах мы отделяем ложноположительные результаты от ложноотрицательных и обсуждаем различные подходы к их устранению.
С другой стороны, при экстракции и очистке белка возникают ложные отрицательные результаты. Солюбилизируя белки в буфере для экстракции белков, белки разбавляются, изменяя их концентрацию и кинетику связывания. Последующая очистка белка-приманки требует связывания с аффинной смолой, удаления несвязанных белков и повторяющихся этапов промывки для уменьшения неспецифического связывания со смолой.Эти шаги навязывают потенциальные ложноотрицательные взаимодействия, потому что истинно взаимодействующие белки, которые демонстрируют слабое взаимодействие с белком-приманкой, теряются на этапе разбавления экстракта белка или во время различных этапов очистки. В следующих разделах мы отделяем ложноположительные результаты от ложноотрицательных и обсуждаем различные подходы к их устранению.
Ложные срабатывания: проблема фильтрации фона
Одна из самых больших проблем в любом эксперименте AP / MS состоит в том, чтобы различить истинных взаимодействующих белка и неспецифических фоновых белков.Неспецифические фоновые белки обычно представляют собой смесь ложноположительных и истинно положительных результатов, которые взаимодействуют со многими несвязанными белками, такими как белки, участвующие в трансляции, сворачивании и транспорте белков. Первоначально ТАП был разработан как метод очистки белковых комплексов высокой чистоты в условиях, близких к физиологическим, с минимизацией количества фона. Однако с увеличением чувствительности масс-спектрометров даже белковые комплексы, очищенные с помощью TAP, по-прежнему содержат много фоновых белков и по-прежнему требуют тщательной фоновой фильтрации.
Традиционно фоновая фильтрация выполнялась путем картирования белков, идентифицированных при ложной очистке или повторно встречающихся как совместно очищенные белки с разными, неродственными белками-приманками (Van Leene et al., 2015; Dedecker et al., 2016). Этот список фоновых белков можно затем использовать в качестве списка вычитания, чтобы отфильтровать фоновые взаимодействия, оставив только истинные и конкретные взаимодействующие. Однако вариации в образце, протоколе очистки или подготовке образца могут значительно изменить идентификацию белков в эксперименте AP / MS, а следовательно, и фоновую идентификацию.Поэтому в экспериментах с единичным отрицательным контролем часто не удается уловить полный набор загрязняющих веществ. Большое количество контрольных очисток, отрицательных контролей или очисток неродственных белков-приманок, которые были выполнены в очень схожих экспериментальных условиях, необходимо объединить для достижения полного набора фоновых белков. Эти фоновые списки обычно увеличиваются в размере, когда выполняется все больше и больше контрольных или несвязанных очисток приманки, или с повышенной чувствительностью машин MS, что может привести к ложной классификации белков как неспецифических для определенных белков приманки.Чтобы справиться с этой проблемой, интеграция полуколичественной информации о содержании белка, т. Е. На основе нормированных спектральных коэффициентов распространенности, оказалась действенным методом для вызова истинных интеракторов из фоновых списков (Van Leene et al., 2015). Тем не менее, при правильном составлении фоновый список предлагает высоконадежный и настраиваемый вручную способ фильтрации данных. Онлайн-хранилища стандартизированных образцов отрицательного контроля были разработаны, чтобы преодолеть потребность отдельных исследователей в выполнении большого количества отрицательных контролей, например репозиторий загрязнителей для аффинной очистки, т.е.е., CRAPome (Mellacheruvu et al., 2013) и исчерпывающие справочные списки культур клеток Arabidopsis, проростков и культур клеток риса общедоступны (Van Leene et al., 2015; Dedecker et al., 2016; Supplementary Table S1 ).
Однако вариации в образце, протоколе очистки или подготовке образца могут значительно изменить идентификацию белков в эксперименте AP / MS, а следовательно, и фоновую идентификацию.Поэтому в экспериментах с единичным отрицательным контролем часто не удается уловить полный набор загрязняющих веществ. Большое количество контрольных очисток, отрицательных контролей или очисток неродственных белков-приманок, которые были выполнены в очень схожих экспериментальных условиях, необходимо объединить для достижения полного набора фоновых белков. Эти фоновые списки обычно увеличиваются в размере, когда выполняется все больше и больше контрольных или несвязанных очисток приманки, или с повышенной чувствительностью машин MS, что может привести к ложной классификации белков как неспецифических для определенных белков приманки.Чтобы справиться с этой проблемой, интеграция полуколичественной информации о содержании белка, т. Е. На основе нормированных спектральных коэффициентов распространенности, оказалась действенным методом для вызова истинных интеракторов из фоновых списков (Van Leene et al., 2015). Тем не менее, при правильном составлении фоновый список предлагает высоконадежный и настраиваемый вручную способ фильтрации данных. Онлайн-хранилища стандартизированных образцов отрицательного контроля были разработаны, чтобы преодолеть потребность отдельных исследователей в выполнении большого количества отрицательных контролей, например репозиторий загрязнителей для аффинной очистки, т.е.е., CRAPome (Mellacheruvu et al., 2013) и исчерпывающие справочные списки культур клеток Arabidopsis, проростков и культур клеток риса общедоступны (Van Leene et al., 2015; Dedecker et al., 2016; Supplementary Table S1 ).
Однако при изучении развития растений исследователи часто проводят эксперименты AP / MS на определенных типах тканей или в определенных экспериментальных условиях, характеризующихся уникальным набором экспрессируемых белков. В этих случаях исчерпывающие справочные списки, которые были разработаны для стандартных экспериментальных условий и в них, недостаточно. Появление количественной протеомики предоставило исследователям альтернативный метод, позволяющий отличить bona fide взаимодействующих белков от фоновых белков без необходимости в больших фоновых списках. В количественных экспериментах AP / MS количество белков, которые очищаются совместно с белками приманки, сравнивают с их количествами в образце отрицательного контроля. В этой установке фоновые белки будут иметь соотношение 1: 1 по сравнению с контролем, тогда как истинно взаимодействующие белки будут обогащены.Было разработано множество подходов к количественной протеомике, которые можно подразделить на химические или метаболические методы мечения и методы без меток (Huang et al., 2016). В количественной протеомике на основе меток контрольные и тестовые образцы помечаются легкими и тяжелыми изотопами. Затем образцы смешивают и измеряют в одном и том же сеансе МС, уменьшая экспериментальные вариации. Поскольку идентичные пептиды в разных образцах будут одинаково обнаруживаться масс-спектрометром, разница в интенсивности пика между образцами коррелирует с разницей в содержании пептидов.Количественное определение белка затем выполняется путем расчета отношения интенсивностей меченных изотопами пептидных пар. В количественной протеомике без меток контрольные и тестовые образцы измеряются в отдельных прогонах МС. Здесь идентичные пептиды сопоставляются между сериями на основе их значения m / z и времени удерживания, а количественное определение белка выполняется путем расчета отношения интенсивностей сопоставленных пептидов. Хотя химическая и метаболическая маркировка успешно применяется к растениям (Gouw et al., 2010; Minkoff et al., 2014; Liu et al., 2018), безметки методы стали предпочтительным методом в количественных экспериментах AP / MS растений (Podwojski et al., 2010; Zhu et al., 2010; Huang et al., 2016). Наиболее часто используемый алгоритм для количественной оценки AP / MS данных без меток — это MaxQuant (Cox, Mann, 2008; Tyanova et al., 2016). Здесь следует отметить важное замечание: различение истинных и ложных интеракторов на основе количественных данных AP / MS является статистическим процессом, а это означает, что белки считаются истинными интеракторами, когда они значительно обогащены по сравнению с контролем.
Появление количественной протеомики предоставило исследователям альтернативный метод, позволяющий отличить bona fide взаимодействующих белков от фоновых белков без необходимости в больших фоновых списках. В количественных экспериментах AP / MS количество белков, которые очищаются совместно с белками приманки, сравнивают с их количествами в образце отрицательного контроля. В этой установке фоновые белки будут иметь соотношение 1: 1 по сравнению с контролем, тогда как истинно взаимодействующие белки будут обогащены.Было разработано множество подходов к количественной протеомике, которые можно подразделить на химические или метаболические методы мечения и методы без меток (Huang et al., 2016). В количественной протеомике на основе меток контрольные и тестовые образцы помечаются легкими и тяжелыми изотопами. Затем образцы смешивают и измеряют в одном и том же сеансе МС, уменьшая экспериментальные вариации. Поскольку идентичные пептиды в разных образцах будут одинаково обнаруживаться масс-спектрометром, разница в интенсивности пика между образцами коррелирует с разницей в содержании пептидов.Количественное определение белка затем выполняется путем расчета отношения интенсивностей меченных изотопами пептидных пар. В количественной протеомике без меток контрольные и тестовые образцы измеряются в отдельных прогонах МС. Здесь идентичные пептиды сопоставляются между сериями на основе их значения m / z и времени удерживания, а количественное определение белка выполняется путем расчета отношения интенсивностей сопоставленных пептидов. Хотя химическая и метаболическая маркировка успешно применяется к растениям (Gouw et al., 2010; Minkoff et al., 2014; Liu et al., 2018), безметки методы стали предпочтительным методом в количественных экспериментах AP / MS растений (Podwojski et al., 2010; Zhu et al., 2010; Huang et al., 2016). Наиболее часто используемый алгоритм для количественной оценки AP / MS данных без меток — это MaxQuant (Cox, Mann, 2008; Tyanova et al., 2016). Здесь следует отметить важное замечание: различение истинных и ложных интеракторов на основе количественных данных AP / MS является статистическим процессом, а это означает, что белки считаются истинными интеракторами, когда они значительно обогащены по сравнению с контролем. Следовательно, качество анализа данных улучшится с увеличением размера списка совместно очищенных белков. По этой причине одношаговое раскрытие, которое приводит к более высоким уровням фона по сравнению с TAP и, следовательно, к большему набору данных, на самом деле лучше работает в сочетании с количественным анализом данных по сравнению с образцами TAP. Поскольку нисходящая очистка скорее обогащает белок-приманку, чем фактически очищает его с высокой специфичностью, предлагается переименовать объединение нисходящего метода с количественной оценкой без метки в аффинное обогащение, а не аффинную очистку (Keilhauer et al., 2015).
Следовательно, качество анализа данных улучшится с увеличением размера списка совместно очищенных белков. По этой причине одношаговое раскрытие, которое приводит к более высоким уровням фона по сравнению с TAP и, следовательно, к большему набору данных, на самом деле лучше работает в сочетании с количественным анализом данных по сравнению с образцами TAP. Поскольку нисходящая очистка скорее обогащает белок-приманку, чем фактически очищает его с высокой специфичностью, предлагается переименовать объединение нисходящего метода с количественной оценкой без метки в аффинное обогащение, а не аффинную очистку (Keilhauer et al., 2015).
Практика обогащения сродства
Обогащение сродства было успешно выполнено на растениях в многочисленных исследованиях (Mravec et al., 2011; Smaczniak et al., 2012a, b; De Rybel et al., 2013; Debernardi et al., 2014; Nelissen et al., 2015). ; Née et al., 2017). Несмотря на то, что в прошлом было разработано и использовалось большое количество отдельных тегов сродства (Dedecker et al., 2015), GFP стал предпочтительным тегом для раскрывающихся списков. Явным преимуществом использования меток на основе флуоресценции является то, что экспрессию и локализацию клеточного белка можно изучать одновременно с использованием одной и той же трансгенной линии.Более того, эти метки могут помочь исследователям в выборе тканей или стадий развития, которые необходимо собрать. Например, эта стратегия была применена в вышеупомянутом исследовании, в котором было обнаружено, что специфические TF GRF взаимодействуют с AN3 в соцветиях (Debernardi et al., 2014). Действительно, при визуализации клеточной локализации AN3-GFP, экспрессируемой его эндогенным промотором, было обнаружено высокое накопление AN3-GFP в меристемах соцветий. Это послужило хорошей проверкой использования этой ткани в качестве исходного материала для эксперимента AP / MS с использованием AN3-GFP в качестве белка-приманки.Другим примером является исследование функции bHLH TF TARGET OF MONOPTEROS5 (TMO5) в создании и поддержании сосудистой ткани (De Rybel et al., 2013). Специфическая локализация TMO5-GFP была обнаружена в эмбрионах глобулярной стадии и зрелых корнях. Таким образом, силики и корни проростков использовали для очистки TMO5-GFP и идентификации bHLH TFs LHW и LHW-like2 как белков, взаимодействующих с TMO5. Взаимный AP / MS с использованием LHW в качестве белка-приманки подтвердил его взаимодействие с TMO5 и дополнительно идентифицировал несколько TMO5-подобных белков в качестве партнеров по взаимодействию.Последующее подробное исследование этих профилей взаимодействия привело к описанию нового гетеродимерного ТФ комплекса bHLH, который играет решающую роль как в формировании сосудистых тканей у ранних эмбрионов, так и в поддержании неопределенности этой клеточной популяции в пост- эмбриональные ткани.
Аффинное обогащение также использовалось для изучения покоя семян Arabidopsis (Née et al., 2017). Это исследование было сосредоточено на белке ЗАДЕРЖКИ ПРОРАСТАНИЯ 1 (DOG1). Хотя было известно, что количество DOG1 важно для времени, необходимого для выхода из состояния покоя семян, и что это количество DOG1 зависит от факторов окружающей среды во время созревания семян, никаких доказательств молекулярной функции DOG1 не сообщалось.С использованием аффинного обогащения для DOG1-YFP из четырех различных условий посевного материала, сухих по сравнению с 24-часовым набуханием как для покоящихся, так и для бездействующих семян, было идентифицировано 184 взаимодействующих белка. Потеря состояния покоя резко снижает количество взаимодействующих белков, что указывает на потерю активности DOG1 после созревания семян. Дальнейшая проверка специфических взаимодействий показала, что DOG1 взаимодействует с множественными фосфатазами, которые играют избыточную, но важную роль в высвобождении покоя семян. Поразительно, что сходные фосфатазы действуют как ключевые негативные регуляторы сигнального пути ABA, указывая на то, что оба сигнальных пути, контролирующих покой семян, сходятся на наборе отдельных и частично перекрывающихся протеинфосфатаз.
Недавно протоколы аффинного обогащения были обновлены и дополнительно оптимизированы для ядерных, цитоплазматических и связанных с мембранами белковых комплексов (Wendrich et al., 2017; Jamge et al., 2018).
Проверка результатов AP / MS
Независимо от того, какой метод был использован для различения bona fide взаимодействующих белков и неспецифических фоновых белков, дополнительная проверка идентифицированных PPI остается важной. Для крупномасштабных сетей PPI, генерируемых AP / MS, для оценки качества данных требуется проверка по крайней мере подмножества идентифицированных взаимодействий, тогда как мелкомасштабные сети PPI позволяют проводить более обширную проверку с помощью нескольких дополнительных методов для демонстрации актуальность выявленных взаимодействий.
Один из самых элегантных способов проверки результатов AP / MS — проведение экспериментов с обратным AP / MS. Здесь один или несколько идентифицированных взаимодействующих веществ используются в качестве белка-приманки для поиска взаимных доказательств для PPI. Например, комплекс TPLATE из восьми субъединиц был идентифицирован с использованием TPLATE в качестве приманки, но все восемь субъединиц также могут быть взаимно идентифицированы с использованием любого из компонентов TPLATE в качестве белка приманки (Gadeyne et al., 2014). Однако выполнение дополнительных экспериментов AP / MS может стать дорогостоящим и трудоемким мероприятием.В качестве альтернативного подхода может применяться обратный co-IP на том же генетическом фоне, что и эксперименты AP / MS. Относительно дешевые и быстрые бинарные методы, такие как Y2H и BiFC, также являются популярными методами для попарной проверки PPI. Однако интерактомы, генерируемые бинарными методами и методами ко-комплексов, как было показано, перекрываются менее чем на 20% у дрожжей (Yu et al., 2008). Следовательно, при проверке данных AP / MS бинарными методами можно ожидать большого количества ложноотрицательных результатов.Например, подмножество интерактома клеточного цикла было подтверждено с помощью анализа расщепленной люциферазы, что дало результат только 41%. Однако, учитывая низкое перекрытие между двоичными и сопряженными данными, это фактически можно рассматривать как высокий уровень успеха (Van Leene et al., 2010).
Наконец, генетика также может использоваться для проверки ИЦП. Например, Хуанг и др. (2016) показали, что фитохром B (phyB) действует как концентратор, соединяющий циркадные часы и сигнальные пути красного света.Во-первых, AP / MS, использующая компонент вечернего комплекса EARLY FLOWERING 4 (ELF4) в качестве белка-приманки, привела к идентификации других компонентов вечернего комплекса, белков циркадных часов и нескольких фоторецепторов и регуляторов световой сигнализации. Поскольку phyB был основным ассоциированным фоторецептором, эксперимент был повторен на мутантном фоне phyB. Здесь было показано, что потеря phyB приводит к тому, что ELF4 теряет способность взаимодействовать с другими белками, передающими часы и свет, в то время как его взаимодействия с другими компонентами вечернего комплекса остаются неизменными.Помимо проверки взаимодействия между вечерним комплексом и phyB, этот эксперимент элегантно продемонстрировал, как генетика связывания с AP / MS может использоваться для идентификации субкомплексов и связей между различными сигнальными путями.
Ложноотрицательные результаты: обнаружение кратковременных или слабых взаимодействий
Как упоминалось ранее, AP / MS включает различную степень промывки для удаления фоновых белков и увеличения отношения сигнал / шум. Однако во время этих этапов промывки белки, которые демонстрируют слабое или временное взаимодействие с белком приманки, часто теряются.Действительно, путем сравнения крупномасштабных наборов данных AP / MS с наборами данных Y2H было показано, что наборы данных AP / MS обогащены для стабильных взаимодействий, тогда как наборы данных Y2H более обогащены для временных взаимодействий (Yu et al., 2008). Предлагаемое решение для увеличения шансов обнаружения кратковременных или слабых взаимодействий — это методы маркировки, зависящие от близости. С помощью этих методов возможные взаимодействующие белки помечены как in vivo на основании их близости к интересующему белку. Меченые белки можно впоследствии подвергнуть аффинной очистке и идентифицировать с помощью масс-спектрометрии.Несколько методов мечения, зависимых от близости, были разработаны и рассмотрены в другом месте (Roux, 2013; Rees et al., 2015), но лишь некоторые из них были использованы на растениях.
Первым методом, успешно применяемым на растениях, является сшивание in vivo . Rohila et al. (2004) описали метод увеличения восстановления взаимодействующих белков в протоколах TAP с использованием перекрестного связывания in vivo и , который использовался в нескольких других экспериментах AP / MS (Qi and Katagiri, 2009; Pertl-Obermeyer et al., 2014; Bellati et al., 2016). Конкретным примером полезного сшивания in vivo является очистка мембранных белков. Поскольку эти белки содержат высокогидрофобные участки, встроенные в мембраны, для их солюбилизации требуются специальные детергенты, что может привести к потере взаимодействующих белков. По этой причине, как известно, сложно идентифицировать взаимодействующие белки для мембранных белков, из-за чего внутренние мембранные белки явно недостаточно представлены в литературе в качестве белков-приманок для экспериментов с AP / MS на растениях.Чтобы стабилизировать взаимодействия мембранных белков, Bellati et al. (2016) объединили сшивание формальдегидом с обогащением сродства, чтобы идентифицировать взаимодействующие белки аквапоринов PIP1; 2 и PIP2; 1, чтобы получить дополнительную информацию о том, как регулируется транспорт корневой воды. Эта работа выявила крупномасштабный интерактом, состоящий из 436 и 388 взаимодействующих белков PIP1; 2 и PIP2; 1, соответственно, из которых 80% было общим для обоих белков. Этот интерактом предоставил важную информацию о том, как активность PIP регулируется такими процессами, как внутриклеточный трафик, передача липидных сигналов, а также активность специфических рецептороподобных киназ.В качестве альтернативы, белковые комплексы in vitro также могут быть стабилизированы во время экстракции белка, как показано на примере использования обратимого сшивающего агента DSP для анализа мишени рапамицинового взаимодействия у дрозофилы (Glatter et al., 2011).
Более свежим многообещающим примером зависящих от близости растений мечения является BioID, который основан на слиянии интересующего белка с мутантной версией биотинлигазы BirA Escherichia coli (Roux et al., 2012).Этот мутант BirA биотинилирует белки, которые находятся в радиусе 10 нм от фермента, без необходимости в специфическом сайте узнавания на целевом белке. Меченые белки могут быть впоследствии выделены с использованием аффинного захвата на основе стрептавидина. Поскольку мечение является ковалентной модификацией и из-за чрезвычайно сильного взаимодействия биотин-стрептавидин, нет необходимости поддерживать PPI на стадии очистки, что позволяет создавать жесткие денатурирующие условия во время очистки, которые снижают фоновое связывание.BioID сильно отличается от перекрестного сшивания в том смысле, что сшивание просто обеспечивает моментальный снимок белков в непосредственной близости от белка-приманки во время перекрестного сшивания. Вместо этого BioID создает отпечаток взаимодействий, производимых интересующим белком в течение определенного периода времени. Недавно была опубликована оптимизированная версия протокола BioID для протопластов риса (Lin et al., 2017), показывающая его применимость для растений, но также подчеркивающая некоторые недостатки. Например, из-за бактериальной природы белка BirA мечение более эффективно при более высокой температуре (Kim et al., 2016). Однако выращивание растений при более высоких температурах может вызвать вызванную температурой активацию определенных генов и, следовательно, искусственные взаимодействия. Кроме того, для повышения эффективности фермента BirA в питательную среду необходимо добавлять экзогенный биотин (Lin et al., 2017). Кроме того, контрольные эксперименты должны быть организованы очень осторожно, чтобы отфильтровать эндогенно биотинилированные белки, которые загрязняют очистку. Хотя методы мечения, зависимые от близости, просто предоставляют информацию о том, какие белки находятся в непосредственной близости друг от друга, они не предоставляют прямых доказательств физического взаимодействия между этими белками, что требует дальнейшей проверки с помощью независимых методов PPI.
Выбор правильного подхода к AP / MS
Успех эксперимента AP / MS может быть очень зависимым от приманки, и, как подчеркивалось в разделах выше, множество различных параметров могут повлиять на окончательные результаты. Таким образом, выбор наиболее подходящей экспериментальной установки может быть сложной задачей, зачастую обусловленной интуицией и предшествующим опытом. Таким образом, хорошее представление о сильных сторонах и недостатках доступных подходов играет важную роль в принятии правильных решений (рис. 3).
РИСУНОК 3. Обзор преимуществ и недостатков различных подходов AP / MS.
Одной из самых обсуждаемых тем в этом отношении является сравнение pull-down с TAP. Как подчеркивалось ранее, выпадающий список в сочетании с количественной оценкой без меток, называемый аффинным обогащением, быстро набирает популярность и может стать стандартным методом AP / MS для растений. Эта популярность в основном объясняется его высокой степенью гибкости при изменении экспериментальных условий, например.g., типы тканей, методы лечения и модельный организм. Более того, как описано выше, более низкое отношение сигнал / шум в образцах с пониженным рейтингом по сравнению с образцами TAP высокой чистоты на самом деле полезно для последующего анализа с использованием количественного определения без метки (Keilhauer et al., 2015). Кроме того, во время очистки TAP значительное количество белка-приманки теряется во время двухэтапного протокола очистки. Следовательно, TAP обычно требует больше входного материала по сравнению с вытяжкой. Это может быть особенно проблематичным при заборе ткани определенного типа или экспериментальных условиях.Наконец, поскольку «выпадение» — это более короткая и менее исчерпывающая очистка (рис. 2), она увеличивает шансы удержания слабых или переходных взаимодействующих элементов, снижая частоту ложноотрицательных результатов. Однако, хотя аффинное обогащение быстро набирает силу в области AP / MS, это не означает, что подход TAP стал или станет устаревшим. Первоначально ТАП был разработан как метод очистки нативных белковых комплексов до высокой чистоты, что до сих пор является его главной сильной стороной. Высокое отношение сигнал / шум образцов TAP по сравнению с образцами с пониженным содержанием приводит к более высокой вероятности выявления субстехиометрически взаимодействующих элементов, которые в противном случае были бы скрыты более многочисленными фоновыми белками.Таким образом, в идеальных условиях следует применять как метод «pull-down», так и подход TAP / MS, чтобы полностью раскрыть потенциал того, что может предложить AP / MS при изучении белковых взаимодействий. Высокая чистота образцов ТАП также лучше подходит для возможных последующих применений, таких как in vitro для анализа активности с использованием очищенных комплексов или разделения очищенных субкомплексов с помощью гель-фильтрации.
Эндогенная маркировка
Как подчеркивалось ранее, выборка с использованием антитела, специфичного для белка-приманки, предлагает наиболее эндогенный способ идентификации взаимодействующих белков с помощью AP / MS.Однако технические трудности, связанные с этими специфическими антителами, ограничили их использование. Поэтому в большинстве экспериментов AP / MS используются слитые белки, которые можно иммобилизовать с помощью обычных антител. Для успешной очистки слитого белка одним из ключевых критериев является то, что слитый белок превосходит эндогенный белок за своих партнеров по взаимодействию. По идее, нацеливание на эндогенный ген, таким образом, сохраняя все эндогенные регуляторные элементы нетронутыми, является лучшим способом пометить интересующий белок.В простых биологических системах, таких как дрожжи, гены могут быть легко помечены в их эндогенном локусе с помощью HR (Baudin et al., 1993). У высших организмов, однако, эндогенная маркировка является гораздо более сложной задачей из-за гораздо более низкой эффективности HR (Puchta and Fauser, 2013). Это также верно для растений, за исключением мха Physcomitrella patens , который демонстрирует замечательную эффективность для интеграции трансгенов в заранее определенный локус посредством HR (Kamisugi et al., 2006). В Arabidopsis используются два метода, чтобы обойти неэффективный HR.Первый метод, который в основном используется в клеточных культурах, заключается в сверхэкспрессии белка-приманки с использованием сильного конститутивного промотора, такого как промотор 35S вируса мозаики цветной капусты. Однако этот метод сверхэкспрессии происходит за счет сокрытия дозировки физиологического гена, который может влиять на сворачивание белка и сложную сборку, что может приводить к аберрантным взаимодействиям белков и отсутствию взаимодействующих белков с низким содержанием, поскольку некомплексированный белок-приманка доминирует в образце очищенного белки (Гибсон и др., 2013). Второй метод использует трансформацию гибридного белка под контролем его эндогенного промотора на мутантном фоне. У Arabidopsis общепринято, что большинство регуляторных последовательностей типичного гена расположены в области размером 2–3 т.п.н. перед стартовым кодоном и в области 0,5–1 т.п.н. ниже стоп-кодона (Tian et al., 2004 г.). В настоящее время это метод выбора для Arabidopsis из-за доступности больших коллекций мутантов и того факта, что комплементация мутантного фенотипа гибридным белком может служить подтверждением функциональности гибридного белка.
Однако этот метод основан на доступности мутанта с полным нокаутом, поскольку любой остаточный эндогенный белок будет конкурировать с гибридным белком, а также на доступности эндогенного промотора. Более того, даже когда эндогенный промотор доступен, нельзя быть уверенным, что он содержит все необходимые цис- -регулирующие элементы. Следовательно, не исключение, что промоторы теряют часть своей функциональности при использовании в условиях трансгена. Как следствие, исследователи часто предпочитают использовать конститутивный промотор 35S для дополнения своей мутантной линии, даже если это может привести к выделению ложноположительных взаимодействующих веществ.У видов с менее хорошо аннотированными геномами еще сложнее предсказать, какие регуляторные элементы отвечают за правильную экспрессию гена, а коллекции мутантов обычно отсутствуют. Наконец, этот метод комплементации мутантов все еще основан на трансформации растений трансгеном, подвергая Т-ДНК позиционным эффектам геномных областей, окружающих сайт вставки, которые могут влиять на экспрессию слитого белка.
Альтернативным методом для достижения эндогенного мечения генов без необходимости использования HR в растениях является метод мечения генов, основанный на рекомбинации (Zhou et al., 2011). В этом методе используются бактериальные искусственные хромосомы, содержащие большие участки генома растения (десятки т.п.н.), в которых интересующий ген может быть помечен с помощью бактериальной системы рекомбинации HR. Преобразование этих бактериальных искусственных хромосом в мутантный фон эффективно приводит к замене эндогенного белка на меченый аналог, который экспрессируется со всеми его регулирующими элементами цис в неизменном виде. Этот метод использовался для исследования локализации белка во время определенных процессов развития, таких как дифференцировка клеток в корнях (Liberman et al., 2015; Moreno-Risueno et al., 2015) и передачу сигналов гормонов (Péret et al., 2012; Zhang W. et al., 2013; Band et al., 2014), но, насколько нам известно, применялся только один раз. для целей AP / MS у растений (Локдарши и др., 2016). Однако этот метод имеет очевидный недостаток, заключающийся в том, что он не только вводит представляющий интерес эндогенно меченый ген, но также и большую геномную область, окружающую этот ген, что может приводить к изменениям в дозировке гена.
Геномная инженерия растений на основе гомологичной рекомбинации является активной областью исследований уже более 20 лет.Со временем ученые использовали множество технологий для индукции двухцепочечных разрывов ДНК, что является предпосылкой для HR, в определенных участках генома, таких как нуклеазы цинковых пальцев, эффекторные нуклеазы, подобные активаторам транскрипции, и мегануклеазы (Steinert et al., 2016) . Используя эти технологии, стало возможным модифицировать эндогенные гены различных растительных организмов, таких как Brachypodium, рис, кукуруза и табак (Mahfouz et al., 2011; Shan et al., 2013; Zhang Y. et al., 2013). ). Однако развитие геномной инженерии CRISPR / Cas явно изменило правила игры в этой области.CRISPR / Cas обеспечивает беспрецедентную точность и эффективность в создании двухцепочечных разрывов ДНК в определенном геномном локусе и, кажется, работает почти для всех видов растений, протестированных на данный момент. Значительные успехи в использовании систем CRISPR / Cas для эндогенного мечения в растениях уже достигнуты, но эффективность все еще низкая, а обнаружение событий HR по-прежнему требует обширного и трудоемкого скрининга (Lokdarshi et al., 2016). Однако ожидается, что это только вопрос времени, когда станет возможным эффективное HR-опосредованное включение метки, что еще больше повысит AP / MS у растений.
Перспективы на будущее
По мере того, как ученые углубляются в понимание сетей PPI, участвующих в развитии растений, применяемые ими технологии постоянно развиваются. Постоянное повышение чувствительности масс-спектрометрии позволило исследователям начать отбор образцов из более специфических тканей, увеличивая разрешающую способность исходных материалов, используемых для экспериментов AP / MS. Одним из конкретных примеров того, как разрешающая способность развития может быть дополнительно увеличена, является внедрение метода, называемого «выделение ядер, помеченных в определенных типах клеток» (INTACT).INTACT использует двухкомпонентную систему с синтетическим белком, содержащим ядерную нацеливающую последовательность, GFP и пептид распознавания биотин-лигазы, который биотинилируется котрансформированной биотин-лигазой BirA. Используя пространственно или временно регулируемые промоторы для управления экспрессией этой системы, специфические подтипы ядер в интактных органах могут быть помечены биотином и очищены с использованием стрептавидиновой смолы (Deal and Henikoff, 2010). Этот метод уже применялся для выделения ядер, специфичных для клеточного типа, из корней Arabidopsis (Deal and Henikoff, 2010; Foley et al., 2017), ранний зародыш (Palovaara et al., 2017), эндосперм (Moreno-Romero et al., 2017) и корни томатов (Ron et al., 2014) и недавно был оптимизирован для использования в однодольных (Reynoso et al. др., 2018). Хотя о сочетании INTACT с AP / MS еще не сообщалось, эта технология позволит исследователям начать картирование ядерных PPI в зависимости от типа клеток.
AP / MS также находит свое применение в других модельных организмах. В идеальной ситуации ученые могли бы выбрать свою модельную систему исходя из ее биологической значимости и конкретных морфологических и физиологических характеристик или экономической важности в зависимости от процесса, который они хотят изучить.В действительности, однако, арабидопсис является предпочтительной моделью для экспериментов с AP / MS на растениях, главным образом из-за эффективности, с которой этот организм может трансформироваться. В настоящее время одним из самых серьезных препятствий для применения AP / MS к любому организму является необходимость стабильной трансформации с помощью слитого белка и, следовательно, эффективного протокола трансформации. Однако недавняя революция CRISPR / Cas вынуждает направить огромные объемы ресурсов на оптимизацию эффективности трансформации, особенно для сельскохозяйственных культур (Altpeter et al., 2016). Например, недавно было обнаружено, что сверхэкспрессия генов кукурузы Baby boom ( Bbm ) и Wuschel2 ( Wus2 ) может стимулировать эффективность трансформации кукурузы, сорго, сахарного тростника и риса (Lowe et al. , 2016). Кроме того, разрабатываются новые технологии, позволяющие обойти необходимость регенерации из тканевой культуры, которая по-прежнему является основным узким местом в большинстве протоколов трансформации. Например, магнитофекция, метод с использованием магнитных наночастиц в качестве носителей ДНК, недавно был применен для введения ДНК в пыльцу хлопка (Zhao et al., 2017). Последующее опыление с использованием магнитоактивной пыльцы позволило получить трансгенные семена, в результате чего были получены стабильно трансформированные растения. Поскольку растения производят большое количество пыльцы, которую также можно легко собрать, этот метод также можно легко перенести на другие виды растений.
В заключение, AP / MS как технология для растений достигла созревания, и ее обычно проводят на культурах клеток и проростках Arabidopsis. Мы продемонстрировали, что AP / MS использовалась для проверки in vivo взаимодействий, которые ранее были обнаружены только с использованием методов in vitro , а также является очень полезным инструментом для открытия нового понимания молекулярной функции белков.Как мы подчеркивали в этом обзоре, сочетание AP / MS с другими методами молекулярной биологии, такими как отбор образцов с высоким разрешением, количественная протеомика без меток или HR, позволит исследователям решать все более сложные биологические вопросы и вопросы развития. Таким образом, AP / MS несомненно выиграет от будущих разработок в других областях, таких как масс-спектрометрия, трансформация растений и геномная инженерия. Таким образом, будущее AP / MS в изучении развития растений заключается не только в постоянном улучшении протоколов AP / MS, но и во все большей интеграции AP / MS в более сложные экспериментальные рабочие процессы, чтобы максимизировать вероятность успеха и контекст развития результатов AP / MS.
Авторские взносы
МБ организовал и написал рукопись. JVL, AG, DE, HN, BDR и GDJ контролировали и дополняли написание.
Финансирование
Эта работа финансировалась Европейским исследовательским советом в рамках Седьмой рамочной программы Европейского сообщества [FP7 / 2007-2013] в соответствии с соглашением о гранте ERC No. [339341-AMAIZE] 11 и Исследовательским фондом Фландрии (FWO) (стипендии для докторантов JVL и AG, а также гранты Odysseus II G0D0515N и Post-doc 12D1815N для BDR.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим Анник Блейс за конструктивные комментарии к рукописи.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389 / fpls.2018.00640 / full # дополнительный материал
Сокращения
AP / MS, аффинная очистка в сочетании с масс-спектрометрией; BiFC, бимолекулярная комплементация флуоресценции; ко-IP, коиммунопреципитация; HR — гомологичная рекомбинация; ИПП — белок-белковое взаимодействие; ТАР, тандемная аффинная очистка; ТФ, фактор транскрипции; Y2H, двугибридный.
Список литературы
Абэ М., Фудзивара М., Куротани К.-И., Ёкои С. и Симамото К. (2008). Идентификация динамина как взаимодействия с рисом GIGANTEA методом тандемной аффинной очистки (TAP). Physiol растительных клеток. 49, 420–432. DOI: 10.1093 / Pcp / Pcn019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Альбертс Б. (1998). Клетка как совокупность белковых машин: подготовка следующего поколения молекулярных биологов. Cell 92, 291–294. DOI: 10.1016 / S0092-8674 (00) 80922-8
CrossRef Полный текст | Google Scholar
Альбрехт, К., Бутро, Ф., Сегонзак, К., Швессингер, Б., Хименес-Ибанез, С., Шиншилла, Д., и другие. (2012). Брассиностероиды ингибируют связанный с патогеном молекулярный паттерн иммунной сигнализации независимо от рецепторной киназы BAK1. Proc. Natl. Акад. Sci. США 109, 303–308. DOI: 10.1073 / pnas.1109
8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Альтпетер, Ф., Спрингер, Н. М., Бартли, Л. Е., Блехл, А. Е., Брутнелл, Т. П., Цитовски, В., и др. (2016). Продвижение трансформации сельскохозяйственных культур в эпоху редактирования генома. Растительная клетка 28, 1510–1520.DOI: 10.1105 / tpc.16.00196
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Андрианкаджа М., Дхондт С., Де Бодт С., Ванхерен Х., Коппенс Ф., Де Милде Л. и др. (2012). Выход из разрастания во время развития листа у Arabidopsis thaliana : процесс не такой постепенный. Dev. Cell 22, 64–78. DOI: 10.1016 / j.devcel.2011.11.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Антони, Р., Гонсалес-Гусман, М., Родригес, Л., Пейратс-Льобет, М., Пиццио, Г.А., Фернандес, М.А., и др. (2013). PYRABACTIN RESISTANCE1-LIKE8 играет важную роль в регуляции передачи сигналов абсцизовой кислоты в корнях. Plant Physiol. 161, 931–941. DOI: 10.1104 / стр.112.208678
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Band, L. R., Wells, D. M., Fozard, J. A., Ghetiu, T., French, A. P., Pound, M. P., et al. (2014). Системный анализ транспорта ауксина в верхушке корня Arabidopsis . Растительная клетка 26, 862–875. DOI: 10.1105 / tpc.113.119495
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бартлетт, М. Э. (2017). Изменение белок-белковых взаимодействий фактора транскрипции MADS-бокса как механизм создания морфологического разнообразия растений. Integr. Комп. Биол. 57, 1312–1321. DOI: 10.1093 / icb / icx067
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bassard, J.-E., Richert, L., Geerinck, J., Renault, H., Duval, F., Ullmann, P., et al. (2012). Белок-белковые и белок-мембранные ассоциации в лигниновом пути. Растительная клетка 24, 4465–4482. DOI: 10.1105 / tpc.112.102566
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боден, А., Озье-Калогеропулос, О., Денуэль, А., Лакрут, Ф., и Куллин, К. (1993). Простой и эффективный метод прямой делеции гена в Saccharomyces cerevisiae . Nucleic Acids Res. 21, 3329–3330.DOI: 10.1093 / nar / 21.14.3329
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bellati, J., Champeyroux, C., Hem, S., Rofidal, V., Krouk, G., Maurel, C., et al. (2016). Новые механизмы регуляции аквапоринов, выявленные с помощью интерактомики. Мол. Клетка. Протеомика 15, 3473–3487. DOI: 10.1074 / mcp.M116.060087
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Besbrugge, N., Van Leene, J., Eeckhout, D., Cannoot, B., Kulkarni, S.R., De Winne, N., et al. (2018). GSyellow, метка швейцарского ножа для функционального анализа белков у однодольных и двудольных растений. Plant Physiol. [Epub перед печатью]. DOI: 10.1104 / стр. 18.00175
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кокс, Дж., И Манн, М. (2008). MaxQuant обеспечивает высокую скорость идентификации пептидов, индивидуальную точность измерения масс в диапазоне p.p.b. и количественное определение белка в масштабе всего протеома. Nat. Biotechnol. 26, 1367–1372. DOI: 10.1038 / nbt.1511
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Рыбель, Б., Мёллер, Б., Йошида, С., Грабович, И., Де Рейл, П. Б., Берен, С., и др. (2013). Комплекс bHLH контролирует формирование эмбриональной сосудистой ткани и неопределенный рост у Arabidopsis . Dev. Ячейка 24, 426–437. DOI: 10.1016 / j.devcel.2012.12.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дил, Р. Б., и Хеникофф, С.(2010). Простой метод экспрессии генов и профилирования хроматина отдельных типов клеток в ткани. Dev. Ячейка 18, 1030–1040. DOI: 10.1016 / j.devcel.2010.05.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дебернарди, Дж. М., Меккья, М. А., Веркрюссен, Л., Смачняк, К., Кауфманн, К., Инзе, Д., и др. (2014). Посттранскрипционный контроль факторов транскрипции GRF с помощью микроРНК miR396 и соактиватора GIF влияет на размер и продолжительность жизни листа. Plant J. 79, 413–426. DOI: 10.1111 / tpj.12567
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дедекер, М., Ван Лин, Дж., И Де Джагер, Г. (2015). Раскрытие молекулярных механизмов растений с помощью аффинной очистки в сочетании с масс-спектрометрией. Curr. Opin. Plant Biol. 24, 1–9. DOI: 10.1016 / j.pbi.2015.01.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дедекер, М., Ван Лин, Дж., Де Винн, Н., Eeckhout, D., Persiau, G., Van De Slijke, E., et al. (2016). Перенос оптимизированного набора инструментов TAP для выделения белковых комплексов в набор рисовых салфеток. Завод Мол. Биол. 91, 341–354. DOI: 10.1007 / s11103-016-0471-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Элой, Н. Б., Гонсалес, Н., Ван Леен, Дж., Мале, К., Ванхерен, Х., Де Милде, Л. и др. (2012). SAMBA, специфический для растений комплекс / регулятор циклосомы, стимулирующий анафазу, участвует в раннем развитии и стабилизации циклинов А-типа. Proc. Natl. Акад. Sci. США 109, 13853–13858. DOI: 10.1073 / pnas.1211418109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фернандес-Кальво, П., Чини, А., Фернандес-Барберо, Г., Чико, Ж.-М., Хименес-Ибанес, С., Геринк, Дж. И др. (2011). Факторы транскрипции MYC3 и MYC4 bHLH Arabidopsis являются мишенями для репрессоров JAZ и действуют аддитивно с MYC2 при активации жасмонатных ответов. Растительная клетка 23, 701–715. DOI: 10,1105 / тпк.110.080788
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фолей, С. В., Госай, С. Дж., Ван, Д., Селамоглу, Н., Соллитти, А. К., Кёстер, Т. и др. (2017). Глобальный взгляд на взаимодействия РНК-белок позволяет идентифицировать посттранскрипционные регуляторы судьбы корневых волосковых клеток. Dev. Ячейка 41, 204.e5–220.e5. DOI: 10.1016 / j.devcel.2017.03.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гадейн, А., Санчес-Родригес, К., Ваннест, С., Ди Руббо, С., Заубер, Х., Ваннест, К. и др. (2014). Адаптерный комплекс TPLATE запускает клатрин-опосредованный эндоцитоз у растений. Cell 156, 691–704. DOI: 10.1016 / j.cell.2014.01.039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Geerinck, J., Pauwels, L., De Jaeger, G., and Goossens, A. (2010). Рассечение белкового комплекса одного мегадальтона JAZ1. Завод Сигнал. Behav. 5, 1039–1041. DOI: 10.4161 / psb.5.8.12338
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Глаттер, Т., Шиттенхельм, Р. Б., Риннер, О., Рогуска, К., Вепф, А., Юнгер, М. А., и др. (2011). Модульность и гормональная чувствительность рецептора инсулина Drosophila melanogaster / мишени протеома взаимодействия рапамицина. Мол. Syst. Биол. 7: 547. DOI: 10.1038 / msb.2011.79
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Goossens, J., De Geyter, N., Walton, A., Eeckhout, D., Mertens, J., Pollier, J., et al. (2016). Выделение белковых комплексов из модельного бобового растения Medicago truncatula путем тандемной аффинной очистки в культурах волосистых корней. Plant J. 88, 476–489. DOI: 10.1111 / tpj.13258
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гоу, Дж. У., Кригсвельд, Дж., И Хек, А. Дж. Р. (2010). Количественная протеомика путем метаболического мечения модельных организмов. Мол. Клетка. Протеомика 9, 11–24. DOI: 10.1074 / mcp.R
1-MCP200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хо Ким, Дж., И Цукая, Х. (2015). Регулирование роста и развития растений дуэтом ФАКТОР, РЕГУЛИРУЮЩИЙ РОСТ и ФАКТОР, ВЗАИМОДЕЙСТВУЮЩИЙ с GRF. J. Exp. Бот. 66, 6093–6107. DOI: 10.1093 / jxb / erv349
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоригучи Г., Ким Г.-Т. и Цукая Х. (2005). Фактор транскрипции AtGRF5 и коактиватор транскрипции AN3 регулируют пролиферацию клеток в зачатках листьев Arabidopsis thaliana . Plant J. 43, 68–78. DOI: 10.1111 / j.1365-313X.2005.02429.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг, Х., Альварес, С., Биндбойтель, Р., Шен, З., Налдретт, М. Дж., Эванс, Б. С. и др. (2016). Идентификация белков, ассоциированных с вечерним комплексом, в Arabidopsis thaliana с помощью аффинной очистки и масс-спектрометрии. Мол. Клетка. Протеомика 15, 201–217. DOI: 10.1074 / mcp.M115.054064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джемге, С., Ангенент, Г. К., и Бемер, М. (2018). Идентификация межбелковых взаимодействий in planta с помощью IP-MS. Methods Mol. Биол. 1675, 315–329. DOI: 10.1007 / 978-1-4939-7318-7_18
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камисуги, Ю., Шлинк, К., Ренсинг, С.А., Швин, Г., фон Штакельберг, М., Куминг, А.С., и др. (2006). Механизм нацеливания гена в Physcomitrella patens : гомологичная рекомбинация, конкатенация и множественная интеграция. Nucleic Acids Res. 34, 6205–6214. DOI: 10.1093 / nar / gkl832
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кейльхауэр, Э.К., Хайн М. Ю., Манн М. (2015). Точное извлечение белкового комплекса с помощью масс-спектрометрии с обогащением по аффинности (AE-MS), а не с помощью масс-спектрометрии с аффинной очисткой (AP-MS). Мол. Клетка. Протеомика 14, 120–135. DOI: 10.1074 / mcp.M114.041012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким Д. И., Дженсен С. С., Нобл К. А., Бирендра К. К., Ру К. Х., Мотамедчабоки К. и др. (2016). Улучшенная биотин-лигаза меньшего размера для бесконтактной маркировки BioID. Мол. Биол. Ячейка 27, 1188–1196. DOI: 10.1091 / mbc.E15-12-0844
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, Дж. Х., и Кенде, Х. (2004). Коактиватор транскрипции, AtGIF1, участвует в регуляции роста и морфологии листьев Arabidopsis . Proc. Natl. Акад. Sci. США 101, 13374–13379. DOI: 10.1073 / pnas.0405450101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
König, A.-C., Hartl, M., Pham, P.A., Laxa, M., Boersema, P.J., Orwat, A., et al. (2014). Сиртуин Arabidopsis класса II представляет собой лизиндеацетилазу и взаимодействует с энергетическим метаболизмом митохондрий. Plant Physiol. 164, 1401–1414. DOI: 10.1104 / стр.113.232496
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лян, Г., Хе, Х., Ли, Ю., Ван, Ф., и Ю, Д. (2014). Молекулярный механизм микроРНК396, опосредующей развитие пестика у Arabidopsis. Plant Physiol. 164, 249–258. DOI: 10.1104 / стр.113.225144
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Либерман, Л. М., Спаркс, Э. Э., Морено-Рисуено, М. А., Петричка, Дж. Дж., И Бенфей, П. Н. (2015). MYB36 регулирует переход от пролиферации к дифференцировке в корне Arabidopsis. Proc. Natl. Акад. Sci. США 112, 12099–12104. DOI: 10.1073 / pnas.1515576112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lin, Q., Чжоу, З., Ло, В., Фанг, М., Ли, М., и Ли, Х. (2017). Скрининг проксимальных и взаимодействующих белков в протопластах риса с помощью зависимого от близости биотинилирования. Фронт. Plant Sci. 8: 749. DOI: 10.3389 / fpls.2017.00749
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю С., Ю, Ф., Ян, З., Ван, Т., Сюн, Х., Чанг, К. и др. (2018). Создание количественной ацетилпротеомики на основе диметилового мечения у Arabidopsis. Мол. Клетка. Протеомика DOI: 10.1074 / mcp.RA117.000530 [EPUB перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Локдарши А., Коннер В. К., Макклинток К., Ли Т. и Робертс Д. М. (2016). Arabidopsis CML38, сенсор кальция, который локализуется в рибонуклеопротеидных комплексах в условиях гипоксического стресса. Plant Physiol. 170, 1046–1059. DOI: 10.1104 / стр.15.01407
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лоу, К., Ву, Э., Ван, Н., Хёрстер, Г., Hastings, C., Cho, M.-J., et al. (2016). Морфогенные регуляторы Baby boom и Wuschel улучшают трансформацию однодольных. Растительная клетка 28, 1998–2015. DOI: 10.1105 / tpc.16.00124
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Махфуз, М. М., Ли, Л., Шамимуззаман, М., Вибово, А., Фанг, X. и Чжу, Ж.-К. (2011). Созданная de novo гибридная нуклеаза, подобная активатору транскрипции (TALE), с новой специфичностью связывания ДНК, создает двухцепочечные разрывы. Proc. Natl. Акад. Sci. США 108, 2623–2628. DOI: 10.1073 / pnas.101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Меллачеруву, Д., Райт, З., Кузенс, А. Л., Ламберт, Ж.-П., Сен-Дени, Н. А., Ли, Т. и др. (2013). CRAPome: хранилище загрязняющих веществ для данных аффинной очистки и масс-спектрометрии. Nat. Методы 10, 730–736. DOI: 10.1038 / Nmeth.2557
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Менгес, М., и Мюррей, Дж. А. Х. (2002). Синхронные суспензионные культуры Arabidopsis для анализа активности генов клеточного цикла. Plant J. 30, 203–212. DOI: 10.1046 / j.1365-313X.2002.01274.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Менгес М. и Мюррей Дж. А. Х. (2004). Криоконсервация трансформированных культур Arabidopsis дикого типа и суспензионных культур клеток табака. Plant J. 37, 635–644. DOI: 10.1046 / j.1365-313X.2003.01980.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Минкофф Б. Б., Берч Х. Л. и Сассман М. Р. (2014). Конвейер для метаболического мечения 15N и анализа фосфопротеома в Arabidopsis thaliana . Methods Mol. Биол. 1062, 353–379. DOI: 10.1007 / 978-1-62703-580-4_19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Морено-Рисуено, М.А., Соццани, Р., Ярдымчи, Г.Г., Петричка, Дж. Дж., Верну, Т., Blilou, I., et al. (2015). Транскрипционный контроль образования ткани на протяжении всего развития корня. Наука 350, 426–430. DOI: 10.1126 / science.aad1171
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Морено-Ромеро, Дж., Сантос-Гонсалес, Дж., Хенниг, Л., и Келер, К. (2017). Применение метода INTACT для очистки ядер эндосперма и создания профилей эпигенома, специфичных для родителей. Nat. Protoc. 12, 238–254. DOI: 10.1038 / nprot.2016.167
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моррис, Дж.H., Knudsen, G.M., Verschueren, E., Johnson, J. R., Cimermancic, P., Greninger, A. L., et al. (2014). Аффинная очистка — масс-спектрометрия и сетевой анализ для понимания белок-белковых взаимодействий. Nat. Protoc. 9, 2539–2554. DOI: 10.1038 / nprot.2014.164
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mravec, J., Petrášek, J., Li, N., Boeren, S., Karlova, R., Kitakura, S., et al. (2011). Ограниченная на клеточной пластине ассоциация белков DRP1A и PIN необходима для установления клеточной полярности у Arabidopsis . Curr. Биол. 21, 1055–1060. DOI: 10.1016 / j.cub.2011.05.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Налламилли, Б. Р., Чжан, Дж., Муджахид, Х., Мэлоун, Б. М., Бриджес, С. М., и Пэн, З. (2013). Ген OsFIE2 группы поликомб регулирует развитие семян риса ( Oryza sativa ) и наполнение зерна посредством механизма, отличного от Arabidopsis . PLoS Genet. 9: e1003322. DOI: 10.1371 / journal.pgen.1003322
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Née, G., Kramer, K., Nakabayashi, K., Yuan, B., Xiang, Y., Miatton, E., et al. (2017). ЗАДЕРЖКА ПРОРАСТИВАНИЯ1 требует фосфатаз PP2C сигнального пути ABA для контроля покоя семян. Nat. Commun. 8:72. DOI: 10.1038 / s41467-017-00113-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Nelissen, H., Eeckhout, D., Demuynck, K., Persiau, G., Walton, A., Van Bel, M., et al. (2015). Динамические изменения в составе комплекса ANGUSTIFOLIA3 раскрывают механизм регуляции роста листа кукурузы. Растительная клетка 27, 1605–1619. DOI: 10.1105 / tpc.15.00269
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Nishikiori, M., Mori, M., Dohi, K., Okamura, H., Katoh, E., Naito, S., et al. (2011). Небольшой GTP-связывающий белок хозяина ARL8 играет решающую роль в репликации РНК тобамовируса. PLoS Pathog. 7: e1002409. DOI: 10.1371 / journal.ppat.1002409
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нодзинский, Т., Ферару, М.I., Hirsch, S., De Rycke, R., Niculaes, C., Boerjan, W., et al. (2013). Ретромерные субъединицы VPS35A и VPS29 опосредуют функцию предвакуолярного компартмента (PVC) у Arabidopsis . Мол. Завод 6, 1849–1862 гг. DOI: 10.1093 / mp / sst044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Охад Н., Яловский С. (2010). Использование бимолекулярной флуоресцентной комплементации (BiFC) для анализа межбелкового взаимодействия в растениях. Methods Mol. Биол. 655, 347–358.DOI: 10.1007 / 978-1-60761-765-5_23
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Омидбахшфард, М., Проост, С., Фуджикура, У., и Мюллер-Робер, Б. (2015). Факторы, регулирующие рост (GRF): небольшое семейство факторов транскрипции, выполняющих важные функции в биологии растений. Мол. Завод 8, 998–1010. DOI: 10.1016 / j.molp.2015.01.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паловаара, Дж., Сайга, С., Вендрих, Дж.R., Van ’T Wout Hofland, N., Van Schayck, J.P., Hater, F., et al. (2017). Динамика транскриптома, выявленная с помощью атласа экспрессии генов раннего эмбриона Arabidopsis . Nat. Растения 3, 894–904. DOI: 10.1038 / s41477-017-0035-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пауэлс, Л., Барберо, Г. Ф., Геринк, Дж., Тиллеман, С., Грюневальд, В., Куэльяр Перес, А., и др. (2010). NINJA соединяет корепрессор TOPLESS с сигнализацией jasmonate. Природа 464, 788–791. DOI: 10.1038 / nature08854
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перет Б., Сваруп К., Фергюсон А., Сет М., Янг Ю., Дондт С. и др. (2012). Гены AUX / LAX кодируют семейство переносчиков притока ауксина, которые выполняют различные функции во время развития Arabidopsis . Растительная клетка 24, 2874–2885. DOI: 10.1105 / tpc.112.097766
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пертль-Обермейер, Х., Шульце, В. X., и Обермейер, Г. (2014). Сшивание in vivo в сочетании с масс-спектрометрическим анализом выявляет рецептор-подобные киназы и сигнальные белки Ca2 + в качестве предполагаемых партнеров по взаимодействию H + АТФаз плазматической мембраны пыльцы. J. Proteomics 108, 17–29. DOI: 10.1016 / j.jprot.2014.05.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Подвойски, К., Эйзенахер, М., Коль, М., Туревич, М., Мейер, Х. Э., Рахненфюрер, Дж. И др. (2010). Peek a peak: взгляд на статистику количественной протеомики без меток. Expert Rev. Proteomics 7, 249–261. DOI: 10.1586 / EPR.09.107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ци Ю. и Катагири Ф. (2009). Очистка низко-распространенных белковых комплексов плазматической мембраны Arabidopsis и идентификация компонентов-кандидатов. Plant J. 57, 932–944. DOI: 10.1111 / j.1365-313X.2008.03736.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рис, Дж. С., Ли, X.-W., Перретт, С., Лилли, К.С., и Джексон, А.П. (2015). Белковые соседи и протеомика близости. Мол. Клетка. Протеомика 14, 2848–2856. DOI: 10.1074 / mcp.R115.052902
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рейносо, М., Паулуцци, Г., Каяла, К., Кабанлит, С., Веласко, Дж., Базен, Дж. И др. (2018). Ядерные транскриптомы в высоком разрешении с использованием переработанного INTACT. Plant Physiol. 176, 270–281. DOI: 10.1104 / стр.17.00688
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рохила, Дж.С., Чен, М., Черни, Р., Фромм, М. Э. (2004). Улучшенная тандемная метка аффинной очистки и методы выделения гетерокомплексов белков из растений. Plant J. 38, 172–181. DOI: 10.1111 / j.1365-313X.2004.02031.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рон, М., Кайала, К., Паулуцци, Г., Ван, Д., Рейносо, М.А., Зумштейн, К., и др. (2014). Трансформация волосистых корней с использованием Agrobacterium rhizogenes в качестве инструмента для изучения экспрессии и функции генов, специфичных для клеточного типа, с использованием томата в качестве модели. Plant Physiol. 166, 455–469. DOI: 10.1104 / стр.114.239392
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ру, К. Дж. (2013). Отмечено ассоциацией: методы зависимого от близости мечения белков в эукариотических клетках. Cell. Мол. Life Sci. 70, 3657–3664. DOI: 10.1007 / s00018-013-1287-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ру, К. Дж., Ким, Д. И., Райда, М., и Берк, Б. (2012). Слитый белок с неразборчивой биотин-лигазой идентифицирует проксимальные и взаимодействующие белки в клетках млекопитающих. J. Cell Biol. 196, 801–810. DOI: 10.1083 / jcb.201112098
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рубио В., Шен Ю., Сайджо Ю., Лю Ю., Гусмароли Г., Динеш-Кумар С. П. и др. (2005). Альтернативная стратегия тандемной аффинной очистки, применяемая для выделения белкового комплекса Arabidopsis. Plant J. 41, 767–778. DOI: 10.1111 / j.1365-313X.2004.02328.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раймен, Б., Коппенс, Ф., Дондт, С., Фиорани, Ф., и Бемстер, Г. Т. С. (2010). Кинематический анализ деления и разрастания клеток. Methods Mol. Биол. 655, 203–227. DOI: 10.1007 / 978-1-60761-765-5_14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Shan, Q., Wang, Y., Chen, K., Liang, Z., Li, J., Zhang, Y., et al. (2013). Быстрая и эффективная модификация генов риса и Brachypodium с использованием TALEN. Мол. Завод 6, 1365–1368. DOI: 10.1093 / mp / sss162
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Smaczniak, C., Имминк, Р. Г. Х., Муиньо, Дж. М., Бланвиллен, Р., Бушер, М., Бюшер-Ланге, Дж. И др. (2012a). Характеристика комплексов факторов транскрипции MADS-домен в развитии цветка арабидопсиса. Proc. Natl. Акад. Sci. США 109, 1560–1565. DOI: 10.1073 / pnas.1112871109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Smaczniak, C., Li, N., Boeren, S., America, T., Van Dongen, W., Goerdayal, S. S., et al. (2012b). Идентификация на основе протеомики сигнальных и регуляторных белковых комплексов с низким содержанием в природных растительных тканях. Nat. Protoc. 7, 2144–2158. DOI: 10.1038 / nprot.2012.129
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шпехт, К. Д., Бартлетт, М. Э. (2009). Эволюция цветка: происхождение и последующее разнообразие цветков покрытосеменных. Annu. Rev. Ecol. Evol. Syst. 40, 217–243. DOI: 10.1146 / annurev.ecolsys.110308.120203
CrossRef Полный текст | Google Scholar
Steinert, J., Schiml, S., and Puchta, H. (2016). Геномная инженерия растений, индуцированная двухцепочечным разрывом на основе гомологии. Plant Cell Rep. 35, 1429–1438. DOI: 10.1007 / s00299-016-1981-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тейсен, Г., Мельцер, Р., Рюмплер, Ф. (2016). Факторы транскрипции MADS-домена и модель цветочного квартета развития цветов: связь развития и эволюции растений. Разработка 143, 3259–3271. DOI: 10.1242 / dev.134080
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тиан, Г.-В., Моханти, А., Чари, С. Н., Ли, С., Паап, Б., Дракакаки, Г. и др. (2004). Высокопроизводительное флуоресцентное мечение полноразмерных генных продуктов Arabidopsis in planta. Plant Physiol. 135, 25–38. DOI: 10.1104 / стр.104.040139
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тригг С.А., Гарза Р.М., Маквиллиамс А., Нери Дж. Р., Бартлетт А., Кастанон Р. и др. (2017). CrY2H-seq: массивный мультиплексный анализ для картирования взаимодействий с глубоким охватом. Nat. Методы 14, 819–825.DOI: 10.1038 / nmeth.4343
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цугама Д., Лю С. и Такано Т. (2014). Анализ функций VIP1 и его близких гомологов в осмосенсорных ответах Arabidopsis thaliana . PLoS One 9: e103930. DOI: 10.1371 / journal.pone.0103930
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тянова С., Тему Т., Кокс Дж. (2016). Вычислительная платформа MaxQuant для протеомики дробовика на основе масс-спектрометрии. Nat. Protoc. 11, 2301–2319. DOI: 10.1038 / nprot.2016.136
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Дамм, Д., Кутуэр, С., Де Рике, Р., Буге, Ф.-Й., Инзе, Д., и Гилен, Д. (2006). Соматический цитокинез и созревание пыльцы у Arabidopsis зависят от TPLATE, который имеет домены, подобные белкам оболочки. Растительная клетка 18, 3502–3518. DOI: 10.1105 / tpc.106.040923
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Лин, Дж., Бломм, Дж., Кулкарни, С. Р., Кэннот, Б., Де Винн, Н., Экхаут, Д. и др. (2016). Функциональная характеристика транскрипционного фактора Arabidopsis bZIP29 показывает его роль в развитии листьев и корней. J. Exp. Бот. 67, 5825–5840. DOI: 10.1093 / jxb / erw347
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Лин, Дж., Экхаут, Д., Кэннот, Б., Де Винн, Н., Персиу, Г., Ван Де Слейке, Э. и др. (2015). Усовершенствованный набор инструментов для раскрытия клеточного аппарата растений путем тандемной аффинной очистки белковых комплексов Arabidopsis . Nat. Protoc. 10, 169–187. DOI: 10.1038 / nprot.2014.199
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Лин, Дж., Холлундер, Дж., Экхаут, Д., Персиу, Г., Ван Де Слейке, Э., Стальс, Х. и др. (2010). Целенаправленная интерактомика выявляет сложный аппарат ядра клеточного цикла у Arabidopsis thaliana . Мол. Syst. Биол. 6: 397. DOI: 10.1038 / msb.2010.53
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Лин, Дж., Stals, H., Eeckhout, D., Persiau, G., Van De Slijke, E., Van Isterdael, G., et al. (2007). Технологическая платформа на основе тандемной аффинной очистки для изучения взаимодействия клеточного цикла у Arabidopsis thaliana . Мол. Клетка. Протеомика 6, 1226–1238. DOI: 10.1074 / mcp.M700078-MCP200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Лин, Дж., Виттерс, Э., Инзе, Д., и Де Джагер, Г. (2008). Повышение тандемной аффинной очистки растительных белковых комплексов. Trends Plant Sci. 13, 517–520. DOI: 10.1016 / j.tplants.2008.08.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vercruyssen, L., Verkest, A., Gonzalez, N., Heyndrickx, K. S., Eeckhout, D., Han, S.-K., et al. (2014). ANGUSTIFOLIA3 связывается с комплексами ремоделирования хроматина SWI / SNF для регулирования транскрипции во время развития листьев Arabidopsis . Растительная клетка 26, 210–229. DOI: 10.1105 / tpc.113.115907
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вендрих, Дж.Р., Берен, С., Мёллер, Б. К., Вейерс, Д., и Де Рибель, Б. (2017). Идентификация комплексов белков растений in vivo с помощью IP-MS / MS. Methods Mol. Биол. 1497, 147–158. DOI: 10.1007 / 978-1-4939-6469-7_14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уилс, К. Р., и Кауфманн, К. (2017). Генно-регуляторные сети, контролирующие соцветие и развитие цветков Arabidopsis thaliana . Biochim. Биофиз. Acta 1860, 95–105.DOI: 10.1016 / j.bbagrm.2016.07.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Yu, H., Braun, P., Yildirim, M. A., Lemmens, I., Venkatesan, K., Sahalie, J., et al. (2008). Качественная бинарная карта взаимодействия белков сети взаимодействия дрожжей. Наука 322, 104–110. DOI: 10.1126 / science.1158684
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, W., Swarup, R., Bennett, M., Schaller, G.E., and Kieber, J.J. (2013). Цитокинин индуцирует деление клеток в неподвижном центре апикальной меристемы корня Arabidopsis . Curr. Биол. 23, 1979–1989. DOI: 10.1016 / j.cub.2013.08.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, Y., Zhang, F., Li, X., Baller, J. A., Qi, Y., Starker, C.G., et al. (2013). Эффекторные нуклеазы, подобные активаторам транскрипции, обеспечивают эффективную инженерию генома растений. Plant Physiol. 161, 20–27. DOI: 10.1104 / pp.112.205179
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhao, X., Meng, Z., Wang, Y., Chen, W., Sun, C., Cui, B., et al. (2017). Магнитофекция пыльцы для генетической модификации с использованием магнитных наночастиц в качестве носителей генов. Nat. Растения 3, 956–964. DOI: 10.1038 / s41477-017-0063-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжун, Дж., Хейнс, П. А., Чжан, С., Янг, X., Андон, Н. Л., Эккерт, Д., и др.(2003). Разработка системы для изучения белок-белковых взаимодействий in planta: характеристика комплекса связывающих белков TATA-бокса в Oryza sativa . J. Proteome Res. 2, 514–522. DOI: 10.1021 / pr034023z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу Р., Бенавенте Л. М., Степанова А. Н. и Алонсо Дж. М. (2011). Система мечения генов Arabidopsis, основанная на рекомбинации. Plant J. 66, 712–723. DOI: 10.1111 / j.1365-313X.2011.04524.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сохранение и изменчивость белков синаптонемных комплексов в филогенезе эукариот
Проблемы происхождения и эволюции мейоза включают загадочную изменчивость синаптонемных комплексов (СК), которые, будучи сходными по морфологии, состоят из разных белков в разных типах эукариот. Используя методы биоинформатики, мы отслеживали все доступные эукариотические протеомы, чтобы найти белки, похожие на известные SC-белки модельных организмов.Мы обнаружили белки, сходные с белками боковых элементов SC (LE) и обладающие доменом HORMA в большинстве таксонов эукариот, и считаем их наиболее древними среди всех белков SC. Было доказано, что белки LE позвоночных SYCP2, SYCP3 и SC65 имеют родственные белки во многих таксонах беспозвоночных. Белки центрального пространства SC наиболее эволюционно изменчивы. Это означает, что для соединения LE могут существовать разные белок-белковые взаимодействия. Белки, аналогичные известным SC-белкам, не обнаружены у Euglenophyta, Chrysophyta, Charophyta, Xanthophyta, Dinoflagellata и примитивных Coelomata.Мы пришли к выводу, что разные белки, общей чертой которых является наличие доменов с определенной конформацией, участвуют в формировании СК в разных типах эукариот. Это позволяет проводить целенаправленный поиск ортологов белков SC с использованием филогенетических деревьев. Здесь мы рассматриваем пример филогенетических деревьев для простейших, грибов, водорослей, мхов и цветковых растений.
1. Введение
Мейоз — это деление клеток зародышевой линии, которое включает рекомбинацию генетического материала и сегрегацию гомологичных хромосом, что приводит к образованию гаплоидных гамет из диплоидной клетки, в то время как митоз сохраняет исходное количество хромосом в обеих дочерних клетках. .Мейоз — обязательный компонент полового процесса у эукариот. Возникновение и эволюция механизма мейоза и белков, участвующих в мейотических процессах, являются предметом обсуждения [1–6].
Принципиальная разница между результатами мейоза и митоза определяется их различием в генетическом контроле, структуре хромосом и поведении хромосом. Различие на ультраструктурном уровне проявляется в формировании специфичных для мейоза синаптонемных комплексов (SCs), ультраструктур, которые объединяют гомологичные хромосомы в биваленты во время стадии пахитены мейотической профазы I у подавляющего большинства эукариот.СК необходим для специфической организации профазных мейотических хромосом [7–9], синапсов гомологичных хромосом [7, 10, 11] и количества хиазм на одну СК, достаточного для регулярной сегрегации гомологов [8, 12].
СК образуются из белков, специфичных для мейоза [11, 13, 14]. Общая организация СК более или менее схожа у всех исследованных в этом отношении эукариот, тогда как ультраструктура его морфологических компонентов несколько различается [8, 15]. Помимо ультраструктурных вариаций, было обнаружено низкое сходство, если оно вообще было обнаружено, между специфическими белками, которые создают SCs у растений, грибов и животных [11, 14, 16].Это означает, что функциональная консервация белков как материала для построения SC не связана с гомологией их аминокислотных последовательностей. Таким образом, общую картину можно предположительно представить следующим образом. Негомологичные белки образуют СК, которые представляют собой довольно консервативные ультраструктуры мейоцитов и выполняют общую функцию в ходе мейоза у эукариотических организмов [4]. До сих пор остается загадкой, как очень разные белки могут создавать внутриклеточные структуры с принципиально сходной морфологией и функцией.
Стоит рассмотреть несколько деталей разнообразия белков SC. Боковые элементы (БЭ) СК формируются на основе хромосомных осевых элементов, которые соединяют сестринские хроматиды и состоят в основном из когезинов [17]. LE соединяются вместе, образуя целостную структуру SC с помощью застежки-молния из поперечных волокон, которые проходят через центральное пространство SC. Головки поперечных нитей перекрываются в середине центрального пространства, образуя центральный элемент (ЦЭ) СК [4, 13].
Различные специфичные для мейоза белки СК синтезируются в генеративных клетках накануне или в ходе ранних стадий мейоза [17, 18]. Поскольку были идентифицированы первые SC-белки, дрожжевые Hop1 и Zip1 [19–21], SYCP1 грызунов [22, 23], SYCP2 [24] и SYCP3 [23, 25], SC-белки, которые будут универсальными для всех эукариот. разыскиваются методами биоинформатики. Однако было обнаружено, что белок центрального пространства SC млекопитающих SYCP1 негомологичен белку центрального пространства SC дрожжей Zip1 [26].Их функциональный аналог в растениях, ZYP1 из Arabidopsis , имеет только 20% идентичности с двумя предыдущими белками [27, 28]. То же самое верно для белка Drosophila , кодируемого геном c (3) G [29, 30], и для нематоды SYP-1 [31]. Вторичная структура некоторых частей полипептидных цепей всех этих белков — лишь их общая черта; то есть все они имеют глобулярные домены на N- и C-концах и центральный α -спиральный домен. Длинная α -спираль (спиральная спираль) придает молекуле стержневую форму [10, 32, 33], которая необходима для образования поперечных филаментов в центральном пространстве СК.Мышиные низкомолекулярные белки, которые модифицируют структуру центрального пространства SC (SYCE1, SYCE2, SYCE3 и TEX12), изначально считались имеющими только ортологи позвоночных [34–36].
Белки LE млекопитающих SYCP2 и SYCP3 имеют лишь небольшое сходство с их аналогами дрожжей (Hop1, Red1), нематодами (HIM-3) и Arabidopsis (ASY1), идентифицированными совсем недавно [23, 37-40] . Домен HORMA — единственное свойство, общее для некоторых белков SC LE. Таким образом, СК сходны по общей морфологии (структурному плану), но различаются ультраструктурой и состоят из разных белков у дрожжей, нематод, Drosophila , млекопитающих и Arabidopsis .Эти организмы в дальнейшем называются моделями для изучения белков SC.
Рамеш и др. [3] провели интересное исследование по поиску ортологов ключевых белков мейоза в протеомах архей, бактерий и 15 эукариот различных таксонов от простейших до человека. Из всех структурных мейотических белков в анализ был включен только компонент LE Hop1. Ортологи Hop1 были обнаружены почти у всех исследованных видов, включая человека и мышь. Белок мыши был идентифицирован как HORMAD1, который рассматривается ниже.
Fraune et al. [41] сделали следующий шаг и обнаружили ортологи SYCP1 и SYCP3 в протеомах различных таксонов многоклеточных животных, включая Placozoa, Porifera и Coelenterata. В качестве запросов использовались фрагменты белков, идентифицированные как наиболее консервативные, а не общие аминокислотные последовательности. Биоинформатический поиск был дополнен экспериментальной проверкой на примере Hydra . В недавнем исследовании Fraune et al. [42] расширили свои эксперименты и проследили происхождение белков, структурирующих центральное пространство СК.Они обнаружили, что SYCE2 и TEX12 консервативны у Metazoa, SYCE1 появляется у Bilateria, а SYCE3 специфичен для Vertebrata.
Наша гипотеза состоит в том, что гомология некоторых полипептидных доменов, а не гомология целых белков является критической для построения ультраструктурных компонентов SCs в отдаленных таксонах. Основная цель нашей работы состояла в поиске протеомов различных таксонов эукариот, особенно тех, которые еще не были исследованы ранее, таких как различные одноклеточные животные, водоросли, низшие грибы, мхи и некоторые другие, для белков и их доменов, подобных SC-белкам модельные организмы.При поиске родственных белков в протеомах основных таксонов эукариот в одном исследовании мы впервые рассмотрели почти все известные SC-белки модельных организмов. Мы получили большой список белков, которые могут служить потенциальным источником для целенаправленного поиска ортологов белков SC с использованием филогенетических деревьев, и построили примерные деревья для групп организмов, пока плохо изученных в этом отношении.
2. Материалы и методы
Всего было протестировано около 11 миллионов белков из примерно 5000 протеомов всех основных эукариотических групп.Использовалась таксономия, доступная из базы данных NCBI (http://www.ncbi.nlm.nih.gov/). Белки SC семи модельных видов эукариот, а именно дрожжей Schizosaccharomyces pombe и Saccharomyces cerevisiae, растений Arabidopsis thaliana, нематоды Caenorhabditis elegans , насекомых Drosophila , Drosophila , Drosophila melio , насекомых Drosophila musculus (как наиболее частые объекты в исследованиях мейоза) использовались в качестве запросов при сравнении с указанными выше белками (таблицы 1 и 2).В этих модельных организмах SC-белки были выделены и исследованы экспериментально, за исключением D. rerio , геном которого был хорошо изучен, а SC-белки были выявлены с помощью биоинформатических методов. В одном эксперименте D. rerio заменяли другой рыбой Anoplopoma fimbria. Поэтому мы не включили Af в список основных модельных организмов. Как только недавно обнаруженные SC-белки SYCE и TEX млекопитающих были обнаружены у мышей, мы рассматриваем мышь как наиболее репрезентативный вид млекопитающих, если только один вид должен быть выбран в качестве запроса при кропотливом компьютерном мониторинге базы данных.Человеческие SC-белки очень похожи на свои мышиные аналоги, и их использование в качестве запросов не приведет к добавлению новых результатов по сравнению с мышиными.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
b Модельные организмы обозначены в таблице 1. См. идентификаторы белков в таблице 1.
Домены SMC, Smc, SCP-1, COR1 и RAD21 характерны для структурных белков хромосом. Домен HORMA распознает состояние хроматина и облегчает взаимодействие с другими белками. PRK00409 участвует в рекомбинации. Цис-транс-изомеразы катализируют изомеризацию белковых молекул, имеющих двойные связи. Остальные домены не имеют отношения к мейозу.
Аминокислотные последовательности белков SC искали в NCBI (http://www.ncbi.nlm.nih.gov/) и UniProtKB / Swiss-Prot (http://www.uniprot.org/ uniprot /) базы данных. Функциональные домены вышеуказанных белков были идентифицированы с использованием программного обеспечения CDART (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi?). Случайные аминокислотные последовательности были созданы на основе нативных белков программой RandSeq (http://au.expasy.org/tools/randseq.htm), чтобы служить в качестве контроля при оценке сходства белков.
Белки, сходные с белками SC, искали в протеомах основных эукариотических групп с помощью программного обеспечения NCBI Protein BLAST (http://www.ncbi.nlm.nih.gov/blast/Blast.cgi?PROGRAM=blastp&BLAST_PROGRAMS=blastp&PAGE_TYPE=BlastS на & LINK_LOC = blasthome #). Обзор изученных таксонов представлен в таблицах 3–6. Таксоны, в которых из баз данных было доступно лишь несколько белковых последовательностей, были объединены. Параметры нашего поиска PROTEIN BLAST были следующими. Максимальное количество целевых последовательностей составляет 1000 или 5000 в различных исследованиях (максимальное количество выровненных последовательностей для отображения; фактическое количество выравниваний может быть меньше или больше этого).Ожидаемый порог равен 100 (этот параметр определяет порог статистической значимости для сообщения о совпадениях с последовательностями базы данных. Значение по умолчанию (100) означает, что 100 таких совпадений будут найдены случайно). Остальные были параметрами по умолчанию. Оценка индекса сходства (вывод BLAST) основана на трех параметрах: количестве совпадающих аминокислотных остатков, количестве аминокислотных остатков одного типа и количестве пробелов, то есть случаях, когда определенная позиция занята аминокислотный остаток в одном белке и пустой в другом.Для каждого из белков SC сравнивали показатели сходства с белками протеомов конкретной эукариотической группы для рассматриваемого белка и его «случайного» аналога. Значимость индекса сходства характеризовалась значением E , которое отражает количество похожих белков, которые могут быть случайно выбраны программой BLAST, и рассчитывается самим BLAST. Максимальные баллы, найденные BLAST, в порядке увеличения суммированы в таблицах (см. Результаты и обсуждение).Белки SC с оценкой ниже 50 не указаны, поскольку их сходство считалось очень низким. Когда аналогичные оценки были получены для нативного и «случайного» белка, мы сравнили их оценки, усредненные по 10 лучшим результатам поиска. Сравнения с помощью теста Стьюдента t проводили с использованием программного обеспечения STATISTICA v.7 (http://www.statsoft.com).
На момент начала исследования (сентябрь 2011 г.). | b Сходство с родственными белками не показано. Максимальные баллы указаны в скобках. Белки с высокими баллами (от 100 и выше) выделены жирным шрифтом. Модельные организмы обозначены в таблице 1. # Здесь и далее: SC-белки животных — это Dm, Ce, Dr, Mm, а из грибов и растений — Sc, Sp и At.
Поскольку оценка зависит от длины последовательности, сравнивать оценки, полученные для белков разного размера, некорректно. Однако «вертикальное» сравнение оценок, то есть сравнение оценок, полученных для аналогичных белков из разных эукариотических групп, кажется правильным. Также очевидно, что абсолютные значения баллов не имеют большого значения, когда баллы низкие и сопоставимы с баллами случайных последовательностей. Филогенетические деревья были построены с использованием инструмента множественного выравнивания белков на основе ограничений (COBALT) из пакета NCBI (http: // www.ncbi.nlm.nih.gov/tools/cobalt/cobalt.cgi?CMD=Web). Параметры по умолчанию использовались при множественном выравнивании последовательностей. На заключительном этапе построения деревьев использовался алгоритм быстрой минимальной эволюции. Идентификаторы белков указаны в подписях к рисункам. Для каждого таксона рассматривались белки с наибольшим сходством с Hop1 и ASY1. 3. Результаты и обсуждениеСписок белков SC семи модельных организмов представлен в таблице 1. Размер белков и некоторые характеристики их функциональных доменов показаны в таблице 2.Сходные белки искали в протеомах всех видов эукариот, доступных в базах данных на момент исследования (см. Материалы и методы) с помощью программы BLAST. Степень сходства оценивалась по балльному индексу (см. «Материалы и методы»). 3.1. Закономерности распределения исследуемых белков среди эукариотКак и ожидалось, чрезвычайно высокие баллы были получены при сравнении белков SC дрожжей с протеомами дрожжей, белков SC нематод с протеомами нематод и т.д.е., белок с родственным протеомом). Результат показал, что метод работал; очевидно, что эти данные не вошли в таблицы. Баллы зависели от размера белка. Например, для мышиного SYCE3 (88 остатков) была получена оценка 178, тогда как для мышиного SYCP2 (1500 остатков) была получена оценка 3106. 3.1.1. Водоросли, мхи, цветущие растения и грибыБелки, сходные с дрожжевыми и Arabidopsis, SC-белки Hop1, ASY1 и ASY2 были обнаружены в протеомах водорослей, мхов, грибов и высших растений (таблица 3).Наибольшее сходство с белками SYCP1 позвоночных наблюдалось для белков из протеомов зеленых водорослей, бурых водорослей и аскомицетов (таблица 3), что, по-видимому, связано со сходством их вторичной структуры (см. Ниже). Все исследованные одноклеточные эукариотические группы имели белки, более или менее похожие на SC-белки модельных организмов (таблица 4). Наивысшие баллы были получены для группы Fornicata-Parabasalia-Heterolobosea. Их ортологи Hop1 уже аннотированы в базах данных.Парабасалия, возможно, самая древняя группа эукариот с половым размножением [44]. В качестве примера практического использования обнаруженных сходств мы построили филогенетические деревья белков HORMA-домена, подобных Hop1 из Saccharomyces cerevisiae и ASY1 из Arabidopsis thaliana . Один вид, белок которого показал наибольшее сходство с Hop1 и ASY1, был выбран из каждой из таксономических групп, представленных в таблицах 3 и 4, за исключением Ciliophora.Белки в основном были аналогами. Идентификаторы белков и исходные виды перечислены в подписях к рисункам. В качестве контроля мы использовали отдаленно родственный белок архей Methanococcus voltae , который показал низкое, но все же значительное сходство с Hop1. Одно дерево (рис. 1) было построено для водорослей, грибов, мхов и зеленых растений. Как и ожидалось, белок архей был автоматически исключен программой. Белок, обнаруженный в низших грибах ( Nosema ceranae , Microsporidia), также был исключен программой, чего можно было ожидать.Неожиданным открытием было то, что Hop1 дрожжей S. cerevisiae был довольно далек от всех других белков, включенных в дерево. Другое дерево (рис. 2) было построено для белков одноклеточных эукариот и включало известные белки Hop1 и ASY1. Белки Methanococcus voltae (Archaea) и Monosiga brevicollis (Choanoflagellata) были исключены автоматически при кластеризации с Giardia Кишечник (Fornicata) Hop1 на этапе построения кобальтового дерева.Фактически, белки Choanoflagellata показали лишь незначительное сходство с белками SC модельных организмов. 3.1.2. ЖивотныеСреди многоклеточных организмов, перечисленных в Таблице 5, моллюски имели самые высокие показатели сходства между некоторыми из их белков и модельными белками SC. Гомологи SYCP2 и SYCP3 Crassostrea gigas (максимальные баллы 80 и 199 соответственно) аннотированы в базе данных NCBI. Гомолог SYCP3 был дополнительно обнаружен в протеомах губки Amphimedon queenslandica и кишечнополостных Hydra magnipapillata .Следует отметить, что белок губки, обнаруженный в нашем поиске (таблица 5), не совпадал с SYCP3, описанным Fraune et al. [41]. Белок, обозначенный как SC65, присутствует в протеоме аскаридной нематоды (). В качестве контроля мы сравнили SC65 для мышей и рыб (оценка = 456) и SYCP3 для мышей и рыб (оценка = 263). Видно, что полученные оценки сходства SC65 и SYCP3 с белками вышеуказанных эукариотических групп были достаточно высокими. Все эукариотические группы, включенные в Таблицу 5, имели не только белки, сходные с белками SC животных, но также белки, подобные дрожжевым Hop1 и ASY1 растений. Чтобы лучше понять приведенные выше значения, также может быть полезно рассмотреть баллы, полученные для нескольких других белков. Высококонсервативный мейотический фермент DMC1 показал следующие максимальные оценки при сравнении DMC1 мыши с белками других организмов: 622 для Danio rerio , 307 для Caenorhabditis elegans , 391 для Arabidopsis thaliana , 310 для Drosophila melan и 372 для Saccharomyces cerevisiae (наши данные).Максимальные баллы, полученные при аналогичных сравнениях для структурного SC-белка SYCP1, консервативность которого намного ниже, составили 320, 49, 38, 42 и 33 соответственно. Понятно, что оценки, превышающие 100 при сравнении белков SC с протеомами кишечнополостных или моллюсков, могут указывать на некоторую родственность определенных белков, хотя об их ортологии не может быть и речи. У наиболее высокоорганизованных животных были белки, прямо ортологичные или очень похожие на SC-белки модельных организмов (Таблица 6).Гипотетический белок BRAFLDRAFT_118903, обнаруженный нами в протеоме Branchiostoma floridae (подтип Cephalochordata), аналогичен различным белкам, образующим поперечные филаменты СК. Белок содержит несколько иммуноглобулиновых доменов филаминного типа (повторы Filamin / ABP280), а в центральной части его молекулы образуется отчетливая α -спираль (наши данные), как и в СК трансверсальных белков филаментов модельных организмов. Белок CBY10027.1 Tunicata показал дополнительное сходство со случайным аналогом SYCP1 мыши (таблица 6).Белок содержит повторы GCC2_GCC3 и домен Trichoplein (подробнее см. Ниже) и аналогичным образом образует α -спираль, хотя и находится в С-концевой области молекулы. 3.1.3. Таксоны без «стандартных» белков SCВ нескольких таксонах эукариот не обнаружено белков со значительным сходством с белками SC модельных видов, выбранных для наших сравнений. Мы не включили эти таксоны в таблицы, а просто перечислили их здесь. Среди водорослей это были Rhodophyta, Euglenophyta, Chrysophyta, Charophyta, Xanthophyta и Dinoflagellata.Среди животных были Mesozoa, Gnathostomulida, Bryozoa, Cycliophora, Myzostomida, Nemertea; также есть Rotifera, Nematomorpha, Scalidophora, Acanthocephala, Entoprocta и Gastrotricha из Coelomata. Точно так же не было обнаружено белков, подобных белкам SC, у Tardigrada и Onychophora (Protostomia), а также у Hyperotreti, Hyperoartia и Chondrichthyes (Chordata). Белки со значительным сходством только с FKBP6 (пептидил-пролил цис-транс-изомераза) были обнаружены для нескольких таксонов, которые также не были перечислены в таблицах.Эти таксоны включали Cryptophyta, Diatoms и Pelagophyceae (водоросли) и Perkinsea, Oomycota и Labyrinthulomycota (Labyrinthulida), две последние группы дополнительно содержали белки, аналогичные мышиному SYCP1. Среди животных Rhizaria, Myxosporea, амебоидные простейшие и Annelida также имеют белки, подобные мышиному FKBP6. Мы не обнаружили каких-либо белков, подобных структурным мейотическим белкам в этих эукариотических группах, возможно потому, что только некоторые из их белков доступны в базах данных. Исключение составляют Rhodophyta, Dinoflagellata, Chondrichthyes, Oomycota, Rhizaria и Annelida.Для каждого из этих типов в базах данных аннотировано более 10 протеомов. Это означает, что СК в этих таксономических группах, если они вообще существуют, лишены типичных белков модельных СК и могут быть построены из неканонических белков. 3.1.4. Мейоз без SC и с нетипичными SCСчитается, что мейоз возникает одновременно с митозом [5] или возникает в результате митоза [6]. Большинство компонентов молекулярного аппарата, необходимого для инициирования гомологичного спаривания (напр., Мейоз-специфический cohesin Rec8 и др.) Могут возникать уже во время происхождения протоэукариот [6], тогда как компоненты SC, возможно, имеют более недавнее происхождение.Ключевые мейотические белки были обнаружены у протиста Giardia Кишечник , хотя этот организм предположительно лишен мейоза [3]. И Рамеш и др. [3] и Cavalier-Smith [1] предположили, что мейоз возник довольно рано в эукариотической эволюции. Однако из всех белков SC в их анализ был включен только Hop1. Нам не удалось установить, образуются ли SC во время мейоза у всех наших испытуемых. Мейоз протекает без образования СК у низших грибов, таких как Schizosaccharomyces pombe и Aspergillus nidulans (цит. Из [8]).Мейоз отсутствует у аскомицета Candida albicans и присутствует в Candida lusitaniae , но у обоих видов аналогично отсутствуют ключевые белки SC, похожие на белки SC модельных организмов [45]. В то же время СК образуется у аскомицета Neurospora crassa и базидиомицета Coprinus cinereus [46–48]. СК образуются также у Eimeria tenella (Apicomplexa) [49], но не у его дальнего родственника Tetrahymena thermophila (Ciliophora), тогда как остаточные СК-подобные структуры наблюдаются у протиста Stylonychia [50].У бурой водоросли Ectocarpus siliculosus есть мейоз [51], но только ее Hop1 аннотирован в базах данных (таблица 3). Красные водоросли и диатомеи образуют СК [46]. Протеомы водорослей, мхов, зеленых растений и грибов, перечисленные в таблице 3, включают белки, сходные с белками LE дрожжей и растений, включая Hop1, ASY1 и ASY2. Однако протеомы водорослей, мха и грибов не содержат белков, подобных дрожжевому Zip1 или Arabidopsis ZYP1, которые образуют поперечные филаменты в SC.Мы обнаружили только те белки, которые имеют довольно низкое сходство с белками поперечных филаментов позвоночных. Эти эукариотические группы развивались независимо друг от друга [51]. Их SCs могут включать еще не идентифицированные белки со вторичной структурой, характерной для поперечных филаментов SC. Интересно, что белки с высоким сходством с каким-либо известным SC-белком не были обнаружены в протеомах Choanoflagellata, которые считаются ближайшими родственниками Metazoa среди всех одноклеточных организмов [52].Это наблюдение может указывать на то, что известные SC-белки возникли у более высокоорганизованных эукариот. Возможно, что каждая из независимых эволюционных ветвей многоклеточных эукариот (красные и бурые водоросли, зеленые растения, грибы и животные) имеет две категории белков, специфичных для мейоза: общий набор основных белков мейоза, как можно предположить из результаты, полученные Ramesh et al. [3], и, кроме того, клон-специфичный набор структурных белков, включая SC-белки. Гипотеза подтверждается тем фактом, что белки, подобные SYCP1 и SYCP3, обнаруживаются в протеомах основных Metazoa [41] и отсутствуют у грибов и растений. Было установлено, что некоторые структурные мейотические белки по своему происхождению ближе к бактериальным белкам, тогда как некоторые другие более похожи на белки архей [53]. Однако SC-белки обычно демонстрируют низкое сходство с прокариотическими белками, если оно вообще есть, которое не превышает сходство между случайными аминокислотными последовательностями и прокариотическими белками [53]. Эти находки привели к заключению, что белки SC возникли относительно недавно в эволюции, когда эволюционировали первичные эукариоты. 3.2. SC-белки модельных организмов с наибольшим сходством с белками исследованных эукариотYeast Hop1 и Arabidopsis ASY1 среди всех компонентов LE имеют сходство главным образом с белками протеомов водорослей, мха, грибов, растений и одноклеточных животных. Родственные белки были дополнительно обнаружены в протеомах высокоорганизованных животных. Эти белки имеют домен HORMA, который структурирует хромосомы. Другие компоненты SC, такие как SC65, SYCP2 и SYCP3 мыши и рыбы, показали значительное сходство только с белками многоклеточных организмов. Постоянно высокое сходство с белками даже одноклеточных эукариот наблюдалось для FKBP6, который аннотирован как компонент SC только у мышей. Максимальные баллы, полученные для FKBP6, достигли 115 у растений (Таблица 3), 133 у одноклеточных эукариот (Таблица 4), 208 у губок и плакозоев (Таблица 5) и 402 с размером молекулы 327 остатков у позвоночных (Таблица 6). Дальние родственники FKBP6 были обнаружены даже в прокариотических протеомах (эубактериальных и архейных) с максимальными баллами 77 и 41 соответственно (наши данные).Белки центрального пространства SC, которые образуют поперечные филаменты (Zip1, C (3) G, ZYP1, SYP-1 и SYCP1), обнаруживают низкое, но все же значительное сходство с белками почти всех неродственных групп эукариот. Достаточно высокое сходство наблюдается с белками родственных групп. Белки, родственные SYCE2 позвоночных, были обнаружены в протеомах Mollusca, Cnidaria (Таблица 5) и Иглокожих (Таблица 6). Эти белки, возможно, не ограничиваются позвоночными, вопреки первоначальному предположению [34].Этот вывод согласуется с возможным появлением SYCE2-подобных белков у ранних Metazoa, как было предложено Fraune et al. [42]. Компонент SC SC65 встречается не только в Deuterostomia (Таблица 6), но также, возможно, в Coelenterata, Porifera и некоторых Protostomia (Таблица 5). Примечательно, что этот белок аннотирован в базе данных по нематодам. 3.3. «Эксклюзивные белки» в протеомах некоторых эукариотических группПри сравнении белков поперечных филаментов SC модельных организмов с белками Sporozoa, Placozoa, Mollusca, Echinodermata и Hemichordata было получено значительное сходство оценок не только для нативных белков. , но также и для случайных аминокислотных последовательностей, сгенерированных на основе нативных белков с помощью специальной программы, чтобы они имели одинаковый размер и одинаковую пропорцию аминокислот (выделены курсивом в таблицах 4–6).Такие же оценки были получены для нативных и случайных «белков SC», используемых в качестве запросов. Обычно баллы, полученные для случайных (контрольных) последовательностей, не превышали 40, а во многих случаях были ниже 30. В вышеуказанных эукариотических группах максимальный балл достигал 70 (например, для случайного аналога SYCP1 мыши). Максимальные оценки, полученные с нативными белками для различных протеомов, были довольно низкими, но все же значительными: 70–77 для Zip1, 63–70 для C (3) G, 56–83 для ZYP1a, 53–70 для ZYP1b, 67–99. для SYCP1 мыши, 44–66 для SYCP1 рыб и 50–68 для SYP-1 нематоды. E -значения были достаточно высокими, например, от минимума до нативных белков и от минимума до случайных «белков» в случае Placozoa; то есть эти результаты были надежными. Чтобы изучить причину почти равных оценок для нативных и случайных «белков», нами был проведен анализ доменов и вторичной структуры белков, присутствующих в протеомах вышеуказанных эукариотических групп и имеющих большое сходство с поперечным филаментом SC. белки.Белков оказалось мало; например, только один «эксклюзивный» белок был обнаружен в каждом из протеомов Mollusca, Hemichordata и Echinodermata. Эксклюзивные белки имели большой размер во всех протестированных протеомах, от 3906 остатков в Hemichordata до 7710 остатков в Placozoa. Сходство с белками SC было ограничено их С-концевыми областями, которые были взяты для дальнейшего анализа. Состав доменов С-концевой области у этих исключительных белков незначительно отличался.Например, функциональные домены миозина 10 и GCC2_GCC3 были обнаружены в белках Mollusca. Домен Smc, который отвечает за деление клеток и сегрегацию хромосом, был обнаружен в белках Apicomplexa. Мы обнаружили домены GCC2_GCC3 и Trichoplein у Hemichordata, домен Trichoplein у иглокожих и множество различных доменов, включая два домена Trichoplein и несколько доменов миозина у Placozoa. Домены SMC, которые структурируют хроматин и привлекают другие белки, также имеют особое значение.Эти домены были обнаружены в некоторых SC-белках (таблица 2). Примечательно, что все домены (т.е. соответствующие белковые области) образуют отдельную α -спираль, что характерно для белков поперечных филаментов SC. Trichoplein также представляет интерес, будучи аннотированным как специфичный для мейоза ядерный структурный белок. Мы выполнили «обратный» поиск двух белков с помощью BLAST, ища в протеомах мыши и Drosophila белки, подобные эксклюзивным белкам Trichoplax adhaerens (Placozoa) XP_002107637.1 и XP_002111687.1. За исключением одного крупного белка мыши, обнаруженные белки мыши и Drosophila были небольшими и демонстрировали сходство с С-концевыми областями двух белков T. adhaerens . Набор включал различные миозины и, в случае Drosophila, цитоплазматических линкерных белка. И миозины, и линкерные белки имеют α -спиральных домена, как C-концевые домены белков T. adhaerens (использовалась программа COILS от ExPASy tools (http: // www.ch.embnet.org/software/COILS_form.html)). Согласно критериям биоинформатики, поперечные белки филаментов SC имеют много общего с так называемыми промежуточными белками, которые включают белки ядерной пластинки, ядерного матрикса и тела полюса веретена, тяжелую цепь миозина и некоторые другие белки. Белки образуют α -спиральную структуру, и все α -спирали имеют примерно 20% сходства друг с другом. Это связано с повторяющимися «эталонными» гидрофобными аминокислотными остатками [13, 22, 32].Такая же ситуация наблюдалась в случае вышеупомянутых эксклюзивных белков. Почему белки, обнаруженные в определенных группах эукариот, похожи не только на белки поперечных филаментов SC, но и на случайные аминокислотные последовательности, созданные на основе нативных белков? Возможны два объяснения. Во-первых, подобные комбинации аминокислот могут встречаться в SC-белках и их случайных «аналогах», поскольку повторы характерны для α -спиралей, присутствующих в первых.Во-вторых, ошибки могут возникать при компьютерной сборке секвенированных геномов и соответствующих протеомов. Сайты генома, кодирующие каждый обнаруженный белок, могут отвечать не за длинный, а за два более коротких полипептида, второй из которых похож на белок SC. Вот почему C-концевые области белков, обнаруженных в нашей работе, могут принадлежать SC трансверсальным белкам филаментов или другим промежуточным белкам. Гипотеза основана на том факте, что α -спиральные белки встречаются во многих протеомах, в то время как вышеупомянутый феномен наблюдался только для нескольких белков из определенных протеомов эукариот. 4. Выводы и перспективыНаши сравнения позволяют сделать вывод, что Hop1, ASY1 и ASY2 являются наиболее универсальными из всех структурных белков SC (Таблица 7). У них есть функциональный домен HORMA, который распознает состояния хроматина и действует как адаптер, который рекрутирует другие белки. Ранее мы предполагали, что белки, содержащие HORMA-домен, также играют универсальную роль в формировании СК у высших эукариот [4]. Сходным образом, мышиный HORMAD1 недавно было обнаружено, что он играет важную роль в формировании SC и правильном прогрессе мейоза [54].Поскольку SC формируется на основе осей хромосом посредством белок-белковых взаимодействий, ясно, что подобные белки, участвующие в организации хромосом, должны встречаться в протеомах всех эукариот, способных к мейозу, и это действительно наблюдалось в нашем исследовании.
Белки LE, возможно, являются наиболее древними из всех белков SC. Это предположение кажется наиболее правдоподобным, учитывая, что оси хромосом сформировались раньше, чем поперечные филаменты SC. SYCP2 и SYCP3 заменяли Hop1 и Red1 у животных, хотя белки, содержащие HORMA-домен, также активны в их мейозе [54].Возможно, замена была связана с усложнением геномов. Однако растения с очень большими геномами имеют ортолог ASY1 для Hop1. Возможно, что SYCP2 и SYCP3 были задействованы у позвоночных животных, потому что белковые комплексы, структурирующие хромосомы, были сложны для включения специфичных для мейоза когезинов и дополнительных белков у Vertebrata. Ортологи SYCP1 и SYCP3, которые недавно были обнаружены у беспозвоночных [41], обнаруживают лишь небольшое сходство со своими коллегами у позвоночных (Table 7).Белки, по-видимому, эволюционировали довольно быстро параллельно с усложнением генома. В основном мы использовали программу BLAST, построив только два филогенетических дерева в качестве примеров. Не исключено, что сходство белков, выявленное только с помощью BLAST, не может служить основанием для филогенетических выводов [55, 56]. Мы не искали конкретных ортологов для известных белков SC. Нашей целью было выяснить, встречаются ли белки, подобные известным SC-белкам, в протеомах определенной группы эукариот.Наши результаты могут быть использованы как основа для целенаправленного поиска ортологов белков SC с помощью филогенетических деревьев. Наиболее интересные для такого исследования таксоны были выявлены в настоящем исследовании и включают Chlorophyta, Phaeophyceae, Apicomplexa, Porifera, Placozoa и Mollusca (таблица 7). Значимость наших результатов обычно была высокой или очень высокой в соответствии с полученными значениями E , которые варьировались от низкой значимости для Zip1 Sc в протеомах Parabasalia, Fornicata и Heterolobosea до очень высокой значимости для SC65 Dr у млекопитающих. протеомы или даже 0.0 для SC65 Mm в протеомах амфибий и птиц. Оценки сопоставимы или даже выше, чем те, которые указаны в литературе как необходимые для правильных филогенетических выводов, от [57] до [58]. Таким образом, мы получили новое подтверждение сделанного ранее предположения о том, что разные белки, общей чертой которых является наличие доменов с определенной конформацией, используются для формирования СК у разных таксонов эукариот [4, 59]. Здесь мы расширили этот вывод с зеленых растений, грибов и позвоночных, включив простейших, а также красные и бурые водоросли, в то время как Fraune et al.[41] распространил его на беспозвоночных. Независимые эволюционные линии многоклеточных эукариот [51], возможно, имели общий набор основных мейотических белков, что может быть получено из результатов Ramesh et al. [3], а также клон-специфичный набор структурных белков, включая SC-белки. Белки центрального пространства SC наиболее эволюционно изменчивы. Это означает, что могут существовать разные белок-белковые взаимодействия для соединения двух LE в SC. В то же время, похоже, что домен HORMA является наиболее ценным для сборки самого LE из разных белков. На основании наших данных отсутствие белков, аналогичных СК-белкам модельных организмов у Rhodophyta, Euglenophyta, Chrysophyta, Charophyta, Xanthophyta и Dinoflagellata, позволяет предположить, что мейоз у этих водорослей отличается от классического мейоза протеканием без любые СК или неизвестные новые белки образуют СК в этих водорослях. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


