Вегетативная (автономная) нервная система | Компетентно о здоровье на iLive
Физиология вегетативной нервной системы
Вегетативная нервная система контролирует артериальное давление (АД), частоту сердечных сокращений (ЧСС), температуру и массу тела, пищеварение, метаболизм, водно-электролитный баланс, потоотделение, мочеиспускание, дефекацию, половые реакции и другие процессы. Многие органы управляются в основном либо симпатической, либо парасимпатической системой, хотя они могут получать входящие импульсы из обоих отделов вегетативной нервной системы. Чаще действие симпатической и парасимпатической систем на один и тот же орган прямо противоположное, например симпатическая стимуляция повышает частоту сердечных сокращений, а парасимпатическая — снижает.
Симпатическая нервная система способствует интенсивной деятельности организма (катаболические процессы) и гормонально обеспечивает фазу ответа на стресс «дерись или беги». Так, симпатические эфферентные сигналы увеличивают частоту сердечных сокращений и сократимость миокарда, вызывают бронходилатацию, активируют гликогенолиз в печени и высвобождение глюкозы, увеличивают скорость основного обмена и мышечную силу; а также стимулируют потоотделение на ладонях.
Парасимпатическая нервная система способствует восстановлению затраченных организмом ресурсов, т.е. обеспечивает процессы анаболизма. Парасимпатическая вегетативная нервная система стимулирует секрецию пищеварительных желез и моторику желудочно-кишечного тракта (включая эвакуацию), снижает частоту сердечных сокращений и артериальное давление, а также обеспечивает эрекцию.
Функции вегетативной нервной системы обеспечивают два основных нейромедиатора — ацетилхолин и норадреналин. В зависимости от химической природы медиатора нервные волокна, секретирующие ацетилхолин, называют холинергическими; это все преганглионарные и все постганглионарные парасимпатические волокна. Волокна, секретирующие норадреналин, называют адренергическими; ими являются большинство постганглионарных симпатических волокон, за исключением иннервирующих кровеносные сосуды, потовые железы и мышцы arectores pilorum, которые являются холинергическими.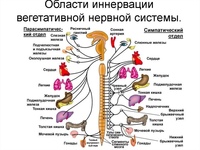
Оценка вегетативной нервной системы
Заподозрить вегетативную дисфункцию можно при наличии таких симптомов, как ортостатическая гипотензия, отсутствие толерантности к высокой температуре и потеря контроля над функцией кишечника и мочевого пузыря. Эректильная дисфункция — один из ранних симптомов дисфункции вегетативной нервной системы. Ксерофтальмия и ксеростомия не являются специфическими симптомами дисфункции вегетативной нервной системы.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12]
Физикальное обследование
Устойчивое снижение систолического артериального давления более чем на 20 мм рт. ст. или диастолического более чем на 10 мм рт. ст. после принятия вертикального положения (при отсутствии обезвоживания организма) предполагает наличие вегетативной дисфункции. Следует обращать внимание на изменение частоты сердечных сокращений (ЧСС) во время дыхания и при перемене положения тела. Отсутствие дыхательной аритмии и недостаточный прирост ЧСС после принятия вертикального положения указывают на вегетативную дисфункцию.
Следует обращать внимание на изменение частоты сердечных сокращений (ЧСС) во время дыхания и при перемене положения тела. Отсутствие дыхательной аритмии и недостаточный прирост ЧСС после принятия вертикального положения указывают на вегетативную дисфункцию.
Миоз и умеренный птоз (синдром Горнера) свидетельствуют о поражении симпатического отдела вегетативной нервной системы, расширенный и не реагирующий на свет зрачок (зрачок Эйди) — о поражении парасимпатической вегетативной нервной системы.
Патологические мочеполовые и ректальные рефлексы могут также быть симптомами недостаточности вегетативной нервной системы. Исследование включает оценку кремастерного рефлекса (в норме штриховое раздражение кожи бедра приводит к поднятию яичек), анального рефлекса (в норме штриховое раздражение перианальной кожи приводит к сокращению анального сфинктера) и бульбо0кавернозного рефлекса (в норме сдавление головки полового члена или клитора приводит к сокращению анального сфинктера).
Лабораторные исследования
При наличии симптомов вегетативной дисфункции с целью определения степени выраженности патологического процесса и объективной количественной оценки вегетативной регуляции сердечно0сосудистой системы проводятся кардиовагальная проба, пробы на чувствительность периферических а-дренорецепторов, а также количественная оценка потоотделения.
Количественным судомоторным аксонрефлекстестом проверяется функция постганглионарных нейронов. Локальное потоотделение стимулируется ионофорезом ацетилхолина, электроды устанавливают на голени и запястье, выраженность потоотделения регистрируется специальным судометром, передающим в аналоговой форме информацию на компьютер. Результатом теста может быть снижение потоотделения, либо его отсутствие, либо продолжение потоотделения после прекращения стимуляции. С помощью терморегуляторной пробы оценивают состояние преганглионарных и постганглионарных проводящих путей. Значительно реже для оценки функции потоотделения используют красящие пробы. После нанесения на кожу краски пациента помещают в закрытое помещение, которое нагревается до достижения максимального потоотделения; потоотделение приводит к изменению цвета краски, что выявляет области ангидроза и гипогидроза и позволяет провести их количественный анализ. Отсутствие потоотделения свидетельствует о поражении эфферентной части рефлекторной дуги.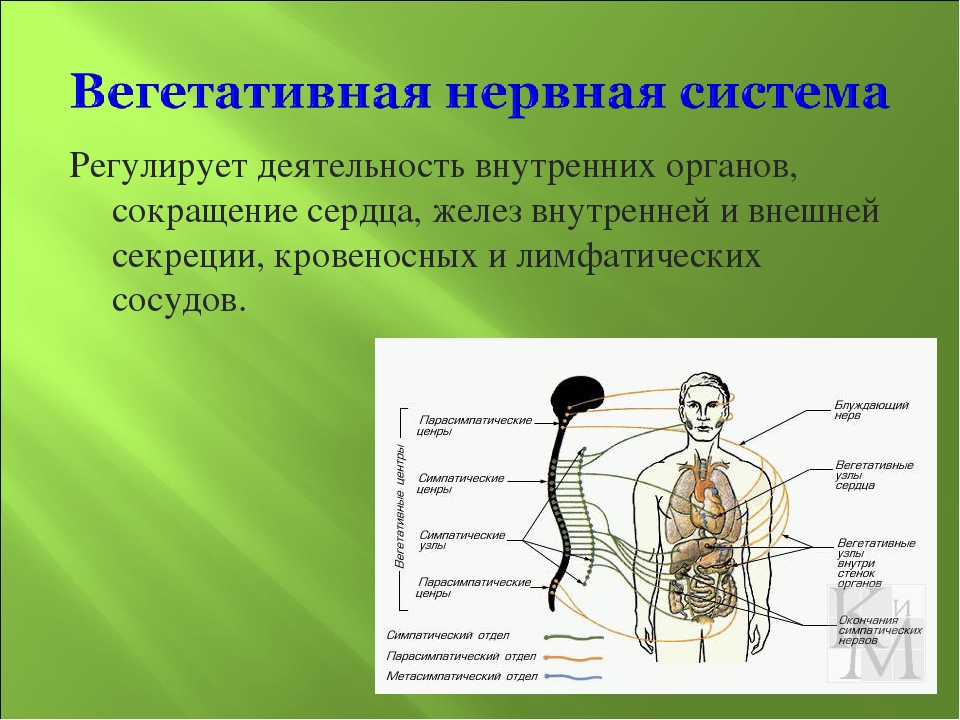
Кардиовагальные пробы оценивают реакцию ЧСС (регистрация и анализ ЭКГ) на глубокое дыхание и пробу Вальсальвы. Если вегетативная нервная система интактна, то максимальное увеличение ЧСС отмечается после 15-го сердечного удара и снижение — после 30-го. Отношение между интервалами RR на 15-30-м ударах (т.е. самого длинного интервала к самому короткому) — отношение 30:15 — в норме составляет 1,4 (отношение Вальсальвы).
Пробы на чувствительность периферических адренорецепторов включают изучение сердечного ритма и артериального давления в тилт-тесте (пассивной ортопробе) и пробе Вальсальвы. При проведении пассивной ортопробы происходит перераспределение объема крови в нижележащие части тела, что вызывает рефлекторные гемодинамические реакции. В пробе Вальсальвы проводят оценку изменений АД и ЧСС в результате повышения внутри грудного давления (и снижения венозного притока), что вызывает характерные изменения артериального давления и рефлекторную вазоконстрикцию. В норме изменения гемодинамических показателей происходят на протяжении 1,5-2 мин и имеют 4 фазы, в период которых АД повышается (1-я и 4-я фазы) или снижается после быстрого восстановления (2-я и 3-я фазы).
Заболевания вегетативной нервной системы, пароксизм, пароксизмальные состояния
Закрыть- Болезни
- Инфекционные и паразитарные болезни
- Новообразования
- Болезни крови и кроветворных органов
- Болезни эндокринной системы
- Психические расстройства
- Болезни нервной системы
- Болезни глаза
- Болезни уха
- Болезни системы кровообращения
- Болезни органов дыхания
- Болезни органов пищеварения
- Болезни кожи
- Болезни костно-мышечной системы
- Болезни мочеполовой системы
- Беременность и роды
- Болезни плода и новорожденного
- Врожденные аномалии (пороки развития)
- Травмы и отравления
- Симптомы
- Системы кровообращения и дыхания
- Система пищеварения и брюшная полость
- Кожа и подкожная клетчатка
- Нервная и костно-мышечная системы
- Мочевая система
- Восприятие и поведение
- Речь и голос
- Общие симптомы и признаки
- Отклонения от нормы
- Диеты
- Снижение веса
- Лечебные
- Быстрые
- Для красоты и здоровья
- Разгрузочные дни
- От профессионалов
- Монодиеты
- Звездные
- На кашах
- Овощные
- Детокс-диеты
- Фруктовые
- Модные
- Для мужчин
- Набор веса
- Вегетарианство
- Национальные
- Лекарства
- Пищеварительный тракт и обмен веществ
- Кровь и система кроветворения
- Сердечно-сосудистая система
- Дерматологические препараты
- Mочеполовая система и половые гормоны
- Гормональные препараты
- Противомикробные препараты
- Противоопухолевые препараты и иммуномодуляторы
- Костно-мышечная система
- Нервная система
- Противопаразитарные препараты, инсектициды и репелленты
- Дыхательная система
- Органы чувств
- Прочие препараты
- БАДы и ТАА
- Врачи
- Клиники
- Справочник
- Аллергология
- Анализы и диагностика
- Беременность
- Витамины
- Вредные привычки
- Геронтология (Старение)
- Дерматология
- Дети
- Женское здоровье
- Инфекция
- Контрацепция
- Косметология
- Народная медицина
- Обзоры заболеваний
- Обзоры лекарств
- Ортопедия и травматология
- Питание
- Пластическая хирургия
- Процедуры и операции
- Психология
- Роды и послеродовый период
- Сексология
- Стоматология
- Травы и продукты
- Трихология
- Другие статьи
- Словарь терминов
- [А] Абазия .
 . Ацидоз
. Ацидоз - [Б] Базофилы .. Богатая тромбоцитами плазма
- [В] Вазопрессин .. Выкидыш
- [Г] Галлюциногены .. Грязи лечебные
- [Д] Деацетилазы гистонов .. Дофамин
- [Ж] Железы .. Жиры
- [И] Иммунитет .. Искусственная кома
- [К] Каверна .. Кумарин
- [Л] Лапароскоп .. Лучевая терапия
- [М] Макрофаги .. Мутация
- [Н] Наркоз .. Нистагм
- [О]
- [А] Абазия .
Симпатическая и парасимпатическая нервная система
Сложное строение организма людей предусматривает несколько подуровней нервной регуляции каждого органа. Так, для симпатической нервной системы присуща мобилизация энергетических ресурсов для выполнения определенной задачи. Вегетативный же отдел контролирует работу структур в их функциональном покое, к примеру, в момент сна.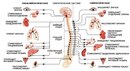 Правильное взаимодействие и деятельность вегетативной нервной системы в целом – залог крепкого здоровья людей.
Правильное взаимодействие и деятельность вегетативной нервной системы в целом – залог крепкого здоровья людей.
Отличительные черты и параметры
Природа мудро распределила функциональные обязанности симпатического и парасимпатического отделов вегетативной нервной системы – согласно расположению их ядер и волокон, а также предназначению и ответственности. К примеру, центральные нейроны симпатического сегмента размещены исключительно в боковых рогах спинного мозга. У парасимпатического же они локализуются в стволе полушарий.
Отдаленные, эффекторные нейроны в первом случае всегда расположены на периферии – присутствуют в околопозвонковых ганглиях. Они формируют различные сплетения, самым важным из которых признано солнечное. Оно несет ответственность за иннервацию внутрибрюшных органов. Тогда как парасимпатические эффекторные нейроны располагаются непосредственно в иннервируемых ими органах. Поэтому и ответные реакции на посылаемые к ним из мозга импульсы наступают быстрее.
Различия можно наблюдать и в функциональных характеристиках. Энергичная деятельность человека требует активации сердца, сосудов, легких – усиливается деятельность симпатических волокон. Однако, в этом случае происходит торможение процессов пищеварения.
В покое же за иннервацию внутриполостных органов отвечает парасимпатика – восстанавливается пищеварение, гомеостаз, мочевыделение. Недаром, после плотного обеда хочется полежать и поспать. В тесном сотрудничестве обоих отделов и заключается единство и неделимость нервной системы.
Структурные единицы
Главные центры вегетативной системы локализуются:
- мезэенцефальный отдел – в структурах среднего мозга, от которого они отходят волокном глазодвигательного нерва;
- бульбарный сегмент – в тканях продолговатого мозга, который далее представлен, как лицевой, так и блуждающий, языкоглоточный нерв;
- торако-люмбальный отдел – поясничные и грудные ганглии в спинномозговых сегментах;
- сакральный сегмент – в крестцовом отделе, парасимпатическая нервная система иннервирует тазовые органы.

Симпатический отдел выводит нервные волокна из головного мозга до пограничного сегмента – паравертебральными ганглиями в районе спинного мозга. Его называют симптоматический ствол, поскольку в нем имеется несколько узлов, каждый из которых взаимосвязан с отдельными органами через нервные сплетения. Передача импульса с нервных волокон на иннервируемую ткань происходит через синапсы – с помощью особых биохимических соединений, симпатинов.
Парасимпатический отдел, помимо внутричерепных центральных ядер представлен:
- преганглионарные нейроны и волокна – пролегают в составе черепно-мозговых нервов;
- постагнглионарные нейроны и волокна – проходят до иннервируемых структур;
- терминальные узлы – расположены вблизи внутриполостных органов или непосредственно в их тканях.
Периферическая нервная система, представленная двумя отделами, практически не поддается сознательному контролю и функционирует самостоятельно, поддерживая постоянство гомеостаза.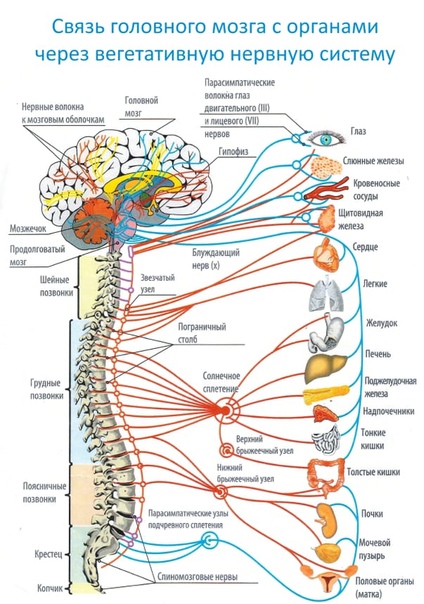
Суть взаимодействия
Для того чтобы человек мог приспособиться и адаптироваться к любой ситуации – внешней либо внутренней угрозе, симпатическая, а также парасимпатическая части вегетативной нервной системы должны тесно взаимодействовать. Однако, при этом они оказывают на организм человека прямо противоположное воздействие.
Для парасимпатики характерно:
- понижать артериальное давление;
- уряжать частоту дыхания;
- расширять просвет сосудов;
- сужать зрачки;
- корректировать концентрацию глюкозы в кровяном русле;
- улучшать пищеварительный процесс;
- тонизировать гладкую мускулатуру.
Защитные рефлексы также во введении парасимпатической деятельности – чихание, кашель, позывы на рвоту. Для симпатического отдела вегетативной нервной системы присуще повышать параметры сердечнососудистой системы – частоту пульса и цифры артериального давления, усиливать обмен веществ.
О том, что преобладает симпатикоотдел, человек узнает по ощущению жара, тахикардии, беспокойному сну и страху смерти, потоотделению.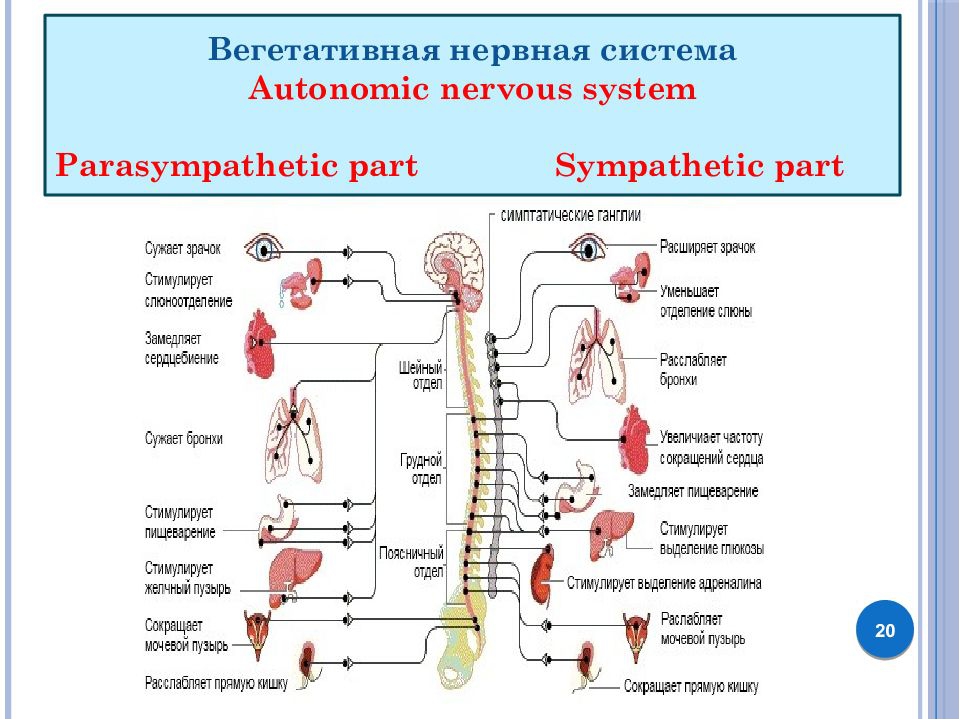 Если активна больше парасимпатика, изменения будут иными – холодная, влажная кожа, брадикардия, обморочность, чрезмерное слюноотделение и одышка. При уравновешенном функционировании обоих отделов деятельность сердца, легких, почек, кишечника соответствует возрастной норме и человек ощущает себя здоровым.
Если активна больше парасимпатика, изменения будут иными – холодная, влажная кожа, брадикардия, обморочность, чрезмерное слюноотделение и одышка. При уравновешенном функционировании обоих отделов деятельность сердца, легких, почек, кишечника соответствует возрастной норме и человек ощущает себя здоровым.
Функции
Природой определено так, что симпатический отдел принимает активное участие во многих важных процессах организма людей – особенно двигательного состояния. За ним преимущественно закреплена роль мобилизовать внутренние ресурсы, чтобы преодолеть различные препятствия. К примеру, активирует сфинктер радужной оболочки, зрачок расширяется, и поток поступающей информации усиливается.
При возбуждении симпатической нервной системы расширяются бронхи для усиления поступления кислорода к тканям, к сердцу поступает больше крови, тогда как на периферии артерии и вены становятся узкими – перераспределение питательных веществ. Одновременно происходит выброс депонированной крови из селезенки, а также расщепление гликогена – мобилизация дополнительных источников энергии. Угнетению же будут подвержены пищеварительные и мочевыделительные структуры – усвоение питательных веществ в кишечнике замедляется, ткани мочевого пузыря расслабляется. Все усилия организма направлены на поддержания высокой активности мускулатуры.
Угнетению же будут подвержены пищеварительные и мочевыделительные структуры – усвоение питательных веществ в кишечнике замедляется, ткани мочевого пузыря расслабляется. Все усилия организма направлены на поддержания высокой активности мускулатуры.
Парасимпатическое влияние на сердечную деятельность будет выражаться в восстановлении ритма и сокращений, нормализации кровяной регуляции – артериальное давление соответствует привычным для человека параметрам. Коррекции будет подвержена дыхательная система – бронхи сужаются, гипервентиляция прекращается, а концентрация глюкозы в кровяном русле снижается. Одновременно усиливается моторика в петлях кишечника – продукты усваиваются быстрее, а полые органы освобождаются от содержимого – дефекация, мочеиспускание. Дополнительно парасимпатика повышает секрецию слюны, но уменьшает потоотделение.
Нарушения и патологии
Строение вегетативной системы в целом – это сложные сплетение нервных волокон, которые действуют сообща для сохранения стабильности внутри организма. Поэтому даже незначительное повреждение одного из центров будет негативно отражаться на иннервации внутренних органов в целом. К примеру, при высоком тонусе симпатической нервной системы в кровь людей постоянно поступает огромное количество гормонов надпочечников, что провоцирует скачки артериального давления, тахикардию, потливость, гипервозбуждение, быстрое истощение сил. Тогда как вялость и сонливость, повышенный аппетит и гипотония будут признаками сбоев в вегетативном отделе.
Поэтому даже незначительное повреждение одного из центров будет негативно отражаться на иннервации внутренних органов в целом. К примеру, при высоком тонусе симпатической нервной системы в кровь людей постоянно поступает огромное количество гормонов надпочечников, что провоцирует скачки артериального давления, тахикардию, потливость, гипервозбуждение, быстрое истощение сил. Тогда как вялость и сонливость, повышенный аппетит и гипотония будут признаками сбоев в вегетативном отделе.
Клинические признаки заболеваний периферической нервной системы напрямую связаны с уровнем, на котором произошло поражение нервного волокна и причины – воспаления, инфекции, либо травмы, опухолевого процесса. Характерные симптомы воспаления – отек тканей, болевой синдром, повышение температуры, нарушения движений в той части тела, которую иннервирует сегмент. Специалист обязательно учитывает возможность иррадиции признаков – их удаленность от первичного очага болезни. К примеру, изменения в глазодвигательном нерве могут выражаться в опущении век, усиления слезовыделения, затрудненности движений глазного яблока.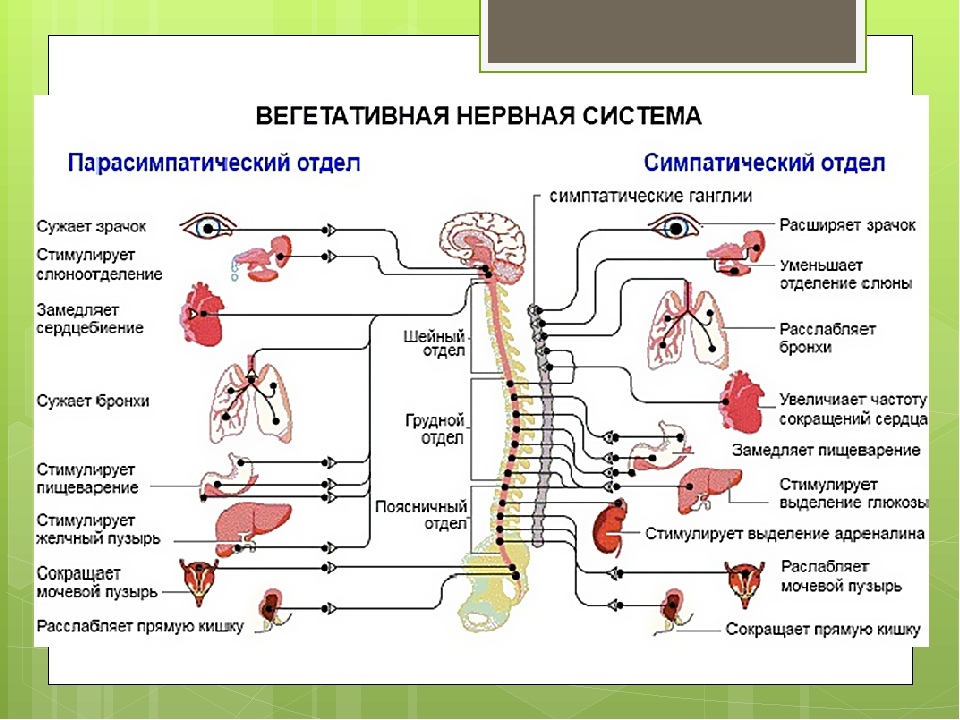
Если страдает симпатическая НС в районе малого таза, что присуще детям – то формируется энурез, кишечная непроходимость. Или же проблемы с репродуктивной системой у взрослых. При травмах в клинической картине будут преобладать повреждения тканей, кровотечения, а в последующем парезы и параличи.
Принципы лечения
Подозрения на расстройства симпатической системы либо парасимпатического отдела должны быть обязательно подтверждены осмотром невропатолога, результатами лабораторных и инструментальных исследований.
Только после оценки общего состояния здоровья человека, выявления причин заболевания, специалист подберет оптимальную схему терапии. При диагностированной опухоли, ее удалят оперативным образом или же подвергнут лучевой, химиотерапии. Для ускорения реабилитации после травмы врач назначит физиотерапевтические процедуры, препараты, способные ускорять регенерацию, а также средства для предупреждения вторичного инфицирования.
Если симпатическая нервная структура страдает от избытка выделения гормонов, эндокринолог подберет медикаменты для изменения концентрации их в кровяном русле. Дополнительно назначают отвары и настои целебных трав с успокоительным эффектом – мелисса, ромашка, а также мята, валериана. По индивидуальным показаниям прибегают к помощи антидепрессантов, антиконвульсантов либо нейролептиков. Наименования, дозы и продолжительность лечения – прерогатива невропатолога. Самолечение абсолютно недопустимо.
Дополнительно назначают отвары и настои целебных трав с успокоительным эффектом – мелисса, ромашка, а также мята, валериана. По индивидуальным показаниям прибегают к помощи антидепрессантов, антиконвульсантов либо нейролептиков. Наименования, дозы и продолжительность лечения – прерогатива невропатолога. Самолечение абсолютно недопустимо.
Отлично зарекомендовало себя санаторно-курортное лечение – грязелечение, водолечение, гирудотерапия, радоновые ванны. Комплексное воздействие изнутри – отдых, правильное питание, витамины и снаружи – целебные обвертывания травами, грязями, ванны с лечебной солью, приводят в норму все отделы периферической нервной системы.
Профилактика
Лучшим лечением любой болезни, безусловно, является профилактика. Для предупреждения функциональных сбоев в иннервации того или иного органа, специалисты рекомендуют людям соблюдать основные принципы здорового образа жизни:
- отказаться от вредных привычек – употребления табачной, алкогольной продукции;
- хорошо высыпаться – не менее 8–9 часов сна в проветриваемом, затемненном, спокойном помещении;
- скорректировать рацион – преобладание овощей, различных фруктов, зелени, злаковых культур;
- соблюдение водного режима – прием не менее 1.
 5–2 л очищенной воды, соков, морсов, компотов, чтобы из тканей удалялись токсины и шлаки;
5–2 л очищенной воды, соков, морсов, компотов, чтобы из тканей удалялись токсины и шлаки; - ежедневная активность – пешие долгие прогулки, посещение бассейна, спортивного зала, освоение йоги, пилатеса.
У человека, который тщательно следит за своим здоровьем, посещает врача для ежегодного медицинского осмотра, нервы будут спокойными на любом их уровне. Поэтому и о таких проблемах, как потливость, тахикардия, одышка, высокое давление они знают только понаслышке, от своих родственников.
AP2 Автономная нервная система Глава 14 Карточки
Нам не удалось определить язык звукового сопровождения на ваших карточках. Пожалуйста, выберите правильный язык ниже.
Фронт Китайский, PinyinChinese, SimplifiedChinese, TraditionalEnglishFrenchGermanItalianJapaneseJapanese, RomajiKoreanMath / SymbolsRussianSpanishAfrikaansAkanAkkadianAlbanianAmharicArabicArmenianAzerbaijaniBasqueBelarusianBengaliBihariBretonBulgarianBurmeseCatalanCebuanoChamorroChemistryCherokeeChinese, PinyinChinese, SimplifiedChinese, TraditionalChoctawCopticCorsicanCroatianCzechDanishDeneDhivehiDutchEnglishEsperantoEstonianFaroeseFilipinoFinnishFrenchFulaGaelicGalicianGeorgianGermanGreekGuaraniGujaratiHaidaHaitianHausaHawaiianHebrewHindiHungarianIcelandicIgboIndonesianInuktitutIrishItalianJapaneseJapanese, RomajiJavaneseKannadaKazakhKhmerKoreanKurdishKyrgyzLakotaLaoLatinLatvianLingalaLithuanianLuba-KasaiLuxembourgishMacedonianMalayMalayalamMalteseMaoriMarathiMarshalleseMath / SymbolsMongolianNepaliNorwegianOccitanOjibweOriyaOromoOther / UnknownPashtoPersianPolishPortuguesePunjabiPāliQuechuaRomanianRomanshRussianSanskritSerbianSindhiSinhaleseSlovakSlovenianSpanishSundaneseSwahiliSwedishTaga logТаджикскийТамильскийТатарскийТелугуТайскийТибетскийТигриньяTohono O’odhamТонгаТурецкийУйгурскийУкраинскийУрдуУзбекскийВьетнамский Валлийский Западно-фризскийИдишЙорубааудио еще не доступно для этого языка
Назад Китайский, PinyinChinese, SimplifiedChinese, TraditionalEnglishFrenchGermanItalianJapaneseJapanese, RomajiKoreanMath / SymbolsRussianSpanishAfrikaansAkanAkkadianAlbanianAmharicArabicArmenianAzerbaijaniBasqueBelarusianBengaliBihariBretonBulgarianBurmeseCatalanCebuanoChamorroChemistryCherokeeChinese, PinyinChinese, SimplifiedChinese, TraditionalChoctawCopticCorsicanCroatianCzechDanishDeneDhivehiDutchEnglishEsperantoEstonianFaroeseFilipinoFinnishFrenchFulaGaelicGalicianGeorgianGermanGreekGuaraniGujaratiHaidaHaitianHausaHawaiianHebrewHindiHungarianIcelandicIgboIndonesianInuktitutIrishItalianJapaneseJapanese, RomajiJavaneseKannadaKazakhKhmerKoreanKurdishKyrgyzLakotaLaoLatinLatvianLingalaLithuanianLuba-KasaiLuxembourgishMacedonianMalayMalayalamMalteseMaoriMarathiMarshalleseMath / SymbolsMongolianNepaliNorwegianOccitanOjibweOriyaOromoOther / UnknownPashtoPersianPolishPortuguesePunjabiPāliQuechuaRomanianRomanshRussianSanskritSerbianSindhiSinhaleseSlovakSlovenianSpanishSundaneseSwahiliSwedishTaga logТаджикскийТамильскийТатарскийТелугуТайскийТибетскийТигриньяTohono O’odhamТонгаТурецкийУйгурскийУкраинскийУрдуУзбекскийВьетнамский Валлийский Западно-фризскийИдишЙорубааудио еще не доступно для этого языка
Неврология для детей — вегетативная нервная система
Вегетативная нервная система
Вегетативная нервная система (ВНС) , регулирует
функции наших внутренних органов (внутренностей), таких как сердце,
желудок и кишечник. ВНС является частью периферической нервной системы.
а также контролирует некоторые мышцы тела. Мы часто
не подозревая о ВНС, потому что он функционирует непроизвольно и рефлекторно. За
Например, мы не замечаем, когда кровеносные сосуды меняют размер или когда наше сердце
бьет быстрее. Однако некоторых людей можно научить контролировать некоторые
функции ВНС, такие как частота сердечных сокращений или артериальное давление.
ВНС является частью периферической нервной системы.
а также контролирует некоторые мышцы тела. Мы часто
не подозревая о ВНС, потому что он функционирует непроизвольно и рефлекторно. За
Например, мы не замечаем, когда кровеносные сосуды меняют размер или когда наше сердце
бьет быстрее. Однако некоторых людей можно научить контролировать некоторые
функции ВНС, такие как частота сердечных сокращений или артериальное давление.
ANS наиболее важен в двух ситуациях:
- В экстренных случаях, которые вызывают стресс и требуют от нас вызова «бороться» или «беги» (убегай)
- В нештатных ситуациях, что позволяет нам «отдыхать» и «переваривать.»
ANS регулирует:
— в коже (вокруг волосяных фолликулов; гладкие мышцы
— вокруг кровеносных сосудов (гладкие мышцы)
— в глазу (радужная оболочка; гладкие мышцы)
— в желудке, кишечнике и мочевом пузыре (гладкие мышцы)
— сердца (сердечной мышцы)
ANS состоит из трех частей:
- Симпатическая нервная система
- Парасимпатическая нервная система
- Кишечный нерв система
| Симпатическая нервная система | |
Хороший солнечный день. Обратите внимание на картинке слева, что симпатическая нервная система берет начало в спинном мозге. В частности, тела клеток первого нейрон (преганглионарный нейрон) расположены в грудном и поясничном отделах спинной мозг.Аксоны от этих нейронов проецируются в цепочку ганглиев. расположен рядом со спинным мозгом. В большинстве случаев этот нейрон образует синапс с другим нейроном (постганглионарный нейрон) в ганглии. Несколько преганглионарных нейронов переходят в другие ганглии вне симпатической цепи и синапсов нет. Постганглионарный Затем нейрон проецируется на «цель» — мышцу или железу. Еще два факта о симпатической нервной системе: синапс в
симпатический ганглий использует ацетилхолин в качестве нейромедиатора; синапс постганглионарного
нейрон с органом-мишенью использует нейромедиатор, называемый норэпинефрин . |
| Парасимпатическая нервная система | |
Хороший солнечный день … Вы прогуливаетесь по парку. Однако на этот раз вы решили расслабиться в удобном кресле, которое у вас есть. принес с собой. Это требует ответов «Отдыхай и дайджест». Сейчас пора парасимпатической нервной системе поработать для экономии энергии.Это когда артериальное давление может снизиться, частота пульса может замедлиться, а пищеварение может Начало. Обратите внимание на изображение слева, что тела клеток
парасимпатическая нервная система расположена в спинном мозге (крестцовый
регион) и в мозговом веществе . В мозговом веществе черепные нервы III, VII, IX и X образуют
преганглионарные парасимпатические волокна. Преганглионарное волокно из
мозговой или спинной мозг проецируется на ганглии очень близко к органу-мишени
и делает синапс. |
Вот краткое изложение некоторых эффектов симпатического и парасимпатическая стимуляция. Обратите внимание, что эффекты обычно противостояние друг другу.
Вегетативная нервная система
| Структура | Симпатическая стимуляция | Парасимпатическая Стимуляция |
|---|---|---|
| Ирис (глазная мышца) | Расширение зрачка | Зрачок сужение |
| Слюнные железы | Производство слюны снижено | Производство слюны увеличено |
| Слизистая оболочка полости рта / носа | Производство слизи снижено | Производство слизи увеличено |
| Сердце | Частота и сила пульса увеличено | Частота сердечных сокращений и сила уменьшились |
| Легкое | Бронхиальная мышца расслаблена | Бронхиальная мышца Контракт |
| Желудок | Перистальтика снижена | Желудок выделяемый сок; увеличилась перистальтика |
| Тонкий кишечник | Подвижность снижено | Усиление пищеварения |
| Толстый кишечник | Подвижность снижено | Секреции и подвижность увеличены |
| Печень | Повышенная конверсия
Из гликогена в глюкозу | |
| Почки | Снижение количества мочи секреция | Повышенная секреция мочи |
| Мозговое вещество надпочечников | Норэпинефрин и адреналин секретный | |
| Мочевой пузырь | Стенка расслаблена Сфинктер закрыта | Стена сокращена Сфинктер расслаблен |
Следует отметить, что вегетативная нервная система всегда работает. Он активен НЕ только во время «борьбы или бегства» или «отдыха и переваривания».
ситуации. Скорее, вегетативная нервная система поддерживает нормальное состояние.
внутренние функции и работает с соматической нервной системой.
Он активен НЕ только во время «борьбы или бегства» или «отдыха и переваривания».
ситуации. Скорее, вегетативная нервная система поддерживает нормальное состояние.
внутренние функции и работает с соматической нервной системой.
Кишечный нерв система — это третий отдел вегетативной нервной системы, который вы мало о чем слышите. Кишечная нервная система представляет собой сеть нервные волокна, иннервирующие внутренние органы (желудочно-кишечный тракт, поджелудочная железа, и желчный пузырь).
Авторские права © 1996-2020, Эрик Х.Чудлер, Университет Вашингтон
Первичные головные боли и их связь с вегетативной нервной системой
1. Введение
Основы нашего нынешнего понимания механизмов головной боли восходят к семнадцатому веку, когда Томас Уиллис, один из великих деятелей медицины, предположил, что источником боли был не сам мозг, а нервные волокна, натянутые растянутыми сосудами. Поэтому он постулировал сосудистую теорию головной боли.Сегодня известно, что вегетативные проявления сосудистых головных болей провоцируются тесными связями между болевыми рецепторами, расположенными на уровне головы, и вегетативными структурами центральной нервной системы. Первичные цефалгические синдромы с сосудистыми проявлениями (мигрень, кластерная головная боль, SUNCT и пароксизмальная гемикрания) представляют собой сложные патогенные механизмы, затрагивающие вегетативные центры ствола мозга. Следовательно, сложные проявления головной боли следует понимать на основе анатомических и физиологических соотношений с боле чувствительными структурами черепа.
Первичные цефалгические синдромы с сосудистыми проявлениями (мигрень, кластерная головная боль, SUNCT и пароксизмальная гемикрания) представляют собой сложные патогенные механизмы, затрагивающие вегетативные центры ствола мозга. Следовательно, сложные проявления головной боли следует понимать на основе анатомических и физиологических соотношений с боле чувствительными структурами черепа.
Первичные головные боли определяют «идиопатические» типы цефалгии, которые не являются результатом основного заболевания или процесса. Однако эти условия кажутся результатом сложного взаимодействия между генетическими факторами, факторами риска развития и окружающей средой. Всемирная организация здравоохранения (ВОЗ) считает головные боли серьезной проблемой общественного здравоохранения с учетом индивидуальных и социальных последствий и финансовых затрат для общества [1]. Мигрень — одна из наиболее распространенных первичных головных болей — в настоящее время занимает 19-е место ВОЗ среди всех болезней, вызывающих инвалидность в мире.
В течение последних лет классификация головных болей претерпела динамичный процесс реструктуризации, постепенно добавляемые более подробные спецификации для каждого объекта в связи с прогрессом в понимании патофизиологических механизмов. Международное общество головной боли (IHS) классифицирует первичные головные боли по четырем основным категориям: мигрень (с ее подтипами), головная боль напряжения, кластерная головная боль и другие вегетативные цефалгии тройничного нерва и другие первичные головные боли [2].
Мигрень характеризуется приступами односторонней и пульсирующей головной боли от умеренной до сильной, продолжительностью 4–72 ч, что часто сопровождается светобоязнью, фонофобией, тошнотой и рвотой. При мигрени с аурой головной боли могут предшествовать преходящие очаговые неврологические симптомы. Вегетативные цефалгии тройничного нерва (ТАС) — это группа первичных головных болей, характеризующихся латерализованной головной болью и ипсилатеральными краниальными вегетативными особенностями, такими как конъюнктивная инъекция, слезотечение и ринорея.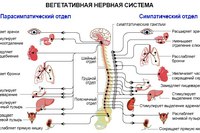 Основные подтипы представлены кластерной головной болью, пароксизмальной гемикранией, краткосрочными односторонними приступами невралгической головной боли с инъекцией конъюнктивы и разрывом (SUNCT) / краткосрочными односторонними приступами невралгической головной боли с краниально-вегетативными особенностями (SUNA) и континуальной гемикранией [2]. TAC отличаются друг от друга длиной атаки, продолжительностью и частотой появления [2].
Основные подтипы представлены кластерной головной болью, пароксизмальной гемикранией, краткосрочными односторонними приступами невралгической головной боли с инъекцией конъюнктивы и разрывом (SUNCT) / краткосрочными односторонними приступами невралгической головной боли с краниально-вегетативными особенностями (SUNA) и континуальной гемикранией [2]. TAC отличаются друг от друга длиной атаки, продолжительностью и частотой появления [2].
Доклинические исследования первичных головных болей выявили сложные и запутанные механизмы, включающие анатомию и физиологию тройнично-сосудистой и краниальной вегетативной систем, ответственных за различные симптомы [3–5].Ноцицептивная иннервация внутричерепных сосудов и мозговых оболочек основана на немиелинизированных (C-волокна) и тонко миелинизированных (Aδ-волокна) аксонах, содержащих вазоактивные нейропептиды, такие как вещество P (SP) и пептид, связанный с геном кальцитонина (CGRP) [6]. Помимо волокон тройничного нерва, берущих начало в ипсилатеральном ганглии тройничного нерва, описаны нейровегетативные волокна, образованные в основном симпатическими путями, возникающими в основном из верхнего шейного ганглия, и довольно редкой иннервацией парасимпатических волокон, берущих начало в сфенопалатиновых и слуховых ганглиях [7, 8]. Иннервация внутримозговых (пиальных) кровеносных сосудов также имеет вегетативный компонент, представленный в основном парасимпатическими волокнами, исходящими в основном из внутренних сонных и клиновидно-небных ганглиев [9].
Иннервация внутримозговых (пиальных) кровеносных сосудов также имеет вегетативный компонент, представленный в основном парасимпатическими волокнами, исходящими в основном из внутренних сонных и клиновидно-небных ганглиев [9].
Однако, несмотря на растущий объем данных, касающихся морфофункциональной организации болевой системы при головной боли, эпизодические и довольно непредсказуемые проявления большинства первичных головных болей по-прежнему представляют собой клиническую и терапевтическую проблему. Существует множество гипотез на разных уровнях, от молекулярной сигнализации до мозговых сетей, с все большим количеством данных, определяющих «матрицу боли» как нисходящую систему, подразумевающую как центральные, так и периферические структуры, от нарушения функциональной связи во время состояния покоя ( default mode network) к нейрогенному воспалению, опосредующему расширение сосудов и повышенную проницаемость кровеносных сосудов [10, 11].
2. Сложные нервно-сосудистые взаимодействия при первичных головных болях: мигрень
как патофизиологическая модель
Первичные головные боли имеют много общего, в первую очередь активацию тригемино-сосудистой системы. В то время как мигрень является наиболее изученной из всех первичных головных болей, как с клинической, так и с доклинической точки зрения, были достигнуты успехи в нашем понимании патофизиологии головной боли напряжения и вегетативных цефалгий тройничного нерва благодаря сочетанию клинических исследований и доклинических исследований на животных. модели.
В то время как мигрень является наиболее изученной из всех первичных головных болей, как с клинической, так и с доклинической точки зрения, были достигнуты успехи в нашем понимании патофизиологии головной боли напряжения и вегетативных цефалгий тройничного нерва благодаря сочетанию клинических исследований и доклинических исследований на животных. модели.
Мигрень — сложное первичное заболевание головного мозга, которое включает в себя каскад событий, которые приводят к повторяющимся несоответствующим активациям болевой системы тригеминоцервикального канала. Как и любую другую боль, каждый пациент воспринимает ее по-разному. Задуманная как система сигнализации тела, боль может в какой-то момент стать фактором агрессии собственного тела из-за рефлекторных реакций, которые она может вызвать. Хорошо известно, что восприятие боли зависит не только от интенсивности стимула, но и от множества генетических, психологических факторов (эмоционального состояния и внимания), от предшествующих переживаний, воспоминаний, ассоциаций с фактами жизни и сопутствующие заболевания. Стимуляция ноцицепторов в покровах, сосудах и суставах приводит к стимулированию по известным чувствительным путям к теменной коре, но ряд регулирующих нейронных механизмов вмешивается как на кортикальном уровне, так и на пути стимула, пытаясь адаптировать восприятие. от болевого ощущения к гомеостазу индивидуального тела. Что это за структуры и можно ли на них повлиять, десятилетиями интересовало ученых.
Стимуляция ноцицепторов в покровах, сосудах и суставах приводит к стимулированию по известным чувствительным путям к теменной коре, но ряд регулирующих нейронных механизмов вмешивается как на кортикальном уровне, так и на пути стимула, пытаясь адаптировать восприятие. от болевого ощущения к гомеостазу индивидуального тела. Что это за структуры и можно ли на них повлиять, десятилетиями интересовало ученых.
Менингеальные сосуды имеют моторную и чувствительную иннервацию за счет окончаний тройничного нерва (глазные ветви для переднего и заднего отделов, шейные нервные корешки C2, C3 с симпатическими волокнами паравертебральной симпатической цепи, обеспечивающими заднюю часть), что , в конце концов, устанавливают связи с вторичными нейронами тройничного нерва из каудального ядра тройничного нерва.Ядро тройничного нерва состоит из спинной части, объединяющей информацию о боли и температуре, и области моста с тактильной информацией. Дендриты биполярных нейронов из ганглиев Гассера получают сигнал от болевых рецепторов твердой мозговой оболочки и черепно-лицевых структур, а также от сосудистой стенки и направляют его в ядро тройничного нерва, таламус и контралатеральную теменную кору (и в то же время коллатеральные проекции). также нацелены на мезэнцефалические ядра), включая дорсальное ретикулярное ядро (DRt), ростральное вентральное мозговое вещество (RVM) и периакведуктальный серый средний мозг (PAG) [12–14].
также нацелены на мезэнцефалические ядра), включая дорсальное ретикулярное ядро (DRt), ростральное вентральное мозговое вещество (RVM) и периакведуктальный серый средний мозг (PAG) [12–14].
Моторный компонент цереброваскулярной системы подразумевает внешнюю иннервацию менингеальных сосудов из шейных (симпатических), отических, сфенопалатиновых и тройничных ганглиев (парасимпатических), а также внутреннюю иннервацию мелких интрапаренхиматозных сосудов, происходящих из ядер ствола мозга. такие как locus coeruleus [15].
Церебральный кровоток (CBF) регулируется вазомоторными, химическими, метаболическими и нейрогенными механизмами, но в нормальных физиологических условиях нейрогенный контроль мало влияет на церебральную ауторегуляцию, поскольку другие методы контроля являются доминирующими [16].
Существует обширная экспериментальная литература, подтверждающая, что стимуляция афферентов тройничного нерва может привести к краниальному вегетативному оттоку, тройнично-вегетативному рефлексу.
С момента стимуляции ноцицептивных окончаний до восприятия болевого ощущения передача сигнала модифицируется рядом механизмов с конечной целью улучшения болевого ощущения.
3. Модуляция ноцицептивной системы при первичных головных болях
Известная в большой степени эндогенная антиноцицептивная система организована на трех уровнях: первый, супраспинальное нисходящее торможение; во-вторых, сегментарное спинальное торможение (комплекс ингибиторов боли в заднем роге позвоночника) и в-третьих, проприоспинальное, гетеросегментное торможение — супраспинальная нисходящая система торможения.
Экспериментальные исследования с использованием фармакологических методов, ингибиторов, электрических стимуляторов и функциональных методов нейровизуализации выявили существование сложной системы модуляции боли, реальной нейронной матрицы, которая сильно активируется при появлении ноцицептивного стимула. Эта сеть представляет собой динамическую и пластичную связь между различными нейронными реле, а также участвует в другой высшей нервной деятельности: познании, эмоциях и мотивации. Сеть боли, анатомическая основа которой все еще частично известна, включает ряд нейромодуляторов и рецепторов, и на нее можно влиять как фармакологически (включая опиаты, каннабиноиды, НПВП и блокаторы обратного захвата серотонина / норадреналина), так и психологически и эмоционально, в конечном итоге определяя ощущение боль [17].
Сеть боли, анатомическая основа которой все еще частично известна, включает ряд нейромодуляторов и рецепторов, и на нее можно влиять как фармакологически (включая опиаты, каннабиноиды, НПВП и блокаторы обратного захвата серотонина / норадреналина), так и психологически и эмоционально, в конечном итоге определяя ощущение боль [17].
Анатомически теменная кора 1 и 2, островковая доля, таламус, гипоталамус, миндалевидное тело и ростральная передняя поясная кора (rACC) отправляют сообщения в периакведуктальное серое вещество (PAG), откуда нисходящий ингибиторный стимул передается в туловище. (сенсорное ядро тройничного нерва) и ростральный костный мозг с нисходящей тормозной проекцией на заднем мозговом роге.
Периакведуктальное серое вещество является реальным центром целостной интеграции болезненных ощущений, поскольку оно связано с префронтальной корой и миндалевидным телом, которые, в свою очередь, играют признанную роль в интеграции эмоций, тревоги и оценки риска с избеганием. [18].
[18].
Филдс и др. [19] определили в ростральной шейной области существование двух популяций нейронов с разными функциональными ролями: популяция «включена», которая увеличивает свои разряды до того, как инициирует ноцицептивный рефлекс, и популяция «выключена», которая уменьшает свои разряды при ответе на боль. и активация которого вызывает обезболивание. Популяция «на» представлена μ-опиоидными рецепторами, активация которых подавляет разряды этих нейронов. Опиоиды и каннабиноиды подавляют боль, увеличивая исходную скорость активации «выключенных» клеток и устраняя паузу «выключенных» клеток в ответ на ноцицептивные стимулы [20].В этих взаимозависимых связях ряд нейромедиаторов может иметь множественное действие, например серотонин и норадреналин, а также другие аминергические системы.
Стимуляция PAG и RVM определяет высвобождение серотонина, поскольку большое ядро шва, расположенное рядом с ядром тройничного нерва, в двусторонней нижней дуге, высвобождает серотонин, который, возможно, играет роль в процессе эндогенной анальгезии. Функциональная нейровизуализация с использованием техники BOLD показала активацию ядра в ответ на болевую стимуляцию тройничного нерва, что предполагает ее роль [14, 21, 22].
Функциональная нейровизуализация с использованием техники BOLD показала активацию ядра в ответ на болевую стимуляцию тройничного нерва, что предполагает ее роль [14, 21, 22].
И наоборот, роль серотонина в стимуляции нейронов PAG и RVM до конца не изучена, но очевидно, что другие несеротонергические системы участвуют в модуляции боли. Серотонин может как подавлять, так и облегчать боль в зависимости от подтипа возбуждаемых рецепторов. Эти ГАМКергические и глицинергические проекции от RVM опосредуют антиноцицепцию [23].
Норэпинефрин, выделяемый голубым пятном и ядрами Кёлликера-Фюзе под воздействием импульсов, поступающих от PAG и RVM, по-видимому, играет сильную антиноцицептивную роль, блокируя пре- и постсинаптические рецепторы спинномозговых нейронов, участвующих в передаче боли, или стимулируя альфа -2-адренорецепторы и косвенно путем стимуляции альфа-1- рецепторов, что вызовет деполяризацию тормозных ГАМКергических нейронов [23].
3.1. Сегментарное спинальное торможение
В заднем роге позвоночника эндогенная антиноцицептивная система представлена интернейронами и надмедуллярными нисходящими окончаниями.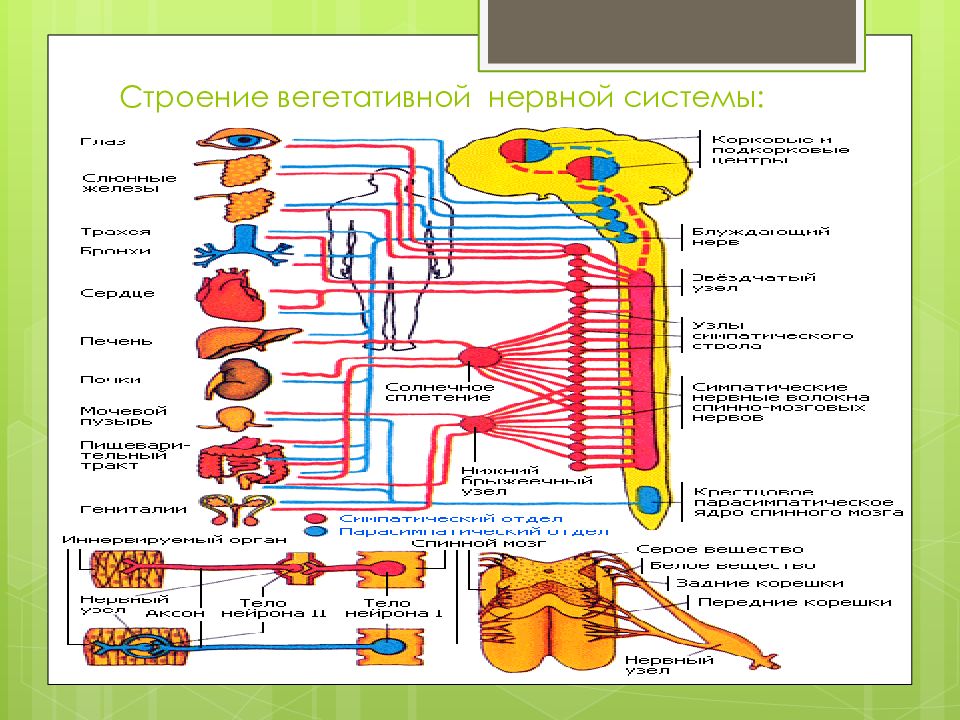 Опиоиды действуют на µ-рецепторы, расположенные на пресинаптических окончаниях связанных волокон, где они блокируют кальциевые каналы и открывают калиевые каналы, вызывая гиперполяризацию, ингибируя высвобождение нейромедиатора и, таким образом, обезболивая. Эндогенная анальгетическая система, которая обычно неактивна и центром которой является PAG, проецируется из своих аксонов (проводников энкефалина) в ядро большого шва, а отсюда в интернейроны заднего рога, где они могут секретировать серотонин, способствуя высвобождению энкефалинов из спинного мозга. интернейроны.Интернейроны получают внешние ноцицептивные волокна, а энкефалины из двух источников блокируют пресинаптический ноцицептивный сигнал. Стимуляция опиоидных рецепторов из родственных ноцицептивных волокон энкефалином будет определять такую же блокировку кальциевых каналов, активация которых также необходима для высвобождения вещества P [24]. Подавление надспинального нисходящего движения может не только снижать среднюю скорость разряда ноцицептивных нейронов спинного рога, но также может изменять гармонические колебания и нелинейную динамику (размерность) разрядов [25].
Опиоиды действуют на µ-рецепторы, расположенные на пресинаптических окончаниях связанных волокон, где они блокируют кальциевые каналы и открывают калиевые каналы, вызывая гиперполяризацию, ингибируя высвобождение нейромедиатора и, таким образом, обезболивая. Эндогенная анальгетическая система, которая обычно неактивна и центром которой является PAG, проецируется из своих аксонов (проводников энкефалина) в ядро большого шва, а отсюда в интернейроны заднего рога, где они могут секретировать серотонин, способствуя высвобождению энкефалинов из спинного мозга. интернейроны.Интернейроны получают внешние ноцицептивные волокна, а энкефалины из двух источников блокируют пресинаптический ноцицептивный сигнал. Стимуляция опиоидных рецепторов из родственных ноцицептивных волокон энкефалином будет определять такую же блокировку кальциевых каналов, активация которых также необходима для высвобождения вещества P [24]. Подавление надспинального нисходящего движения может не только снижать среднюю скорость разряда ноцицептивных нейронов спинного рога, но также может изменять гармонические колебания и нелинейную динамику (размерность) разрядов [25].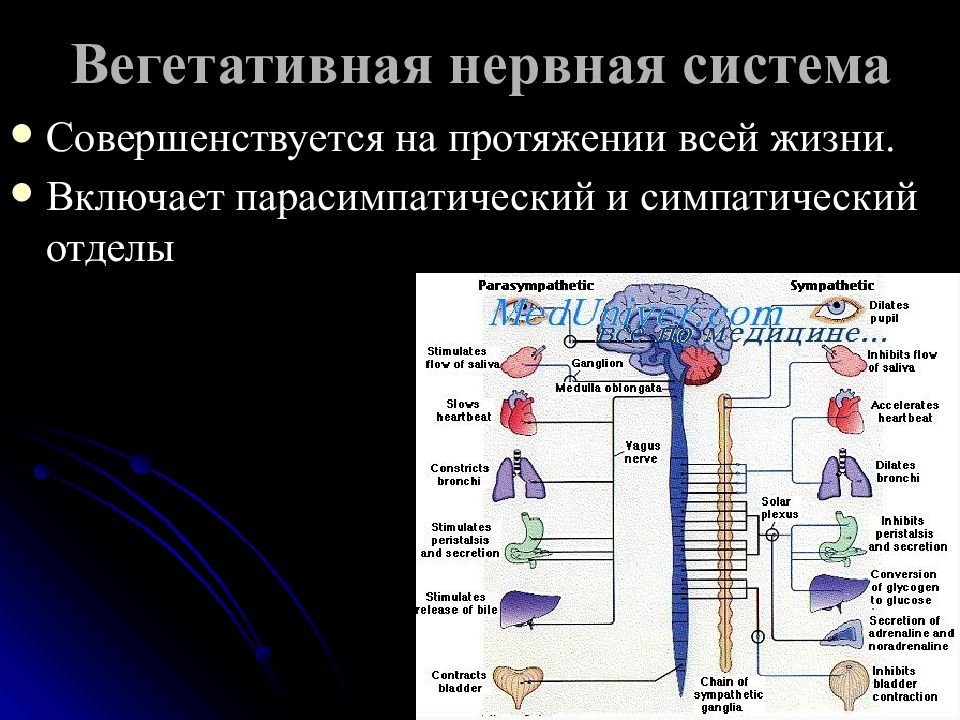
3.2. Проприоспинальное, гетеросегментарное ингибирование
Помимо классической, локальной, сегментарной и надспинальной нисходящей систем, по-видимому, существует третья эндогенная антиноцицептивная система: проприоспинальная межсегментарная система, подавляющая ноцицептивные нейроны в дорсальном роге. Похоже, что он частично модулирует нисходящие пути и активируется путем кондиционирования (стимуляции) гетеросегментарных болевых стимулов, вызывающих нейрональную констрастимуляцию (противодействие) [25].
На эту многоступенчатую организацию эндогенной антиноцицептивной системы можно повлиять с положительными результатами или ее можно демодулировать, что приведет к обострению боли.
Новые методы функциональной нейровизуализации продемонстрировали влияние психогенного фактора типа плацебо, который вызывает активацию нисходящей тормозной сети со стимуляцией μ-опиоидов в ростральной передней поясной коре головного мозга (rACC), задней поясной коре головного мозга (PCC).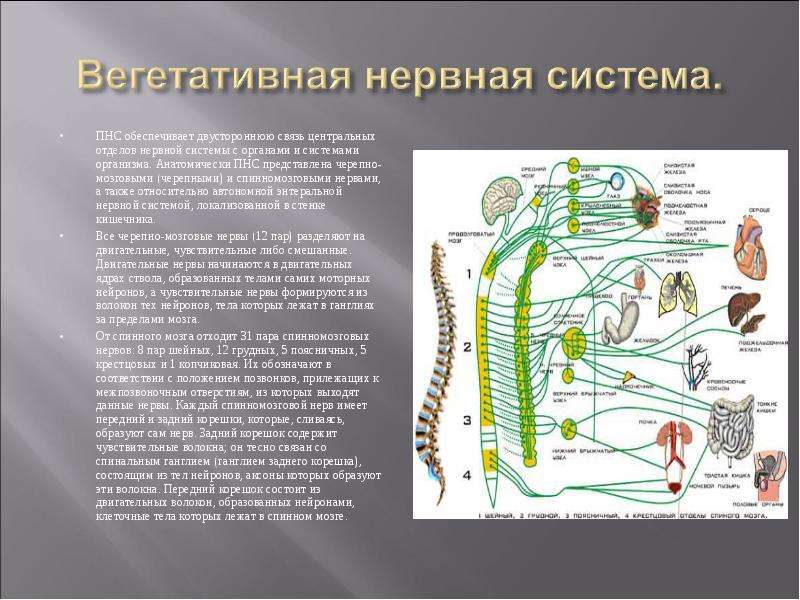 ), дорсолатеральной префронтальной коры и передней части коры островка с увеличением кровотока также при ПАГ.Точно так же обратная реакция ожидания, ожидания болезненного ощущения, определяет тенденцию к торможению, аналогичную таковой при интенсивной стимуляции (эффект ноцебо) [26].
), дорсолатеральной префронтальной коры и передней части коры островка с увеличением кровотока также при ПАГ.Точно так же обратная реакция ожидания, ожидания болезненного ощущения, определяет тенденцию к торможению, аналогичную таковой при интенсивной стимуляции (эффект ноцебо) [26].
У пациентов с интерктальной мигренью функциональные МРТ-исследования выявили усиление ноцицептивной диффузной активности, опосредованное различными путями [27]. Другой способ модуляции боли представлен «ноцицептивным диффузным контролем над болью». Концепция, выпущенная Ле Барсом с 8-го десятилетия прошлого века, относится к подавлению широкого динамического диапазона нейронов спинного рога, реагирующего на болезненную стимуляцию ноцицептивным стимулом, применяемым в другом месте тела.Механизм торможения, по-видимому, является центральным, и его потеря связана с хроническими болезненными синдромами, но также и с переходом в хроническую форму головной боли, связанной с чрезмерным употреблением лекарств [28, 29].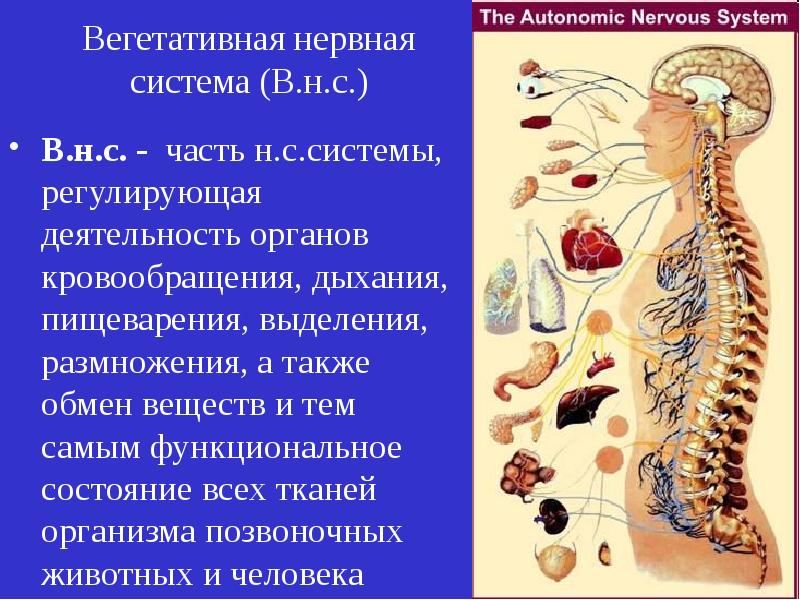 Эта система интегрирована в дорсальное ретикулярное ядро, которое получает ноцицептивную информацию от костного мозга и взаимодействует с PAG и RVM, миндалевидным телом, таламусом и, наконец, подавляет костный мозг посредством нисходящих выступов. Нейроны в дорсальном ретикулярном ядре (DRt) устанавливают связи с корой и множественными участками центральной нервной системы, участвующими в модуляции боли — спинно-надостной петлей [30].
Эта система интегрирована в дорсальное ретикулярное ядро, которое получает ноцицептивную информацию от костного мозга и взаимодействует с PAG и RVM, миндалевидным телом, таламусом и, наконец, подавляет костный мозг посредством нисходящих выступов. Нейроны в дорсальном ретикулярном ядре (DRt) устанавливают связи с корой и множественными участками центральной нервной системы, участвующими в модуляции боли — спинно-надостной петлей [30].
Perrotta et al. [31] обнаружили существование процесса центральной сенсибилизации болевых путей с аномальной и способствующей обработке стимулов в ядре тройничного нерва как в критическом, так и в интериктальном состоянии, что предполагает хроническую гипервозбудимость, возможно, генетически обусловленную дисфункциональными последствиями для антиноцицептивного модулирующего действия. система [32].
Возможно, эта демодуляция обработки ноцицептивных стимулов вызвана дефектом сети режима по умолчанию, что подтверждается морфофункциональными исследованиями нейровизуализации, которые выявили метаболические изменения в областях мозга, участвующих в обработке боли.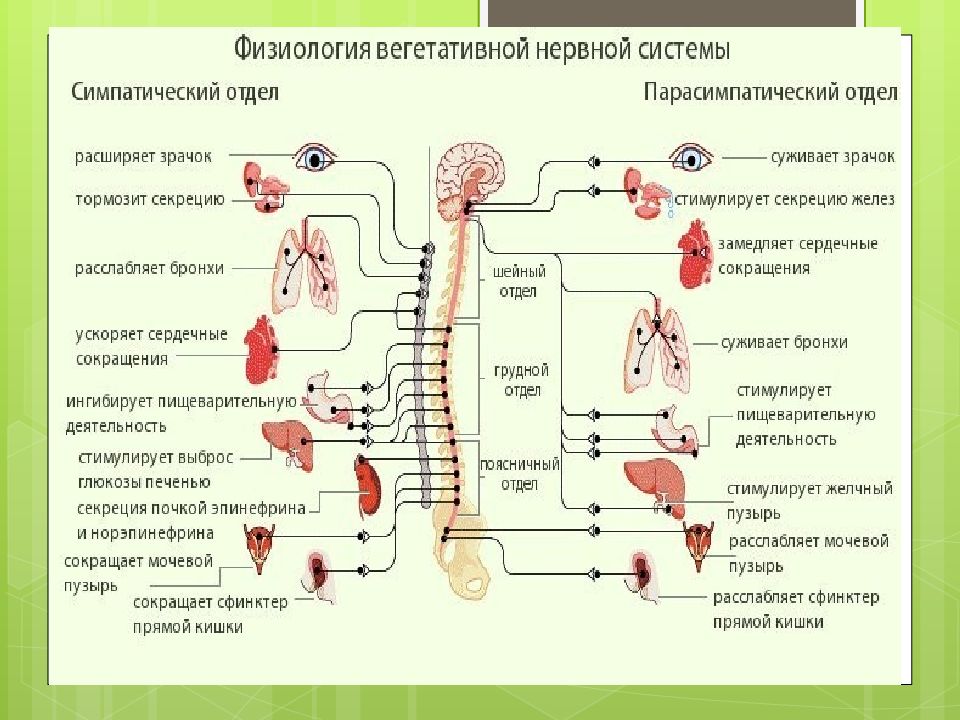 Сеть режима по умолчанию состоит из серии реле (часть медиальной височной доли, часть медиальной префронтальной коры и задней поясной коры, а также прилегающая вентральная предклинье и медиальная, латеральная и нижняя теменная кора), анатомические особенности которых основания переплетаются с путями обработки боли. Текущие данные предполагают, что сеть активна, когда человек не сосредоточен на внешнем мире, а мозг находится в состоянии бодрствования, и возможно, что он участвует в основных настройках основных функций мозга [33].
Сеть режима по умолчанию состоит из серии реле (часть медиальной височной доли, часть медиальной префронтальной коры и задней поясной коры, а также прилегающая вентральная предклинье и медиальная, латеральная и нижняя теменная кора), анатомические особенности которых основания переплетаются с путями обработки боли. Текущие данные предполагают, что сеть активна, когда человек не сосредоточен на внешнем мире, а мозг находится в состоянии бодрствования, и возможно, что он участвует в основных настройках основных функций мозга [33].
Гипоталамус, вегетативный мозг, устанавливает прямые анатомические связи со структурами тройничного нерва и участвует в различных церебральных функциях с вегетативным компонентом, включая регулирование вазомоторики и обработку боли, поддержание гомеостаза. Недавние исследования показали, что существует нарушение его функциональной связи с вегетативными структурами в смысле его увеличения или уменьшения, причем все они способны нарушить обработку экстероцептивных стимулов, особенно болезненных [34–37].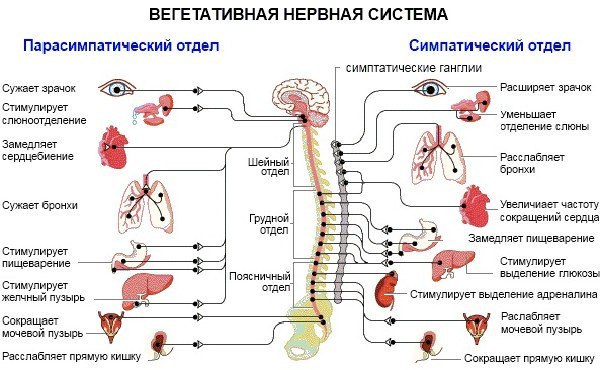
Гипоталамус также связан с симпатическими церебральными структурами, такими как парагиппокампальная извилина и ножка мозжечка. Усиление связи с этими центрами, обнаруженное у пациентов с мигренью, может преобладать в ответе коры на внешние ноцицептивные стимулы. Открытие было сделано BOLD нейровизуализационными исследованиями путем увеличения активности этих структур как при симпатической стимуляции, так и в состоянии покоя. Точно так же были обнаружены сверхвозбудимые связи (повышенная функциональная связность) с парасимпатическими структурами (височный полюс, верхняя височная извилина и V и VI доли мозжечка), в конечном итоге определяющие нарушение обработки внутренних стимулов у пациентов с мигренью, что объясняет некоторые особенности реакция пациента на внешние раздражители [38].
Locus coeruleus, крупнейшее норадренергическое ядро в головном мозге, связано анатомическими структурами с гипоталамусом, с которым он устанавливает гиперфункциональные связи. Участвует в модулировании нейронных разрядов из таламуса и префронтальной коры в ответ на ноцицептивные стимулы и в ингибировании ноцицептивных рефлексов, он может играть важную роль в обработке боли у пациентов с мигренью [39].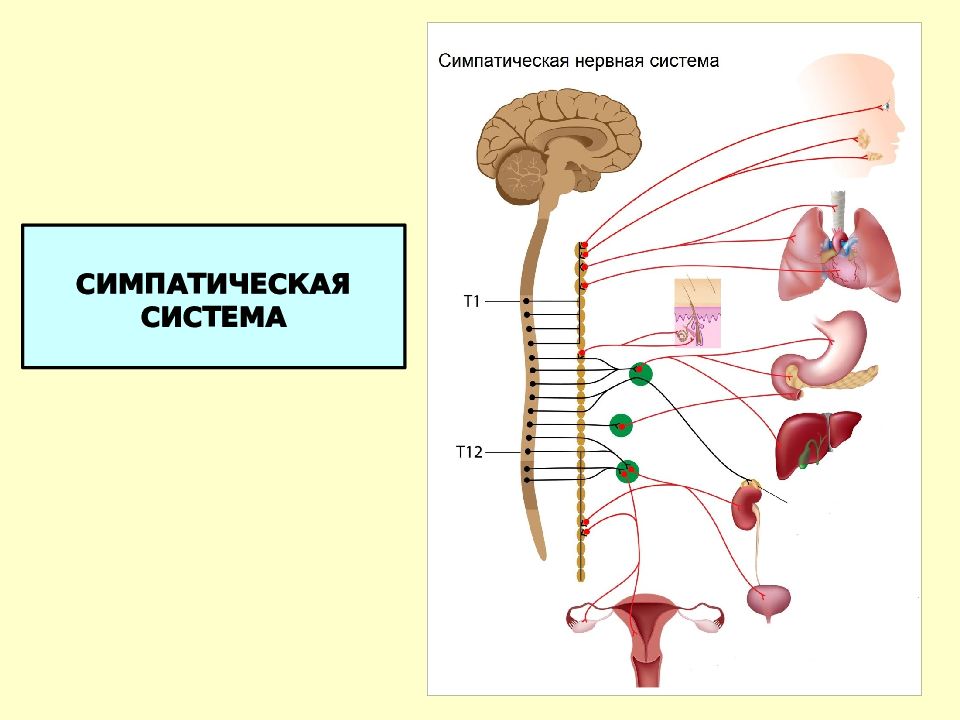 Хвостатое ядро, недавно участвовавшее в обработке боли, также имеет гиперфункциональную связь с гипоталамусом, что позволяет предположить его участие в хронобиологии мигрени [40].
Хвостатое ядро, недавно участвовавшее в обработке боли, также имеет гиперфункциональную связь с гипоталамусом, что позволяет предположить его участие в хронобиологии мигрени [40].
С другой стороны, было обнаружено снижение функциональной связи с различными церебральными структурами (корковые области в лобной и затылочной областях) там, где были обнаружены гипофункции. На данный момент никто не может сказать, что гипоталамус играет при мигрени роль, аналогичную сосудистым водорослям на лице, но он, безусловно, мешает обработке боли и отвечает за часть вегетативных проявлений мигрени и их взаимосвязь с психикой человека. . Нарушение могло быть связано с большим объемом информации, получаемой от нейронов ядра тройничного нерва спинного мозга, повторяющейся активацией во время приступов и феноменом центральной сенсибилизации гипоталамических и вегетативных связей [41].
В дополнение к быстрой синаптической передаче, опосредованной классическими нейротрансмиттерами, дополнительная синаптическая передача химических сигналов, таких как нейропептиды, может играть ключевую роль в долгосрочных эффектах после интенсивной вредной стимуляции.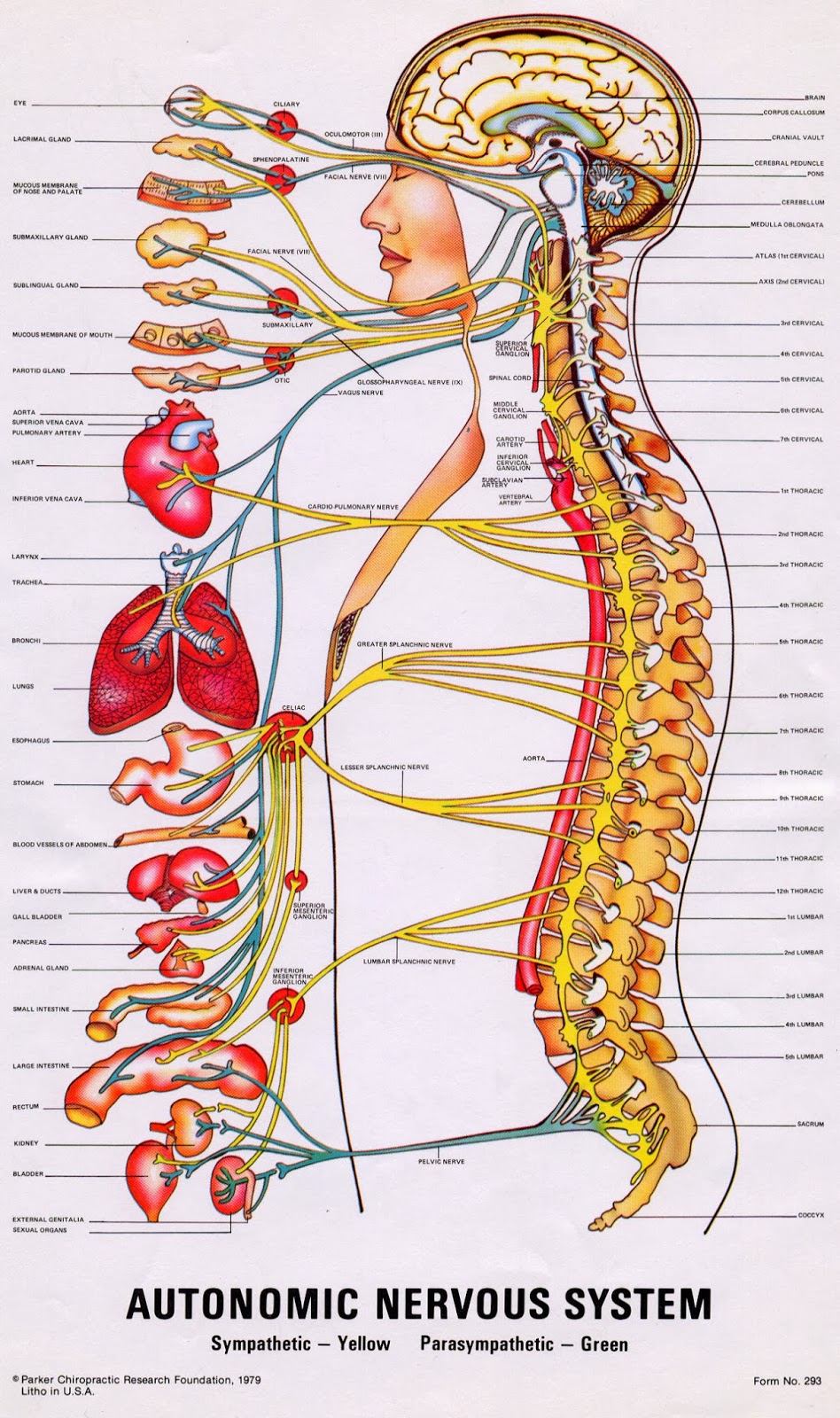 Эти дополнительные синаптические пептиды, среди их собственной сосудистой активности, также увеличивают возбудимость нейронов в дорсальном роге и запускают экспрессию немедленных-ранних генов, таким образом изменяя лежащую в основе хронизацию боли.
Эти дополнительные синаптические пептиды, среди их собственной сосудистой активности, также увеличивают возбудимость нейронов в дорсальном роге и запускают экспрессию немедленных-ранних генов, таким образом изменяя лежащую в основе хронизацию боли.
Передача нервного сигнала к нейронам тройничного нерва также включает присутствие некоторых пептидов с сильным сосудорасширяющим действием на сосуды головного мозга, которые являются важным звеном в патогенезе первичных цефалгий.Эти пептиды (пептид, связанный с геном кальцитонина — CGRP, вещество P (SP) и нейрокинин A — NKA) часто секретируются одним и тем же нейроном в разных количествах и комбинациях, что придает им удивительное функциональное разнообразие. Пептид, связанный с геном кальцитонина, является наиболее мощным вазодилататорным медиатором, обнаруженным в мозговом кровообращении, и его действие не зависит от эндотелия и связано с увеличением циклического АМФ в стенке сосудов [42–44].
Вещество P — недекапептид, участвующий в ноцицептивной передаче.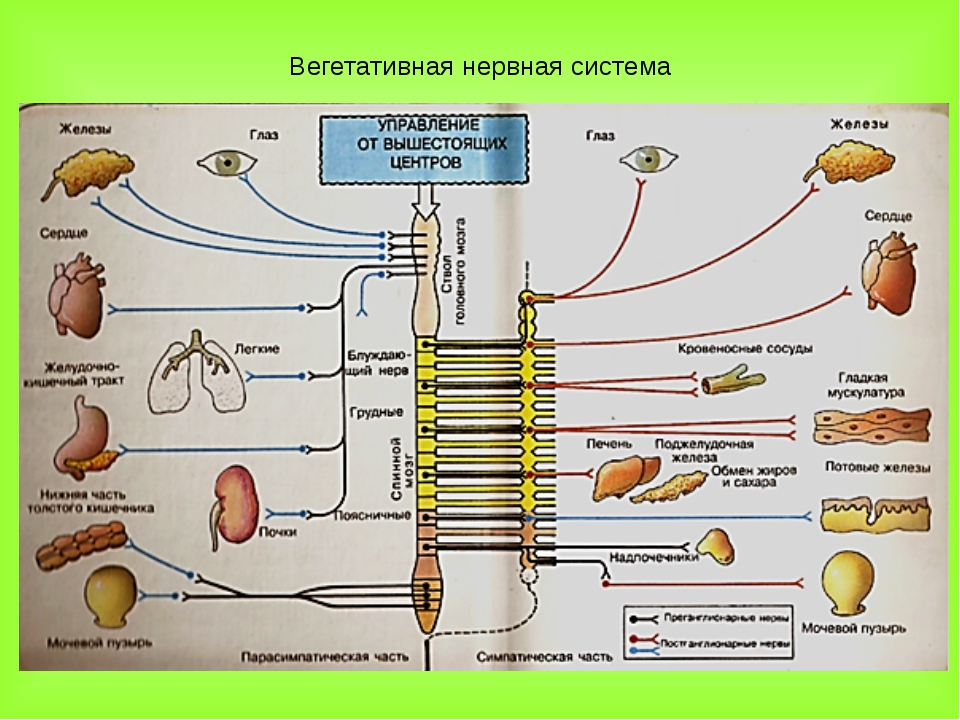 Во многих сосудистых руслах, включая церебральное, вещество P является сильнодействующим вазодилататором, а также расширяет артерии и вены in situ [45]. Вещество P может вызывать экстравазацию белка на периферии, и аналогичный ответ наблюдается в твердой мозговой оболочке с экстравазацией белка и дегрануляцией тучных клеток [46]. Нейрокинин А может расслаблять сосуды головного мозга как in vitro, , так и in vivo , хотя он лишь на одну десятую слабее, чем вещество P [47]. И вещество P, и NKA сосуществуют в периваскулярных нервных волокнах в периферических и церебральных сосудах [48].
Во многих сосудистых руслах, включая церебральное, вещество P является сильнодействующим вазодилататором, а также расширяет артерии и вены in situ [45]. Вещество P может вызывать экстравазацию белка на периферии, и аналогичный ответ наблюдается в твердой мозговой оболочке с экстравазацией белка и дегрануляцией тучных клеток [46]. Нейрокинин А может расслаблять сосуды головного мозга как in vitro, , так и in vivo , хотя он лишь на одну десятую слабее, чем вещество P [47]. И вещество P, и NKA сосуществуют в периваскулярных нервных волокнах в периферических и церебральных сосудах [48].
Возможно, что антиноцицептивная система активируется не только прямой стимуляцией, но также растормаживанием в ПАГ. Путем исследования экспрессии протеина c-FOS в активированных нейронах были обнаружены паттерны, отличные от нейрональной активности в структурах, участвующих в контроле обезболивания. Существование этих паттернов, отличных от разряда нейронов, особенно в позвоночнике, и обнаружение фонового шума предполагают существование тонической активности наиболее ноцицептивных нейронов в заднем роге костного мозга, определяемой надспинальными непрерывными разрядами эндогенной антиноцицептивной системы.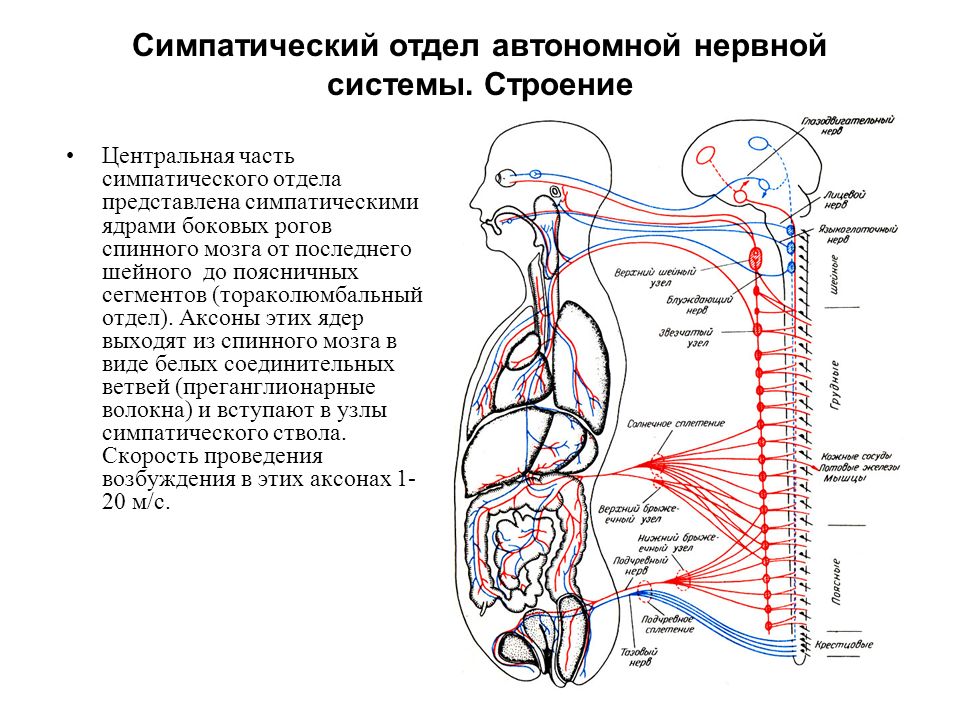 определение гипотезы «профилактической антиноцицептивной системы» [49].
определение гипотезы «профилактической антиноцицептивной системы» [49].
4. Дисфункция вегетативной системы при первичных головных болях
Точное участие автономной нервной системы (ВНС) в различных типах первичных головных болей все еще является предметом споров, поскольку до сих пор нет четкого объяснения различий, обнаруженных между различные исследования на людях и животных, касающиеся модуляции симпатической и парасимпатической нервной системы. Различия в результатах по дисвегетативным механизмам у пациентов с головной болью можно частично объяснить многочисленными методами, используемыми для количественной оценки активности ВНС, что позволяет получать конкретные результаты для различных систем, таких как сердечная (например.ж., вариабельность сердечного ритма), сердечно-сосудистой системы (например, гипотония), реакции зрачка, а также различными временными вариациями, влияющими на динамику вегетативной системы [50, 51].
Вегетативная дисфункция при различных типах первичной головной боли изучалась в нескольких исследованиях, большинство из которых посвящено анализу механизмов сердечно-сосудистых рефлексов или биохимических изменений [52–54]. Сегодня известно, что разные подтипы первичных головных болей имеют общие вегетативные механизмы, подразумевающие разные эндогенные молекулы и дисфункциональные взаимодействия между вегетативными путями и системой сосудов головного мозга [55].Результаты указывают в качестве центральных механизмов как симпатическую гиперфункцию, так и парасимпатическую гипофункцию в вегетативных проявлениях у пациентов с головной болью [56, 57].
Сегодня известно, что разные подтипы первичных головных болей имеют общие вегетативные механизмы, подразумевающие разные эндогенные молекулы и дисфункциональные взаимодействия между вегетативными путями и системой сосудов головного мозга [55].Результаты указывают в качестве центральных механизмов как симпатическую гиперфункцию, так и парасимпатическую гипофункцию в вегетативных проявлениях у пациентов с головной болью [56, 57].
4.1. Симпатическая нервная система и головная боль
Симпатические тракты, участвующие в сосудистой регуляции при головной боли, возникают в основном из ипсилатерального верхнего шейного ганглия, в то время как некоторые нервные волокна, снабжающие позвоночные и базилярные артерии, исходят из нижнего шейного ганглия и звездчатого ганглия [58, 59].
Сосудистая динамика и регуляция внутричерепного давления опосредуются норадреналином (NA) и нейропептидом Y (NPY) [60, 61]. Нейропептид Y широко распределяется по симпатическим нервным окончаниям вместе с NA и считается маркером норадренергической функции.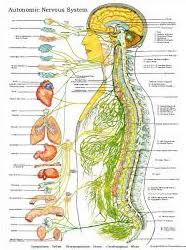 Было показано, что оба медиатора могут подвергаться внешнему влиянию, например, симпатэктомией, которая, в свою очередь, стимулирует экспрессию парасимпатических волокон [62]. NPY участвует в вегетативном контроле мозгового кровообращения и может участвовать в нарушениях, характеризующихся нейрогенными изменениями мозгового кровотока, такими как мигрень, кластерная головная боль и инсульт.Снижение концентрации NPY в бессимптомные периоды является дополнительным доказательством нарушения регуляции симпатической функции во время мигрени. Уровни NPY повышаются во время приступов у пациентов с мигренью [63]. Микроскопические и функциональные исследования показали, что экспрессия NPY становится заметной с увеличением симпатической активности [64]. Более того, было доказано, что NA модулирует реакцию мелких пиальных сосудов на поверхности коры и что симпатические волокна возникают из центральных источников, таких как голубое пятно (LC) или гипоталамус [65–67].Следовательно, при прямом воздействии разрушение LC вызывает уменьшение количества норадренергических нервных волокон во внутримозговых сосудах [59], в то время как, напротив, стимуляция нейронов NA в гипоталамусе связана с увеличением гипоталамического кровотока, что не является причиной под влиянием ганглионэктомии верхней шейки матки или антагониста β-адренорецепторов пропранолола [68].
Было показано, что оба медиатора могут подвергаться внешнему влиянию, например, симпатэктомией, которая, в свою очередь, стимулирует экспрессию парасимпатических волокон [62]. NPY участвует в вегетативном контроле мозгового кровообращения и может участвовать в нарушениях, характеризующихся нейрогенными изменениями мозгового кровотока, такими как мигрень, кластерная головная боль и инсульт.Снижение концентрации NPY в бессимптомные периоды является дополнительным доказательством нарушения регуляции симпатической функции во время мигрени. Уровни NPY повышаются во время приступов у пациентов с мигренью [63]. Микроскопические и функциональные исследования показали, что экспрессия NPY становится заметной с увеличением симпатической активности [64]. Более того, было доказано, что NA модулирует реакцию мелких пиальных сосудов на поверхности коры и что симпатические волокна возникают из центральных источников, таких как голубое пятно (LC) или гипоталамус [65–67].Следовательно, при прямом воздействии разрушение LC вызывает уменьшение количества норадренергических нервных волокон во внутримозговых сосудах [59], в то время как, напротив, стимуляция нейронов NA в гипоталамусе связана с увеличением гипоталамического кровотока, что не является причиной под влиянием ганглионэктомии верхней шейки матки или антагониста β-адренорецепторов пропранолола [68]. Эти анатомические и физиологические особенности, показывающие центральный контроль, могут представлять собой возможные терапевтические цели при первичных головных болях.
Эти анатомические и физиологические особенности, показывающие центральный контроль, могут представлять собой возможные терапевтические цели при первичных головных болях.
4.2. Парасимпатическая нервная система
Как известно, кровеносные сосуды головного мозга проявляют периваскулярные нервы, проявляющие парасимпатическую активность (опосредованную активностью ацетилхолина и ацетилхолинэстеразы [69, 70]. Подавляющее большинство парасимпатических нервных волокон, ведущих к сосудам головного мозга, подразумевает сфенопалатин и слуховые ганглии [71]. Достаточно интересно, что было показано, что парасимпатические нервы могут взаимодействовать с симпатическими окончаниями в непосредственной близости от эффектора гладких мышц цереброваскулярного аппарата [71].Активация тройничного нерва и последующая ноцицептивная передача сигналов опосредуют парасимпатический рефлекс, ведущий к высвобождению вазоактивных нейропептидов [9, 72, 73]. Вазодилатация черепных сосудов кажется общим свойством черепно-сосудистой динамики с участием сенсорных и парасимпатических механизмов [44, 74].
Наряду с ацетилхолином существуют и другие нейромессенджеры, которые опосредуют нейрогенную вазодилатацию, такие как вазоактивный кишечный пептид (VIP), полипептид, активирующий аденилатциклазу гипофиза (PACAP) и оксид азота (NO), что продемонстрировано экспериментальными ответами изолированных церебральных артерий и гемодинамических измерений in vivo [75–77].VIP является одним из парасимпатических передатчиков сигналов, участвующих в краниальном парасимпатическом оттоке через клиновидно-небные ганглии. Было показано, что VIP сосуществует с Ach в периваскулярных нервных волокнах вокруг сосудов головного мозга [78]. Хотя VIP-иммунореактивное нервное питание в мозговых артериях или венах скудно, считается, что концентрации VIP являются маркером парасимпатической активации при мигрени [79–81].
4.3. Патогенные вегетативные механизмы при головной боли
Большой объем данных свидетельствует о центральной роли сенсорных и парасимпатических механизмов в патофизиологии первичных головных болей.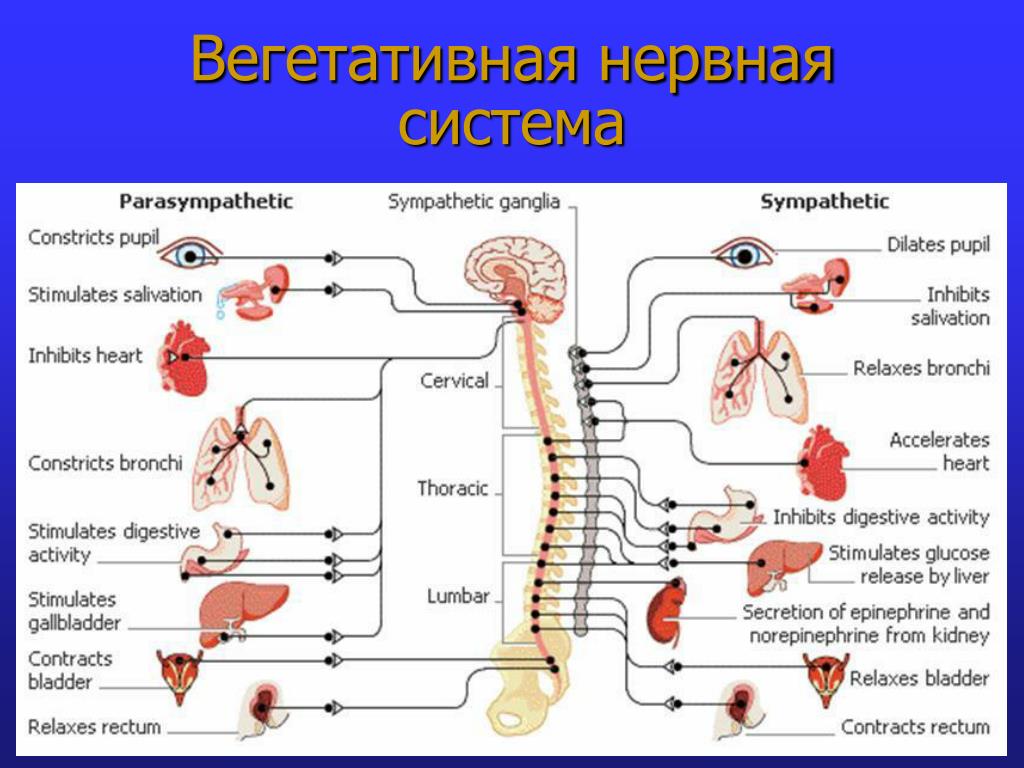 Исследования подтвердили наличие дисбаланса между парасимпатической и симпатической нервными системами, которые запускают патогенные механизмы и вносят вклад в клинические проявления первичных головных болей. Активация парасимпатического краниального оттока во время приступов мигрени и кластерной головной боли (КГ), по-видимому, связана с активацией тригеминоваскулярной системы, которая была описана ранее. Это подразумевает высвобождение специфических нейромедиаторов, таких как нейропептидный пептид, связанный с геном кальцитонина (CGRP) [82].
Исследования подтвердили наличие дисбаланса между парасимпатической и симпатической нервными системами, которые запускают патогенные механизмы и вносят вклад в клинические проявления первичных головных болей. Активация парасимпатического краниального оттока во время приступов мигрени и кластерной головной боли (КГ), по-видимому, связана с активацией тригеминоваскулярной системы, которая была описана ранее. Это подразумевает высвобождение специфических нейромедиаторов, таких как нейропептидный пептид, связанный с геном кальцитонина (CGRP) [82].
В некоторых исследованиях использовалась транскраниальная допплерография для оценки сосудистых колебаний, соответствующих миогенной цереброваскулярной регуляции у пациентов с мигренью и головной болью напряжения [55, 83]. Большинство данных сосредоточено на мигрени, хроническом нервно-сосудистом расстройстве, которое классически считается результатом дисбаланса симпатической системы, что обычно означает повышенную симпатическую активность, хотя некоторые исследования показали снижение симпатической активности [53, 57]. Как в продромальной фазе, так и в фазе головной боли приступа мигрени сначала наблюдаются вегетативные симптомы, такие как голод, сонливость и ортостатическая гипотензия, а затем, в фазе головной боли, рвота и тошнота, что указывает на тесную взаимосвязь между ВНС и этот вид головной боли [2].Вегетативные проявления подразумевают снижение уровня норадреналина в плазме и повышенную чувствительность адренергических рецепторов [53]. До сих пор существуют противоречивые данные о точном участии симпатической системы в мигрени. В некоторых исследованиях изучались сердечные и сердечно-сосудистые реакции при активации вагуса и симпатической нервной системы [84]. Повышенный базальный симпатический тонус также подтверждается частой ассоциацией гипертензии с мигренью [85]. Однако связь мигрени с вариациями артериального давления до сих пор неясна, поскольку есть исследования, показывающие повышенное диастолическое артериальное давление при мигрени, а также связь мигрени с более низким артериальным давлением [85].
Как в продромальной фазе, так и в фазе головной боли приступа мигрени сначала наблюдаются вегетативные симптомы, такие как голод, сонливость и ортостатическая гипотензия, а затем, в фазе головной боли, рвота и тошнота, что указывает на тесную взаимосвязь между ВНС и этот вид головной боли [2].Вегетативные проявления подразумевают снижение уровня норадреналина в плазме и повышенную чувствительность адренергических рецепторов [53]. До сих пор существуют противоречивые данные о точном участии симпатической системы в мигрени. В некоторых исследованиях изучались сердечные и сердечно-сосудистые реакции при активации вагуса и симпатической нервной системы [84]. Повышенный базальный симпатический тонус также подтверждается частой ассоциацией гипертензии с мигренью [85]. Однако связь мигрени с вариациями артериального давления до сих пор неясна, поскольку есть исследования, показывающие повышенное диастолическое артериальное давление при мигрени, а также связь мигрени с более низким артериальным давлением [85]. Симпатическая гипофункция при мигрени описана в исследованиях диаметра зрачка [82, 86], сердечно-сосудистых рефлекторных реакций и восстановления частоты сердечных сокращений [87]. Вариабельность сердечного ритма у пациентов с мигренью в течение более длительного периода времени отличалась от показателей здоровой контрольной группы при нормальной повседневной активности, что указывало на парасимпатическую гипофункцию у пациентов с мигренью [88].
Симпатическая гипофункция при мигрени описана в исследованиях диаметра зрачка [82, 86], сердечно-сосудистых рефлекторных реакций и восстановления частоты сердечных сокращений [87]. Вариабельность сердечного ритма у пациентов с мигренью в течение более длительного периода времени отличалась от показателей здоровой контрольной группы при нормальной повседневной активности, что указывало на парасимпатическую гипофункцию у пациентов с мигренью [88].
Симпатические кожные реакции [89] и уровни амилазы в слюне как маркер активности симпатоадреналового мозга [90], по-видимому, снижаются во время приступов мигрени, что свидетельствует о динамическом вовлечении симпатической системы в эту патологию.
Gass и Glaros [91] исследовали различные вегетативные биомаркеры, такие как вариабельность сердечного ритма, температура кожи, проводимость кожи и дыхание, у пациентов с мигренью и по сравнению со здоровыми людьми из контрольной группы, и обнаружили у пациентов с мигренью пониженную вариабельность последовательного R‐ Интервалы to-R свидетельствуют о гиперфункции симпатической нервной системы и снижении парасимпатического тонуса у пациентов с мигренью [91]. Yerdelen et al. [87] исследовали восстановление частоты сердечных сокращений после физических упражнений как показатель парасимпатической активности блуждающего нерва у пациентов с мигренью и головной болью напряжения (ГТГ) и контрольной группы и показали, что, хотя парасимпатическая функция не была нарушена у пациентов с мигренью и ГТГ, симпатический тонус в у пациентов с мигренью чаще по сравнению с пациентами с эпизодической головной болью напряжения [87].
Yerdelen et al. [87] исследовали восстановление частоты сердечных сокращений после физических упражнений как показатель парасимпатической активности блуждающего нерва у пациентов с мигренью и головной болью напряжения (ГТГ) и контрольной группы и показали, что, хотя парасимпатическая функция не была нарушена у пациентов с мигренью и ГТГ, симпатический тонус в у пациентов с мигренью чаще по сравнению с пациентами с эпизодической головной болью напряжения [87].
В интересном исследовании Tomé-Pires и Miró [92] измеряли реакции проводимости кожи (SCR) у пациентов с мигренью по сравнению с контрольными субъектами, представляя дескрипторы боли, эмоционально-негативные и нейтральные слова [92]. Авторы не показали различий в реакциях проводимости кожи в двух группах, но люди с мигренью запоминают больше эмоциональных слов, чем контрольная группа, что указывает на возможные новые способы модуляции восприятия боли при мигрени и вегетативных реакций.
4.4. Кластерная головная боль
Этот тип головной боли подразумевает офтальмологический отдел тройничного нерва, ответственный за проявления боли.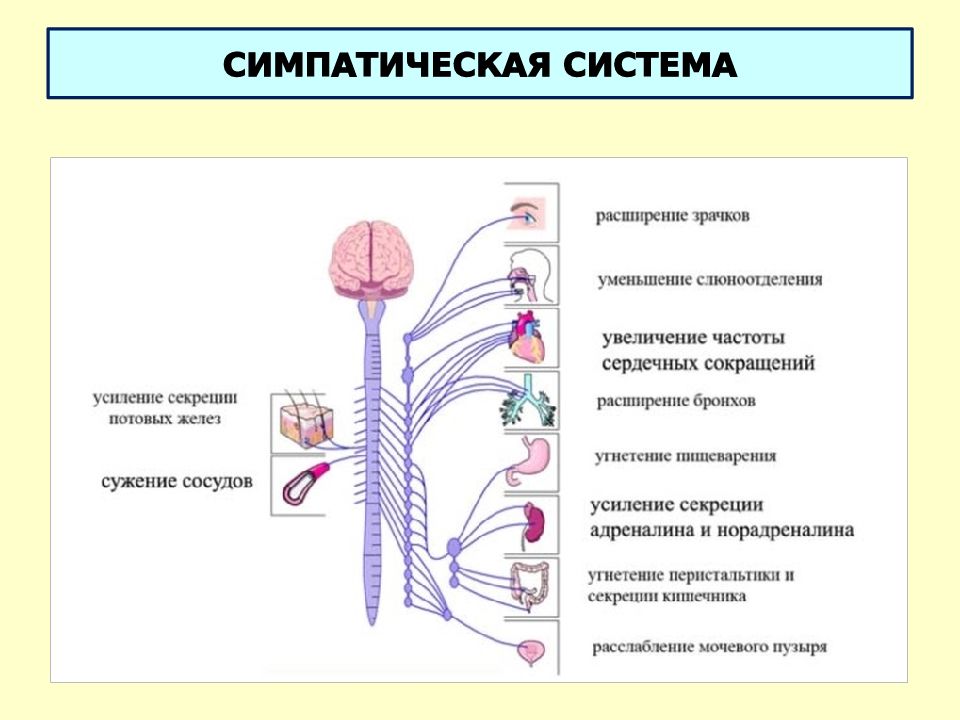 Кроме того, есть признаки чрезмерной активности парасимпатических нервов, воздействующей на сосудистую сеть лица и черепа, такие как слезотечение, заложенность носа и инъекции в глаза [2]. Черепные парасимпатические системы могут участвовать в опосредовании этих дисфункций с высвобождением VIP, стимулирующего вазомоторные лицевые симптомы [93]. Более того, было показано, что вредная химическая стимуляция слизистой оболочки лица крысы увеличивает внутричерепной кровоток за счет тригемино-парасимпатического рефлекса, что может объяснить участие вегетативных путей [94].В моделях на животных использовалось верхнее слюноотделение в качестве модели для измерения черепно-вегетативных симптомов и изменений кровотока в слезной железе / протоке в качестве меры краниальной автономной активации [95]. Верхнее слюнное ядро проецируется к черепным сосудам через клиновидно-небный ганглий через большой пиетрозный нерв лицевого нерва. Электрофизиологические методы измеряли нервную активность в ответ на стимуляцию верхнего слюноотделительного ядра.
Кроме того, есть признаки чрезмерной активности парасимпатических нервов, воздействующей на сосудистую сеть лица и черепа, такие как слезотечение, заложенность носа и инъекции в глаза [2]. Черепные парасимпатические системы могут участвовать в опосредовании этих дисфункций с высвобождением VIP, стимулирующего вазомоторные лицевые симптомы [93]. Более того, было показано, что вредная химическая стимуляция слизистой оболочки лица крысы увеличивает внутричерепной кровоток за счет тригемино-парасимпатического рефлекса, что может объяснить участие вегетативных путей [94].В моделях на животных использовалось верхнее слюноотделение в качестве модели для измерения черепно-вегетативных симптомов и изменений кровотока в слезной железе / протоке в качестве меры краниальной автономной активации [95]. Верхнее слюнное ядро проецируется к черепным сосудам через клиновидно-небный ганглий через большой пиетрозный нерв лицевого нерва. Электрофизиологические методы измеряли нервную активность в ответ на стимуляцию верхнего слюноотделительного ядра.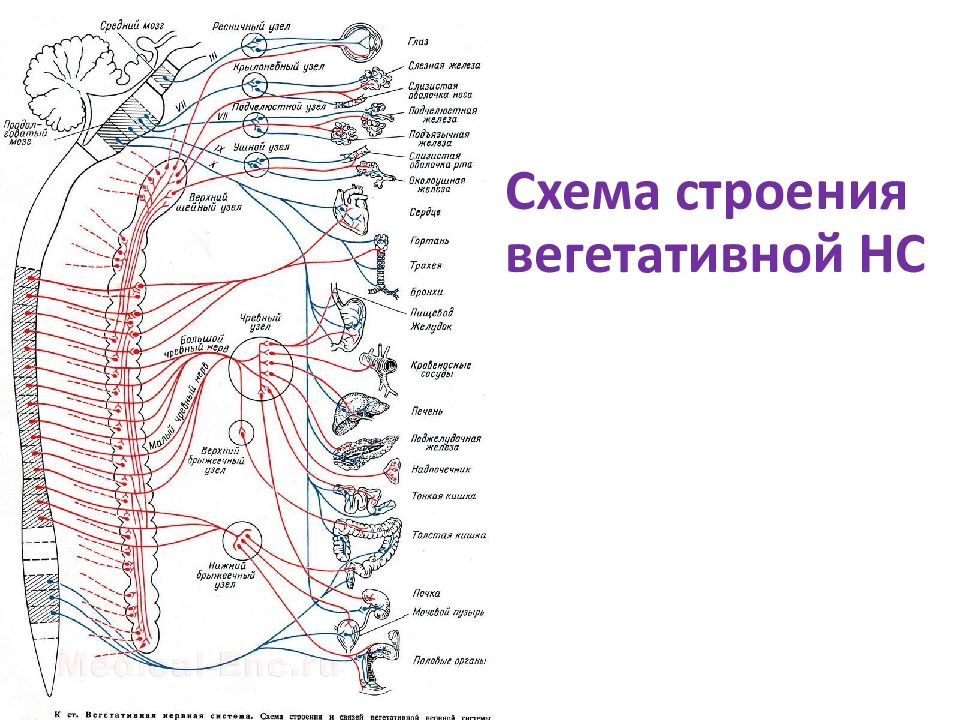 Было две популяции нейронов с разными латентными периодами действия.Реакция нейронов с более длительным латентным периодом опосредована активацией парасимпатического оттока, и действие кислорода, как терапевтический подход, вероятно, осуществляется через этот путь. Более короткая латентная реакция, по-видимому, наиболее вероятна за счет антидромной активации вегетативного рефлекса тройничного нерва [96]. Более того, было также показано, что задний гипоталамус может играть центральную роль в СН, что объясняет циркадную и околгодовую периодичность симптомов [97].
Было две популяции нейронов с разными латентными периодами действия.Реакция нейронов с более длительным латентным периодом опосредована активацией парасимпатического оттока, и действие кислорода, как терапевтический подход, вероятно, осуществляется через этот путь. Более короткая латентная реакция, по-видимому, наиболее вероятна за счет антидромной активации вегетативного рефлекса тройничного нерва [96]. Более того, было также показано, что задний гипоталамус может играть центральную роль в СН, что объясняет циркадную и околгодовую периодичность симптомов [97].
4.5. Головная боль напряжения (ГТН)
Связь между головной болью напряжения и активностью ВНС, хотя и встречается очень часто, менее документирована [87].Похоже, что хроническая ГТГ наряду с мигренью может быть связана с повышенным тонусом симпатической нервной системы, выражающимся в повышенной частоте сердечных сокращений в состоянии покоя, по сравнению с эпизодической ГТГ [93]. У пациентов с ГБН также может наблюдаться отсроченная адаптация частоты сердечных сокращений к стрессу и сниженное подавление системы контроля боли [97].
Несмотря на то, что динамика вмешательства ВНС при первичных головных болях еще полностью не изучена, появление трансляционных исследовательских моделей, а также разработка новых методов измерения вегетативных биомаркеров при головных болях обеспечивают прочную основу для новых и более эффективных терапевтических стратегий.
5. Вариабельность сердечного ритма как мера вегетативной нервной системы
при мигрени
Вегетативная нервная система (ВНС) выполняет важные функции по поддержанию гомеостаза, приспосабливая организм к внутренним потребностям и требованиям окружающей среды. Помимо ключевых функций, контролируемых ВНС, таких как дыхание, артериальное давление, частота сердечных сокращений, гормональная регуляция и т. Д., ВНС также участвует в регулировании эмоционального поведения и когнитивных функций.
Симпатическая нервная система (СНС) контролирует сердце, исходящее из верхней части грудного отдела спинного мозга.Преганглионарные волокна синапсируют с постганглионарными симпатическими волокнами и высвобождают ацетилхолин, который связывается с никотиновыми рецепторами на постганглионарных волокнах. Через симпатические адренергические эфферентные волокна распространяются на синоатриальные и атриовентрикулярные узлы в сердце, где они высвобождают норэпинефрин в синапсах с бета-адренорецепторами [98]. Стимуляция СНС увеличивает частоту сердечных сокращений (положительная хронотропия), сокращение желудочков (положительная инотропия), скорость проведения (положительная дромотропия) и скорость расслабления (положительная лузитропия).Парасимпатическая нервная система (ПНС) контролирует сердце, исходящее от ядер блуждающего нерва в продолговатом мозге в стволе мозга, а эфферентный нервный отток осуществляется через 10-й черепной нерв (блуждающий нерв). Длинные преганглионарные эфферентные нервные волокна простираются до сердца и синапсов с ганглиями, расположенными рядом с синоатриальными и атриовентрикулярными узлами. Высвобождается ацетилхолин, связывается с никотиновыми рецепторами и активирует короткие постганглионарные эфферентные нервные волокна. Эти постганглионарные волокна синапсы с мускариновыми рецепторами в синоатриальных и атриовентрикулярных узлах и активируются ацетилхолином.
Через симпатические адренергические эфферентные волокна распространяются на синоатриальные и атриовентрикулярные узлы в сердце, где они высвобождают норэпинефрин в синапсах с бета-адренорецепторами [98]. Стимуляция СНС увеличивает частоту сердечных сокращений (положительная хронотропия), сокращение желудочков (положительная инотропия), скорость проведения (положительная дромотропия) и скорость расслабления (положительная лузитропия).Парасимпатическая нервная система (ПНС) контролирует сердце, исходящее от ядер блуждающего нерва в продолговатом мозге в стволе мозга, а эфферентный нервный отток осуществляется через 10-й черепной нерв (блуждающий нерв). Длинные преганглионарные эфферентные нервные волокна простираются до сердца и синапсов с ганглиями, расположенными рядом с синоатриальными и атриовентрикулярными узлами. Высвобождается ацетилхолин, связывается с никотиновыми рецепторами и активирует короткие постганглионарные эфферентные нервные волокна. Эти постганглионарные волокна синапсы с мускариновыми рецепторами в синоатриальных и атриовентрикулярных узлах и активируются ацетилхолином.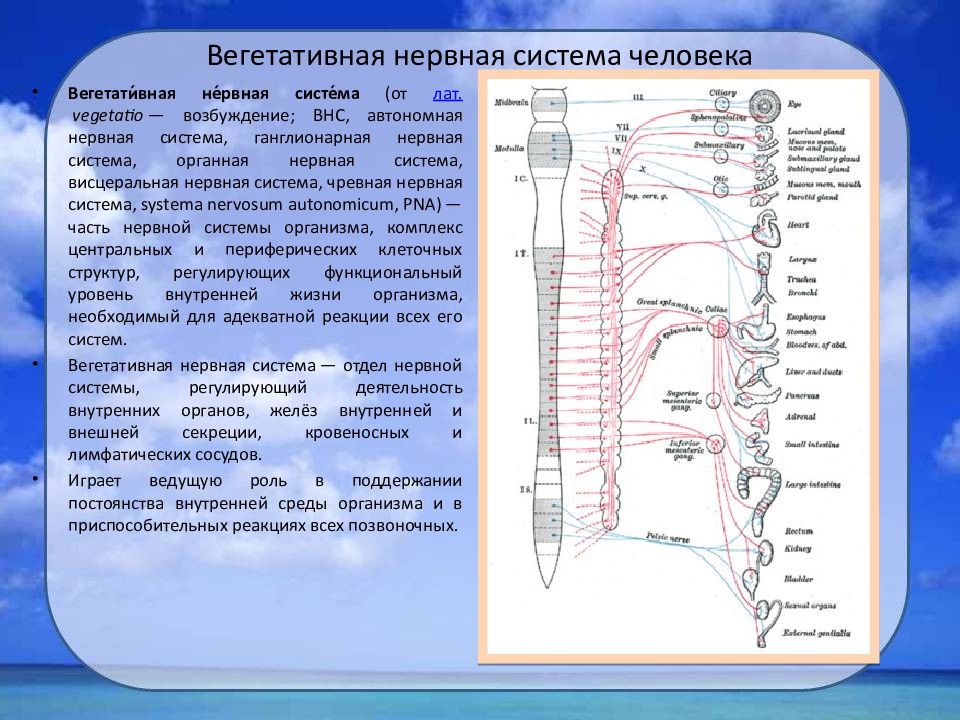 Для сердца ПНС снижает частоту сердечных сокращений (отрицательная хронотропия), силу сокращения предсердий (отрицательная инотропия), скорость расслабления (отрицательная лузитропия) и отрицательная дромотропия [98].
Для сердца ПНС снижает частоту сердечных сокращений (отрицательная хронотропия), силу сокращения предсердий (отрицательная инотропия), скорость расслабления (отрицательная лузитропия) и отрицательная дромотропия [98].
Действия SNS и PNS часто противоположны по своим эффектам, и обычно активности SNS и PNS находятся в динамическом равновесии, что указывает на здоровую и гибкую физиологическую систему [99]. Вегетативный дисбаланс, описываемый повышенной активностью СНС и подавлением активности ПНС, связан с повышенным риском заболеваний [99].Центральный контроль сердечно-сосудистой системы включает несколько областей спинного, бульбопонтинного, понтомезэнцефалического и переднего мозга. Медуллярные центры работают через рефлекторные сердечно-сосудистые механизмы, такие как барорефлекс, хеморефлекс и сердечно-легочный рефлекс [100]. Афферентные волокна сердечно-сосудистых рефлексов оканчиваются в ядерном тракте солитарии [100]. Ретикулярная формация вентролатерального мозгового вещества (VLM) является основным центральным участком, который регулирует отток симпатической нервной системы, тем самым внося вклад в регуляцию АД и частоты сердечных сокращений (ЧСС).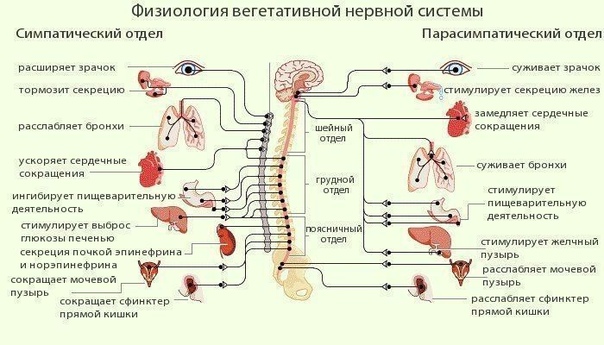 В ростральной части VLM находятся возбуждающие нейроны, которые синапсами находятся в промежуточно-латеральном сером столбце спинного мозга, а в каудальной части VLM — тормозящие нейроны, которые посылают проекции в ростральные VLM. Преганглионарные парасимпатические нейроны, расположенные в ядре неоднозначного и дорсальном моторном ядре блуждающего нерва, участвуют в парасимпатической регуляции сердечных рефлексов [101]. Также парабрахиальное ядро, ядро Kolliker-Fuse, кластер клеток A5 являются центрами ствола мозга, участвующими в контроле сердечно-сосудистой системы.
В ростральной части VLM находятся возбуждающие нейроны, которые синапсами находятся в промежуточно-латеральном сером столбце спинного мозга, а в каудальной части VLM — тормозящие нейроны, которые посылают проекции в ростральные VLM. Преганглионарные парасимпатические нейроны, расположенные в ядре неоднозначного и дорсальном моторном ядре блуждающего нерва, участвуют в парасимпатической регуляции сердечных рефлексов [101]. Также парабрахиальное ядро, ядро Kolliker-Fuse, кластер клеток A5 являются центрами ствола мозга, участвующими в контроле сердечно-сосудистой системы.
Верхний уровень ствола мозга включает периакведуктальное серое вещество (PAG), которое объединяет вегетативный контроль с модуляцией боли и поведенческими реакциями на стресс [102]. Уровень переднего мозга включает паравентрикулярные и родственные ядра гипоталамуса, таламуса, миндалины и передней поясной коры, островную и медиальную префронтальную кору, которая объединяет вегетативные и эндокринные реакции [102].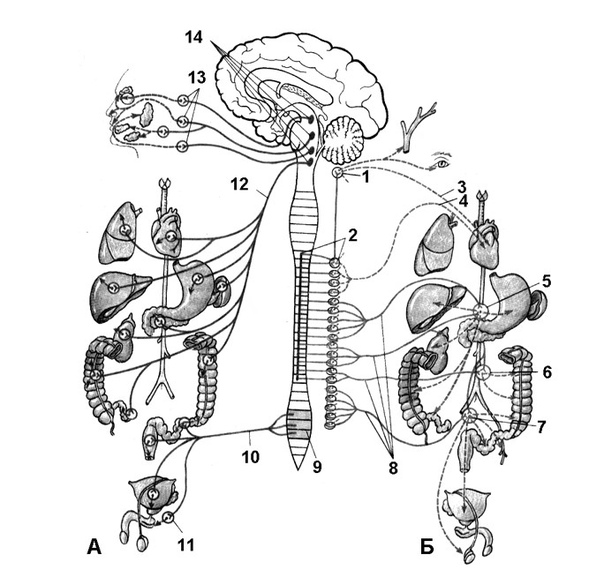 Передний лимбический контур (островок, передняя поясная кора и миндалевидное тело) обеспечивает интеграцию специфических ощущений с эмоциональными и целевыми вегетативными реакциями [102].Электрическая стимуляция префронтальной и поясной коры, левого островка, латерального ядра гипоталамуса снижает частоту сердечных сокращений и артериальное давление, тогда как электрическая стимуляция правого островка, вентромедиального ядра гипоталамуса увеличивает частоту сердечных сокращений и артериальное давление [103]. Стимуляция базолатерального ядра миндалины повышает кровяное давление и снижает частоту сердечных сокращений; Стимуляция рострального ядра миндалины приводит к депрессивным эффектам и различным изменениям частоты сердечных сокращений [103].
Передний лимбический контур (островок, передняя поясная кора и миндалевидное тело) обеспечивает интеграцию специфических ощущений с эмоциональными и целевыми вегетативными реакциями [102].Электрическая стимуляция префронтальной и поясной коры, левого островка, латерального ядра гипоталамуса снижает частоту сердечных сокращений и артериальное давление, тогда как электрическая стимуляция правого островка, вентромедиального ядра гипоталамуса увеличивает частоту сердечных сокращений и артериальное давление [103]. Стимуляция базолатерального ядра миндалины повышает кровяное давление и снижает частоту сердечных сокращений; Стимуляция рострального ядра миндалины приводит к депрессивным эффектам и различным изменениям частоты сердечных сокращений [103].
Нормальная симпатовагальная регуляция вызывает увеличение частоты сердечных сокращений во время вдоха и снижение во время выдоха, и это физиологическое явление известно как дыхательная аритмия. Собственная частота сердечных сокращений составляет 105 ударов в минуту, в то время как частота сердечных сокращений в состоянии покоя составляет всего 60–80 ударов в минуту, что указывает на то, что сердце находится в состоянии «доминирования блуждающего нерва» [104].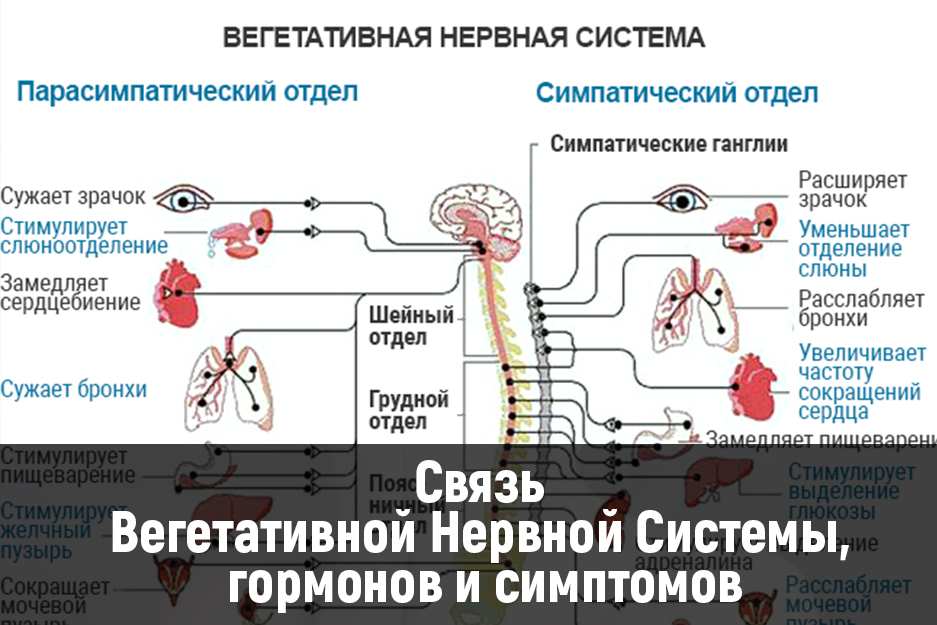
Электрический сигнал, производимый сердцем, можно измерить с помощью электрокардиограммы. Электрокардиограмма регистрирует деполяризацию предсердий (зубец P), деполяризацию желудочков (комплекс QRS) и реполяризацию желудочков (зубец T).Используя эти точки, мы можем измерить сердечный период или интервал между ударами, которые измеряют время между двумя последовательными ударами сердца в миллисекундах [105]. Частота сердечных сокращений (ЧСС) измеряет количество последовательных сердечных сокращений за 1 мин (ударов в минуту). Анализ последовательных интервалов R-R синусового ритма известен как вариабельность сердечного ритма (ВСР), неинвазивный электрокардиографический маркер, отражающий активность ВНС в отношении функции синусового узла.
Параметры ВСР могут быть рассчитаны во временной области (статистической и геометрической), частотной области (спектральная плотность мощности) и нелинейными измерениями.В методах временной области параметры ВСР представляют собой стандартное отклонение между нормальными интервалами во время записи — SDNN (мс), стандартное отклонение средних значений интервалов NN, рассчитанных по всем 5-минутным сегментам всей записи — SDANN (мс), квадратный корень из среднее значение суммы квадратов разностей между соседними интервалами NN — RMSSD (мс), процент различий между соседними интервалами NN, различающихся более чем на 50 мс — pNN50% [105].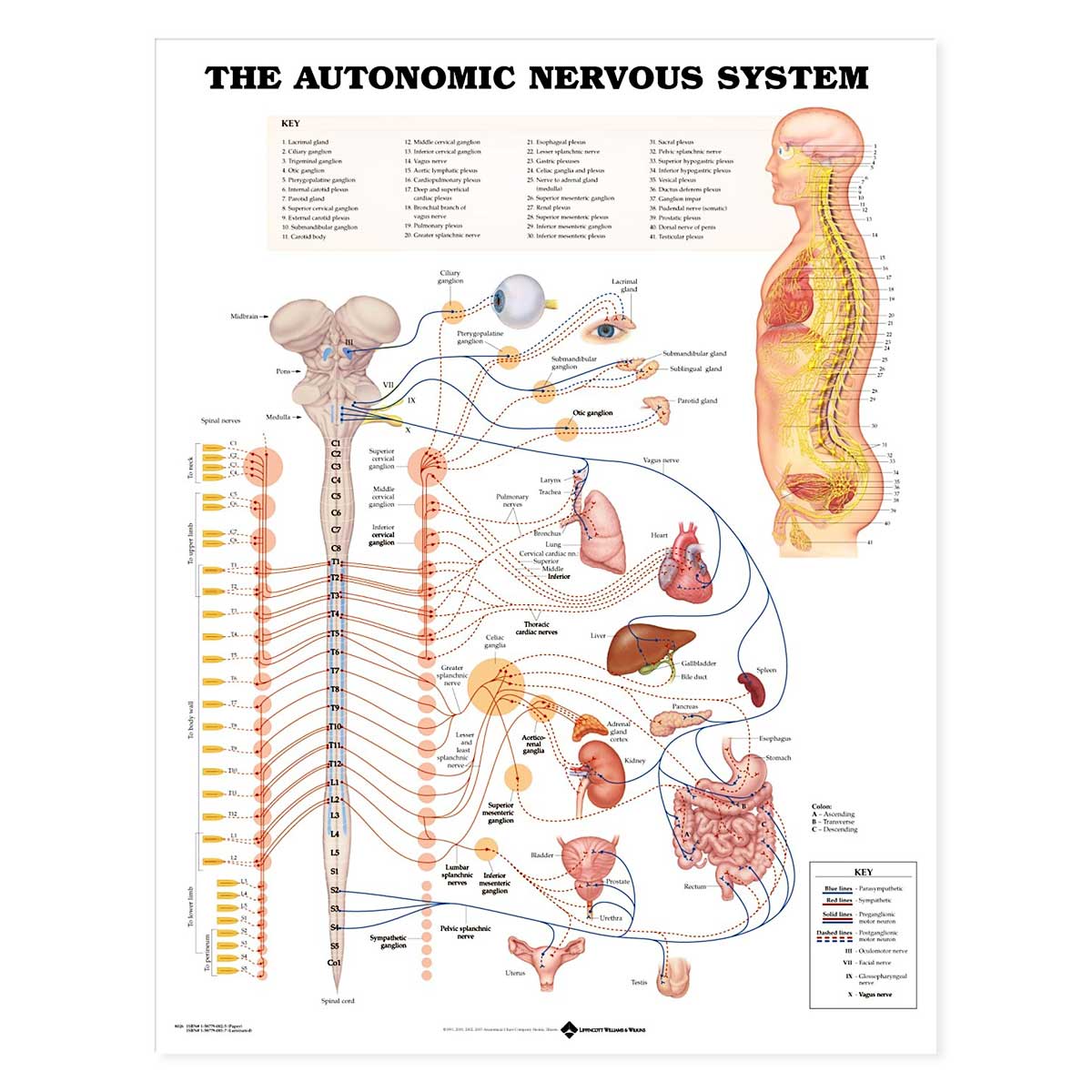 Многие исследования показывают, что SDNN, RMSSD и pNN50%, индикаторы ВСР во временной области, отражают активность блуждающего нерва.
Многие исследования показывают, что SDNN, RMSSD и pNN50%, индикаторы ВСР во временной области, отражают активность блуждающего нерва.
Используя одновременно метод быстрого преобразования Фурье и параметрически-авторегрессионный метод (AR), ВСР можно анализировать в частотной области (спектральный анализ мощности ВСР), в которой можно измерить низкочастотный компонент (НЧ <0,15 Гц), взятый в качестве индикатор как вагусной, так и симпатической функции, высокочастотный компонент (HF ≥ 0,15 Гц) как индикатор парасимпатической функции, очень низкочастотный компонент (VLF - полоса частот в диапазоне 0,003–0,04 Гц), сверхнизкочастотный (ULF - полоса частот ниже 0.003 Гц) и полной мощности (TP) [105, 106]. VLF связаны с терморегуляторной активностью симпатических сосудов и колебаниями в ренин-ангиотензиновой системе [107]. Отношение LF / HF рассматривается как показатель баланса сердечного симпатического / парасимпатического тонуса.
Нарушения в SNS или PNS были обнаружены у пациентов с мигренью во время фазы без головной боли [108, 109]. Некоторые исследователи выявили симпатическую гипофункцию и парасимпатическую гиперфункцию у пациентов с мигренью в тот же период [83, 110].Другое исследование показало, что пожилые пациенты с мигренью могут иметь симпатическую гиперфункцию и парасимпатическую гипофункцию во время интервалов без головной боли [111]. Martin et al. [112] обнаружили снижение ЧСС во время глубокого дыхания и после 2 минут наклона. Appel et al. [113] выявили увеличение низкочастотного диапазона анализа ВСР у мигрени, что свидетельствует об увеличении симпатической активности.
Некоторые исследователи выявили симпатическую гипофункцию и парасимпатическую гиперфункцию у пациентов с мигренью в тот же период [83, 110].Другое исследование показало, что пожилые пациенты с мигренью могут иметь симпатическую гиперфункцию и парасимпатическую гипофункцию во время интервалов без головной боли [111]. Martin et al. [112] обнаружили снижение ЧСС во время глубокого дыхания и после 2 минут наклона. Appel et al. [113] выявили увеличение низкочастотного диапазона анализа ВСР у мигрени, что свидетельствует об увеличении симпатической активности.
Мы попытались проанализировать участие ВНС в мигрени, используя ВСР на долгосрочной 24-часовой ЭКГ.Мы исследовали 27 субъектов с мигренью (10 с мигренью с аурой и 17 без ауры) в периоды без головной боли и 10 здоровых контрольных субъектов соответствующего возраста. Мы обнаружили значительное снижение SDNN, RMSSD и HF, указывающее на парасимпатическую дисфункцию в группах мигрени в периоды без головной боли в ночное время, и больше всего страдали пациенты с мигренью с аурой (рисунки 1 и 2). Соотношение LF и LF / HF увеличивалось в ночное время у пациентов с мигренью с аурой (Рисунки 3 и 4). В обеих группах больных мигренью мы обнаружили дисфункцию вегетативной нервной системы.Наиболее выраженное нарушение ВНС присутствует в группе страдающих мигренью с аурой, где мы обнаружили симпатическую гиперфункцию, связанную с парасимпатической гипофункцией, особенно ночью с потерей циркадных ритмов [114].
Соотношение LF и LF / HF увеличивалось в ночное время у пациентов с мигренью с аурой (Рисунки 3 и 4). В обеих группах больных мигренью мы обнаружили дисфункцию вегетативной нервной системы.Наиболее выраженное нарушение ВНС присутствует в группе страдающих мигренью с аурой, где мы обнаружили симпатическую гиперфункцию, связанную с парасимпатической гипофункцией, особенно ночью с потерей циркадных ритмов [114].
Рисунок 1.
Корень квадратный из среднего значения суммы квадратов различий между соседними интервалами NN — RMSSD (мс) в исследуемых группах (C, контрольная группа; M, группа мигрени без ауры, MA, мигрень с аурой). группа).
Рисунок 2.
Высокочастотный компонент спектрального анализа мощности ВСР в исследуемых группах.
Рисунок 3.
Низкочастотная составляющая спектрального анализа мощности ВСР в исследуемых группах.
Рисунок 4.
Соотношение LF / HF в исследуемых группах.
ВСР связана с высокофункциональной ингибирующей активностью префронтальной коры над подкорковыми структурами, которые заставляют организм хорошо адаптироваться к окружающей среде. Низкая ВСР связана со снижением префронтального тормозящего контроля над подкорковыми структурами и неспособностью распознавать сигналы безопасности [104]. Отсутствие торможения приводит к продолжению обработки информации о страхе и связано с тревогой и депрессией [115].Было показано, что хронический психологический стресс и депрессивное настроение связаны с преобладанием СНС и отменой блуждающего нерва, на что указывает снижение ВСР [115, 116]. В нашем исследовании мы обнаружили повышенную частоту тревожных и депрессивных симптомов у пациентов с мигренью, особенно в группе мигрени с аурой [114]. У людей с высоким уровнем стресса, тревожности и депрессии наблюдается дисбаланс между действиями ПНС и СНС. Продолжительный стресс может влиять на здоровье несколькими способами, т. Е.е., изменения в вегетативной нервной системе (усиление SNS и снижение PNS), нейроэндокринной активности, иммунных, поведенческих и когнитивных функций.
Низкая ВСР связана со снижением префронтального тормозящего контроля над подкорковыми структурами и неспособностью распознавать сигналы безопасности [104]. Отсутствие торможения приводит к продолжению обработки информации о страхе и связано с тревогой и депрессией [115].Было показано, что хронический психологический стресс и депрессивное настроение связаны с преобладанием СНС и отменой блуждающего нерва, на что указывает снижение ВСР [115, 116]. В нашем исследовании мы обнаружили повышенную частоту тревожных и депрессивных симптомов у пациентов с мигренью, особенно в группе мигрени с аурой [114]. У людей с высоким уровнем стресса, тревожности и депрессии наблюдается дисбаланс между действиями ПНС и СНС. Продолжительный стресс может влиять на здоровье несколькими способами, т. Е.е., изменения в вегетативной нервной системе (усиление SNS и снижение PNS), нейроэндокринной активности, иммунных, поведенческих и когнитивных функций.
Многие другие факторы, такие как алкоголь, никотин, физические упражнения, возраст, пол, диабет, гипертония, сердечно-сосудистые заболевания, апноэ во сне, хронические респираторные заболевания или лекарства (половые стероидные гормоны, антидепрессанты, μ‐ блокаторы и т. Д.) Могут влиять на вегетативная нервная система [117–121]. Более того, ВНС демонстрирует циркадные вариации [122].
Д.) Могут влиять на вегетативная нервная система [117–121]. Более того, ВНС демонстрирует циркадные вариации [122].
Поражение ВНС во время фазы предупреждения приступа мигрени можно предположить по многим симптомам и признакам с потенциальным поражением гипоталамуса (депрессия, раздражительность, усталость, тяга к пище и учащение зевоты), ствола мозга (ригидность шеи) и коры головного мозга ( аномальная чувствительность к свету, звуку и запаху) [123]. Во время фазы боли могут возникать тошнота, рвота, головокружение, кожная вазоконстрикция или расширение сосудов, инъекция конъюнктивы, слезотечение, заложенность носа, ринорея, отек век, пилоэрекция и потоотделение [108, 109].Также могут появиться сопутствующие психологические и когнитивные симптомы — неспособность организовывать мысли и планы, физическое истощение, замешательство, возбуждение, агрессивность, депрессия и беспокойство.
Мигрень может быть вызвана различными триггерами, включая яркий свет, звуки, голод и умственное напряжение; плохое качество сна, менструации, чрезмерное употребление алкоголя, шоколада и ферментированного сыра. Сон обычно успокаивает боль.
Сон обычно успокаивает боль.
В нашем исследовании, когда мы спрашивали пациентов о качестве сна и сновидениях, они жаловались на плохое качество сна.Большинство из них испытывают негативные ощущения, такие как тревога, страх или ужас, и такие ощущения, как ощущение падения и безуспешные попытки сделать различные вещи [114]. Эти наблюдения предполагают, что есть некоторая неисправность в префронтальной коре, лимбической системе, миндалине и гипоталамусе, элементах, участвующих в патофизиологии сновидений и мигрени [124]. Активация лимбической системы, миндалевидного тела и передней поясной коры, наблюдаемая во время сна с быстрым движением глаз, участвует в регуляции сердечно-сосудистой системы и может отражать реакции на сильные эмоции, такие как страх и тревогу, обнаруживаемые у пациентов с мигренью в ночное время [125].
Когда физиологические факторы стресса, такие как приступы мигрени, являются частыми и стойкие аллостатические реакции могут стать дезадаптивными, что приведет к изменениям в системе организма.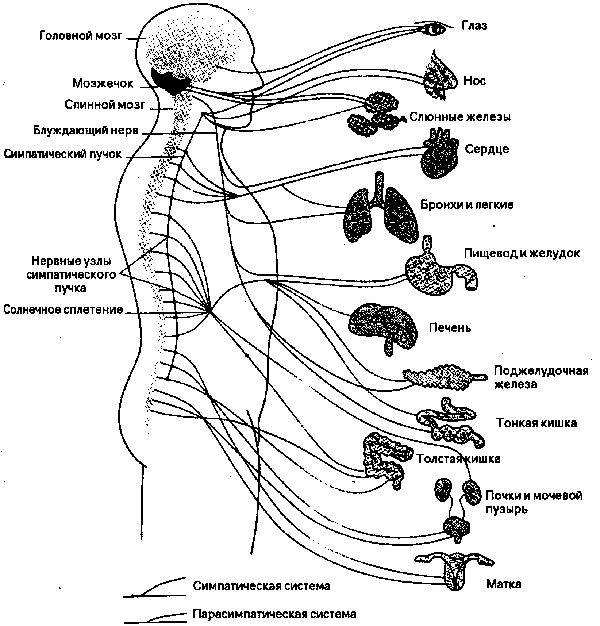 У пациентов с мигренью был обнаружен повышенный уровень кортизола в плазме в периоды без головной боли [126] и во время периода боли [127]. Повышенный хронический уровень кортизола может вызвать атрофию ПФУ, снизить уровень дофамина в цепях удовольствия мозга, истощить норэпинефрин в ЦП и снизить уровни серотониновых рецепторов лобных долей, тем самым способствуя однотонности эмоций, ослаблению концентрации, нарушению настроения и плохому настроению. качество сна [128].Нейрогенез и апоптоз в гиппокампе подавляются [129], а также выявляется нарушение регуляции вегетативной нервной системы и гипоталамо-гипофизарно-надпочечниковой системы с изменениями в регуляции гормонов во время хронического стресса. При хронической мигрени наблюдается уменьшение объема миндалины [130], что может быть связано с высоким уровнем тревоги или страха у этих пациентов [131]. При хронической мигрени, помимо кортизола, сообщалось о других нарушениях секреции гормонов пролактина и мелатонина [132].Недосыпание и нарушение циркадного ритма могут иметь негативные последствия для функций организма, включая повышенный аппетит, повышенный уровень провоспалительных цитокинов, снижение парасимпатического и повышенного симпатического тонуса, повышение артериального давления и повышение уровня инсулина и глюкозы в крови [133].
У пациентов с мигренью был обнаружен повышенный уровень кортизола в плазме в периоды без головной боли [126] и во время периода боли [127]. Повышенный хронический уровень кортизола может вызвать атрофию ПФУ, снизить уровень дофамина в цепях удовольствия мозга, истощить норэпинефрин в ЦП и снизить уровни серотониновых рецепторов лобных долей, тем самым способствуя однотонности эмоций, ослаблению концентрации, нарушению настроения и плохому настроению. качество сна [128].Нейрогенез и апоптоз в гиппокампе подавляются [129], а также выявляется нарушение регуляции вегетативной нервной системы и гипоталамо-гипофизарно-надпочечниковой системы с изменениями в регуляции гормонов во время хронического стресса. При хронической мигрени наблюдается уменьшение объема миндалины [130], что может быть связано с высоким уровнем тревоги или страха у этих пациентов [131]. При хронической мигрени, помимо кортизола, сообщалось о других нарушениях секреции гормонов пролактина и мелатонина [132].Недосыпание и нарушение циркадного ритма могут иметь негативные последствия для функций организма, включая повышенный аппетит, повышенный уровень провоспалительных цитокинов, снижение парасимпатического и повышенного симпатического тонуса, повышение артериального давления и повышение уровня инсулина и глюкозы в крови [133]. Гормональные дисфункции в регуляции эстрогена и прогестерона часто встречаются у пациентов с мигренью, и мигрень улучшается после менопаузы или с помощью гормональной терапии [134].
Гормональные дисфункции в регуляции эстрогена и прогестерона часто встречаются у пациентов с мигренью, и мигрень улучшается после менопаузы или с помощью гормональной терапии [134].
Совокупное воздействие мигрени на организм, а также ее лечение представляют собой аллостатическую нагрузку [135].Раннее прерывание порочного цикла с прямой связью с использованием различных методов (лекарства и снижение стресса) важно для снижения аллостатической нагрузки [135].
6. Новые направления в лечении первичных головных болей
Классически считается, что мигрень может реагировать на несколько различных фармакологических агентов, таких как обезболивающие (например, триптаны) в острой фазе и профилактические препараты, такие как противоэпилептические средства (например, топирамат), CH реагирует на кислород и парентеральные триптаны, в то время как верапамил наиболее эффективен для профилактики.Пароксизмальная гемикрания реагирует на индометацин. SUNCT / SUNA реагирует на ламотриджин и топирамат. Гемикрания континуума отвечает на индометацин [136].
Гемикрания континуума отвечает на индометацин [136].
6.1. Нейростимуляция
Многообещающим и довольно новым направлением в лечении головной боли, по-видимому, является нейромодуляция центральной системы боли и вегетативных путей. Эти неинвазивные методы могут помочь пациентам с хроническими и фармакорезистентными формами головной боли. Таким образом, сообщалось, что чрескожная стимуляция парасимпатической нервной системы через блуждающий нерв может купировать приступы мигрени [137].Стимуляция блуждающего нерва представляет собой хорошо отработанную нефармакологическую стратегию у пациентов с эпилепсией с трудноизлечимыми приступами, а также у пациентов с депрессией. Некоторые группы пациентов с эпилепсией с имплантированными ВНС показали улучшение симптомов мигрени, но возможная причинная связь с уменьшением частоты приступов все еще требует обсуждения [138]. Точно так же у пациентов с мигренью, получавших VNS от депрессии, наблюдалось улучшение приступов мигрени [139].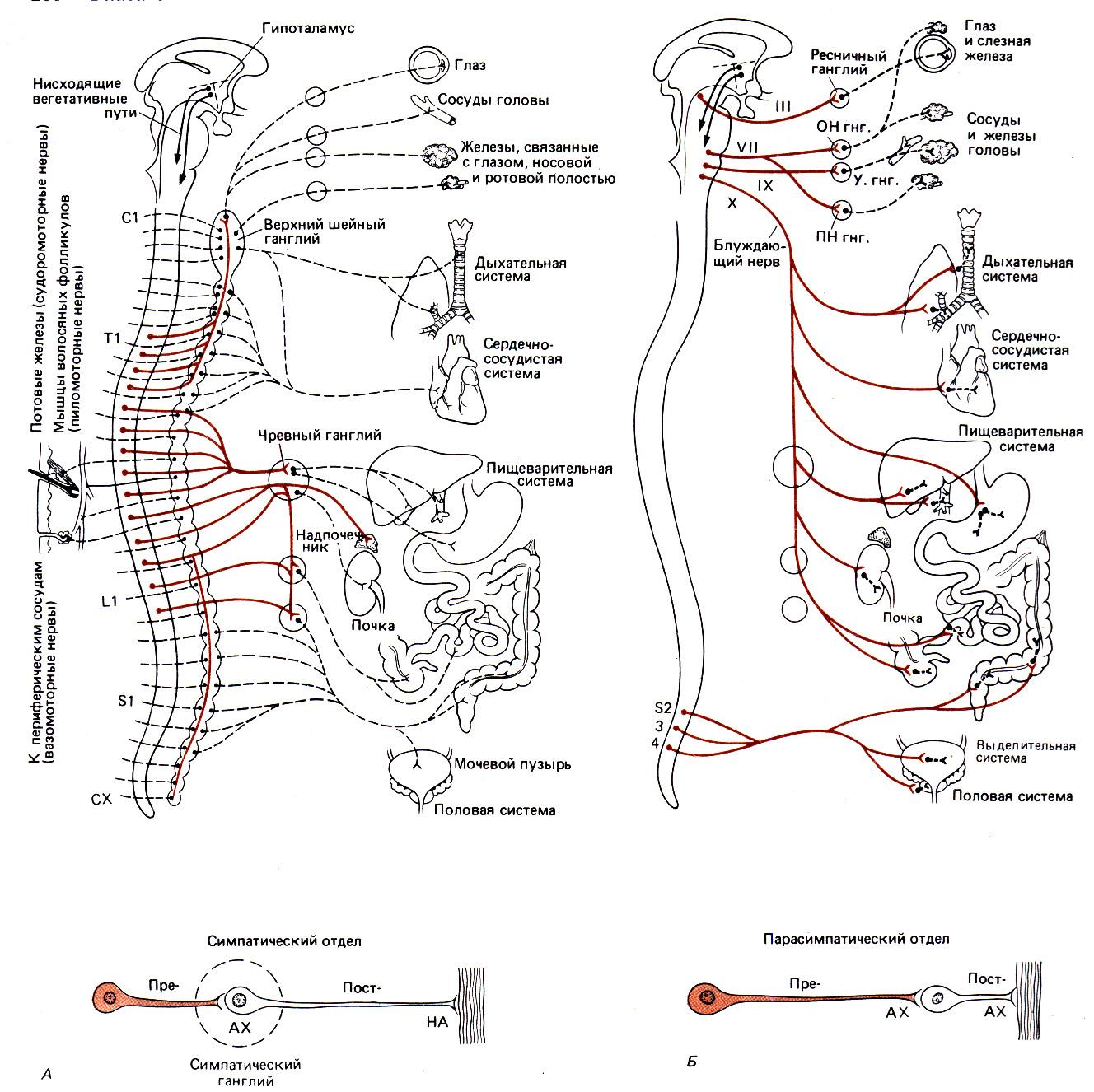 Тем не менее, необходимы дальнейшие исследования, чтобы прояснить точную корреляцию между эффектами VNS и механизмами мигрени.
Тем не менее, необходимы дальнейшие исследования, чтобы прояснить точную корреляцию между эффектами VNS и механизмами мигрени.
Недавно было показано, что пациенты с CH, по-видимому, также получают пользу от неинвазивного VNS с улучшением их исходного состояния примерно на 50% [140]. С другой стороны, стимуляция затылочного нерва (ONS) доказала положительные клинические результаты в лечении рефрактерной хронической СН в хорошо задокументированных случаях, но исследования в этом направлении все еще ограничены. Активация гипоталамуса во время кластерных атак привела к внедрению техники глубокой стимуляции головного мозга (DBS) для рефрактерной ХГ с довольно положительными эффектами.Тем не менее, существует потребность в дальнейшем подтверждении этого метода при СН с точки зрения целевых анатомо-функциональных центров и отбора пациентов для получения хорошего результата соотношения риск / польза [141, 142].
6.2. Модуляция сигнальных молекул
Мигрень рассматривается как синдром хронически низкой центральной серотониновой системы с последующей гиперчувствительностью 5-HT рецепторов, с приступами мигрени, вызванными внезапным увеличением высвобождения 5-HT [143].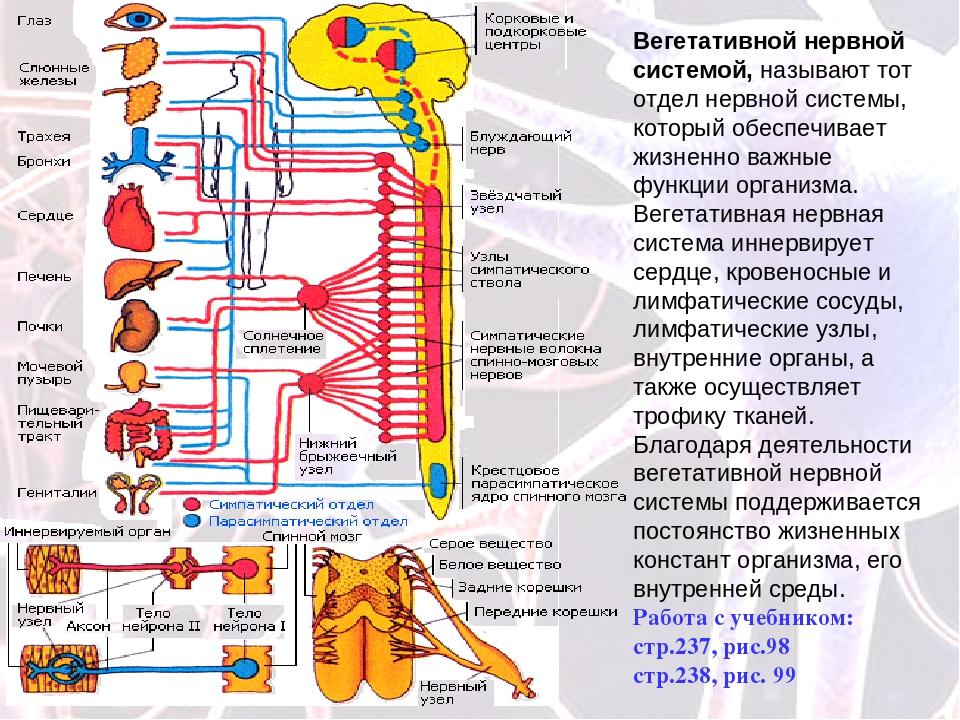 Таким образом, препараты, нацеленные на определенные серотонинергические пути, показали свою эффективность при лечении острых мигрени.Триптаны являются селективными агонистами серотонина, специфически действующими на рецепторы 5-гидрокситриптамина 1B / 1D / 1F (5-HT1B / 1D / 1F) внутричерепных кровеносных сосудов и сенсорных нервных окончаний. Первый комбинированный препарат триптана и нестероидного противовоспалительного препарата (напроксен) был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в апреле 2008 года. Суматриптан / напроксен натрия сообщил о более эффективных результатах в уменьшении боли и связанных с мигренью симптомов светобоязни и фонофобии [144].
Таким образом, препараты, нацеленные на определенные серотонинергические пути, показали свою эффективность при лечении острых мигрени.Триптаны являются селективными агонистами серотонина, специфически действующими на рецепторы 5-гидрокситриптамина 1B / 1D / 1F (5-HT1B / 1D / 1F) внутричерепных кровеносных сосудов и сенсорных нервных окончаний. Первый комбинированный препарат триптана и нестероидного противовоспалительного препарата (напроксен) был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в апреле 2008 года. Суматриптан / напроксен натрия сообщил о более эффективных результатах в уменьшении боли и связанных с мигренью симптомов светобоязни и фонофобии [144].
Новая стратегия профилактики с помощью биохимической передачи сигналов в профилактике мигрени основана на использовании моноклональных антител к пептиду, связанному с геном кальцитонина (CGRP), к CGRP, которые эффективны в профилактике мигрени [145]. Как показано ранее, надежные данные показали, что нейропептиды, присутствующие в периваскулярном пространстве черепных сосудов, являются важными медиаторами ноцицептивного воздействия во время приступов мигрени.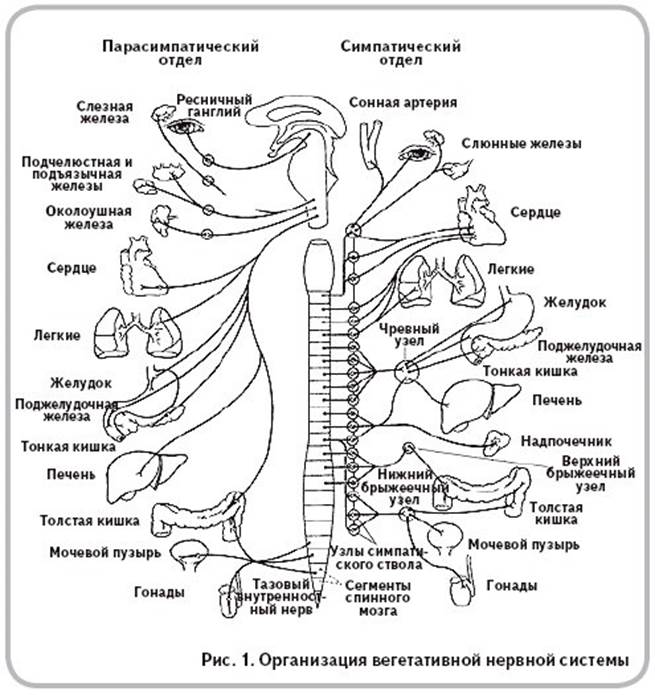 Полипептид, активирующий аденилатциклазу гипофиза (PACAP), присутствует в сенсорных нейронах тройничного нерва и может модулировать ноцицепцию на разных уровнях нервной системы.Было высказано предположение, что рецептор PAC (1) представляет собой возможный сигнальный путь, участвующий в мигрени, и может быть будущей фармакологической мишенью при лечении мигрени [146].
Полипептид, активирующий аденилатциклазу гипофиза (PACAP), присутствует в сенсорных нейронах тройничного нерва и может модулировать ноцицепцию на разных уровнях нервной системы.Было высказано предположение, что рецептор PAC (1) представляет собой возможный сигнальный путь, участвующий в мигрени, и может быть будущей фармакологической мишенью при лечении мигрени [146].
Обсуждается точное значение гипоталамуса в предупреждающих фазах мигрени, а также во время приступов мигрени. Следовательно, новые мишени могут включать гипоталамические пептиды, такие как орексин, который препятствует ноцицептивной активности тройничного нерва и кортикальной распространяющейся депрессии — хорошо известным нервным феноменам в продромальной фазе мигрени [147].Интересно, что ботулинический токсин А был связан с небольшой или умеренной пользой при хронических ежедневных головных болях и хронических мигрени, уменьшая количество эпизодов головной боли в месяц [148].
6.3. Генетическая терапия
Генетические исследования выявили потенциальную роль в этиопатогенезе первичных головных болей нескольких генов, связанных с сосудистыми, нейрональными и нейроэндокринными механизмами.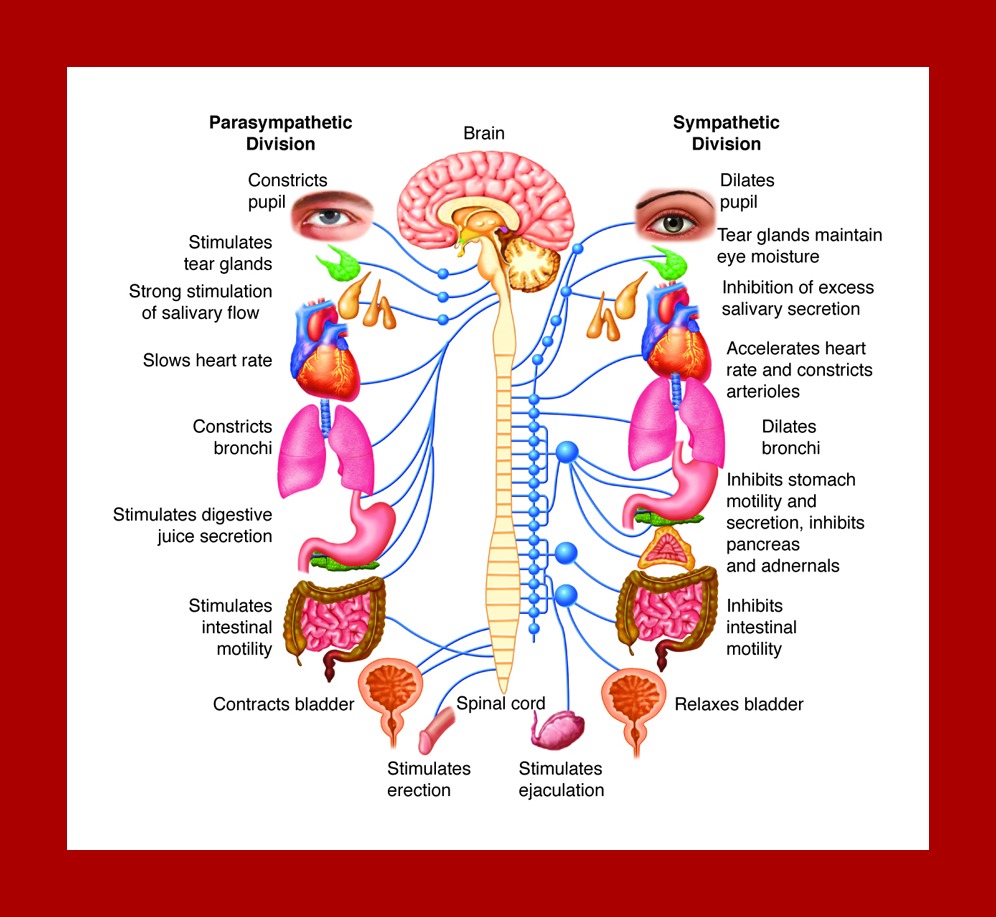 Таким образом, недавние данные показали влияние новых генов, таких как метилентетрагидрофолатредуктаза (MTHFR), калиевый канал, член подсемейства K 18 (KCNK18), временный связанный потенциальный ваниллоид типа 1 (TRPV1), временный связанный потенциальный ваниллоид типа 3 (TRPV3), гипокретин. (орексин) рецептор 1 (HCRTR1) и гипокретин (орексин) рецептор 2 (HCRTR2), как при мигрени, так и при кластерной головной боли.Конечно, необходимы дополнительные доклинические и клинические данные для подтверждения точного места и показаний генетического вмешательства при лечении первичных головных болей, что способствует многофакторному определению этой патологии [149].
Таким образом, недавние данные показали влияние новых генов, таких как метилентетрагидрофолатредуктаза (MTHFR), калиевый канал, член подсемейства K 18 (KCNK18), временный связанный потенциальный ваниллоид типа 1 (TRPV1), временный связанный потенциальный ваниллоид типа 3 (TRPV3), гипокретин. (орексин) рецептор 1 (HCRTR1) и гипокретин (орексин) рецептор 2 (HCRTR2), как при мигрени, так и при кластерной головной боли.Конечно, необходимы дополнительные доклинические и клинические данные для подтверждения точного места и показаний генетического вмешательства при лечении первичных головных болей, что способствует многофакторному определению этой патологии [149].
6.4. Междисциплинарные нефармакологические вмешательства
Поведенческий и психологический коучинг пациентов с хронической головной болью в мультидисциплинарной среде может способствовать приверженности лечению и улучшить качество жизни этих пациентов. Считается, что поведенческая терапия в сочетании с фармакологическим вмешательством (например, одним бета-блокатором) обеспечивает более эффективное лечение [150].


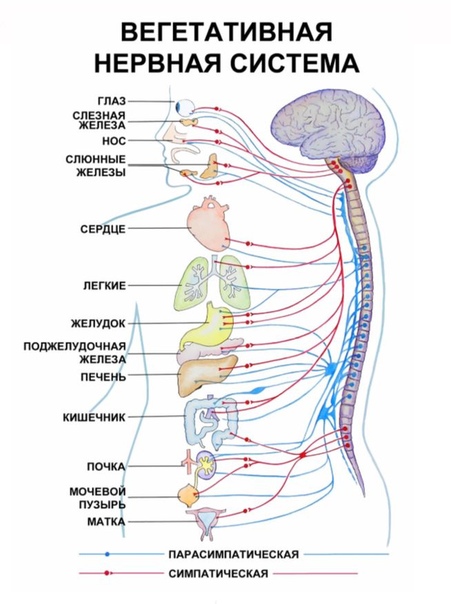 . Ацидоз
. Ацидоз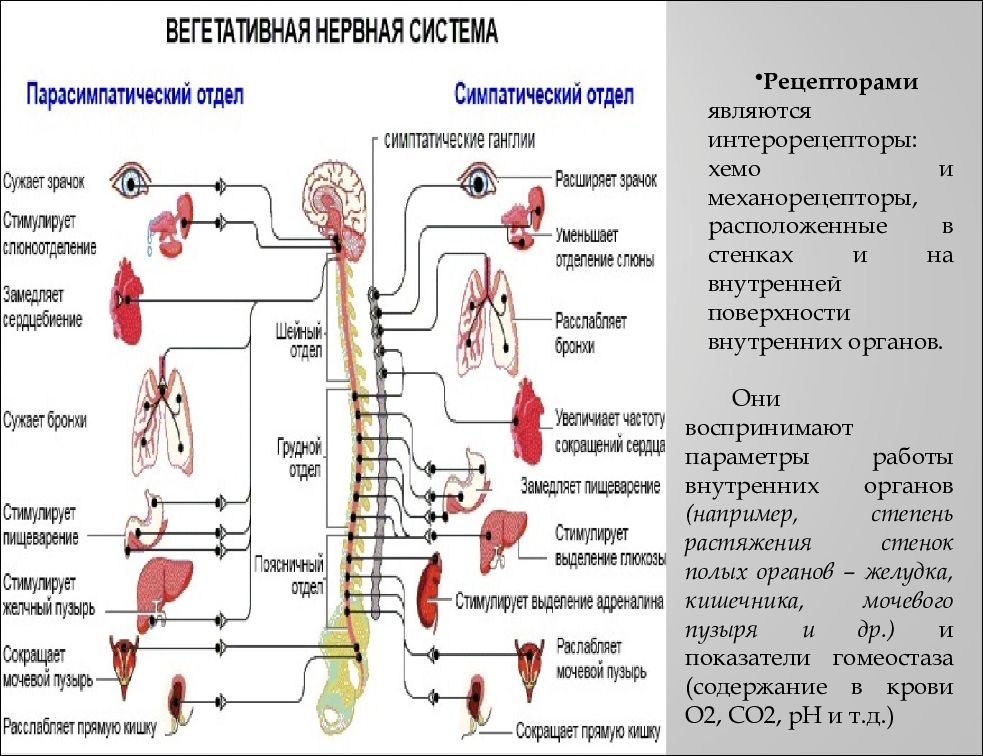
 5–2 л очищенной воды, соков, морсов, компотов, чтобы из тканей удалялись токсины и шлаки;
5–2 л очищенной воды, соков, морсов, компотов, чтобы из тканей удалялись токсины и шлаки; ..Вы прогуливаетесь по парку.
Вдруг сердитый
появляется медведь
на вашем пути. Вы остаетесь и сражаетесь ИЛИ поворачиваетесь и убегаете? Эти
это ответы «Сражайся или беги». В таких ситуациях ваш
симпатическая нервная система задействована — она использует энергию — ваш
повышается артериальное давление, ваше сердце бьется быстрее, а пищеварение замедляется
вниз.
..Вы прогуливаетесь по парку.
Вдруг сердитый
появляется медведь
на вашем пути. Вы остаетесь и сражаетесь ИЛИ поворачиваетесь и убегаете? Эти
это ответы «Сражайся или беги». В таких ситуациях ваш
симпатическая нервная система задействована — она использует энергию — ваш
повышается артериальное давление, ваше сердце бьется быстрее, а пищеварение замедляется
вниз. (Конечно, есть одно исключение:
симпатический постганглионарный нейрон, который заканчивается на потовых железах
использует ацетилхолин.)
(Конечно, есть одно исключение:
симпатический постганглионарный нейрон, который заканчивается на потовых железах
использует ацетилхолин.)