Роль аминокислот в программах омоложения
Аминокислоты — мономеры белков.В состав белков входят 20 разновидностей АК. Они связываются между собой пептидными связями и образуют молекулу полимера — полипептид.
Как воздействуют аминокислоты на процессы похудения?
Помощь белковых «кирпичиков» состоит в следующем:
- «разгоняют» скорость метаболизма;
- сжигают излишки жира в зонах его скопления;
- снижают аппетит;
- уменьшают количество холестерина и сахара;
- являются источником дополнительной энергии;
- относятся к группе антиоксидантов;
- наращивают мышечные ткани, вместо жировых прослоек;
- помогают сбросить вес в ходе тренировок.
Какие же аминокислоты жизненно необходимы для человека?
1) Незаменимые аминокислоты:
- Валин
- Лейцин
- Изолейцин
- Лизин
- Метионин
- Треонин
- Фенилаланин
- Триптофан
- Гликокол
- Аланин
- Цитруллин
- Серин
- Цистин
- Аспарагиновая кислота
- Глютаминовая кислота
- Тирозин
- Пролин
- Оксипролин
- Аргинин
- Гистидин

L-карнитин же, который принято считать жиросжигателем, тоже относится формально к аминокислотам. На самом деле, он участвует в процессе похудения, доставляя жиры к месту их расщепления интенсивнее, чем этот процесс идет обычно, потому и усиливает эффект физических нагрузок для похудения.
Триптофан и тирозин подавляют чувство голода, регулируя уровень гормона инсулина в крови. Потому эти аминокислоты можно применять для похудения без тренировок, только на фоне ограниченного питания. К тому же, триптофан обладает некоторым успокаивающим действием, что позволяет снизить уровень стресса, который вызывают диеты и переживания о лишнем весе.
«Содержание незаменимых аминокислот в пищевых продуктах»:
- Лизин: злаковые и молочные продукты, яйца, орехи, рыба
- Гистидин: бобовые и мясные продукты
- Триптофан: кунжут, финики, бананы
- Треонин: яйца и молочные продукты
- Фенилаланин: крупы, бобовые, мясные продукты
Убихинон (Q10) — присутствует в любой клетке организма. Защищает организм от воздействия свободных радикалов. Обязательная составляющая часть программ лечения ожирения, гипертонии, диабета. Но главное, способно замедлять процессы старения
Терапевтический эффект после 45 лет — 60-90 мг в сутки
Креатин — белок, поставляющий энергию для сокращения мышц;
Организм синтезирует этот белок из аминокислот аргинина, глицина, метионина. Терапевтический эффект наступает при приеме 20 г в сутки.
Повышение качества жизни и энергичности
Следить за рационом питания, в котором, в котором много белка и мало простых сахаров
Необходимы: Магний 400-800 мг, Глутатион 0,5-1г, Витамин С3-5 г, Витамин Е 600-1000 МЕ (высвобождает эстроген из жировых клеток).
Целлюлит — это интоксикация соединительно -тканного матрикса дермы и гиподермы. Причина — нарушение клеточного дренажа, циркуляторного,иммунного, гормонального нарушения в организме.
Необходимо улучшить крово-и лимфообращение, стимулировать метаболизм адипоцитов, проводить детоксикации подкожно-жировой клетчатки, активизировать липолиз, нормализовать гормональную сферу.
Посмотреть бесплатный вебинар о роли аминокислот в программах омоложения и коррекции фигуры.
Аминокислоты в питании человека Текст научной статьи по специальности «Фундаментальная медицина»
lectures
АМИНОКИСЛОТЫ В ПИТАНИИ ЧЕЛОВЕКА
Лысиков Ю.А.
ГУ Институт питания РАМН, Москва
Лысиков Юрий Александрович 109240 Москва, Устьинский проезд, д. 2/14 E-mail: [email protected]
РЕЗЮМЕ
В статье представлены данные о метаболизме аминокислот в организме человека. Рассмотрена структура и свойства аминокислот, критерии незаменимости, вклад аминокислот в энергетику организма, специфические функции аминокислот, потребность в аминокислотах.
SUMMARY
The article presents data on amino acids metabolism in human organism. The review described structure and function of amino acids, essentiality criteria, amino acids energy source role, amino acids specific functions, amino acids requirements.
CO CO
СТРУКТУРА И СВОЙСТВА АМИНОКИСЛОТ
Известно около 200 природных аминокислот, из них только 20 входят в состав белков. Эти аминокислоты называют протеиногенными — строящими белки. В организме человека наряду с протеиногенными аминокислотами можно найти и другие, которые играют иную роль, например, орнитин, в-аланин, таурин и др.
Первая аминокислота, аспарагин, была открыта еще в 1806 году. Последней из обнаруженных известных аминокислот оказался треонин, который
соон
Рис. 1. Общая структурная формула аминокислоты
удалось выделить лишь в 1938 году. Каждая аминокислота имеет тривиальное (традиционное) название, иногда связанное с источником происхождения. Например, аспарагин впервые был обнаружен в аспарагусе, глютаминовая кислота — в клейковине (глютене) пшеницы. Глицин был назван так за сладкий вкус (от греческого glykos — сладкий). В пищевых продуктах наиболее распространены 22 аминокислоты.
Все 20 аминокислот, которые входят в состав белка, характеризуются общей структурной особенностью — наличием карбоксильной группы (-СООН) и аминогруппы (-№И2), связанной с одним и тем же атомом углерода и различаются структурой боковых цепей групп) (рис. 1). Почти все аминокислоты содержат по одной карбоксильной и аминогруппе. Однако имеются аминокислоты, которые могут содержать две карбоксильные (дикарбоновые аминокислоты) или две аминогруппы (диаминоами-нокислоты). Большинство аминокислот являются а-аминокислотами, в отличие от в-аминокислот, таких как в-аланин и таурин.
Стереоизомеры аминокислот. Из-за асимметрии молекулы все а-аминокислоты, за исключением
глицина, могут существовать в форме двух Б- или Ь-стереоизомеров — оптических изомеров, которые представляют собой зеркальные изображения друг друга. В ходе биосинтеза белка в его состав попадают только Ъ-аминокислоты. Следует подчеркнуть, что присутствие в составе белка Ъ-аминокислот определяет его структуру и свойства. Б-аминокислоты никогда не включаются в белки в процессе биосинтеза. В то же время в составе белка можно обнаружить и Б-аминокислоты. Причина этого парадокса
В ходе биосинтеза белка в его состав попадают только Ъ-аминокислоты. Следует подчеркнуть, что присутствие в составе белка Ъ-аминокислот определяет его структуру и свойства. Б-аминокислоты никогда не включаются в белки в процессе биосинтеза. В то же время в составе белка можно обнаружить и Б-аминокислоты. Причина этого парадокса
заключается в том, что для аминокислот характерна медленная самопроизвольная неферментативная рацемизация, в результате которой в составе белка появляются Б-аминокислоты. По этой причине структура белка со временем начинает меняться, могут изменяться и его свойства. Это является одним из механизмов старения белков, что вызывает необходимость их непрерывного обновления.
Таблица 1
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ [2; 3]
Химическая структура Полярность боковой цепи Изоэлектри-ческая точка р! Молекулярная масса , г/моль Степень гидрофильности Полярность боковой цепи
1. Алифатические Высокогидрофильные
Алании -1,9 6,0 89 Глютамин +9,4
Валин* -2,0 6,0 117 Аспарагин +9,7Глицин -2,4 6,0 75 Глютаминовая кислота +10,2
Изолейцин* -2,2 5,9 131 Гистидин +10,3
Лейцин* -2,3 6,0 131 Аспарагиновая кислота +11,0
2. Серосодержащие Лизин* +15,0
Метионин* -1,5 5,7 149 Аргинин +20,0
Цистеин -1,2 5,0 121 Умеренно гидрофильные
3. Ароматические Треонин* +4,9
Ароматические Треонин* +4,9
Тирозин +6,1 5,7 181 Серин +5,1
Триптофан* +5,9 5,9 204 Триптофан* +5,9
4. Оксиаминокислоты Тирозин +6,1
Серин +5,1 5,7 105 Высокогидрофобные
Треонин* +4,9 5,6 119 Цистеин -1,2
5. Дикарбоновые (кислые) Метионин* -1,5
Аспарагиновая кислота +11,0 2,8 133 Аланин -1,9
Глютаминовая кислота +10,2 3,2 147 Валин* -2,0
6. Амиды дикарбоновых кислот Изолейцин* -2,2
Аспарагин +9,7 5,4 132 Лейцин* -2,3
Глютамин +9,4 5,7 146 Глицин -2,4
7. Диаминоаминокислоты (основные) Фенилаланин* +0,8
Аргинин +20,0 10,9 174
Гистидин +10,3 7,6 155
Лизин* +15,0 9,7 146
8. Иминокислота
Пролин +6,0 6,3 115
о
СО
Примечание: * — незаменимые аминокислоты.
сэ
о
Биосинтез Ь-аминокислот в клетках организма происходит с помощью стереоспецифических ферментов, которые имеют асимметричные активные центры. При химическом синтезе аминокислот с одинаковой скоростью образуются как Б-, так и Ь-стереоизомеры. В результате получается рацемическая (одинаковая по составу) смесь разных стереоизомеров аминокислот. Рацемическую смесь аминокислот можно разделить на Б- и Ь-стереоизомеры, но это дорого. Поэтому полученные искусственным путем препараты аминокислот могут содержать не только необходимые организму Ь-аминокислоты, но и Б-стереоизомеры. Полные гидролизаты белков будут содержать только Ь-стереоизомеры аминокислот. В природе встречаются и некоторые Б-аминокислоты, которые входят в состав пептидных антибиотиков и клеточных стенок бактерий [1].
При химическом синтезе аминокислот с одинаковой скоростью образуются как Б-, так и Ь-стереоизомеры. В результате получается рацемическая (одинаковая по составу) смесь разных стереоизомеров аминокислот. Рацемическую смесь аминокислот можно разделить на Б- и Ь-стереоизомеры, но это дорого. Поэтому полученные искусственным путем препараты аминокислот могут содержать не только необходимые организму Ь-аминокислоты, но и Б-стереоизомеры. Полные гидролизаты белков будут содержать только Ь-стереоизомеры аминокислот. В природе встречаются и некоторые Б-аминокислоты, которые входят в состав пептидных антибиотиков и клеточных стенок бактерий [1].
По химической структуре можно выделить 8 классов аминокислот (табл. 1):
1. Алифатические аминокислоты (аланин, ва-лин, глицин, изолейцин и лейцин) отличаются тем, что их боковые цепи содержат лишь атомы углерода и водорода.
У валина, изолейцина и лейцина боковая цепь разветвляется, их еще называют аминокислотами с разветвленной цепью.
2. Серосодержащие аминокислоты (метионин и цистеин) содержат атомы серы. При этом место серы может занимать атом селена.
3. Ароматические аминокислоты (тирозин, триптофан и фенилаланин) содержат ароматические циклические группы.
4. Оксиаминокислоты (серин и треонин) содержат -ОН-группы.
5. Дикарбоновые аминокислоты (аспарагино-вая и глютаминовая кислоты) содержат две карбоксильные группы
6. Амиды дикарбоновых аминокислот (аспа-рагин и глютамин) содержат атом азота в составе второй карбоксильной группы.
7. Диамино-, или двуосновные, аминокислоты (аргинин, гистидин и лизин) содержат две аминогруппы.
8. «Аминокислота» пролин занимает особое положение, поскольку, аминокислотой не является. По своей структуре это иминокислота и включает циклическое имидазольное кольцо. Благодаря циклической группе пролин вызывает изгибы в полипептидной цепочке белка, что очень важно, например, для структуры белка соединительной ткани коллагена, где пролина очень много.
Благодаря наличию карбоксильной и аминогруппы в водных растворах все аминокислоты ионизированы и ведут себя одновременно как кислоты и как основания. В водной среде организма свободные аминокислоты играют роль буферных веществ, стабилизируя рН среды. При этом растворимость в воде и степень гидрофильности разных аминокислот существенно различается. По степени
гидрофильности — способности связывать молекулы воды аминокислоты можно разделить на [2]:
1. Высокогидрофильные: аспарагин, аспара-гиновая кислота, аргинин, гистидин, глютамин, глютаминовая кислота и лизин, которые почти всегда располагаются на внешней поверхности молекул белка.
2. Умеренно гидрофильные: пролин, серин, тирозин, треонин и триптофан. Они занимают промежуточное положение, отличаясь определенной гидрофильностью.
3. Гидрофобные: аланин, валин, глицин, изо-лейцин, лейцин, метионин, цистеин и фенилала-нин, которые располагаются в основном внутри молекул белка.
Гидрофильность аминокислот во многом зависит от их полярности, которая связана с величиной заряда их боковых групп. Пять алифатических аминокислот (аланин, валин, глицин, изолейцин и лейцин) содержат слабо полярные боковые группы. Слабую полярность имеют серосодержащие аминокислоты (метионин и цистеин), а также одна из ароматических аминокислот — фенилаланин. Благодаря гидрофобности эти аминокислоты плохо растворяются в воде. Остальные аминокислоты содержат заряженные положительно полярные боковые группы и поэтому они более гидрофильны и хорошо растворяются в воде. Полярность аминокислот оказывают существенное влияние на структуру белка, его свойства и функции. Следует подчеркнуть, что большинство гидрофобных аминокислот являются незаменимыми (валин, изолейцин, лейцин, метионин и фенилаланин). Две других незаменимых аминокислоты (треонин и триптофан) отличаются умеренной гидрофильностью.
Благодаря гидрофобности эти аминокислоты плохо растворяются в воде. Остальные аминокислоты содержат заряженные положительно полярные боковые группы и поэтому они более гидрофильны и хорошо растворяются в воде. Полярность аминокислот оказывают существенное влияние на структуру белка, его свойства и функции. Следует подчеркнуть, что большинство гидрофобных аминокислот являются незаменимыми (валин, изолейцин, лейцин, метионин и фенилаланин). Две других незаменимых аминокислоты (треонин и триптофан) отличаются умеренной гидрофильностью.
Онкотическое давление. Гидрофобные аминокислоты, как правило, располагаются внутри молекулы белка, тогда как гидрофильные — на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка. Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток. Гидрофильность белков крови обеспечивают онкотическое давление, которое удерживает жидкость в кровеносных сосудах. При уменьшении содержания белка в организме человека в первую очередь уменьшается количество плазменных белков, что приводит к снижению он-котического давления крови, выходу жидкости из кровеносной системы в межклеточное пространство, что может приводить к возникновению безбелковых (голодных) отеков. Гидрофильность пищевых белков обеспечивает их способность набухать, образовывать студни, эмульсии и пены. Гидрофильность белков клейковины злаков определяет качество зерна и его хлебопекарные свойства.
Нестандартные аминокислоты в составе белка. Кроме 20 стандартных аминокислот, которые присутствуют почти во всех белках, существуют так называемые нестандартные аминокислоты, которые
встречаются лишь в некоторых из них. Причем, каждая из этих аминокислот представляет собой производное одной из обычных. К нестандартным аминокислотам относят: производное пролина — 4-гидроксипролин и 5-гидроксипролин.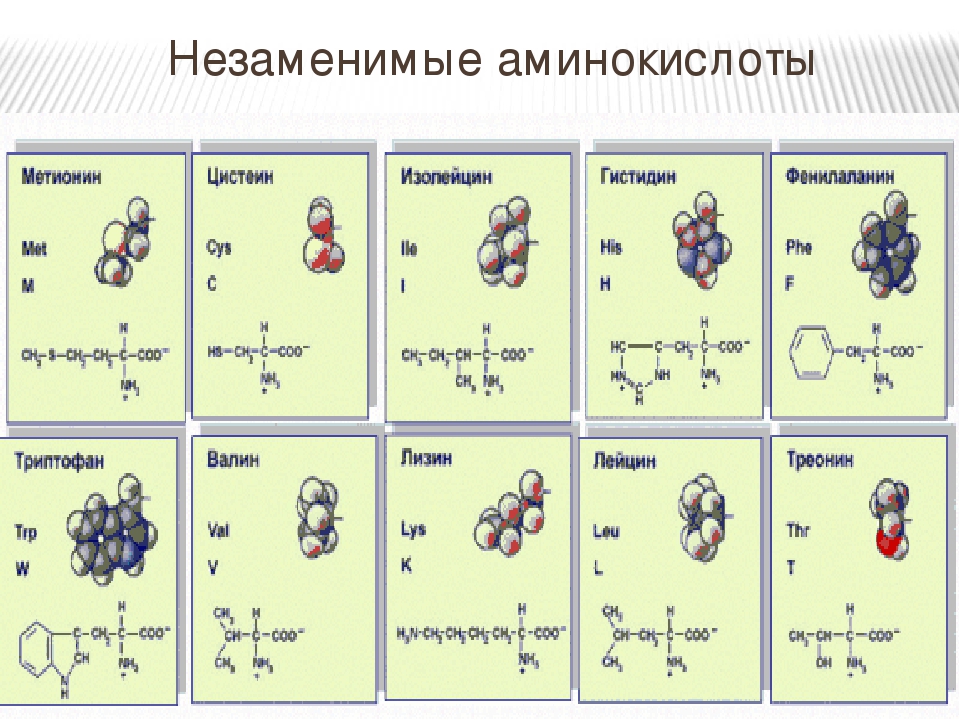 Обе аминокислоты входят в состав коллагена. В мышечном белке миозине присутствует производное лизина — Nметиллизин. Другое производное лизина — аминокислота десмозин (комплекс из четырех молекул лизина — тетрапептид) содержится только в фибриллярном белке соединительной ткани — эластине. В белке протромбине, а также в некоторых других белках, которые активно связывают ионы кальция, присутствует у-карбоксиглютаминовая кислота.
Обе аминокислоты входят в состав коллагена. В мышечном белке миозине присутствует производное лизина — Nметиллизин. Другое производное лизина — аминокислота десмозин (комплекс из четырех молекул лизина — тетрапептид) содержится только в фибриллярном белке соединительной ткани — эластине. В белке протромбине, а также в некоторых других белках, которые активно связывают ионы кальция, присутствует у-карбоксиглютаминовая кислота.
Особо следует остановиться на серосодержащей аминокислоте цистеине. Она может находиться в составе белка в двух формах: либо в форме цисте-ина, либо в форме дипептида — цистина, который представляет собой комплекс из двух молекул ци-стеина, ковалентно связанных друг с другом при помощи дисульфидного мостика. Благодаря этому свойству цистеин выполняет важную функцию по стабилизации структуры белковой молекулы. Цистеин играет ключевую роль в формировании инсулина и иммуноглобулинов (антител). В этих белках благодаря дисульфидным цистеиновым мостикам соединяются разные полипептидные цепи в одну молекулу белка. Такие поперечные связи обычно отсутствуют во внутриклеточных белках, но широко представлены в секреторных белках. Разрушение дисульфидных связей в кератине, формирующем структуру волос, лежит в основе процесса химической завивки. Для этого используют тиоловые соединения, под действием которых происходит разрыв поперечных дисульфидных связей в кератине. После укладки волос действие кислорода воздуха приводит к образованию новых поперечных связей, которые закрепляют новую форму волос.
Функциональная классификация аминокислот. С физиологических позиций аминокислоты можно разделить на:
• Протеиногенные, которые входят в состав белка (20 аминокислот), и непротеиногенные, не входящие в состав белка, но выполняющие в организме человека другие важные функции.
• Заменимые (8 аминокислот) и незаменимые (12 аминокислот). О них мы будем говорить ниже.
О них мы будем говорить ниже.
• Глюкогенные, которые превращаются в глюкозу и далее в гликоген или расщепляются по пути метаболизма глюкозы с образованием АТФ. Глюкогенными, в той или иной степени, являются подавляющее большинство — 19 аминокислот, за исключением лейцина.
• Кетогенные, которые могут превращаться в кетоновые тела (короткоцепочечные жирные кислоты). Кетогенными являются 6 аминокислот: изолейцин, лейцин, лизин, тирозин, триптофан и фенилаланин.
АМИНОКИСЛОТЫ КАК ИСТОЧНИКИ ЭНЕРГИИ
Известно, что при полном окислении 1 г белка (или смеси аминокислот) в калориметрической бомбе в среднем образуется 5,65 ккал. Углерод аминокислот окисляется до СО2, водород — до Н2О, а азот — до NО2. Однако в организме человека энергию в форме АТФ можно получить только при окислении углеводородной составляющей аминокислот. Поэтому из 5,65 ккал организму будут доступны только 4,3 ккал, а оставшаяся часть (1,3 ккал) является энергией окисления азота. В настоящее время установлено, что действительная энергетическая ценность белка колеблется от 1,82 до 4,27 ккал/г, однако за эталон принимают цифру 4,0 ккал/г [4]. Существенные различия в энергетической ценности белка связаны, с одной стороны, с различной молекулярной массой аминокислот, а с другой — с разными путями и механизмами их окислительного метаболизма (рис. 2).
Считают, что белки (аминокислоты) могут обеспечить 11-14% энергии суточного рациона. Например, при суточной калорийности в 2500 ккал на белок может приходиться 275-350 ккал, что должно соответствовать 69-88 г белка. Однако все пищевые аминокислоты не могут полностью окисляться с образованием энергии. Значительная часть энергии теряется в процессе кругооборота и метаболизма аминокислот. Поэтому эффективность использования энергии пищи организмом человека, как полагают, составляет около 20-25% [4].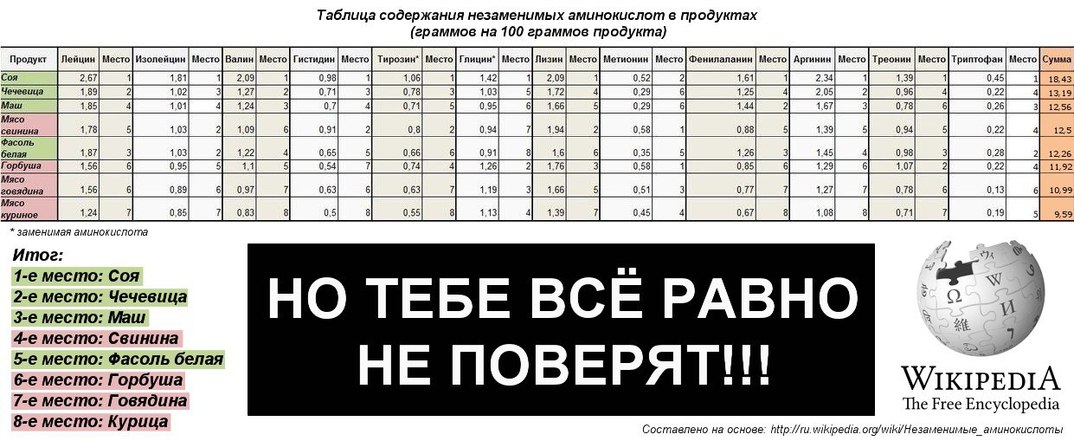
2
го
1
I
ГЛЮКОЗА
ГЛИКОГЕН
фосфоенолпируват
оксалоацетат
Пируват
аминокислоты
Ацетил-КоА
I
ЦИТРАТНЫЙ ЦИКЛ сукцинил КоА, кетоглутарат, фумарат, оксалоацетат
ДЫХАТЕЛЬНАЯ ЦЕПЬ
ЭНЕРГИЯ
Рис. 2. Пути метаболизма глюкогенных аминокислот
о
неодинакова: одни из них могут превращаться в глюкозу и далее в гликоген, тогда как другие, минуя глюкозу, могут непосредственно окисляться до СО2 и Н2О с образованием АТФ.
Установлено, что из 100 г аминокислот может образовываться только 57 г глюкозы. При голодании в первые 3-4 дня из аминокислот в среднем в сутки образуется около 41 г глюкозы, а спустя несколько недель голодания образование глюкозы снижается до 16 г в сутки. При сахарном диабете 2-го типа превращение глюкогенных аминокислот в глюкозу происходит с гораздо большей скоростью, чем у здоровых людей [5]. Как следствие этого у больных диабетом с мочой выводится большое количество мочевины, которая образуется при дезаминировании глюкогенных аминокислот. В критических состояниях скорость глюконеогенеза с использованием аминокислот также существенно возрастает.
В критических состояниях скорость глюконеогенеза с использованием аминокислот также существенно возрастает.
Среди аминокислот наиболее эффективно превращаются в глюкозу серин, аланин и пролин, тогда как глютамин, который широко используется в энтеральном и парентеральном питании, стоит на четвертом месте (табл. 3).
Важную роль в процессах глюконеогенеза играет так называемый цикл аланина, который характерен для мышечной ткани (рис. 3). При дефиците глюкозы в организме или при голодании усиливается катаболизм мышечных белков с освобождением свободных аминокислот, около 50% которых составляет аланин [2]. Аланин поступает в печень, где из него образуется пируват, который включается в глюконеогенез. Когда в мышечной ткани возобновляется биосинтез белка, возникает потребность в аланине, который начинает синтезироваться из пирувата. В свою очередь источником пирувата является глюкоза, из которой он образуется в результате гликолиза. Таким образом, аланин завершает свой кругооборот:
НЕЗАМЕНИМОСТЬ АМИНОКИСЛОТ
Говоря о значении различных аминокислот для организма человека, необходимо рассмотреть понятие незаменимости. Основным критерием в определении биологической ценности аминокислот является их способность поддерживать рост животных и человека, что связано с биосинтезом белка в организме. Исключение из пищевого рациона хотя бы одной из таких аминокислот, при сохранении содержания остальных, влечет за собой задержку роста и снижение массы тела растущего организма. Поэтому незаменимыми аминокислотами считают такие, которые «либо не синтезируются в организме, или синтезируются со скоростью, недостаточной или не соответствующей обмену веществ,
S Lr
обеспечивающих пластические и регенера- sj
тивные процессы, связанные с образованием ц
новых клеток и тканей» [6]. <
<
Согласно классическим исследованиям Rose, для взрослого здорового человека жизненно необходимыми являются 8 аминокислот, которые стали считать незаменимыми (табл. 4). Полагают, что эти аминокислоты не образуются в организме человека и обязательно должны поступать с пищей.
Остальные 12 аминокислот считают заменимыми. К ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, гистидин, глицин, глютамин, глютами-новую кислоту, пролин, серин, тирозин и цистеин. Эти аминокислоты, как полагают,
катаболизм белка t! глюконеогенез
БЕЛОК аланин пируват ГЛЮКОЗА
анаболизм белка МЫШЕЧНАЯ ТКАНЬ гликолиз ПЕЧЕНЬ
Рис. 3. Цикл аланина Таблица 2
СУДЬБА ГЛЮКОГЕННЫХ АМИНОКИСЛОТ [5]
Аминокислоты Превращаются в: Результат
Аланин, глицин, серин, треонин, цистеин Пируват Глюкоза/АТФ
Аспарагин, аспарагиновая кислота Оксалоацетат Глюкоза/АТФ
Валин, изолейцин, метионин, триптофан Сукцинил-КоА АТФ
Аргинин, гистидин, глутамин, глутаминовая кислота, пролин Кетоглутарат АТФ
Аспарагиновая кислота, тирозин, фенилаланин Фумарат АТФ
Таблица 3
СКОРОСТЬ ГЛЮКОНЕОГЕНЕЗА В ПЕЧЕНИ ИЗ РАЗЛИЧНЫХ ПРЕДШЕСТВЕННИКОВ [5]
Предшественник Образование глюкозы мк моль/мин г ткани Предшественник Образование глюкозы, мкмоль/мин г ткани
Фруктоза 2,68 Глутамин 0,45
Диоксиацетон 2,07 Треонин* 0,40
Лактат 1,06 Глутамат 0,31
Пируват 1,02 Аргинин 0,27
Серин 0,98 Аспартат 0,23
Аланин 0,66 Изолейцин* 0,22
Пролин 0,55 Орнитин 0,19
Глицерин 0,48 Валин* 0,12
Примечание: * — незаменимые аминокислоты.
m
о
способны синтезироваться в организме человека в достаточном количестве. Наряду с этим выделяют группу аминокислот, которые необходимы человеку в определенные периоды развития и в некоторых физиологических и клинических ситуациях. Эти аминокислоты относят к условно незаменимым (табл. 5).
Другим критерием значимости и биологической ценности аминокислот считают степень их участия в обеспечении азотистого равновесия. Имеются данные о целесообразности выделения третьей группы аминокислот, обладающих свойствами ускорять рост. К их числу относят 7 аминокислот: аргинин, глютаминовую кислоту, пролин, серин, тирозин, триптофан и цистеин.
Заслуживает внимание классификация аминокислот, предложенная Josue de Castro, который разделил их на две группы. В первую группу вошли 5 аминокислот, обеспечивающие рост: аргинин, гистидин, лизин, пролин и цистеин. Во вторую — другие 5 аминокислот, которые необходимы для регенерации тканей: аспарагиновая и глютаминовая кислоты, тирозин, триптофан и фенилаланин [6].
А.Э. Шарпенак относил к незаменимым 12 аминокислот: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, тирозин, треонин, триптофан, фенилаланин и цистеин. По данным Eagle, для культивирования клеток животных и человека необходимы те же 12 аминокислот, но с заменой треонина на глютамин [6].
Таблица 4
НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ [6]
Автор Rose Условно незаменимые Ускоряют рост Jose de Castro А.Э. Шарпенак Eagle, 1958
Число 8 6 7 10 12 12
Валин Аспартат Аргинин Рост Аргинин Аргинин
Изолейцин Гистидин Глютамат Аргинин Валин Валин
Лейцин Глютамин Пролин Гистидин Гистидин Гистидин
ЛИЗИН* Таурин Серин Лизин Изолейцин Изолейцин
Метионин Тирозин Тирозин Пролин Лейцин Лейцин
Ами- ТРЕОНИН* Цистеин Триптофан Цистеин Лизин Лизин
лоты Триптофан Цистеин Регенерация Метионин Метионин
Фенилаланин Аспартат Тирозин Тирозин
Абсолютно Глютамат Треонин Глютамин
заменимые Тирозин Триптофан Триптофан
ГЛЮТАМАТ Триптофан Фенилаланин Фенилаланин
СЕРИН Фенилаланин Цистеин Цистеин
Примечание: * — абсолютно незаменимые аминокислоты.
Таблица 5
ФУНКЦИИ УСЛОВНО НЕЗАМЕНИМЫХ АМИНОКИСЛОТ
Аминокислота Функции в организме
Аспартат Необходим для процессов регенерации
Гистидин Необходим для маленьких детей, у которых эндогенный синтез недостаточен
Глютамин Необходим для процессов регенерации, является важным энергетическим субстратом в критических состояниях
Таурин Необходим для новорожденных, у которых эндогенный синтез недостаточен, а также для больных в критических состояниях. Дефицит возникает при недостатке метионина и цистеина
Тирозин Необходим для маленьких детей, у которых эндогенный синтез недостаточен. При нарушении функции почек снижено образование тирозина из фенилаланина
Цистеин Необходим для маленьких детей, у которых эндогенный синтез недостаточен. Дефицит возникает при недостаточном содержании метионина в питании. Крайне необходим при нарушениях функции печени и для больных в критических состояниях
В основе разноголосицы в определении важности и незаменимости тех или иных аминокислот лежат особенности их биосинтеза и метаболизма в организме человека. За исключением двух аминокислот — лизина и треонина, которые являются у человека абсолютно незаменимыми, остальные «незаменимые» аминокислоты в определенных количествах могут синтезироваться за счет реакций трансаминирования, но объем их синтеза является недостаточным.
Ряд незаменимых аминокислот являются предшественниками для синтеза заменимых. Например, из незаменимой аминокислоты фенилаланина синтезируется заменимая аминокислота тирозин, а из незаменимого метионина — заменимый цистеин. Установлено, что до 80-89% метионина может трансформироваться в цистеин, а 70-75% фенилаланина — в тирозин [2]. По этой причине незаменимых аминокислот метионина и фенилаланина требуется больше, так как существенная их часть должна расходоваться на образование цистеина и тирозина. Аминокислоты цистеин и тирозин по своему физиологическому значению близки к незаменимым аминокислотам, к которым их относили ранее. Таким образом, поступление с пищей цистеина и тирозина позволяют сократить потребность в незаменимых аминокислотах мети-онине и фенилаланине.
Установлено, что до 80-89% метионина может трансформироваться в цистеин, а 70-75% фенилаланина — в тирозин [2]. По этой причине незаменимых аминокислот метионина и фенилаланина требуется больше, так как существенная их часть должна расходоваться на образование цистеина и тирозина. Аминокислоты цистеин и тирозин по своему физиологическому значению близки к незаменимым аминокислотам, к которым их относили ранее. Таким образом, поступление с пищей цистеина и тирозина позволяют сократить потребность в незаменимых аминокислотах мети-онине и фенилаланине.
С метаболических позиций абсолютно заменимыми являются глютаминовая кислота и серин, которые в необходимых количествах синтезируются из кетокислот. Биосинтез остальных «заменимых» аминокислот в организме человека ограничен. По этой и другим причинам полностью обеспечить потребность организма только за счет биосинтеза большинства заменимых аминокислот невозможно. Важно подчеркнуть, что потребность организма в белке, а, стало быть, в аминокислотах — есть величина переменная, которая изменяется на протяжении жизни и может резко возрастать при очень многих физиологических и патологических состояниях.
Подводя итог спорам о важности и незаменимости тех или иных аминокислот, следует подчеркнуть:
• Во-первых, ценность тех или иных аминокислот определяется возможностью их биосинтеза в организме. При этом часть незаменимых аминокислот может синтезироваться в организме, но объем их биосинтеза недостаточен. Разумеется, те аминокислоты, которые ни при каких условиях не образуются в организме и являются абсолютно незаменимыми, должны непрерывно поступать с пищей. Возможности запасания и резервирования лимитирующих аминокислот в составе мышечных белков, альбумина или других белков ограничены.
• Во-вторых, некоторая часть незаменимых аминокислот, помимо пищи, может образовываться при микробиологическом синтезе кишечной микрофлорой и поступать во внутреннюю среду организма.
• В-третьих, физиологическая потребность в незаменимых аминокислотах есть величина переменная и может изменяться в зависимости от активности процессов анаболизма и катаболизма белка, которые, в свою очередь, зависят от уровня физической активности, особенностей обмена веществ, состояния здоровья.
• В-четвертых, обеспечение организма белком и незаменимыми аминокислотами зависит не только от качества, но и режима питания, а также от содержания других компонентов пищевого рациона, например, углеводов. Заменимые аминокислоты занимают
достаточно большой удельный вес в составе белков пищи — до 2/3 суммы аминокислот. В организме человека они выполняют весьма важные функции, причем многие из них играют не меньшую роль, чем незаменимые аминокислоты. Следует подчеркнуть, что хотя заменимые аминокислоты могут образовываться в организме, однако за счет эндогенного биосинтеза обеспечивается лишь минимальная потребность организма. Более того, установлено, что при небольшом потреблении белка в том случае, когда потребность в незаменимых аминокислотах удовлетворяется полностью, лимитирующими становятся заменимые аминокислоты I II [6]. Для обеспечения стабильного азотистого равновесия в организме необходимо примерно в 2 раза больше качественного белка, чем для того, чтобы закрыть потребность в незаменимых аминокислотах. Таким образом, хотя заменимые аминокислоты не являются лимитирующим фактором в белковом питании, но их присутствие в питании также является обязательным. Поступление достаточного количества заменимых аминокислот в составе белков пищи является тем путем, с помощью которого можно обеспечить их оптимальную физиологическую потребность, более легкое и быстрое использования для нужд организма.
ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОТДЕЛЬНЫХ АМИНОКИСЛОТ
В организме человека аминокислоты, помимо строительства белковых молекул, выполняют еще целый ряд важных функций:
• Участвуют в образовании других аминокислот.
• Входят в состав разных природных соединений — коферментов, желчных кислот, антибиотиков.
• Участвуют в образовании гормонов, медиаторов и нейротрансмиттеров.
• Являются источниками метаболитов, принимающих участие в обмене веществ.
К числу медиаторов относятся некоторые аминокислоты (глютаминовая и аспарагиновая кислоты, глицин и дофа), а также биогенные амины.
1-Л
о
<3
о
Биогенные амины образуются при отщеплении от аминокислот карбоксильной группы (реакция декарбоксилирования). К их числу относятся: у-аминомасляная кислота, дофамин, норадреналин, адреналин, серотонин, гистамин. Из триптофана через промежуточный продукт 5-гидрокситриптофан образуется нейромедиатор серотонин. Из глютамино-вой кислоты образуется у-аминомасляная кислота.
Гистамин — важнейший медиатор и нейромедиатор, образуется в основном в тучных клетках и нейтрофильных лейкоцитах и участвует в развитии аллергических и воспалительных реакций. При аллергических реакциях высвобождение гистамина происходит под действием аллергенов, лекарств, некоторых тканевых гормонов. В ЦНС гистамин действует как нейромедиатор. Важным системным эффектом гистамина является расширение кровеносных сосудов, снижение артериального давления и частоты сердечных сокращений. Гистамин также стимулирует секрецию соляной кислоты.
Таблица 6
Адреналин — гормон коры надпочечников, где он образуется из аминокислоты тирозина. Адреналин является ключевым гормоном стресса — «аварийным гормоном» и действует на обмен веществ и сердечно-сосудистую систему: повышает сердечную функцию; сужает сосуды, повышая артериальное давление; расширяет бронхи, увеличивая снабжение кислородом; ускоряет расщепление гликогена до глюкозы, обеспечивая энергией мышечную ткань.
Катехоламины — группа биогенных аминов, которые содержат в качестве общего фрагмента производное фенилаланина — катехол. Все эти вещества берут свое начало от аминокислоты тирозина, из которой первоначально образуется аминокислота дофа (3,4-дигидроксифенилаланин). При ее декар-боксилировании образуется дофамин, который в дальнейшем может превращаться в норадреналин и далее в адреналин. Адреналин выполняет функции, как медиатора, так и гормона [2].
ПРОДУКТЫ МЕТАБОЛИЗМА И СПЕЦИФИЧЕСКИЕ ФУНКЦИИ ОТДЕЛЬНЫХ АМИНОКИСЛОТ [8]
Аминокислота Метаболиты аминокислот Физиологическая функция
Аргинин Образования N0 Креатин Полиамины Молекулярный биорегулятор Предшественник креатинфосфата Экспрессия генов
Аспарагиновая кислота Основа нуклеотида пиримидина Входит в состав нуклеотидов и нуклеиновых кислот
Гистидин Гистамин Нейромедиатор, медиатор воспаления, стимуляция секреции соляной кислоты
Глицин Основа нуклеотида пурина Порфирин Креатин Гиппуровая кислота Гликохолевая желчная кислота Входит в состав нуклеотидов и нуклеиновых кислот Входит в состав гемоглобина и цитохрома Предшественник креатинфосфата Связывание токсических соединений — детоксикация Эмульгирование липидов
Глютаминовая кислота Глютамин у-аминомасляная кислота Транспорт азота в организме, важный источник энергии, предшественник глутатиона Нейромедиатор
Лизин Гидроксилизин Карнитин Составная часть коллагена Транспорт жирных кислот в клетке
Метионин Холин Составная часть фосфолипидов
Серин Этаноламин Холин-ацетилхолин Составная часть фосфолипидов Нейромедиатор
Тирозин Норадреналин-адреналин Тироксин Меланин Нейромедиатор, гормон Гормон щитовидной железы Пигмент кожи и волос
Триптофан Серотонин Никотиновая кислота Нейромедиатор Витамин, составная часть пуриновых нуклеотидов, NAD и NADH
Цистеин Таурин Таурохолевая желчная кислота Антиокислительная активность Предшественник глутатиона
В процессе обмена веществ отдельные аминокислоты превращаются в метаболиты, которые выполняют важные функции в организме человека.-имидазолилпролиновая кислота) выделен в 1896 году. В значительном количестве содержится в гемоглобине, а также входит в состав карнозина и ансерина. По этой причине недостаток гистидина приводит к снижению уровня гемоглобина. Гемоглобин является одним из резервов гистидина в организме и при недостатке гистидина происходит повышенное разрушение гемоглобина, в результате которого высвобождается гистидин. При декарбоксилировании гистидина образуется гистамин. В ряде продуктов при их хранении, например в рыбе и сыре, происходит микробиологическое декарбоксилирование гисти-дина с образованием и накоплением больших количеств гистамина, что может иметь клинические последствия.
Лейцин (а-аминоизокапроновая кислота) впервые получен из сыра в 1819 году. Его много в составе белка (в среднем 10%). При недостатке лейцина в
Таблица 7
питании у детей происходит задержка роста и снижение массы тела, отмечают изменения в почках и щитовидной железе.
Лизин (а,е-диаминокапроновая кислота) выделен в 1889 году из казеина. Недостаточное содержание лизина в широко распространенных зерновых продуктах и сравнительно высокая потребность в нем организма (3-5 г в сутки) делают его одной из наиболее важных незаменимых аминокислот. Его недостаток в питании приводит к уменьшению числа эритроцитов и снижению гемоглобина, возникают дистрофические изменения в мышцах, в печени и в легких, нарушается кальцификация костей. Наиболее богат лизином мышечный белок — миозин, а также гемоглобин.
Метионин (а-амино-у-метилтиомасля-ная кислота) впервые был выделен в 1922 году из казеина. Метионин относится к серосодержащим аминокислотам и играет исключительно важную роль в обмене веществ и в процессах метилирования и трансметилирования. Метионин является основным донатором метильных групп. В процессе деметилирования метионина образуется гомоцистеин. Метильные группы метионина используются для синтеза хо-лина, который участвует в обмене липидов. Метионин, также как и холин, относится к липотропным веществам, оказывая влияние на обмен липидов и фосфолипидов, он важен в профилактике атеросклероза. При высоком уровне метионина наиболее полно проявляется
I
ФУНКЦИИ И ПРИЗНАКИ НЕДОСТАТОЧНОСТИ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ [6]
Аминокислота Функция Признаки недостаточности
Валин Легко переаминируется и теряется, восстанавливает мышцы после физической нагрузки Гипертензия, атаксия
Гистидин Синтез фолиевой кислоты, нуклеиновых кислот, гемоглобина и карнозина, важна при уремии, усиливает секрецию соляной кислоты и пепсина Анемия, нехватка карнози-на, нарушение умственного развития у детей
Изолейцин Много в составе иммуноглобулинов, ключевая роль в утилизации пищи Потеря массы тела, высокий диурез
Лейцин Активирует эндокринную систему, важная роль для иммунной системы Задержка роста и физического развития
Лизин Содержится во всех белках, обеспечивает рост костной ткани, стимулирует митозы, поддерживает половую функцию у женщин, снижает уровень триглицеридов, противовирусное действие Головная боль, тошнота, снижение слуха, медленный рост костной ткани
Метионин Защита печени, детоксикация организма, защита от токсикоза беременных, антиоксидантное действие, синтез гемоглобина, функция щитовидной железы, рост Ожирение, цирроз печени, анемия, кровотечения, атрофия мышц
Треонин Усвоение пищевого белка, липотропное действие, обмен коллагена и эластина, повышает иммунитет Потеря веса, высокий диурез
Фенилала-нин 50% идет на синтез белка, синтез адреналина и тирозина, умственная активность, память, улучшает работу печени и поджелудочной железы Нарушение функции щитовидной железы и надпочечников, гипотония
г^.
о
СО
о
биологическое действие витамина В и фолиевой кислоты. В свою очередь эти витамины стимулируют деметилирование метионина и образование холина. Метионин играет важную роль в функции надпочечников, он необходим для синтеза адреналина. Имеются данные о профилактическом действии метионина при лучевых поражениях и бактериальной интоксикации.
Треонин (а-амино-в-оксимасляная кислота) получен в 1935 году из фибрина. Дефицит треонина вызывает задержку роста и снижение массы тела.
Триптофан (а-амино-в-индолилпропионовая кислота) выделен в 1901 году. Важнейшая из незаменимых аминокислот необходим для роста и поддержания азотистого равновесия, участвует в биосинтезе белков сыворотки крови и гемоглобина. Триптофан играет важную роль в образовании никотиновой кислоты (витамина РР).
Фенилаланин (а-амино-в-фенилпропионовая кислота) выделен в 1879 году. Фенилаланин регулирует функцию щитовидной железы и надпочечников. Из него образуется гормон тироксин, а также аминокислота тирозин, из которого, в свою очередь, образуется адреналин. Тирозин может образовываться из фенилаланина, однако обратного образования фенилаланина из тирозина не происходит.
ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ЗАМЕНИМЫХ АМИНОКИСЛОТ
Аргинин (амино-$-гуанидин валериановая кислота) открыт в 1886 году. Играет очень важную роль в обмене веществ. Белки ядер сперматозоидов содержат до 80% аргинина. Аргинин является предшественником оксида азота (N0), который является важным молекулярным биорегулятором. Введение аргинина приводит к расширению сосудов и существенному снижению артериального давления при гипертонической болезни. Регулярное назначение аргинина способствует улучшению клинического состояния больных ишемической болезнью сердца. Помимо этого он снижает вязкость крови и уменьшает риск тромбоза сосудов. При физической нагрузке аргинин способствует улучшению кровотока в коронарных артериях. Аргинин ускоряет регенерацию печени при ее токсическом поражении и может применяться при лечении цирроза печени и жирового гепатоза. Ингаляционное назначение аргинина при муковис-цидозе приводит к быстрому улучшению функции легких, он помогает при астматическом бронхите.
Известно, что аргинин стимулирует активность Т-лимфоцитов, предотвращает возрастное угнетение фагоцитоза макрофагами. Неспецифическая стимуляция иммунной функции аргинином сопровождается снижение частоты рака толстой кишки и молочной железы у экспериментальных животных. Назначение аргинина больным сахарным диабетом 2-го типа существенно повышает чувствительность к инсулину рецепторов клеток организма. У пациентов
с сахарным диабетом он ингибирует гликозилиро-вание гемоглобина, снижая развитие осложнений. У лиц с повышенной физической нагрузкой аргинин усиливает действие инсулина и увеличивает рост кровеносных капилляров в скелетных мышцах. Аргинин стимулирует выработку соматотропного гормона (гормона роста), способствует уменьшению жировых отложений, росту мышечной массы, увеличивает активность и физическую выносливость, улучшает настроение. Он повышает половую функцию, увеличивают выработку сперматозоидов.
Аргинин не рекомендуют беременным и кормящим женщинам, больным шизофренией. Он может стимулировать свободнорадикальные процессы, поэтому его следует принимать в сопровождении антиоксидантов.
Глицин (аминоуксусная кислота) — наиболее простая из аминокислот, в большом количестве содержится в клетках головного и спинного мозга. Он является метаболитом широкого спектра действия, специфическим регулятором активности нервных клеток, тормозным медиатором. Глицин способен связывать различные эндогенные и экзогенные (лекарства) соединения. В настоящее время его применяют как успокаивающее (седативное) средство, он улучшает мозговую функцию. Менее известна его способность нормализовать синтез коллагена и соединительной ткани.
Глютамин (8-амид-а-аминоглутаровая кислота) — самая распространенная свободная аминокислота в организме человека (в мышечной ткани содержание свободного глютамина составляет 67%). Очень активно обменивается в организме и является наиболее важной для переноса азота в печень и другие органы. Однако содержание глютамина в составе белка сравнительно небольшое — 5-7% (на лейцин приходится 10%). Глютамин является важным энергетическим субстратом для клеток печени, эпителиальных клеток тонкой кишки и иммунных клеток. Введение глютамина тяжелым больным ослабляет потерю мышечной массы улучшает функцию всасывания. Наличие глютамина является необходимым условием синтеза нуклео-тидов — пиринов и пиримидинов.
Глютамин играет ключевую роль в регуляции синтеза глутатиона — трипептида, состоящего из глютаминовой кислоты, цистеина и глицина. Глутатион является важнейшим эндогенным анти-оксидантом и защищает клетки от окислительного повреждения. Потребность в глютамине возрастает при окислительном стрессе.
Глютаминовая кислота (аминоглютаровая кислота) выделена в 1866 году из эндосперма пшеницы. Глютаминовая кислота играет активную роль в обмене белка и в удалении из организма продуктов распада. Глютаминовая кислота является единственной аминокислотой, поддерживающей дыхание клеток головного мозга. Аминокислоту применяют при лечении некоторых нервных и психических заболеваний. Глютаминовая кислота
участвует в поддержании кислотно-щелочного го-меостаза в крови и тканях.
Пролин (пирролидин-а-карбоновая кислота) — способствует заживлению ран, укрепляет сухожилия, связки и суставы, увеличивает физическую работоспособность, укрепляет сердечную мышцу.
Тирозин (а-амино-в-параоксифенилпропионовая кислота) — способствует функционированию щитовидной железы (синтез тироксина), гипофиза, надпочечников, снижает раздражительность, усталость, стресс, укрепляет сон.
Цистеин (ди-а-амино-в-тиопропионовая кислота) — способствует заживлению ожогов и ран, регенерации кожи, активирует иммунную систему, обладает антиоксидантной активностью.
ПОТРЕБНОСТЬ В АМИНОКИСЛОТАХ
Физиологическая потребность в аминокислотах окончательно не установлена. Проведенные исследования позволили выявить ориентиры потребности в незаменимых аминокислотах, отражающие минимальную потребность, «безусловно достаточное количество» и минимальные показатели суточной потребности [6]. Считают, что может быть «только один уровень физиологической потребности в незаменимых аминокислотах для здорового человека, хотя этот уровень для разных людей и в разное время может быть различным». ФАО/ВОЗ предложил в качестве идеального белка аминокислотную шкалу, в которой представлены незаменимые аминокислоты в расчете на 100 г стандартного белка. Однако данная шкала далека от идеального белка, о чем мы будем говорить ниже.
Поскольку заменимые аминокислоты могут образовываться в организме, определение их физиологической потребности также непросто. В 2004 году в РФ предложены (на основе расчета) значения адекватного и верхнего уровня потребности для заменимых и незаменимых аминокислот, табл. 9.
Как видно из таблицы, в 2004 году по сравнению с 1971-м суточная потребность примерно для половины аминокислот была пересмотрена как в сторону повышения (аспарагиновая кислота, серин и аланин), так и в сторону снижения (фенилаланин, валин, метионин, триптофан и глютами-новая кислота). При этом суточная потребность в заменимых аминокислотах выше (в 2,5 раза), чем в незаменимых, и в настоящее время составляет 56,9 г/сутки (72%), против 22,6 г/сутки (28%) для незаменимых аминокислот. В соответствии с современными нормами потребности среди незаменимых аминокислот доминируют: лейцин, фенилаланин и лизин, тогда как среди заменимых: глютамин (включая глютамат), аспарагин (включая аспартат) и серин. Следует подчеркнуть, что в соответствии с нормами потребности заменимых аминокислот должно быть в 2-2,5 раза больше, чем незаменимых.
Аминокислотный скор. Качество белка можно оценивать, сравнивая его аминокислотный состав с составом стандартного (идеального) белка. Такой расчет называют аминокислотным скором (оценкой). Аминокислотный скор определяют по формуле:
I
Таблица 8
ФУНКЦИИ И ПРИЗНАКИ НЕДОСТАТОЧНОСТИ ЗАМЕНИМЫХ АМИНОКИСЛОТ [6]
Аминокислота Функция Признаки недостаточности
Аргинин Образование мочевины, регулирует рост, тормозит рост опухолей за счет стимуляции иммунитета, детоксикация печени Нарушение роста, риск развития сахарного диабета, эректильная дисфункция
Глицин Синтез коллагена и соединительной ткани, седативное действие, нормализует мозговую функцию и сон, связывание аммиака. Увеличивает синтез лецитина Артрозы и артриты Повышенная возбудимость
Глютамин Переносчик аминных групп, важный энергетический субстрат для печени, тонкой кишки и иммунной системы, играет ключевую роль в регуляции синтеза глутатиона Быстрая потеря мышечной массы у больных, окислительный стресс
Пролин Синтез коллагена и соединительной ткани
Таурин Незаменим у детей, необходим в критических состояниях Нарушение развития мозга, миокарда, ЖКТ
Тирозин Синтез тироксина, пигмента кожи меланина, норадренали-на и адреналина Нарушение пигментации кожи
Триптофан Образование альбумина, выработка серотонина, снижает содержание жира, гипотензивное действие, синтез альбумина и глобулинов, гормона роста, антидепрессант, улучшает сон, снижает аппетит Анемия, стерильность, выпадение волос, депрессия, тревожность
Цистеин Процессы регенерации и заживления ожогов и ран Длительное заживление ран
о о
CD CD
(содержание аминокислоты данного белка (г/100 г) / содержание аминокислоты стандартного белка (г/100 г)) х 100.
Если в исследуемом белке содержание какой-либо аминокислоты будет менее 100%, то эта аминокислота окажется лимитирующей. Для взрослого человека в качестве идеального белка применяют шкалу ФАО/ВОЗ, в которой указано содержание каждой из незаменимых аминокислот в расчете на 100 г белка. Однако для человека и животных существует другие белки, которые в определенные периоды жизни являются единственным источником аминокислот для растущего организма. Среди белков животного происхождения к ним относятся белки молока и яйца. Среди растительных белков
Таблица 9
такими белками являются, например, белки сои, орехов, зародыша пшеницы и др. Сравним состав незаменимых аминокислот женского молока, который можно считать эталонным, с составом аминокислот известных животных (табл. 10) и растительных (табл. 11) белков [9].
Как видно из таблицы, состав незаменимых аминокислот женского молока является достаточно уникальным и не похожим как по составу, так и по соотношению аминокислот среди аналогичных по значимости белков коровьего молока и куриного яйца. В составе коровьего молока незаменимых аминокислот на 11% меньше, чем в женском молоке, в белке коровьего молока на 30% меньше валина, хотя метионина на 61% больше. Куриное яйцо по
РЕЙТИНГ ПОТРЕБНОСТИ ВЗРОСЛОГО ЧЕЛОВЕКА В АМИНОКИСЛОТАХ (г/сутки)
Аминокислоты А.Э. Шарпенак [6] Rous, Mesy, Block [6] ФАО/ВОЗ г/100 г белка [4] О.П. Молчанова, 1971 [6] Адекватный уровень (РФ, 2004) Верхний уровень (РФ, 2004)
Незаменимые
Лейцин 10,0*** 9,1 6,6 4-6 4,6 7,3
Фенилаланин 4,5 4,4 6,3* 2-4 4,4* 6,9*
Лизин 8,0 5,2 5,8 3-5 4,1 6,4
Валин 6,0 3,8 3,5 4,0 2,5 3,9
Треонин — 3,5 3,4 2-3 2,4 3,7
Изолейцин — 3,3 2,8 3-4 2,0 3,1
Метионин 2,5 3,8** 2,5** 2-4 1,8** 2,8**
Триптофан 1,6 1,1 1,1 1,0 0,8 1,2
Суммарно, г/сутки 32,6 34,2 32,0 26 22,6 35,3
% аминокислот 32% 34% 28% 28%
Заменимые
Глютамин + глютаминовая кислота 16,0 13,6 21,8
Аспарагин + аспарагиновая кислота 6,0 12,2 19,9
Серин 3,0 8,3 13,3
Аланин 3,0 6,6 10,6
Аргинин 6,0 6,1 9,8
Пролин 5,0 4,5 7,2
Глицин 3,0 3,5 5,6
Гистидин 2,0 2,1 3,4
Тирозин 3-4
Цистеин 2-3
Суммарно, г/сутки 68 50 56,9 91,6
% аминокислот 68% 66% 72% 72%
Сумма всех аминокислот 100 76 79,5 126,9
заменимые : незаменимые 2,12 1,92 2,5 2,6
Примечание:* — фенилаланин + тирозин; ** — метионин + цистеин; *** — лейцин + изолейцин.
Таблица 10
СРАВНИТЕЛЬНЫЙ СОСТАВ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ ЖЕНСКОГО МОЛОКА
И ЖИВОТНЫХ БЕЛКОВ
Аминокислоты Женское молоко Коровье молоко Куриное яйцо Рыба Мясо ФАО/ВОЗ
Незаменимые г/100 г г/100 г % г/100 г % г/100 г % г/100 г % г/100 г %
Лейцин 10,2 9,7 95 9,2 90 9,1 89 8,7 85 6,6 65
Валин 9,9 6,9 70 7,3 74 6,1 62 5,9 60 3,5 35
Лизин 8,5 7,5 88 7,9 93 9,5 112 8,6 101 5,8 68
Изолейцин 7,6 6,2 82 8,0 105 6,0 79 4,5 59 2,8 37
Фенилаланин 5,9 5,7 97 7,3 124 4,8 81 4,5 76 6,3* —
Треонин 5,0 4,6 92 5,9 118 5,1 102 5,3 106 3,4 68
Метионин 2,3 3,7 161 4,1 178 2,6 113 3,2 139 2,5** —
Триптофан 1,9 1,6 84 1,5 79 0,8 42 1,2 63 1,1 58
Аргинин*** 5,0 4,3 86 6,5 130 8,1 162 6,5 130 — —
Гистидин*** 2,7 2,5 93 2,1 78 2,6 96 3,0 111 — —
Суммарно 51,3 45,9 89 51,2 100 44,0 86 41,9 82 32,0 62
Заменимые 48,7 54,1 48,8 56,0 58,1 68,0
Заменимые : незаменимые 0,94 1,18 0,95 1,27 1,39 2,13
Примечание: * — фенилаланин + тирозин; ** — метионин + цистеин; *** — заменимые аминокислоты.
Таблица 11
СРАВНИТЕЛЬНЫЙ СОСТАВ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ ЖЕНСКОГО МОЛОКА
И РАСТИТЕЛЬНЫХ БЕЛКОВ
Аминокислоты Женское молоко Соевые бобы Овсяные хлопья Пшеничная мука Картофель
Незаменимые г/100 г г/100 г % г/100 г % г/100 г % г/100 г %
Лейцин 10,2 7,7 75 7,7 75 6,2 61 10* 56
Валин 9,9 5,3 54 5,3 54 4,3 43 4,0 40
Лизин 8,5 6,9 81 3,0 35 2,5 29 2,6 31
Изолейцин 7,6 5,8 76 5,3 70 3,1 41
Фенилаланин 5,9 5,0 85 4,6 78 4,8 81 6,4 108
Треонин 5,0 4,4 88 3,5 70 2,8 56 3,1 62
Метионин 2,3 1,3 57 1,2 52 1,2 52 1,5 65
Триптофан 1,9 1,3 68 1,3 68 1,3 68 0,6 32
Аргинин** 5,0 7,3 146 7,4 148 4,5 90 1,4 28
Гистидин** 2,7 2,5 93 2,0 74 2,0 74 0,6 22
Суммарно 51,3 37,7 73 31,9 62 26,2 51 28,2 55
Заменимые 48,7 62,3 68,1 73,8 71,8
Заменимые : незаменимые 0,94 1,65 2,13 2,82 2,55
Примечание: * — лейцин + изолейцин; ** — заменимые аминокислоты.
количеству незаменимых аминокислот и биологиче-Л ской ценности более всего приближено к женскому молоку, но соотношение незаменимых аминокислот ^ в белке куриного яйца совершенно иное. а белку женского молока, и кроме фенилаланина, ™ являются дефицитными практически по всем не° а__заменимым аминокислотам, особенно по лизину
(29-35%), валину (40-54%) и метионину (52-65%). Среди наиболее распространенных растительных белков, безусловно, лучшим является белок сои, который содержит существенно больше незаменимых аминокислот, чем другие растительные белки. Однако белок сои дефицитен по валину (54%), метионину (57%) и изолейцину (76%). Обращает на себя внимание доминирование в растительном белке заменимых аминокислот, которых больше чем незаменимых в 1,6-2,5 раза.
Сравнивая состав незаменимых аминокислот «идеального» белка ФАО/ВОЗ с белками женского или коровьего молока, а также яйца, можно увидеть, что последние отличаются принципиально иным составом и соотношением заменимых и незаменимых аминокислот близким к 1,0. Тогда как в «идеальном» белке ФАО/ВОЗ, а также в современных отечественных нормах это соотношение больше 2,0 (2,12-2,5), что характерно для белков растительного происхождения. Таким образом, по составу незаменимых аминокислот к идеальному белку наиболее близки белки яиц и молока. Белки рыбы
и мяса по содержанию аминокислот существенно отличаются от идеала, а растительные белки имеют еще более низкую биологическую ценность.
Биологическая ценность белка — доля задержки азота в организме от всего белка, попавшего в кровь. Мерой биологической ценности является такое количество белка, которое необходимо для поддержания азотистого равновесия в организме человека или животных. Если в белке есть все необходимые организму незаменимые и заменимые аминокислоты в нужном количестве и в необходимых пропорциях, и они полностью всасываются в желудочно-кишечном тракте, то его биологическая ценность будет равна 100. Когда в составе белка соотношение аминокислот неоптимальное, имеется дефицит отдельных незаменимых аминокислот или если белок плохо усваивается, то его биологическая ценность будет заведомо ниже (табл. 12).
Кругооборот белка в организме человека — явление физиологическое и связано с необходимостью обновления белка. Дело в том, что большинство белков и, прежде всего ферменты, живут недолго и могут разрушаться через несколько часов после биосинтеза. Значительно более долговечны структурные белки, гистоны, гемоглобин или компоненты цитоскелета клетки. Полупериод жизни белков в организме человека в среднем составляет 2-8 дней. Постоянное обновление белка играет важную роль в обмене веществ и является весьма эффективным механизмом регуляции активности ферментов, обновления пула иммуноглобулинов, удаления дефектных и ненужных в данное время белков. Быстрое разрушение требуется для удаления из организма биологически активных пептидов и пептидных гормонов. Постоянное разрушение и ресинтез новых белков позволяет клеткам «быстро приводить в соответствие с метаболическими потребностями уровень и активность наиболее важных ферментов» [2]. Ориентировочно в организме взрослого человека ежедневно в результате протеолиза деградирует до аминокислот 300-400 г белка. В то же время примерно столько же аминокислот включается во вновь
Таблица 12
ОЛ
сэ
КАЧЕСТВО НЕКОТОРЫХ ПИЩЕВЫХ БЕЛКОВ ОТНОСИТЕЛЬНО БЕЛКОВ ЖЕНСКОГО МОЛОКА
Пищевой белок Химическая ценность, % Биологическая ценность, % Дефицитные аминокислоты
Женское молоко 100 95 Нет
Яйцо куриное 100 87 Валин (74%), триптофан (79%)
Говядина 98 93 Изолейцин (59%), валин (60%), триптофан (63%), фенилала-нин (76%)
Коровье молоко 95 80-82 Валин (70%)
Рыба 61-86 Триптофан (42%), валин (62%), изолейцин (79%)
Соя 61-73 Валин (64%), метионин (57%), лейцин (75%), изолейцин (76%)
Белый хлеб 47 30 Лизин (29%), изолейцин (41%), валин (43%), метионин (52%), треонин (56%), лейцин (61%), триптофан (68%)
образованные белки. Оба эти процесса формируют кругооборот белка в организме. Учитывая, что в организме содержится около 10 кг различных белков, текущий протеолиз затрагивает всего 3% белка [2].
В результате протеолиза образуются аминокислоты, которые могут быть использованы клеткой для биосинтеза новых белков или поступают в кровь, формируя пул свободных аминокислот, объем которого составляет около 100 г. Деградация белка в клетках осуществляется с помощью двух специализированных систем: лизосом и протеосом. Важную роль в осуществлении деградации белков организма играет система пищеварения, в которой переваривается, а затем реутилизируется значительная часть плазматических и других эндогенных белков, а также белки, которые попадают в просвет кишки при слущивании завершивших свою работу эпителиальных клеток. В ходе деградации белка может накапливаться аминный азот, который, в отличие от углеводородной части аминокислот, непригоден для получения энергии. Поэтому аминогруппы, которые не могут быть использованы повторно, например, в реакциях трансаминирования, превращаются в аммиак, а затем — в мочевину.
В организме человека существует весьма эффективный механизм регуляции уровня белка. Чем выше дефицит белка в организме, тем лучше
Таблица 13
усваивается пищевой белок, и тем меньше будут потери аминокислот с калом и мочой. С другой стороны, чем больше белка содержится в пище, тем хуже он будет усваиваться. При отсутствии дефицита белка в организме его усвоение в желудочно-кишечном тракте также снижается. Механизм регуляции уровня белка в организме человека также связан с увеличением кругооборота белка и аминокислот при его дефиците и снижением кругооборота и усилением катаболизма белка при его избыточном поступлении с пищей. Таким образом, организм способен в определенной степени сглаживать дефицит белка, в то же время препятствуя перегрузке организма пищевым белком. Например, после приема пищи с высоким содержанием белка более половины аминокислот (57%), поступающих в печень, превращается в мочевину, 14% аминокислот остаются в печени и 23% — выходят в кровь и поступают в пул свободных аминокислот. Только 6% аминокислот используется печенью для синтеза белков [2].
Свободные аминокислоты, находящиеся в крови, захватываются печенью, почками, поджелудочной железой, тонкой кишкой,
РЕЙТИНГ СОДЕРЖАНИЯ АМИНОКИСЛОТ В КРОВИ И В МОЧЕ ЧЕЛОВЕКА [10]
Аминокислота Содержание в крови, мг/100 мл Экскреция с мочой в сутки, мг
Незаменимые диапазон в среднем
Валин 2,88 4-6 5,0
Лизин 2,72 7-48 27,5
Лейцин 1,86 9-26 17,5
Треонин 1,67 15-53 34,0
Изолейцин 1,34 14-28 21
Триптофан 1,27
Метионин 0,52 5-10 7,5
Заменимые
Аланин 3,40 21-71 46
Пролин 2,36 Менее 10 10
Аргинин 1,62
Глицин 1,50 21-71 46
Цистеин 1,47 10-21 15,5
Гистидин 1,38 113-320 217
Серин 1,12 27-73 50
Тирозин 1,04 15-49 32
Глютамат 0,70 8-40 24
Аспартат 0,03 Менее 10 10
т
сэ
более 85% свободных аминокислот покидает систему кровообращения в течение 5-15 минут, поэтому концентрация аминокислот в крови достаточно низкая — 35-70 мг/100 мл [2] (табл. 13).
ЗАКЛЮЧЕНИЕ
Таким образом, потребность человека в белке во многом зависит от качественного состава аминокислот, и прежде всего незаменимых. Поэтому белков животного происхождения, которые наиболее близки по составу аминокислот к белкам организма человека, требуется меньше, чем белков растительных, аминокислотный состав которых существенно отличается от оптимального для человека. Например, при употреблении белков с высокой биологической ценностью (мяса, молока, яиц) для удовлетворения потребности взрослого человека достаточно 0,75 г/ кг массы тела (52,5 г белка/сутки). При употреблении смешанного рациона (белки животного и растительного происхождения) потребность в белке будет составлять 0,85-1,0 г кг массы тела (59,5-70,0 г белка/сутки). Более того, при потреблении животных белков с калом теряется 2,5-3,0% азота, тогда как употреблении в пищу растительных продуктов, богатых клетчаткой (овощи, зерновые) — до 40% пищевого азота [6].
Низкие нормы потребности в белке, которые в свое время предлагали Ро и Читтенден, а затем и Вильямс, были основаны на классических представлениях об азотистом балансе (равновесии). Согласно этим представлениям для поддержания азотистого (белкового) равновесия в организме большинства взрослых людей, которые здоровы и находятся в покое, может быть достаточно 30 г белка/сутки. Читтенден, который изучал белковый обмен у молодых людей (студентов, солдат, спортсменов), показал, что азотистое равновесие вполне может обеспечить 55-60 г белка/сутки [7].
В принципе для поддержания азотистого равновесия у взрослого и здорового человека на минимальном уровне достаточно 36,9 г молочного белка/ сутки. С учетом высокого качества белка куриного яйца минимальная потребность в белке для поддержания азотистого равновесия может составлять 0,34-0,43 г белка/кг массы тела в сутки, или 28 г яичного белка в сутки [11]. Однако для обеспечения «надежного уровня потребления», белка требуется больше — 56,25-57,5 г белка казеина в сутки при калорийности пищевого рациона около 3000 ккал/ сутки. Для нормального физического развития, повышения работоспособности и устойчивости к неблагоприятным внешним воздействиям, а также сопротивляемости организма к инфекции белка нужно еще больше, чем то количество, которое всего лишь «обеспечивает поддержание азотистого равновесия». В этой связи выделяют «оптимальную потребность человека в белке», которая должна превышать надежный уровень на 50% и будет составлять 84,4-87,5 г белка/сутки [7].
Таким образом, потребность в белке должна складываться из некоего минимального количества — «безопасного уровня белка», который обеспечивает «надежный уровень потребления», и «дополнительного количества белка», который учитывает особенности обмена веществ, состояние здоровья и качественный состав пищевого рациона. Безопасный уровень белка обеспечивает надежное поддержание азотистого равновесия в организме определенного числа людей, а введение дополнительного количества белка необходимо для заполнения так называемых «лабильныхрезервов белка».
В 1973 году ФАО/ВОЗ путем расчета определило, что величина средней потребности в белке населения развитых стран должно составлять 48,5-56,6 г/ сутки (при относительной биологической ценности 70-80%). Для развивающихся стран, в питании которых присутствует большая доля низкокачественного растительного белка (относительная биологическая ценность — 60-70%), средняя потребность в белке была определена равной 56,6-65,5 г в сутки [11].
Чем ниже биологическая ценность белка, тем больше его требуется. Однако в этом случае некоторые аминокислоты будут поступать в организм человека в избыточном количестве, превышающем текущие потребности, связанные с биосинтезом белка и специфическим метаболизмом отдельных аминокислот. Белки и аминокислоты не способны запасаться в организме, поэтому лишние аминокислоты будут либо выводиться из организма, либо подвергаться метаболической деградации. Содержащийся в аминокислотах азот будет превращаться в мочевину и креатинин и выделяться с почками, углеродный скелет — использоваться для биосинтеза глюкозы или жирных кислот, а другая его часть — окисляться до углекислого газа и воды с образованием АТФ.
Потребность в белке во многом зависит от калорийности и состава других компонентов пищевого рациона — углеводов и липидов (табл. 14). Низкокалорийные диеты или диеты с недостаточным количеством углеводов увеличивают потребность в белке, поскольку часть белка начинает расходоваться для образования глюкозы и кетоновых тел. При отсутствии в пищевом рационе углеводов и жиров для достижения азотистого равновесия пищевого белка требуется в 5 раз больше [6]. С увеличением калорийности пищевого рациона потребность в белке снижается.
Таким образом, рассматривая потребность организма в белке и аминокислотах, можно сделать следующие выводы:
• Белок пищи необходим не только для биосинтеза белков организма, но и для решения энергетических проблем, особенно в критических ситуациях.
• Отдельные аминокислоты пищевого белка выполняют в организме самостоятельную функцию, что необходимо учитывать при назначении
Таблица 14
ВЛИЯНИЕ КАЛОРИЙНОСТИ РАЦИОНА НА ПОТРЕБНОСТЬ В БЕЛКЕ ДЛЯ ПОДДЕРЖАНИЯ АЗОТИСТОГО РАВНОВЕСИЯ [12]
Калорийность рациона Потребность в белке для нулевого баланса Безопасный уровень потребления белка
ккал/кг кал/70 кг г/кг г/70 кг г/кг г/70 кг
40 2800 0,78 54,6 1,02 71,4
45 3150 0,56 39,2 0,74 51,8
48 3360 0,51 35,7 0,62 43,4
57 4000 0,42 29,4 0,50 35
Рекомендуемая норма потребления 0,80 56
I
аминокислот, используя отдельные аминокислоты для коррекции питания.
• Идеальными белками по составу и пропорциям незаменимых аминокислот являются белки молока и куриного яйца и в меньшей степени — белки мяса. Растительные белки содержат аминокислоты в иных пропорциях и дефицитны по большинству незаменимых аминокислот.
• Избыточное потребление белковой пищи «не идет нам впрок», поскольку лишние аминокислоты пищи будут разрушаться, а белковый азот удаляться из организма. Потребление белка
должно быть равномерным на протяжении суток, что позволяет оптимизировать его всасывание и утилизацию, а также свести к минимуму потери аминокислот.
• Умеренное потребление белка не является столь катастрофичным для организма человека, поскольку при этом снижаются потери аминокислот.
• Для достижения разных целей необходимы белковые модули с разным количеством и соотношением как заменимых, так и незаменимых аминокислот.
ЛИТЕРАТУРА
1. ЛенинджерА.Л. Основы биохимии. — М.: Мир, 1985. — Т. 1. — 365 с.
2. КольманЯ., РемК.-Г. Наглядная биохимия. — М.: Мир, 2000. — 469 с.
3. Попова Т.С., Шестопалов А.Е., Тамазашвили Т.Ш., Лейдерман И.Н. Нутритивная поддержка больных в критических состояниях. — М., 2002. — 320 с.
4. Мартинчик А.Н., Маев И.В., Петухов А.Б. Питание человека (основы нутрициологии). — М.: ГОУ ВУНМЦ МЗ РФ, 2002. — 572 с.
5. Ньюсхолм Э., Старт К. Регуляция метаболизма. — М.: Мир, 1977. — 408 с.
6. Гигиена питания / Под ред. К.С. Петровского. — М.: Медицина, 1971.— Т. 1. — 511 с.
7. Высоцкий В.Г. К оценке потребности человека в белке // Вопросы питания. — 1978. — № 6. — С. 8-17.
8. Основы клинического питания. — Петрозаводск: ИнтелТек, 2003. — 412 с.
9. Химический состав пищевых продуктов. Книга 2. — М.: ВО Агропромиздат, 1987. — 360 с.
10. Большая медицинская энциклопедия. — М.: Медицина, 1974. — Т. 1. — С. 364-371.
11. Energy and Protein Requirements // WHO Tech. Rep. Ser. — 1973. — No 522. — P. 40-72.
12. Общая нутрициология. — М.: МЕДпресс-информ, 2005. — 392 с.
LЛ
CD
Заменимые и незаменимые аминокислоты. Для чего они нужны?
10.06.2015
Аминокислоты являются одними из самых продаваемых продуктов спортивного питания. Существует огромное количество разных аминокислот, их выбор очень велик. Выпускают комплексные аминокислоты, в которых содержатся и заменимые аминокислоты, и незаменимые и условно-заменимые.
Также есть аминокислоты, в состав которых входит только три аминокислоты. Такие продукты называютсяВСАА.
Выпускаются и добавки в составе с двумя-тремя аминокислотами. Аминокислоты представлены на рынке в виде капсул, таблеток, в жидком виде, в порошке. Есть аминокислоты, которые нужно вводить внутривенно, они могут содержать глюкозу , а могут быть без нее. Но среди комплексных аминокислот самыми продаваемыми являются аминокислоты, выпущенные в твердой форме – это каплеты, таблетки и капсулы.
Что же такое аминокислоты? Человеческое тело насыщено огромнейшим количеством белков. Молекулы белков построены из маленьких кирпичиков – аминокислот. Белки в организме человека отвечают за то, чтобы разные ткани организма росли и восстанавливались. В процессе катаболических реакций они могут быть использованы как энергия. Когда пища переваривается белок, который поступил в желудок, сначала расщепляется на пептидные фрагменты, а потом из него образуются свободные аминокислоты, которые никак друг с другом не связаны. Эти аминокислоты распространяются с помощью кровотока ко всем органам. С помощью них восстанавливаются поврежденные мышцы и образуются новые. В составе комплексных аминокислот есть аминокислоты, которые не полностью были переварены. Чтобы они попали в кровоток нужно намного меньше времени, чем для попадания в кровоток протеинов (даже сывороточного белка). Комплексы из аминокислот рекомендован использовать для того, чтобы моментально восстановить запас протеина. Лучше всего их принимать в утреннее время или же по окончанию тренировки. Чтобы подкорректировать аминокислотный состав из обычной еды нужно принимать комплексы аминокислот после приема пищи. Следует знать о том, что аминокислотные комплексы не могут заменить протеин, то есть, они дополняют другие источники протеина. В природе есть близко 150 видов аминокислот и только 20 из них находится в пище. Эти аминокислоты делятся на незаменимые и заменимые. Незаменимые аминокислоты организм не может синтезировать и они должны поступать в организм вместе с едой. Заменимыми называют те аминокислоты, которые может выработать печень при условии нормального функционирования.
Существую и частично заменимые аминокислоты, их организм может сам синтезировать, но для этого нужно , чтобы их достаточное количество поступило извне. Незаменимые аминокислоты – лейцин, валин, изолейцин, триптофан, лизин, метионин, фенилаланин, треонин. Частично заменимые аминокислоты- гистидин и аргинин.
Заменимые аминокислоты – глютамин, аланин, глютаминовая кислота, аспарагин, серин, аспарагиновая кислота, цистин (цистеин), глицин, пролин, тирозин. Как правильно выбрать аминокислотный комплекс?
При выборе комплексных аминокислот следует обратить внимание на следующие факторы:
•Форма выпуска. Скорость усвоения зависит от формы выпуска. Мы говорим об аминокислотах выпущенных в твердой форме, но среди них также есть разные. Самыми быстрыми по усвоения считаются аминокислоты в порошке. Для усвоения аминокислот в таблетках нужно больше всего времени. Кроме того, они бывают очень больших размеров и их достаточно сложно проглотить. Самыми удобными являются капсулированные аминокислоты.
•Аминокислотный состав. Достаточно сложно определить какое оптимальное соотношение аминокислот должно быть в комплексном препарата (кроме ВСАА конечно же). Самое главное, чтобы в составе присутствовали незаменимые аминокислоты.
•Присутствие других аминокислот, минералов и витаминов.
•Источник аминокислот. Хоть и незначительно( так как в комплексах эти вещества находятся полупереваренными), но от него зависит скорость усвоения.
Также важно обращать внимание на аминокислотный состав. Как правильно принимать комплексные аминокислоты и когда это лучше делать? Лучше всего комплексные аминокислоты могут усваиваться в утреннее врем, после тренировки и перед ней. Принимать их нужно соответственно. В утреннее время при приеме аминокислот нужно обязательно подавить глюконеогенез, иначе большое количество поступивших аминокислот будет превращаться в глюкозу. Если употреблять аминокислоты после окончания тренировки, то нужно понимать, что в этом периоде очень высокая чувствительность инсулиновых рецепторов, в особенности тех, которые находятся на поверхности волокон мышц. В основном бодибилдеры не ограничиваются после тренировки приемом одних только аминокислот. Обычно они их дополняют коктейлями из углеводов и белков. Правильное потребление. В утреннее время нужно употреблять данную добавку после еды (спустя полчаса) или перед ней (тоже за полчаса), запивая при этом большим количеством жидкости. Следует придерживаться нормы, которую указывает производитель. Если превысить ее, то это может раздражать желудок или же кишечник. А во вторых – в наших интересах, чтобы много аминокислот как можно быстрее попали в кровь, а в большом количестве они могут на долгое время осесть в желудке, особенно это касается таблеток.
Статьи о спортивном питании. Заказать спортивное питание Meal to Goal
Как вы знаете белок – это основа любой клетки человека. Белок, он же протеин – первостепенен (не зря protos по гречески означает «первый).
Сами белки, в свою очередь, состоят из аминокислот. Связываясь в определенной последовательности, аминокислоты выстраивают разнообразные белковые молекулы. Это напоминает построение слов из отдельных букв.
Организм, благодаря усвоению аминокислот, способен производить свыше 50000 белков и свыше 15000 ферментов. Помимо воспроизводства ферментов (включая пищевые ферменты), аминокислоты играют важную роль в нашем организме, отвечая за нормализацию настроения, концентрации, агрессии, внимания, сна, а также и сексуальной активности. Поступая в организм, потребленный белок разрушается на аминокислоты. Затем, отдельные аминокислоты используются для создания необходимых организму белков и ферментов. В свою очередь, пищеварительные ферменты помогают в усвоении белка и расщеплении его на аминокислоты, потребляемые человеком.
Аминокислоты делятся на заменимые и незаменимые:
Незаменимые АК | Заменимые АК |
Валин | Аланин |
Гистидин | Аргинин |
Лизин | Аспарагин |
Лейцин | Аспарагиновая кислота |
Изолейцин | Глицин |
Метионин | Глутамин |
Треонин | Глутаминовая кислота |
Триптофан | Пролин |
Фенилаланин | Серин |
Аргинин* | Тирозин |
Цистеин |
“*” незаменимая для детей
Заменимые аминокислоты человеческий организм способен вырабатывать самостоятельно. Незаменимые аминокислоты самостоятельно не синтезируются, а потому должны поступать извне. Такие аминокислоты обязательно должны входить в рацион человека.
Существует установленная среднесуточная потребность человеком незаменимых аминокислот:
Аминокислота | Надежный уровень* (г) | Оптимальный уровень** (г) |
Изолейцин | 1,8 | 4 |
Лейцин | 2,5 | 7 |
Лизин | 2,2 | 5,5 |
Метионин+цистин | 2,4 | 3,5 |
Фенилаланин+тирозин | 2,5 | 6 |
Треонин | 1,3 | 4 |
Триптофан | 0,65 | 1 |
Валин | 1,8 | 5 |
“*” минимальный физиологический уровень
“**” по рекомендации ФАО/ВОЗ
Таким образом, аминокислоты являются важным компонентом для нашего организма.
В нашем он-лайн магазине вы можете найти аминокислоты, необходимые для ваших целей.
Команда M2G
Сколько всего аминокислот существует?
Выберите разделВ помощь кондитеруКак применятьПолезно знатьРецептуры и технологииРецептыРецепты кондитера
Этот блог не предназначен для предоставления диагностики, лечения или медицинской консультации. Контент, представленный в этом блоге, предназначен только для информационных целей. Пожалуйста, проконсультируйтесь с врачом или другим медицинским работником относительно любых медицинских или связанных со здоровьем диагнозов или вариантов лечения. Информация в этом блоге не должна рассматриваться в качестве замены консультации с медицинским работником. Утверждения, сделанные о конкретных продуктах в этом блоге, не одобрены для диагностики, лечения, лечения или профилактики заболеваний.
Как вы думаете – сколько всего аминокислот существует? Давайте разберемся в этом вопросе. Аминокислоты — это в первую очередь «фундамент» для образования в нашем организме протеинов, гормонов, антител, белков в тканях, различных ферментов. Все белки – это соединенные в определенной последовательности цепочки из аминокислот. Если отсутствует одна аминокислота, то строительство молекулы белка становится попросту невозможным.
Каково назначение этих элементов? Аминокислоты в первую очередь обеспечивают функционирование практически всех систем в организме, угнетая или наоборот стимулируя все процессы жизнедеятельности:
- обогащают энергией, необходимой для мышечной ткани;
- обеспечивают правильную работу и функционирование нервной системы, являясь нейромедиаторами;
- активно участвуют в водно-солевом обмене.
На сегодняшний день обнаружено 26 аминокислот. Простыми компонентами в образовании белка, считаются 20 аминокислот. Все живые организмы образуют множество различных соединений белка. Все аминокислоты можно разделить на две группы:
1. Аминокислоты незаменимые – они поступают в наш организм исключительно с белковой пищей. Это следующие кислоты:
- гистидин;
- метионин;
- треонин;
- изолейцин;
- лейцин;
- фенилаланин;
- триптофан;
- валин.
2. Аминокислоты заменимые – они поступают в человеческий организм с белковой пищей или строятся из других аминокислот. В их число входят:
- аланин;
- глицин;
- аргинин;
- аспарагин;
- кислота аспарагиновая;
- цистеин;
- кислота глютаминовая;
- глютамин;
- пролин;
- серин;
- таурин;
- тирозин.
А где же эти аминокислоты синтезируются? Основная масса аминокислот в организме человека образуется в печени. Но к сожалению, стрессы, инфекции, старение и многие другие факторы, нарушают эти процессы, что ведет к быстрому истощению организма и потере физической активности.
Чтобы и вы получили такой ошеломительный эффект, покупайте кондитерские ингредиенты по промокоду BLOG со скидкой в 10%, который распространяется на все заказы до 15 кг! И до встреч в новых статьях!
Описание анализа Анализ мочи на аминокислоты (31 показатель) в Култаево
Код: 10.20.01.А
Цена: 6300 руб
ОПИСАНИЕ
Комплексное определение концентрации аминокислот и их производных в моче для диагностики врожденных и приобретенных нарушений аминокислотного обмена.
Состав комплекса:
• Аргинин
• Аспарагиновая кислота
• Цитруллин
• Глутаминовая кислота
• Глицин
• Метионин
• Орнитин
• Фенилаланин
• Тирозин
• Валин
• Лейцин
• Изолейцин
• Гидроксипролин
• Серин
• Аспарагин
• альфа-аминоадипиновая кислота
• Глутамин
• Таурин
• Гистидин
• Треонин
• 1-метилгистидин
• 3-метилгистидин
• гамма-аминомасляная кислота
• альфа-аминомасляная кислота
• Пролин
• Лизин
• Цистин
• Триптофан
• Гомоцистин
• Фосфоэтаноламин
• Фосфосерин
• Этаноламин
Аминокислоты – органические соединения, молекулы которых содержат карбоксильные и аминогруппы. Аминокислоты – основной структурный компонент белков. Известно около 200 природных аминокислот, однако в состав белков входит только 20 аминокислот. Также аминокислоты участвуют в обмене белков, углеводов, образовании важных для организма соединений (например, пуриновых и пиримидиновых азотистых оснований, являющихся неотъемлемой частью нуклеиновых кислот), входят в состав гормонов, витаминов, пигментов, токсинов. Некоторые аминокислоты служат посредниками при передаче нервного импульса.
Согласно классификации, выделяют незаменимые, заменимые и условно-заменимые аминокислоты. Аминокислоты, которые не синтезируются в организме и которые необходимо получать с пищей, называются незаменимыми. Для человека и разных животных набор незаменимых аминокислот неодинаков. Для человека незаменимые аминокислоты — валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин. Для образования условно заменимых аминокислот необходимы незаменимые аминокислоты. Заменимые аминокислоты – аминокислоты, потребность в которых может быть восполнена синтезом из других веществ.
Пищевая ценность белка зависит от его аминокислотного состава и способности усваиваться организмом. Присутствие в белках всех незаменимых аминокислот говорит о его полноценности. Чем выше содержание незаменимых аминокислот, тем больше пищевая ценность белка.
Данное комплексное исследование заключается в одновременном определении аминокислот, как входящих в состав белков, так и аминокислот, не содержащихся в белках, а также их производных (таких как фосфоэтаноламин, гомоцистин, цистин, таурин, фосфосерин и другие).
Аланин — протеиногенная заменимая аминокислота, является структурным компонентом белков, одним из субстратов синтеза глюкозы, важным энергетическим компонентом для органов центральной нервной системы. При интенсивной мышечной работе потребность в аланине возрастает.
Аргинин входит в состав белков и пептидов, особенно высоко его содержание в гистонах — ядерных белках, выполняющих две основных функции: участие в упаковке нитей ДНК в ядре и регуляции процессов синтеза белка — транскрипции, репликации. Аргинином богаты белки ядер клеток, а также белки растущих тканей (эмбриональная ткань, опухоли). Также аргинин входит в состав гормона гипофиза вазопрессина, участвует в образовании антител, стимулирует выработку Т-лимфоцитов, является одним из предшественников в синтезе креатина, промежуточным продуктом в синтезе мочевины в печени. При окислении аргинина образуется оксид азота. Данное соединение обладает широким спектром биологического действия: является нейромедиатором, принимает участие в регуляции сосудистого тонуса и расслаблении гладкой мускулатуры сосудов, предотвращает агрегацию тромбоцитов и адгезию нейтрофилов к эндотелию, обладает цитотоксической и антимикробной активностью.
Аспарагиновая кислота участвует в реакциях обмена аминокислот (трансаминировании) синтезе мочевины, пуриновых и пиримидиновых оснований, регуляции синтеза иммуноглобулинов.
Цитруллин – заменимая аминокислота, не входит в состав белков, синтезируется в организме двумя способами: из глютамина и в процессе окисления аргинина, участвует в цикле образования мочевины в печени.
Глутаминовая кислота является нейромедиаторной аминокислотой, стимулирующей передачу возбуждения в синапсах центральной нервной системы. Участвует в обмене белков, углеводов, окислительно-восстановительных процессах. Глутаминовая кислота способна присоединять аммиак и переносить его в печень, где затем образуется мочевина и глюкоза. Также она принимает участие в синтезе других аминокислот, ацетилхолина, АТФ (аденозинтрифостфата), в переносе ионов калия, входит в состав белков скелетной мускулатуры. Является предшественником в синтезе глутатиона.
Глицин — тормозной медиатор, регулирующей процессы торможения и возбуждения в центральной нервной системе. В спинном мозге глицин приводит к торможению двигательных нейронов, что позволяет использовать глицин в неврологической практике для устранения повышенного мышечного тонуса. Участвует в синтезе порфиринов, пуриновых оснований.
Метионин – это аминокислота, которая необходима для синтеза адреналина, холина. Участвует в обмене липидов, фосфолипидов, витаминов, активирует действие гормонов, ферментов, белков. Является источником серы в синтезе серосодержащих аминокислот, в частности цистеина. Метионин также обеспечивает процессы детоксикации, способствует пищеварению, является одним из источников синтеза глюкозы.
Орнитин участвует в синтезе мочевины, снижении концентрации аммиака в плазме крови, регулирует кислотно-щелочной баланс в организме человека. Необходим для синтеза и высвобождения инсулина и соматотропного гормона, для нормального функционирования иммунной системы.
Фенилаланин необходим для синтеза нейромедиаторов: адреналина, норадреналина, допамина. Улучшает работу центральной нервной системы, функционирование щитовидной железы.
Тирозин необходим для биосинтеза меланинов, дофамина, адреналина, гормонов щитовидной железы. Улучшает работу надпочечников, щитовидной железы, гипофиза.
Валин является важным источником для функционирования мышечной ткани, участвует в поддержании баланса азота в организме, регулирует восстановительные процессы в поврежденных тканях.
Лейцин является важным компонентом в синтезе холестерина, других стероидов и гормона роста и, следовательно, участвует в процессах регенерации тканей и органов.
Изолейцин участвует в энергетических процессах организма, регулирует уровень глюкозы в крови, необходим для синтеза гемоглобина и также участвует в регенерации кожи, мышечной, хрящевой и костной тканей.
Уровень лейцина и изолейцин в организме коррелирует с физической работоспособностью, у профессиональных спортсменов недостаток этих аминокислот считается прогностическим признаком утомляемости или недостаточного восстановления физической формы при интенсивных тренировочных нагрузках.
Гидроксипролин составляет около 10% молекулы коллагена — белка костной и соединительной ткани. Определение выведения гидроксипролина с мочой является одним из показателей общего обмена коллагена и отражает состояние соединительной ткани.
Серин необходим для синтеза пуриновых и пиримидиновых оснований, а также для ряда других аминокислот (цистеина, метионина, глицина). Участвует в обмене жирных кислот и жиров, в функционировании некоторых ферментов.
Аспарагин является важным регулятором процессов, происходящих в центральной нервной системе (возбуждение-торможение), участвует в метаболизме и синтезе аминокислот в печени.
Альфа-аминоадипиновая кислота является одним из продуктов конечного обмена аминокислот.
Глутамин участвует в синтезе углеводов, других аминокислот, нуклеиновых кислот, ферментов. Обеспечивает поддержание кислотно-щелочного равновесия, необходим для синтеза белков скелетной и гладкомышечной мускулатуры, обладает антиоксидантной активностью. Глутамин не только связывает и обезвреживает аммиак, но также служит его транспортной формой, так как легко проходит через мембраны и поступает из клеток в кровь.
Таурин способствует увеличению энергетической активности клеток, участвует в процессах заживления и регенерации, нормализует функциональное состояние клеточных мембран.
Гистидин является исходным веществом при синтезе гистамина, мышечных белков, большого числа ферментов. Входит в состав гемоглобина, участвует в процессах регенерации и роста тканей.
Треонин необходим в синтезе коллагена и эластина, регулирует обмен веществ за счет участия в функционировании работы печени, белковом и жировом обмене.
1-метилгистидин и 3-метилгистидин являются одними из продуктов распада белков мышечной ткани. Поэтому, уровень 3-метилгистидина в моче, образующегося при расщеплении актина и миозина, служит показателем деградации мышечных белков.
Гамма-аминомасляная кислота в основном содержится в центральной нервной системе и головном мозге. Участвует в обменных процессах в данных органах, в процессах нейромедиаторной передачи импульсов, оказывая тормозящее действие на нервную активность, а также играет роль в метаболизме глюкозы.
Альфа-аминомасляная кислота участвует в синтезе некоторых белков и является продуктом биосинтеза офтальмовой кислоты, являющейся структурным компонентом хрусталика глаза.
Пролин входит в состав большинства белков, а также является компонентом инсулина, адренокортикотропного гормона, коллагена. Способствует восстановлению кожи, соединительной ткани.
Лизин входит в состав большинства белков, необходим для роста, восстановления тканей, синтеза гормонов, ферментов, антител, синтеза коллагена.
Цистин является компонентом многих белков и донором тиольных групп для пептидов, что играет важную роль в их метаболизме и биологической активности. Входит в состав инсулина, соматотропного гормона.
Триптофан — незаменимая аминокислота, в организм человека поступает только с пищей. Используется организмом для синтеза белка, является предшественником биогенных аминов, таких как, серотонин, триптамин, мелатонин.
Гомоцистин — в норме это соединение не содержится в тканях и биологических жидкостях человека. При дефиците фермента цистатион-синтазы, участвующего в превращении аминокислоты метионин в цистеин, развивается заболевание сопровождающееся образованием и накоплением гомоцистина, повышением уровня метионина и гомоцистеина в сыворотке крови. Для этого заболевания характерны высокие показатели почечной экскреции метионина, гомоцистеина, гомоцистина и низкие – цистина. Заболевание наследуется по аутосомно — рецессивному признаку.
Гомоцистин активирует фактор Хагемана, способствуя процессу тромбообразования, обладает низкой растворимостью, может оседать в патологически измененной интиме сосудов, также предрасполагая к образованию тромбов. Имеются данные, свидетельствующие об изменении обмена соединительной ткани у больных с гомоцистинурией. Клинические симптомы заболевания — задержка психомоторного развития, умственная отсталость, снижение зрения, деформации скелета (кифосколиозы, воронкообразная или килевидная деформации грудной клетки), патология со стороны сердечно-сосудистой системы, частые переломы у детей старшего возраста.
Фосфоэтаноламин – является компонентом клеточных мембран, определяет их структуру и функции, принимает участие в активации мембранных и лизосомальных ферментов, проведении нервного импульса, свертывании крови, иммунологических реакциях, процессах клеточной пролиферации и регенерации тканей.
Фосфосерин входит в состав сложных белков – фосфопротеинов. Чаще всего в фосфопротеинах преобладает именно соединения фосфорной кислоты с серином. Фосфопротеины вместе с необходимым пулом аминокислот участвуют в формирование скелета. Типичными представителями этих сложных белков являются казеины, существующие в нескольких формах и различающиеся между собой по содержанию фосфата и аминокислотным составом. Несколько различных фосфопротеинов найдено в белках яиц: овальбумин – фосфопротеин яичного белка; вителленин и фосвитин, выделен из яичного желтка.
Этаноламин участвует в образовании фосфолипидов — важнейших липидов клеточных мембран. Фосфолипиды есть во всех живых клетках, они играют важную биологическую роль в межклеточном взаимодействии, содержатся в нервной ткани, участвуют в транспорте липидов, жирных кислот и холестерина. В клинических исследованиях определение содержания этаноламина в моче используют для изучения тяжести различных нефропатий, в частности дисметаболического характера, у детей. Отмечены изменения количества этаноламина в крови при патологии центральной нервной системы, печени.
Для определения качественного и количественного состава аминокислот в моче используется метод высокоэффективной жидкостной хроматографии. Данный метод позволяет провести разделение и анализ сложных смесей веществ, с различной молекулярной массой и размерами.
Анализ аминокислот в моче позволяет оценить их качественный и количественный состав, получить информацию об имеющемся дисбалансе, что может свидетельствовать о пищевых и метаболических нарушениях, лежащих в основе большого числа заболеваний. Следует отметить, что снижение количества той или иной аминокислоты в моче происходит раньше, чем в плазме крови. Учитывая эти обстоятельства и доступность исходного биоматериала, определение аминокислот в моче может быть рекомендовано для оценки ранних изменений аминокислотного состава.
ПОДГОТОВКА К ИССЛЕДОВАНИЮ
Утром после тщательного туалета половых органов собрать в контейнер первую порцию мочи. Исключить из рациона алкоголь за 24 часа до анализа. Исключить прием мочегонных препаратов за 48 часов до сдачи мочи (по согласованию с врачом).
Биоматериал: разовая порция утренней мочи.
ПОКАЗАНИЯ
- Диагностика врожденных и приобретенных нарушений обмена аминокислот.
- Контроль проводимой лекарственной терапии.
- Оценка пищевого статуса при нарушении питания, приеме белковых препаратов, гормональных веществ.
- Мониторинг соблюдения диетотерапии и эффективности лечения;
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ
Интерпретация результатов содержит аналитическую информацию для лечащего врача. Лабораторные данные входят в комплекс всестороннего обследования пациента, проводимого врачом и не могут быть использованы для самодиагностики и самолечения.
Исследование предполагает количественное определение аминокислот и их производных, входящих в состав данного комплекса. Следует отметить, что повышение уровня отдельных аминокислот может наблюдаться у практически здоровых лиц, носить кратковременный характер и быть связано с особенностями пищевого рациона, приемом лекарственных препаратов, в частности, белковых и гормональных препаратов, биологически активных добавок.
Повышение общего уровня аминокислот кислот в моче:
- аминоацидемия (аминоацидурия).
- эклампсия;
- нарушение толерантности к фруктозе;
- диабетическицй кетоацидоз;
- почечная недостаточность;
- синдром Рейе.
Снижение общего уровня аминокислот кислот в моче:
- положительная динамика на фоне лечения заболевания.
- гиперфункция коры надпочечников;
- лихорадка;
- болезнь Хартнупа;
- хорея Хантингтона;
- неадекватное питании, голодание;
- синдром мальабсорбции при тяжелых заболеваниях желудочно-кишечного тракта;
- гиповитаминоз;
- нефротический синдром;
- ревматоидный артрит.
Добавить
Заменимые и незаменимые аминокислоты и их свойства
Время прочтения 3 минутыАминокислоты образуют белки. Из белков в теле человека формируются мышцы, связки, сухожилия, органы, железы, волосы, ногти. Белки – составляющие жидкостей и костей. Гормоны и ферменты регулирующие процессы в организме – также белки.
Всего существует 150 аминокислот, нашему организму нужно только 20 из них. Это связано с тем, что белок бывает разный. Есть белки, которые не несут ценности для организма, а ценность белка определяется только количеством важных для него аминокислот. Их них 11 аминокислот мы синтезируем сами. Их называют заменимыми. Остальные 9 аминокислот мы получаем из пищи. Их назвали незаменимыми.
Аминокислоты химияОни участвуют в строительстве соединительных тканей, мышц, тканей внутренних органов. Они повышают работоспособность мышц, снижают их утомление и восстанавливают. Способствуют насыщению организма кислородом.
Аминокислоты нужны и для поддержания иммунитета, внутренней секреции, выработки гормонов. Это также пища для ума. Они помогают понимать, запоминать, усваивать информацию, усиливают умственную, творческую деятельности.
Аминокислоты свойстваЭти компоненты перерабатываются в желудке. Потом кровотоком разносятся по всему организму. Вступая в биохимические процессы, они составляют белки, которые играют различные биологические роли в организме – формируют мышечные ткани, способствуют сжиганию подкожного жира, вырабатывают ферменты, гормоны, поддерживают иммунитет, отвечают за возбудимость нервной системы, интеллект, память, помогают витаминам и минералам выполняют свои функции и так далее.
Кому нужны аминокислоты. Спойлер: всемТо есть белок ценен не сам по себе, а ценны – аминокислоты, его составляющие.
Без аминокислот человек не сможет жить. Они нужны всем. Особое внимание на употребление аминокислот нужно обратить тем, кто:
- стремится придерживаться сбалансированного питания;
- ведёт активный образ жизни, увлекается спортом;
- хочет похудеть;
- имеет повышенные физические и умственные нагрузки;
- восстанавливается после болезни или лечится.
Аминокислоты лизин и треонин помогают вырабатывать белки: коллаген и эластин. Они отвечают за прочность и упругость соединительных тканей, включая кожу. Таким образом, аминокислоты в косметических средствах сохраняют нашу молодость.
Аминокислоты нужны, когда есть проблемы с волосами. Они препятствует выпадению волос, восстанавливают и укрепляют волосяные фолликулы.
Рекомендуемая суточная норма незаменимых аминокислот для взрослого человека Всемирной Организации Здравоохранения (мг на 1 кг веса):
- гистидин – 10 мг;
- изолейцин – 20 мг;
- лейцин – 39 мг;
- лизин – 30 мг;
- метионин – 15 мг;
- фенилаланин – 25 мг;
- триптофан – 4 мг;
- валин – 26 мг.
Суточная норма аминокислот для тех, у кого систематические физические нагрузки – 2-4 чайных ложки порошка, так как при систематической физической нагрузке, организм нуждается в повышенном количестве аминокислот. Получить такую дозу можно, употребляя аминокислоты.
Превышать суточную норму незаменимых аминокислот вредно. Их избыток, как и дефицит может привести к нарушению работы организма.
Заменимые аминокислоты наш организм вырабатывает самостоятельно благодаря процессам метаболизма. Когда и сколько вырабатывать заменимых аминокислот организм определяет сам – на основе своего состояния.
Чем опасен дефицит аминокислотПри недостатке аминокислот организм вынужден «добывать» их из собственных запасов. Для спортсменов, цель которых – набор мышечной массы, это весьма критично.
При отсутствии хотя бы одной незаменимой аминокислоты процесс образования белков приостанавливается. Поэтому могут возникнуть: мышечная слабость, нарушение функций нервной системы, пищеварения, сна, ухудшение иммунитета, повышение уровня сахара в крови, депрессия и иные признаки патологии обмена веществ и энергии.
При травмах, стрессах, возрастных изменениях, инфекциях – сбалансированного питания недостаточно. Необходим дополнительный прием аминокислот.
Аминокислоты в продуктахВо продуктах питания, чаще всего белковых, содержится около 20 аминокислот, 10 из которых – незаменимые.
Они есть не только в продуктах питания. Они входят в состав спортивных препаратов, биодобавок, медпрепаратов. Для спортсменов аминокислоты выпускают в форме: таблеток, капсул, порошка, растворов и даже внутривенных инъекций.
Частота и время приема аминокислот для спортсменов зависит от цели. Например, для набора мышечной массы их принимают перед и после тренировок, по утрам. Это время, в которое требуется быстрое усвоение аминокислот. В других случаях нужно придерживаться инструкции.
Для организма роль аминокислот поистине велика, так как они формируют человеческий организм. Не важно спортсмен вы или много лежите на диване – аминокислоты нужны всем.
9 незаменимых аминокислот: что это такое и зачем они нам нужны?
Мы все слышали об аминокислотах, но что они собой представляют и почему они необходимы для нашего питания?
Аминокислоты — строительные блоки белка. Это органические соединения, содержащие аминогруппу (-Nh3) и карбоксигруппу (-COOH). Поскольку около двадцати процентов человеческого тела состоит из белков, аминокислоты составляют значительную часть наших клеток, мышц и тканей.
Аминокислоты являются неотъемлемой частью биологических процессов, происходящих в нашем организме, таких как придание клеткам их структуры, транспортировка и хранение питательных веществ, а также формирование наших органов, желез, артерий и мышц.Они также необходимы для заживления ран и восстановления тканей, особенно мышц, кожи, костей и волос.
Всего существует 23 протеиногенных (строящих белок) аминокислоты и более 100 природных аминокислот, которые не являются протеиногенными. Из протеиногенных аминокислот 9 незаменимы, 11 несущественных и 3 из которых не встречаются в организме человека.
Незаменимые аминокислоты не производятся организмом естественным путем, поэтому они должны поступать из продуктов, которые мы едим.Девять основных аминокислот: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Каждая из этих аминокислот обладает уникальными свойствами и играет важную роль в наших рабочих органах.
Незаменимые аминокислоты производятся в организме человека, поэтому они не являются необходимыми для нашего питания. Есть также три аминокислоты (селеноцистеин, пирролизин и N-формилметионин), которые не встречаются у людей, но представляют собой нестандартные аминокислоты, строящие белок, обнаруженные в растениях и других организмах.
Аминокислоты с разветвленной цепью (BCAA) относятся к трем незаменимым аминокислотам: лейцину, изолейцину и валину. Это аминокислоты, которые имеют алифатические боковые цепи с разветвленной атомной структурой. Аминокислоты с разветвленной цепью составляют 35% незаменимых аминокислот в наших мышцах.
Так как же получить нужные аминокислоты и что именно они делают? Вот краткое описание каждой из этих мощных маленьких молекул.
9 незаменимых аминокислот
ЛЕЙЦИН
Лейцин помогает стимулировать мышечную силу и рост, а также помогает сохранить мышечную массу при соблюдении диеты.Лейцин — основная аминокислота, непосредственно ответственная за активацию незаменимого соединения в мышцах, называемого mTOR (мишень рапамицина у млекопитающих), которое непосредственно отвечает за активацию синтеза белка. Лейцин является основным строительным материалом для мышц и помогает синтезировать больше. Лейцин также помогает регулировать уровень сахара в крови, снижая уровень инсулина в организме во время и после упражнений, и оказывает положительное влияние на наш мозг и нейротрансмиттеры.
Источники лейцина: сыр, соевые бобы, говядина, свинина, курица, тыква, семена, орехи, горох, тунец, морепродукты, бобы, сывороточный белок, растительные белки и т. Д.
ISOLEUCINE
Изолейцин — это изолированная форма лейцина, которая помогает организму вырабатывать гемоглобин. Гемоглобин переносит железо в кровь и регулирует уровень сахара в крови, который сжигается для получения энергии в мышцах во время упражнений. Изолят сывороточного протеина от природы богат изолейцином.
Изолейцин также способствует росту азота в мышечных клетках, который составляет значительную часть нашей структуры и ДНК.
Источники изолейцина: соя, мясо и рыба, молочные продукты и яйца, кешью, миндаль, овес, чечевица, фасоль, коричневый рис, бобовые, семена чиа.
ЛИЗИН
Лизин — одна из основных аминокислот, которая отвечает за восстановление и рост мышц, а также повышает иммунную систему организма. Лизин также помогает усвоению других минералов в организме и необходим для синтеза коллагена, который является основным элементом, необходимым для образования соединительной ткани и костей в организме.
Источники лизина: яиц, мясо, птица, фасоль, горох, сыр, семена чиа, спирулина, петрушка, авокадо, миндаль, кешью, сывороточный протеин.
МЕТИОНИН
Метионин важен для роста новых кровеносных сосудов и роста мышц, и он содержит серу, которая является неотъемлемой частью здоровья тканей и мышц. Без достаточного количества серы в организме люди могут быть подвержены артриту, повреждению тканей и иметь проблемы с заживлением. Метионин также способствует росту мышц и образованию креатина, который необходим для получения энергии. Метионин также может растворять жир в организме и уменьшать жировые отложения в печени.
Источники метионина: мясо, рыба, сыр, молочные продукты, бобы, семена, семена чиа, бразильские орехи, овес, пшеница, инжир, цельнозерновой рис, фасоль, бобовые, лук и какао.
ФЕНИЛАЛАНИН
Фенилаланин превращается в организме в аминокислоту тирозин, которая необходима для выработки белков и химических веществ мозга, таких как адреналин, L-допа, норэпинефрин и гормоны щитовидной железы. Таким образом, фенилаланин оказывает большое влияние на наше настроение и психическое здоровье.
Источники фенилаланина: молоко и молочные продукты, мясо, рыба, курица, яйца, спирулина, водоросли, тыква, фасоль, рис, авокадо, миндаль, арахис, киноа, инжир, изюм, листовая зелень, большинство ягод, оливки и семена.
ТРЕОНИН
Треонин поддерживает функцию здоровья иммунной системы, печени, сердца и центральной нервной системы. Он также необходим для создания глицина и серина, аминокислот, необходимых для производства эластина, коллагена и мышечной ткани. Он необходим для здоровой работы мышц и помогает сохранять их сильными и эластичными. Треонин также помогает укрепить кости и может помочь ускорить заживление ран и повреждений тканей.
Источники треонина: нежирное мясо, сыр, орехи, семена, чечевица, кресс-салат и спирулина, тыква, листовая зелень, семена конопли, семена чиа, соевые бобы, миндаль, авокадо, инжир, изюм и киноа.
ТРИПТОФАН
Когда триптофан поглощается организмом, он в конечном итоге превращается в серотонин — химическое вещество, которое делает нас счастливыми, является нейромедиатором и помогает снизить уровень стресса и депрессии. Триптофан также известен тем, что оказывает расслабляющее действие на организм и способствует здоровому режиму сна, а также поддерживает функции мозга и нервной системы.
Источники триптофана: шоколад, молоко, сыр, индейка, красное мясо, йогурт, яйца, рыба, птица, нут, миндаль, семечки подсолнечника, пепитас, спирулина, бананы и арахис.
ВАЛИН
Валин необходим для оптимального роста и восстановления мышц. Он помогает снабжать мышцы дополнительной глюкозой, отвечающей за выработку энергии во время физической активности, что делает ее необходимой для выносливости и общего здоровья мышц. Он также помогает улучшить работу нервной системы и когнитивных функций, а также излечивает метаболические заболевания и заболевания печени.
Источники валина включают: сыр, красное мясо, курицу, свинину, орехи, бобы, шпинат, бобовые, брокколи, семена, семена чиа, цельнозерновые, инжир, авокадо, яблоки, чернику, клюкву, апельсины и абрикосы.
ГИСТИДИН
Гистидин поддерживает здоровье мозга и поддерживает нейротрансмиттеры (в частности, нейротрансмиттер гистамин). Это также помогает детоксикации организма, производя красные и белые кровяные тельца, которые необходимы для общего здоровья и иммунитета. Гистидин может даже помочь защитить ткани от повреждений, вызванных радиацией или тяжелыми металлами.
Источники гистидина: красное мясо, сыр, белое мясо и птица, морепродукты, соя, фасоль, бобовые, семена чиа, гречка, картофель.
Лучший источник аминокислот?
На рынке есть много добавок, которые были произведены химическим способом. Это включает синтезированные аминокислоты, известные как BCAA. Это можно сделать с помощью химического синтеза или экстракции из источников белка. Синтезированные аминокислоты различаются по действию, в зависимости от способа, которым они были созданы с помощью генной инженерии. Мы рекомендуем получать аминокислоты из натурального источника белка, а не из синтезированного заменителя.
Сывороточный протеин — один из немногих источников, которые естественным образом содержат все 20 аминокислот, что делает его полноценным протеином.
Смеси изолятов сывороточного протеинаBare Blends имеют превосходный аминокислотный профиль и особенно неденатурированы. Они обеспечивают наш организм наиболее функциональным белком для восстановления, восстановления и наращивания мышц, а также повышают наш иммунитет.
Существуют также безмолочные протеиновые порошки, которые являются отличной альтернативой сывороточному протеину для тех, кто придерживается растительной диеты. Фактор удобства наших смесей веганского протеина или смесей сывороточного протеина очень важен — так как после тренировки важно сразу же подпитывать наш организм аминокислотами, чтобы они могли немедленно начать восстановление наших мышц.
Эти смеси также очень удобны для быстрого приготовления насыщенных питательными веществами смузи на завтрак, когда у вас нет времени ни на что другое. Смешивание порции нашего WPI с молочным / ореховым молоком или жидкостью по вашему выбору с некоторыми замороженными фруктами — это вкусный здоровый завтрак, который поддержит вас и содержит белок и аминокислоты, необходимые вашему организму для восстановления и оптимальной работы.
Ознакомьтесь с нашим руководством по протеину для женщин, чтобы узнать больше о том, как правильно выбрать протеиновый порошок.
Источники:
Незаменимые аминокислоты в первую очередь отвечают за аминокислотную стимуляцию анаболизма мышечного белка у здоровых пожилых людей.Основные аминокислоты и восстановление мышечного белка после упражнений с отягощениями
Аминокислоты с разветвленной цепью
метионин
непротеиногенные аминокислоты
лейцин
Аминокислоты и белки в образовании гемоглобина. 2. Изолейцин
Что такое лизин?
Треонин
9 незаменимых аминокислот | Источники пищи для их поиска
Аминокислоты известны как строительные блоки белков.В то время как организму для роста и правильного функционирования требуется 20 различных аминокислот, есть 9 незаменимых аминокислот, которые ваше тело не может производить без еды.
Каждая из 9 незаменимых аминокислот имеет уникальные функции. Некоторые незаменимые аминокислоты важны для развития мышц, а другие помогают регулировать настроение. Таким образом, даже если мы не все фанатики фитнеса, которые хотят накапливать аминокислоты для наращивания мышечной массы, каждый может получить пользу от здорового питания с правильными незаменимыми аминокислотами.Вот 9 незаменимых аминокислот, какую роль они играют и где их найти в пище. Приготовьтесь к серьезной научной терминологии:
1. Фенилаланин
Без достаточного количества фенилаланина ваше тело может испытать когнитивную дисфункцию, депрессию и потерю аппетита. 1 Его роль в организме включает:
- Фенилаланин помогает создавать другие аминокислоты, такие как тирозин. Тирозин используется для выработки нейромедиаторов, таких как дофамин (химическое вещество счастья).
- Фенилаланин также помогает формировать другие важные химические вещества в мозге, которые регулируют уровень адреналина (реакцию вашего тела на борьбу или бегство).
- Фенилаланин является предшественником гормонов щитовидной железы, регулирующих метаболизм.
Пищевые источники фенилаланина
- Источники животного происхождения включают говядину, баранину, свинину, птицу, сыр, яйца и йогурт. На каждые 100 г говядины вы получите около 154% рекомендуемой диеты. 2
- Варианты на растительной основе включают тофу, семена тыквы, арахис, зародыши пшеницы, киноа, дикий рис, а также некоторые семена и орехи.В среднем, на каждые 100 г твердого тофу приходится около 95% рекомендуемой нормы потребления фенилаланина
2. Треонин
Треонин играет ключевую роль в поддержании здоровья кожи и зубов. Поскольку треонин в основном содержится в центральной нервной системе, исследования показали, что он может быть полезен при лечении различных типов депрессии. 4 Вот как он взаимодействует в организме:
- Попадая в организм, треонин превращается в химическое вещество под названием глицин.Глицин помогает производить эластин, коллаген и мышечную ткань.
- В сочетании с метионином (другая аминокислота) глицин помогает перерабатывать жирные кислоты и помогает предотвратить печеночную недостаточность. 3
Источники питания треонина
- Источники треонина животного происхождения включают постную говядину, баранину, свинину, коллаген, желатин, сыр. На каждые 100 г нежирной говядины или баранины приходится около 165% рекомендуемой диеты. 5
- Источники на растительной основе включают тофу, семена подсолнечника, семена льна, зародыши пшеницы, кешью, миндаль, чечевицу и фисташки.Самым богатым источником треонина на растительной основе являются соевые продукты: 100 г жареных соевых бобов также дают вам около 165% рекомендуемого рациона треонина. 5
3. Триптофан
Потребление достаточного количества триптофана потенциально может помочь в регулировании тяги к еде. 6 Его роль в организме включает:
- Триптофан имеет решающее значение для производства серотонина. Серотонин помогает регулировать аппетит, сон, настроение и боль, а также действует как естественное седативное средство.
- Также известно, что он является предшественником мелатонина, гормона, который помогает регулировать наш сон. Как многие из нас знают, хороший сон имеет решающее значение для иммунного ответа вашего организма и работы нервной системы.
Пищевые источники триптофана
- Источники животного происхождения включают темный шоколад, молоко, сыр, индейку, красное мясо, йогурт, яйца и рыбу.
- Источники на растительной основе включают нут, пепитас, спирулину, бананы и арахис. Однако семена и орехи (особенно семена тыквы и кабачков) также содержат большое количество триптофана.На каждые 100 г семян вы получите примерно 206% рекомендуемого диетического потребления триптофана. На 100 г сыра (моцарелла с пониженным содержанием жира) вы должны составлять около 204% от рекомендуемой диеты. 7
4. Метионин
Метионин способствует метаболизму и детоксикации. Его роль в организме включает:
- Сера, содержащаяся в метионине, действует как антиоксидант для организма, защищая клетки от повреждения свободными радикалами. Он также помогает удалить из организма другие тяжелые металлы, такие как свинец и ртуть.Без достаточного количества серы в организме люди могут быть более восприимчивыми к артриту, повреждению тканей и иметь проблемы с заживлением. 8
- Метионин также помогает расщеплять жир и предотвращает жировые отложения в печени. Однако слишком много этой аминокислоты может привести к атеросклерозу или отложению жира в артериях. 9
Пищевые источники метионина
- Источники животного происхождения включают тунец, лосось, креветки, говядину и баранину. На каждые 100 г тунца приходится 122% рекомендуемой суточной нормы метионина.
- Источники растительного происхождения включают бразильские орехи, соевые бобы, тофу, бобы, чечевицу, зародыши пшеницы и спирулину. Около 100 г бразильских орехов обеспечат вам 154% рекомендуемой суточной нормы. 10
5. Лизин
Лизин отвечает за восстановление и рост мышц. Как он функционирует в организме:
- Вырабатывая различные гормоны, ферменты и антитела, лизин помогает построить здоровую иммунную систему.
- Он также играет решающую роль в производстве коллагена.Коллаген — самый распространенный белок в организме, который придает структуру связкам, сухожилиям, коже, волосам, хрящам и органам.
- Лизин также помогает организму усваивать кальций, железо и цинк. Это важные минералы для здоровья иммунной системы. 11
Источники питания лизина
- Красное мясо обеспечивает наибольшее количество лизина. На каждые 100 г говядины следует рассчитывать 157% рекомендуемой суточной нормы лизина.
- Источники на растительной основе включают фасоль лима, авокадо, курагу и манго, свеклу, лук-порей, картофель и перец. 12
6. Гистидин
Гистидин способствует росту, образованию клеток крови и восстановлению тканей. Как он функционирует в организме:
- В конечном итоге организм превращает гистидин в гистамин. Гистамин — это нейромедиатор, который жизненно важен для иммунного ответа, пищеварения, половой функции и циклов сна и бодрствования. 13
- Он также поддерживает миелиновую оболочку.
Источники пищи гистидина
- Основные источники гистидина включают яблоки, гранаты, люцерну, свеклу, морковь, сельдерей, огурцы, чеснок, редис и шпинат.100 г сушеных бананов обеспечивают около 48% рекомендуемой суточной нормы гистидина. 14
Интересный факт: Следующие три незаменимые аминокислоты известны как аминокислоты с разветвленной цепью (BCAA). Они составляют большую часть общего пула аминокислот организма (около 35-40%). BCAA не только помогают наращивать мышечный белок и производить энергию, но и помогают снизить усталость. 15
7. Валин
Валин, один из трех BCAA, часто используется в форме добавок с другими BCAA для наращивания мышечной массы у спортсменов.Его роль в организме:
- Стимулирует рост и регенерацию мышц и участвует в производстве энергии.
- Исследования показали, что валин также может помочь стимулировать активность, сохраняя при этом умственную и физическую выносливость. Это потому, что он помогает поддерживать центральную нервную систему, сохраняя ее спокойствие. 16
Источники питания валина
- Валин наиболее широко содержится в красном мясе, молочных продуктах, соевых продуктах, грибах и арахисе.На 100 г обезжиренного йогурта (в зависимости от марки) вы получите около 26% рекомендуемой суточной нормы. Даже чашка молока даст вам около 60% рекомендуемой суточной нормы валина. 17
8. Лейцин
Лейцин имеет решающее значение для синтеза белка и восстановления мышц. Утверждалось, что это самая важная аминокислота для наращивания мышечной массы, поскольку она помогает активировать сигнальный путь, который отвечает за стимуляцию синтеза белка. Как он функционирует в организме:
- Помогает регулировать уровень сахара в крови, стимулирует заживление ран и гормоны роста.
- Лейцин также способствует заживлению мышц после травм или сильного стресса. 18
Источники пищи лейцина
- Вы можете найти лейцин в животных источниках, таких как сыр, говядина, баранина, птица, желатин и коллаген. На каждые 100 г курицы вы получаете около 75% рекомендуемой суточной нормы лейцина.
- Источники на растительной основе включают киноа, семена подсолнечника, фисташки, арахис, кукурузу, зародыши пшеницы и коричневый рис.Спирулина — фантастический источник лейцина, составляющий около 181% от рекомендуемой дневной нормы потребления на 100 г. 19
Подробнее о том, как производится спирулина, можно узнать здесь.
9. Изолейцин
Было обнаружено, что изолейцин также способствует образованию тромбов. 20 Как он функционирует в организме:
- Изолейцин в значительной степени сконцентрирован в мышечной ткани и играет жизненно важную роль в метаболизме мышц, иммунной функции, производстве гемоглобина и регуляции энергии.
Источники пищи изолейцина
- Источники животного происхождения включают говядину, тунец, треску, пикшу и йогурт. 21
- Источники на растительной основе включают овес, чечевицу, спирулину, семена подсолнечника и кунжута, а также морские водоросли. На 100 г пшеницы вы получаете около 16% рекомендуемой суточной нормы изолейцина.
Ежедневные рекомендации по аминокислотам
Оценить суточную потребность в аминокислотах сложно, однако Всемирная организация здравоохранения составила список рекомендуемого суточного потребления этих незаменимых аминокислот. 22 Соблюдая здоровую диету, богатую овощами, фруктами и белком, вы сможете достичь рекомендуемого суточного количества незаменимых аминокислот.
| Аминокислота | Ежедневные рекомендации (мг / кг массы тела) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Гистидин | 10 мг | ||||||||||||||||||||
| Изолейцин | 20 мг | ||||||||||||||||||||
| Лейцин | 30 мг | ||||||||||||||||||||
| Метионин | 10.4 мг | ||||||||||||||||||||
| Фенилаланин | 25 мг | ||||||||||||||||||||
| Треонин | 15 мг | ||||||||||||||||||||
| Триптофан | 4 мг | ||||||||||||||||||||
| Валин | аминокислоты — добавки или еда? Дайте нам знать в комментариях ниже! Незаменимые аминокислотыАминокислоты — это мономерные соединения, которые образуют белки. Незаменимые аминокислоты не могут вырабатываться организмом, поэтому должны поступать из нашего рациона. Синтез незаменимых аминокислотНезаменимые аминокислоты не синтезируются в организме человека, но синтезируются растениями или бактериями. Девять незаменимых аминокислот — это гистидин (His), изолейцин (Ile), лейцин (Leu), метионин (Met), фенилаланин (Phe), треонин (Thr), триптофан (Trp) и валин (Val). Phe и Trp — ароматические аминокислоты. Синтез этих двух аминокислот начинается с превращения фосфоенолпирувата и эритрозо-4-фосфата в хоризмат посредством шикиматного пути. Хоризмат впоследствии превращается в Phe посредством пути биосинтеза ароматических аминокислот. Для синтеза Trp хоризмат превращается в антранилат антранилатсинтазой. Под действием 4 ферментов антранилат превращается в Trp. Синтез His происходит в растениях. Рибозо-5-фосфат превращается в гистидинол под действием 9 ферментов. Затем гистидинол превращается в L-гистидин, который катализируется гистидинолдегидрогеназой. Thr, Met и Ile синтезируются через семейный путь аспартата (Asp). Asp превращается в аспартилфосфат, а затем в полуальдегид аспартил. Аспартил-полуальдегид впоследствии превращается в О-фосфогомосерин. О-фосфогомосерин превращается в Thr с помощью Thr-синтазы, он также превращается в Met под действием 3 ферментов, включая Met-синтазу. И Met, и Thr могут быть превращены в 2-оксобутаноат с помощью Met γ-синтазы и Thr дегидрогеназы соответственно.Затем 2-оксобутаноат превращается в Иль под действием 4 ферментов. Ile также может быть синтезирован из Thr другим путем под действием 5 ферментов. Leu и Val синтезируются из пирувата в растениях. Пируват превращается в 3-метил-2-метилбутаноат под действием 3 ферментов. 3-Метил-2-метилбутаноат может быть превращен в Val с помощью аминотрансферазы с разветвленной цепью (BCAT), а также может быть преобразован в Leu под действием 3 ферментов, включая BCAT. Основные незаменимые аминокислоты с обозначенными радикалами, химические структурные формулы. Кредит изображения: Chromatos / Shutterstock Метаболизм основных аминокислотНезаменимые аминокислоты участвуют во многих путях и процессах, которые имеют решающее значение для гомеостаза организма. Met необходим для синтеза цистеина (Cys). Конденсация АТФ и Met катализируется Met аденозилтрансферазой (MAT), которая создает S-аденозилметионин (SAM).Затем SAM может быть преобразован в Cys под действием 3 ферментов. SAM также используется ДНК-метилтрансферазами при метилировании остатков цитидина, обнаруженных в динуклеотидах CpG в ДНК, которые регулируют экспрессию генов. Phe синтезируется в Tyr, который катализируется фенилаланингидроксилазой. Phe также может быть включен в полипептидные цепи. Thr катаболизируется в митохондриях у млекопитающих, что катализируется треониндегидрогеназой (TDH), продуцирующей α-амино-β-кетобутират.Α-амино-β-кетобутират может быть превращен в ацетил-КоА и глицин под действием α-амино-β-кетобутират-кофермента А лигазы, или он может разлагаться в аминоацетон, который будет преобразован в пируват. Leu, Ile и Val — все аминокислоты с разветвленной цепью (BCAA). Катаболизм этих аминокислот является самым высоким в скелетных мышцах, но также наблюдается в большинстве клеток организма. Катаболизм BCAA также производит NADH и FADh3, которые используются для выработки АТФ. Это причина высокой скорости катаболизма BCAA в скелетных мышцах. Первые несколько шагов катаболизма BCAA включают трансаминирование с использованием аминотрансферазы с разветвленной цепью (BCAT) с 2-оксоглутаратом в качестве аминоакцептора. Используя реакцию BCAT, три BCCA превращаются в три различных α-кетокислоты, которые окисляются с использованием комплекса дегидрогеназы α-кетокислот с разветвленной цепью (BCKD). Это дает три различных производных КоА, каждое из которых может быть преобразовано в более полезные соединения. Активность BCKD ингибируется фосфорилированием и активируется дефосфорилированием.Во время этого пути Ile в конечном итоге становится ацетил-CoA и пропионил-CoA, Leu в конечном итоге становится ацетил-CoA и ацетоацетатом, а Val в конечном итоге становится пропионил-CoA. В заключение, незаменимые аминокислоты очень важны для многих метаболических процессов в организме. Они необходимы для производства других заменимых аминокислот, а также участвуют в таких процессах, как регуляция генов и генерация АТФ. Совершенно очевидно, что синтез и метаболизм незаменимых аминокислот очень сложны, поэтому дополнительные исследования в этой области дадут лучшее понимание этих процессов. Почему восемь незаменимых аминокислот считаются незаменимыми? | Здоровое питаниеАльберто Дж. Медина Обновлено 17 декабря 2018 г. Аминокислоты — это органические соединения, состоящие из центрального углерода, уникальной боковой цепи, по крайней мере одной аминогруппы и по крайней мере одной группы карбоновой кислоты. Организм человека использует аминокислоты для производства белков, выполнения важных метаболических функций при образовании других молекул и для производства энергии. Некоторые аминокислоты синтезируются человеческим организмом, но незаменимые аминокислоты должны быть получены с пищей. Заменимые аминокислотыЗаменимые с пищей или незаменимые аминокислоты могут вырабатываться организмом человека различными путями биосинтеза. Здоровые люди с нормальным синтезом аминокислот производят следующие аминокислоты: аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутамин, глицин, серин, глутаминовую кислоту, пролин и тирозин. Условные аминокислотыПроизводство заменимых аминокислот может быть нарушено нарушением функции органа.Это происходит при преждевременных родах, нарушении функции печени и недостаточном производстве ферментов. Заменимые аминокислоты, которые могут стать незаменимыми, называются условными аминокислотами. Аргинин, цистеин, глутамин, пролин и тирозин — условные аминокислоты. Хотя условные аминокислоты незаменимы, их необходимо получать из пищи. Незаменимые аминокислотыНезаменимые или незаменимые с пищей аминокислоты не могут вырабатываться организмом человека и должны поступать с пищей.Эти аминокислоты не являются обязательными, так как отсутствие достаточной биодоступности имеет неблагоприятные последствия для здоровья. В 1930-х годах была установлена важность восьми аминокислот. Восемь исходных незаменимых аминокислот — это изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Источниками питания аминокислот являются продукты, богатые белком. Когда эти продукты перевариваются и усваиваются, пептидные связи, которые связывают аминокислотные цепи с образованием белков, разрушаются. Девять незаменимых аминокислотКогда аминокислоты были впервые классифицированы по эссенциальности, только восемь из 22 стандартных аминокислот считались незаменимыми для взрослых людей.Некоторое время считалось, что гистидин незаменим только в младенчестве, что делало его условной аминокислотой. Позже гистидин был переклассифицирован как незаменимая аминокислота, когда было обнаружено, что он незаменим на протяжении всей жизни человека. Chem4Kids.com: Биохимия: двадцать аминокислотДля существования человека необходимы двадцать аминокислот. Взрослым нужно девять незаменимых аминокислот, которые они не могут синтезировать и должны получать с пищей.Остальные одиннадцать могут быть произведены в наших телах. В дополнение к двадцати аминокислотам, которые мы вам показываем, есть другие, которые встречаются в природе (и некоторые в очень небольших количествах у нас). Эти двадцать являются самыми важными для нашего вида и определены как стандартных аминокислот.
Аминокислоты в астероидах? (Наука @ НАСА Видео) Chem4Kids Разделы Сеть сайтов по науке и математике Рейдера Что такое аминокислоты и какие необходимы?Некоторые спортсмены (особенно бодибилдеры и другие спортсмены, занимающиеся силовыми тренировками) уделяют пристальное внимание потреблению аминокислот.Некоторые даже принимают добавки, чтобы увеличить потребление и получить правильный баланс аминокислот, особенно аминокислот с разветвленной цепью. Полезно знать факты об этих важных пептидах и понимать, что они могут и чего не могут делать в вашем организме, чтобы сбалансировать потребление питательных веществ и достичь ваших целей в области здоровья и фитнеса. Что такое аминокислоты?Аминокислоты чаще всего называют строительными блоками белка.Белок — важный макроэлемент, который мы потребляем с такими продуктами, как мясо и птица. Но белки внутри тела выполняют несколько ключевых функций. Белки обеспечивают основные структурные компоненты наших мышц, мозга, нервной системы, крови, кожи и волос. Белок также необходим для кислотно-щелочного и жидкостного баланса в организме и помогает транспортировать кислород, жиры и важные витамины и минералы. Аминокислоты — строительные блоки белков. Белки, в свою очередь, необходимы для многих структур и функций нашего тела. Роль аминокислот в организмеНашему организму требуется 20 различных аминокислот. Вместе эти аминокислоты секвенируются и складываются, чтобы объединяться практически бесконечным количеством способов. Длинные цепи аминокислот связаны пептидными связями. Способ, которым связаны узы, называется их первичной структурой и определяет ее функцию в организме. Пептидные связи также имеют вторичную, третичную и четвертичную структуру. Конечная четвертичная структура — это белок. Аминокислоты составляют ферменты, которые облегчают бесчисленные химические реакции в нашем организме. Они переносят питательные вещества и другие необходимые молекулы через нашу кровь и через клеточные мембраны и передают сигналы от одной части тела к другой. Кроме того, антитела, которые защищают нас от болезней, являются белками. В конце концов, задач белков слишком много, чтобы их сосчитать! Незаменимые аминокислотыИз 20 аминокислот, которые нам нужны, наш организм может производить 11 из них.Остальные девять мы должны пройти через нашу диету. Они называются незаменимыми аминокислотами, потому что мы должны их есть. незаменимых аминокислот включают гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Незаменимые аминокислоты включают аланин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин, глицин, пролин, серин и тирозин. Эти аминокислоты производятся организмом. Также существует ситуация, в которой аминокислота или другие питательные вещества могут быть «условно незаменимыми» — аминокислоты, которые становятся незаменимыми, потому что организму возникают проблемы с их выработкой из-за расстройства, болезни или старения. Например, цистеин иногда считается условно незаменимой аминокислотой в особых группах населения, включая младенцев, пожилых людей и людей с определенными заболеваниями. Аминокислоты с разветвленной цепьюЕсть некоторые аминокислоты, которые называются «аминокислоты с разветвленной цепью» или BCAA.Возможно, вы слышали, что спортсмены и бодибилдеры ссылаются на добавки BCAA или продукты, содержащие аминокислоты с разветвленной цепью. BCAA — это незаменимые аминокислоты, которые имеют разветвленную R-цепь, по существу, боковую цепь. Эти аминокислоты метаболизируются в мышцах и, как считается, оказывают наибольшее влияние на развитие мышц. Аминокислоты с разветвленной цепью включают лейцин, валин и изолейцин. Польза аминокислот для здоровьяНаучные исследования изучали преимущества аминокислот, особенно аминокислот с разветвленной цепью, в организме.Большинство этих исследований сосредоточено на добавлении BCAA и на том, необходимо ли оно для оптимальной спортивной функции или производительности. Развитие мышцНаиболее широко рекламируемое преимущество аминокислот с разветвленной цепью — улучшение мышечного развития. Во многих отчетах, в том числе в одном исследовании, опубликованном в 2018 году изданием Frontiers in Physiology, было обнаружено, что добавка BCAA дает преимущества. Их выводы совпадали с результатами других исследований и показали, что когда люди, выполняющие упражнения, употребляют напиток, содержащий BCAA, сразу после тренировки с отягощениями, они улучшают мышечную функцию. Однако другие отчеты об исследованиях ставят под сомнение степень преимущества, ссылаясь на влияние массовой индустрии пищевых добавок на научные исследования. Кроме того, исследователи расходятся во мнениях относительно того, могут ли BCAA приносить какую-либо пользу в периоды ограничения калорийности. Хотя добавки BCAA широко распространены как эффективный метод достижения оптимального роста мышц, важно помнить, что простая покупка и употребление добавок не заставит ваши мышцы набрать силу и размер.Необходимо соблюдать комплексный план тренировок и питания. Включение аминокислот с разветвленной цепью в комплексную программу силовых тренировок и питания может помочь улучшить стимуляцию синтеза мышечного белка и ускорить развитие мышц. Восстановление мышцТакже широко распространено мнение, что аминокислоты с разветвленной цепью улучшают восстановление мышц после занятий спортом или интенсивных упражнений. Отсроченная болезненность мышц (DOMS) — это состояние, с которым многие тяжело тренирующиеся испытывают в течение 24-48 часов после напряженной тренировки.DOMS может снижать производительность, особенно когда это серьезно. Опубликованные исследования показали, что добавление BCAA может быть полезной стратегией для ускорения восстановления мышц и уменьшения DOMS после напряженных силовых тренировок. Дополнительные исследования показали, что добавка BCAA может помочь спортсменам, работающим на выносливость, уменьшить повреждение мышц. Наконец, обзор исследования, опубликованный в 2017 году на сайте Nutrition , показал, что использование BCAA лучше, чем пассивное восстановление или отдых после различных форм изнурительных и разрушительных упражнений. Однако важно помнить о преимуществах BCAA. Всесторонний обзор, опубликованный в 2017 году изданием Nutrients , пришел к выводу, что, хотя известно, что BCAA полезны для развития мышц, их способность уменьшать повреждение мышц, вызванное тренировками с отягощениями, эффективна только при определенных условиях. Эти условия включали высокое потребление BCAA, прием добавок в течение 10 или более дней и повреждение мышц, которое было описано как слабое или умеренное. Исследования показали, что добавка BCAA может помочь уменьшить повреждение мышц, вызванное силовыми тренировками или тренировками на выносливость. Иммунная функция и лечение заболеванийИсследователи изучили роль аминокислот с разветвленной цепью на иммунную функцию и лечение заболеваний. Например, в исследовании, опубликованном в 2018 году в издании Nutrition and Metabolism , рассматривается роль BCAA в нарушениях мышечной атрофии. Исследователи пришли к выводу, что они могут иметь терапевтический эффект при хронической почечной недостаточности. Но необходимы новые стратегии и дальнейшие исследования, чтобы понять роль этих аминокислот в случаях цирроза печени, нарушений цикла мочевины, ожогов, травм, сепсиса и рака. Источники аминокислот для хорошего питанияХотя основная часть исследований незаменимых аминокислот, особенно аминокислот с разветвленной цепью, сосредоточена на добавках, многие эксперты по питанию скажут вам, что лучший способ употребления BCAA — это ежедневный рацион. Когда вы потребляете пищу с аминокислотами, вы не только получаете пользу от других питательных веществ, которые она содержит, но и получаете уверенность в том, что точно знаете, что вы потребляете. Несколько отчетов об исследованиях выявили, что индустрия пищевых добавок не всегда предоставляет продукты, содержащие ингредиенты, которые, по их утверждениям, включают. Рекомендуемые уровниКоличество каждой из аминокислот разное. Например, согласно стандартам Всемирной организации здравоохранения, человеку, который весит 154 фунта (70 кг), необходимо 280 мг триптофана в день, но 2100 мг лизина и 2730 мг лейцина. Хотя маловероятно, что вы сможете контролировать (и различать) потребление определенных аминокислот, вы можете убедиться, что потребляете достаточно общего белка, и выбрать разумные источники белка. Согласно рекомендациям Национальной академии медицины, взрослые должны потреблять минимум 0,8 грамма белка на каждый килограмм веса тела в день. Это означает, что вы должны потреблять около семи граммов на каждые 20 фунтов веса тела. Хотите верьте, хотите нет, но большинство из нас потребляет достаточно белка. Источники питания аминокислотНесмотря на то, что большинство из нас потребляет достаточно белка , мы не можем выбирать источники, которые обеспечивают все незаменимые аминокислоты. Пища, содержащая все незаменимые кислоты в количествах, пропорциональных нашим потребностям, называется полноценными белками. В целом продукты животного происхождения, такие как мясо, птица, яйца, морепродукты и молочные продукты, являются хорошими источниками полноценного белка. Семена сои, киноа и чиа являются растительными источниками полноценного белка. Люди, придерживающиеся вегетарианской диеты, могут полагаться на полноценные белки растительного происхождения, но также могут успешно удовлетворить свои потребности, если комбинируют дополнительные неполноценные белки. Если вы специально хотите увеличить потребление аминокислот с разветвленной цепью, хорошие источники включают молоко (особенно сыворотку в молоке), соевый белок, нут, бобы лима, мясные продукты, чечевицу, коричневый рис и орехи (миндаль, Бразилия). орехи и кешью). Слово VerywellАминокислоты играют важную роль в организме, особенно когда речь идет о развитии мышц. Незаменимые аминокислоты особенно важны, потому что мы должны потреблять их в нашем рационе.Аминокислоты с разветвленной цепью представляют особый интерес для спортсменов из-за их предполагаемого влияния на рост и восстановление мышц. Однако нет необходимости покупать или использовать добавки, чтобы получить необходимые аминокислоты. Может возникнуть соблазн купить добавку BCAA в надежде получить желаемую мускулатуру или спортивные результаты. Помните, что для того, чтобы ваше тело работало на оптимальном уровне, необходим комплексный план, включающий правильные тренировки и восстановление, а также хорошее питание. Обзор физиологических и метаболических эффектов незаменимых аминокислотAdams M, Forsyth C, Jessup W, Robinson J, Celermajer D (1995) Пероральный L-аргинин подавляет агрегацию тромбоцитов, но не усиливает эндотелий-зависимую дилатацию у здоровых молодых людей. люди. J Am Coll Cardiol 26: 1054–1061 Google Scholar Armstrong P, Rae PW, Gray WM, Spence AA (1991) Закись азота и форминоглутаминовая кислота: экскреция у хирургических пациентов и анестезиологов.Br J Anaesth 66: 163–169 Google Scholar Ayala A, Gordillo E, Castano A, Lobato M (1991) Участие уменьшения глутатиона, вызванного дефицитом метионина в рационе, в повышении уровня яблочного фермента в печени крыс. Biochem Biophys Acta 1084: 48–52 Google Scholar Badawy AA, Morgan CJ, Lovett JW, Bradley DM, Thomas R (1995) Снижение доступности триптофана в мозгу после острого употребления этанола нормальными добровольцами: последствия для агрессивного поведения и депрессии, вызванного алкоголем.Фармакопсихиатрия 28 [Дополнение]: 93–97 Google Scholar Balfour J, Clissold S (1990) Бендазак лизин: обзор его фармакологических свойств и терапевтического потенциала в лечении катаракты. Наркотики 39: 575–596 Google Scholar Barberi I, Macchia A, Spata N, Scaricabarozzi I, Nava M (1993) Двойная слепая оценка нумесулида по сравнению с лизин-аспирином при лечении острых инфекций дыхательных путей у детей.Лекарства 46 [Дополнение 1]: 219–221 Google Scholar Bartz-Bazzanella P, Genth E, Pollmann H, Schroder J, Volker A (1992) Синдром эозинофиллиамиалгии с фасциитом и интерстициальным миозитом после введения L-триптофана. Ревматол 51: 3–13 Google Scholar Берн Р.М., Леви М.Н. (1993) Физиология, 3-е изд. Mosby Publishing, Сент-Луис, стр. 688–694 Google Scholar Берри Х., Бруннер Р., Хант М., Уайт П. (1990) Валин, изолейцин и лейцин: новое лечение фенилкетонурии.Ам Дж. Дис Чайлд 144: 539–543 Google Scholar Bertuglia S, Colantuoni A, Intaglietta M (1995) Капиллярная реперфузия после обработки L-аргинином, LNMMA и L-NNA в микроциркуляторном русле защечного мешка. Microvasc Res 50: 162–174 Google Scholar Бхагаван Н.В. (1992) Медицинская биохимия. Jones and Bartlett Publishing, Boston, стр. 18–34, 364, 375, 782–783 Google Scholar Blazer S, Reinersman G, Askanazi J, Furst P, Datz D, Fleischman A (1994) Аминокислоты с разветвленной цепью и респираторный паттерн у новорожденных.J Perinatology 14: 290–295 Google Scholar Bode-Boger S, Boger R, Alfke H, Heinzel D, Tsikas, Creutzig A, Alexander K, Frolich J (1996) L-аргинин вызывает зависимую от оксида азота вазодилатацию у пациентов с критической ишемией конечностей. Тираж 93: 85–90 Google Scholar Boers GH (1994) Гипергомоцистеинемия: недавно признанный фактор риска сосудистых заболеваний.Neth J Med 45: 34–41 Google Scholar Болдырев А., Северин С. (1990) Гистидин-содержащие дипептиды, карнозин и ансерин: распределение, свойства и биологическое значение. Adv Enzyme Regul 30: 175–194 Google Scholar Бонон П.К., Розенберг Л.Е. (1980) Метаболический контроль и метаболические заболевания. WB Saunders Co., Филадельфия, стр 74, 588, 610 Google Scholar Breillout F, Antoine E, Poupon M (1990) Зависимость злокачественных опухолей от метионина: возможный подход к терапии.J Natl Cancer Inst 82: 1628–1632 Google Scholar Бриттенден Дж., Хейс С., Еремин О. (1994) L-аргинин и злокачественные заболевания: потенциальная терапевтическая роль? Eur J Surg Oncol 20: 189–192 Google Scholar Брауэр О.Ф. (1992) Гомоцистинурия. Неврология 42: 1254 Google Scholar Cai Q, Takemura G, Ashraf M (1995) Антиоксидантные свойства гистидина и его влияние на повреждение миокарда во время ишемии / реперфузии в изолированных сердцах крыс.J Cardiovasc Pharmacol 25: 147–155 Google Scholar Castagne V, Moennoz D, Finot P, Maire J (1993) Эффекты вызванной диетой гиперреонинемии: уровни аминокислот в центральной нервной системе и периферических тканях. Life Sci 53: 1803–1810 Google Scholar Castagne V, Finot P, Maire J (1994) Эффекты вызванной диетой гиперреонинемии: тканевые и внеклеточные уровни аминокислот в головном мозге.Life Sci 54: 41–48 Google Scholar Castagne V, Maire J, Moennoz D, Gyger M (1995) Влияние треонина на поведенческое развитие крысы. Pharmacol Biochem Behav 52: 281–289 Google Scholar Castillo L, DeRojas-Walker T, Yu Y, Sanchez M, Chapman T, Shannon D, Tannenbaum S, Burke J, Young V (1995) Метаболизм аргинина в организме и синтез оксида азота у новорожденных с постоянной легочной гипертензией.Педиатр Рес 38: 17–24 Google Scholar Cestaro B (1994) Влияние аргинина, S-аденозилметионина и полиаминов на регенерацию нервов. Acta Neurol Scand [Дополнение] 154: 32–41 Google Scholar Chabriat H, Joire J, Danchot J, Grippon P, Bousser M (1994) Комбинированный пероральный прием ацетилсалицилата лизина и метоклопрамида при остром лечении мигрени: многоцентровое двойное слепое плацебо-контролируемое исследование.Цефалгия 14: 297–300 Google Scholar Chang Y, Gao X (1995) L-лизин в барбитуратоподобном противосудорожном средстве и модулятор бензодиазепиновых рецепторов. Neurochem Res 20: 931–937 Google Scholar Civitelli R, Villareal D, Agnusdei D, Nardi P, Avioli L, Gennari C (1992) Диетический метаболизм L-лизина и кальция у людей. Питание 8: 400–405 Google Scholar Дэвис М., Дален Х., Ким Дж., Барбер Л., Свендсен Э., Хаген П. (1995) Контроль ускоренной атеромы венозного трансплантата с помощью предшественника оксида азота, L-аргинина.J Surg Res 59: 35–42 Google Scholar Davis A, Kruggel E, Randall S (1993) Избыточный диетический лизин увеличивает скелетные мышцы и триметиллизин в плазме у крыс. J Nutr 123: 1109–1116 Google Scholar Дэвис Дж. М. (1995) Углеводы, аминокислоты с разветвленной цепью и выносливость: центральная гипотеза усталости. Int J Sport Nutr 5 [Дополнение]: 529–538 Google Scholar Delgado P, Price L, Miller H, Solomon R, Aghajanian G, Heninger G, Charney D (1994) Эффекты истощения триптофана у пациентов с депрессией, не принимающих лекарств.Arch Gen Psychiatry 51: 865–874 Google Scholar Diamond A, Ciaramitaro V, Donner E, Djali S, Robinson M (1994) Модель на животных при раннем лечении PKU. J Neuroscience 14: 3072–3082 Google Scholar ДиЛоренцо М., Басс Дж., Крантис А. (1995) Использование L-аргинина в лечении экспериментального некротического энтероколита. J Pediatr Surg 30: 235–240 Google Scholar Eisensmith RC, Woo SL (1994) Популяционная генетика фенилкетонурии.Acta Paediatr [Дополнение] 407: 19–26 Google Scholar Eynard N, Flachaire E, Lestra C, Broyer M, Zaidan R, Claustrat B, Quincy C (1993) Содержание серотонина в тромбоцитах и общий свободный триптофан в плазме у здоровых добровольцев в течение 24 часов. Clin Chem 39: 2337–2340 Google Scholar Fadel M, Foley P, Kassell N, Lee K (1995) Гистидин ослабляет церебральный вазоспазм на кроличьей модели субарахноидального кровоизлияния.Surg Neurol 43: 52–57 Google Scholar Фарран М., Томас О. (1992) Влияние кормления рационом с дефицитом валина в начальный период на продуктивность и аномалии ног самцов цыплят-бройлеров. Poult Sci 71: 1885–1890 Google Scholar Ferrando A, Williams B, Stuart C, Lane H, Wolfe R (1995) Пероральные аминокислоты с разветвленной цепью уменьшают протеолиз всего тела.J Parenter Enter Nutr 19: 47–54 Google Scholar Фитцпатрик П.Ф. (1991) Исследования стадии ограничения скорости тирозингидроксилазной реакции: альтернативные вещества, эффекты изотопа растворителя и аналоги переходного состояния. Биохимия 30: 6386–6391 Google Scholar Fleisher M (1993) Аналоги антифолатов: механизм действия, аналитическая методология и клиническая эффективность.Ther Drug Monit 15: 521–526 Google Scholar Фрис Дж., Линдгрен Дж., Булл Дж. (1973) Склеродермоподобные поражения и карциноидный синдром. Arch Intern Med 131: 550–553 Google Scholar Фукуда Н., Микада Т., Тодо Т., Сугано М. (1990) Измененный печеночный метаболизм свободных жирных кислот у крыс, получавших диету с несбалансированным треонином. J Nutr Sci Vitaminol 36: 467–474 Google Scholar Furst P (1993) Многообещающее диетическое средство для профилактики и лечения остеопороза.Питание 9: 71–72 Google Scholar Ganong WF (1993) Медицинская физиология, 16-е изд. Appleton and Lange, Norwalk, p 539 Google Scholar Георгадзе А., Формин В., Булгаков С., Феденко В. (1990) Лечение язвенного кровотечения аналогом лейцин-энкефалина галаргином. Хирургия Моск 3: 39–43 Google Scholar Ghigo E, Ceda G, Valcavi R, Goffi S, Zini M, Mucci M, Valenti G, Cocchi D, Muller E, Camanni F (1994) Низкие дозы аргинина, вводимого внутривенно или перорально, способны усиливать рост гормональные реакции на гормоны, высвобождающие гормон роста, у пожилых людей.J Endocrinol Invest 17: 113–117 Google Scholar Giacoia G, Berry G (1993) Синдром, подобный энтеропатическому акродерматиту, вторичный по отношению к дефициту изолейцина во время лечения болезни мочи кленового сиропа. Ам Дж. Дис Чайлд 147: 954–956 Google Scholar Gokbuget N, Hoelzer D (1996) Высокие дозы метотрексата при лечении лимфобластного лейкоза взрослых.Ann Hematol 72: 194–201 Google Scholar Gowenlock AH (1988) Практическая клиническая биохимия, 6-е изд. CRC Press, Boca Raton, pp 395–396 Google Scholar Гриффитс П., Патерсон Л., Харви А. (1995) Нейрофизиологические эффекты последующего воздействия фенилаланина на подростков и молодых людей с ранней леченной фенилкетонурией. J Intellect Disabil Res 39: 365–372 Google Scholar Guldberg P, Levy H, Koch R, Berlin Jr.C, Francois B, Henrikson K, Guttler F (1994) Анализ мутаций в семьях с дискордантными фенотипами дефицита фенилаланингидроксилазы: наследование и выражение гиперфенилаланинемии. J Ingerit Metab Dis 17: 645–651 Google Scholar Guttler F, Guldberg P (1994) Мутации в гене фенилаланингидроксилазы: генетические детерминанты фенотипической изменчивости гиперфенилаланинемии. Acta Paediatr [Дополнение] 407: 49–56 Google Scholar Halberg F (1969) Хронобиология.Энн Рев Физиол 31: 675–725 Google Scholar Hankes L, DeBruin E, Jansen C, Vorster L, Schmaeler M (1977) Метаболизм C (14) меченного L-триптофана, L-кинуренина и гидрокси-L-кинуренина у шахтеров со склеродермией. S Afr Med J 51: 383–390 Google Scholar Hauser S, Doolittle T, Lopez-Bresnahan M, Shahani B, Schoenfeld D, Shih V, Growdon J, Lehrich J (1992) Антиспастический эффект треонина при рассеянном склерозе.Arch Neurol 49: 923–926 Google Scholar Haycock JW (1991) Четыре формы тирозингидроксилазы присутствуют в мозговом веществе надпочечников человека. J Neurochem 56: 2139–2142 Google Scholar Haze JJ (1991) К пониманию причин использования пищевых добавок для лечения хронической боли: режимы серотонина. Кранио 9: 339–343 Google Scholar Hegedus ZL, Nayak U (1994) Гомогентизиновая кислота и структурно родственные соединения в качестве промежуточных продуктов в образовании растворимого в плазме меланина и в тканевой токсичности.Arch Int Physiol Biochim Biophys 102: 175–181 Google Scholar Higashi Y, Oshima T, Ono N, Hiraga H, Yoshimura M, Wantanabe M, Matsuura H, Kambe M, Kajiyama G (1995) Внутривенное введение L-аргинина ингибирует ангиотензин-превращающий фермент у людей. J Clin Endocrinol Metab 80: 2198–2202 Google Scholar Higuchi K, Shimizu Y, Nambu S, Miyabayashi C, Takahara T, Saito S, Hoiki O, Kuwabara Y, Watanabe A (1994) Влияние инфузии аминокислот с разветвленной цепью на нейрофизиологические и психометрические тесты при циррозе печени. пациенты с легкой энцефалопатией.J Gastroenterol Hepatol 9: 366–372 Google Scholar Hill J, Bird H, Fenn G, Lee C, Woodward M, Wright V (1990) Двойное слепое перекрестное исследование для сравнения ацетилсалицилата лизина (аспергетического) с ибупрофеном при лечении ревматоидного артрита. J Clin Pharm Ther 15: 205–211 Google Scholar Hirsch EC (1994) Биохимия болезни Паркинсона с особым упором на дофаминергические системы.Мол нейробиол 1-3: 135–142 Google Scholar Imeri L, DeSimoni MG, Giglio R, Clavenna A, Mancia M (1994) Изменения в серотонинергической системе во время цикла сна-бодрствования: одновременные полиграфические и вольтамперометрические записи в гипоталамусе с использованием систем телеметрии. Неврология 58: 353–358 Google Scholar Ishiwata K, Ido T, Honda C, Kawamura M, Ichihashi M, Mishima Y (1991) 4-бороно-2 [18F] фтор-D, L-фенилаланин как целевое соединение для борной нейтронно-захватной терапии: опухоль возможность визуализации с помощью позитронно-эмиссионной томографии.Int J Rad Appl Instrum B 18: 745–751 Google Scholar Ishiwata K, Ido T, Honda C, Kawamura M, Ichihashi M, Mishima Y (1992) 4-бороно-2 [18F] фтор-D, L-фенилаланин: возможный индикатор для диагностики меланомы с помощью ПЭТ. Int J Rad Appl Instrum B 19: 311–318 Google Scholar Jimenz F, Ortiz Layba C, Morales Mendez S (1991) Проспективное исследование эффективности аминокислот с разветвленной цепью у пациентов с сепсисом.J Pareneral Enteral Nutr 15: 252–261 Google Scholar Jorens P, Vermeire P, Herman A (1993) L-аргинин-зависимая синтаза оксида азота: новый метаболический путь в легких и дыхательных путях. Eur Respir J 6: 258–266 Google Scholar Juszko J, Kubalska J, Kanigowska K (1994) Глазные проблемы у детей с гомоцистинурией. Klin Oczna (польский) 96: 212–215 Google Scholar Kawabe M, Takesada Y, Tamano S, Hagiwara A, Ito N, Shirai T (1996) Исследование субхронической токсичности L-изолейцина у крыс F344.J Toxicol Environ Health 47: 499–508 Google Scholar Kelly E, Morris Jr S, Billiar T (1995) Оксид азота, сепсис и метаболизм аргинина. J Parenter Enteral Nutr 19: 235–238 Google Scholar Kennedy B, Elayan H, Ziegler MG (1990) Синтез адреналина в легких. Am J Physiol 258: L227-L231 Google Scholar Ketteler M, Border W, Noble N (1994) Цитокины и L-аргинин при повреждении и восстановлении почек.Am J Physiol 267: F197-F207 Google Scholar Ko F, Nyhan W, Wolff, Barshop B, Sweetman L (1991) 3-гидроксимасляная ацидурия: врожденная ошибка метаболизма валина. Педиатр Res 30: 322–326 Google Scholar Коблин Д.Д., Томерсон Б.В., Вальдман Ф.М., Лампе Г.Х., Вок Л.З., Эгер Э.И. (190) Влияние закиси азота на метаболизм фолиевой кислоты и витамина B12 у пациентов. Anesth Analg 71: 610–617 Google Scholar Koffman B, Wallman Y, Bogomolny N, Chernichowsky T, Finkelstein A, Peer G, Scherez J, Blum M, Laniado S, Iaina A (1995) Улучшение сердечной деятельности при внутривенной инфузии L-аргинина у пациентов с умеренная застойная сердечная недостаточность.J Am Coll Cardiol 26: 1251–1256 Google Scholar Laight DW, Woodward B, Waterfall JF (1995) Расширение почек до гистамина in vitro: роль оксида азота, продуктов циклооксигеназы и рецепторов h3. Inflamm Res 44: 116–120 Google Scholar Lamhonwah AM, Troxel CE, Schuster S, Gravel RA (1990) Две различные мутации в одном и том же сайте гена PCCB при пропионовой ацидемии.Геномика 8: 249–254 Google Scholar Lau E, Li Z (1995) Защита мышей от тератоген-индуцированной волчьей пасти с помощью экзогенного метионина. Proc Soc Exp Biol Med 209: 141–145 Google Scholar Laurant P, Demolombe B (1995) Диетический L-аргинин снижает кровяное давление у крыс с гипертонической болезнью минералокортикоидов. Clin Exp Hypertens 17: 1009–1024 Google Scholar Ли А., Паттерсон В. (1993) Двойное слепое исследование L-треонина у пациентов со спастичностью позвоночника.Acta Neuro Scand 88: 334–338 Google Scholar Lefebvre RA (1995) Оксид азота в периферической нервной системе. Ann Med 27: 370–388 Google Scholar Леуцци В., Тразимени Дж., Гуальди Дж., Антоноцци I (1995) Биохимические, клинические и нейрорадиологические (МРТ) корреляции у пациентов с поздним выявлением фенилкетонурии. J Inherit Metab Dis 18: 624–634 Google Scholar Lewis DA, Melchitzky DS, Haycock JW (1993) Четыре изоформы тирозингидроксилазы экспрессируются в головном мозге человека.Неврология 54: 477–492 Google Scholar Li H, Han H, He J (1995) Гистидин уменьшил отек мозга и сердечную дисфункцию во время местной тромботической церебральной ишемии у крыс. Чунг Куо Яо Ли Цзюэн Пао 16: 156–159 Google Scholar Loguercio C, Nardi G, Argenzio F, Aurilio C, Petrone E, Grella A, DelVecchio Blanco C, Coltorti M (1994) Влияние введения S-аденозил-L-метионина на уровни цистеина и глутатионина в эритроцитах алкогольные пациенты с заболеваниями печени и без них.Алкоголь-Алкоголь 29: 567–604 Google Scholar Lou HC (1994) Предшественники дофамина и функция мозга при дефиците фенилаланингидроксилазы. Acta Paediatr [Suppl] 407: 86–88 Google Scholar Louard R, Barrett E, Gelfand R (1995) Ночная инфузия аминокислот с разветвленной цепью вызывает стойкое подавление протеолиза мышц. Метаболизм 44: 424–429 Google Scholar Love J, Rader J, Crofford L, Raybourne R, Principato M, Page S, Trucksess M, Smith M, Dugan E, Turner M, Zelazowski E, Zelazowski P, Stenberg E (1993) Патологические и иммунологические эффекты проглатывание L-триптофана и 11′-этилиденбиса (L-триптофана) крысам линии Льюис.J Clin Invest 91: 804–811 Google Scholar Lucca A, Lucini V, Catalano M, Smeraldi E (1995) Доступность нейтральных аминокислот при двух основных психических расстройствах. Prog Neuropsychopharmacol Biol Psychiatry 19: 615–626 Google Scholar Луи Т., Кей М., Дарлингтон Г., Ву С. (1992) Восстановление ферментативной активности в гепатоцитах мышей с дефицитом фенилаланингидроксилазы.Somat Cell Mol Genet 18: 89–96 Google Scholar MacAllister R, Calver A, Collier J, Edwards C, Herreros B, Nussey S, Vallance P (1995) Сосудистые и гормональные реакции на аргинин: обеспечение субстратов для оксида азота или неспецифических эффектов? Clin Sci 89: 183–190 Google Scholar Мамер О., Реймер М. (1992) О механизме образования стереоизомеров L-аллоизолейцина и 2-гидрокси-3-метилвалериановой кислоты из L-изолейцина у пациентов с болезнью мочи кленового сиропа и у нормальных людей.J Biol Chem 267: 22141–22147 Google Scholar Маннер Т., Виссе С., Кац Д.П., Скей Б., Асканази Дж. (1992) Аминокислоты с разветвленной цепью и дыхание. Питание 8: 311–315 Google Scholar Marchesini G, Bugianesi E, Bianchi G, Fabbri A, Marchi E, Zoli M, Pisi E (1992) Дефектный метаболизм метионина при циррозе: связь с тяжестью заболевания печени.Гепатология 16: 149–155 Google Scholar Мартин Д.В., Мэйс П.А., Родвелл В.М. (1983) Обзор биохимии Харпера. Lange Medical Publications, Los Altos, стр. 14–30, 153–60, 262, 265, 270, 273, 283, 449, 596 Google Scholar МакЛарни М., Пеллетт П., Янг В. (1996) Структура потребностей в аминокислотах у людей — межвидовое сравнение с использованием опубликованных рекомендаций по потребностям в аминокислотах.J Nutr 126: 1871–1882 Google Scholar Милнер Дж. Д., Вуртман Р. Дж. (1986) Синтез катехоламинов: физиологическое взаимодействие с поставкой предшественников. Biochem Pharmacol 35: 875–881 Google Scholar Mitnaui LJ, Shiman R (1995) Координированная регуляция обмена тетрагидробиоптерина и активности фенилаланингидроксилазы в клетках печени крыс. Proc Natl Acad Sci USA 92: 885–889 Google Scholar Mizock B, Sabelli H, Dubin A, Javaid J, Poulos A, Rackow E (1990) Септическая энцефалопатия: доказательства изменения метаболизма фенилаланина и сравнение с печеночной энцефалопатией.Arch Intern Med 150: 443–449 Google Scholar Mogos T, Cheta C, Mincu I (1994) Клинические последствия нарушений промежуточного метаболизма аминокислот с разветвленной цепью (валин, лейцин и изолейцин). Rom J Intern Med 32: 57–61 Google Scholar Moller S, Bech P, Bjerrum H, Bojholm S, Butler B, Folker H, Gram L, Larsen J, Lauritzen L, Loudrup D (1990) Триптофан / нейтральные аминокислоты Plsma в отношении клинической реакции на пароксетин и кломипрамин у пациентов с большой депрессией.J Affect Disord 18: 59–66 Google Scholar Mousseau D (1993) Метаболит триптофана, участвующий в различных психоневрологических расстройствах. Metab Brain Dis 8: 1–44 Google Scholar Накаки Т., Като Р. (1994) Благотворное влияние L-аргинина на кровообращение. Jpn J Pharmacol 66: 167–171 Google Scholar Ньюсхолм Е.А., Пиявка А.Р. (1983) Биохимия для медицинских наук.John Wiley and Sons, Нью-Йорк, стр. 541, 15–16, 382–441, 391, 392, 403, 784, 558 Google Scholar Newsholme EA, Blomstrand E (1996) Уровень некоторых аминокислот в плазме и физическая и умственная усталость. Experientia 52: 413–415 Google Scholar Нишихира Т., Такаги Т., Мори С. (1993) Лейцин и проявление противоопухолевой активности за счет дефицита валина аминокислотного дисбаланса.Питание 9: 146–152 Google Scholar Окахара К., Мураками Т., Ямамото С., Ята Н. (1995) Микродиализ кожи: обнаружение высвобождения гистамина in vivo при кожных аллергических реакциях. Skin Pharmacol 8: 113–118 Google Scholar Ортен JM, Neuhaus JM (1975) Биохимия человека, 9-е изд. CV Mosby Co., Сент-Луис, стр 220, 305–307, 311, 326–327, 336–338, 678–679, 923–926 Google Scholar Ouzou S, Deflandre A, Giacomoni PU (1994) Протонирование имидазольного кольца предотвращает модуляцию гистидином окислительной деградации ДНК.Mutat Res 316: 9–16 Google Scholar Палмер Р. (1993) Путь L-аргинин: оксид азота. Curr Opin Nephrol Hypertens 2: 122–128 Google Scholar Pascale R, Simile M, Seddaiu M, Daino L, Vinci M, Pinna G, Bennati S, Gaspa L, Feo F (1993) Химиопрофилактика канцерогенеза печени крыс с помощью S-аденозил-L-метионина: метилирование ДНК вовлеченный? Basic Life Sci 61: 219–237 Google Scholar Pascale R, Simile M, DeMiglio M, Nufris A, Daino L, Seddaiu M, Rao P, Rajalakshmi S, Sarma D, Feo F (1995) Началась химиопрофилактика канцерогенеза печени крыс с помощью S-аденозил-L-метионина 1,2-диметилгидразином и промотируется оротовой кислотой.Кардиогенез 16: 427–430 Google Scholar Pattichis J, Louca LL (1995) Гистамин, антагонисты h3-рецепторов гистамина, секреция желудочного сока и язвы: обзор. Наркотики Метаболизм Наркотиков Взаимодействие 12: 1–36 Google Scholar Pietz J, Kreis R, Boesch C, Penzien J, Rating D, Herschkowitz N (1995) Динамика концентраций фенилаланина в мозге и ее клиническое значение.Педиатр Рес 38: 657–663 Google Scholar Plauth M, Egberts E, Hamster W, Torok M, Muller P, Brand O, Furst P, Dolle W (1993) Долгосрочное лечение протосистемной энцефалопатии аминокислотами с разветвленной цепью: двойной слепой плацебо-контролируемый кроссоверное исследование. J Hepatol 17: 308–314 Google Scholar Price L, Charney P, Delgado P, Goodman W, Krystal J, Woods S, Heninger G (1990) Клинические исследования функции 5-HT с использованием I.V. L-триптофан. Prog Neuropsychopharmacol Biol Psychiatry 14: 459–472 Google Scholar Priori R, Conti F, Luan F, Arpino C, Valesini G (1994) Своеобразная эволюция синдрома эозинофильной миалгии после лечения L-триптофаном у четырех итальянских подростков. Eur J Pediatr 153: 344–346 Google Scholar Rafique S, Guardascione M, Osman E, Burroughs A, Owen J (1992) Обратное отложение холестерина внепеченочной мембраны у пациентов с хроническим заболеванием печени с помощью S-аденозил-L-метионина.Clin Sci Colch 83: 353–356 Google Scholar Reinartz G, Angremaier A, Buchfelder M, Fahlbusch R, Georgieff M (1995) Предоперационные и послеоперационные исследования пеподукции глюкозы в печени и оборота лейцина при болезни подушечек с использованием методов стабильных изотопов. Horm Metab Res 27: 425–431 Google Scholar Reyes A, Karl I, Klahr S (1994) Роль аргинина в здоровье и почечной недостаточности.Am J Physiol 267: 17331–17346 Google Scholar Ribalta J, Reyes H, Gonzalez M, Iglesias J, Arrese M, Poniazchik J, Molina C, Segovia N (1991) S-аденозил-метионин в лечении пациенток с внутрипеченочным холестазом беременности: рандомизированный, двойной -слепое плацебо-контролируемое исследование с отрицательными результатами. Гепатология 13: 1084–1089 Google Scholar Roufs J (1991) L-треонин как симптоматическое лечение бокового амиотрофического склероза (БАС).Med Hypotheses 34: 20–23 Google Scholar Рубин Э., Фарбер Дж.Л. (1988) Патология. J.P. Lippincott Co., Филадельфия, стр. 735–737 Google Scholar Russel IJ, Michalek JE, Viproia GA, Fletcher EM, Javors MA, Bowden CA (1992) Плотность рецептора захвата 3h-имипрамина тромбоцитами и уровни серотонина в сыворотке у пациентов с синдромом фибромиалгии / фиброзита. J Rheumatol 19: 104–109 Google Scholar Sac H (1994) Аргинин стимулирует заживление ран и иммунную функцию у пожилых людей.J Parenter Enter Nutr 18: 559–560 Google Scholar Salomon R, Miller H, Delgado P, Charney D (1993) Использование истощения триптофана для оценки центральной функции серотонина при депрессии и других психоневрологических расстройствах. Clin Psychopharmacol 8 [Дополнение]: 41–46 Google Scholar Самойл Д., Грабб Б.П. (1995) Нервно-опосредованные синкопе и ингибиторы обратного захвата серотонина.Clin Anton Res 5: 251–255 Google Scholar Sato H, Zhao Z, McGee D, williams M, Hammon J, Vinten-Hohansen J (1995) Дополнительный L-аргинин во время остановки сердца и реперфузии позволяет избежать регионарной постишемической травмы. J Thorac Cardiovasc Surg 110: 302–314 Google Scholar Schini V, Vanhoutte P (1993) Роль пути L-аргинин-оксид азота в гладких мышцах сосудов.Eur Heat J 14 [Suppl] 1: 16–21 Google Scholar Schwartz PJ, Wehr TA, Rosenthal NE, Bartko JJ, Oren DA, Leutke C, Murphy DL (1995) Серотонин и терморегуляция: физиологические и фармакологические аспекты контроля, выявленные внутривенным введением m-CCP у нормальных людей. Нейропсихофармакология 13: 105–115 Google Scholar Сельвам Р., Куриен Т. (1992) Восстановление антиоксидантов в печени путем кормления метионином при экспериментальной мочекаменной болезни крыс.Индийский журнал J Biochem Biophys 29: 364–370 Google Scholar Серрес Ф, Дасса Д., Азорин Дж. М., Жаннингрос Р. (1995) Снижение содержания триптофана в красных кровяных тельцах у больных шизофренией: возможная связь с потерей контроля над импульсами. Neuropsychopharmacol Biol Psychiatry 19: 903–913 Google Scholar Сейюм Г., Персо Т. (1991) Могут ли метионин и цинк предотвратить эмбриопатические эффекты алкоголя? Med-Hypotheses 31: 153–156 Google Scholar Shibata K (1995) Превращение триптофана в ниацин у крыс, получавших не содержащую никотиновую кислоту диету с ограничением триптофана.Biosci Biochem 59: 715–716 Google Scholar Simile M, Pascale R, DeMiglio M, Nufris A, Daino L, Seddaiu M, Gaspa L, Feo F (1994) Корреляция между содержанием S-аденозил-L-метионина и производством c-myc, cha-ras и транскрипты мРНК c-ki-ras на ранних стадиях канцерогенеза печени крыс. Cancer Lett 79: 9–16 Google Scholar Сингер М., Соломон Т., Гроссман М. (1976) Ответ поджелудочной железы на кишечную перфузию с триптофаном и фенилаланином.Гастроэнтерология 76: 124 Google Scholar Саутхорн Б., Келли Дж., МакБридж Б. (1992) Процедура дозирования фенилаланина эффективна для измерения синтеза белка в кишечнике и печени овец. J Nutr 122: 2398–2407 Google Scholar Совик О. (1993) Дефицит митохондриальной 2-метиацетоацетил-КоА-тиолазы: врожденная ошибка метаболизма изолейцина и кетоновых тел.J Inherit Met Dis 16: 46–54 Google Scholar Sperandeo MP, Panico M, Pepe A, Candito M, de-Franchis R, Kraus JP, Andria G, Sebastio G (1995) Молекулярный анализ пациентов, страдающих гомоцистинурией из-за дефицита цистатион-бета-синтазы: отчет о новая мутация в экзоне 8 и делеция в интроне 11. J Inherit Metab Dis 18: 211–214 Google Scholar Stachow A (1978) Коллаген и заболевания, связанные с его метаболическими нарушениями.Przegl Dermatol 65: 361–370 Google Scholar Stachow A, Jablonska S, Kencka D (1985) Актуальные темы ревматологии. Gower Medical, Нью-Йорк, стр. 130–134 Google Scholar Strasser A, McCarron R, Ishii H, Stanimirovic D, Spatz M (1994) L-аргинин индуцирует высвобождение дофамина из полосатого тела in vivo. Нейроотчет 5: 2298–2300 Google Scholar Swason R, Shiraishi K, Morton M, Sharp F (1990) Сульфоксамид метионина уменьшает размеры кортикального инфаркта у крыс после окклюзии средней мозговой артерии.Ход 21: 322–327 Google Scholar Szende B (1993) Влияние аминокислот и производных аминокислот на пролиферацию клеток. Acta Biomed Ataneo Parmese 64: 139–145 Google Scholar Тандон С., Сингх С., Флора С. (1994) Влияние добавок метионина и цинка во время хелатирования свинца у крыс. J Trace-Elem-Electrolytes Health Dis 8: 75–77 Google Scholar Tessari P, Biolo B, Inchiostro S, Orlando R, Vettore M, Sergi G (1993) Кинетика лейцина и фенилаланина при компенсированном циррозе печени: эффекты инсулина.Гастероэнтерология 104: 1712–1721 Google Scholar Tessari P, Inchiostro S, Barazzoni R, Zanetti M, Orlando R, Orlando G, Biolo G, Sergi G, Pino A, Tiengo A (1994) Постпрандиальная кинетика фенилаланина и лейцина при циррозе печени. Am J Physiol 267: E140-E149 Google Scholar Testa D, Caraceni T, Fetoni V, Girotti F (1992) Хроническое лечение L-треонином при боковом амиотрофическом склерозе: пилотное исследование.Clin Neurol Neurosurg 94: 7–9 Google Scholar Торчинский Ю.М. (1987) Трансаминирование: открытие, биологические и химические аспекты. Trends Biochemi Sci 12: 115–117 Google Scholar Цуда М., Сакияма Т. (1990) Остеопороз при врожденных патологиях. Ниппон Риншо (японский) 28: 2910–2915 Google Scholar Turner S, Wen C, Li M, Whiworth J (1996) L-аргинин предотвращает вызванное кортикотропином повышение артериального давления у крыс.Гипертония 27: 184–189 Google Scholar Useman E, Owen J, Burroughs A (1993) S-аденозил-L-метионин: новое терапевтическое средство при заболеваниях печени. Aliment Pharmacol Ther 7: 21–28 Google Scholar Варга Дж., Хименес С., Уитто Дж. (1993) L-триптофан и синдром эозинофилии-миалгии: современное понимание этиологии и патогенеза. J Invest Dermatol 100: 97S-105S Google Scholar Vasdev S, Whalen M, Ford C, Longerich L, Prabhakaran V, Parai S (1995) Этанол и гипертензия, вызванная треонином у крыс: общий метанизм.Кан Дж Кардио 11: 807–815 Google Scholar Vieira-Makings E, Van der Westhuyzen J, Metz J (1990) Добавки валина и изолейцина задерживают развитие неврологических нарушений у летучих мышей с дефицитом витамина B12. J Vitam Nutr Res 60: 41–46 Google Scholar Вирмани К., Видхальм К. (1993) Гистидинемия: биохимический вариант или заболевание? J Am Coll Nutr 12: 115–124 Google Scholar Visser J, Hoekman K (1994) Добавление аргинина в профилактику и лечение остеопороза.Med Hypothesis 43: 339–342 Google Scholar Воет Д., Воет Дж. (1990) Биохимия. John Wiley and Sons, Нью-Йорк, стр 62, 322, 506–525, 678–725, 734 Google Scholar Ван Т. (1991) Молекулярная генетика фенилкетонурии у восточных народов: неравновесие по сцеплению между терминирующей мутацией и гаплотипом 4 гена фенилаланингидроксилазы. Сюэн Ко Ссун Юань Ссун Пао 13: 1–6 Google Scholar Williamson D, McTavish S, Park S, Cowen P (1995) Влияние валина на 5-HT-опосредованное высвобождение пролактина у здоровых добровольцев и на настроение у пациентов с ремиссивной депрессией.Br J Psychiatry 167: 238–242 Google Scholar Райт Э. (1994) Клиническая эффективность лизина при лечении рецидивирующих афтозных язв и лабиального герпеса. Общая стоматология 42: 40–42 Google Scholar Yanicelli S, Rohr F, Warman ML (1994) Нутриционная поддержка при глутаровой ацидемии типа I. J Am Diet Assoc 94: 183–191 Google Scholar Young S (1991) Использование триптофана в сочетании с другими антидепрессантами: обзор.J Psychiatry Neurosci 16: 241–246 Google Scholar Younv V (1994) Потребности взрослых в аминокислотах: аргументы в пользу серьезного пересмотра текущих рекомендаций. J Nutr 124 [Дополнение] 8: 15175–15235 Google Scholar Юдкофф М., Дайхин Ю., Лин З, Ниссим И., Стерн Дж., Удовольствие Д. (1994) Метаболизм лейцина в астроцитах: значение трансаминирования аминокислот с разветвленной цепью.J Neurochem 62: 1192–1202 Google Scholar Юдкофф М., Дайхин Ю., Грюнштейн Л., Ниссим И., Стерн Дж., Удовольствие Д. (1996) Взаимосвязь лейцина и метаболизма глутамата в культивируемых астроцитах. J Neurochem 66: 378–385 Google Scholar Zeisel SH, Blusztajn JK (1994) Холин и питание человека. Энн Рев Нат 14: 269–296 Google Scholar Зелло BA, Pencharz PB, Ball RO (1990) Поток фенилаланина, окисление и превращение в тирозин у людей изучали с L- [1-13C] фенилаланином.Am J Physiol 259: E835-E843 Google Scholar Zello GA, Wykes LJ, Ball RO, Pancharz P (1995) Последние методы оценки диетических потребностей в аминокислотах для взрослых людей. J Nutr 125: 2907–2915 Google Scholar Zhao G (1991) Унаследованная метаболическая аберрация фенилаланина у членов семьи пациентов с гипертонической болезнью и инсультом. |


