Рыба семга: полезные свойства слабосоленой семги, польза для женщин
Семга или лосось относятся к красному виду рыбного продукта. Рыба семга является любимым лакомством у многих, потому что блюда из лосося не только вкусные, но и полезные. Она употребляется в разном виде: слабосоленая, запечённая, вареная или копченая. Часто кушанья из рыбы присутствуют на застольях или в качестве каждодневного блюда. Семга причисляется к лососёвому виду лучеперых рыб. Ее длина достигает 4,6 метров.
Описание рыбы семги
Вес лосося достигает 40 кг. Атлантический вид обитает в Северном Ледовитом океане. Когда происходит нерест, то рыбу можно встретить в водах Скандинавского полуострова, около Финляндии или Португалии. Озерного лосося встречают в водоемах Белого и Балтийского морей, Онежского и Ладожского озер, а также в водах около Карелии, Швеции или Норвегии. Лосось — это переходная рыба, которая проплывает большие расстояния, перемещаясь из морей в океаны и обратно. Семга подразделяется на 2 вида в зависимости от периода размножения:
- Осеняя или озимая.

- Весенняя или яровая.
Основное место обитания лосося — это море, но на нерест рыба «приходит» в реки, где задерживается на период до двух лет. Семга — удивительный вид рыбы, потому что, проживая в реке, ничем не кормится, а живет за счет накопленных запасов. Семга отличается от другой красной рыбы следующим:
- Мясо светло-розового тона.
- Чешуя крупная, с серебристым отливом.
- Тушка вытянутой формы, которая напоминает торпеду.
- Форма головы вытянутая, немного заострена на конце.
Полезные вещества
Сёмга не только вкусная, но и полезная. У мяса определенная пищевая ценность, при помощи ее можно рассчитать суточную норму потребления. Продукт, приготовленный из мяса семги, обладает следующими показателями калорийности:
- Минералы. Калий 10%, кальций 5%, натрий 28%, железо 15%, фосфор 28%.

- Витамины. РР 52%, В2 12%, В1 11%, Е 18%, А 4%.
- Микронутриенты. Жиры 20%, белки 39%, насыщенные жиры 11%.
Мясо озерной или атлантической семги питательное, вкусное, имеет много полезных элементов. Чтобы сохранить полезные вещества, лосось не жарится, а запекается в фольге. Главная полезная особенность для человеческого организма — это высокое содержание белка. Если в сутки употреблять хотя бы 100 г запечённой рыбы, то можно восполнить половину суточной потребности организма в белке. 100 г мяса содержат 220 ккал.
Польза для организма
Организм человека с легкостью усваивает мясо лосося. Спустя 30 минут после употребления в пищу рыбы в организм всасываются полезные элементы. Благодаря жирной кислоте Омега-3 происходит улучшение кровеносных сосудов, понижается вероятность возникновения тромбозов. Регулируются гормоны, отвечающие за стресс. Человек при употреблении лосося каждодневно быстрее избавляется от последствий стрессовых ситуаций и перенапряжения. А также предупреждается депрессивное состояние, повышается работоспособность, увеличивается умственная деятельность мозга.
А также предупреждается депрессивное состояние, повышается работоспособность, увеличивается умственная деятельность мозга.
Полезные свойства семги заключаются в содержании в мясе специальных жиров, которые помогают в правильном функционировании женского организма. Контролируется уровень холестерина, стенки сосудов становятся более эластичными. Происходит питание клеток. Польза семги для женщин:
- Жирные кислоты, включенные в состав рыбы, помогают избавиться от лишних килограммов, способствуют быстрому похудению. При этом организму не наносится вред.
- Кислоты не откладываются в виде жира. Поэтому мясо можно есть без опаски набрать лишний вес.
- Лосось повышает иммунитет. Поэтому уменьшается опасность разных заболеваний.
- При частом употреблении мяса красной рыбы ногти становятся более крепкие, волосы приобретают блеск. Регенерация кожного покрова происходит быстрее, это способствует заживлению и подсушиванию прыщиков.
В составе мяса содержатся метионины, которые предупреждает возникновение сахарного диабета и заболевания почек. Лосось богат витаминами РР и Д, поэтому часто назначается врачами беременным женщинам. Употребление мяса положительно сказывается на формировании костей будущего ребенка, предупреждается возникновение рахита. Организм, получая необходимые полезные элементы, начинает в больших количествах вырабатывать мелатонин. Это вещество придает человеку защиту от солнечных лучей, способствует быстрому обновлению клеток. Так достигается омолаживающий эффект.
Лосось богат витаминами РР и Д, поэтому часто назначается врачами беременным женщинам. Употребление мяса положительно сказывается на формировании костей будущего ребенка, предупреждается возникновение рахита. Организм, получая необходимые полезные элементы, начинает в больших количествах вырабатывать мелатонин. Это вещество придает человеку защиту от солнечных лучей, способствует быстрому обновлению клеток. Так достигается омолаживающий эффект.
Необходимость сёмги в рационе
Спортсмены обязательно включают в меню лосося, потому что в нем содержится большое количество легкоусвояемых аминокислот. Если у спортсмена перелом или другая травма, то семга быстро восстанавливает мышечные ткани. В состав включен витамин В6, который помогает решить проблему бесплодия у мужчин.
Во время менопаузы врачи рекомендуют употреблять женщинам запечённое мясо семги, чтобы предотвратить заболевание остеопороз. Жирные кислоты и кальций помогают в усвоении кальция. В комплексе лечения часто назначается красная рыба при борьбе с заболеваниями сердечно-сосудистой и нервной системы. А также лосось используется для следующих целей:
Жирные кислоты и кальций помогают в усвоении кальция. В комплексе лечения часто назначается красная рыба при борьбе с заболеваниями сердечно-сосудистой и нервной системы. А также лосось используется для следующих целей:
- Из элементов продукта получают панкреатин и инсулин.
- Икра семги применяется в косметологии в составе масок.
- Лечебные процедуры восстанавливают кожу, дарят молодость и свежесть.
Вред от мяса красной рыбы
Несомненна польза семги для организма. Но иногда продукт может нанести вред. Происходит это в следующих случаях:
- Чтобы мясо приобрело красивый насыщенный красный цвет, некоторые производители кормят рыбу непригодными составами. В рацион включены красящие элементы, которые при приготовлении мяса наносят вред человеческому организму.
- Некоторые ученые полагают, что семга в себе скапливает ртуть. Чем больший размер особи, тем большее количество вредного вещества.
- Ртуть наносит вред потомству рыбы, вызывает нежелательные мутации.

Обычный человек, как правило, не может отличить дикую рыбу от искусственно выращенной. Особи, выращенные в питомниках, содержат большое количество вредных компонентов. Они наносят вред полезному мясу семги. В маленьком водоеме на рыбной ферме выращивается слишком большое число особей, поэтому семга частот болеет. Чтобы избавиться от некоторых заболеваний, сотрудники питомника часто пользуются нейротоксическими пестицидами. Их остаточные вещества скапливаются в лососе. От слабосоленой семги польза и вред следующие:
- Недостатки лосося: может возникнуть личная непереносимость компонентов рыбы, появление аллергической реакции из-за вещества гистидина. Возникновение мочекаменной болезни, аномалии в печени, язва ЖКТ. Не рекомендуется употреблять пациентам с гипертонией.
- Плюсы: в мясе содержится много фосфора и кальция, что положительно влияет на здоровье костей и зубов. Никотиновая кислота и магний хорошо воздействуют в целом на весь организм.
 В состав включен В6, который помогает при возникновении гинекологических заболеваний у женщины.
В состав включен В6, который помогает при возникновении гинекологических заболеваний у женщины.
Правильное хранение
Лосось необходимо правильно хранить, чтобы мясо оставалось долго свежим и не потеряло свои полезные свойства. Лосось причисляется к быстропортящимся продуктам, поэтому придерживаются правильных форм хранения. Распространённые методы:
- Готовый лосось хранится в холодильнике при различных температурах, в зависимости от способа приготовления: копченое мясо при -5С°, слабосоленый продукт при 0 С°.
- Есть много методов приготовить маринад для семги. В маринованном состоянии лосось дольше сохраняет полезные свойства.
- Для хранения семги применяется пищевая бумага вместо полиэтилена.
- Перед замораживанием рыба тщательно очищается, моется, а затем просушивается. Далее продукт заворачивается в бумагу или фольгу. Подготовленное таким образом мясо хранится в морозильной камере при -25 С°.

Применение при диете
В лососе есть жирные кислоты, которые без труда усваиваются организмом. Употребление лосося не способствует отложению ненужного жира. Во время ограниченной диеты организм получает все необходимые вещества для полноценного функционирования.
При похудении человек не испытывает неприятные ощущения, которые связаны с голодом. А также при диете не портятся волосы и ногти. При диетическом питании мясо готовят на пару или отваривают. Это уменьшает калорийность и помогает сохранить полезные свойства продукта.
Рецепты с семгой
Чем полезна семга слабосоленая, известно многим хозяйкам. Чтобы мясо сохранило полезные свойства, его нужно правильно готовить. Есть несколько распространённых рецептов, которые придутся по вкусу многим людям:
- Паста с семгой.
- Лосось в маринаде.
Первый рецепт: понадобятся 250 г мяса лосося, 4 дольки чеснока, 3 столовые ложки масла оливы, 250 г помидоров, немного базилика или петрушки, 250 г спагетти. Специи и соль прибавляются по вкусу. Сначала чеснок продавливается через чеснокодавку, затем обжаривается до золотистого цвета на растительном масле. Помидоры обдаются кипятком. Это необходимо, чтобы без труда снять кожуру. Потом томаты режутся кубиками и тушатся 4 минуты.
Специи и соль прибавляются по вкусу. Сначала чеснок продавливается через чеснокодавку, затем обжаривается до золотистого цвета на растительном масле. Помидоры обдаются кипятком. Это необходимо, чтобы без труда снять кожуру. Потом томаты режутся кубиками и тушатся 4 минуты.
Семга разрезается на небольшие части, добавляется к помидорам на сковороде. Следом добавляется измельченная зелень. Одновременно в кастрюле отвариваются спагетти до готовности. Макаронные изделия выкладываются на тарелку, сверху угадывается мясо лосося.
Второй рецепт: для приготовления понадобятся 250 мл винного уксуса, 500 мл бульона, немного кинзы, 4 зубчика чеснока, 1 небольшая луковица, лавровый лист, черный перец неизмельченный, соль, немного красного перца и 1 кг лосося. Вода доводится до кипения вместе со специями. После закипания смесь варится еще 5 минут. В состав ложится рыба, варится до готовности. Затем прибавляются чеснок и уксус. Мясо лосося ложится в стеклянную посуду и заливается уксусом. Когда семга остынет, ее держат в холоде не менее 7 часов. Блюдо получается ароматным и вкусным.
Когда семга остынет, ее держат в холоде не менее 7 часов. Блюдо получается ароматным и вкусным.
Необычные факты
Самая большая рыба семга весила приблизительно 42 кг, а в длину она была 1,5 метра. Вальтер Скотт кормил своих работников семгой, потому что в то время ее было очень много. Главной героиней лучшего кинофильма Т. Китано была семга. Лосось может определить, где находится его река, за 800 км. У него большая популяция, поэтому этот вид рыбы населил даже северные регионы нашей родины. Местные жители употребляют ее в пищу каждодневно.
Польза Омега-3
Люди, страдающие от астмы, должны каждодневно употреблять лосось, скумбрию или селедку. Эти виды относятся к жирным сортам. Учеными доказано, что если женщина во время вынашивания плода употребляла эти продукты, то будущий ребенок защищен от такого заболевания.
В рыбных продуктах содержатся Омега-3 и магний.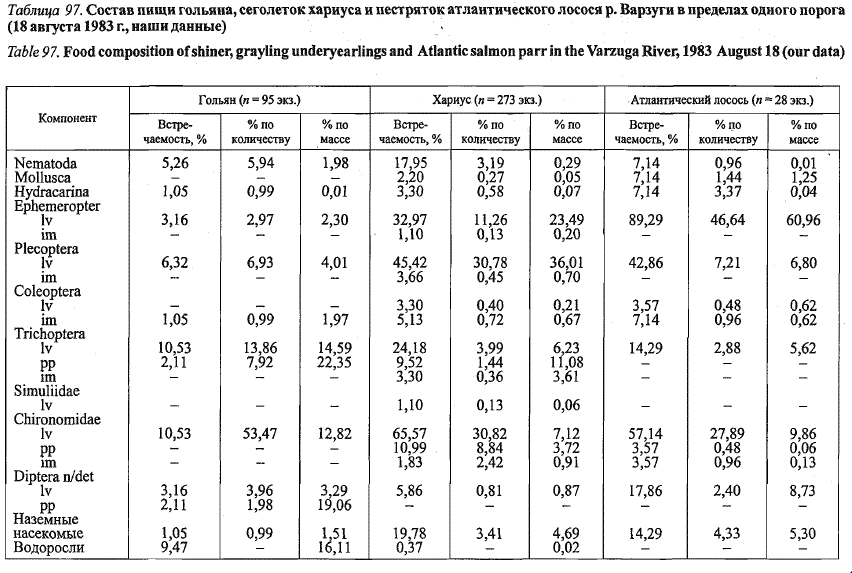 Они защищают организм от различных заболеваний, которые связаны с дыхательными путями. Жирные кислоты предохраняют от более серьезных заболеваний. Если постоянно употреблять лосось, то можно избавиться от плохого настроения, депрессии и повысить тонус организма. В рыбу включены полезные элементы, которые необходимы для нормального функционирования ЦНС. Какое еще положительное воздействие оказывается:
Они защищают организм от различных заболеваний, которые связаны с дыхательными путями. Жирные кислоты предохраняют от более серьезных заболеваний. Если постоянно употреблять лосось, то можно избавиться от плохого настроения, депрессии и повысить тонус организма. В рыбу включены полезные элементы, которые необходимы для нормального функционирования ЦНС. Какое еще положительное воздействие оказывается:
- Улучшается состояние головного мозга.
- Полезные элементы провоцируют кровообращение, поэтому клетки мозга насыщаются кислородом.
Кроме лосося, следует употреблять в пищу и другие морепродукты. Некоторые люди опасаются его есть, считая вредным. Но если потреблять в меру, то никакой опасности рыбный продукт не представляет. Среди покупателей популярно мнение, что полезна только та семга, которая выросла в диких природных условиях. При покупке рыбы следует поинтересоваться у продавца, где была выращена семга: на рыбной ферме или поймана в природном водоеме.
Загрузка…В рацион каждого человека должны быть включены морепродукты.
Они полезны для всего организма. Их можно употреблять без опаски приобрести лишний вес. Морепродукты имеют маленькую калорийность, поэтому рекомендованы тем, кто худеет.
Семга — описание, состав, калорийность и пищевая ценность
Один из самых распространенных представителей лососевых. Семгу еще называют атлантическим лососем или озерным лососем. Рыба может достигать 1,5 метров и веса более 40 кг. Ее выделяет яркая серебристая чешуя, пятнышки выше боковой линии и синеватый отлив в области спины. Продолжительность жизни, в среднем, составляет 9 лет, но может достигать 13 лет.
Семга обитает на севере Атлантического океана, нерестится в реках от Испании и Португалии до Баренцева моря. Существует озерная семга, которая живет в России, Финляндии, Швеции, Норвегии. Во время нереста рыба перестает питаться.
Семгу также выращивают искусственно.
Как готовить
Семга продается в свежем или замороженном виде. Также ее солят, маринуют или коптят. Мясо этой рыбы не требует длительной температурной обработки, оно нежное, с приятным ароматом.
Семгу можно варить, обжаривать, запекать, готовить на гриле, использовать при приготовлении супов, салатов, бутербродов, соусов для пасты, закусок, омлетов.
Как выбирать
Свежая семга не издает слишком сильный запах – он должен быть приятным, еле выраженным. Тушка – упругая и плотная, поверхность боков и брюшка – серебристая, спинка – черная с переливами. Если тушка семги – черная и покрыта цветными пятнами, значит, она выловлена во время нереста и ее мясо будет невкусным.
Соленая рыба в вакуумной упаковке должна быть бледно-розовой, без жидкости в середине упаковки. Слишком яркий цвет говорит о том, что ее мясо может быть окрашено искусственно.
Полезные свойства
Семга предотвращает возникновение сердечно-сосудистых заболеваний, укрепляет иммунитет, нормализует работу желудочно-кишечного тракта, улучшает кровообращение, делает стенки сосудов эластичными, снижает риск возникновения тромбов, улучшает состояние кожи, помогает противостоять стрессам, поддерживает остроту зрения, активизирует деятельность мозга, ослабляет симптомы псориаза, нормализует уровень холестерина в крови, устраняет бессонницу, сглаживает проявления предменструального симптома.
Мясо семги содержит легкоусвояемые белки, которые способствуют росту мышечной ткани. Жирные кислоты омега-3 продлевают молодость, защищают от рака, атеросклероза, ревматоидного артрита.
Ограничения по употреблению
Семгу не стоит есть людям с непереносимостью рыбы и морепродуктов.
Некоторая искусственно выращенная семга может содержать вредные для человека вещества.
Чем отличаются форель, семга, лосось? Что лучше форель или семга?
Покупая красную рыбу, мало кто задумывается над тем, какую именно рыбу он покупает — семгу или форель. Более того, большинство людей даже не задумывается над тем, есть ли между ними разница и какая. Женский журнал о похудении Dietaclub расскажет, что лучше, форель или семга, и какие между ними отличия.
Очень часто можно встретить мнение, что лосось, семга и форель — это разные сорта рыб. На самом деле семга и форель – это лосось. Эти рыбы входят в семейство лососевых, они похожи, но все-таки отличаются друг от друга.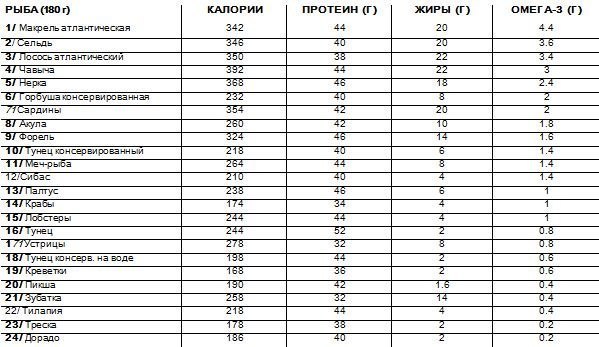 В чем заключаются эти отличия?
В чем заключаются эти отличия?
Семга
Чем отличается форель от семги
Если вы покупаете целую рыбину, то отличить форель от семги не составит большого труда. Во-первых, разница в размере рыбы. Семга всегда больше, весит одна рыбина примерно 6-7 кг, именно при таком весе ее чаще всего забивают. Кстати, семга может достигать 1,5 метров в длину, в отличие от форели. А вот форель намного меньше семги — ее вес около 3-4 кг.
Отличаются эти рыбы и окрасом – семга серебристая, без каких-либо полосок, в то время форель может иметь разные цвета. Спина форели обычно имеет зеленоватый оттенок, а бока серые или белые. Покупая лосось, также обратите внимание и на форму головы – у семги она намного больше и имеет заостренную форму. Отличить семгу от форели поможет и чешуя – у семги она более крупная.
Форель
Отличается форель от семги и по цвету. Но тут следует заметить, что цвет самой форели отличается в зависимости от того, морская это форель или речная. Если мы говорим о морской форели, то цвет мяса будет ярким, почти красным, у речной форели цвет может быть розовым, нежно-розовым и даже почти белым. Цвет семги должен быть нежно-розовым, если перед вами семга красного или ярко-оранжевого цвета, то скорее всего для получения такого цвета использовались красители.
Если мы говорим о морской форели, то цвет мяса будет ярким, почти красным, у речной форели цвет может быть розовым, нежно-розовым и даже почти белым. Цвет семги должен быть нежно-розовым, если перед вами семга красного или ярко-оранжевого цвета, то скорее всего для получения такого цвета использовались красители.
Правды ради следует отметить, что и семга, и форель в замороженном виде могут иметь абсолютно одинаковые цвета, в таком случае сложно будет определить, где какая рыба. Это касается и уже приготовленной рыбы, например соленой. Она может быть не такой яркой, и тут снова же производители могут подкрашивать ее красителями. При покупке уже соленой рыбы обращайте внимание на белые прожилки, если они есть, значит, рыба не крашеная.
Для того чтобы не путаться, лучше всего покупать свежую семгу или форель, и не филе, а тушку.
Семга: калорийность, полезные свойства Семга обязательно должна присутствовать в диетическом рационе. |
Что жирней, семга или форель?
Что лучше, форель или семга? Если говорить о вкусе рыбы, то здесь мнения разделись. Форель считается более изысканной и нежной рыбой. Отчасти это объясняется тем, что форель не такая жирная, как семга.
Форель. Калорийность и химический состав
- Калорийность – около 150 ккал
- Белки – 20,5 г
- Жиры – 4,3 г
- Углеводы – 0
Семга. Калорийность и химический состав
- Калорийность — 220 ккал
- Белки – 20 г
- Жиры – 15 г
- Углеводы – 0
Как мы видим, жирность семги, действительно, отличается от жирности форели. По этой причине во время диеты многие исключают семгу из своего рациона. Однако женский журнал о похудении Диетаклуб не советует прибегать к исключению семги из своего рациона, ведь содержащиеся жиры Омега 3 являются очень полезными.
Чем отличается форель от семги, если рыба уже приготовлена? Если мы говорим о жарке или готовке на пару, то различия сложно выделить. Вместе с этим, для засолки советуют использовать именно семгу, из-за того, что эта рыба жирнее, в результате у соленой семги вкус получается нежнее. Форель соленая более пресная, однако при правильной засолке эта рыба тоже имеет очень хороший вкус.
Во время засолки семги или форели лучше не злоупотреблять различными специями, которые могут изменить вкус рыбы. Обычной соли и черного перца будет достаточно.
При приготовлении семги лучше выбирать простые рецепты, без добавления разных соусов и заправок. Так как семга достаточно жирная сама по себе, то способы ее готовки лучше все-таки выбирать диетические. Идеально будут стейки на гриле, например, или семга на пару, тушеная семга, семга в духовке. А вот с форелью можно включить свое воображение и попробовать различные соусы и заправки. Но не забывайте, что
заправки должны быть диетическими.
Семга и форель отличаются также и ценой. Собственно на этом и играют недобропорядочные производители, выдавая форель за семгу. Обычно, форель стоит дешевле семги, в среднем на 3-5 долларов за килограмм. Это касается как свежей рыбы, так и уже соленой или копченой.
Виктория Высоцкая
Frontiers | Включение кормов и фекальных отходов от аквакультуры лосося в больших морских гребешков (Pecten maximus), питающихся различными концентрациями водорослей
Введение
Производство норвежского лосося, по оценкам, увеличится с 1,2 миллиона тонн до 3 миллионов тонн, в результате чего в 2030 году будет использоваться 3,6 миллиона тонн кормов в год (Olafsen et al., 2012). Значительная часть такого корма выбрасывается в окружающие воды в виде респираторных продуктов, фекалий и несъеденного корма, при этом общие потери оцениваются в 62% C, 57% N и 76% P от общего количества вводимого корма (Wang et al., 2013). Растущее количество питательных веществ и органических веществ, выделяемых норвежской отраслью аквакультуры, вызывает экологические проблемы (Taranger et al. , 2014). Выбросы питательных веществ могут привести к эвтрофикации (Folke et al., 1994), хотя сильно зависят от способности принимающих вод ассимилировать питательные вещества (Wang et al., 2012). Выброс частиц увеличит органическую нагрузку и может изменить химический состав донных отложений и привести к изменениям в бентических сообществах (Carroll et al., 2003).
, 2014). Выбросы питательных веществ могут привести к эвтрофикации (Folke et al., 1994), хотя сильно зависят от способности принимающих вод ассимилировать питательные вещества (Wang et al., 2012). Выброс частиц увеличит органическую нагрузку и может изменить химический состав донных отложений и привести к изменениям в бентических сообществах (Carroll et al., 2003).
Включение видов, способных отфильтровывать отходы питательных веществ в виде твердых частиц, происходящие от рыбоводных хозяйств, в интегрированные системы мультитрофной аквакультуры (IMTA) может смягчить возможные негативные экологические последствия выращивания лосося. В IMTA частицы питательных веществ кормов и фекалий могут потребляться органическими экстрактивными фильтрующими организмами, такими как мидии (Redmond et al., 2010; Handå et al., 2012a, b), в то время как растворенные неорганические питательные вещества могут потребляться неорганическими экстрактивными организмами, такими как морские водоросли (Chopin et al. , 2001; Брох и Слагстад, 2012; Handå et al., 2013). Помимо снижения воздействия на окружающую среду, IMTA может повысить стоимость производства, поскольку при том же кормовом ресурсе можно производить больше биомассы (Buschmann et al., 2001; Chopin et al., 2001; Troell et al., 2009). Было показано, что голубые мидии ( Mytilus edulis ) способны вбирать питательные отходы от аквакультуры лосося (Redmond et al., 2010; Handå et al., 2012a, b). Мидии также показали более высокий рост рядом с рыбоводными хозяйствами (например,г., Уоллес, 1980; Lander et al., 2004; Peharda et al., 2007; Sara et al., 2009), но их эффективность и потенциал для промышленного применения были поставлены под сомнение (Handå et al., 2012b; Cranford et al., 2013). В то время как синие мидии относятся к малоценным видам, гребешки, такие как Pecten maximus , являются привлекательными и высоко ценятся.
, 2001; Брох и Слагстад, 2012; Handå et al., 2013). Помимо снижения воздействия на окружающую среду, IMTA может повысить стоимость производства, поскольку при том же кормовом ресурсе можно производить больше биомассы (Buschmann et al., 2001; Chopin et al., 2001; Troell et al., 2009). Было показано, что голубые мидии ( Mytilus edulis ) способны вбирать питательные отходы от аквакультуры лосося (Redmond et al., 2010; Handå et al., 2012a, b). Мидии также показали более высокий рост рядом с рыбоводными хозяйствами (например,г., Уоллес, 1980; Lander et al., 2004; Peharda et al., 2007; Sara et al., 2009), но их эффективность и потенциал для промышленного применения были поставлены под сомнение (Handå et al., 2012b; Cranford et al., 2013). В то время как синие мидии относятся к малоценным видам, гребешки, такие как Pecten maximus , являются привлекательными и высоко ценятся.
Гребешок ( P. maximus ) — это фильтр-питатель, обитающий на морском дне на глубине 10–30 м (Shumway and Parsons, 2006). Взвешенный обломочный материал и фитопланктон являются его основным источником пищи, и было высказано предположение, что такие гребешки могут использовать пищевые частицы, связанные с поверхностными отложениями (MacDonald et al., 2006). Также было показано, что органический материал из кормов и фекальных отходов, образующихся при аквакультуре лосося, может вносить вклад в рацион пектинидов (Seguel et al., 1998). Более того, мертвый органический материал в виде частиц (детрит), происходящий от деградированных макроводорослей, может быть потенциальным источником пищи при низких концентрациях фитопланктона в окружающей среде (Cranford and Grant, 1990), а P. maximus продемонстрировал свою способность разлагать фукоидан водорослей (Daniel et al. al., 1999), предполагая, что гребешки также могут использовать частицы деградированных тканей морских водорослей в IMTA.Однако эксперименты показали, что гребешки имеют более низкую эффективность удерживания пищевых частиц размером менее 5–7 мкм (MacDonald et al.
Взвешенный обломочный материал и фитопланктон являются его основным источником пищи, и было высказано предположение, что такие гребешки могут использовать пищевые частицы, связанные с поверхностными отложениями (MacDonald et al., 2006). Также было показано, что органический материал из кормов и фекальных отходов, образующихся при аквакультуре лосося, может вносить вклад в рацион пектинидов (Seguel et al., 1998). Более того, мертвый органический материал в виде частиц (детрит), происходящий от деградированных макроводорослей, может быть потенциальным источником пищи при низких концентрациях фитопланктона в окружающей среде (Cranford and Grant, 1990), а P. maximus продемонстрировал свою способность разлагать фукоидан водорослей (Daniel et al. al., 1999), предполагая, что гребешки также могут использовать частицы деградированных тканей морских водорослей в IMTA.Однако эксперименты показали, что гребешки имеют более низкую эффективность удерживания пищевых частиц размером менее 5–7 мкм (MacDonald et al. , 2006). Это может быть проблемой, поскольку было показано, что частицы вблизи фермы лосося имеют размер от 1 до 10 мкм (Lander et al., 2013). Эти более мелкие частицы доступны в толще воды в виде взвешенных частиц и будут разноситься от фермы, в то время как более крупные частицы быстрее опускаются на морское дно (Bannister et al., 2016). Наличие взвешенных частиц в толще воды будет зависеть от глубины, течения, скорости опускания, скорости растворения частиц и режима кормления на ферме (Troell and Norberg, 1998; Lander et al., 2013; Баннистер и др., 2016; Husa et al., 2017).
, 2006). Это может быть проблемой, поскольку было показано, что частицы вблизи фермы лосося имеют размер от 1 до 10 мкм (Lander et al., 2013). Эти более мелкие частицы доступны в толще воды в виде взвешенных частиц и будут разноситься от фермы, в то время как более крупные частицы быстрее опускаются на морское дно (Bannister et al., 2016). Наличие взвешенных частиц в толще воды будет зависеть от глубины, течения, скорости опускания, скорости растворения частиц и режима кормления на ферме (Troell and Norberg, 1998; Lander et al., 2013; Баннистер и др., 2016; Husa et al., 2017).
Профилирование жирных кислот и анализ стабильных изотопов — классические инструменты, используемые для изучения включения частиц пищи в двустворчатых моллюсков. Эти методы используются для изучения трофических отношений и выявления потенциальных источников пищи (Peterson and Fry, 1987; Dalsgaard et al., 2003). Они также использовались для отслеживания частиц отходов, выбрасываемых рыбоводными хозяйствами (Gao et al. , 2006; Handå et al., 2012a; Irisarri et al., 2014, 2015). Стабильные изотопы углерода и азота могут выявить сложные взаимодействия источников пищи и традиционно используются для экологических и биологических исследований населения (Peterson and Fry, 1987).В разных тканях скорость метаболизма разная. Мышцы имеют медленную скорость обновления и могут отражать долгосрочные изменения в диете, тогда как пищеварительные железы и гонады имеют высокую скорость обновления и могут отражать недавнюю диету (Tieszen et al., 1983; Lorrain et al., 2002; Logan et al. , 2006). Анализ тканей с высокой скоростью обновления делает возможным использование стабильных соотношений изотопов в более коротких экспериментах со сдвигом в диете (Paulet et al., 2006).
, 2006; Handå et al., 2012a; Irisarri et al., 2014, 2015). Стабильные изотопы углерода и азота могут выявить сложные взаимодействия источников пищи и традиционно используются для экологических и биологических исследований населения (Peterson and Fry, 1987).В разных тканях скорость метаболизма разная. Мышцы имеют медленную скорость обновления и могут отражать долгосрочные изменения в диете, тогда как пищеварительные железы и гонады имеют высокую скорость обновления и могут отражать недавнюю диету (Tieszen et al., 1983; Lorrain et al., 2002; Logan et al. , 2006). Анализ тканей с высокой скоростью обновления делает возможным использование стабильных соотношений изотопов в более коротких экспериментах со сдвигом в диете (Paulet et al., 2006).
Пищеварительная железа является основным органом переваривания питательных веществ и хранения липидов у P.maximus и другие пектиниды (Giese, 1966). Липид, хранящийся в пищеварительной железе, может принимать две формы: маленькие липидные капли (при хранении в канальцевой области) или форму, аналогичную форме клеток адипоцитов (при хранении в ацинусных областях пищеварительной железы) (Le Pennec et al. , 2001). Предполагается, что эти липиды играют различную роль в морских гребешках, при этом маленькие капельки служат в качестве краткосрочного накопителя энергии для ежедневного метаболизма и соматического роста, а жировоподобный липид — как долгосрочное хранилище липидов, которое, например, можно использовать для созревания гамет (Le Pennec et al., 2001). Затем происходит перенос липидов из пищеварительной железы в женские половые железы для производства яиц (Strohmeier et al., 2000). Было показано, что жирные кислоты липидов в пищеварительной железе отражают пектинидовую диету. Более того, пищеварительная железа имеет быстрый метаболический оборот, что делает ее подходящим органом для анализа при изучении питания, трофических отношений и отслеживания компонентов корма как жирными кислотами, так и стабильными изотопами.
, 2001). Предполагается, что эти липиды играют различную роль в морских гребешках, при этом маленькие капельки служат в качестве краткосрочного накопителя энергии для ежедневного метаболизма и соматического роста, а жировоподобный липид — как долгосрочное хранилище липидов, которое, например, можно использовать для созревания гамет (Le Pennec et al., 2001). Затем происходит перенос липидов из пищеварительной железы в женские половые железы для производства яиц (Strohmeier et al., 2000). Было показано, что жирные кислоты липидов в пищеварительной железе отражают пектинидовую диету. Более того, пищеварительная железа имеет быстрый метаболический оборот, что делает ее подходящим органом для анализа при изучении питания, трофических отношений и отслеживания компонентов корма как жирными кислотами, так и стабильными изотопами.
Основная цель настоящего эксперимента заключалась в изучении способности гребешков поглощать частицы корма и фекалий лосося в среде фитопланктона с «высокими» и «низкими» концентрациями.Это имитировало сценарии IMTA во время весеннего цветения и зимнего периода в умеренных прибрежных водах Северной Европы. Вторичные цели заключались в оценке важности различных компонентов в качестве пищевых ресурсов в средах с «высоким» и «низким» фитопланктоном и в сравнении использования профилей жирных кислот и стабильных изотопов в качестве индикаторов питательных веществ в виде твердых частиц от аквакультуры лосося.
Материалы и методы
Экспериментальный проект
Эксперимент проводился по факторному плану, в котором молоди гребешков (30–35 мм) давали рацион, состоящий из водорослей ( Rhodomonas baltica и Chaetoceros muelleri ) в сочетании с кормом лосося или фекалиями лосося.Водоросли кормили в высокой концентрации (300 мкг C L -1 ) и в низкой концентрации (50 мкг C L -1 ). Контрольной группе давали водоросли в высоких и низких концентрациях, что привело к шести различным обработкам (таблица 1). Высокая и низкая концентрация водорослей были основаны на значениях POC в Handå et al. (2012b) и Etter et al. (2017) из средней Норвегии. Зимние значения POC были типичными: 100 мкг POC L -1 в обоих справочных материалах с низкими значениями Chl a. Значение 50 мкг C L -1 было выбрано как приближение для зимней ситуации.POC варьировалось от 200 до 500 мкг POC L -1 во время весеннего цветения, а 300 мкг CL -1 было выбрано в качестве среднего значения содержания углерода сестона в весеннем цветении (Handå et al., 2012a; Etter et al. , 2017). Корм лосося и фекалии лосося скармливались в относительно низких концентрациях отдельно (30 мкг C L -1 ) и предоставлялись в дополнение к двум различным концентрациям водорослей. Низкая концентрация частиц отходов была выбрана для имитации низкой доступности частиц в поверхностных водах от разведения лосося (Bannister et al., 2016). Небольшая часть отходов (5–10%) меньшего размера будет представлять собой взвешенные частицы в поверхностных водах (Husa et al., 2017) и могут быть доступны для фильтрующих устройств, находящихся рядом с фермой. Хотя выбросы твердых частиц с ферм оказались неоднородными и поступают импульсами (Troell and Norberg, 1998; Brager et al., 2016), в нашем эксперименте мы решили имитировать постоянное низкое поступление частиц отходов.
Таблица 1. Диеты, использованные в эксперименте.
Три лотка по 30 гребешков в каждом были развернуты для каждой процедуры.Эксперимент длился 27 дней и считается достаточно продолжительным, чтобы дать ответы как в жирных кислотах, так и в стабильных изотопах (Paulet et al., 2006; Redmond et al., 2010; Handå et al., 2012b). Фотопериод составлял 12 ч при свете и 12 ч в темноте.
Рацион водорослей состоял из R. baltica (CloneNIVA 5/9) и C. muelleri (CCAP1010 / 3), из которых R. baltica составляли 90% от общего содержания углерода. C. muelleri был выбран из-за его питательной ценности с точки зрения липидов и углеводов для морских гребешков (Parrish et al., 1999; Рейтан, 2011). R. baltica также считается высоко питательным из-за высокого содержания полиненасыщенных жирных кислот (Gagné et al., 2010; Brown and Blackburn, 2013), а также использовался для голубых мидий в лабораторных испытаниях. Handå et al. (2012b). Полунепрерывные культуры R. baltica и C. muelleri культивировали в поликарбонатных пробирках (200 л) и стеклянных колбах (20 л) соответственно, используя автоклавированную морскую воду, обогащенную средой Конви (Walne, 1974), и непрерывная подача CO 2 . C. muelleri также был снабжен силикатом, который диатомовым водорослям необходим для построения своих клеточных стенок из кремнезема, содержащего панцири. Каждый день перед кормлением плотность водорослей измеряли с помощью Beckman Coulter-Counter Multisizer 3, и кормовые суспензии смешивали с 1 мкм фильтрованной морской воды для получения правильной концентрации. Корм для лосося в рационе был Optiline Premium 2500 (Skretting Ltd.), а фекалии лосося были собраны у лосося весом 6 кг (S almo salar ), который был анестезирован бензоаком перед зачисткой на рыбоводной ферме Farmannsøya (Marine Harvest). .Кал лосося сушили вымораживанием и хранили при -18 ° C для сохранения питательных веществ. Сублимационная сушка считается бережным методом консервации. Содержание углерода в рационе анализировали на элементном анализаторе Carlo Erba CHN model 1106. Корм лосося и лиофилизированные фекалии лосося содержали 50% и 30% C dw -1 , соответственно. Каждый день гранулы корма и лиофилизированные фекалии лосося взвешивали (Mettler Toledo XA204), гомогенизировали (Elektrolux ASB 2600) с 1 мкм фильтрованной морской воды и разбавляли для получения нужной концентрации для рациона.Затем рационы помещали в 30-литровые банки с аэрацией для обеспечения равномерного распределения корма.
Морские гребешки предоставлены компанией ScalPro (Берген, Норвегия). После транспортировки и за 14 дней до эксперимента их немедленно помещали в проточные каналы (40 × 20 × 400 см, объем 320 л, скорость обмена 1,6 л мин. -1 ) в помещении с контролируемой температурой (12 ° C). В) для акклиматизации. R. baltica непрерывно добавляли в канал с помощью перистальтических насосов (Watson-Marlow 505U), чтобы поддерживать концентрацию водорослей на уровне 15 мкг C L -1 в канале.Морская вода (соленость 35) откачивалась с глубины 70 м из фьорда Тронхейм. Затем он был профильтрован через песок и обработан ультрафиолетовым светом, который хранится в аэрируемых резервуарах для регулирования температуры. Воду дополнительно фильтровали с помощью двух воздушных фильтров CUNO AquaPure с номинальным удерживанием частиц (> 10 мкм и> 1 мкм соответственно) перед попаданием в экспериментальную установку.
После акклиматизации 30 гребешков с высотой раковины 30–36 мм были помещены в каждый лоток ( n = 3 для каждой обработки) с проточной морской водой.Температуру каждого лотка измеряли каждый день и в среднем составляли 12,6 ± 0,2 ° C. Дизайн лотков был аналогичен описанному Handå et al. (2012b), которые изучали голубых мидий. Некоторые корректировки были сделаны для настоящего эксперимента. Перфорированная пластиковая пластина (отверстия 2 мм) была размещена поперек лотка (40 × 12 × 70 см, объем 30 л), чтобы создать зону смешивания для воды и притока корма, обеспечивая равномерное распределение корма и предотвращая турбулентность в воде. поток (рисунок 1). Скорость водообмена составляла 6 л ч -1 .Наряду с аквариумными насосами (New-Jet 1) этот обменный курс создавал поток воды вдоль лотка. Аквариумные насосы перекачивали воду из дистального конца в зону смешивания со скоростью 3 л мин. -1 , что означает, что воду меняли шесть раз в час. Регулировка уровня воды достигалась путем размещения вертикальной сливной трубы (12 см) на дальнем конце. Пища добавлялась непрерывно со скоростью 1,5 мл суспендированной пищи в минуту с помощью перистальтических насосов (Watson-Marlow 505U) в зону смешивания.
Рисунок 1. Обзор экспериментальной установки каждого лотка, с притоком воды и подачи трубы, насос для обеспечения рециркуляции воды, перфорированной пластины, чтобы создать зону смешивания и выпускную трубу для регулирования уровня воды.
Измерения роста
Индивидуальная высота раковины измерялась до и в конце эксперимента с помощью цифрового штангенциркуля (нониус 150 мм). Сухой вес ткани измеряли после сушки при 105 ° C до постоянного веса (24 ч) в конце эксперимента.Среднюю скорость роста рассчитывали путем деления разницы продолжительности до и после эксперимента на продолжительность испытания (27 дней). Индекс состояния был рассчитан путем определения взаимосвязи между высотой скорлупы и сухим весом мягких частей (Luoma and Carter, 1991) ( n = 15–20 для каждого лотка).
Клиренс
Скорость выведения измерялась дважды во время эксперимента, через 15 и 25 дней, когда гребешки адаптировались к различным диетам. Одиночные гребешки помещали на горизонтальную решетку в круглые стеклянные стаканы объемом 1 л, покрытые темным пластиком, чтобы избежать помех во время измерения в помещении с контролируемой температурой (10 ° C).Циркуляция воды была достигнута с помощью магнитной мешалки, чтобы уменьшить осаждение исходных частиц.
Для измерения скорости выведения по три гребешка из каждого лотка были перенесены в стаканы объемом 1 л и дали корм, см. Экспериментальные рационы в конце этого раздела.
В каждой серии измерений использовался один дополнительный стакан с такой же концентрацией углерода, что и в других стаканах, но без добавленного гребешка. Это было сделано для того, чтобы при перемешивании сохранялось равномерное распределение частиц.Во время испытаний скорости клиренса не наблюдалось седиментации. Измерение началось, когда было обнаружено, что первый гребешок активно питается. Образцы воды (20 мл) отбирали через 7, 15, 30, 45, 60, 90 и 120 минут. Размер частиц (2-40 мкм) и концентрацию (частицы, мл -1 ) измеряли с помощью мультисайзера Beckman Coulter-Counter Multisizer 3. Когда гребешки начинали фильтровать, уменьшение количества частиц со временем было логарифмическим. Уровень клиренса рассчитывался по следующей формуле:
CR = v / t (lnC0 / Ct)
, где v — объем контейнера, т, — продолжительность эксперимента, а C 0 и C t — начальная и конечная концентрация частиц в пределах линейной области кривая (Marin et al., 1986). Морские гребешки были помечены после первого анализа скорости выведения и вернулись в эксперимент по кормлению. После второго анализа степени очистки гребешки использовались для анализа индекса состояния.
Экспериментальные диеты
На 15 день эксперимента измеряли скорость выведения, и диета была такой же, как и в эксперименте по кормлению (шесть различных диет, n = 9, таблица 1).
Уровень выведениятакже измеряли на 25 день. Диета состояла из водорослей ( R.baltica и C. muelleri , где R. baltica составляло 90% от общего содержания углерода), корм лосося и фекалии лосося отдельно с начальной концентрацией 12000 частиц мл -1 для каждого рациона (три различных рациона , n = 9). Концентрация углерода составляла 300 мкг C L -1 для водорослей, 1390 мкг C L -1 для корма лосося и 865 мкг C L -1 для фекалий.
Анализ липидов
морских гребешков вскрывали в конце испытания кормления, на 27 день, для анализа липидов.Это было через 24 часа после прекращения кормления, чтобы опорожнить содержимое кишечника перед анализом. Пищеварительные железы и мышцы отделяли от гребешков ( n = 10 с каждого лотка) и замораживали в жидком азоте. В этом исследовании жабры не анализировались, поскольку основное внимание уделялось липидам, а накопление липидов происходит в пищеварительной железе. Мышца включали для изучения характера включения жирных кислот в мышечную ткань. У этих молодых гребешков гонад не было.Все образцы, использованные для определения липидов, были высушены вымораживанием, промыли N 2 и хранили при -80 ° C до анализа. Общий липид экстрагировали и определяли гравиметрически в соответствии с Bligh and Dyer (1959), но с модификациями, описанными Jakobsen et al. (2008). Метиловые эфиры жирных кислот получали из экстрагированного липида в соответствии с методом Metcalfe et al. (1966). Затем они были проанализированы с помощью газового хроматографа (AutoSystem XL, Perkin Elme, Waltham, MA, США) с TotalChrom Version 6.Программное обеспечение 3.1. Система была оборудована автоматическим инжектором (объем впрыска 1 мкл, впрыск в колонку, температура на входе 250 ° C) и пламенно-ионизационным детектором (FID, 280 ° C). Использовали капиллярную колонку из плавленого кварца, покрытую химически связанным полиэтиленгликолем (CP-Wax 52CB, 25 м × 0,25 мм внутренний диаметр; Varian, Пало-Альто, Калифорния, США). Температурная программа духовки была первоначально установлена на 90 ° C в течение 1 мин. Затем температуру повышали до 150 ° C при 30 ° C мин. -1 и, наконец, до 225 ° C при 3 ° C мин. -1 и выдерживали в течение 7 мин.В качестве газа-носителя использовался гелий. Время удерживания метиловых эфиров жирных кислот сравнивали с коммерческими стандартами (Nu-Chek Prep, Токио, Япония) и определяли количественно с использованием 19: 0 в качестве внутреннего стандарта, добавленного перед экстракцией, в сочетании с кривыми внешнего стандарта.
Стабильный изотопный и элементный анализ
Пищеварительные железы и мышцы морских гребешков и различные диеты, использованные в этом эксперименте, были проанализированы на предмет содержания в них углерода, азота, а также изотопных соотношений углерода и азота (δ 13 C и δ 15 N) в Лаборатория стабильных изотопов плато Колорадо в Университете Северной Аризоны, США.Образцы были высушены вымораживанием, измельчили, взвесили и упаковали в оловянные капсулы перед анализом с помощью элементного анализатора Carlo Erba NC2100, соединенного с масс-спектрометром изотопного отношения Thermo-Electron Delta V Advantage, настроенным через CONFLO III. Изотопные отношения были рассчитаны следующим образом:
δXsample (‰) = [(Rsample / Rstandard) −1] × 1000
, где X — это 13 C или 15 N, а R — соотношение 13 C / 12 C для углерода и 15 N / 14 N для азота, соответственно.Стандартный белемнит Pee Dee был использован для анализа изотопов углерода, в то время как атмосферный азот использовался в качестве стандарта для азота.
Анализ данных
Все статистические анализы были выполнены с помощью SigmaPlot 13.0 с уровнем значимости p <0,05. Двусторонний дисперсионный анализ с апостериорным тестом Холма-Сидака использовался для сравнения образцов после того, как они прошли тест на нормальность (Шапиро-Уилка) и тест на гомогенную изменчивость. Нормализованные данные были преобразованы в квадратный корень перед статистическим анализом.Статистические параметры степеней свободы, значения F и p приведены в дополнительной таблице 2. Unscrambler 10.2 (CAMO AS, Осло, Норвегия) использовался для анализа главных компонент (PCA) преобразованного квадратного корня. нормализованные данные по жирным кислотам. Значения, представленные в этой статье, представляют собой средние значения со стандартной ошибкой среднего.
Результаты
Фильтрация и предпочтение частиц
Размер частиц в рационах этого испытания был меньше 10 мкм (рис. 2А).Частицы из корма лосося и фекалий лосося были в основном от 2,2 до 6,0 мкм (95–96%), а размер водорослей в смешанной культуре ( R. baltica и C. muelleri ) составлял в основном от 6 до 10 мкм (82%). , Рисунок 2А).
Рисунок 2. (A) Распределение по размерам (частицы, мл -1 ) корма лосося, фекалий лосося и водорослей ( R. baltica и C. muelleri ), частиц, используемых в лабораторных экспериментах и в исследования удержания частиц.Распределение частиц по размерам измеряли с помощью Beckman Coulter-Counter Multisizer 3. (B) Степень очистки от водорослей, корма лосося и фекалий лосося (L инд. -1 ч -1 ). Значения, показанные с погрешностями, представляют собой средние значения ± 1 стандартное отклонение. Существенные отличия отмечены буквами.
Морские гребешки очищают водоросли более эффективно, чем более мелкие частицы корма лосося и фекалий лосося, когда их кормят водорослями ( R. baltica и C. muelleri ), кормом лосося и фекалиями лосося ( p <0.05), и не было существенной разницы в скорости выведения между кормом лосося и фекалиями лосося ( p > 0,05, рис. 2B).
Когда гребешкам давали разные диеты, использованные в эксперименте по кормлению, не было статистических различий в скорости выведения ( p <0,05) между гребешками, которым давали высокую концентрацию частиц (водоросли 2,7 ± 0,5 л, инд -1 ч — 1 , водоросли и корм лосося 2,7 ± 0,4 л, инд -1 ч -1 , водоросли и фекалии лосося 2.2 ± 0,4 л (инд. -1 ч, -1 ) и гребешки, подаваемые с низкой концентрацией частиц (водоросли 2,0 ± 0,2 л инд. -1 ч -1 , корм водорослей и лосося 2,2 ± 0,1 л инд. — 1 ч -1 , водоросли и фекалии лосося 2,1 ± 0,2 л (инд. -1 ч -1 ). Более того, дополнительный корм и фекалии лосося не влияли на скорость выведения при концентрациях, используемых в эксперименте.
Индекс роста и состояния
Не было различий в индексе состояния гребешков, которых кормили кормом лосося или фекалиями лосося (или гребешками контрольной группы) для каждой концентрации водорослей, но гребешки с высокой концентрацией водорослей получили более высокий индекс состояния, чем у гребешков. учитывая низкую концентрацию для всех видов лечения ( p <0.001, рис. 3А). Морские гребешки, которых кормили высокой концентрацией водорослей, не показали значительных различий в средней скорости роста между рационами с высоким содержанием водорослей ( p > 0,05, Рисунок 3B). Морские гребешки, которых кормили кормом лосося и фекалиями лосося в дополнение к низкой концентрации водорослей, не показали значительных различий по сравнению с контролем ( p > 0,05). Морские гребешки, которых кормили высокой концентрацией водорослей, росли быстрее, чем те, которые получали низкую концентрацию водорослей для контроля ( p <0,001), кормовой рацион лосося ( p <0.05) и диеты с фекалиями лосося ( p <0,05, рис. 3B).
Рисунок 3. Средняя скорость роста (мкм в день -1 ) (A) , индекс состояния (B) , общий липид в пищеварительной железе (мг г -1 dw) (C) и общий липид в мышцах (мг г -1 dw) (D) контрольных гребешков, гребешков, которых кормили лососем, и гребешков, которых кормили фекалиями лосося в дополнение к высокой или низкой концентрации водорослей. Значения, показанные с погрешностями, представляют собой средние значения ± 1 стандартное отклонение.Значительные различия между высокой и низкой концентрацией водорослей отмечены звездочкой ( ∗ p <0,05, ∗∗ p <0,001).
Общее липидное содержание пищеварительной железы не показало значимых различий между контролем и гребешками, получавшими корм лосося или фекалии лосося как при высоких, так и при низких концентрациях водорослей ( p > 0,05). Обеспечение высокой концентрации водорослей привело к более высокому общему содержанию липидов в пищеварительной железе гребешков по сравнению с показателем, полученным для низкой концентрации водорослей (средние значения 143 ± 5 мг г -1 dw и 79 ± 4 мг г — 1 dw соответственно P <0.05, рис. 3С). Среднее содержание общих жирных кислот в пищеварительной железе для обработок составляло 33,2 ± 5,9 мг г -1 dw у морских гребешков с низкой концентрацией водорослей и 95,5 ± 13,6 мг g -1 dw у морских гребешков с высокой концентрацией водорослей. . Не было значительных различий в общем содержании липидов в мышцах гребешков, получавших корм лосося или фекалии лосося при обеих концентрациях водорослей ( p > 0,05, рисунок 3D). Мышца показала среднее содержание липидов 42.0 ± 2,5 мг г -1 dw и среднее общее содержание жирных кислот 16,8 ± 1,6 мг g -1 dw.
Определение содержания жирных кислот в компонентах корма
Профиль жирных кислот варьировался между различными диетическими компонентами (таблица 2). Основные жирные кислоты, которые составляли 52% от общего количества жирных кислот у Rhodomonas sp. составило 18: 3n3, 18: 4n3 и 18: 2n6, тогда как в Chaetoceros sp., 16: 0 и 16: 1n7 составляли 55% от общего количества жирных кислот (таблица 2). Двумя наиболее распространенными жирными кислотами в корме лосося были 18: 1n9 и 18: 2n6, тогда как 18: 1n9 и 16: 0 были доминирующими жирными кислотами в фекалиях лосося, составляя 39% и 50% от общего количества жирных кислот, соответственно.Мононенасыщенные жирные кислоты 18: 1n9, 20: 1n9 и 22: 1n11 соответственно присутствовали как в корме лосося, так и в фекалиях лосося, но только в значительно меньших количествах у обоих видов водорослей (Таблица 2). Таким образом, эти жирные кислоты служат потенциальными индикаторными жирными кислотами для корма лосося и фекалий лосося в эксперименте.
Таблица 2. Общее содержание липидов (мг г -1 dw), общее содержание жирных кислот (FA) (мг g -1 dw) и доля жирных кислот (мг g -1 всего жирных кислот ) в кормовых компонентах рациона в эксперименте по кормлению.
Доля потенциальной трассирующей жирной кислоты 18: 1n9 в пищеварительной железе морских гребешков показала значительные различия между диетами (рис. 4А). Как для высокой, так и для низкой концентрации водорослей доля 18: n9 стала выше, когда гребешки кормили кормом лосося и фекалиями лосося в дополнение к водорослям. Кроме того, разница между долями 18: 1n9 в контроле и у гребешков, получавших корм лосося и фекалии лосося, была выше в группах с низкой концентрацией водорослей ( p <0.001), чем у пациентов с высокой концентрацией водорослей ( p <0,05), что свидетельствует о более высоком относительном включении корма и фекалий лосося при низкой концентрации водорослей, чем при высокой концентрации. Мышцы гребешков, получавших фекалии лосося, в дополнение к высоким и низким концентрациям водорослей содержали значительно более низкие доли 18: 1n9, чем контроли, и добавление корма лосося к высоким ( p <0,05) и низким концентрациям водорослей ( p <0,05, рис. 4В).В отличие от этого, рацион кормления лососем в дополнение к водорослям привел к более высокой доле 18: 1n9 для высокой концентрации водорослей ( p <0,05), но не было значительных различий по сравнению с контролем для низкой концентрации водорослей ( р > 0,05).
Рис. 4. Содержание потенциальных индикаторных жирных кислот [18: 1n9 (A, B) , 20: 1n9 (C, D) , 22: 1n11 (E, F) , мг г — 1 общих жирных кислот, TFA] в пищеварительной железе (A, C, E) и мышцах (B, D, F) морских гребешков, которых кормили водорослями, кормом лосося и фекалиями лосося в дополнение к высоким и низким концентрация водорослей.Значительные различия между диетами с высокой концентрацией водорослей отмечены буквами a, b и c, тогда как существенные различия между диетами с низкой концентрацией водорослей отмечены буквами x, y и z. Значительные различия между высокой и низкой концентрацией водорослей отмечены звездочкой ( ∗ p <0,05, ∗∗ p <0,001).
Доля 20: 1n9 в пищеварительной железе была выше для всех рационов у морских гребешков с низкой концентрацией водорослей, чем с высокой концентрацией ( p <0.001, фиг. 4С). И при высоких, и при низких концентрациях водорослей доля 20: 1n9 в гребешках, которым давали корм лосося и фекалиях лосося, была выше, чем в гребешках, которым давали только водоросли (контроль, p <0,05). В мышцах гребешков была немного более высокая доля 20: 1n9, обнаруженная в гребешках, которым давали низкую концентрацию водорослей, по сравнению с высокой концентрацией, когда дополнительно давали фекалии лосося или корм лосося (рис. 4D). Мышцы морских гребешков, получавших фекалии лосося или корм лосося, помимо низкой концентрации водорослей, содержали немного более высокую долю 20: 1n9 по сравнению с контролем ( p <0.05), в то время как у морских гребешков, питавшихся высокой концентрацией водорослей, не было значительных различий.
Доля 22: 1n11 в пищеварительной железе не показала различий между диетами, которые включали одинаковую концентрацию водорослей, но была более высокая доля, обнаруженная у морских гребешков, получавших высокую концентрацию водорослей, по сравнению с низкой концентрацией для всех диет (рис. 4E). Доля 22: 1n11 в мышцах не была обнаружена у морских гребешков, получавших низкую концентрацию водорослей, и не было значительных различий между гребешками, получавшими высокие концентрации водорослей ( p > 0.05, рисунок 4F). Доли всех жирных кислот, проанализированные в мышцах и пищеварительных железах, приведены в дополнительной таблице 1.
PCA жирных кислот в пищеварительной железе показал, что гребешки, получавшие только диету с высоким и низким содержанием водорослей, сгруппированы с главным компонентом 1 (PC-1), описывающим 96% этой вариации (рис. 5A). Жирные кислоты, ответственные за эту изменчивость, были в основном 18: 2n6, 18: 3n3, 18: 4n3 и 22: 6n3. Эти жирные кислоты (вместе с 20: 5n3) являются наиболее распространенными жирными кислотами в R.baltica , предполагая, что на состав жирных кислот пищеварительной железы сильно влияет водорослевая диета.
Рис. 5. Анализ главных компонентов (PCA) содержания жирных кислот в пищеварительной железе гребешков, которым давали корм лосося (квадраты), фекалии лосося (треугольники) и контроль (кружки) для высокой концентрации водорослей (закрашены) символы) и низкой концентрации водорослей (открытые символы). (A) График баллов и график нагрузки жирных кислот в пищеварительной железе для всех образцов в эксперименте по кормлению, график баллов (B) и график нагрузки образцов с низкой концентрацией водорослей и (C) балл график и график загрузки образцов с высокой концентрацией водорослей.
Затем группы, получавшие низкую и высокую концентрацию водорослей, анализировали отдельно (Рисунки 5B, C). В обеих группах контроль был отделен от двух других групп, получавших корм лосося или фекалии лосося. Для группы с низким содержанием водорослей контроль был отделен от других рационов в направлении PC-1, которое описывало 75% вариаций в образцах, где 18: 1n9 и 16: 0 были основными жирными кислотами, ответственными за это изменение. Для групп, получавших высокие концентрации водорослей, контроль был отделен от групп корма лосося и фекалий лосося в направлении PC-2, что составляет 20% вариации в образцах.Две жирные кислоты 18: 1n9 и 16: 0 снова были ответственны за большую часть этого изменения. Графики PCA также показали, что соотношение 18: 1n9 лучше всего описывает вариации в образцах для групп, получавших низкую концентрацию водорослей, где корм лосося и фекалии лосося имели наибольший вклад в рацион.
PCA жирных кислот в мышцах морских гребешков также показал, что гребешки, получавшие высокие концентрации водорослей, были отделены от гребешков, которым давали низкую концентрацию водорослей, где PC-1 описал 89% вариации (рис. 6A).Жирные кислоты 18: 3n3, 18: 2n6, 18: 4n3 и 22: 6n3 также объясняют большую часть кластеризации образцов для мышц, что указывает на то, что состав жирных кислот в рационе также влияет на состав жирных кислот в мышцах. . Группы, которым давали низкую концентрацию водорослей, анализировали на отдельном графике PCA (Рисунок 6B). Контрольную группу, получавшую только водоросли, отделили от контрольной группы, которую кормили фекалиями лосося или кормом лосося, за исключением одной из повторностей, получавших корм для лосося. Жирные кислоты 18: 3n3 и 22: 6n3 отвечают за разделение в направлении PC-1, что объясняет 50% вариации.В направлении PC-2, которое объяснило 24% вариации, корм лосося и контрольный корм, получавший только небольшое количество водорослей, были отделены от группы фекалий лосося, где 18: 1n9 и 18: 2n6 объясняли большую часть этой изменчивости. Для мышц гребешка, получавшего высокую концентрацию водорослей, группа корма лосося отличалась от фекалий лосося и контрольных групп в направлении PC-1, что объясняет 50% вариации (Рисунок 6C). Жирная кислота 18: 1n9 была ответственна за большую часть этого изменения.
Рисунок 6. Анализ главных компонентов (PCA) содержания жирных кислот в мышцах гребешков, которым давали корм лосося (квадраты), фекалии лосося (треугольники) и контроль (кружки) для высокой концентрации водорослей (закрашенные символы) и низкой концентрации водорослей концентрация (открытые символы). (A) График баллов и график нагрузки жирных кислот в мышцах всех образцов в эксперименте по кормлению, график баллов (B) и график нагрузки образцов с низкой концентрацией водорослей и график (C) баллов и график загрузки образцов с высокой концентрацией водорослей.
Стабильные изотопы δ 13 C и δ 15 N были проанализированы в различных диетах, в пищеварительной железе гребешков и в мышцах гребешков (рис. 7). Сигнатуры δ 13 C двух водорослей существенно не различались ( p > 0,05) и имели низкое соотношение -37,8 ± 0,3 ( n = 3) и -38,4 ± 0,4 ‰ ( n = 3) (для R. baltica и C. muelleri соответственно). Корм лосося и фекалии показали более высокую сигнатуру δ 13 C по сравнению с водорослями, но они были сопоставимы друг с другом (-26.4 и -25,6 ‰). К сожалению, анализ стабильных изотопов в кормах лосося и фекалиях лосося основан на одном анализе, и разница не может быть проверена.
Рисунок 7. Диаграмма двойного изотопа (δ 13 C и δ 15 N, ‰) источников питания (корм лосося, фекалии лосося, R. baltica и C. muelleri ), пищеварительная железа и мышцы контрольных гребешков, гребешков, которых кормили лососем, и гребешков, которых кормили фекалиями лосося, в дополнение к высокой и низкой концентрации водорослей.
Пищеварительная железа гребешков, которые кормили водорослями с высокой концентрацией водорослей, были сгруппированы вместе и показали значительно более низкую сигнатуру δ 13 C, чем пищеварительная железа морских гребешков, которых кормили низкой концентрацией водорослей ( p <0,001, n = 9). То же самое наблюдалось и для мышцы; мышцы морских гребешков, которым давали высокую концентрацию водорослей, имели значительно более низкую сигнатуру δ 13 C, чем гребешки, которым давали низкую концентрацию водорослей ( p <0.001, n = 9). Однако разница в сигнатуре δ 13 C между высокой и низкой концентрацией водорослей была выше в пищеварительной железе, чем в мышцах (разница 7,7 и 3,3, соответственно). Не было значительной разницы между контролем, который кормили только водорослями, и гребешками, которым также давали корм лосося или фекалии лосося. Это было верно как для высокой и низкой концентрации водорослей, так и для пищеварительной железы и мышц ( p > 0,05, n = 3).
Сигнатуры δ 15 N R. baltica и C. muelleri также не отличались значимо, показывая значения 4,8 ± 0,5 ( n = 3) и 5,0 ± 0,4 ‰ ( n = 3). соответственно. Корм лосося и фекалии лосося показали значения 2,4 ( n = 1) и 3,9 ‰ ( n = 1) и не могли быть проверены на различия.
Пищеварительная железа показала сигнатуру δ 15 N 5,8 ± 0,1 ( n = 9) и 7.2 ± 0,2 ‰ ( n = 8) для морских гребешков, которых кормили высокой и низкой концентрацией водорослей, соответственно, в то время как мышца показала сигнатуру δ 15 N 7,5 ± 0,1 ( n = 9) и 7,2 ± 0,2 ± ( n = 9) для морских гребешков с высокой и низкой концентрацией водорослей соответственно.
Обсуждение
Важность кормов и фекалий лосося в средах с высоким и низким содержанием фитопланктона
Основная цель настоящего эксперимента состояла в том, чтобы изучить способность гребешков включать в себя частицы корма и фекалий лосося в сценарии IMTA весеннего цветения и зимних условий.Эти условия характеризуются относительно высокой и низкой концентрацией фитопланктона, соответственно, в прибрежных водах умеренного пояса Северной Европы.
Измерения скорости выведения в настоящем исследовании показали, что гребешки обладают способностью очищать и удерживать корм и фекалии лосося, хотя и с меньшими показателями, чем водоросли. Более низкие скорости, вероятно, являются результатом небольшого размера частиц; Удерживание частиц у других двустворчатых моллюсков ниже для частиц <3 мкм (Mohlenberg and Riisgard, 1978; Riisgard, 1988), в то время как пектиниды показали более низкую эффективность для частиц <5-7 мкм (Cranford and Grant, 1990; MacDonald и другие., 2006). Концентрация частиц также может объяснить ограниченную способность гребешков убирать корм и фекалии лосося. Концентрация углерода в корме и фекалиях лосося составляла 1390 и 865 мкг C L -1 , соответственно, при измерении скорости выведения из корма лосося и фекалий лосося. Концентрация углерода в корме и фекалиях лосося, используемых в экспериментальных рационах, составляла 30 мкг C L -1 . Скорость выведения, измеренная для рационов в эксперименте по кормлению, не показала различий между рационами.
Жирные кислоты пищеварительной железы использовались для отслеживания корма лосося и / или фекалий лосося в синих мидиях в нескольких исследованиях (Redmond et al., 2010; Handå et al., 2012a, b; Irisarri et al., 2014). Наши результаты показывают, что содержание 18: 1n9 было выше в пищеварительной железе гребешков, которых кормили кормом лосося и фекалиями лосося, по сравнению с гребешками, которых кормили только водорослями, как при высоких, так и при низких концентрациях водорослей. Эта жирная кислота содержится в большом количестве в корме и фекалиях лосося, но только в низких количествах в микроводорослях, использованных в эксперименте (таблица 2).В лабораторных исследованиях (Redmond et al., 2010; Both et al., 2011; Handå et al., 2012b) и в полевых исследованиях в лососевых кормах и фекалиях лосося была обнаружена более высокая доля 18: 1n9. близость рыбных хозяйств (Gao et al., 2006; Handå et al., 2012a). Изменение доли этой жирной кислоты было наиболее заметным при низкой концентрации водорослей, как в корме лосося, так и в добавленных фекалиях. Более того, график PCA пищеварительной железы показывает, что характерные жирные кислоты из корма и фекалий лосося объясняют большую часть изменений в составе жирных кислот при низкой концентрации водорослей, тогда как жирные кислоты водорослей объясняют большую часть изменений, когда концентрация водорослей была низкой. высоко.Это также свидетельствует о том, что корм и фекалии лосося стали более важным источником пищи, когда концентрация водорослей в окружающей среде была низкой, что также предположили Troell и Norberg (1998).
Содержание липидов в пищеварительных железах было примерно в два раза выше при кормлении с высокой концентрацией водорослей по сравнению с низкой концентрацией. Это подтверждает, что гребешки использовали пищеварительную железу для хранения липидов при высокой концентрации пищи. При низких концентрациях водорослей энергия в основном использовалась для поддержания метаболизма, так как гребешки показали минимальный рост за этот короткий экспериментальный период.Анализ профиля питания мышц гребешка мог бы дать больше информации о включении белков и углеводов из кормов лосося и фекалий лосося, и его следует рассмотреть в будущих исследованиях.
Кроме того, было также изменение состава жирных кислот в мышцах, выявленное разделением различных групп на графиках PCA. Это говорит о том, что липид, включенный в пищеварительную железу, был переведен на фосфолипиды в мышцах. Включение жирных кислот в фосфолипиды более строго метаболически регулируется, чем в триацилглицеридах, потому что фосфолипиды являются важным функциональным компонентом мышечных клеток и потому что они играют важную роль в системе передачи сигналов клеток (Sargent et al., 2002). График PCA профиля жирных кислот в мышцах показал сильное влияние концентрации водорослей на профиль жирных кислот в мышцах (рис. 6A). Морские гребешки, получавшие диету с высоким содержанием водорослей, показали большее включение жирных кислот водорослей C18: 3n3, C18: 2n6 и C18: 4n3 в фосфолипиды мышц, чем гребешки, которым давали низкие концентрации водорослей. График PCA также показал, что диета, состоящая из корма лосося и фекалий, влияла на профиль жирных кислот в мышцах гребешков, которым давали низкую концентрацию водорослей, больше, чем высокую концентрацию водорослей.
Состав жирных кислот пищеварительной железы и мышц позволяет предположить, что гребешки могут использовать корм и фекалии лосося при низких концентрациях водорослей, как это предполагалось также для мидий (Wallace, 1980; Stirling and Okumuş, 1995; Handå et al., 2012а).
Еще одно различие в профиле жирных кислот в мышцах морских гребешков, получавших диету с высоким и низким содержанием водорослей, заключалось в том, что водорослевая диета оказывала более сильное влияние на профиль жирных кислот, что приводило к более низкой доле C22: 6n3.Морские гребешки, получавшие диету с высоким содержанием водорослей, имели в среднем 33% C22: 6n3 от общего количества жирных кислот, в то время как у гребешков, получавших диету с низким содержанием водорослей, доля C22: 6n3 TFA составляла 40%. Соответственно, эта важная жирная кислота демонстрировала избирательное накопление в фосфолипидах мышц. Селективная ассимиляция этой жирной кислоты ранее была предложена для личинок гребешка (Marty et al., 1992), которые, как было показано, имеют особые потребности в длинноцепочечных полиненасыщенных жирных кислотах n3, таких как C22: 6n3 (Delaunay et al., 1993). C22: 6n3 играет важную структурную и функциональную роль в мембранах большинства видов.
Изучение корма и фекалий лосося с помощью биомаркеров жирных кислот и стабильных изотопов
Наиболее распространенная жирная кислота в корме лосося и фекалиях лосося составляла 18: 1n9, что, как ожидалось, могло быть потенциальным индикатором этих компонентов рациона в данном эксперименте. Это произошло потому, что оба используемых вида водорослей показали низкие уровни этой жирной кислоты и потому, что эта жирная кислота использовалась в качестве индикаторной жирной кислоты для корма лосося и / или фекалий лосося в исследованиях с голубыми мидиями (Redmond et al., 2010; Handå et al., 2012a, b) и зеленогубых мидий Perna viridis (Gao et al., 2006). Однако есть некоторые вопросы, связанные с общим использованием 18: 1n9 в качестве индикаторной жирной кислоты для моллюсков, выращиваемых в естественной среде обитания. Поскольку 18: 1n9 является очень распространенной жирной кислотой, ее содержание варьируется среди видов фитопланктона (Reuss and Poulsen, 2002), и многие виды простейших и многоклеточных животных, которые могут составлять часть корма морского гребешка, способны синтезировать ее. Таким образом, 18: 1n9 будет демонстрировать фоновые уровни или даже высокие уровни в естественном сестоне.Таким образом, недостаточно просто оценить влияние корма и фекальных отходов от выращивания лосося на гребешков, просто проанализировав содержание 18: 1n9 в них. При содержании 18: 1n9 в естественной пище сестона морских гребешков может доминировать фитопланктон на репрезентативном эталонном участке, на который не влияют отходы разведения лосося. Такое измерение может сделать оценку на основе содержания 18: 1n9 более осуществимой, если содержание природного сестона низкое.
Другие жирные кислоты были предложены в качестве индикаторных жирных кислот для рыбных отходов, включая мононенасыщенные жирные кислоты 20: 1n9 и 22: 1n11 (Van Biesen and Parrish, 2005; Both et al., 2012). Однако эти жирные кислоты не показали (за исключением 20: 1n9 в пищеварительной железе у морских гребешков, получавших высокие концентрации водорослей) какого-либо отношения к корму лосося и частицам фекалий в нашем исследовании. Однако мы использовали относительно низкую концентрацию корма и фекалий лосося в рационе, и концентрация этих жирных кислот была низкой по сравнению с 18: 1n9. И 20: 1n9, и 22: 1n11 также являются маркерами зоопланктона и будут варьироваться в корме для рыб в зависимости от содержания рыбной муки и жира, обычно получаемых из планктоядных рыб (Van Biesen and Parrish, 2005).Более того, мидии и другие двустворчатые моллюски способны потреблять простейшие и ранние стадии зоопланктона многоклеточных животных (Davenport et al., 2000), что может еще больше усложнить использование этих жирных кислот в качестве индикаторов питательных веществ в отходах лососевых ферм. 18: 2n6 также был предложен в качестве потенциального индикатора сброса питательных веществ из рыбоводных хозяйств, поскольку он возникает в результате включения в корм высших растений (Olsen et al., 2009, 2012; Both et al., 2011). Однако эта жирная кислота не использовалась в качестве маркера в нашем эксперименте, поскольку R.baltica содержал большое количество 18: 2n6. Другой фитопланктон, который может быть в изобилии в полевых экспериментах, также может продуцировать эту жирную кислоту (Dalsgaard et al., 2003; Shin et al., 2014).
Количественный анализ стабильных изотопов ранее использовался для определения степени, в которой двустворчатые моллюски включают корм и фекалии рыб в полевых условиях (Gao et al., 2006) и в лабораторных экспериментах (Redmond et al., 2010). Однако этот метод был недостаточно чувствительным, чтобы определить, были ли морские гребешки включили корм лосося или фекалии в их мышцы и пищеварительные железы в нашем эксперименте.Эта неспособность могла возникнуть из-за относительно низких концентраций корма и фекалий лосося, используемых в рационах. Однако наблюдалась разница в изотопных характеристиках морских гребешков, питавшихся с низкой концентрацией водорослей по сравнению с высокой концентрацией водорослей как в мышцах, так и в пищеварительной железе. Lorrain et al. (2002) сообщили о сезонных колебаниях стабильных изотопов у морских гребешков, где мышцы демонстрировали незначительные изменения, а пищеварительная железа варьировала от 5 до 7,5 δ 15 N. Наибольшее значение пищеварительной железы было обнаружено в феврале / марте, когда еда было мало, а наименьшее значение было в апреле и мае, когда еды было много.Это хорошо согласуется с нашими выводами для морских гребешков, которых кормили высокой и низкой концентрацией водорослей. Было показано, что пектиниды используют белок вместо липидов в качестве источника энергии при гаметогенезе и при дефиците пищи зимой (MacDonald et al., 2006). Затем количество выделяемого аммиака увеличивается из-за дезаминирования аминокислот. Этот аммиак будет обеднен δ 15 N из-за дезаминирования, поскольку ферменты предпочитают более легкий изотоп, в результате чего гребешок может быть обогащен до 15 N.Если морские гребешки, получившие низкую концентрацию водорослей в нашем исследовании, в основном использовали белки для поддержки своих метаболических потребностей в энергии, это могло бы привести к гребешку с более высокой потерей аммиака, чем у гребешков, получавших диету с высоким содержанием водорослей, и, следовательно, гребешка с более высоким δ 15 N подпись. Комбинация высокого метаболического оборота, приводящего к более быстрому включению стабильных изотопов из пищи и дезаминированию, может объяснить различия в сигнатуре δ 15 N между пищеварительной железой и мышцей.Пищеварительная железа и мышцы морских гребешков, получавших высокие концентрации водорослей в нашем эксперименте, были более истощены по 13 C, чем у морских гребешков, получавших низкую концентрацию водорослей. Это различие, вероятно, вызвано различием в содержании липидов (DeNiro and Epstein, 1977), скорости обмена и физиологических процессах (Lorrain et al., 2002).
Заключение
Настоящий лабораторный эксперимент показал, что гребешок P. maximus может очищать и включать корм лосося и частицы фекалий лосося, что позволяет предположить, что гребешок может быть подходящим кандидатом для IMTA.Однако, когда концентрация частиц в корме лосося и фекалиях лосося высока, эффективность фильтрации ниже по сравнению с водорослями. Основываясь на профилировании жирных кислот, мы пришли к выводу, что гребешки содержали корм лосося и фекалии лосося; однако использование стабильных изотопов углерода и азота для отслеживания источников пищи не принесло результатов. Жирная кислота 18: 1n9 присутствует в большом количестве в кормах и фекалиях рыб, но не в микроводорослях, использованных в этом эксперименте, поэтому ее использовали в качестве индикатора. Его содержание в пищеварительной железе и мышцах позволяет предположить, что гребешки могут использовать корм и фекалии лосося.Соответственно, было обнаружено, что использование жирных кислот является более чувствительным методом для отслеживания низких концентраций компонентов корма отходов лосося, при условии, что естественные рационы сестона имеют низкое и известное содержание 18: 1n9.
Заявление об этике
Настоящее исследование включает морских гребешков, которые не регулируются норвежскими правилами использования животных в экспериментах (FOR-2015-06-18-761). Эксперимент проводился с большим уважением к благополучию морских гребешков и гуманно умерщвлен после экспериментов.
Авторские взносы
МБ участвовал в планировании эксперимента, участвовал и руководил как экспериментами, так и последующим анализом, а также написал рукопись. LS выполнил большую часть экспериментов и анализа, а также внес свой вклад в рукопись. AH, KR, ØS и YO участвовали в планировании эксперимента и внесли свой вклад в рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить Исследовательский совет Норвегии за финансирование проекта EXPLOIT (216201 / E40). Благодарим Дага Алтина (Биотрикс) за предоставление лабораторного оборудования и интересные обсуждения. Мы также хотели бы поблагодарить ScalPro за предоставленные гребешки для нашего лабораторного эксперимента.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389 / fmars.2018.00524 / полный # дополнительный материал
Список литературы
Баннистер, Р. Дж., Йонсен, И. А., Хансен, П. К., Кутти, Т., и Асплин, Л. (2016). Моделирование рассеивания органических отходов от аквакультуры атлантического лосося в системах фьордов в ближнем и дальнем поле. ICES J. Mar. Sci. 9, 2408–2419. DOI: 10.1093 / icesjms / fsw027
CrossRef Полный текст | Google Scholar
Блай, Э. Г. и Дайер, У. Дж. (1959). Быстрый метод экстракции и очистки общих липидов. Банка. J. Biochem. Phys. 37, 911–917. DOI: 10.1139 / y59-099
CrossRef Полный текст | Google Scholar
Оба, А., Пэрриш, К. К. и Пенни, Р. У. (2012). Рост и биохимический состав Mytilus Edulis при выращивании на стоках трески, Gadus Morhua , аквакультурный объект. J. Моллюски. Res. 31, 79–85. DOI: 10.2983 / 035.031.0110
CrossRef Полный текст | Google Scholar
Оба, А., Пэрриш, К. К., Пенни, Р. У., и Томпсон, Р. Дж. (2011). Липидный состав Mytilus edulis , выращенного на органических отходах предприятия аквакультуры Gadus morhua . Aquat. Живой ресурс. 24, 295–301. DOI: 10.1051 / alr / 2011138
CrossRef Полный текст | Google Scholar
Брагер, Л., Крэнфорд, П. Дж., Янсен, Х. М., и Стрэнд, Ø. (2016). Временные колебания концентраций взвешенных твердых частиц в открытых рыбных хозяйствах Канады и Норвегии. Aquacult.Environ. Взаимодействовать. 8, 437–452. DOI: 10.3354 / aei00190
CrossRef Полный текст | Google Scholar
Брох, О. Дж., И Слагстад, Д. (2012). Моделирование сезонного роста и состава ламинарии Saccharina latissima . J. Appl. Phycol. 24, 759–776. DOI: 10.1007 / s10811-011-9695-y
CrossRef Полный текст | Google Scholar
Браун М. Р., Блэкберн С. И. (2013). «Живые микроводоросли в качестве живого корма в инкубаториях аквакультуры», in. Глава 4 в: Достижения в технологии инкубатория аквакультуры , ред. К. Деннис и М. Стрингер (Нью-Йорк, Нью-Йорк: издательство Woodhead Publishing Series в области пищевых наук, технологий и питания, Эльзевир), 680. doi: 10.1533 / 9780857097460.1.117
CrossRef Полный текст | Google Scholar
Бушманн, А. Х., Троелл, М., Каутский, Н. (2001). Комплексное водорослеводство: обзор. Cah. Биол. марта 42, 83–90.
Google Scholar
Кэрролл, М. Л., Кокрейн, С., Филер Р., Велвин Р. и Уайт П. (2003). Органическое обогащение донных отложений от разведения лосося в Норвегии: факторы окружающей среды, методы управления и методы мониторинга. Аквакультура 226, 165–180. DOI: 10.1016 / S0044-8486 (03) 00475-7
CrossRef Полный текст | Google Scholar
Шопен, Т., Бушманн, А.Х., Холлинг, К., Троелл, М., Каутский, Н., Неори, А. и др. (2001). Интеграция морских водорослей в системы морской аквакультуры: ключ к устойчивости. Дж.Phycol. 37, 975–986. DOI: 10.1046 / j.1529-8817.2001.01137.x
CrossRef Полный текст | Google Scholar
Крэнфорд, П. Дж., И Грант, Дж. (1990). Очистка от частиц и поглощение фитопланктона и детрита морским гребешком Placopecten magellanicus (Gmelin). J. Exp. Mar. Biol. Ecol. 137, 105–121. DOI: 10.1016 / 0022-0981 (90) -J
CrossRef Полный текст | Google Scholar
Крэнфорд, П. Дж., Рид, Г. К., и Робинсон, С.М. С. (2013). Интегрированная мульти-трофическая аквакультура в открытых водах: ограничения эффективности мидий как органического экстрактивного компонента. Aquacult. Environ. Interac. 4, 163–173. DOI: 10.3354 / aei00081
CrossRef Полный текст | Google Scholar
Далсгаард, Дж., Сент-Джон, М., Каттнер, Г., Мюллер-Наварра, Д., и Хаген, В. (2003). Трофические маркеры жирных кислот в пелагической морской среде. Adv. Mar. Biol. 46, 225–340. DOI: 10.1016 / S0065-2881 (03) 46005-7
CrossRef Полный текст | Google Scholar
Даниил, Р., Берто, О., Йозефонвич, Дж., И Гоасду, Н. (1999). Разложение фукоидана из водорослей ( Ascophyllum nodosum ) под действием ферментов, содержащихся в пищеварительных железах морского моллюска Pecten maximus . Углеводы. Res. 322, 291–297. DOI: 10.1016 / S0008-6215 (99) 00223-2
CrossRef Полный текст | Google Scholar
Дэвенпорт, Дж., Смит, Р. Дж. Дж. У. и Пакер, М. (2000). Мидии Mytilus edulis : важные потребители и разрушители мезозоопланктона. Mar. Ecol. Прог. Сер. 198, 131–137. DOI: 10.3354 / meps198131
CrossRef Полный текст | Google Scholar
Делоне Ф., Марти Ю., Моал Дж. И Самейн Дж. Ф. (1993). Влияние моноспецифической диеты водорослей на рост и жирнокислотный состав личинок Pecten maximus (L.). J. Exp. Mar. Biol. Ecol. 173, 163–179. DOI: 10.1016 / 0022-0981 (93) -O
CrossRef Полный текст | Google Scholar
Эттер, С.А., Андресен, К., Лейкнес, Ø., Ван, X. X., и Olsen, Y. (2017). Miljødokumentasjon Sunnmøre — Utslipp og vurdering av miljøvirkninger av næringssalter tilført frappdrett i regionen Sunnmøre i 2014 и 2015. Trondheim: Norges teknisk-naturvitenskapelige nologi. NTNU-раппорт.
Фольке, К., Каутский, Н., Троелл, М. (1994). Затраты на эвтрофикацию при выращивании лосося: последствия для политики. J. Environ. Управляй. 40, 173–182. DOI: 10.1006 / jema.1994.1013
CrossRef Полный текст | Google Scholar
Ганье Р., Трембле Р., Перне Ф., Майнер П., Самейн Дж. Ф. и Оливье Ф. (2010). Потребность гребешка в липидах Pecten maximus (L.) во время личиночного и постличиночного развития в связи с добавлением в рацион Rhodomonas salina . Аквакультура 370–371, 172–178. DOI: 10.1016 / j.aquaculture.2010.09.040
CrossRef Полный текст | Google Scholar
Гао, Q.Ф., Шин, П. К. С., Лин, Г. Х., Чен, С. П., и Чунг, С. Г. (2006). Стабильные изотопы и жирные кислоты, свидетельствующие о поглощении органических отходов зелеными мидиями Perna viridis в системе поликультуры рыбоводства. Mar. Ecol. Прог. Сер. 317, 273–283. DOI: 10.3354 / meps317273
CrossRef Полный текст | Google Scholar
Handå, A., Forbord, S., Wang, X.X., Broch, O.J., Dahle, S.W., Storseth, T.R., et al. (2013). Рост культивируемых водорослей (Saccharina latissima ) в зависимости от сезона и глубины в непосредственной близости от аквакультуры лосося ( Salmo salar ) в Норвегии. Аквакультура 414, 191–201. DOI: 10.1016 / j.aquaculture.2013.08.006
CrossRef Полный текст | Google Scholar
Handå, A., Min, H. J. E., Wang, X. X., Broch, O. J., Reitan, K. I., Reinertsen, H., et al. (2012a). Использование кормов для рыб и выращивание голубых мидий ( Mytilus edulis ) в непосредственной близости от аквакультуры лосося ( Salmo salar ): последствия для интегрированной мультитрофической аквакультуры в прибрежных водах Норвегии. Аквакультура 35, 328–341.DOI: 10.1016 / j.aquaculture.2012.04.048
CrossRef Полный текст | Google Scholar
Handå, A., Ranheim, A., Olsen, A.J., Altin, D., Reitan, K. I., Olsen, Y., et al. (2012b). Включение компонентов кормов и фекалий лососевых рыб в мидии ( Mytilus edulis ): последствия для интегрированной мультитрофической аквакультуры в водах Северной Атлантики с прохладным умеренным климатом. Аквакультура 370, 40–53. DOI: 10.1016 / j.aquaculture.2012.09.030
CrossRef Полный текст | Google Scholar
Хуса, В., Хансен, П. К., Баннистер, Р., Кутти, Т., и Фредриксен, С. (2017). «Utslipp av partiklulære og løste stoffer fra matfiskanlegg», в Kap 7 i Risikorapport Norsk Fiskeoppdrett 2017 , eds. Т. Свосанд, Э. С. Грефсруд, Ø. Карлсен, Б. О. Квамме, К. Гловер, В. Хуса и Т. С. Кристиансен (Осло: Fisken og havet).
Ирисарри, Дж., Фернандес-Рейрис, М. Дж., Де Трош, М., и Лабарта, У. (2014). Жирные кислоты как индикаторы трофических взаимодействий между сестоном, мидиями и биологическими отложениями в прибрежном заливе плотов с мидиями в непосредственной близости от садков с рыбами. Комп. Biochem. Phys. В 172, 105–115. DOI: 10.1016 / j.cbpb.2014.04.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ирисарри, Дж., Фернандес-Рейрис, М. Дж., Лабарта, У., Крэнфорд, П. Дж., И Робинсон, С. М. К. (2015). Доступность и использование отходов кормления рыб мидиями Mytilus edulis в коммерческой интегрированной многотрофической системе аквакультуры (IMTA): подход к оценке с использованием нескольких индикаторов. Ecol. Индикат. 48, 673–686.DOI: 10.1016 / j.ecolind.2014.09.030
CrossRef Полный текст | Google Scholar
Якобсен, А. Н., Аасен, И. М., Йозефсен, К. Д., и Стром, А. Р. (2008). Накопление липидов, богатых докозагексаеновой кислотой, в траустохитриде Aurantiochytrium sp. Штамм T66: эффекты голодания по азоту и фосфору и ограничения O (2). заявл. Microbiol. Biotecnol. 80, 297–306. DOI: 10.1007 / s00253-008-1537-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лендер, Т., Баррингтон, К., Робинсон, С.М.С., Макдональд, Б., и Мартин, Б. (2004). Динамика синей мидии как экстрактивного организма в интегрированной мультитрофической системе аквакультуры. Бык. Aquacult. Ассос. Канада 904, 79–82.
Google Scholar
Ландер Т. Р., Робинсон С. М., Макдональд Б. А. и Мартин Дж. Д. (2013). Характеристика взвешенных органических частиц, высвобождаемых из лососевых хозяйств, и их потенциала в качестве корма для кормораздатчика Mytilus edulis в интегрированных мультитрофических системах аквакультуры (IMTA). Аквакультура 406, 160–171. DOI: 10.1016 / j.aquaculture.2013.05.001
CrossRef Полный текст | Google Scholar
Ле Пеннек, Г., Ле Пеннек, М., и Бенинджер, П. Г. (2001). Сезонная динамика пищеварительных желез гребешка Pecten maximus в Брестском заливе (Франция). J. Mar. Biol. Доц. U.K. 81, 663–671. DOI: 10.1017 / S0025315401004349
CrossRef Полный текст | Google Scholar
Логан, Дж., Хаас, Х., Диган, Л., и Гейнс, Э.(2006). Скорость оборота стабильных изотопов азота в mummichog солончака, Fundulus heteroclitus , после смены диеты в лаборатории. Oecologia 147, 391–395. DOI: 10.1007 / s00442-005-0277-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лоррен А., Поле Ю. М., Шово Л., Савой Н., Донваль А. и Саут К. (2002). Дифференциальные сигнатуры дельта C-13 и дельта N-15 среди тканей гребешка: значение для экологии и физиологии. J. Exp. Mar. Biol. Ecol. 275, 47–61. DOI: 10.1016 / S0022-0981 (02) 00220-4
CrossRef Полный текст | Google Scholar
Луома, С. Н., и Картер, Дж. Л. (1991). «Влияние микроэлементов металлов на водный бентос», в Metal Ecotoxicology: Concepts and Applications , eds M. C. Newman and A. W. McIntosh (Lansing, MI: CRC Press).
Google Scholar
Макдональд Б.А., Бричелж В.М. и Шамвей С.Э. (2006). «Физиология: получение и использование энергии», в Морские гребешки: биология, экология и аквакультура , ред.Э. Шамуэй и Дж. Дж. Парсонс (Нью-Йорк, Нью-Йорк: Эльзевьер).
Google Scholar
Марин В., Хантли М. Э. и Фрост Б. (1986). Измерение скорости кормления пелагических травоядных — Анализ дизайна и методов эксперимента. Mar. Biol. 93, 49–58. DOI: 10.1007 / BF00428654
CrossRef Полный текст | Google Scholar
Марти Ю., Делоне Ф., Моал Дж. И Самейн Дж. Ф. (1992). Изменения жирнокислотного состава Pecten maximus (L.) во время личиночного развития. J. Exp. Mar. Biol. Ecol. 163, 221–234. DOI: 10.1016 / 0022-0981 (92) -B
CrossRef Полный текст | Google Scholar
Меткалф, Л. Д., Шмитц, А. А., и Пелка, Дж. Р. (1966). Быстрое получение эфиров жирных кислот из липидов для газохроматографического анализа. Анал. Chem. 38, 514–515. DOI: 10.1021 / ac60235a044
CrossRef Полный текст | Google Scholar
Mohlenberg, F., and Riisgard, H.U. (1978). Эффективность удержания частиц у 13 видов двустворчатых моллюсков. Офелия 17, 239–246. DOI: 10.1080 / 00785326.1978.10425487
CrossRef Полный текст | Google Scholar
Олафсен, Т., Винтер, У., Олсен, Й., Скьермо, Дж. (2012). Ценность продуктивного океана в 2050 году. Тронхейм: DKNVS и NTVA.
Google Scholar
Олсен, С. А., Эрвик, А., Граль-Нильсен, О. (2009). Глубоководные креветки ( Pandalus borealis , Krøyer 1838) как организм-индикатор для отходов рыбоводных хозяйств. Дж.Exp. Mar. Biol. Ecol. 381, 82–89. DOI: 10.1016 / j.jembe.2009.09.019
CrossRef Полный текст | Google Scholar
Олсен, С. А., Эрвик, А., Граль-Нильсен, О. (2012). Отслеживание отходов рыбоводных хозяйств у северных креветок Pandalus borealis (Kroyer, 1838) с использованием липидных биомаркеров. Aquacult. Environ. Interac. 2, 133–144. DOI: 10.3354 / aei00036
CrossRef Полный текст | Google Scholar
Пэрриш, К. К., Уэллс, Дж. С., Янг, З., и Дабинетт, П.(1999). Рост и липидный состав молоди гребешка Placopecten magellanicus , получавший жгутик Isochrysis galbana с различным липидным составом и диатомовую водоросль Chaetoceros muelleri . Mar. Biol. 133, 461–471. DOI: 10.1007 / s002270050486
CrossRef Полный текст | Google Scholar
Полет, Ю. М., Лоррен, А., Ричард, Дж., И Пувро, С. (2006). Экспериментальный сдвиг в рационе δ13C: потенциальный инструмент для экофизиологических исследований морских двустворчатых моллюсков. Org. Геохим. 37, 1359–1370. DOI: 10.1016 / j.orggeochem.2006.01.008
CrossRef Полный текст | Google Scholar
Пехарда, М., Жупан, И., Бавчевич, Л., Франкич, А., и Кланйчек, Т. (2007). Индекс роста и состояния мидии Mytilus galloprovincialis в экспериментальной комплексной аквакультуре. Aquacult. Res. 38, 1714–1720. DOI: 10.1111 / j.1365-2109.2007.01840.x
CrossRef Полный текст | Google Scholar
Петерсон, Б.Дж. И Фрай Б. (1987). Стабильные изотопы в экосистемных исследованиях. Annu. Rev. Ecol. Syst. 18, 293–320. DOI: 10.1146 / annurev.es.18.110187.001453
CrossRef Полный текст |
Химический состав драгоценного камня жемчуг (моти)
Драгоценный камень жемчуг
Тихий, нежный блеск и мягкость жемчуга привлекают не только женщин, но и мужчин. Жемчуг считается дефектным, если у него есть трещины на коже, родинка, тусклая.
Жемчуг бывает разных цветов — белый, черный и с оттенками желтого, синего, розового, красного, коричневого и зеленого.Натуральный жемчуг — это нежный драгоценный камень.
Плоский жемчуг ничего не стоит. Так что носить плоский жемчуг — неинтересно. Самый ценный жемчуг белого цвета и круглой формы. При надлежащем уходе драгоценные камни прослужат веками.
Ношение жемчуга защищает человека от болезней легких и желудка, болезней, связанных с водой, эмоциональных проблем и импульсивных решений. Жемчуг защищает своего владельца от злых недугов Луны.
Жемчужная композиция
Химический состав жемчуга: 82-86% карбоната кальция, 10-14% конхиолина и 2-4% воды (CaCO3 и h3O).Диапазон показателя преломления составляет от 1,530 до 1,685. Твердость по шкале Мооса 3,5 — 4. Удельный вес 2,65-2,85
[ширина таблицы = ”100%” style = ”table-Bordered table-hover” responseive = ”true”]
[table_body]
[table_row]
[row_column] Химический состав [/ row_column]
[row_column] CACO 3 [/ row_column]
[/ table_row]
[table_row]
[row_column] Индекс преломления [/ row_column]
[row_column] 1,530–1.685 [/ row_column]
[/ table_row]
[table_row]
[row_column] Плотность / row_column]
[row_column] 2.6 — 2,78
Жемчуг конхиолин — 2,85, культивированный жемчуг — 2,72 — 2,78. [/ Row_column]
[/ table_row]
[table_row]
[row_column] Цвет [/ row_column]
[row_column] Черный, белый, серый, желтый, оранжевый, красный, зеленый, синий, серебристый, кремовый, бесцветный. [/ row_column]
[/ table_row]
[table_row]
[row_column] Удельный вес [/ row_column]
[row_column] 2,65 — 2,85 [/ row_column]
[ / table_row]
[/ table_body]
[/ table]
Жемчуг часто называют «морской королевой».Ношение Жемчужины может принести гармонию и стабильность. Жемчуг относится к планете Луна с точки зрения астрологии, он символизирует чистоту, целомудрие, спокойствие и невинность.
Также излечивает психические расстройства. Драгоценный камень жемчуг популярен в астрологических целях. Драгоценный жемчуг может излечить все болезни сердца.
19 Классные химические реакции, доказывающие, что наука увлекательна
Химия может быть одной из самых завораживающих, но также и опасных наук.Смешивание определенных химикатов может вызвать довольно неожиданные реакции, которые могут быть интересны для демонстрации. Хотя некоторые реакции можно наблюдать ежедневно, например, смешивание сахара с кофе, некоторые требуют контролируемых условий для визуализации эффектов. Но есть некоторые химические реакции, наблюдать за которыми просто потрясающе, и их легко провести в химических лабораториях.
Однако для вашей безопасности самый простой выход — посмотреть видео с такими впечатляющими химическими реакциями, прежде чем вы подумаете о воспроизведении их, чтобы лучше понять уровень риска и необходимые меры безопасности.
Вот список из 19 самых потрясающих химических реакций, которые доказывают, что наука всегда крута.
1. Полиакрилат натрия и вода
Полиакрилат натрия представляет собой суперабсорбирующий полимер. Подводя итог реакции, ионы полимера притягивают воду путем диффузии. Полимер поглощает воду за секунды, что приводит к почти мгновенному превращению в гелеобразное вещество. Именно это химическое вещество используется в подгузниках для поглощения отработанной жидкости.Технически это не химическая реакция, потому что химическая структура не меняется и не происходит реакции с молекулами воды. Скорее, это демонстрация поглощения в макроуровне.
2. Диэтилцинк и воздух
Диэтилцинк — очень нестабильное соединение. При контакте с воздухом он горит с образованием оксида цинка, CO2 и воды. Реакция происходит, когда диэтилцинк вступает в контакт с молекулами кислорода. Химическое уравнение выглядит следующим образом:
Zn (C2H5) 2 + 5O2 → ZnO + 4CO2 + 5h3O
3.Цезий и вода
Источник: GiphyЦезий — один из наиболее реактивных щелочных металлов. При контакте с водой он реагирует с образованием гидроксида цезия и газообразного водорода. Эта реакция происходит так быстро, что вокруг цезия образуется водородный пузырь, который поднимается на поверхность, который затем подвергает цезий воздействию воды, вызывая дальнейшую экзотермическую реакцию, таким образом воспламеняя газообразный водород. Этот цикл повторяется до тех пор, пока не будет исчерпан весь цезий.
4. Глюконат кальция
Глюконат кальция обычно используется для лечения дефицита кальция.Однако когда он нагревается, он вызывает огромное расширение молекулярной структуры. Это приводит к образованию пены, напоминающей серую змею, вызванной испарением воды и обезвоживанием гидроксильных групп внутри соединения. Говоря менее научным языком, при нагревании глюконат кальция быстро разлагается. Реакция протекает следующим образом:
2C 12 H 22 CaO 14 + O 2 → 22H 2 O + 21C + 2CaO + 3CO 2
5. Трииодид азота
Вы можете приготовить это соединение дома, но имейте в виду, что это очень опасно.Соединение образуется в результате осторожной реакции йода и аммиака. После высыхания исходных компонентов образуется NI3 — очень реактивное соединение. Простое прикосновение пера вызовет взрыв этого очень опасного контактного взрывчатого вещества.
6. Дихромат аммония
При воспламенении дихромата аммония он разлагается экзотермически, с образованием искр, золы, пара и азота.
7. Перекись водорода и иодид калия
Когда перекись водорода и иодид калия смешиваются в надлежащих пропорциях, перекись водорода разлагается очень быстро.В эту реакцию часто добавляют мыло, чтобы в результате образовалось пенистое вещество. Мыльная вода улавливает кислород, продукт реакции, и создает множество пузырьков.
8. Хлорат калия и конфеты
Мармеладные мишки — это, по сути, просто сахароза. Когда мармеладные мишки попадают в хлорат калия, он вступает в реакцию с молекулой глюкозы в сахарозе, что приводит к сильно экзотермической реакции горения.
9. Реакция Белоусова-Жаботинского (BZ)
Реакция BZ образуется при осторожном сочетании брома и кислоты.Реакция является ярким примером неравновесной термодинамики, которая приводит к красочным химическим колебаниям, которые вы видите на видео выше.
10. Окись азота и сероуглерод
Реакция, часто называемая «лающей собакой», представляет собой химическую реакцию в результате воспламенения сероуглерода и закиси азота. Реакция дает яркую синюю вспышку и очевидный звук глухой. Реагенты реакции быстро разлагаются в процессе горения.
11. Сплав NaK и вода
Сплав NaK представляет собой металлический сплав, образованный смешением натрия и калия вне воздуха, обычно в керосине. Этот чрезвычайно реактивный материал может реагировать с воздухом, но еще более бурная реакция происходит при контакте с водой.
12. Термит и лед
Вы когда-нибудь думали, что смешивание огня и льда может привести к взрыву?
СВЯЗАННЫЕ: 11 ЛУЧШИХ ХИМИЧЕСКИХ КАНАЛОВ НА YOUTUBE
Вот что происходит, когда вы получаете небольшую помощь от Thermite, который представляет собой смесь алюминиевого порошка и оксида металла.Когда эта смесь воспламеняется, происходит экзотермическая окислительно-восстановительная реакция, то есть химическая реакция, в которой выделяется энергия в виде электронов, которые переходят между двумя веществами. Таким образом, когда термит помещается поверх льда и воспламеняется с помощью пламени, лед сразу же загорается, и выделяется большое количество тепла в виде взрыва. Однако нет какой-либо убедительной научной теории о том, почему термит вызывает взрыв. Но одно ясно из демонстрационного видео — не пробуйте это дома.
13. Колебательные часы Бриггса-Раушера
Реакция Бриггса-Раушера — одна из очень немногих колеблющихся химических реакций. Реакция дает ошеломляющий визуальный эффект за счет изменения цвета раствора. Для инициирования реакции смешивают три бесцветных раствора. Полученный раствор будет циклически менять цвет с прозрачного на янтарный в течение 3-5 минут и в итоге станет темно-синим. Три раствора, необходимые для этого наблюдения, — это разбавленная смесь серной кислоты (H 2 SO 4 ) и йодата калия (KIO 3 ), разбавленная смесь малоновой кислоты (HOOOCCH 2 COOH), моногидрат сульфата марганца. (МнСО 4 .H 2 O) и крахмал витекс и, наконец, разбавленный пероксид водорода (H 2 O 2 ).
14. Supercool Water
Вы можете не заморозить окружающую среду, как это сделала Эльза в фильме Frozen, но вы определенно можете заморозить воду прикосновением к этому классному научному эксперименту. Эксперимент с супер холодной водой заключается в охлаждении очищенной воды до -24 ° C (-11 ° F). Охлажденную бутылку можно медленно вынуть и постучать по дну или по бокам, чтобы запустить процесс кристаллизации.Поскольку очищенная вода не имеет примесей, молекулы воды не имеют ядра для образования твердых кристаллов. Внешняя энергия, обеспечиваемая в виде крана или удара, заставит молекулы переохлажденной воды образовывать твердые кристаллы посредством зародышеобразования и запустит цепную реакцию по кристаллизации воды по всей бутылке.
15. Феррожидкость
Ферромагнитная жидкость состоит из наноразмерных ферромагнитных частиц, взвешенных в жидкости-носителе, такой как органический растворитель или вода.Изначально обнаруженные Исследовательским центром НАСА в 1960-х годах в рамках исследования по поиску методов контроля жидкостей в космосе, феррожидкости при воздействии сильных магнитных полей будут создавать впечатляющие формы и узоры. Эти жидкости могут быть приготовлены путем объединения пропорций соли Fe (II) и соли Fe (III) в основном растворе с образованием валентного оксида (Fe 3 O 4 ).
16. Гигантский пузырь сухого льда
Сухой лед всегда является забавным веществом для разнообразных экспериментов.Если вам удастся найти немного сухого льда, попробуйте в этом эксперименте создать гигантский пузырь из простых материалов. Возьмите миску и наполовину наполните ее водой. Разбрызгайте жидкое мыло водой и перемешайте. Пальцами намочите края миски и добавьте в раствор сухой лед. Окуните полоску ткани в мыльную воду и протяните ее по всему краю миски. Подождите, пока пары сухого льда не задержатся внутри пузыря, который начнет постепенно расширяться.
17. Змея фараона
Змея фараона — это простая демонстрация фейерверка.Когда тиоцианат ртути воспламеняется, он распадается на три продукта, и каждый из них снова распадается на еще три вещества. Результатом этой реакции является растущий столб, напоминающий змею, с выделением пепла и дыма. Хотя все соединения ртути токсичны, лучший способ провести этот эксперимент — в вытяжном шкафу. Также существует серьезная опасность пожара. Однако самое простое решение — посмотреть видео, если у вас нет доступа к материалам.
18. Эффект Мейснера
Охлаждение сверхпроводника ниже температуры перехода сделает его диамагнитным.Это эффект, при котором объект будет отталкиваться от магнитного поля, а не тянуться к нему. Эффект Мейснера также привел к концепции транспортировки без трения, при которой объект может левитировать по рельсам, а не прикрепляться к колесам. Однако этот эффект также можно воспроизвести в лаборатории. Вам понадобится сверхпроводник и неодимовый магнит, а также жидкий азот.



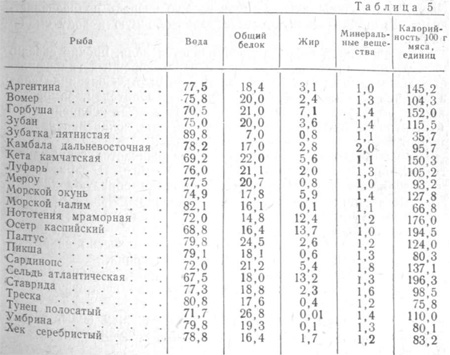
 В состав включен В6, который помогает при возникновении гинекологических заболеваний у женщины.
В состав включен В6, который помогает при возникновении гинекологических заболеваний у женщины.

 Несмотря на относительно большую калорийность семги, это блюдо ценно содержанием полезных жирных кислот, которые необходимы нашему организму и которые помогают худеть правильно.
Несмотря на относительно большую калорийность семги, это блюдо ценно содержанием полезных жирных кислот, которые необходимы нашему организму и которые помогают худеть правильно.