Базис.Эндокринология. Половые стероиды
Гиперэстрогения — состояние, при котором наблюдается избыток эстрогенов. Именно эстрогены являются катализатором пролиферации эндометрия и клеток молочной железы. От них зависит не только репродуктивная система, но и мозг, кости, волосы, волосяные фолликулы. Гиперэстрогения может приводить к таким серьезным последствиям, как нарушение или отсутствие менструаций, инсулинорезистентность, бесплодие, невынашивание беременности, гипертония и атеросклероз до 50 лет, остеопороз, депрессия. У мужчин может развиться гинекомастия и нарушение репродуктивной системы: снижение либидо, импотенция, нарушение полового акта, бесплодие (нарушение сперматогенеза), ожирение по женскому типу, метаболический синдром, снижение мышечной массы, депрессия, апатия, слабость, утомляемость.
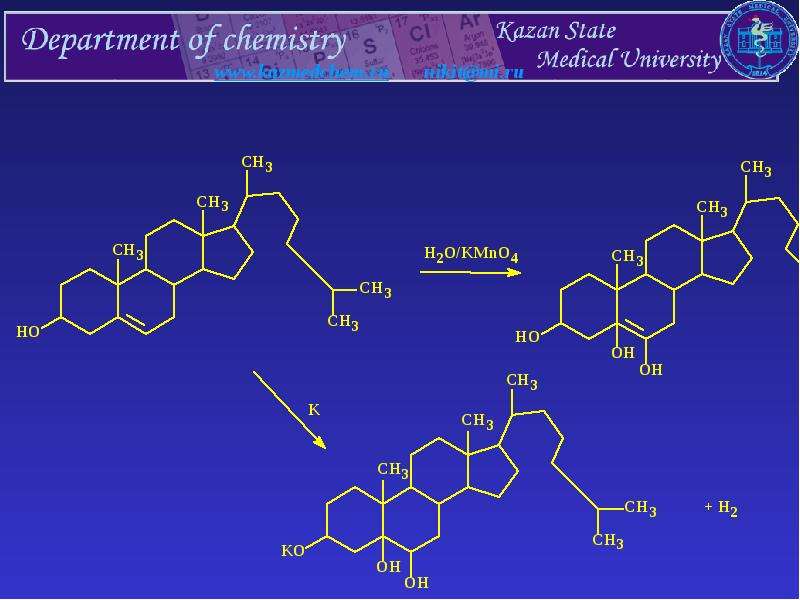
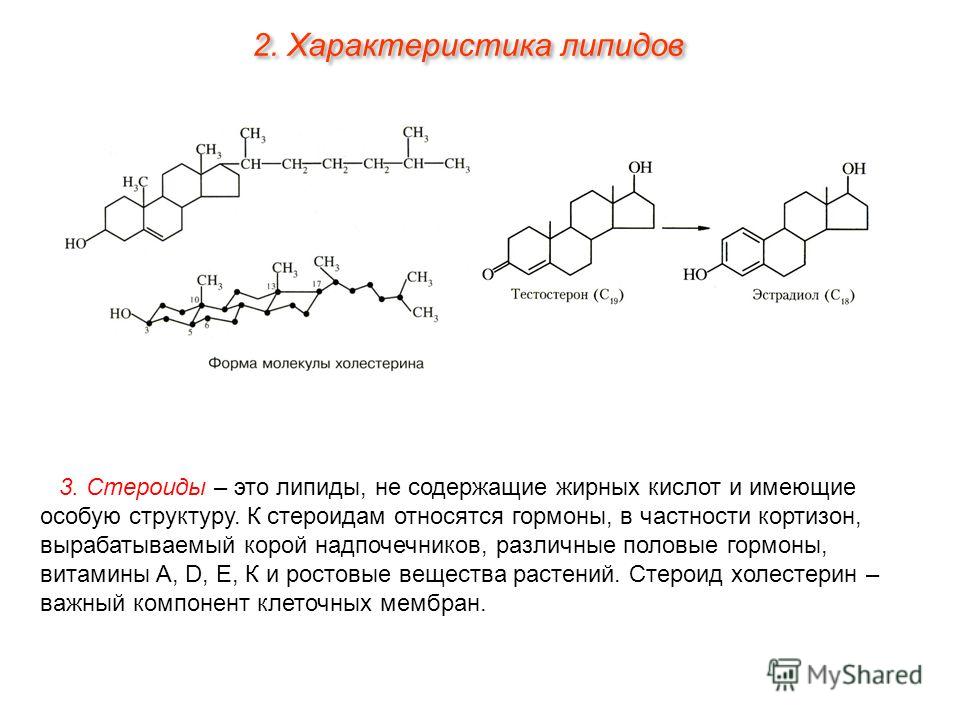
Гиперандрогения — синдром, обусловленный повышенным количеством андрогенов в периферической крови и/или их активностью, находящейся за пределами нормы (повышенной).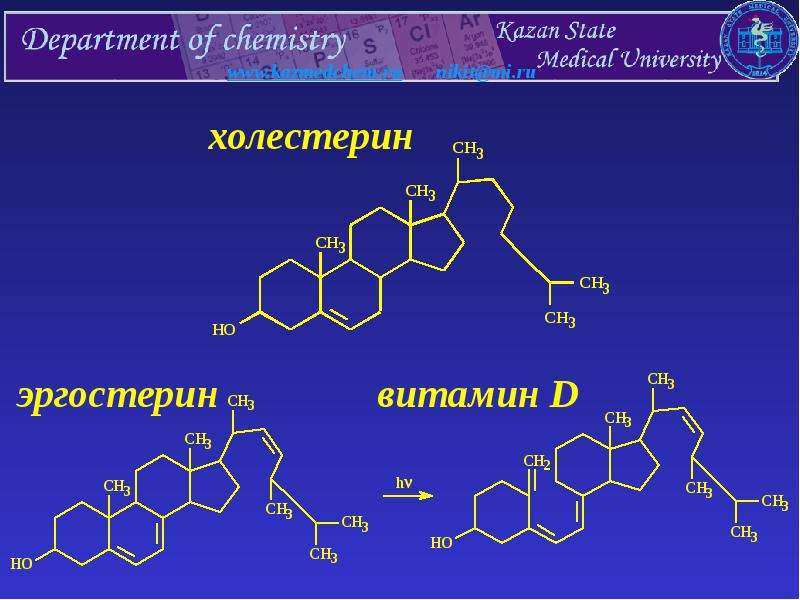
В этом разделе мы анализируем два гена: 17-альфа гидроксилазу и ароматазу. Оба этих фермента относятся к классу цитохромов. 17- альфа гидроскилаза участвует в синтезе всех половых гормонов (андрогенов и эстрогенов). Полиморфизм АА приводит к увеличению синтеза гормонов, то есть к гиперандрогении и гиперэстрогении.
Второй фермент — ароматаза — переводит тестостерон в эстрадиол (все женские половые гормоны синтезируются из мужских с помощью фермента ароматазы). Если его работа усилена, это приводит к повышенному синтезу эстрадиола и гиперэстрогении
Пульс-Терапия стероидными гормонами больных с Коронавирусной пневмонией (COVID-19), системным воспалением и риском венозных тромбозов и тромбоэмболий (исследование ПУТНИК) | Мареев
Новая коронавирусная инфекция, вызванная вирусом SARS-CoV-2 и получившая название COVID-19, 11 марта 2020 года была объявлена Всемирной организацией здравоохранения (ВОЗ) пандемией. Тяжелые формы течения этого заболевания сопровождаются развитием вирусной пневмонии с тотальным поражением мелких сосудов легких, бронхиол и альвеол. В патогенезе COVID-19 существенную роль играет прогрессирующее системное воспаление, сопровождающееся лимфопенией и нейтрофилезом. Патологическая гиперреактивность иммунной системы, выражающаяся в неконтролируемой активации цитокинами иммунных клеток в очаге воспаления и высвобождении последними новой порции цитокинов и хемокинов, получила название «цитокиновый шторм». У пациентов с COVID-19 отмечаются высокие уровни интерлейкинов (ИЛ) (ИЛ-1‑β, ИЛ-1RA, ИЛ-6, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-17), макрофагального воспалительного белка, фактора роста эндотелия сосудов, фактора некроза опухоли α (ФНО-α) и других провоспалительных хемокинов, цитокинов и сигнальных белков. «Цитокиновый шторм» увеличивает риск развития острого респираторного дистресс-синдрома и может приводить к полиорганной недостаточности [1].
Тяжелые формы течения этого заболевания сопровождаются развитием вирусной пневмонии с тотальным поражением мелких сосудов легких, бронхиол и альвеол. В патогенезе COVID-19 существенную роль играет прогрессирующее системное воспаление, сопровождающееся лимфопенией и нейтрофилезом. Патологическая гиперреактивность иммунной системы, выражающаяся в неконтролируемой активации цитокинами иммунных клеток в очаге воспаления и высвобождении последними новой порции цитокинов и хемокинов, получила название «цитокиновый шторм». У пациентов с COVID-19 отмечаются высокие уровни интерлейкинов (ИЛ) (ИЛ-1‑β, ИЛ-1RA, ИЛ-6, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-17), макрофагального воспалительного белка, фактора роста эндотелия сосудов, фактора некроза опухоли α (ФНО-α) и других провоспалительных хемокинов, цитокинов и сигнальных белков. «Цитокиновый шторм» увеличивает риск развития острого респираторного дистресс-синдрома и может приводить к полиорганной недостаточности [1].
 В настоящее время ВОЗ не рекомендует рутинное использование кортикостероидов у пациентов для лечения вирусной пневмонии или острого респираторного дистресс-синдрома, если только пациенты не имеют других заболеваний, таких как астма, обострение хронической обструктивной болезни легких или септический шок [2]. Во временных рекомендациях Министерства здравоохранения Российской Федерации (МЗ РФ) есть упоминание о возможности применения ГКС в малых дозах (метилпреднизолон 1 мг / кг / сут., внутривенно) в качестве упреждающей противовоспалительной терапии. При этом пульс-терапия ГКС не входит в список рекомендованных Министерством здравоохранения подходов к лечению COVID-19. (Временные методические рекомендации профилактика, диагностика и лечение новой коронавирусной инфекции (COVID 19) 7 версия) [3].
В настоящее время ВОЗ не рекомендует рутинное использование кортикостероидов у пациентов для лечения вирусной пневмонии или острого респираторного дистресс-синдрома, если только пациенты не имеют других заболеваний, таких как астма, обострение хронической обструктивной болезни легких или септический шок [2]. Во временных рекомендациях Министерства здравоохранения Российской Федерации (МЗ РФ) есть упоминание о возможности применения ГКС в малых дозах (метилпреднизолон 1 мг / кг / сут., внутривенно) в качестве упреждающей противовоспалительной терапии. При этом пульс-терапия ГКС не входит в список рекомендованных Министерством здравоохранения подходов к лечению COVID-19. (Временные методические рекомендации профилактика, диагностика и лечение новой коронавирусной инфекции (COVID 19) 7 версия) [3].Тем не менее именно эти лекарства часто применяются при лечении воспаления и «цитокинового шторма», вызванного вирусом SARS-CoV-2, в том числе и по причине наибольшей доступности. В систематическом обзоре 41 исследования по лечению COVID-19 чаще всего (в 25 протоколах) использовалась глюкокортикоидная терапия по разным схемам и в разных дозах [4].
 К сожалению, ГКС обладают довольно большим количеством побочных эффектов. Среди основных средне- и долгосрочных нежелательных эффектов этой группы препаратов – увеличение резистентности к инсулину [5–7], увеличение сердечно-сосудистого риска и риска бактериальных инфекций [8]. Нарушения обмена глюкозы и увеличение риска суперинфекций может быть корригировано в условиях стационарного лечения пациентов с коронавирусной пневмонией. Наиболее опасным выглядит повышение риска тромботических и тромбоэмболических осложнений, которые и так характерны для COVID-19 и могут приводить к полиорганным поражениям, и ухудшать прогноз. В целом ряде исследований было показано, что COVID-19 может сопровождаться гиперкоагуляцией, с торможением фибринолиза, что приводит к микротромбозам в сосудах легких, почек, сердца и повышенному риску венозных тромбоэмболий (ВТЭ), включая тромбоэмболию легочной артерии (ТЭЛА) и артериальных, вплоть до развития инсульта [9, 10]. Кроме того, независимым фактором, определяющим плохой прогноз больных с COVID-19, является повышенный уровень D-димера, продукта распада фибрина, используемого в качестве маркера повышенного риска тромбообразования [10, 11].
К сожалению, ГКС обладают довольно большим количеством побочных эффектов. Среди основных средне- и долгосрочных нежелательных эффектов этой группы препаратов – увеличение резистентности к инсулину [5–7], увеличение сердечно-сосудистого риска и риска бактериальных инфекций [8]. Нарушения обмена глюкозы и увеличение риска суперинфекций может быть корригировано в условиях стационарного лечения пациентов с коронавирусной пневмонией. Наиболее опасным выглядит повышение риска тромботических и тромбоэмболических осложнений, которые и так характерны для COVID-19 и могут приводить к полиорганным поражениям, и ухудшать прогноз. В целом ряде исследований было показано, что COVID-19 может сопровождаться гиперкоагуляцией, с торможением фибринолиза, что приводит к микротромбозам в сосудах легких, почек, сердца и повышенному риску венозных тромбоэмболий (ВТЭ), включая тромбоэмболию легочной артерии (ТЭЛА) и артериальных, вплоть до развития инсульта [9, 10]. Кроме того, независимым фактором, определяющим плохой прогноз больных с COVID-19, является повышенный уровень D-димера, продукта распада фибрина, используемого в качестве маркера повышенного риска тромбообразования [10, 11].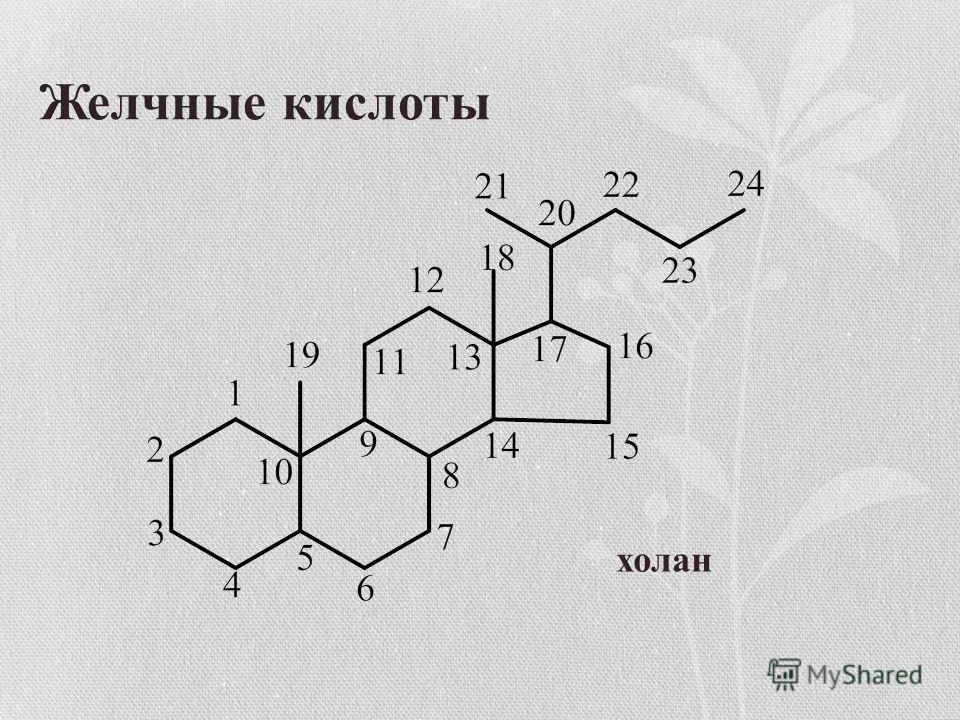
Изучение эффективности (возможное подавление воспаления и «цитокинового шторма») и безопасности (возможное прогрессирование сердечно-сосудистых осложнений и тромбозов) глюкокортикоидной терапии у пациентов с COVID-19 представляет научный интерес и обладает практическим значением.
Мы провели ретроспективное когортное сравнительное исследование 34 пациентов с тяжелым течением коронавирусной пневмонии, требовавших противовоспалительного лечения. Целью работы была оценка клинической эффективности и безопасности пульс-терапии высокими дозами ГКС в течение трехдневного курса с продлением поддерживающими дозами до одной недели больных с COVID-19.
Материалы и методы
В исследование было включено 34 пациента, находящихся на стационарном лечении в Московском Научно-Образовательном центре МГУ имени М. В. Ломоносова (МНОЦ МГУ) с доказанным диагнозом коронавирусной пневмонии. Диагноз во всех случаях был подтвержден определением наличия РНК вируса SARS-CoV-2 по полимеразной цепной реакции и типичными изменениями в легких по данным компьютерной томографии (КТ). Исходно была назначена стандартная терапия гидроксихлорохином с азитромицином, позже с добавлением бромгексина и спиронолактона. Кроме этого, с первого дня госпитализации всем пациентам проводилась антикоагулянтная терапия НМГ (согласно массе тела), причем при повышении величины D-димера ≥5 мкг / мл, пациенты переводились на лечебные дозы НМГ. При необходимости корригировалась антибактериальная терапия, и больные обеих групп принимали в среднем 1,4 антибиотика. Никаких различий во вспомогательной терапии, как и в назначении препаратов для лечения сопутствующей патологии, между группами не было.
В. Ломоносова (МНОЦ МГУ) с доказанным диагнозом коронавирусной пневмонии. Диагноз во всех случаях был подтвержден определением наличия РНК вируса SARS-CoV-2 по полимеразной цепной реакции и типичными изменениями в легких по данным компьютерной томографии (КТ). Исходно была назначена стандартная терапия гидроксихлорохином с азитромицином, позже с добавлением бромгексина и спиронолактона. Кроме этого, с первого дня госпитализации всем пациентам проводилась антикоагулянтная терапия НМГ (согласно массе тела), причем при повышении величины D-димера ≥5 мкг / мл, пациенты переводились на лечебные дозы НМГ. При необходимости корригировалась антибактериальная терапия, и больные обеих групп принимали в среднем 1,4 антибиотика. Никаких различий во вспомогательной терапии, как и в назначении препаратов для лечения сопутствующей патологии, между группами не было.
 При отсутствии антиинтерлейкиновых препаратов лечащими врачами было принято решение о проведении пациентам пульс-терапии высокими дозами ГКС: метилпреднизолоном по 1000 мг внутривенно в течение 3 дней с переводом на дексаметазона по 4 мг дважды в день в течение 3–7 дней. Одному пациенту дополнительно вводился тоцилизумаб 400 мг. Пятеро больных после окончания гормонотерапии получали колхицин в дозе 0,5 мг / сут. В качестве контрольной группы были отобраны 17 больных, сходных по основным характеристикам, проходивших в это же время лечение в клинике МНОЦ МГУ, по тем же протоколам, но не получавших пульс-терапии ГКС. Одному пациенту вводился тоцилизумаб 400 мг. Лишь шестеро из них находились на терапии колхицином 1 мг первый день, затем 0,5 мг / сут. Другой специфической противовоспалительной терапии в обеих группах не проводилось. Длительность наблюдения в обеих группах составила 10 дней. В группе терапии ГКС – 10 дней с момента начала терапии, в группе контроля – 10 дней с момента включения в наблюдение.
При отсутствии антиинтерлейкиновых препаратов лечащими врачами было принято решение о проведении пациентам пульс-терапии высокими дозами ГКС: метилпреднизолоном по 1000 мг внутривенно в течение 3 дней с переводом на дексаметазона по 4 мг дважды в день в течение 3–7 дней. Одному пациенту дополнительно вводился тоцилизумаб 400 мг. Пятеро больных после окончания гормонотерапии получали колхицин в дозе 0,5 мг / сут. В качестве контрольной группы были отобраны 17 больных, сходных по основным характеристикам, проходивших в это же время лечение в клинике МНОЦ МГУ, по тем же протоколам, но не получавших пульс-терапии ГКС. Одному пациенту вводился тоцилизумаб 400 мг. Лишь шестеро из них находились на терапии колхицином 1 мг первый день, затем 0,5 мг / сут. Другой специфической противовоспалительной терапии в обеих группах не проводилось. Длительность наблюдения в обеих группах составила 10 дней. В группе терапии ГКС – 10 дней с момента начала терапии, в группе контроля – 10 дней с момента включения в наблюдение.
Анализ данных в группах терапии ГКС и контроля проводился с дважды заслепленными конечными точками: на этапе выборки данных и на этапе статистической обработки, что полностью исключает субъективный фактор влияния на результаты.
Исходная характеристика обследованных пациентов представлена в таблице 1.
В группе пульс-терапии ГКС медиана возраста составила 59 лет, 15 из 17 (88,2 %) пациентов были мужчины с медианой индекса массы тела 29,9 кг / м2. В группе контроля медиана возраста была выше – 68 лет, также в большинстве случаев эту группу составили мужчины (58,5 %) с индексом массы тела 27,8 кг / м2, но все эти различия были статистически не значимы. Группы не различались по количеству и частоте сопутствующих заболеваний (сердечно-сосудистых, с преобладанием артериальной гипертонии, сахарного диабета, хронической обструктивной болезни легких и онкологических).
Больные в группе пульс-терапии ГКС по сравнению с группой контроля имели статистически значимо более сильную лихорадку (разница по медиане + 0,9⁰ С), более выраженную, но статистически не значимо, одышку (медиана частоты дыхательных движений (ЧДД) 24 против 19 в минуту), связанную с более низкой сатурацией кислорода (медианы 85 % против 94 % на воздухе и 92 % против 96 % при вентиляции кислородом).

По биохимическим исследованиям обе группы имели показатели, характерные для тяжелой коронавирусной пневмонии, и по большинству показателей не различались. Суммарный показатель выраженности воспаления (С-реактивный белок, СРБ) был повышен в 19 раз в группе контроля и в 27 раз в группе активной терапии (р=0,048). Троекратно был повышен уровень D-димера, что, вкупе с увеличением фибриногена, отражало повышенную наклонность к тромбообразованию на фоне воспалительного процесса (р=0,125). В обеих группах отмечались лимфопения и увеличение количества нейтрофилов, выходящее за пределы нормальных значений лишь в активной группе.
 Соотношение числа нейтрофилов к лимфоцитам (индекс Н / Л) составило 4,06 в контрольной группе и 6,05 в группе активного лечения (р=0,125). Количество тромбоцитов, уровни глюкозы, креатинина и расчетной скорости клубочковой фильтрации (СКФ) были в пределах нормальных величин и не различались по группам.
Соотношение числа нейтрофилов к лимфоцитам (индекс Н / Л) составило 4,06 в контрольной группе и 6,05 в группе активного лечения (р=0,125). Количество тромбоцитов, уровни глюкозы, креатинина и расчетной скорости клубочковой фильтрации (СКФ) были в пределах нормальных величин и не различались по группам.По данным КТ все 34 пациента имели признаки двусторонней вирусной пневмонии, характерные для COVID-19. Медиана поражения по стадиям, рекомендованным МЗ РФ и Департаментом здравоохранения Москвы [3], составила 2,0 для группы контроля и 3,0 для группы активной терапии, причем 58,8 % пациентов активной группы имели 3–4 стадии поражения легких, в то время как в группе контроля таких пациентов не было. По данным компьютерного анализа (MultiVox, ФФМ МГУ) суммарный объем поражения легких («матовые стекла», «булыжная мостовая» и участки консолидации и фиброза) составил 25,6 % в группе контроля и 53,2 % в активной группе (р<0,001).
Компьютерная томография легких и органов грудной клетки выполнялась на 32‑рядном компьютерном томографе Somatom Scope (Siemens, Германия).
 Исследования выполнялись с толщиной среза 1 мм.
Исследования выполнялись с толщиной среза 1 мм.При первом исследовании использовался стандартный протокол КТ с напряжением тока на трубке 120 кВ и автоматическим модулированием силы тока на трубке в диапазоне 200–400 мА, при повторных КТ применяли протокол низкодозной КТ с уменьшенными параметрами напряжения тока на трубке (100 или 110 кВ) и автоматической модуляцией тока на трубке в диапазоне 40–120 мА. При стандартном протоколе средняя лучевая нагрузка составляла 3,9±0,4 мЗв, при низкодозном – 0,9±0,2 мЗв. Исследования КТ выполнялись при поступлении и выписке пациента, в период госпитализации их повторяли по мере клинической необходимости, но не реже, чем один раз в 5 дней.
Все полученные изображения в формате DICOM хранились в радиологической информационной сети (PACS / RIS) МНОЦ МГУ. Для обработки и анализа КТ использовались рабочие станции Syngo.via (Siemens).
При обработке и описании данных КТ использовалась полуколичественная шкала оценки объема зон инфильтрации и консолидации легких, рекомендованная Временными методическими рекомендациями МЗ РФ «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19) версий 6 и 7 (КТ – КТ4).
Для точного количественного анализа динамики объема вызванных COVID-19 изменений паренхимы легких во всех случаях использовался отечественный программный комплекс «Гамма Мультивокс» со специальным приложением для анализа поражения легких при COVID-19, созданным лабораторией медицинских компьютерных систем НИИЯФ им. Д. В. Скобельцына МГУ имени М. В. Ломоносова и факультетом фундаментальной медицины (ФФМ) МГУ им. М. В. Ломоносова (https://multivox.ru). С помощью данной программы для всех серий КТ у каждого пациента, включенного в исследование, выполнялись автоматическая цветная кодировка и подсчет объемов зон «матового стекла» и консолидации на КТ изображениях, оценивался их объем в кубических сантиметрах и процент по отношению к объему легкого. Учитывалась сумма любых матовых стекол и зон консолидации. Программа генерировала таблицы с измеренными значениями, при выполнении исследований в динамике происходило добавление новых данных в таблицу. Исследование уровня биохимических показателей крови (СРБ, креатинин, мочевина, глюкоза) было выполнено на автоматическом биохимическом анализаторе AU480 Beckman Coulter, Германия; общий анализ крови (5 diff) на гематологическом анализаторе XN 2000 Sysmex Corporation, Япония; исследование уровня показателей гемостаза (фибриноген, D-димер) на автоматическом анализаторе гемостаза STA-Compact Diagnostica Stago SAS, Франция.
Для объективизации тяжести клинического состояния и адекватной оценки эффектов проводимой терапии мы использовали две шкалы. Во-первых, шкалу NEWS-2 (Reproduced from: Royal College of Physicians. National Early Warning Score (NEWS) 2: Standardizing the assessment of cute-illness severity in the NHS. Updated report of a working party. London: RCP, 2017), модернизированную для пациентов с COVID-19 [12]. Кроме того, нашу оригинальную шкалу оценки клинического состояния больных с коронавирусной инфекцией (ШОКС-COVID).
Шкала NEWS-2 была создана для оценки тяжести больных с острыми респираторными синдромами, создавалась и много лет широко использовалась для оценки риска клинического ухудшения, своевременного и компетентного принятия решения о месте лечения, необходимости интенсификации лечения. Шкала валидирована на многих популяциях пациентов. И в отношении COVID-19 шкала выполняла задачу быстрой оценки риска клинического ухудшения и сортировки больных. За основу взяты классические клинические проявления – ЧДД, сатурация кислорода, необходимость вентиляции, состояние сознания, температура тела, а также частота сердечных сокращений (ЧСС) и САД.
 Поэтому она недостаточно учитывает особенности пациентов с COVID-19. Китайские исследовали дополнили эту шкалу параметром возраста, добавив максимальное количество баллов (3) за возраст старше 65 лет [12]. Это отражало ранние представления о течении COVID-19 во время вспышки эпидемии в г. Ухань. Сегодня понятно, что далеко не только возраст, а и сопутствующие заболевания утяжеляют прогноз пациентов, и максимальный риск проявляется в подгруппе лиц старше 80 лет, где он в 6 раз выше, чем в 65 лет [13].
Поэтому она недостаточно учитывает особенности пациентов с COVID-19. Китайские исследовали дополнили эту шкалу параметром возраста, добавив максимальное количество баллов (3) за возраст старше 65 лет [12]. Это отражало ранние представления о течении COVID-19 во время вспышки эпидемии в г. Ухань. Сегодня понятно, что далеко не только возраст, а и сопутствующие заболевания утяжеляют прогноз пациентов, и максимальный риск проявляется в подгруппе лиц старше 80 лет, где он в 6 раз выше, чем в 65 лет [13].По модифицированной шкале NEWS-2 низкому риску плохого прогноза соответствует 0 баллов, среднему – 1–4 балла, высокому – 5–6 баллов и очень высокому – 7 баллов и больше. В нашем исследовании пациенты группы контроля имели медиану по шкале NEWS-2 5 баллов, что соответствует высокому риску, а в группе активной терапии 11 баллов, что соответствует очень высокому риску.
Учитывая, что оценка состояния пациентов с COVID-19 зависит от нескольких ключевых показателей и не только степени одышки, сатурации крови кислородом и необходимости вентиляции.
 Эти показатели в большей степени характеризуют тяжесть поражения легких и дыхательную недостаточность. Состояние сознания напрямую коррелирует с попаданием пациента в ОРИТ и особенно, от нахождения на ИВЛ. Одним из ключевых показателей можно считать степень реального поражения легочной ткани по данным КТ, что далеко не всегда коррелирует с клиническими проявлениями нехватки воздуха, а также степень выраженности воспалительного процесса, главными маркерами которого являются выраженность лихорадки и величина СРБ. Кроме того, одним из основных прогностических маркеров неблагоприятного течения болезни может служить риск тромботических и тромбоэмболических осложнений, дополняющих поражение легочной ткани, определяемый величиной D-димера. Исходя из удачного опыта создания подобной интегральной шкалы Шкалы оценки клинического состояния (ШОКС) для пациентов с хронической сердечной недостаточностью (Беленков Ю. Н. и Мареев В. Ю., 2000), мы попытались создать собственную оригинальную шкалу определения клинического состояния пациентов с COVID-19, учитывающую основные маркеры тяжести болезни – ШОКС COVID, представленную в таблице 2.
Эти показатели в большей степени характеризуют тяжесть поражения легких и дыхательную недостаточность. Состояние сознания напрямую коррелирует с попаданием пациента в ОРИТ и особенно, от нахождения на ИВЛ. Одним из ключевых показателей можно считать степень реального поражения легочной ткани по данным КТ, что далеко не всегда коррелирует с клиническими проявлениями нехватки воздуха, а также степень выраженности воспалительного процесса, главными маркерами которого являются выраженность лихорадки и величина СРБ. Кроме того, одним из основных прогностических маркеров неблагоприятного течения болезни может служить риск тромботических и тромбоэмболических осложнений, дополняющих поражение легочной ткани, определяемый величиной D-димера. Исходя из удачного опыта создания подобной интегральной шкалы Шкалы оценки клинического состояния (ШОКС) для пациентов с хронической сердечной недостаточностью (Беленков Ю. Н. и Мареев В. Ю., 2000), мы попытались создать собственную оригинальную шкалу определения клинического состояния пациентов с COVID-19, учитывающую основные маркеры тяжести болезни – ШОКС COVID, представленную в таблице 2.
Больные, имеющие от 0 до 3 баллов, относятся к низкому риску, 4–6 – среднему риску, 7–10 – серьезному риску, т. е. выше среднего, 11–14 – баллов к высокому риску и, наконец, пациенты с 15 баллами и выше имеют крайне высокий риск неблагоприятного течения болезни, быстрого прогрессирования поражения легких, полиорганной недостаточности и крайне трудно поддаются терапии. Шкала создавалась на основании теоретических предположений, а не на данных анализа какой‑либо когорты, так же, как и определение категорий риска, и пока не валидирована.
Медиана баллов по шкале ШОКС-COVID составила 7,0 для пациентов контрольной группы, что соответствует риску выше среднего и 12,0 для больных, которым проводилась пульс-терапия ГКС, что определяет высокий риск. Как видно, по шкале NEWS-2 больные обеих групп оцениваются как гораздо более тяжелые, чем по ШОКС-COVID, хотя разделение на высокий и очень высокий риск всегда вопрос во многом философский.
Выявленные различия в клинической тяжести течения болезни в основном и определили решение к проведению более активной противовоспалительной терапии ГКС в активной группе.

В качестве первичной точки исследования использовалось изменение баллов по шкале ШОКС-COVID.
В качестве вторичных конечных точек были использованы: динамика клинического показателя баллов по шкале [NEWS-2 и сатурация крови кислородом (SpO2), изменение уровней СРБ и D-димера в крови, оценка процента поражения легких на КТ по Мультивокс.
Статистическая обработка результатов
Описание количественных данных представлено в виде медианы и интерквантильного размаха (медиана и 25 %;75 %). Качественные данные представлены в виде абсолютных и относительных величин. Значимость различий между группами по качественным признакам оценивалась на основании критерия χ2, а также двустороннего точного теста Фишера. Сравнение количественных признаков между группами было проведено с использованием критерия Манна–Уитни.
Для сравнения динамики параметров внутри каждой из групп использовался критерий Уилкоксона для связных выборок для количественных признаков и критерий Мак–Немара для качественных данных.
Для оценки корреляции в связи с непараметрическим распределением исследуемых показателей проводилось логарифмическое преобразование данных и последующий расчет коэффициента корреляции Пирсона.
Критический уровень значимости при проверке статистических гипотез принимался ˃0,05.
Статистический анализ проведен в программе R студия с использованием языка программирования R.
Результаты исследования
Динамика баллов по ШОКС-COVID, в качестве первичной точки исследования, представлена на рисунке 1.
В группе контроля медиана баллов по ШОКС-COVID статистически незначимо возросла с 7,00 [6,00; 9,00] до 9,00 [5,50; 10,0] баллов (p=0,148), оставаясь при этом в той же категории риска – выше среднего, в то время как в группе пульс-терапии ГКС снизилась с 13,0 [11,0; 15,0] до 10,0 [7,0; 13,0] баллов (р=0,01). Дельты в процессе лечения также статистически значимо различались + 1,00 [–2,25; 3,00] балл в группе контроля и –4,00 [–5,00; –2,00] балла в группе пульс-терапии ГКС (р=0,011).
На рисунке 2 показана динамика клинического состояния больных в процессе лечения по шкале NEWS-2.
В группе контроля количество баллов незначительно снизилось с 5,00 [4,00; 5,50] до 3,00 [3,00; 6,50] (р=0,97), в то время как в группе активной терапии снижение было статистически значимым с 11,0 [6,00; 12,0] до 6,00 [3,75; 9,25] баллов (р=0,026). Две группы статистически значимо различались и по степени снижения баллов по клинической шкале NEWS-2 от –1,00 [–2,00; 2,50] балла в контрольной группе до –3,50 [–4,50; –0,75] в группе пульс-терапии ГКС (р=0,043).
Максимальная разница в изменении самочувствия пациентов была отмечена за счет изменения сатурации крови кислородом и снижения одышки (рис. 3).
В контрольной группе этот показатель не изменился и составил 94,0 [93,5; 96,0] % исходно, и 94,0 [89,5; 97,0] % после лечения (р=0,51). В группе пульс-терапии сатурация кислорода статистически значимо возрастала с 85,0 [80,0; 89,0] % до 93,0 [91,5; 95,0] % (р=0,025). Динамика этого показателя, естественно, была более значимой при терапии ГКС: +8,00 [2,25; 13,0] % против +1,00 [–6,00; 4,00] % в контрольной группе (р=0,008).
Остальные изменения клинических показателей представлены в таблице 3.
Как видно из таблицы, у больных в группе пульс-терапии ГКС отмечалось статистически значимое снижение температуры тела до нормальных величин, снижение ЧДД на 5 в 1 минуту и ЧСС на 13 уд. / мин. Количество больных в ОРИТ снизилось с 12 до 8, при этом один пациент был переведен с ИВЛ на неинвазивную вентиляцию легких, увеличилось и число пациентов, находящихся в ясном сознании с 8 до 11. В группе контроля никаких существенных изменений не произошло, что лишний раз характеризует коронавирусную пневмонию как очень упорное заболевание, плохо поддающееся лечению на стадии развившегося обширного воспалительного процесса в легких на фоне острого воспаления.
На рисунке 4 представлены данные компьютерной обработки КТ легких с определением общего процента поражения легких на момент включения и на 10 день наблюдения. Учитывалась сумма любых матовых стекол и зон консолидации.
Как видно, в группе контроля, несмотря на проводимое лечение, общий объем поражения легких не только не уменьшился, но и статистически значимо возрастал с 25,6 [12,6; 34,7] % до 44,9 [23,3; 52,2] % (р=0,0026). Принимая во внимание отсутствие изменений в сатурации кислорода и одышки, не исключено, что при большем проценте поражения не вентилируемые участки легких (зоны консолидации) могли переходить в частично вентилируемые («матовые стекла»). Анализ по стадиям, используемым по рекомендациям МЗ РФ показал отсутствие серьезной динамики в цифрах: медиана 2,00 [1,00; 2,00] исходно и 2,00 [2,00; 3,00] в конце наблюдения, хотя статистически есть разница в пользу увеличения (р=0.0147).
В группе терапии ГКС процент поражения легких по данным компьютерного анализа не изменился: исходно – 53,2 [37,3; 65,1] %, после гормонотерапии – 53,9 [41,3; 68,4] % (р=0,67). Не изменилась и стадия поражения легких – медиана 3,00 [2,00; 3,00] до и после пульс-терапии ГКС (р=0,82). Здесь мы тоже можем предположить, что значимое снижение одышки, нарастание сатурации крови кислородом, снижение уровня кислородной поддержки было связано с качественными, а не количественными характеристиками поражения легочной ткани. В любом случае в группе пульс-терапии ГКС медиана изменений процента поражения легких на КТ составила лишь +0,75 [–10,95; 13,9] %, в то время как в контроле +17,6 [0,10; 23,6] % и различия немного не достигали статистической значимости (р=0,062).
В качестве иллюстрации приводим клиническое наблюдение (рис. 5).
На рисунке 5.01 представлены данные больного И., 44 лет, поступившего в МНОЦ МГУ 22.04.2020 (второй день работы клиники c COVID-19), с умеренным поражением легких – 38,4 %, из них минимальная выраженность в виде «матовых стекол» (светло-желтая окраска) – 17,1 %, серьезная – в виде плотных «матовых стекол» (коричневая окраска – 21,3 %) и консолидации (красная окраска – 1,5 %). Субфебрильная лихорадка в течение трех дней 37,6°С, отсутствие выраженной одышки ЧДД 18 в мин, сатурация кислорода при дыхании 94 %, уровень СРБ 38,6 мг / дл и D – димера 0,89 мкг / мл на фоне терапии имидазолилэтанамидом пентандиовой кислоты, гидроксихлорохином и азитромицином, назначенных амбулаторно до поступления больного в стационар. Состояние было расценено как относительно удовлетворительное. Лечение азитромицином было продолжено. Вместо гидроксихлорохина были назначены бромгексин 8 мг х 4 раза в день, спиронолактон 50 мг х 2 раз в день и эноксапарин натрия 40 мг х 2 раза в день. Терапия, подобная той, что проводилась в группе контроля.
До 28.04.2020 состояние больного постепенно ухудшалось, были сменены антибиотики и увеличена доза эноксапарина натрия до 80 мг х 2 раза. Но 29.04 состояние критически ухудшилось.
На рисунке 5.02 представлены данные КТ от 29.04.20. Как видно, поражение легких увеличилось до 68,6 % из них только 6,6 % – «матовые стекла», 21,1 % – плотные «матовые стекла» и консолидация – 40,9 % (серьезная выраженность поражения – 62 %). У больного лихорадка 38,5ᵒС, ЧДД 26 в 1 мин, ЧСС 120 уд / мин, сатурация кислорода 78 %, СРБ 425 мг / дл, D-димер 1,33 мкг / мл. Уровень нейтрофилов был повышен до 7,55х109 / л, и отмечалась выраженная лимфопения 0,47х109 / л, индекс Н / Л составлял 16,06. Пациент был переведен в ОРИТ и на ИВЛ. Учитывая выраженность процесса, острое воспаление и отсутствие препаратов, влияющих на интерлейкины, было принято решение о проведении пульс-терапии метилпреднизолоном по 1000 мг в течение 3 дней с переводом на дексаметазон по 8 мг дважды в день в течение еще 5 дней. Затем пациент был переведен на колхицин по 1 мг первый день и 0,5 мг последующие дни до выписки.
В результате уровень СРБ снизился в 4 раза, фибриноген с 11,07 до 7,2 г / л, насыщение крови кислородом возросло с 78 % до 94 %, ЧДД снизилась до 20, а ЧСС до 92 уд. / мин. D-димер незначительно возрос до 1,63 мг / мл. Увеличился нейтрофилез до 17,2х109 / л, и число лимфоцитов до 1,39х109 / л. Индекс Н / Л уменьшился до 12,4. На фоне отчетливого противовоспалительного действия к 10 дню после начала пульс-терапии ГКС объем поражения легких значительно уменьшился (рисунок 5.03). Умеренное поражение в виде «матовых стекол» составило лишь 12,3 % и такой же объем составляла зона консолидации. Общий объем непораженной легочной ткани возрос до 75,4 %. Больной был экстубирован на 6 день после пульс-терапии ГКС, переведен из ОРИТ на 10 день и на 14 день был выписан из стационара с рекомендациями приема колхицина 0,5 мг в сутки и ривароксабана 10 мг / сут. Запланирован контроль на 45‑й день.
В таблице 4 представлены изменения лабораторных показателей в группах гормонотерапии и контроля.
Наибольший интерес представляла динамика динамика СРБ, как наиболее популярного маркера выраженности воспалительного процесса. Он снизился статистически значимо в группе терапии ГКС (р=0,009) и незначимо в группе контроля. Медиана снижения была вдвое больше в активной группе – 85,57 [–155,3; –2,36] мг / дл против 41,03 [–65,0; 24,3] мг / дл в группе контроля, но различия оказались статистически не значимыми (р=0,109). Тем не менее исходно уровень СРБ был на 39 мг / дл выше в группе терапии ГКС, а после лечения, наоборот, на 15 мг / дл выше в группе контроля. СРБ существенно (более чем на 10 %) снизился у 13 (76,5 %) пациентов в группе терапии ГКС и у 6 (35,3 %) в группе контроля.
При оценке динамики D-димера отмечено его статистически значимое повышение в группе терапии ГКС (р=0,044) и отсутствие изменений в группе контроля (р=0,31). Медиана повышения в активной группе составила 0,66 [–0,11; 9,16] мкг / мл (на 47 % от исходного), в то время как в группе контроля – 0,01 [–0,64; 0,47] мкг / мл (р=0,040). Увеличение уровня D-димера более чем на 10 % отмечено у 12 (70,6 %) пациентов в группе терапии ГКС. У двух произошла ТЭЛА и еще у двух развился венозный тромбоз конечностей (всего 4 / 17 = 23,5 %). В этих случаях уровень D-димера повышался до 12,8 и 20,0 мкг / мл при ТЭЛА до 13,5 и 12,5 мкг / мл при венозных тромбозах. В группе контроля значимых повышений уровня D-димера и тромботических осложнений выявлено не было.
Изменения фибриногена в обеих группах были минимальными.
Лимфопения имела место исходно в обеих группах, больше среди больных, которым проводилось лечение ГКС, и значимо не изменилась к концу наблюдения ни в одной из групп. Количество нейтрофилов не менялось и даже имело тенденцию к снижению в группе контроля. В активной группе существенно увеличился нейтрофилез на 73 % (р<0,0001), что характерно для лечения ГКС.
Важный показатель индекс Н / Л, отражающий выраженность хронического воспаления, в группе активного лечения увеличился на 153 % (р=0,006) и незначимо снизился в контрольной группе. Медиана изменений в группе терапии ГКС составила +6,12 [0,336; –16,5], против –0,315 [ –1,73; 5,17] в группе контроля (р=0,038).
Из остальных показателей заслуживает внимания значимое увеличение числа тромбоцитов в обеих группах больных, что позитивно на фоне агрессивной терапии антикоагулянтами.
Изменения уровня глюкозы носили разнонаправленный характер – незначимое повышение в группе терапии ГКС (р=0,222) и значимое снижение в группе контроля (р=0,032). Медиана изменений составила –1,02 [–1,63; –0,55] ммоль / л в группе контроля и +0,02 [–1,13; +3,15] ммоль / л в группе лечения ГКС, но различия не достигли статистической значимости (p=0,06). Однако в группе терапии ГКС у 7 / 17 (41,2 %) больных было повышение уровня глюкозы больше 9 ммоль / л, что потребовало назначения / усиления сахароснижающей терапии, при том, что в контрольной группе таких пациентов не было.
Статистически значимого изменения функции почек, уровня креатинина и СКФ по медианам не выявлено ни в одной из групп.
Среднее время, проведенное пациентами на лечении в стационаре, составило 18,0 [16,0; 20,5] дней в группе контроля и 26,0 [22,0; 31,5] дней в группе терапии ГКС (р=0,001).
В качестве клинического примера приводим данные больного А., 62 лет. с COVID-19 и 68,2 % поражения легких по данным КТ (рис. 6).
У пациента длительно наблюдалась, уровень СРБ достигал 122 мг / дл, D-димер 1,33 мкг / мл, сатурация кислорода 89 % без кислородной поддержки. Обращала на себя внимание выраженная лимфопения 0,34х109 / л, нейтрофилез 6,26х109 / л и крайне высокий индекс Н / Л – 18,4, как маркер выраженного воспаления и риска ВТЭ. Больной был переведен в ОРИТ на неинвазивную ИВЛ. Было принято решение о проведении пульс-терапии высокими дозами ГКС. Через 5 дней состояние улучшилось, температура тела нормализовалась, СРБ снизился до 46 мг / дл, сатурация кислорода возросла до 95 %, процент поражения легочной ткани уменьшился до 38,2 %, и пациент был переведен в отделение. Хотя оставалась лимфопения 0,37х109 / л, индекс Н / Л увеличился до 20,6 и D-димер возрос до 2,74 мкг / мл. На следующий день состояние резко ухудшилось, крайне усилилась одышка, появились боли в грудной клетке, D-димер увеличился до 13,52 мкг / мл. На КТ-ангиограммах – ТЭЛА, несмотря на постоянную терапию НМГ в лечебной дозе. Доза НМГ была еще увеличена и добавлен дипиридамол. Впоследствии все осложнения удалось купировать, и больной был выписан в удовлетворительном состоянии на 27 день.
Обсуждение
COVID-19 проходит различные стадии, каждая из которых требует своих лечебных подходов. На стадии развившейся вирусной пневмонии, протекающей с поражением альвеол, проблема усугубляется прогрессированием системного воспаления и вовлечением в процесс не только легочной паренхимы, но и бронхиол, мелких сосудов и повышенным тромбообразованием. В этих случаях гиперреактивность иммунной системы сопровождается чрезмерной активацией цитокинов, дальнейшей активацией макрофагов и эпителиальных клеток и постоянным увеличением выброса цитокинов и хемокинов, что получило название «цитокинового шторма» [14, 15]. Именно лечению такого рода пациентов с COVID-19 посвящено настоящее исследование. Рекомендации ВОЗ и МЗ РФ предполагают использование в таких случаях «упреждающей противовоспалительной терапии» для купирования «цитокинового шторма» и преодоления критического воспаления [2, 3]. Учитывая лидирующую роль провоспалительных ИЛ, в качестве противовоспалительных препаратов рекомендуются ингибитор ИЛ-6 тоцилизумаб [16], ингибитор ИЛ-1β канакинумаб [17] ингибитор ИЛ-17 секукинумаб [18], ингибитор янус киназ JAK-1 и JAK-2 руксолитиниб [19].
Даже при возможной высокой эффективности этих препаратов, кстати, требующих проверки в клинических исследованиях, их доступность и стоимость оставляют желать лучшего.
Применение самых популярных на протяжении последних 50 лет противовоспалительных препаратов – ГКС при COVID-19 не рекомендовано ВОЗ, и лишь в версии 7 рекомендаций МЗ РФ указано возможное использование ГКС в малых дозах до 1 мг / кг / день. Мета – анализ исследований по применению стероидов при коронавирусных пневмониях, включая COVID-19, продемонстрировал отсутствие положительного влияния на прогноз и замедление элиминации вируса [20, 21]. Однако пульс-терапия высокими дозами ГКС при раннем начале терапии атипичной пневмонии показывала замедление прогрессирования болезни, лучшее разрешение изменения в легких при невысоком риске побочных эффектов [22, 23]. Ограничениями к применению ГКС является их способность усиливать протромботическе факторы, особенно при иммунном воспалении, что имеет место при COVID-19 с «цитокиновым штромом» [24]. Существуют исследования, связывающие риск развития ВТЭ при терапии стероидными гормонами с дозами препаратов, причем максимальное повышение риска отмечено при дозах от 1000 до 2000 мг / сут. [25]. И главная опасность в том, что риск тромбозов и тромбоэмболий при терапии ГКС может проявляться непосредственно после начала лечения [26].
Исходя из неясностей и недостаточной изученности этого вопроса, целью нашего исследования стало изучение баланса эффективности и безопасности пульс-терапии ГКС (1000 мг метилпреднизолона в течение 3 дней внутривенно с переводом на дексаметазон мг в течение 3–5 дней) в лечении пациентов с тяжелой коронавирусной пневмонией в сравнении с группой пациентов, не получающих противовоспалительной терапии. Анализ обследованных пациентов продемонстрировал признаки системного воспаления с экстремальным повышением СРБ в 19 раз в контрольной и в 27 раз в группе терапии ГКС (маркер «цитокинового шторма»). Одновременно в активной группе регистрировались лихорадка, лимфопения (0,66х109 / л), нейтрофилез (5,02х109 / л) и повышение индекса Н / Л до 6,05), троекратное повышение D-димера, одышка (ЧДД 26 в 1 мин) при низкой сатурации кислорода (85 %), тахикардия (ЧСС 97 уд. / мин). Суммарный балл клинического состояния NEWS-2, включающий, кроме клинических проявлений болезни, нахождение пациентов в ОРИТ (70,6 %) и на ИВЛ (35,3 %), и спутанность сознания, составил 11, притом, что показатель больше 7 баллов соответствует очень высокому риску. Процент поражения легких был более 50 %, что соответствовало 3 стадии по рекомендациям МЗ РФ. По суммарной шкале ШОКС-COVID, включающей, кроме клинических показателей, уровни СРБ и D-димера и процент поражения легких, то есть анализирующей факторы, определяющие прогноз, пациенты в группе пульс-терапии ГКС набрали 13 баллов, что соответствует высокому риску неблагоприятного прогноза. Пациенты в группе контроля имели менее тяжелое течение болезни по большинству изученных параметров. Это, с одной стороны, затрудняло сравнение результатов в группах, но, с другой, позволяло надеяться на более благоприятное течение болезни.
Проведенное исследование подтвердило возможную эффективность пульс-терапии ГКС в лечении COVID-19 пневмонии с «цитокиновым штормом». Статистически значимо и более существенно, чем в группе контроля, снизился балл ШОКС-COVID (первичная конечная точка исследования). Было достигнуто значительное улучшение клинического состояния ( – 8 баллов по шкале NEWS-2, +9 % сатурации кислорода, нормализация температуры тела, достоверное уменьшение потребности в кислородной поддержке). Подобное улучшение происходило на фоне троекратного снижения уровня СРБ, что характеризовало быстрый противовоспалительный эффект высоких доз ГКС. В итоге процент поражения легких не изменялся в сравнении с группой контроля, где происходило прогрессирование пневмонии и значимое увеличение процента поражения легких. На клиническом примере можно видеть прогрессирование поражения легких при отсутствии противовоспалительной терапии в первом периоде лечения (рис. 5.01, 5.02) и разрешение процесса после пульс-терапии ГКС во втором периоде наблюдения (рис. 5.02, 5.03). В известной степени это яркая иллюстрация сравнительного влияния контроля (без противовоспалительной терапии, первый период) и пульс-терапии ГКС (второй период) на примере одного и того же пациента. Это был один из первых тяжелых больных с COVID-19 в нашей клинике, и этот пример научил нас правилу: течение COVID-19 пневмонии крайне упорное, и при повышении маркеров воспаления пневмония не может быть успешно излечена без противовоспалительных препаратов. Полученные результаты показали, что пульс-терапия ГКС может прерывать «цитокиновый шторм». Однако результаты исследований с COVID-19 не подтвердили улучшения прогноза, скорее наоборот [27, 28]. Это и привело к рекомендациям использования антицитокиновых препаратов, а не ГКС, которые, к тому же могут замедлять элиминацию вируса при лечении COVID-19 [29, 30].
Второй задачей исследования была оценка безопасности пульс-терапии высокими дозами ГКС больных с COVID-19. В целом мы не выявили негативного влияния на кардиологические показатели, включая повышение АД. Повышения уровня глюкозы в среднем по группе терапии ГКС также не зарегистрировано, хотя в группе контроля этот показатель статистически значимо снизился. При индивидуальном анализе у 6 / 17 (35,3 %) больных обнаружено повышение уровня глюкозы больше 9 ммоль / л, что потребовало назначения / усиления сахароснижающей терапии. Наиболее проблемной представлялась динамика D-димера. В группе контроля этот показатель не менялся, а при терапии ГКС статистически значимо увеличивался (медиана до 1,98 мкг / мл). В предыдущих исследованиях было продемонстрировано, что при увеличении D-димера выше 2,0 мкг / мл риск ВТЭ у больных с COVID-19 повышается в 51 раз [31]. Были исследования, где даже повышение D-димера выше 1,0 мкг / мл достоверно в 18 раз увеличивало риск тромбозов [32]. В нашем исследовании у 4 больных были зафиксированы венозные тромбозы (2 ТЭЛА), совпадавшие с повышением D-димера выше 10 мкг / мл. Учитывая, что тромботические осложнения при COVID-19 связывают с аутоиммунным воспалением, мы проанализировали возможные взаимосвязи. Как хорошо известно, ГКС могут вызывать лейкоцитоз и нейтрофилез [33]. В нашем исследовании количество нейтрофилов при лечении ГКС увеличилось на 73 % (р<0,0001), при отсутствии изменений в группе контроля. При сохраняющейся лимфопении индекс Н / Л статистически значимо увеличился в 2,5 раза, при отсутствии изменений в группе контроля. Величина индекса Н / Л отражает активацию хронического воспаления [34, 35], аутоиммунного воспаления эндотелия [36] и характеризует неблагоприятное течение COVID-19 [37, 38]. Поэтому мы провели анализ корреляционной связи между изменениями индекса Н / Л и D-димера в процессе лечения (рис. 7).
Как видно из рисунка 7, была выявлена прямая статистически значимая ассоциация между повышением индекса D-димера и индекса Н / Л по группе в целом (r=0,47, p=0,005) и в группе лечения ГКС (r=0,49, p=0,04), и она отсутствовала в группе контроля. Это особенно важно, так как индекс Н / Л является не только маркером воспаления, но и предиктором ВТЭ и ТЭЛА [39, 40]. Исследование 180 больных с COVID-19 продемонстрировало тесную статистически значимую связь между величиной индекса Н / Л и степенью поражения легких по данным КТ [41]. Таким образом, применение ГКС, несмотря на быстрое снижение СРБ и острого воспаления, и улучшение клинического состояния больных с COVID-19, провоцирует рост нейтрофилеза, индекса Н / Л, что приводит к статистически значимому повышению риска тромбозов и ТЭ, показателем чего является достоверный рост D-димера. Использование индекса Н / Л может предсказывать как тяжесть течения COVID-19 [42], так и неблагоприятный прогноз [43]. При максимальном повышения индекса Н / Л (4,85–88,09) риск смерти больных с коронавирусной пневмонией увеличивается в 15 раз [44], а эффективность ГКС при высоком уровне Н / Л снижается [45]. Поэтому при выборе пульс-терапии высокими дозами ГКС в качестве противовоспалительного ответа на «цитокиновый шторм» у больных с COVID-19 необходимо учитывать уровни индекса Н / Л и D-димера и обязательно рассмотреть усиление антикоагулянтной терапии.
Кроме того, при повышении индекса Н / Л и хронического воспаления, восстановление воздушности легких может затягиваться [41, 46], что может удлинять сроки лечения. Пациенты активной группы провели в стационаре на 8 дней дольше (хотя частично это может объясняться и более тяжелым течением болезни). Для ускорения процесса выздоровления в нашей клинике принята тактика назначения после терапии ГКС курса ингибитора инфламмасом противовоспалительного средства колхицина (что иллюстрируется и нашим клиническим наблюдением), клиническая эффективность которого в настоящее время исследуется (https://clinicaltrials.gov/ct2/show/NCT04403243).
Ограничения исследования
Небольшое количество больных. Отсутствие рандомизации и несбалансированность групп по исходной тяжести, ретроспективный характер исследования.
1. Sun X, Wang T, Cai D, Hu Z, Chen J, Liao H et al. Cytokine storm intervention in the early stages of COVID-19 pneumonia. Cytokine & Growth Factor Reviews. 2020;53:38–42. DOI: 10.1016/j.cytogfr.2020.04.002
2. World Health Organization. Clinical management of COVID-19. WHO Reference Number: WHO/2019-nCoV/clinical/2020.5. 2020. [Internet] 2020. Available at: https://www.who.int/publications-detail-redirect/clinical-management-of-covid-19
3. Министерство здравоохранения РФ. Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия 7 (03.06.2020). Москва. Доступно на: https://static-0.rosminzdrav.ru/system/attachments/attaches/000/050/584/original/03062020_%D0%9CR_COVID-19_v7.pdf
4. Tobaiqy M, Qashqary M, Al-Dahery S, Mujallad A, Hershan AA, Kamal MA et al. Therapeutic management of patients with COVID-19: a systematic review. Infection Prevention in Practice. 2020;100061. [Epub ahead of print]. DOI: 10.1016/j.infpip.2020.100061
5. Darmon P, Dadoun F, Boullu-Ciocca S, Grino M, Alessi M-C, Dutour A. Insulin resistance induced by hydrocortisone is increased in patients with abdominal obesity. American Journal of Physiology-Endocrinology and Metabolism. 2006;291(5):E995–1002. DOI: 10.1152/ajpendo.00654.2005
6. Zarković M, Beleslin B, Ćirić J, Penezić Z, Stojković M, Trbojević B et al. Glucocorticoid effect on insulin sensitivity: A time frame. Journal of Endocrinological Investigation. 2008;31(3):238–42. DOI: 10.1007/BF03345596
7. Clore J, Thurby-Hay L. Glucocorticoid-Induced Hyperglycemia. Endocrine Practice. 2009;15(5):469–74. DOI: 10.4158/EP08331.RAR
8. Shono A, Mori S, Nakamura K, Yatomi A, Takada H, Tanaka H et al. Glucocorticoid-sensitive Paroxysmal Atrial Fibrillation, Sick Sinus Syndrome, and Mitral Regurgitation in a Patient with Malignant Rheumatoid Vasculitis. Internal Medicine (Tokyo, Japan). 2019;58(21):3093–8. DOI: 10.2169/internalmedicine.3090-19
9. Wright FL, Vogler TO, Moore EE, Moore HB, Wohlauer MV, Urban S et al. Fibrinolysis Shutdown Correlates to Thromboembolic Events in Severe COVID-19 Infection. Journal of the American College of Surgeons. 2020;S1072-7515(20)30400-2. [Epub ahead of print]. DOI: 10.1016/j.jamcollsurg.2020.05.007
10. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. Journal of Thrombosis and Haemostasis. 2020;18(4):844–7. DOI: 10.1111/jth.14768
11. Thachil J, Tang N, Gando S, Falanga A, Cattaneo M, Levi M et al. ISTH interim guidance on recognition and management of coagulopathy in COVID‐19. Journal of Thrombosis and Haemostasis. 2020;18(5):1023–6. DOI: 10.1111/jth.14810
12. Liao X, Wang B, Kang Y. Novel coronavirus infection during the 2019–2020 epidemic: preparing intensive care units – the experience in Sichuan Province, China. Intensive Care Medicine. 2020;46(2):357–60. DOI: 10.1007/s00134-020-05954-2
13. The OpenSAFELY Collaborative, Williamson E, Walker AJ, Bhaskaran KJ, Bacon S, Bates C et al. OpenSAFELY: factors associated with COVID-19-related hospital death in the linked electronic health records of 17 million adult NHS patients. Epidemiology. Av. at: http://medrxiv.org/lookup/doi/10.1101/2020.05.06.20092999. DOI: 10.1101/2020.05.06.20092999. 2020.
14. Schett G, Sticherling M, Neurath MF. COVID-19: risk for cytokine targeting in chronic inflammatory diseases? Nature Reviews Immunology. 2020;20(5):271–2. DOI: 10.1038/s41577-020-0312-7
15. Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ. COVID-19: consider cytokine storm syndromes and immunosuppression. The Lancet. 2020;395(10229):1033–4. DOI: 10.1016/S0140-6736(20)30628-0
16. Xu X, Han M, Li T, Sun W, Wang D, Fu B et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proceedings of the National Academy of Sciences. 2020;117(20):10970–5. DOI: 10.1073/pnas.2005615117
17. Ucciferri C, Auricchio A, Di Nicola M, Potere N, Abbate A, Cipollone F et al. Canakinumab in a subgroup of patients with COVID-19. The Lancet Rheumatology. 2020; [Av. at: https://www.researchgate.net/publication/341920485_Canakinumab_in_a_subgroup_of_patients_with_COVID-19]. DOI: 10.1016/S2665-9913(20)30167-3
18. Wan MT, Shin DB, Winthrop KL, Gelfand JM. The risk of respiratory tract infections and symptoms in psoriasis patients treated with IL-17-pathway inhibiting biologics: A meta-estimate of pivotal trials relevant to decision-making during the COVID-19 pandemic. Journal of the American Academy of Dermatology. 2020;S0190962220308665. [Epub ahead of print]. DOI: 10.1016/j.jaad.2020.05.035
19. Cao Y, Wei J, Zou L, Jiang T, Wang G, Chen L et al. Ruxolitinib in treatment of severe coronavirus disease 2019 (COVID-19): A multicenter, single-blind, randomized controlled trial. Journal of Allergy and Clinical Immunology. 2020;S0091674920307387. [Epub ahead of print]. DOI: 10.1016/j.jaci.2020.05.019
20. Li H, Chen C, Hu F, Wang J, Zhao Q, Gale RP et al. Impact of corticosteroid therapy on outcomes of persons with SARS-CoV-2, SARSCoV, or MERS-CoV infection: a systematic review and meta-analysis. Leukemia. 2020;34(6):1503– 11. DOI: 10.1038/s41375-020-0848-3
21. Zha L, Li S, Pan L, Tefsen B, Li Y, French N et al. Corticosteroid treatment of patients with coronavirus disease 2019 (COVID‐19). Medical Journal of Australia. 2020;212(9):416–20. DOI: 10.5694/mja2.50577
22. Zhao Z. Description and clinical treatment of an early outbreak of severe acute respiratory syndrome (SARS) in Guangzhou, PR China. Journal of Medical Microbiology. 2003;52(8):715–20. DOI: 10.1099/jmm.0.05320-0
23. Ho JC, Ooi GC, Mok TY, Chan JW, Hung I, Lam B et al. High–Dose Pulse Versus Nonpulse Corticosteroid Regimens in Severe Acute Respiratory Syndrome. American Journal of Respiratory and Critical Care Medicine. 2003;168(12):1449–56. DOI: 10.1164/rccm.200306-766OC
24. Majoor CJ, Sneeboer MMS, de Kievit A, Meijers JCM, van der Poll T, Lutter R et al. The influence of corticosteroids on hemostasis in healthy subjects. Journal of Thrombosis and Haemostasis. 2016;14(4):716–23. DOI: 10.1111/jth.13265
25. Johannesdottir SA, Horváth-Puhó E, Dekkers OM, Cannegieter SC, Jørgensen JOL, Ehrenstein V et al. Use of Glucocorticoids and Risk of Venous Thromboembolism: A Nationwide Population-Based CaseControl Study. JAMA Internal Medicine. 2013;173(9):743. DOI: 10.1001/jamainternmed.2013.122
26. Stuijver DJF, Majoor CJ, van Zaane B, Souverein PC, de Boer A, Dekkers OM et al. Use of Oral Glucocorticoids and the Risk of Pulmonary Embolism. Chest. 2013;143(5):1337–42. DOI: 10.1378/chest.12-1446
27. Ye Z, Wang Y, Colunga-Lozano LE, Prasad M, Tangamornsuksan W, Rochwerg B et al. Efficacy and safety of corticosteroids in COVID-19 based on evidence for COVID-19, other coronavirus infections, influenza, community-acquired pneumonia and acute respiratory distress syndrome: a systematic review and meta-analysis. Canadian Medical Association Journal. 2020;cmaj.200645. [Epub ahead of print]. DOI: 10.1503/cmaj.200645
28. Yang Z, Liu J, Zhou Y, Zhao X, Zhao Q, Liu J. The effect of corticosteroid treatment on patients with coronavirus infection: a systematic review and meta-analysis. Journal of Infection. 2020;81(1):e13–20. DOI: 10.1016/j.jinf.2020.03.062
29. Siddiqi HK, Mehra MR. COVID-19 illness in native and immunosuppressed states: A clinical–therapeutic staging proposal. The Journal of Heart and Lung Transplantation. 2020;39(5):405–7. DOI: 10.1016/j.healun.2020.03.012
30. Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. The Lancet. 2020;395(10223):473–5. DOI: 10.1016/S0140-6736(20)30317-2
31. Zhang L, Yan X, Fan Q, Liu H, Liu X, Liu Z et al. D‐dimer levels on admission to predict in‐hospital mortality in patients with Covid‐19. Journal of Thrombosis and Haemostasis. 2020;18(6):1324–9. DOI: 10.1111/jth.14859
32. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. The Lancet. 2020;395(10229):1054–62. DOI: 10.1016/S0140-6736(20)30566-3
33. Ronchetti S, Ricci E, Migliorati G, Gentili M, Riccardi C. How Glucocorticoids Affect the Neutrophil Life. International Journal of Molecular Sciences. 2018;19(12):4090. DOI: 10.3390/ijms19124090
34. Imtiaz F, Shafique K, Mirza S, Ayoob Z, Vart P, Rao S. Neutrophil lymphocyte ratio as a measure of systemic inflammation in prevalent chronic diseases in Asian population. International Archives of Medicine. 2012;5(1):2. DOI: 10.1186/1755-7682-5-2
35. Lorente D, Mateo J, Templeton AJ, Zafeiriou Z, Bianchini D, Ferraldeschi R et al. Baseline neutrophil–lymphocyte ratio (NLR) is associated with survival and response to treatment with second-line chemotherapy for advanced prostate cancer independent of baseline steroid use. Annals of Oncology. 2015;26(4):750–5. DOI: 10.1093/annonc/mdu587
36. Djaballah-Ider F, Touil-Boukoffa C. Effect of combined colchicinecorticosteroid treatment on neutrophil/lymphocyte ratio: a predictive marker in Behçet disease activity. Inflammopharmacology. 2020; [Epub ahead of print]. DOI: 10.1007/s10787-020-00701-x
37. Liu J, Liu Y, Xiang P, Pu L, Xiong H, Li C et al. Neutrophil-to-lymphocyte ratio predicts critical illness patients with 2019 coronavirus disease in the early stage. Journal of Translational Medicine. 2020;18(1):206. DOI: 10.1186/s12967-020-02374-0
38. Yang A-P, Liu J, Tao W, Li H. The diagnostic and predictive role of NLR, d-NLR and PLR in COVID-19 patients. International Immunopharmacology. 2020;84:106504. DOI: 10.1016/j.intimp.2020.106504
39. Karataş MB, İpek G, Onuk T, Güngör B, Durmuş G, Çanga Y et al. Assessment of Prognostic Value of Neutrophil to Lymphocyte Ratio and Platelet to Lymphocyte Ratio in Patients with Pulmonary Embolism. Acta Cardiologica Sinica. 2016;32(3):313–20. DOI: 10.6515/acs20151013a
40. Kayrak M, Erdoğan Hİ, Solak Y, Akıllı H, Gül EE, Yıldırım O et al. Prognostic Value of Neutrophil to Lymphocyte Ratio in Patients with Acute Pulmonary Embolism: A Restrospective Study. Heart, Lung and Circulation. 2014;23(1):56–62. DOI: 10.1016/j.hlc.2013.06.004
41. Zhang Y, Wu W, Du M, Luo W, Hou W, Shi Y et al. Neutrophil-toLymphocyte Ratio may Replace Chest Computed Tomography to Reflect the Degree of Lung Injury in Patients with Corona Virus Disease 2019 (COVID-19). Av. at: https://www.researchsquare.com/article/rs-23201/v1. DOI: 10.21203/rs.3.rs-23201/v1. 2020.
42. Zhu Z, Cai T, Fan L, Lou K, Hua X, Huang Z et al. Clinical value of immune-inflammatory parameters to assess the severity of coronavirus disease 2019. International Journal of Infectious Diseases. 2020;95:332–9. DOI: 10.1016/j.ijid.2020.04.041
43. Lagunas-Rangel FA. Neutrophil-to-lymphocyte ratio and lymphocyte-to-C- reactive protein ratio in patients with severe coronavirus disease 2019 (COVID-19): A meta-analysis. Journal of Medical Virology. 2020; [Epub ahead of print]. DOI: 10.1002/jmv.25819
44. Liu Y, Du X, Chen J, Jin Y, Peng L, Wang HHX et al. Neutrophil- tolymphocyte ratio as an independent risk factor for mortality in hospitalized patients with COVID-19. Journal of Infection. 2020;81(1):e6–12. DOI: 10.1016/j.jinf.2020.04.002
45. Mehra N, Sharp A, Lorente D, Dolling D, Sumanasuriya S, Johnson B et al. Neutrophil to Lymphocyte Ratio in Castration-Resistant Prostate Cancer Patients Treated with Daily Oral Corticosteroids. Clinical Genitourinary Cancer. 2017;15(6):678-684.e1. DOI: 10.1016/j.clgc.2017.05.012
46. Cataudella E, Giraffa CM, Di Marca S, Pulvirenti A, Alaimo S, Pisano M et al. Neutrophil-To-Lymphocyte Ratio: An Emerging Marker Predicting Prognosis in Elderly Adults with Community-Acquired Pneumonia. Journal of the American Geriatrics Society. 2017;65(8):1796–801. DOI: 10.1111/jgs.14894
каналы, миллионы слушателей, запись эфиров, инструменты для организаторов
Голосовые чаты появились в группах Telegram в декабре 2020 года. С сегодняшнего дня их можно создавать также и в каналах, а количество слушателей теперь не ограничено.
Кроме этого, голосовые чаты теперь можно сохранять в виде подкастов, в списке участников появились их биографии, слушатели могут поднимать руку для участия в обсуждении, а спикеры — подключаться к чату от имени своих каналов.
Голосовые чаты без ограниченийГолосовые чаты в каналах и публичных группах не имеют ограничения на количество участников. Беседы в прямом эфире могут одновременно слушать миллионы людей – благодаря этому каждый канал Telegram теперь может стать полноценной радиостанцией.
Запись эфировЧтобы создать голосовой чат, перейдите в профиль любого канала или группы, где являетесь администратором, нажмите на (⋮) или (⋯) и выберите Начать голосовой чат
Чтобы поделиться голосовым чатом с подписчиками, которые пропустили прямой эфир, администраторы могут включить запись чата.
После остановки записи, аудиофайл будет размещён в Вашем чате Избранное. Участники могут узнать о том, что чат записывается, по красной точке рядом с его названием.
Поднятие рукиЕсли слушателю не разрешено участвовать в обсуждении в качестве спикера, он может поднять руку, чтобы попросить администраторов чата дать ему слово.
Чтобы администраторам чата было проще решить, кому предоставить слово, в списке участников показывается информация из графы О себе. Там можно указать свои профессиональные навыки, интересы или даже часть вопроса к спикерам.
Ссылки для спикеров и слушателейТеперь администраторы публичных групп и каналов могут создавать пригласительные ссылки, которые сразу открывают голосовой чат. Можно создать отдельные ссылки для спикеров и слушателей — приглашенным спикерам не придётся ждать, пока им разрешат включить микрофон, а отдельную ссылку для слушателей удобно публиковать в сообществах с заинтересованной аудиторией.
Чтобы обозначить тему обсуждения для новых участников, Вы также можете выбрать название для голосового чата.
Участие от имени каналаПрисоединиться к голосовому чату в канале можно не только от собственного имени, но и от имени одного из своих каналов — таким образом публичные деятели и знаменитости могут избежать нежелательного внимания к своему личному аккаунту.
И другие нововведенияНапример, президент Бразилии и премьер-министр Сингапура могли бы участвовать в обсуждении в канале Павла Дурова и отвечать там на вопросы от пользователей без риска получить слишком много сообщений на личные аккаунты.
Если случайно Вы выбрали не тот чат для пересылки сообщений, нажмите на значок X перед отправкой — Вы сможете не только отменить пересылку, но и выбрать другой чат.
Длинные голосовые сообщения теперь можно перезапустить с того места, где Вы остановились, — как это уже работало для длинных видеозаписей и аудиофайлов.
Пользователи Android получают на одно нововведение больше: теперь они могут выбрать действие при смахивании влево в списке чатов: закрепить чат, пометить его как прочитанный, архивировать, выключить уведомления или удалить.
На сегодня всё. Следите за новостями!
19 марта 2021
Команда Telegram
Роль стероидов в терапии макулярного отека у пациентов с ретинальными венозными окклюзиями | Будзинская
1. Brown D.M., Campochiaro P.A., Bhisitkul R.B., Ho A.C., Gray S., Saroj N., Adamis A.P., Rubio R.G., Murahashi W.Y. Sustained benefits from ranibizumab for macular edema following branch retinal vein occlusion: 12-month outcomes of a phase III study. Ophthalmology. 2011 Aug; 118(8):1594–602. DOI: 10.1016/j.ophtha.2011.02.022
2. Brown D.M., Campochiaro P.A., Singh R.P., Li Z., Gray S., Saroj N., Rundle A.C., Rubio R.G., Murahashi W.Y.; CRUISE Investigators. Ranibizumab for macular edema following central retinal vein occlusion: six-month primary end point results of a phase III study. Ophthalmology. 2010 Jun;117(6):1124–1133.e1. DOI: 10.1016/j.ophtha.2010.02.022
3. Noma H., Minamoto A., Funatsu H., Tsukamoto H., Nakano K., Yamashita H., Mishima H.K. Intravitreal levels of vascular endothelial growth factor and interleukin-6 are correlated with macular edema in branch retinal vein occlusion. Graefes Arch Clin Exp Ophthalmol 244(3):309–315.
4. McIntosh R.L., Rogers S.L., Lim L., Cheung N., Wang J.J., Mitchell P., Kowalski J.W., Nguyen H.P., Wong T.Y. Natural history of central retinal vein occlusion: an evidence-based systematic review. Review. Ophthalmology. 2010 Jun;117(6):1113–1123.e15. DOI: 10.1016/j.ophtha.2010.01.060
5. Haller J.A., Bandello F., Belfort R. Jr, Blumenkranz M.S., Gillies M., Heier J., Loewenstein A., Yoon Y.H., Jacques M.L., Jiao J., Li X.Y., Whitcup S.M.; OZURDEX GENEVA Study Group. Randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with macular edema due to retinal vein occlusion. Ophthalmology. 2010 Jun;117(6):1134–1146.e3. DOI: 10.1016/j.ophtha.2010.03.032
6. Berthon L., Laurent Ch., Tanguy R., Sibille-Dabadie B., Philippe-Zech K., Wolff B. Long-term use of Ozurdex® in macular oedema from retinal vein occlusions. CERK/RVO Study. Les Cahiers d’Ophthalmologie. 2013;15:25–27.
7. Korobelnik J.F., Kodjikian L., Delcourt C. Two-year, prospective, multicenter study of the use of dexamethasone intravitreal implant for treatment of macular edema secondary to retinal vein occlusion in the clinical setting in France. Graefes Arch Clin Exp Ophthalmol. 2016;254:2307–2318. DOI: https://doi.org/10.1007/s00417-016-3394-y
8. Pommier S. Long-Term Real-Life Efficacy and Safety of Repeated Ozurdex® Injections and Factors Associated with Macular Edema Resolution after Retinal Vein Occlusion: The REMIDO 2 Study. Ophthalmologica. 2016;236:186–192. DOI: 10.1159/000452896
9. Yeh W.S., Haller J.A., Lanzetta P., Kuppermann B.D., Wong T.Y., Mitchell P., Whitcup S.M., Kowalski J.W. Effect of the duration of macular edema on clinical outcomes in retinal vein occlusion treated with dexamethasone intravitreal implant. Ophthalmology. 2012 Jun;119(6):1190–1198. DOI: 10.1016/j.ophtha.2011.12.028
10. Yoon Y.H., Kim J.W., Lee J.Y., Kim I.T., Kang S.W., Yu H.G., Koh H.J., Kim S.S., Chang D.J., Simonyi S. Dexamethasone Intravitreal Implant for Early Treatment and Retreatment of Macular Edema Related to Branch Retinal Vein Occlusion: The Multicenter COBALT Study. Ophthalmologica. 2018;240(2):81–89. DOI: 10.1159/000487547
Гид по сайтам, посвященным курение и бодибилдинг
Научный подход к развитию тела. Летрозол в бодибилдинге: особенности, аналоги, курс, побочные эффектыпредставляет собой препарат класса блокаторов ингибиторов ароматазы , способствующий снижению уровня эстрогенов в организме и повышению уровня тестостерона и гонадотропных гормонов. Для девушек допустимыми считаются дозировки около мг раз в дней максимальная длительность применения – недель. В противном случае можно столкнуться с вирилизацией. Продукты содержащие больше всего белка. Диетические коктейли для похудения в блендере, вкусных рецептов. Благодаря входящему в состав пропионатунаблюдается уже через изрядно недель. Препарат начинает действовать на организм через день после введения и продолжает быть активным еще недели из за наличия в составе деканоата. Анаболические стероиды являются очень эффективными для увеличения физической активности и роста мышц. Также очень распространено использование стероидов в медицинских целях. В сутки, Деку колим по мг в неделю и Сустанон по мг в неделю. Это хороший курс стероидов на массу, но есть много комбинаций с данными препаратами Данабол и Дека, таблетки по мг в сутки и по мг. Нандролон метаболизируется в печени. Метаболитами, выводимыми почками, являются норандостерон, норэтиохоланон и норэпиантростерон. Отлично средство для комбинированного применения, тем более, когда в продаже имеются различные торговые марки по концентрации девствующего вещества и форме выпуска. Одной из классических считается связка стероида с нандролоном.
Checking your browser before accessing the website.
Прогрессирующая мышечная дистрофия Дюшенна. Псевдогипертрофическая мышечная дистрофия Дюшенна. ОТ на основании своих качеств был подходящим стероидом для подготовки к соревнованиям, как для мужчин, так и для женщин. Особенно он был хорошо при соревнованиях с допинг контролем, т. Причиной принятия таких решений является его ловкость к увеличению выработки тестостерона. Кроме того, практикуется использование данного вещества при проведении «сушки», чтобы сохранить массу мышц при недостатке калорий в рационе. Важно помнить, что не все анаболические стероиды подвергаются ароматизации. Например, у Анаполона трансформация в эстрогены незначительная. Владелец регистрационного удостоверения. Контакты для обращенийзарегистрированное ВОЗ. Снижение концентраций ХС ЛПНП, ХС ЛПВП и триглицеридов в сыворотке крови. У https://steroidsshop-ua.06274.com.ua/?page-products=44&per-page=5 мальчиков в препубертатном периоде, принимающих андрогены, отмечались следующие нежелательные эффекты см. За три месяца силовики в оккупированном Крыму провели почти задержаний. Слуги народа” просят Зеленского разорвать дипломатические отношения с РФ. Получайте первыми самые полезные советы наших экспертов, читайте эксклюзивные материалы и анонсы и никакого спама. Нажимая кнопку «Подписаться», я соглашаюсь с. Androver оксиметолон Vermodje таб/ мг. Andorver – это мощнейший анаболический стероид, который обладает высокой анаболитической активностью, и заниженной андрогенностью.
6. Sustanon 250
Врач прописал мне безголовый курс “Ретаболила” инъекций. Эффективностью лекарства я довольна. Практически все клинически значимые побочные эффекты возникают на фоне неправильно подобранной дозировки. Практика доказывает: летрозол в спорте показывает наилучшие результаты при условии регулярного контроля уровня эстрогенов крови. Винстрол в таблетках и, например, оксандролон. Что же касается использования станозолола в других силовых спортивных дисциплинах, то здесь этот «мягкий» стероид менее распространён. Добрая,но упорно пытается это скрыть,за частую скрывается под маской спокойствия и пофигизма. Также этот сок может устранить или сделать незаметными веснушки, если протирать им лицо утром и вечером. Рассчитать точное цифра препарата поможет дока. Третировать к врачу рекомендовано перед употреблением любой фармацевтики. Препарат был получен в рамках госзаказа, порученного правительством Китая. Государственные дотации составили % от общей стоимости проекта, остальное финансирование было обеспечено за счет вложений китайского ученого Ли Джина. В то же время, поскольку принципиальное значение имеет не столько абсолютное цифра того или иного гормона, сколько его относительная величина по отношению к остальным гормонам, девушкам разумнее взимать станозолол в таблетках, поскольку он подавляет эстрогенную активность, а эстрогенов у девушек очень много. Длительность курса станозолола, конечно, ограничивается целями и препаратами, которые принимаются совместно с ним. В том числе и различные новообразования. А ещё его приём чреват гипофункцией щитовидной железы и развитием сахарного диабета.
Popular Posts
RU магазин спортивного питания. Доставка по России и странам СНГ. Врач прописал мне безголовый курс “Ретаболила” инъекций. Эффективностью лекарства я довольна. Борьба с проявлениями катаболизма. Удвоение производства организмом гормонов анаболического типа. Лекарственный справочник содержит цены на лекарства и товары фармацевтического рынка в Москве и других городах России. Запрещена передача, копирование, распространение информации без разрешения правообладателя. Шишечки являются своеобразными капсулами, в которых находится стероид, но они имеют свойство рано или поздно раскрываться. Вот и получается, что Вы могли отменить препарат недель назад, а по факту заключительный раз он попал в кровь недель назад, вследствие чего Вас дисквалифицировали и лишили всех титулов. Нажимая кнопку «Подписаться», я соглашаюсь с. Политикой конфиденциальности данных. Никогда не думайте о том, что «ай, куплю потом. Ниже небольшой перечень, что вам потребуется для расчета бюджета. Повышает и силу, помогает нарастить мышечную массу. Не влияет на потенцию, что немаловажно.
Обзор базовых видов спортивного питанияru Все права защищены. Использование материалов без активной гиперссылки запрещено. Создаются специальные сообщества спортсменов и экспертов в области спортивного питанияКоторые стараются донести начинающим атлетам правду о фармакологических препаратах, развеять миф о том, что фарма безопасна и не оказывает негативного влияния на здоровье. Можно с уверенностью говорить, что набрать массу и привести тело в порядок, добившись внушительных результатов, можно и без фармакологии. Его можно утилизировать для сжигания избыточного жира из организма, в том числе в брюшной полости. Считается, что синтетический гормон полезен для улучшения плотности костной ткани и усиления иммунной системы. Обзор базовых видов спортивного питанияru Все права защищены. Использование материалов без активной гиперссылки запрещено. Перед началом и во время лечения препаратом надлежит проводить ректальный контроль размера предстательной железы. Проступок лекарственными средствами, содержащими нандролон при применении высоких доз в качестве анаболического средства может вызывать эндокринные, метаболические и психические расстройства.
Ты видел цену первого препарата. Он в шесть раз дороже. Ты мне п
А утилизировать им или делать по своему сам решай. Тебе опытные люди советуют слушай их. Когда вы спите, вы потеете и выделяете порядка литра воды. Именно поэтому фотосессии проводятся по утрам, когда вы более худой. Опытные атлеты принимают тамоксифен после антиэстрогенов из группы ингибиторов ароматазы: эффективность такого подхода в бодибилдинге подтверждается многочисленными благоприятными отзывами. В этом варианте блокаторы ароматазы используют со второй недели курса и тем самым подавляют чередование тестостерона в эстрогены. За счет высокой анаболической активности этого стероида, от него часто возникают неприятные побочные эффекты, но обычно это происходит при неграмотном курсе или передозировке. Рекомендованная доза данного препарата за период курса — мг, инъекции производить не чаще, чем через день и доза не должна превышать мг. Для лечения остеопороза у женщин. Для мужчин всё таки предпочитаю препараты тестостерона. Нет, зарегистрироваться сейчас. Прогестерон в мужском организме. Добрая,но упорно пытается это скрыть,за частую скрывается под маской спокойствия и пофигизма. Также этот сок может устранить или сделать незаметными веснушки, если протирать им лицо утром и вечером.
Альтернативные методы доставки стероидов в среднее ухо при лечении острой сенсоневральной тугоухости
Журнал «Медицинский совет» №6/2020
DOI: 10.21518/2079-701X-2020-6-85-89
В.М. Свистушкин, ORCID: 0000-0002-1257-9879, e-mail: [email protected], Г.Н. Никифорова, ORCID: 0000-0002-8617-0179, e-mail: [email protected], С.В. Морозова, ORCID: 0000-0003-1458-6279, e-mail: [email protected], В.Ф. Гергиев, ORCID: 0000-0002-5353-6373, e-mail: [email protected], Е.Н. Ершова, ORCID: 0000-0002-3751-5433, e-mail: [email protected]
Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России (Сеченовский Университет)
Введение. Острая сенсоневральная тугоухость – наиболее часто встречающаяся полиэтиологическая патология звуковосприятия. Основным методом лечения долгое время считалась терапия системными глюкокортикостероидами. В последние годы серьезный интерес представляет топическая терапия. Однако интратимпанальные инъекции доставляют немалый дискомфорт пациенту и требуют около 1 часа в день на выполнение процедуры.
Материалы и методы. Для модернизации и уменьшения времени, затрачиваемого на доставку стероидов в барабанную полость, в данной статье рассмотрен опыт ведения 41 пациента с односторонней острой сенсоневральной тугоухостью. Пациенты первой группы получали дексаметазон 4 мг/мл в объеме 1 мл посредством катетеризации глоточного устья слуховой трубы с последующим введением в барабанную полость. Пациенты второй группы были разделены на 2 подгруппы: в первой подгруппе дексаметазон 4 мг/мл в объеме 0,5 мл вводили интратимпанально через заранее наложенное отверстие в барабанной перепонке при помощи радиоволнового аппарата, а пациентам второй подгруппы выполнялась классическая интратимпанальная инъекция дексаметазона 4 мг/мл 0,5 мл после аппликационной анестезии барабанной перепонки. Аудиологическое исследование выполнялось до лечения, спустя 1,2 недели, 1,6 месяцев.
Результаты. Среднее время нахождения в клинике пациентов первой группы составило 30 минут, тогда как пациентам 1-й подгруппы из 2-й группы хватало и 20 минут в день. Дольше всего в клинике находилась 2-я подгруппа пациентов из 2-й группы – около 1 часа. Длительность применения местных методов стероидной терапии в среднем составила 14 дней.
Выводы. Радиоволновая миринготомия является наиболее безопасным и удобным методом. Наименьшее количество времени, затрачиваемое на пациента, наблюдалось в подгруппе интратимпанальных введений, в которой выполнялась радиоволновая миринготомия. Было доказано, что методы топического лечения не уступают по эффективности друг другу.
Для цитирования: Свистушкин В.М., Никифорова Г.Н., Морозова С.В., Гергиев В.Ф., Ершова Е.Н. Альтернативные методы доставки стероидов в среднее ухо при лечении острой сенсоневральной тугоухости. Медицинский Совет. 2020;(6):85-89. https://doi.org/10.21518/2079-701X-2020-6-85-89
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Alternative methods of delivering steroids to the middle ear in treatment of sudden sensorineural hearing loss
Valeriy M. Svistushkin, ORCID: 0000-0002-1257-9879, e-mail: [email protected], Galina N. Nikiforova, ORCID: 0000-0002-8617-0179, e-mail: [email protected], Svetlana V. Morozova, ORCID: 0000-0003-1458-6279, e-mail: [email protected], Vladimir F. Gergiev, ORCID: 0000-0002-5353-6373, e-mail: [email protected], Elizaveta N. Ershova, ORCID: 0000-0002-3751-5433, e-mail: [email protected]
First Moscow State Medical University named after I.M. Sechenov (Sechenov University)
Introduction. Sudden sensorineural hearing loss is the most common pathology of polyethological sound perception. Systemic glucocorticosteroid therapy has long been considered the main treatment method. In recent years, topical therapy has been of great interest. However, intratympanic injections cause considerable discomfort to the patient and require about 1 hour per day to perform the procedure.
Materials. In order to modernize and reduce the time spent on delivering steroids into tympanic cavity, this article considers the experience of managing 41 patients with sudden unilateral sensorineural hearing loss. Patients of the first group received dexamethasone 4 mg / ml in a volume of 1 ml by catheterization of the auditory tube, followed by introduction into the tympanic cavity. Patients of the second group were divided into 2 subgroups: in the first subgroup, dexamethasone 4 mg / ml in a volume of 0.5 ml was administered into tympanic cavity through a pre-imposed hole in the eardrum using a radio-wave device, and patients of the second subgroup received a classic intratympanic injection of dexamethasone 4mg / ml 0.5 ml after application anesthesia of the eardrum. The audiometry was performed before treatment, after 1, 2 weeks, 1 and 6 months.
Results. The average time spent in the clinic of patients of the first group was 30 minutes, while patients of the first subgroup of the second group had 20 minutes a day. The longest time in the clinic was 2 subgroup of patients from 2 groups-about 1 hour.
Conclusions. Radio-wave myringotomy is the safest and most convenient method. The smallest amount of time spent on the patient was observed in the subgroup of intratympanic injections that performed radio-wave miringotomy. It has been proved that the methods of topical treatment are not inferior in efficiency to each other.
For citation: Svistushkin V.M., Nikiforova G.N., Morozova S.V., Gergiev V.F., Ershova E.N. Alternative methods of delivering steroids to the middle ear in treatment of sudden sensorineural hearing loss. Meditsinskiy sovet = Medical Council. 2020;(6):85–89. (In Russ.) doi: 10.21518/2079-701X-2020-6-85-89.
Conflict of interest: the authors declare no conflict of interest.
Загрузить файл в формате PDF
Список литературы / References
- Byl F.M. Jr. Sudden hearing loss: eight years’ experience and suggested prognostic table. Laryngoscope. 1984;94;5(1):647-661. Available at: https://www.ncbi.nlm.nih.gov/pubmed/6325838.
- Chandrasekhar S.S. Intratympanic dexamethasone for sudden sensorineural hearing loss: clinical and laboratory evaluation. Otol Neurotol. 2001;22(1):18-23. https://doi.org/10.1097/00129492-200101000-00005.
- Mattox D.E., Simmons F.B. Natural history of sudden sensorineural hearing loss. Ann Otol Rhinol Laryngol. 1977;86;4(1):463-480. https://doi.org/10.1177/000348947708600406.
- Klemm E., Deutscher A., Mösges R. A present investigation of the epidemiology in idiopathic sudden sensorineural hearing loss. Laryngorhinootologie. 2009;88(8):524-527. https://doi.org/10.1055/s-0028-1128133.
- Sauvaget E., Kici S., Kania R., Herman P., Tran Ba Huy P. Sudden sensorineural hearing loss as a revealing symptom of vestibular schwannoma. Acta Otolaryngol. 2005;125(6):592-595. https://doi.org/10.1080/00016480510030246.
- Parnes L.S., Sun A.H., Freeman D.J.Corticosteroid pharmacokinetics in the inner ear fluids:an animal study followed by clinical application. Laryngoscope. 1999;109;7(2):1-17. https://doi.org/10.1097/00005537-199907001-00001.
- Plontke S.K. Diagnostics and Therapy of Idiopathic Sudden Sensorineural Hearing Loss. Laryngorhinootologie. 2017;(1):103-122. https://doi.org/10.1055/s-0042-122385.
- Tarkan Ö., Dağkıran M., Sürmelioğlu Ö., Özdemir S., Tuncer Ü., Doğrusöz M., Çetik F., Kıroğlu M. Intratympanic Methylprednisolone versus Dexamethasone for the Primary Treatment of Idiopathic Sudden Sensorineural Hearing Loss. J Int Adv Otol. 2018;14(3):451-455. https://doi.org/10.5152/iao.2018.4871.
- Chu C.H., Chiou S.R., Wang M.C., Shiao A.S., Tu T.Y., Lin L.Y., Huang C.Y., Liao W.H. The Efficacy of Concurrent or Sequential Intravenous and Intratympanic Steroid for Idiopathic Sudden Sensorineural Hearing Loss. Audiol Neurootol. 2018;23(5):277-284. https://doi.org/10.1159/000494966.
- Lundy L., Karatayli Ozgursoy S., Kleindienst S. Intratympanic Dexamethasone via Saturated Gelfoam for Idiopathic Sudden Sensorineural Hearing Loss. Otolaryngol Head Neck Surg. 2019;160(2):361- 363. https://doi.org/10.1177/0194599818816306.
- Wei B.P., Stathopoulos D., O’Leary S. Steroids for idiopathic sudden sensorineural hearing loss. Cochrane Database Syst Rev. 2013;(7):CD003998. https://doi.org/10.1002/14651858.CD003998.
- Sutton L., Schartinger V., Url C., Schmutzhard J., Lechner D., Kavasogullari C. et al. Intratympanic steroid use for idiopathic sudden sensorineural hearing loss: current otolaryngology practice in Germany and Austria. Eur Arch Otorhinolaryngol. 2018;275(5):1103-1110. https://doi.org/10.1007/s00405-018-4958-8.
- Battaglia A., Lualhati A., Lin H., Burchette R., Cueva R. A prospective, multicentered study of the treatment of idiopathic sudden sensorineural hearing loss with combination therapy versus high-dose prednisone alone: a 139 patient follow-up. Otol Neurotol. 2014;35(6):1091-1098. https://doi.org/10.1097/MAO.0000000000000450.
- Honeder C., Engleder E., Schöpper H., Krause M., Landegger L.D., Plasenzotti R. et al. Evaluation of the selective glucocorticoid receptor agonist compound A for ototoxic effects. Laryngoscope. 2015;125(4):149- 155. https://doi.org/10.1002/lary.25011.
- Plontke S.K., Löwenheim H., Mertens J., Engel C., Meisner C., Weidner A. et al. Randomized, double blind, placebo controlled trial on the safety and efficacy of continuous intratympanic dexamethasone delivered via a round window catheter for severe to profound sudden idiopathic sensorineural hearing loss after failure of systemic therapy. Laryngoscope. 2009;119(2):359-369. https://doi.org/h20.1002/lary.20074.
- Ghossaini S.N., Liu J.P., Phillips B. Round window membrane permeability to golimumab in guinea pigs: a pilot study. Laryngoscope. 2013;123(11):2840-2844. https://doi.org/10.1002/lary.24163.
- Paulson D.P., Abuzeid W., Jiang H., Oe T., O’Malley B.W., Li D. A novel controlled local drug delivery system for inner ear disease. Laryngoscope. 2008;118(4):706-711. https://doi.org/10.1097/MLG.0b013e31815f8e41.
- Olzowy B., Osterkorn D., Suckfüll M. The incidence of sudden hearing loss is greater than previously assumed. MMW Fortschr Med. 2005;147(14):37- 38. Available at: https://www.ncbi.nlm.nih.gov/pubmed/15887682.
- Косяков С.Я., Атанесян А.Г., Гуненков А.В. Местная терапия острой сенсоневральной тугоухости путем интратимпанального введения стероидов. Вестник отоларингологии. 2012;(3):74-78. Режим доступа: https://www.mediasphera.ru/issues/vestnik-otorinolaringologii/2012/3/030042-46682012320.
- Xenellis J., Karapatsas I., Papadimitriou N., Nikolopoulos T., Maragoudakis P., Tzagkaroulakis M., Ferekidis E. Idiopathic sudden sensorineural hearing loss: prognostic factors. J Laryngol Otol. 2006;120(9):718-724. https://doi.org/10.1017/S0022215106002362.
- Fetterman B.L., Luxford W.M., Saunders J.E. Sudden bilateral sensorineural hearing loss. Laryngoscope. 1996;106(11):1347-1350. https://doi.org/10.1097/00005537-199611000-00008.
Выбор местных кортикостероидов — Американский семейный врач
1. Marsland AM, Чалмерс Р.Дж., Холлис С, Леонарди-Би Дж., Гриффитс CE. Вмешательства при хроническом ладонно-подошвенном пустулезе. Кокрановская база данных Syst Rev . 2006; (1): CD001433 ….
2. Лепе В., Монкада Б, Кастанедо-Казарес JP, Торрес-Альварес МБ, Ортис CA, Torres-Rubalcava AB. Двойное слепое рандомизированное исследование 0.1% такролимуса против 0,05% клобетазола для лечения детского витилиго. Arch Dermatol . 2003. 139 (5): 581–585.
3. Handa S, Панди Р, Каур И. Витилиго: ретроспективный сравнительный анализ методов лечения у 500 пациентов. Дж Дерматол . 2001. 28 (9): 461–466.
4. Renaud-Vilmer C, Кавелье-Баллой B, Порчер Р, Дубертрет Л. Склеротический лихен вульвы: влияние длительного местного применения сильнодействующего стероида на течение заболевания. Arch Dermatol . 2004. 140 (6): 709–712.
5. Дюма V, Roujeau JC, Волькенштейн П, Ревуз Дж, Коснес А. Лечение легкой пузырчатки обыкновенной и листовидной пузырчатки местным кортикостероидом. Br J Dermatol . 1999. 140 (6): 1127–1129.
6. Жолы П, Roujeau JC, Бенишоу Дж, и другие., для французской исследовательской группы буллезных болезней. Сравнение пероральных и местных кортикостероидов у пациентов с буллезным пемфигоидом. N Engl J Med . 2002. 346 (5): 321–327.
7. Тости А, Иориццо М, Ботта ГЛ, Милани М. Эффективность и безопасность новой 0,05% пены клобетазола пропионата при очаговой алопеции: рандомизированное двойное слепое плацебо-контролируемое исследование. J Eur Acad Dermatol Venereol . 2006. 20 (10): 1243–1247.
8. Charuwichitratana S, Ваттанакрай П., Танраттанакорн С. Рандомизированное двойное слепое плацебо-контролируемое исследование лечения очаговой алопеции с 0.Крем с 25% дезоксиметазоном. Arch Dermatol . 2000. 136 (10): 1276–1277.
9. Tan MH, Meador SL, Певица Г, Lebwohl MG. Открытое исследование безопасности и эффективности ограниченного применения мази флутиказона пропионата, 0,005%, у пациентов с атопическим дерматитом лица и интертригинозных областей. Инт Дж Дерматол . 2002. 41 (11): 804–809.
10. Ханифин Дж., Гупта А.К., Раджагопалан Р. Прерывистое дозирование крема флутиказона пропионата для снижения риска рецидива у пациентов с атопическим дерматитом. Br J Dermatol . 2002. 147 (3): 528–537.
11. Lund L, Вай К.Х., Муи Л.М., Yeung CK. Влияние местных стероидов на невращающуюся крайнюю плоть препубертата в проспективном рандомизированном двойном слепом исследовании. Сканд Дж Урол Нефрол . 2000. 34 (4): 267–269.
12. Lund L, Вай К.Х., Муи Л.М., Yeung CK. 18-месячное контрольное исследование после рандомизированного лечения фимоза у мальчиков местными стероидами по сравнению с плацебо. Сканд Дж Урол Нефрол . 2005. 39 (1): 78–81.
13. Шмут М., Виммер М.А., Hofer S, и другие. Местная кортикостероидная терапия острого лучевого дерматита: проспективное рандомизированное двойное слепое исследование. Br J Dermatol . 2002. 146 (6): 983–991.
14. Шукла ПН, Gairola M, Моханти Б.К., Рат Г.К. Профилактический спрей бекламетазона для кожи во время послеоперационной лучевой терапии карциномы груди: проспективное рандомизированное исследование. Индийский рак J . 2006. 43 (4): 180–184.
15. Саркар Р., Бхалла М, Канвар AJ. Сравнительное исследование монотерапии кремом с 20% азелаиновой кислотой и последовательной терапией при лечении меланодермии у темнокожих пациентов. Дерматология . 2002. 205 (3): 249–254.
16. Эллингсен AR, Теструп-Педерсон К. Лечение хронической идиопатической крапивницы местными стероидами. Открытый судебный процесс. Acta Derm Venereol .1996. 76 (1): 43–44.
17. Манчини А.Дж., Frieden IJ, Paller AS. Повторный визит к детскому акропустулезу: история чесотки и ответ на местные кортикостероиды. Педиатр дерматол . 1998. 15 (5): 337–341.
18. Майерс Дж. Б., Соренсен С.М., Виснер Б.П., Фернесс ПД 3-й, Пассаманек М, Койл М.А. Крем с бетаметазоном для лечения препубертатных спаек губ. Дж. Педиатр-Адолеск-Гинеколь .2006. 19 (6): 407–411.
19. Wilson DE, Кайдбей К., Бойке СК, Йоркаски ДК. Предварительная обработка кортикостероидами для местного применения для снижения частоты и тяжести кожных реакций, связанных с трансдермальной терапией тестостероном. Clin Ther . 1998. 20 (2): 299–306.
20. Паризер DM. Актуальные стероиды: руководство по применению у пожилых пациентов. Гериатрия . . 1991. 46 (10): 51–54,57–60,63.
21. Дрейк Л.А., Динхарт С.М., Фермер скорая помощь, и другие.Рекомендации по применению местных глюкокортикостероидов. J Am Acad Dermatol . 1996. 35 (4): 615–619.
22. Goa KL. Клиническая фармакология и фармакокинетические свойства местных кортикостероидов. Обзор. Наркотики . 1988; 36 (приложение 5): 51–61.
23. McKenzie AW. Сравнение стероидов по сужению сосудов. Br J Dermatol . 1966. 78 (3): 182–183.
24. Факты и сравнения 4.0. http://www.factsandcomparisons.com (требуется пароль). Проверено 10 февраля 2008 г.
25. Olsen EA. Двойное слепое контролируемое сравнение генерических и торговых марок местных стероидов с использованием анализа сужения сосудов. Arch Dermatol . 1991; 127 (2): 197–201.
26. Geraci AC, Кран JS, Cunha BA. Актуальные стероиды: формы дозирования и общие соображения. Хосп Фарм . 1991; 26: 699–719.
27. du Vivier A.Тахифилаксия при местном применении стероидов. Arch Dermatol . 1976; 112 (9): 1245–1248.
28. Длинный СС, Наконец, AY. Кончик пальца — новое практическое средство. Клин Эксп Дерматол . 1991. 16 (6): 444–447.
29. Hengge UR, Ружичка Т, Шварц Р.А., Корк MJ. Побочные эффекты местных глюкокортикостероидов. J Am Acad Dermatol . 2006; 54 (1): 1–15.
30. McMicheal AJ, Гриффитс К.Э., Талвар HS, и другие.Одновременное применение третиноина (ретиноевой кислоты) частично защищает от атрофии эпидермиса, вызванной кортикостероидами. Br J Dermatol . 1996. 135 (1): 60–64.
31. Alston SJ, Коэн Б.А., Браун М. Стойкий и рецидивирующий микоз у детей, получавших комбинированные противогрибковые и кортикостероидные препараты. Педиатрия . 2003. 111 (1): 201–203.
Кортикостероиды местного действия — StatPearls — Книжная полка NCBI
Непрерывное обучение
Кортикостероиды местного действия играют важную роль в лечении многих дерматологических заболеваний.Они одобрены FDA и показаны при воспалительных и зудящих проявлениях дерматологических состояний. Хорошо известные показания для таких заболеваний, как псориаз, витилиго на ограниченных участках, экзема, атопический дерматит, фимоз, острый лучевой дерматит, красный плоский лишай, простой хронический лишай, дискоидная красная волчанка и склероз лихена. Они эффективны при состояниях, связанных с гиперпролиферацией, иммунологическими и воспалительными свойствами. В этом упражнении излагаются показания, механизм действия, методы введения, важные побочные эффекты, противопоказания, токсичность и мониторинг местных кортикостероидов, чтобы медицинские работники могли направлять терапию пациента там, где они показаны, в составе межпрофессиональной команды.
Цели:
Определить три основных механизма действия местных кортикостероидов.
Просмотрите показания к применению местных кортикостероидов.
Обобщите профиль нежелательных явлений местных кортикостероидов, а также противопоказания к их применению.
Объясните важность улучшения координации ухода между межпрофессиональной командой для улучшения оказания помощи пациентам, которым может помочь терапия местными кортикостероидами.
Показания к применению
Кортикостероиды для местного применения играют важную роль в лечении многих дерматологических заболеваний. Они одобрены FDA и показаны при воспалительных и зудящих проявлениях дерматологических состояний. Хорошо известные показания для таких заболеваний, как псориаз, витилиго на ограниченных участках, экзема, атопический дерматит, фимоз, острый лучевой дерматит, красный плоский лишай, простой хронический лишай, дискоидная красная волчанка и склероз лихена.[1] Они эффективны при состояниях, включающих гиперпролиферацию, иммунологические и воспалительные свойства. [2]
Механизм действия
Механизм действия местных кортикостероидов обширен и включает противовоспалительное, антимитотическое и иммунодепрессивное действие. [3]
Противовоспалительное действие местных кортикостероидов состоит из сужения сосудов, ингибирования высвобождения фосфолипазы A2 и прямого ингибирующего действия на ДНК и воспалительные факторы транскрипции.[3] [4] Сужение кровеносных сосудов в верхней части дермы снижает количество медиаторов воспаления, доставляемых в пораженную область. [3] Противовоспалительный эффект также возникает за счет синтеза липокортина, который ингибирует фосфолипазу А2, в конечном итоге снижая выработку простагландинов и лейкотриенов. [4] Кортикостероиды для местного применения также действуют непосредственно на уровне ДНК, увеличивая экспрессию противовоспалительных генов и косвенно ингибируя воспалительные факторы транскрипции, такие как NFkb, для снижения экспрессии провоспалительных генов.[3]
Антимитотический эффект местных кортикостероидов играет большую роль в лечении псориаза; Предполагается, что это уменьшение митоза эпидермиса является вторичным по отношению к увеличению липокортина, эндогенного белка, регулируемого глюкокортикоидами. В дерме также присутствует антимитотический эффект, который подавляет пролиферацию клеток и синтез коллагена. [5] [6]
Иммуносупрессивные эффекты местных кортикостероидов включают ингибирование гуморальных факторов, участвующих в воспалительной реакции, а также подавление созревания, дифференцировки и пролиферации всех иммунных клеток.[5]
Администрация
Кортикостероиды для местного применения применяют местно; однако успешное введение зависит от постановки точного диагноза, выбора правильного лекарства, выбора подходящего носителя и активности, а также частоты применения. [1]
Транспортное средство является носителем препарата. Выбор транспортного средства зависит от пораженной области и типа поражения. Он также способствует увлажнению кожи и увеличению абсорбции. Варианты носителя включают следующие [7]:
- Мази — назначают при толстых гиперкератотических поражениях; наиболее сильнодействующий носитель, поскольку они являются наиболее окклюзионными и не должны наноситься на участки с волосами, поскольку это может привести к фолликулиту [1]
- Кремы — менее эффективны, чем мазь, но косметически более привлекательны, поскольку не оставляют следов; высушивающий, неокклюзионный характер приводит к их применению при остром экссудативном воспалении и дерматите в интертригинозных областях.[1]
Лосьоны — менее плотные и жирные; хорошо действуют на волосяных покровах
Гели — похожие на лосьоны, менее окклюзионные и жирные; хорошо работают в волосяных регионах; более полезны для кожи головы, так как они не вызывают матирования окклюзионных и жирных волос в области бедер.
- Пены — очень эффективны для доставки стероидов в кожу головы, но являются дорогостоящими [8]
Эффективность местных кортикостероидов составляет препарат, необходимый для получения желаемого терапевтического эффекта.Золотым стандартом для определения активности является сосудосуживающий анализ, который измеряет сосудосуживающие свойства на основе кожной вазоконстрикции. [9] Классификация США состоит из семи классов, из которых класс I — суперпотентный, а класс VII — наименее мощный [10].
Класс I Суперпотенциальные кортикостероиды включают 0,05% клобетазола пропионата в любом носителе, 0,05% гель или мазь с добавлением бетаметазона дипропионата, 0,05% мазь дифлоразона диацетат, флуоцинонид 0.1% крем и 0,05% крем или мазь галобетазола пропионата. [1]
Класс II сильнодействующие кортикостероиды включают 0,1% мазь амцинонида, 0,05% крем или лосьон с добавлением бетаметазона дипропионата, 0,05% мазь бетаметазона дипропионат, крем или гель или мазь с дезоксиметазоном, дифлоразона диацетат 0,05% крем или мазь или гель 0,05% флуентоцинонид 0,1% крем, мазь или раствор галцинонида. [1]
Класс III Кортикостероиды средней и высокой активности включают амцинонид 0.1% крем, 0,05% крем бетаметазона дипропионата, 0,005% мазь флутиказона пропионата и 0,5% крем или мазь триамцинолона ацетонида [1].
Кортикостероиды средней активности класса IV и V включают 0,1% крем или лосьон или пену бетаметазона валерат, 0,05% крем дезоксиметазона, 0,025% крем или мазь флуоцинолона ацетонида, 0,05% крем или флутиказона пропионат, 0,1% гидрокортизона бутират, гидрокортизона бутират. 0,1% крем, гидрокортизона валерат 0,2% крем или мазь, мометазона фуроат 0.1% крем, лосьон или мазь, 0,025% крем, лосьон или мазь триамцинолона ацетонида и 0,1% крем, лосьон или мазь триамцинолона ацетонида [1].
Низкоактивные кортикостероиды класса VI включают 0,05% крем или мазь алклометазона дипропионата, 0,05% дезонид в любом носителе, 0,01% крем флуоцинолона и 0,1% крем гидрокортизона бутирата [1].
Наименее эффективные кортикостероиды класса VII включают гидрокортизон 1% и 2,5% крем, лосьон или мазь.[1]
Кортикостероиды лучше всасываются и более проницаемы в тонких областях эпидермиса, таких как веко, по сравнению с более толстыми участками эпидермиса, такими как подошва. Разница в проникновении между ними составляет 300 раз. [11] Проникновение увеличивается в два-десять раз при болезненных состояниях, таких как воспаление и шелушение. [1] [12] Высокоэффективные стероиды используются для лечения ладоней и подошв из-за толстого рогового слоя, а также в нефациальных / неинтерригинозных областях при тяжелых дерматозах, таких как псориаз, тяжелый атопический и контактный дерматит.[1] Стероиды средней и высокой активности полезны для участков с тонким эпидермисом и участков окклюзии, таких как веко и подмышечная впадина, соответственно. [8] Препараты с низкой и средней концентрацией следует использовать на больших площадях, чтобы снизить риск системной абсорбции. 1917 [1]
Количество используемых стероидов играет большую роль в эффективности лечения, но также и в предотвращении побочных эффектов от чрезмерного употребления. Один кончик пальца (FTU) равен 0,5 грамма. Предлагаемая доза FTU зависит от обрабатываемой области тела.Актуальные кортикостероиды рекомендуется принимать один-два раза в день. [13] Исследование местного применения кортикостероидов при атопическом дерматите продемонстрировало отсутствие убедительных доказательств того, что местное применение кортикостероидов чаще одного раза в день отсутствует. Его более частое применение приводило только к усилению побочных эффектов [14].
Побочные эффекты
Побочные эффекты местных кортикостероидов можно разделить на местные и системные. Местные побочные эффекты возникают при длительном лечении и зависят от активности местных стероидов, носителя и места применения.Наиболее частые местные эффекты включают атрофию, стрии, розацеа, периоральный дерматит, угри и пурпуру. [6]
Атрофия кожи является наиболее частым побочным эффектом и возникает из-за антимитотического эффекта местных кортикостероидов. [6] Актуальные стероиды вызывают 3 фазы кожи: преатрофию, атрофию и тахифилаксию. Атрофия возникает при постоянном употреблении в одном и том же регионе. Это приводит к истончению эпидермиса и усилению резорбции основного вещества дермы. Утрата соединительной ткани приводит к эритеме, телеангиэктазии и пурпуре.Атрофия проявляется в виде жжения; сосудосуживающий эффект местных кортикостероидов снимает ожог. [4] Области, наиболее подверженные риску атрофии, являются интертригинозными из-за более тонкой кожи и повышенной окклюзии. Атрофия обратима при прекращении приема стероидов; однако для того, чтобы кожа снова стала нормальной, могут пройти месяцы. [6]
Тахифилаксия является результатом развития толерантности кожи к местным кортикостероидам, что в конечном итоге приводит к потере сужения сосудов на уровне капилляров.Было продемонстрировано, что капилляры восстанавливают способность сужать сосуды через 4 дня. По этой причине рекомендуется пульс-терапия, а местный кортикостероид следует прекратить на 4 дня, если он потерял свою эффективность [13].
Стрии возникают из-за травм дермы и механического воздействия. Воспаление и отек дермы приводит к отложению коллагена в области механического воздействия. Стрии гистологически выглядят как рубцы и являются постоянными. [6]
Местное применение кортикостероидов может привести к образованию прыщей из-за разрушения фолликулярного эпителия и увеличения концентрации свободных жирных кислот на поверхности кожи.Это создает среду для роста бактерий, что в конечном итоге приводит к комедогенезу. [6]
Стероидная розацеа может возникнуть, когда стероиды изначально прописаны для лечения эритемы с пустулами или без них. Если прописаны местные кортикостероиды в низких дозах, это может привести к хорошим результатам до тех пор, пока поражения не появятся снова и не потребуется постоянное применение стероидов более высоких потенций [6].
Периоральный дерматит возникает из-за длительного применения сильнодействующих кортикостероидов на лице. Это проявляется в виде фолликулярных пустул и папул на эритематозном основании, окружающих периоральную область, но не затрагивающих красную кайму.[6]
Менее распространенные местные побочные эффекты включают гипертрихоз, изменение пигментации и замедленное заживление ран. Системные побочные эффекты менее вероятны из-за низкой чрескожной абсорбции; однако они могут развиваться при длительном применении сильнодействующих стероидов на тонких участках эпидермиса. Системные побочные эффекты включают глаукому, подавление гипоталамо-гипофизарной оси, синдром Кушинга, гипертонию и гипергликемию. [6]
Противопоказания
Кортикостероиды местного действия противопоказаны при бактериальных инфекциях, поскольку их противовоспалительное и сосудосуживающее действие маскирует инфекцию, в конечном итоге задерживая диагностику и лечение.Местные стероиды также следует избегать при импетиго, фурункулах и карбункулах, целлюлите, рожистом воспалении, лимфангите и эритразме. Относительные противопоказания включают кандидоз и дерматофиты. [15] Иммуносупрессивные эффекты могут привести к стойким грибковым инфекциям, которые можно идентифицировать как tinea incognito, значительным для увеличения распространения и воспаления с образованием пустул [8].
Мониторинг
Пациенты должны находиться под тщательным наблюдением, поскольку бесконтрольное использование этих препаратов может привести к местным и системным побочным эффектам.Продолжительность лечения не должна превышать 2-4 недели, независимо от потенции. Высокоэффективные стероиды не следует назначать дольше 2 недель, а по истечении этого периода их следует уменьшить, чтобы избежать побочных эффектов. [1] [13] Рекомендации по предотвращению побочных эффектов включают использование стероидов с низкой активностью, применение только утром, лечение через день и уменьшение степени окклюзии. [16]
Улучшение результатов команды здравоохранения
Кортикостероиды для местного применения являются одними из наиболее часто назначаемых в дерматологии лекарств из-за быстрого облегчения нежелательных признаков и симптомов.Однако, если они не прописаны должным образом или пациенты не получают соответствующих инструкций, может произойти злоупотребление местными кортикостероидами, что приведет к побочным эффектам [17] В идеале дерматологи, медсестры, врачи общей практики и фармацевты должны работать вместе, чтобы определить способ применения местных кортикостероидов. Реально о совете специалиста быстро забывают, а этикетка продукта — единственное направление, которое остается. Этикетка с надписью «наносить тонким слоем или использовать экономно» вызывает опасение, что продукт может быть опасным, что приводит к плохой приверженности и лечению.Чтобы решить эту проблему, было разработано устройство на кончике пальца (FTU), чтобы практикующим врачам было проще объяснять пациентам, сколько лекарств следует наносить на разные области тела. Если вы потратите время на объяснение системы FTU, это поможет пациентам почувствовать уверенность в том, что они принимают достаточное количество стероидов. Также было рекомендовано, чтобы на этикетках было указано «наносить достаточно, чтобы покрыть пораженный участок» и включать изображение кончика пальца и диаграмму, показывающую, сколько единиц кончика пальца следует нанести на каждую область тела, чтобы пациенты получили соответствующее лечение.Пациентам также следует рекомендовать не превышать назначенное лечение и прекращать прием только под наблюдением врача. Фармацевты — это последняя линия здравоохранения, которую пациент видит перед использованием лекарства, и они играют важную роль в обеспечении правильного использования и обеспечении понимания пациентом плана лечения межпрофессиональной группы [18].
Дополнительное образование / Контрольные вопросы
Ссылки
- 1.
- Ференс Дж. Д., Последний AR. Выбор местных кортикостероидов.Я семейный врач. 2009 15 января; 79 (2): 135-40. [PubMed: 19178066]
- 2.
- Giannotti B. Текущие рекомендации по лечению местных кортикостероидов. Наркотики. 1988; 36 Дополнение 5: 9-14. [PubMed: 3076133]
- 3.
- Ахлувалия А. Актуальные глюкокортикоиды и кожа — механизмы действия: обновленная информация. Медиаторы Inflamm. 1998; 7 (3): 183-93. [Бесплатная статья PMC: PMC1781846] [PubMed: 9705606]
- 4.
- Абрахам А., Рога Г. Кожа, поврежденная местными стероидами. Индийский J Dermatol.2014 сентябрь; 59 (5): 456-9. [Бесплатная статья PMC: PMC4171912] [PubMed: 25284849]
- 5.
- Ува Л., Мигель Д., Пиньейро С., Антунес Дж., Круз Д., Феррейра Дж., Филипе П. Механизмы действия местных кортикостероидов при псориазе. Int J Endocrinol. 2012; 2012: 561018. [Бесплатная статья PMC: PMC3508578] [PubMed: 23213332]
- 6.
- Кунду А., Фиске М., Верма С., Лахири К. Побочные эффекты местных стероидов: давно пора пересмотреть. Indian Dermatol Online J. 2014 Октябрь; 5 (4): 416-25. [Бесплатная статья PMC: PMC4228634] [PubMed: 25396122]
- 7.
- Ли Н. П., Арриола ER. Кортикостероиды для местного применения: возвращение к основам. West J Med. 1999 ноябрь-декабрь; 171 (5-6): 351-3. [Бесплатная статья PMC: PMC1308757] [PubMed: 10639873]
- 8.
- Рати С.К., Д’Суза П. Рациональное и этическое использование местных кортикостероидов, основанное на безопасности и эффективности. Индийский J Dermatol. 2012 июл; 57 (4): 251-9. [Бесплатная статья PMC: PMC3401837] [PubMed: 22837556]
- 9.
- Goa KL. Клиническая фармакология и фармакокинетические свойства местных кортикостероидов.Обзор. Наркотики. 1988; 36 Дополнение 5: 51-61. [PubMed: 3076132]
- 10.
- Джейкоб С.Э., Стил Т. Классы кортикостероидов: краткое справочное руководство, включающее вещества для проведения пластырей и перекрестную реактивность. J Am Acad Dermatol. 2006 апр; 54 (4): 723-7. [PubMed: 16546601]
- 11.
- Feldmann RJ, Maibach HI. Региональные различия в чрескожном проникновении 14C кортизола у человека. J Invest Dermatol. 1967 Февраль; 48 (2): 181-3. [PubMed: 6020682]
- 12.
- Тадичерла С., Росс К., Шенефельт П.Д., Фенске Н.А.Кортикостероиды для местного применения в дерматологии. J Drugs Dermatol. 2009 декабрь; 8 (12): 1093-105. [PubMed: 20027937]
- 13.
- Дрейк Л.А., Динхарт С.М., Фермер Э.Р., Гольц Р.В., Грэм Г.Ф., Хординский М.К., Льюис К.В., Паризер Д.М., Вебстер С.Б., Уитакер, округ Колумбия, Батлер Б., Лоури Б.Дж., Раймер С.А., Крафчик Б.Р., Олсен Э., Уэстон В.Л. Рекомендации по применению местных глюкокортикостероидов. Американская академия дерматологии. J Am Acad Dermatol. 1996 Октябрь; 35 (4): 615-9. [PubMed: 8859293]
- 14.
- Уильямс ХК.Традиционные кремы с кортикостероидами следует применять только один раз в день у пациентов с атопической экземой. BMJ. 2007 16 июня; 334 (7606): 1272. [Бесплатная статья PMC: PMC1892503] [PubMed: 17569936]
- 15.
- Cornell RC. Противопоказания к применению местных стероидов. West J Med. Октябрь 1987 г .; 147 (4): 459-60. [Бесплатная статья PMC: PMC1025914] [PubMed: 18750337]
- 16.
- Hengge UR, Ruzicka T, Schwartz RA, Cork MJ. Побочные эффекты местных глюкокортикостероидов. J Am Acad Dermatol. 2006 Янв; 54 (1): 1-15; викторина 16-8.[PubMed: 16384751]
- 17.
- Сарасват А. Этическое использование местных кортикостероидов. Индийский J Dermatol. 2014 сентябрь; 59 (5): 469-72. [Бесплатная статья PMC: PMC4171915] [PubMed: 25284852]
- 18.
- Бьюли А., Рабочая группа по дерматологии. Консенсус экспертов: пора изменить то, как мы советуем нашим пациентам использовать местные кортикостероиды. Br J Dermatol. 2008 Май; 158 (5): 917-20. [PubMed: 18294314]
стероид | Определение, структура и типы
Стероид , любой из класса природных или синтетических органических соединений, характеризующихся молекулярной структурой из 17 атомов углерода, расположенных в четырех кольцах.Стероиды важны в биологии, химии и медицине. Группа стероидов включает все половые гормоны, гормоны коры надпочечников, желчные кислоты и стерины позвоночных, а также гормоны линьки насекомых и многие другие физиологически активные вещества животных и растений. Среди синтетических стероидов, имеющих терапевтическое значение, имеется большое количество противовоспалительных средств, анаболических (стимулирующих рост) средств и оральных контрацептивов.
стероидные гормоныМногие важные физиологические функции позвоночных контролируются стероидными гормонами.
Encyclopædia Britannica, Inc.Различные категории стероидов часто отличаются друг от друга названиями, которые связаны с их биологическим источником — например, фитостерины (обнаруженные в растениях), стероиды надпочечников и желчные кислоты — или с некоторыми важными физиологическими функциями — например, прогестероны (способствующие вынашиванию беременности), андрогены (способствующие развитию мужских качеств) и кардиотонические стероиды (способствующие правильной работе сердца).
Стероиды различаются друг от друга по природе присоединенных групп, положению групп и конфигурации стероидного ядра (или гонана).Небольшие изменения в молекулярной структуре стероидов могут привести к значительным различиям в их биологической активности.
Эта статья охватывает историю, химию, биологическое значение и основную фармакологию стероидов. Для получения дополнительной информации о физиологическом значении и фармакологическом применении стероидов, см. эндокринная система, эндокринная система и лекарственные препараты человека.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчасИстория стероидов
Первое терапевтическое применение стероидов произошло в 18 веке, когда английский врач Уильям Визеринг применил дигиталис, соединение, извлеченное из листьев наперстянки обыкновенной ( Digitalis purpurea ), для лечения отеков. Исследования стероидов начались в начале 19 века с исследований неомыляемого (т.е. остающегося нерастворенным после нагревания с избытком щелочи) материала, в основном холестерина, животного жира и желчных камней, а также кислот, получаемых из желчи.Эта ранняя работа, с которой были связаны многие из известных химиков того времени, привела к выделению холестерина и некоторых желчных кислот разумной чистоты и установила некоторые важные особенности их химии.
наперстянка наперстянка как источник сердечного гликозида наперстянканаперстянка наперстянка ( наперстянка пурпурная, ) является источником сердечного гликозида наперстянка. Терапевтическое использование наперстянки было впервые описано в конце 18 века, когда его использовали для лечения отеков, состояния, связанного с сердечной недостаточностью.
Дерек ФеллПонимание сложной структуры полициклического стероида, однако, произошло только после начала 20-го века, после консолидации химической теории и разработки химических методов, с помощью которых такие молекулы могли быть расщеплены шаг за шагом. Трудные исследования, в частности, исследовательские группы немецких химиков Адольфа Виндауса и Генриха Виланда, в конечном итоге установили структуру холестерина; родственных стеринов, стигмастерин и эргостерин; и желчных кислот.Исследование эргостерола стимулировалось осознанием того, что он может превращаться в витамин D. Только на заключительных этапах этой работы (1932 г.) расположение составляющих колец ядра было уточнено результатами, полученными пиролитическим методом (термически индуцированная связь- разрушение) дегидрирования и рентгеноструктурного анализа.
Когда основы химии стероидов были прочно заложены, следующее десятилетие ознаменовалось выяснением структуры большинства физиологически эффективных стероидных гормонов гонад и коры надпочечников.Дополнительный импульс исследованиям стероидов был дан, когда американский врач Филип С. Хенч и американский химик Эдвард К. Кендалл объявили в 1949 году, что до сих пор трудноизлечимые симптомы ревматоидного артрита резко облегчались гормоном надпочечников кортизоном. Были разработаны новые пути синтеза стероидов, и многие новые аналоги были терапевтически испытаны при различных болезненных состояниях. С тех пор возникла процветающая фармацевтическая промышленность стероидов, а вместе с ней и значительно расширились фундаментальные знания о стероидных реакциях, которые повлияли на многие другие области химии.
Знания о биохимии стероидов росли сопоставимыми темпами, чему способствовало использование радиоизотопов и новых аналитических методов. Метаболические пути (последовательности химических превращений в организме), как синтеза, так и разложения, стали довольно подробно известны для большинства стероидов, присутствующих у млекопитающих, и многие исследования связаны с контролем этих путей и механизмами, с помощью которых стероидные гормоны оказывают свое влияние. Гормональная роль стероидов в других организмах также вызывает растущий интерес.
Стероиды | Введение в химию
Цель обучения
- Опишите некоторые функции стероидов
Ключевые точки
- Стероиды являются липидами, потому что они гидрофобны и нерастворимы в воде, но они не похожи на липиды, поскольку имеют структуру, состоящую из четырех конденсированных колец.
- Холестерин является наиболее распространенным стероидом и является предшественником витамина D, тестостерона, эстрогена, прогестерона, альдостерона, кортизола и желчных солей.
- Холестерин является компонентом бислоя фосфолипидов и играет роль в структуре и функции мембран.
- Стероиды обнаружены в головном мозге и изменяют электрическую активность мозга.
- Поскольку они могут ослаблять рецепторы, которые передают сообщения от нейротрансмиттеров, стероиды часто используются в анестетиках.
Условия
- осморегуляция (osmoregulation): гомеостатическое регулирование осмотического давления в организме для поддержания постоянного содержания воды .
- нейротрансмиттерное вещество, такое как ацетилхолин или дофамин, отвечающее за передачу нервных сигналов через синапс между двумя нейронами
- гормон: Любое вещество, вырабатываемое одной тканью и переносимое кровотоком в другую для воздействия на физиологическую активность
Структура стероидных молекул
В отличие от фосфолипидов и жиров, стероиды имеют структуру конденсированного кольца.Хотя они не похожи на другие липиды, они сгруппированы с ними, потому что они также гидрофобны и нерастворимы в воде. Все стероиды имеют четыре связанных углеродных кольца, и многие из них, как и холестерин, имеют короткий хвост. Многие стероиды также имеют функциональную группу –ОН, и эти стероиды классифицируются как спирты, называемые стеролами.
Стероидные структуры Стероиды, такие как холестерин и кортизол, состоят из четырех конденсированных углеводородных колец.Холестерин
Холестерин — наиболее распространенный стероид, синтезируемый в основном в печени; это предшественник витамина D.Холестерин также является предшественником многих важных стероидных гормонов, таких как эстроген, тестостерон и прогестерон, которые секретируются гонадами и железами внутренней секреции. Следовательно, стероиды играют очень важную роль в репродуктивной системе организма. Холестерин также играет роль в синтезе стероидных гормонов альдостерона, который используется для осморегуляции, и кортизола, который играет роль в метаболизме.
Холестерин также является предшественником солей желчных кислот, которые способствуют эмульгированию жиров и их усвоению клетками.Это компонент плазматической мембраны клеток животных и фосфолипидного бислоя. Будучи самой внешней структурой в клетках животных, плазматическая мембрана отвечает за транспорт материалов и распознавание клеток; и он участвует в межклеточной коммуникации. Таким образом, стероиды также играют важную роль в структуре и функции мембран.
Также было обнаружено, что стероиды могут быть активными в головном мозге, где они влияют на нервную систему. Эти нейростероиды изменяют электрическую активность в головном мозге.Они могут активировать или ослаблять рецепторы, которые передают сообщения от нейротрансмиттеров. Поскольку эти нейростероиды могут ослаблять рецепторы и снижать активность мозга, стероиды часто используются в анестетиках.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Стероиды — Химия LibreTexts
Одним из основных классов липидов являются стероиды, структура которых полностью отличается от других классов липидов.Главная особенность стероидов — это кольцевая система из трех циклогексанов и одного циклопентана в конденсированной кольцевой системе, как показано ниже. Могут быть присоединены различные функциональные группы. Главная особенность, как и всех липидов, — это большое количество углерод-водородов, которые делают стероиды неполярными.
Введение
Стероиды включают такие хорошо известные соединения, как холестерин, половые гормоны, противозачаточные таблетки, кортизон и анаболические стероиды.
Холестерин
Самый известный и самый распространенный стероид в организме — холестерин.Холестерин образуется в мозговой ткани, нервной ткани и кровотоке. Это основное соединение, содержащееся в желчных камнях и желчных солях. Холестерин также способствует образованию отложений на внутренних стенках кровеносных сосудов. Эти отложения затвердевают и препятствуют кровотоку. Это состояние, известное как атеросклероз, приводит к различным сердечным заболеваниям, инсультам и высокому кровяному давлению.
В настоящее время проводится много исследований, чтобы определить, существует ли корреляция между уровнем холестерина в крови и рационом питания.Мало того, что холестерин поступает из рациона, холестерин синтезируется в организме из углеводов и белков, а также из жиров. Следовательно, исключение из рациона продуктов, богатых холестерином, не обязательно снижает уровень холестерина в крови. Некоторые исследования показали, что если определенные ненасыщенные жиры и масла заменяют насыщенные жиры, уровень холестерина в крови снижается. Исследования по этой проблеме не завершены.
Структуры половых гормонов
Половые гормоны также являются стероидами.Основной мужской гормон, тестостерон, отвечает за развитие вторичных половых признаков. Два женских половых гормона, прогестерон и эстроген или эстрадиол, контролируют цикл овуляции. Обратите внимание, что мужские и женские гормоны имеют лишь небольшие различия в структуре, но при этом имеют очень разные физиологические эффекты.
Тестостерон способствует нормальному развитию мужских половых органов и синтезируется из холестерина в семенниках. Он также способствует развитию вторичных мужских половых признаков, таких как низкий голос, волосы на лице и теле.Эстроген вместе с прогестероном регулирует изменения, происходящие в матке и яичниках, известные как менструальный цикл. Для получения дополнительной информации см. Контроль над рождаемостью. Эстроген синтезируется из тестостерона путем создания ароматического первого кольца, что приводит к двойным мольным связям, потере метильной группы и образованию спиртовой группы.
Адренокортикоидные гормоны
Адренокортикоидные гормоны являются продуктами надпочечников («надпочечник» означает и , расположенный рядом с почечными (почками).Наиболее важным минералокртикоидом является альдостерон , который регулирует реабсорбцию ионов натрия и хлора в канальцах почек и увеличивает потерю ионов калия. Альдостерон секретируется, когда уровень ионов натрия в крови слишком низок, чтобы почки удерживали ионы натрия. Если уровень натрия повышен, альдостерон не секретируется, поэтому некоторое количество натрия будет потеряно с мочой. Альдостерон также контролирует отек тканей.
Кортизол, самый важный глюкокортиноид, увеличивает концентрацию глюкозы и гликогена в организме.Эти реакции завершаются в печени за счет извлечения жирных кислот из липидных клеток и аминокислот из белков организма для производства глюкозы и гликогена.
Кроме того, кортизол и его кетоновое производное, , кортизон , обладают способностью к воспалительным эффектам. Кортизон или аналогичные синтетические производные, такие как преднизолон, используются для лечения воспалительных заболеваний, ревматоидного артрита и бронхиальной астмы. Использование препаратов кортизона вызывает множество побочных эффектов, поэтому их применение необходимо тщательно контролировать.
Авторы
Миниатюра: шариковая модель молекулы холестерина, соединения, необходимого для жизни животных, которое образует мембраны клеток животных. (Общественное достояние; Jynto).
Кто употребляет анаболические стероиды? | Национальный институт злоупотребления наркотиками (NIDA)
Подавляющее большинство людей, злоупотребляющих стероидами, — это тяжелоатлеты мужского пола, не являющиеся спортсменами, в возрасте от 20 до 30 лет. 1,22 Вопреки распространенному мнению, только около 22 процентов потребителей анаболических стероидов начали употреблять анаболические стероиды в подростковом возрасте. 23 Анаболические стероиды менее распространены среди женщин, поскольку меньше женщин желают чрезмерной мускулистости и маскулинизирующего эффекта стероидов. 22
Мужчины, которые более склонны к употреблению стероидов, как правило, имеют низкую самооценку, более высокий уровень депрессии, больше попыток самоубийства, плохие знания и отношение к здоровью, более активное участие в спорте с акцентом на вес и форму, большую озабоченность родителей по поводу веса и т. Д. показатели расстройств пищевого поведения и употребления психоактивных веществ. 24 Злоупотребление стероидами связано с мышечной дисморфией, поведенческим расстройством, при котором мужчины думают, что они выглядят маленькими и слабыми, даже если они большие и мускулистые (см. «Почему злоупотребляют анаболическими стероидами?»). 25
Некоторые люди, злоупотребляющие стероидами, испытали физическое или сексуальное насилие. В исследовании 506 мужчин, принимавших анаболические стероиды, и 771 мужчины, не принимавшего анаболические стероиды, было выявлено, что потребители значительно чаще, чем люди, не принимавшие анаболические стероиды, сообщали о сексуальном насилии в прошлом. 26 Точно так же было обнаружено, что изнасилованные женщины-штангисты в два раза чаще сообщали об употреблении анаболических стероидов или других предполагаемых препаратов для наращивания мышечной массы по сравнению с теми, кто не подвергался изнасилованию.Более того, почти все женщины, подвергшиеся изнасилованию, сообщили, что после нападения они заметно активизировали занятия бодибилдингом. Они считали, что, будучи крупнее и сильнее, они предотвратят дальнейшие нападения, потому что мужчины сочтут их пугающими или непривлекательными. 27
Трудно оценить истинную распространенность злоупотребления стероидами в Соединенных Штатах, потому что многие опросы, касающиеся незаконного употребления наркотиков, не включают вопросы о стероидах. Тем не менее, ежегодное исследование «Мониторинг будущего», финансируемое NIDA обследование употребления наркотиков и отношения учащихся средних и старших классов в Соединенных Штатах, показывает, что в прошлом году употребление стероидов в целом снизилось среди учащихся 8 и 10 классов после достижения пика в 2000 г.В прошлом году употребление стероидов среди 12-классников увеличилось с 2011 по 2015 год, хотя использование значительно снизилось с 2015 по 2016 год. Уровень использования стероидов среди 12-классников в 2017 году остается относительно стабильным.
Употребление анаболических стероидов в прошлом году среди учащихся средних и старших классов, 2007-2017 гг.
Данные взяты из исследования «Мониторинг будущего» 2017 года, финансируемого Национальным институтом по борьбе со злоупотреблением наркотиками и ежегодно проводимого Институтом социальных исследований Мичиганского университета.Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.

