Калорийность Хурма. Химический состав и пищевая ценность.
Хурма богат такими витаминами и минералами, как: витамином А — 22,2 %, бэта-каротином — 24 %, витамином C — 16,7 %, витамином H — 15 %, кальцием — 12,7 %, магнием — 14 %, железом — 13,9 %, марганцем — 18 %- Витамин А отвечает за нормальное развитие, репродуктивную функцию, здоровье кожи и глаз, поддержание иммунитета.
- В-каротин является провитамином А и обладает антиоксидантными свойствами. 6 мкг бета-каротина эквивалентны 1 мкг витамина А.
- Витамин С участвует в окислительно-восстановительных реакциях, функционировании иммунной системы, способствует усвоению железа. Дефицит приводит к рыхлости и кровоточивости десен, носовым кровотечениям вследствие повышенной проницаемости и ломкости кровеносных капилляров.
- Витамин Н участвует в синтезе жиров, гликогена, метаболизме аминокислот. Недостаточное потребление этого витамина может вести к нарушению нормального состояния кожных покровов.

- Кальций является главной составляющей наших костей, выступает регулятором нервной системы, участвует в мышечном сокращении. Дефицит кальция приводит к деминерализации позвоночника, костей таза и нижних конечностей, повышает риск развития остеопороза.
- Магний участвует в энергетическом метаболизме, синтезе белков, нуклеиновых кислот, обладает стабилизирующим действием для мембран, необходим для поддержания гомеостаза кальция, калия и натрия. Недостаток магния приводит к гипомагниемии, повышению риска развития гипертонии, болезней сердца.
- Железо входит в состав различных по своей функции белков, в том числе ферментов. Участвует в транспорте электронов, кислорода, обеспечивает протекание окислительно- восстановительных реакций и активацию перекисного окисления. Недостаточное потребление ведет к гипохромной анемии, миоглобиндефицитной атонии скелетных мышц, повышенной утомляемости, миокардиопатии, атрофическому гастриту.
- Марганец участвует в образовании костной и соединительной ткани, входит в состав ферментов, включающихся в метаболизм аминокислот, углеводов, катехоламинов; необходим для синтеза холестерина и нуклеотидов.
 Недостаточное потребление сопровождается замедлением роста, нарушениями в репродуктивной системе, повышенной хрупкостью костной ткани, нарушениями углеводного и липидного обмена.
Недостаточное потребление сопровождается замедлением роста, нарушениями в репродуктивной системе, повышенной хрупкостью костной ткани, нарушениями углеводного и липидного обмена.
Полный справочник самых полезных продуктов вы можете посмотреть в приложении «Мой здоровый рацион».
Калорийность Хурма. Химический состав и пищевая ценность.
Химический состав и анализ пищевой ценности
Пищевая ценность и химический состав «Хурма».
В таблице приведено содержание пищевых веществ (калорийности, белков, жиров, углеводов, витаминов и минералов) на 100 грамм съедобной части.
| Нутриент | Количество | Норма** | % от нормы в 100 г | % от нормы в 100 ккал | 100% нормы |
| Калорийность | 70 кКал | 1684 кКал | 4. 2% 2% | 6% | 2406 г |
| Белки | 0.58 г | 76 г | 0.8% | 1.1% | 13103 г |
| Жиры | 0.19 г | 56 г | 0.3% | 0.4% | 29474 г |
| Углеводы | 14.99 г | 219 г | 6.8% | 9.7% | 1461 г |
| Пищевые волокна | 3. 6 г 6 г | 20 г | 18% | 556 г | |
| Вода | 80.32 г | 2273 г | 3.5% | 5% | 2830 г |
| Зола | 0.33 г | ~ | |||
| Витамины | |||||
| Витамин А, РЭ | 81 мкг | 900 мкг | 9% | 12. | 1111 г |
| бета Каротин | 0.253 мг | 5 мг | 5.1% | 7.3% | 1976 г |
| бета Криптоксантин | 1447 мкг | ~ | |||
| Ликопин | 159 мкг | ||||
| Лютеин + Зеаксантин | 834 мкг | ~ | |||
| Витамин В1, тиамин | 0. 03 мг 03 мг | 1.5 мг | 2% | 2.9% | 5000 г |
| Витамин В2, рибофлавин | 0.02 мг | 1.8 мг | 1.1% | 1.6% | 9000 г |
| Витамин В4, холин | 7.6 мг | 500 мг | 1.5% | 2.1% | 6579 г |
| Витамин В6, пиридоксин | 0.1 мг | 2 мг | 5% | 7. 1% 1% | 2000 г |
| Витамин В9, фолаты | 8 мкг | 400 мкг | 2% | 5000 г | |
| Витамин C, аскорбиновая | 7.5 мг | 90 мг | 8.3% | 11.9% | 1200 г |
| Витамин Е, альфа токоферол, ТЭ | 0.73 мг | 15 мг | 4.9% | 7% | 2055 г |
| Витамин К, филлохинон | 2. 6 мкг 6 мкг | 120 мкг | 2.2% | 3.1% | 4615 г |
| Витамин РР, НЭ | 0.1 мг | 20 мг | 0.5% | 0.7% | 20000 г |
| Макроэлементы | |||||
| Калий, K | 161 мг | 2500 мг | 6.4% | 9.1% | 1553 г |
| Кальций, Ca | 1000 мг | 0. 8% 8% | 1.1% | 12500 г | |
| Магний, Mg | 9 мг | 400 мг | 2.3% | 3.3% | 4444 г |
| Натрий, Na | 1 мг | 1300 мг | 0.1% | 0.1% | 130000 г |
| Сера, S | 5.8 мг | 1000 мг | 0.6% | 0.9% | 17241 г |
| Фосфор, P | 17 мг | 800 мг | 2. 1% 1% | 3% | 4706 г |
| Микроэлементы | |||||
| Железо, Fe | 0.15 мг | 18 мг | 0.8% | 1.1% | 12000 г |
| Марганец, Mn | 0.355 мг | 2 мг | 17.8% | 25.4% | 563 г |
| Медь, Cu | 113 мкг | 1000 мкг | 11. 3% 3% | 16.1% | 885 г |
| Селен, Se | 0.6 мкг | 55 мкг | 1.1% | 1.6% | 9167 г |
| Цинк, Zn | 0.11 мг | 12 мг | 0.9% | 1.3% | 10909 г |
| Усвояемые углеводы | |||||
| Моно- и дисахариды (сахара) | 12. 53 г 53 г | max 100 г | |||
| Глюкоза (декстроза) | 5.44 г | ~ | |||
| Сахароза | 1.54 г | ~ | |||
| Фруктоза | 5.56 г | ~ | |||
| Незаменимые аминокислоты | |||||
| Аргинин* | 0. 025 г 025 г | ~ | |||
| Валин | 0.03 г | ~ | |||
| Гистидин* | 0.012 г | ~ | |||
| Изолейцин | 0.025 г | ~ | |||
| Лейцин | 0. 042 г 042 г | ~ | |||
| Лизин | 0.033 г | ~ | |||
| Метионин | 0.005 г | ~ | |||
| Треонин | 0.03 г | ~ | |||
| Триптофан | 0. 01 г 01 г | ~ | |||
| Фенилаланин | 0.026 г | ~ | |||
| Заменимые аминокислоты | |||||
| Аланин | 0.029 г | ~ | |||
| Аспарагиновая кислота | 0. 057 г 057 г | ~ | |||
| Глицин | 0.025 г | ~ | |||
| Глутаминовая кислота | 0.076 г | ~ | |||
| Пролин | 0.022 г | ~ | |||
| Серин | 0. 022 г 022 г | ~ | |||
| Тирозин | 0.016 г | ~ | |||
| Цистеин | 0.013 г | ~ | |||
| Стеролы (стерины) | |||||
| Фитостеролы | 4 мг | ~ | |||
| Насыщенные жирные кислоты | |||||
| Насыщеные жирные кислоты | 0. 02 г 02 г | max 18.7 г | |||
| 14:0 Миристиновая | 0.001 г | ~ | |||
| 16:0 Пальмитиновая | 0.016 г | ~ | |||
| 18:0 Стеариновая | 0.003 г | ~ | |||
| Мононенасыщенные жирные кислоты | 0. 037 г 037 г | min 16.8 г | 0.2% | 0.3% | |
| 18:1 Олеиновая (омега-9) | 0.037 г | ~ | |||
| Полиненасыщенные жирные кислоты | 0.043 г | от 11.2 до 20.6 г | 0.4% | 0.6% | |
| 18:2 Линолевая | 0.039 г | ~ | |||
| 18:3 Линоленовая | 0. 004 г 004 г | ~ | |||
| Омега-3 жирные кислоты | 0.004 г | от 0.9 до 3.7 г | 0.4% | 0.6% | |
| Омега-6 жирные кислоты | 0.039 г | от 4.7 до 16.8 г | 0.8% | 1.1% |
Энергетическая ценность Хурма составляет 70 кКал.
Основной источник: Создан в приложении пользователем. Подробнее.
Подробнее.
** В данной таблице указаны средние нормы витаминов и минералов для взрослого человека. Если вы хотите узнать нормы с учетом вашего пола, возраста и других факторов, тогда воспользуйтесь приложением «Мой здоровый рацион».
Калорийность хурма. Химический состав и пищевая ценность.
Химический состав и анализ пищевой ценности
Пищевая ценность и химический состав «хурма».
В таблице приведено содержание пищевых веществ (калорийности, белков, жиров, углеводов, витаминов и минералов) на 100 грамм съедобной части.
| Нутриент | Количество | Норма** | % от нормы в 100 г | % от нормы в 100 ккал | 100% нормы |
| Калорийность | 274 кКал | 1684 кКал | 16. 3% 3% | 5.9% | 615 г |
| Белки | 1.38 г | 76 г | 1.8% | 0.7% | 5507 г |
| Жиры | 0.59 г | 56 г | 1.1% | 0.4% | 9492 г |
| Углеводы | 58.93 г | 219 г | 26.9% | 9.8% | 372 г |
| Пищевые волокна | 14. 5 г 5 г | 20 г | 72.5% | 26.5% | 138 г |
| Вода | 23.01 г | 2273 г | 1% | 0.4% | 9878 г |
| Зола | 1.59 г | ~ | |||
| Витамины | |||||
| Витамин А, РЭ | 38 мкг | 900 мкг | 4. 2% 2% | 1.5% | 2368 г |
| альфа Каротин | 18 мкг | ~ | |||
| бета Каротин | 0.374 мг | 5 мг | 7.5% | 2.7% | 1337 г |
| бета Криптоксантин | 156 мкг | ~ | |||
| Витамин В2, рибофлавин | 0. 029 мг 029 мг | 1.8 мг | 1.6% | 0.6% | 6207 г |
| Витамин РР, НЭ | 0.18 мг | 20 мг | 0.9% | 0.3% | 11111 г |
| Макроэлементы | |||||
| Калий, K | 802 мг | 2500 мг | 32.1% | 11.7% | 312 г |
| Кальций, Ca | 25 мг | 1000 мг | 2. 5% 5% | 0.9% | 4000 г |
| Магний, Mg | 31 мг | 400 мг | 7.8% | 2.8% | 1290 г |
| Натрий, Na | 2 мг | 1300 мг | 0.2% | 0.1% | 65000 г |
| Сера, S | 13.8 мг | 1000 мг | 1.4% | 0.5% | 7246 г |
| Фосфор, P | 81 мг | 800 мг | 10. 1% 1% | 3.7% | 988 г |
| Микроэлементы | |||||
| Железо, Fe | 0.74 мг | 18 мг | 4.1% | 1.5% | 2432 г |
| Марганец, Mn | 1.39 мг | 2 мг | 69.5% | 25.4% | 144 г |
| Медь, Cu | 442 мкг | 1000 мкг | 44. 2% 2% | 16.1% | 226 г |
| Цинк, Zn | 0.42 мг | 12 мг | 3.5% | 1.3% | 2857 г |
| Незаменимые аминокислоты | |||||
| Аргинин* | 0.059 г | ~ | |||
| Валин | 0. 072 г 072 г | ~ | |||
| Гистидин* | 0.027 г | ~ | |||
| Изолейцин | 0.06 г | ~ | |||
| Лейцин | 0.101 г | ~ | |||
| Лизин | 0. 078 г 078 г | ~ | |||
| Метионин | 0.012 г | ~ | |||
| Треонин | 0.071 г | ~ | |||
| Триптофан | 0.024 г | ~ | |||
| Фенилаланин | 0. 063 г 063 г | ~ | |||
| Заменимые аминокислоты | |||||
| Аланин | 0.068 г | ~ | |||
| Аспарагиновая кислота | 0.136 г | ~ | |||
| Глицин | 0. 06 г 06 г | ~ | |||
| Глутаминовая кислота | 0.179 г | ~ | |||
| Пролин | 0.053 г | ~ | |||
| Серин | 0.053 г | ~ | |||
| Тирозин | 0. 039 г 039 г | ~ | |||
| Цистеин | 0.03 г | ~ |
Энергетическая ценность хурма составляет 274 кКал.
Основной источник: Создан в приложении пользователем. Подробнее.
** В данной таблице указаны средние нормы витаминов и минералов для взрослого человека. Если вы хотите узнать нормы с учетом вашего пола, возраста и других факторов, тогда воспользуйтесь приложением «Мой здоровый рацион».
Хурма — химический состав, пищевая ценность, БЖУ
Вес порции, г { { Поштучно { { {1 шт — 25,0 г2 шт — 50,0 г3 шт — 75,0 г4 шт — 100,0 г5 шт — 125,0 г6 шт — 150,0 г7 шт — 175,0 г8 шт — 200,0 г9 шт — 225,0 г10 шт — 250,0 г11 шт — 275,0 г12 шт — 300,0 г13 шт — 325,0 г14 шт — 350,0 г15 шт — 375,0 г16 шт — 400,0 г17 шт — 425,0 г18 шт — 450,0 г19 шт — 475,0 г20 шт — 500,0 г21 шт — 525,0 г22 шт — 550,0 г23 шт — 575,0 г24 шт — 600,0 г25 шт — 625,0 г26 шт — 650,0 г27 шт — 675,0 г28 шт — 700,0 г29 шт — 725,0 г30 шт — 750,0 г31 шт — 775,0 г32 шт — 800,0 г33 шт — 825,0 г34 шт — 850,0 г35 шт — 875,0 г36 шт — 900,0 г37 шт — 925,0 г38 шт — 950,0 г39 шт — 975,0 г40 шт — 1 000,0 г41 шт — 1 025,0 г42 шт — 1 050,0 г43 шт — 1 075,0 г44 шт — 1 100,0 г45 шт — 1 125,0 г46 шт — 1 150,0 г47 шт — 1 175,0 г48 шт — 1 200,0 г49 шт — 1 225,0 г50 шт — 1 250,0 г51 шт — 1 275,0 г52 шт — 1 300,0 г53 шт — 1 325,0 г54 шт — 1 350,0 г55 шт — 1 375,0 г56 шт — 1 400,0 г57 шт — 1 425,0 г58 шт — 1 450,0 г59 шт — 1 475,0 г60 шт — 1 500,0 г61 шт — 1 525,0 г62 шт — 1 550,0 г63 шт — 1 575,0 г64 шт — 1 600,0 г65 шт — 1 625,0 г66 шт — 1 650,0 г67 шт — 1 675,0 г68 шт — 1 700,0 г69 шт — 1 725,0 г70 шт — 1 750,0 г71 шт — 1 775,0 г72 шт — 1 800,0 г73 шт — 1 825,0 г74 шт — 1 850,0 г75 шт — 1 875,0 г76 шт — 1 900,0 г77 шт — 1 925,0 г78 шт — 1 950,0 г79 шт — 1 975,0 г80 шт — 2 000,0 г81 шт — 2 025,0 г82 шт — 2 050,0 г83 шт — 2 075,0 г84 шт — 2 100,0 г85 шт — 2 125,0 г86 шт — 2 150,0 г87 шт — 2 175,0 г88 шт — 2 200,0 г89 шт — 2 225,0 г90 шт — 2 250,0 г91 шт — 2 275,0 г92 шт — 2 300,0 г93 шт — 2 325,0 г94 шт — 2 350,0 г95 шт — 2 375,0 г96 шт — 2 400,0 г97 шт — 2 425,0 г98 шт — 2 450,0 г99 шт — 2 475,0 г100 шт — 2 500,0 г
Хурма
- Штук4,0
-
Вес с отходами122,0 г
Отходы: чашечка 2%, семечки 16% (18% от веса).
 В расчётах используется
вес только съедобной части продукта.
В расчётах используется
вес только съедобной части продукта.
Хурма — какие витамины содержит
Вес порции, г { { Поштучно { { {1 шт — 25,0 г2 шт — 50,0 г3 шт — 75,0 г4 шт — 100,0 г5 шт — 125,0 г6 шт — 150,0 г7 шт — 175,0 г8 шт — 200,0 г9 шт — 225,0 г10 шт — 250,0 г11 шт — 275,0 г12 шт — 300,0 г13 шт — 325,0 г14 шт — 350,0 г15 шт — 375,0 г16 шт — 400,0 г17 шт — 425,0 г18 шт — 450,0 г19 шт — 475,0 г20 шт — 500,0 г21 шт — 525,0 г22 шт — 550,0 г23 шт — 575,0 г24 шт — 600,0 г25 шт — 625,0 г26 шт — 650,0 г27 шт — 675,0 г28 шт — 700,0 г29 шт — 725,0 г30 шт — 750,0 г31 шт — 775,0 г32 шт — 800,0 г33 шт — 825,0 г34 шт — 850,0 г35 шт — 875,0 г36 шт — 900,0 г37 шт — 925,0 г38 шт — 950,0 г39 шт — 975,0 г40 шт — 1 000,0 г41 шт — 1 025,0 г42 шт — 1 050,0 г43 шт — 1 075,0 г44 шт — 1 100,0 г45 шт — 1 125,0 г46 шт — 1 150,0 г47 шт — 1 175,0 г48 шт — 1 200,0 г49 шт — 1 225,0 г50 шт — 1 250,0 г51 шт — 1 275,0 г52 шт — 1 300,0 г53 шт — 1 325,0 г54 шт — 1 350,0 г55 шт — 1 375,0 г56 шт — 1 400,0 г57 шт — 1 425,0 г58 шт — 1 450,0 г59 шт — 1 475,0 г60 шт — 1 500,0 г61 шт — 1 525,0 г62 шт — 1 550,0 г63 шт — 1 575,0 г64 шт — 1 600,0 г65 шт — 1 625,0 г66 шт — 1 650,0 г67 шт — 1 675,0 г68 шт — 1 700,0 г69 шт — 1 725,0 г70 шт — 1 750,0 г71 шт — 1 775,0 г72 шт — 1 800,0 г73 шт — 1 825,0 г74 шт — 1 850,0 г75 шт — 1 875,0 г76 шт — 1 900,0 г77 шт — 1 925,0 г78 шт — 1 950,0 г79 шт — 1 975,0 г80 шт — 2 000,0 г81 шт — 2 025,0 г82 шт — 2 050,0 г83 шт — 2 075,0 г84 шт — 2 100,0 г85 шт — 2 125,0 г86 шт — 2 150,0 г87 шт — 2 175,0 г88 шт — 2 200,0 г89 шт — 2 225,0 г90 шт — 2 250,0 г91 шт — 2 275,0 г92 шт — 2 300,0 г93 шт — 2 325,0 г94 шт — 2 350,0 г95 шт — 2 375,0 г96 шт — 2 400,0 г97 шт — 2 425,0 г98 шт — 2 450,0 г99 шт — 2 475,0 г100 шт — 2 500,0 г
Хурма
- Штук4,0
-
Вес с отходами122,0 г
Отходы: чашечка 2%, семечки 16% (18% от веса).
 В расчётах используется
вес только съедобной части продукта.
В расчётах используется
вес только съедобной части продукта.
польза и вред для организма, состав и калорийность
Пища богов – так переводится название с латинского языка. Полезные свойства хурмы многочисленны. Фрукт выводит токсины, шлаки из организма. Содержит марганец, натрий, магний, селен, железо, натрий. Есть фрукты полезно женщинам и мужчинам. Его включают в свой рацион при похудении. У курящих людей – ягода должна присутствовать в рационе, поскольку она содержит большое количество бета-каротина. Чтобы иметь здоровую и красивую кожу, блестящие волосы и крепкие ногти – желательно периодически употреблять эту ягоду. Полезный фрукт утоляет голод. Употребление полезных плодов это профилактика хорошего зрения. Итак, хурма — польза и вред — рассмотрим эти вопросы подробнее.
Как и где растет хурма
Хурма растет в теплых странах: Испания, Китай, Индия, Турция и другие. Известно, что родина Китай, но этот фрукт уже давно полюбился жителям остальных стран.![]() В России продаются плоды, которые выращиваются в Абхазии, Грузии или на Кавказе.
В России продаются плоды, которые выращиваются в Абхазии, Грузии или на Кавказе.
Вкус у мякоти плодов разный – все зависит от выбранного сорта, на какой почве произрастал кустарник, а также температуры, где была выращена полезная ягода.
Многих интересует вопрос, к какому семейству относится хурма. Это род тропических или субтропических вечнозеленых кустарников Эбеновые. Деревья живут 500 лет, имеют съедобные плоды. Если интересно — хурма фрукт или ягода, то она относится к ягодам, хотя в быту считают, что это фрукт.
Калорийность хурмы
Хурма королек калорийность имеет невысокую, поэтому эти сочные ягоды в рационе питания даже у людей, желающих похудеть – сплошная польза. Калорий в хурме немного, и если употреблять ее в разумных количествах, то ягода пойдет только на пользу. Но в продукте не сбалансированы белки жиры и углеводы (углеводы – в приоритете), фрукт утоляет голод за счет содержания сахаров, и при этом совсем не вредит организму – снова польза очевидна.
Свежей
Калорийность хурмы в свежем виде составляет 66 килокалорий. Она содержит 15 грамм углеводов, небольшое (в десятых) количество белков и жиров.
Сушеной
А вот в сушеном виде хурма на много калорийнее – 274 килокалории, ведь при усыхании испаряется влага. Ягода не становится менее полезной, сушеный продукт помогает бороться с анемией, содержит антиоксиданты, которые предотвращают старение организма.
В мороженом фрукте
Полезная ягода доступна не круглый год, хурму иногда замораживают. Энергетическая ценность составит 66 ккал на 100 грамм. Польза хурмы в замороженном виде несколько ниже, но в любом случае хурма богата минералами витаминами и микроэлементами.
Хурма химический состав
Пищевая ценность хурмы – 66 ккал, это мало, несмотря на сладкий вкус этой ягоды. Плоды полезны ввиду того, что обладают большим содержанием витаминов и минералов. Рассмотрим их подробнее:
- аскорбиновая кислота;
- пантотеновая кислота;
- бета-криптоксантин;
- каротиноиды;
- бета-каротин;
- биотин;
- лютеин;
- зеаксантин.

Сколько сахара в хурме и можно ли ее кушать диабетикам? Гликемический индекс плода 50, как и содержание углеводов. Поэтому, если вы страдаете диабетом и хотите уберечь себя от скачков сахара в крови, от этого фрукта лучше воздержаться, либо кушать в очень незначительных количествах.
Ученые утверждают, что химический состав ягоды превышает 10% от суточной нормы, необходимой человеку для хорошего самочувствия. Что касается минералов, то их предостаточно:
- йод
- рубидий
- кобальт
- литий
- марганец
- медь
- железо
- ванадий
- калий
- хром.
Витамины в хурме также многочисленны, их гораздо больше, чем в других плодах – например, в яблоках или апельсинах: витамины группы В, С, Е, Д, К, РР, витамин U.
В плодах содержатся танины, моно — и дисахариды, в составе которых присутствует глюкоза, клетчатка, пектин. Польза и вред семечек (косточек) не доказаны, но в пищу они не употребляются.
Полезные свойства и применение хурмы
О том, что продукт обладает полезными свойствами, становится понятно уже по химическому составу ягоды. Рассмотрим подробно, на какие органы и системы влияет эта ягода.
Рассмотрим подробно, на какие органы и системы влияет эта ягода.
Сердце
Благотворно воздействует на сердечно сосудистую систему. Врачи-кардиологи утверждают, что при предрасположенности к сердечным болезням фрукт будет полезен. Избежите серьезных заболеваний – инсультов, инфарктов. В данной области лечебные свойства хурмы отрицать сложно.
Глаза
Витамин А содержится в больших количествах – об этом свидетельствует ее оранжевый цвет. Плод полезен для глазного аппарата и в том случае, если человек много времени проводит у монитора компьютера, поскольку ретинол (витамин А) способствует выработке слезы, которая отвечает за увлажнение глазницы.
Ротовая полость
Фрукты содержат кальций, элемент, отвечающий за нормальную функцию костной ткани. Чтобы предотвратить кровоточивость десен, стоматит, кариес и прочие неприятные заболевания полости рта, нужно есть полезную ягоду.
Желудочно-кишечный тракт
Благодаря клетчатке нормализует работу двенадцатиперстной кишки, следовательно, и стабилизирует стул. Регулярное употребление фруктов способствует выведению, шлаков и токсинов из организма. Пектин убивает болезнетворные микроорганизмы. Вяжущие волокна полезной хурмы благотворно воздействуют на слизистую желудка, предотвращая гастрит и язву.
Регулярное употребление фруктов способствует выведению, шлаков и токсинов из организма. Пектин убивает болезнетворные микроорганизмы. Вяжущие волокна полезной хурмы благотворно воздействуют на слизистую желудка, предотвращая гастрит и язву.
Эндокринная система
Чем полезна хурма и что она лечит при нарушениях эндокринного характера? При проблемах с щитовидкой в организме присутствует недостаток йода. В хурме этот элемент содержится, поэтому плод полезен при йододефиците. Если употреблять фрукты регулярно, нормализуется работа щитовидной железы. Это хорошая профилактикоа гипотиреоза (недостатка гормонов щитовидной железы).
Мочевыделительная система
Магний, а также калий – это именно те элемент, которые необходимы для нормальной работы мочеполовой системы. Употребляя хурму можно снизить риск образования камней в почках, вывести лишнюю соль за счет чего спадают отеки. Если у человека в организме не хватает магния – это ведет не только к обезвоживанию, но и к проблемам с сердечнососудистой деятельностью.
ЦНС
Фрукт содержит витамины, относящиеся к группе В. Они отвечают за хорошее настроение и выработку эндорфинов. Два небольших плода нужно ежедневно, чтобы повысить работоспособность и замечательно себя чувствовать. При стрессах, чрезмерной утомляемости ягода будет необычайно полезной.
Иммунитет
За счет содержания витамина С обладает свойством оберегать от вирусных инфекций, гриппа, ОРВИ. В осенний, весенний период стоит чаще есть эти полезные фрукты. При ЛОР заболеваниях, пневмонии также можно есть хурму так как выводит из бронхов слизь. В некоторых странах соком ягоды полощут горло, поскольку плод мощный антисептик. Полезные свойства хурмы при лечении вирусных болезней были отмечены даже врачами.
Кровеносная система
Хурма полезна при анемии, если в организме недостаточно железа. Способствует очищению и разжижению крови, выработке эритроцитов, также насыщает ткани кислородом. За счет этого у человека повышается иммунитет, нормализуется давление, ускоряется метаболизм.
Стоит помнить о том, что при диабете 2 типа хурма не так уж и полезна. Это связано с тем, что в ней содержится много сахаров, которые провоцируют скачки сахара в крови.
Польза хурмы для женщин
Женщинам рекомендуют регулярно употреблять хурму, и не только, чтобы иметь красивую кожу и волосы. За счет содержания микроэлементов и витаминов польза хурмы для организма женщины неоценима:
- При диете питание обычно несбалансированно, и организму может не хватать большого количества полезных веществ. Одна штучка в день покрывает недостаток необходимых веществ для сохранения нормальной трудоспособности и самочувствия.
- При климаксе женщины страдают от неприятных симптомов – перепады настроения, приливы жара. В полезных плодах хурмы содержится витамин В, который нормализует данные проблемы.
- Также элементы помогут устранить болезненные ощущения во время менструаций – от них страдают как девушки, так и женщины. Во время месячных актуально кушать хурму, ведь она содержит калий, магний, контролирует объем выделяемой крови, и помогает организму поддерживать нормальный уровень гемоглобина.
 Также предупреждает появление гинекологических заболеваний.
Также предупреждает появление гинекологических заболеваний. - Женщины больше, чем мужчины подвержены скачкам давления. При ежедневном употребили полезной ягоды их можно избежать.
- Продукт употребляют, если стремятся сохранить волосы здоровыми – причем не только внутрь, но и наружно. Существует много рецептов масок для волос с добавлением этого полезного продукта.
При похудении плод кушать можно ввиду того, что клетчатка способствует нормализации перистальтики кишечника. Учитывайте, что в продукте содержится большое количество сахаров, поэтому при чрезмерном потреблении хурмы процесс похудения замедляется.
Польза хурмы для беременных
Доктора при вынашивании ребенка запрещают употреблять медикаменты, поскольку они навредят будущему малышу. Защитить себя от вирусных болезней, предупредить анемию, укрепить иммунитет поможет солнечный фрукт.
Содержится в ягоде и витамин А – он отвечает за качество кожных покровов, а будущим мама это важно, поскольку при беременности они набирают вес. Если хочется остаться в форме, избежать растяжек – кушайте этот плод. Полезность хурмы также заключается в том, что плод препятствует появлению отеков, судорог, устраняет спазмы матки. При беременности употребление будет полезным.
Если хочется остаться в форме, избежать растяжек – кушайте этот плод. Полезность хурмы также заключается в том, что плод препятствует появлению отеков, судорог, устраняет спазмы матки. При беременности употребление будет полезным.
Польза для мужчин
Хурма — профилактика заболеваний предстательной железы, ягода улучшает потенцию. Если мужчина планирует зачать ребенка, стоит включить в питание, поскольку особые элементы позволяют увеличить количество сперматозоидов и повысить их качество.
Аденома простаты – заболевание, которое провоцируют скачки пролактина в крови. Польза хурмы в том, что она снижает синтез этого фермента, предотвращая развитие опасного заболевания.
Полезный фрукт повышает физическую выносливость, нормализует сердечнососудистую деятельность, повышает работоспособность – именно эти факторы являются ключевыми для здорового и успешного мужчины. Особенно полезные и вкусные сорта шарон – они распространены в нашем регионе.
Польза и вред хурмы для детей
Детям этот плод понравится на вкус, а польза его обеспечит нормальное умственное и физическое развитие. Но вот малышам давать этот плод нельзя. Танин при попадании в желудок образовывает липкую смесь, она становится одним комом, и может спровоцировать боли в животе замедляя переваривания и усвоение поступающей пищи. Детям от 6 лет употреблять с осторожностью. Более взрослых детей, с 10 лет можно без опасений баловать хурмой – ведь она так полезна.
Но вот малышам давать этот плод нельзя. Танин при попадании в желудок образовывает липкую смесь, она становится одним комом, и может спровоцировать боли в животе замедляя переваривания и усвоение поступающей пищи. Детям от 6 лет употреблять с осторожностью. Более взрослых детей, с 10 лет можно без опасений баловать хурмой – ведь она так полезна.
Вред хурмы
Все полезно в меру, и вред хурмы тоже можно ощутить. Многих интересует, в чем заключается польза и вред кожуры хурмы. В некоторых сортах ее едят – в полезной кожуре содержатся витамины. Тем не менее, кожица может быть терпкой, плотной и невкусной.
Лучше есть только мякоть. Но стоит учитывать, что в плоде содержатся пищевые волокна, танин, сахариды. Поэтому при употреблении в пищу желательно учитывать некоторые особенности этого плода. Нельзя есть:
- людям, с предрасположенностью к ожирению
- маленьким детям до 3 лет
- сахарный диабет 1 типа.
Нельзя есть хурму в постоперационный период на органах ЖКТ. Во время реабилитации стоит придерживаться строгой диеты, если ее нарушать, то впоследствии на тканях могут образоваться спайки. При ожирении не злоупотребляют этим продуктом ввиду большого содержания углеводов. Нельзя есть хурму во время обострения панкреатита из-за большого содержания клетчатки, которая трудно переваривается. В дальнейшем кушать плод можно только под строгим наблюдением лечащего врача.
Во время реабилитации стоит придерживаться строгой диеты, если ее нарушать, то впоследствии на тканях могут образоваться спайки. При ожирении не злоупотребляют этим продуктом ввиду большого содержания углеводов. Нельзя есть хурму во время обострения панкреатита из-за большого содержания клетчатки, которая трудно переваривается. В дальнейшем кушать плод можно только под строгим наблюдением лечащего врача.
Свойства хурмы — ботанический онлайн
В этом разделе вы найдете информацию о файлах cookie, которые могут быть созданы с помощью этой веб-службы. Botanical-online, как и большинство других веб-сайтов в Интернете, использует свои собственные и сторонние файлы cookie для улучшения взаимодействия с пользователем и обеспечения доступного и адаптированного просмотра. Ниже вы найдете подробную информацию о файлах cookie, типах файлов cookie, используемых на этом веб-сайте, о том, как отключить их в вашем браузере и как заблокировать их во время просмотра, таким образом, соблюдение нормативных требований в отношении файлов cookie (Закон 34/2002 г. 11 июля об услугах информационного общества и электронной коммерции (LSSI), который переносит Директиву 2009/136 / CE, также называемую «Директивой о файлах cookie», в испанское законодательство).
11 июля об услугах информационного общества и электронной коммерции (LSSI), который переносит Директиву 2009/136 / CE, также называемую «Директивой о файлах cookie», в испанское законодательство).
Что такое файлы cookie?
Файлы cookie — это текстовые файлы, которые браузеры или устройства создают при посещении веб-сайтов в Интернете. Они используются для хранения информации о посещении и соответствуют следующим требованиям:
- Для обеспечения правильной работы веб-сайта.
- Для установления уровней защиты пользователей от кибератак.
- Для сохранения предпочтений просмотра.
- Чтобы узнать опыт просмотра пользователем
- Для сбора анонимной статистической информации для повышения качества.
- Предлагать персонализированный рекламный контент
Файлы cookie связаны только с анонимным пользователем. Компьютер или устройство не содержат ссылок, раскрывающих личные данные. В любое время можно получить доступ к настройкам браузера, чтобы изменить и / или заблокировать установку отправленных файлов cookie, не препятствуя доступу к контенту. Однако сообщается, что это может повлиять на качество работы служб.
Однако сообщается, что это может повлиять на качество работы служб.
Какую информацию хранит файл cookie?
Файлы cookie обычно не хранят конфиденциальную информацию о человеке, такую как кредитные карты, банковские реквизиты, фотографии, личную информацию и т. Д.Данные, которые они хранят, носят технический характер.
Какие типы файлов cookie существуют?
Существует 2 типа файлов cookie в зависимости от их управления:
- Собственные файлы cookie: те, которые отправляются в браузер или устройство и управляются исключительно нами для наилучшего функционирования Веб-сайта.
- Сторонние файлы cookie: те, которые отправляются в браузер или устройство и управляются третьими сторонами. Они созданы не в нашем домене. У нас нет доступа к сохраненным данным (например, нажатием кнопок социальных сетей или просмотром видео, размещенных на другом веб-сайте), которые устанавливаются другим доменом нашего веб-сайта.Мы не можем получить доступ к данным, хранящимся в файлах cookie других веб-сайтов, когда вы просматриваете вышеупомянутые веб-сайты.

Какие файлы cookie используются на этом веб-сайте?
При просмотре Botanical-online будут созданы собственные и сторонние файлы cookie. Они используются для хранения и управления информацией о конфигурации навигации, веб-аналитики и персонализации рекламы. Сохраненные данные являются техническими и ни в коем случае не личной информацией для идентификации навигатора.
Ниже приведена таблица с указанием наиболее важных файлов cookie, используемых на этом веб-сайте, и их назначения:
Собственные файлы cookie
| Имя файла cookie | Назначение |
| aviso_idioma | Принятие раздела уведомление (язык согласно браузеру посетителя).Технические файлы cookie. |
| tocplus_hidetoc | Отображение или сбор содержания. Технические файлы cookie |
| adGzcDpEokBbCn XztAIvbJNxM sdLtvFO | Создает случайные буквенно-цифровые данные для защиты веб-сайта путем обнаружения и предотвращения вредоносных действий. |
Сторонние файлы cookie
| Имя файла cookie | Назначение |
| _gid _ga _gat_gtag_ * | Относится к аналитической или статистической функции посещаемости сайта.Идентификаторы сохраняются для подсчета количества посещений, дат доступа, географического положения, а также других статистических функций. Аналитический cookie. |
| __gads | Относится к рекламе, отображаемой на сайте. Рекламный файл cookie |
| IDE DSID СОГЛАСИЕ NID | Создано службами Google (например, reCaptcha, Youtube, поиск. Технические файлы cookie. |
| Youtube | Файлы cookie для интеграции видеосервиса YouTube на веб-сайт.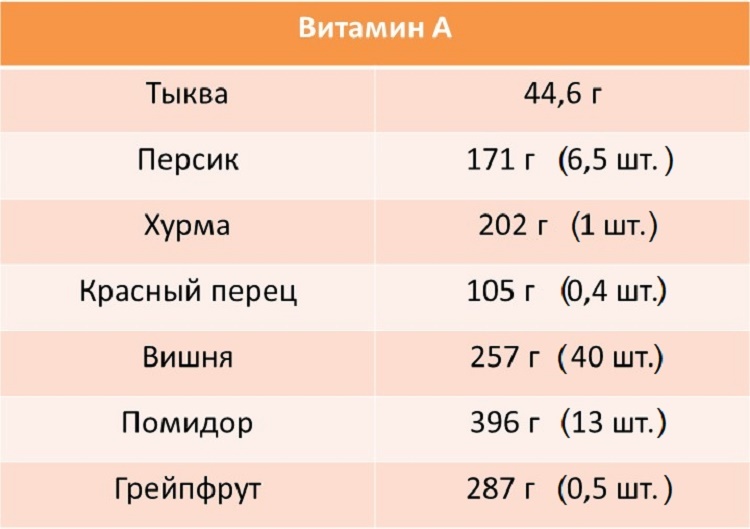 Социальный файл cookie. Социальный файл cookie. |
Как изменить настройки файлов cookie?
Вы можете ограничить, заблокировать или удалить файлы cookie Botanical-online или любой другой веб-сайт, используя свой интернет-браузер. У каждого браузера своя конфигурация. Вы можете увидеть, как действовать дальше, в разделе «Справка». Затем мы показываем список для работы с основными текущими браузерами:
Как изменить настройки файлов cookie на этом сайте?
Напоминаем, что вы можете в любое время просмотреть предпочтения относительно принятия или отказа от файлов cookie на этом сайте, щелкнув «Дополнительная информация» в сообщении о принятии или нажав «Политика использования файлов cookie», постоянно присутствующая на всех страницах сайта.
Химический состав, физико-химические характеристики и пищевая ценность семян Lannea kerstingii и растительного масла
Изучены химический состав, основные физико-химические свойства и питательная ценность муки из семян и масла семян Lannea kerstingii . Результаты показали, что семена содержали 3,61% влаги, 57,85% жира, 26,39% белка, 10,07% углеводов и 2,08% золы. Калий был преобладающим минералом, за ним следовали магний и кальций. Уровни незаменимых аминокислот были выше, чем предполагаемые потребности в аминокислотах ФАО / ВОЗ / УООН, за исключением лизина.Состав жирных кислот показал, что олеиновая кислота была основной жирной кислотой, за ней следовали пальмитиновая, линолевая и стеариновая кислоты. Физико-химические свойства масла семян: температура плавления 19,67 ° C; показатель преломления (25 ° C) 1,47; йодное число, 60,72 / 100 г масла; пероксидное число 0,99 мэкв. О 2 / кг масла; -анизидиновое число 0,08; показатель общего окисления (TOTOX) 2,06; индекс окислительной стабильности (120 ° C), 52,53 ч; свободные жирные кислоты 0,39%; кислотное число 0,64 мг КОН / г масла; значение омыления, 189.73. Общее количество токоферолов, каротиноидов и стеринов составляло 578,60, 4,60 и 929,50 мг / кг масла соответственно.
Результаты показали, что семена содержали 3,61% влаги, 57,85% жира, 26,39% белка, 10,07% углеводов и 2,08% золы. Калий был преобладающим минералом, за ним следовали магний и кальций. Уровни незаменимых аминокислот были выше, чем предполагаемые потребности в аминокислотах ФАО / ВОЗ / УООН, за исключением лизина.Состав жирных кислот показал, что олеиновая кислота была основной жирной кислотой, за ней следовали пальмитиновая, линолевая и стеариновая кислоты. Физико-химические свойства масла семян: температура плавления 19,67 ° C; показатель преломления (25 ° C) 1,47; йодное число, 60,72 / 100 г масла; пероксидное число 0,99 мэкв. О 2 / кг масла; -анизидиновое число 0,08; показатель общего окисления (TOTOX) 2,06; индекс окислительной стабильности (120 ° C), 52,53 ч; свободные жирные кислоты 0,39%; кислотное число 0,64 мг КОН / г масла; значение омыления, 189.73. Общее количество токоферолов, каротиноидов и стеринов составляло 578,60, 4,60 и 929,50 мг / кг масла соответственно. γ, -токоферол (82%), лютеин (80%) и β -ситостерин (93%) были наиболее распространенными формами токоферолов, каротиноидов и стеролов, соответственно. Семена L. kerstingii представляют собой альтернативный источник стабильного растительного масла и белка для пищевых и промышленных применений.
γ, -токоферол (82%), лютеин (80%) и β -ситостерин (93%) были наиболее распространенными формами токоферолов, каротиноидов и стеролов, соответственно. Семена L. kerstingii представляют собой альтернативный источник стабильного растительного масла и белка для пищевых и промышленных применений.
1. Введение
В июне 2013 года Организация Объединенных Наций прогнозировала, что население мира достигнет 9 человек.6 миллиардов к 2050 году с нынешних 7,4 миллиарда [1]. Рост мирового населения увеличивает спрос на продукты питания. По оценкам, масличные культуры должны вырасти на 133 миллиона тонн, чтобы достичь 282 миллионов тонн, чтобы удовлетворить спрос. Четыре масличные культуры (масличная пальма, соя, рапс и подсолнечник) составляют 83% мирового производства [2]. Основные районы выращивания масличных культур находятся в зонах умеренного климата. На Америку и Европу в совокупности приходится более 60% мирового производства масличных семян, тогда как значительно меньшее производство (<5%) производится в тропических регионах, таких как Африка, Малайзия и Индонезия [3]. К наиболее важным тропическим масличным культурам относятся кокос, масличная пальма, арахис и хлопок. Однако в тропической Африке есть много других традиционных масличных культур, которые недостаточно эксплуатируются, поскольку их питательная и экономическая ценность малоизвестна. Эти масла происходят из множества ботанических семейств, включая Anacardiaceae в Западной Африке. Семейство Anacardiaceae включает около 70 родов и 600 видов, включая виды, богатые маслом и белком, например, Pistacia vera L., Sclerocarya birrea (A.Rich.) Hochst., И Lannea microcarpa Engl. et K. Krause [4–6]. Lannea kerstingii Engl. et K. Krause , , близкий родственник Lannea microcarpa , широко распространен в регионе к югу от Сахары от Сенегала до Камеруна. Масло из семян L. kerstingii традиционно используется в Буркина-Фасо в качестве пищи, лекарств и для ухода за кожей [7]. Однако приблизительные составы жирных кислот, аминокислот, витаминов, стеролов и минералов, которые отражают питательную ценность семян и физико-химические свойства, такие как точка плавления, показатель преломления, йодное число, пероксидное число, p -анизидиновое число , кислотное число, число омыления, p, -анизидиновое число и окислительная стабильность, которые определяют использование и применение масел из семян семян, еще не были проанализированы для л.
К наиболее важным тропическим масличным культурам относятся кокос, масличная пальма, арахис и хлопок. Однако в тропической Африке есть много других традиционных масличных культур, которые недостаточно эксплуатируются, поскольку их питательная и экономическая ценность малоизвестна. Эти масла происходят из множества ботанических семейств, включая Anacardiaceae в Западной Африке. Семейство Anacardiaceae включает около 70 родов и 600 видов, включая виды, богатые маслом и белком, например, Pistacia vera L., Sclerocarya birrea (A.Rich.) Hochst., И Lannea microcarpa Engl. et K. Krause [4–6]. Lannea kerstingii Engl. et K. Krause , , близкий родственник Lannea microcarpa , широко распространен в регионе к югу от Сахары от Сенегала до Камеруна. Масло из семян L. kerstingii традиционно используется в Буркина-Фасо в качестве пищи, лекарств и для ухода за кожей [7]. Однако приблизительные составы жирных кислот, аминокислот, витаминов, стеролов и минералов, которые отражают питательную ценность семян и физико-химические свойства, такие как точка плавления, показатель преломления, йодное число, пероксидное число, p -анизидиновое число , кислотное число, число омыления, p, -анизидиновое число и окислительная стабильность, которые определяют использование и применение масел из семян семян, еще не были проанализированы для л. kerstingii семена и растительное масло. Таким образом, в данном исследовании изучались химический состав, физико-химические свойства и питательная ценность семян L. kerstingii . Работа направлена на изучение потенциальных возможностей использования семян L. kerstingii и растительного масла для продвижения их потребления в местных сообществах и их торговли на международных рынках.
kerstingii семена и растительное масло. Таким образом, в данном исследовании изучались химический состав, физико-химические свойства и питательная ценность семян L. kerstingii . Работа направлена на изучение потенциальных возможностей использования семян L. kerstingii и растительного масла для продвижения их потребления в местных сообществах и их торговли на международных рынках.
2. Материалы и методы
2.1. Растительный материал
Созревшие плоды L. kerstingii (30 кг) были собраны в Джанге (широта 10.37 Н; долгота 4,47 з. д.) в климатической зоне Судана (70–90 дождливых дней, 900–1200 мм) на юго-западе Буркина-Фасо в июне 2012 и 2014 гг. Джозеф КИ-ЗЕРБО (ОУА).
2.2. Химический анализ семян
Примерный состав семян анализировали в соответствии со стандартными официальными методами Ассоциации официальных химиков-аналитиков (AOAC) [8]: влажность в вакуумной печи (метод 925.10), неочищенный жир по методу Сокслета (метод 960. 39), общий азот или сырой белок по Кьельдалю с использованием 6,25 в качестве коэффициента пересчета для расчета содержания белка (метод 979.09) и золы от прокаливания (метод 923.03). Содержание углеводов оценивали по разнице средних значений, то есть 100 (сумма процентов влаги, белка, липидов и золы) [9].
39), общий азот или сырой белок по Кьельдалю с использованием 6,25 в качестве коэффициента пересчета для расчета содержания белка (метод 979.09) и золы от прокаливания (метод 923.03). Содержание углеводов оценивали по разнице средних значений, то есть 100 (сумма процентов влаги, белка, липидов и золы) [9].
2.3. Минеральное содержание муки из семян
Для определения содержания минералов в муке из семян, образец 5,0 г сжигали в печи при 550 ° C, а остатки растворяли в 50 мл 0.5 М раствор HNO 3 . Концентрации Ca, Na, K, Mg, Zn и Fe определяли с использованием атомного спектрофотометра (Varian AA240 FS) абсорбции, следуя методу Pinheiro et al. [10]. Калибровочная кривая была построена с использованием стандартных растворов металлов.
2.4. Профили аминокислот семян семян и жирных кислот масла семян
Официальные методы Ассоциации официальных химиков-аналитиков были использованы для определения аминокислот муки семян (метод 982.30) и жирных кислот масла семян семян (методы 996. 06, Ce 2-66, 965.49 и 969.33) [11]. Оценка незаменимых аминокислот была рассчитана со ссылкой на эталонный аминокислотный образец ФАО / ВОЗ / УООН [12] следующим образом:
06, Ce 2-66, 965.49 и 969.33) [11]. Оценка незаменимых аминокислот была рассчитана со ссылкой на эталонный аминокислотный образец ФАО / ВОЗ / УООН [12] следующим образом:
2,5. Физико-химический анализ растительного масла
Для определения температуры плавления (метод Cc 1-25), показателя преломления (метод Cc 7-25), йодного числа (метод Cd 1-25) использовались официальные методы Американского общества химиков-нефтяников. ), пероксидное число (метод Cd 8-53), -анизидиновое число (Cd 18-90), кислотное число (метод Ca 3a-63) и значение омыления (метод Cd 3-25) [13].Величину общего окисления (TOTOX) рассчитывали с использованием определенных значений для пероксида и -анизидина (2Px + Av) [14]. Стабильность измеряли с помощью прибора 743 Rancimat (Metrohm, Херизау, Швейцария), используя образец масла массой 3 г, нагретый до 120 ° C и расход воздуха 20 л / ч. Стабильность выражали как время индукции (ч).
2.6. Анализ токоферола, каротиноидов и стеролов
Каротиноиды, токоферол и стеролы были проанализированы в Craft Technologies Inc. (Wilson, NC). Токоферолы разделяли и количественно определяли с помощью ВЭЖХ в соответствии с методом AOCS Ce 8-89 [13].Каротиноиды были разделены и количественно определены с помощью обращенно-фазовой ВЭЖХ с обнаружением в УФ-видимом диапазоне с использованием опубликованной методологии Craft [15]. Стерины разделяли и количественно определяли с помощью ГХ в соответствии с официальным методом AOCS Ch 6-91 [16].
(Wilson, NC). Токоферолы разделяли и количественно определяли с помощью ВЭЖХ в соответствии с методом AOCS Ce 8-89 [13].Каротиноиды были разделены и количественно определены с помощью обращенно-фазовой ВЭЖХ с обнаружением в УФ-видимом диапазоне с использованием опубликованной методологии Craft [15]. Стерины разделяли и количественно определяли с помощью ГХ в соответствии с официальным методом AOCS Ch 6-91 [16].
2.7. Статистический анализ
Результаты выражаются как среднее значение и стандартное отклонение трех отдельных определений.
3. Результаты и обсуждение
3.1. Примерный состав семян
Результаты экспресс-анализа л.kerstingii представлены в таблице 1. Влажность семян составила 3,61%, что является низким и, следовательно, полезным для
| |
Невероятно несъедобно вяжущий | Наука встречается с едой
ОТ: MORGAN REASE
В последней четверти в Калифорнийском университете в Дэвисе я попробовал кое-что, чего раньше не делал, но о чем слышал. Люди всегда говорили о том, насколько это хорошо, но у меня самого никогда этого не было. Колледж — это когда пробовать новое, верно? Ну, здесь ничего не происходит… пути назад нет. Я слышал о ватной пасти раньше, но решил, что это шутка. СВЯТОЙ ДЕРЬМО, у меня во рту пересохло. Я думал, что у меня аллергическая реакция. Не могу поверить, что мои так называемые «друзья» подталкивали меня к этому. Прошло 60 секунд, и я был почти уверен, что вся влага уже покинула мое тело. Я не хотел так умирать. Пожалуйста, не говори моей маме.
Люди всегда говорили о том, насколько это хорошо, но у меня самого никогда этого не было. Колледж — это когда пробовать новое, верно? Ну, здесь ничего не происходит… пути назад нет. Я слышал о ватной пасти раньше, но решил, что это шутка. СВЯТОЙ ДЕРЬМО, у меня во рту пересохло. Я думал, что у меня аллергическая реакция. Не могу поверить, что мои так называемые «друзья» подталкивали меня к этому. Прошло 60 секунд, и я был почти уверен, что вся влага уже покинула мое тело. Я не хотел так умирать. Пожалуйста, не говори моей маме.
Хурма — дети не для шуток.
Разве фрукты не должны быть сладкими и вкусными? Очевидно, хурма не получила эту памятку. Несомненно, незрелая хурма — самая вяжущая вещь, которую я пробовал, и это ошибка, которую я планирую сделать только один раз. Но в чем дело? Почему такой терпкий? … А что такое хурма?
Хурма
Хурма (Diaspyros kaki L.) по вкусу немного напоминает тыкву, скрещенную с яблоком, со спелой текстурой от хрустящего персика до желе. Сезон хурмы длится всю осень и зиму, с ее уникальным вкусовым профилем, который хорошо подходит для согревающих десертов (например, пудинга из хлеба с хурмой). Они экстенсивно выращиваются в Азии, где в 2011 году Китай производил 74% мировых поставок, Корея — 9%, а Япония — 4%. [1] Мы тоже выращиваем их в Калифорнии, но мы маленькие картофелины.
Сезон хурмы длится всю осень и зиму, с ее уникальным вкусовым профилем, который хорошо подходит для согревающих десертов (например, пудинга из хлеба с хурмой). Они экстенсивно выращиваются в Азии, где в 2011 году Китай производил 74% мировых поставок, Корея — 9%, а Япония — 4%. [1] Мы тоже выращиваем их в Калифорнии, но мы маленькие картофелины.
Пудинг все равно лучше золота
У хурмы есть не только ее употребление в пищу, но и довольно необычное применение. Их можно использовать для детоксикации змеиного яда [2], снижения риска сердечно-сосудистых заболеваний [3] и извлечения частиц золота из раствора.[4, 5] Так почему же хурма такая странная? Хурма, как и дуб, виноград и чай, содержат проантоцианидины, более известные как танины. Танины из дуба и винограда придают вину «полноту» и улучшают вкусовые ощущения. С хурмой создается ощущение полной пустыни. Но не вся хурма бывает терпкой, только избранные сорта.
| Вяжущие сорта | Невяжущие сорта |
| Эврика | Fuyu |
| Хачия | Гошо |
| Красный Хонань | Имото |
| Сайджо | Идзу |
| Тамопан | Дзиро |
| Таненаши | Maekawajiro |
| Триумф | Окугошо |
| Шоколад (без косточек) | Suruga |
| Гейли (без косточек) | Шоколадный |
| Хякуме (без косточек) | Гейли |
| Maru (без косточек) | Хякуме |
| Nishimura Wase (без косточек) | Maru |
| Нисимура Васе |
Источник: Калифорнийские производители редких фруктов [6, 7]
Даже не вяжущая хурма содержит дубильные вещества, но их не так много. В невяжущей хурме в среднем содержится всего 2,5–20% танинов от вяжущих разновидностей [7].
В невяжущей хурме в среднем содержится всего 2,5–20% танинов от вяжущих разновидностей [7].
Химическая основа терпкости
Танины относятся к классу соединений, известных как проантоцианидины, что делает их антиоксидантами. Химически танин представляет собой полимер, состоящий из мономеров флаван-3-ола.
Термин «танин» происходит от германского слова «дуб», дерева, которое использовалось для получения дубильных веществ в процессе изготовления кожи, также известной как дубление кожи.[8] Переход от шкуры к коже частично вызван изменением белковой структуры шкуры дубовыми танинами. Причина, по которой танины вызывают у вас ощущение терпкости, заключается в том, что они связываются с белками слюны и осаждают их. Фактически, именно эта способность связывания белков отличает танины от других полифенольных соединений [8].
В вашей слюне содержится множество различных белков. Белки, участвующие в этом случае, вместе известны как белки, богатые пролином (PRP). Эти PRP составляют 70% белков слюны. Считается, что ощущение терпкости и обилия PRP являются защитным механизмом, поскольку было показано, что диета с высоким содержанием дубильных веществ для некоторых животных является летальной [8].
Эти PRP составляют 70% белков слюны. Считается, что ощущение терпкости и обилия PRP являются защитным механизмом, поскольку было показано, что диета с высоким содержанием дубильных веществ для некоторых животных является летальной [8].
Устранение терпкости
Так как же избежать неприятных дубильных ощущений, когда дело касается хурмы?
Удаление терпкости называется «отверждением» и обычно включает искусственное созревание с использованием газообразного этилена.Некоторые масштабные методы включают: замачивание в уксусе; погружение в теплую воду на 24 часа, а затем ожидание выхода из воды еще 48; и погрузить в кипящую воду, а затем оставить на 12 часов; выдержка плодов парами этанола в течение 10-14 дней; и подвергая фрукты воздействию этиленового газа в течение 3 дней. [9] Поскольку этиленовый газ является ключом к процессу созревания, вы можете удалить терпкость в домашних условиях, запечатав хурму в пакет с фруктами, которые выделяют этиленовый газ, например бананы или помидоры, на 2-4 дня. [9]
[9]
Как вариант, вы можете подождать, пока фрукт созреет, пока он не станет мягким, как желе. Однако если это не вяжущий сорт, нет причин ждать.
Хотите поддерживать беседу? Подпишитесь на нас в Instagram и Facebook , чтобы получать информацию о семинарах, мероприятиях и науке о продуктах питания!
Ссылки
- Наций, F.a.A.O.o.t.U., FAOSTAT , 2011, Продовольственная и сельскохозяйственная организация Объединенных Наций: faostat.fao.org.
- Okonogi, T., et al., ДЕТОКСИФИКАЦИЯ ПЕРСИММОНОМ ТАННИНОМ ЗМЕИНЫХ ЯД И БАКТЕРИАЛЬНЫХ ТОКСИНОВ. Toxicon, 1979. 17 (5): p. 524-527.
- Батт, M.S., et al., ПЕРСИММОН (DIOSPYROS KAKI) ФРУКТЫ: СКРЫТЫЕ ФИТОХИМИЧЕСКИЕ ВЕЩЕСТВА И ПРЕТЕНЗИИ НА ЗДОРОВЬЕ. Excli Journal, 2015. 14 : p. 542-561.
- Parajuli, D., et al., Гель из кожуры хурмы для селективного извлечения золота.
 Гидрометаллургия, 2007. 87 (3-4): с.133-139.
Гидрометаллургия, 2007. 87 (3-4): с.133-139. - Накадзима, А. и Т. Сакагути, ПОЛУЧЕНИЕ И ВОССТАНОВЛЕНИЕ ЗОЛОТА ИММОБИЛИЗИРОВАННЫМ ПЕРСИММОНОМ ТАННИНОМ. Journal of Chemical Technology and Biotechnology, 1993. 57 (4): p. 321-326.
- Growers, C.R.F. Хурма . 1996 [цитируется 25 января 2016 года].
- Giordani, E., et al., Избранные первичные и вторичные метаболиты свежей хурмы (Diospyros kaki Thunb.): Обзор аналитических методов и текущие знания о составе фруктов и их пользе для здоровья. Food Research International, 2011. 44 (7): p. 1752-1767.
- Hagerman, A.E., Tannin Chemistry , в Tannin Handbook 2002, Университет Майами.
- Мортон, Дж. Ф. Плоды теплого климата . 1987 [цитируется 25 января 2016 года].
Frontiers | Структура кутикулы в зависимости от химического состава: переоценка преобладающей модели
Введение
Кутикула — это интерфейс между недревесными органами надземных растений и окружающей атмосферой (Riederer and Schreiber, 2001). В общем, кутикула расположена на внешней периклинальной клеточной стенке эпидермальных клеток, также проецируясь между антиклинальными стенками (Javelle et al., 2011) и иногда покрывая клеточные стенки, граничащие с субоматальными камерами (Osborn and Taylor, 1990). Он распространяется, например, на лист (например, Bessire et al., 2007; Kosma et al., 2010; Buschhaus, Jetter, 2012), лепесток цветка (Li-Beisson et al., 2009; Panikashvili et al., 2011; Mazurek et al., 2013; Buschhaus et al., 2015), первичный ствол (Xue et al., 2014), фруктовые (Khanal et al., 2011; Lara et al., 2014, 2015; Martin, Rose, 2014) и трихомные (Fernández et al., 2011, 2014b) поверхности. Защитная роль кутикулы растений была признана в отношении, например, ограничения потери воды (Kerstiens, 1996; Riederer and Schreiber, 2001), патогенов (Serrano et al., 2014) и нападения насекомых (Eigenbrode and Jetter, 2002). или ослабление УФ-излучения (Krauss et al., 1997).
Многофункциональный характер кутикулы достигается за счет неоднородной структурной и химической природы (Khayet and Fernández, 2012), которая может дополнительно варьироваться между e. g., виды, генотипы, органы, стадии развития, физиологическое состояние растений или условия окружающей среды во время роста (например, Knoche et al., 2004; Szakiel et al., 2012; Nawrath et al., 2013; Fernández et al., 2014a; Guzmán-Delgado et al., 2016).
g., виды, генотипы, органы, стадии развития, физиологическое состояние растений или условия окружающей среды во время роста (например, Knoche et al., 2004; Szakiel et al., 2012; Nawrath et al., 2013; Fernández et al., 2014a; Guzmán-Delgado et al., 2016).
С химической точки зрения кутикула образована набором соединений с различными физико-химическими свойствами (см. Рисунок 1 в качестве примера общих компонентов кутикулы). Эти соединения могут представлять собой воски, кутин и / или кутан, полисахариды, фенольные соединения и минеральные элементы (España et al., 2014; Guzmán et al., 2014a; Гусман-Дельгадо и др., 2016). Кутикулярные воски представляют собой смесь соединений, таких как длинноцепочечные жирные кислоты, спирты, алканы, сложные эфиры или тритерпеноиды (Jetter et al., 2006). Кутин определяется как сложный полиэфир, в основном образованный мономерами гидрокси- и гидроксиэпокси жирных кислот C 16 и C 18 (Kolattukudy, 1970), в то время как другие соединения, такие как глицерин, также считаются частью полимера кутина ( Graça et al. , 2002). Химическая природа кутана, альтернативного очень нерастворимого и не деэтерифицируемого соединения, обнаруженного в кутикуле многих видов и органов (например,г., Boom et al., 2005; Johnson et al., 2007) до сих пор неясно. Кутан может быть образован полиметиленовыми и полисахаридными фрагментами, связанными негидролизуемыми связями (Nip et al., 1986; Tegelaar et al., 1991), или исключительно сетью полиметиленовых цепей, содержащих двойные связи и свободные карбоксильные группы, связанные простыми эфирными связями. (Villena et al., 1999). Другие исследователи предположили, что структура кутана может быть основана на ароматических доменах с дополнительными карбоксильными функциональными группами, связанными сложным эфиром с длинноцепочечными спиртами и длинноцепочечными карбоновыми кислотами соответственно (McKinney et al., 1996; Дешмук и др., 2005).
, 2002). Химическая природа кутана, альтернативного очень нерастворимого и не деэтерифицируемого соединения, обнаруженного в кутикуле многих видов и органов (например,г., Boom et al., 2005; Johnson et al., 2007) до сих пор неясно. Кутан может быть образован полиметиленовыми и полисахаридными фрагментами, связанными негидролизуемыми связями (Nip et al., 1986; Tegelaar et al., 1991), или исключительно сетью полиметиленовых цепей, содержащих двойные связи и свободные карбоксильные группы, связанные простыми эфирными связями. (Villena et al., 1999). Другие исследователи предположили, что структура кутана может быть основана на ароматических доменах с дополнительными карбоксильными функциональными группами, связанными сложным эфиром с длинноцепочечными спиртами и длинноцепочечными карбоновыми кислотами соответственно (McKinney et al., 1996; Дешмук и др., 2005).
РИСУНОК 1. Модельные химические соединения, обычно встречающиеся в кутикуле растений, организованные в соответствии с убывающим градиентом аполярности: (A) Воски (преимущественно аполярные), (B) мономеры кутина (с большим аполярным компонентом, но имеющий некоторую степень полярности и водородные (H) -связывающие взаимодействия из-за присутствия функциональных групп, содержащих кислород (O)) и полисахариды (C) (с более низким аполярным компонентом, но более высокой полярностью и очень сильными H-связующими взаимодействиями из-за на наличие функциональных групп с О). Изменено из Khayet and Fernández (2012).
Изменено из Khayet and Fernández (2012).
Преобладающая модель (как описано, например, в Evert, 2006 или Albersheim et al., 2011) рассматривает кутикулу как липидный слой, взаимоотношения которого с клеточной стенкой ограничены их соседним положением (см. Рис. 2A). Согласно этой модели кутиновая матрица со встроенными внутрикутикулярными восками и фенольными смолами проходит через кутикулу, в то время как полисахариды ограничены самой внутренней областью кутикулы, то есть той, которая находится в контакте с клеточной стенкой под ней (Domínguez et al., 2011). Дополнительный слой эпикутикулярных восков откладывается на кутиновом матриксе и составляет интерфейс орган-атмосфера (Domínguez et al., 2011).
РИСУНОК 2. (A , левая сторона) Предварительная модель фон Моля (1847), в которой кутикула ограничена своей внешней областью, свободной от целлюлозы (т.е. собственно кутикулой), в качестве основы для ( A , правая сторона) преобладающая модель кутикулы растения, в которой собственно кутикула считается свободной от полисахаридов. (B) Кутикула понимается как липидизированная, химически и структурно гетерогенная область эпидермальной клеточной стенки.
В последние десятилетия был достигнут значительный прогресс в описании механизмов синтеза и экспорта парафина (Samuels et al., 2008; Kunst and Samuels, 2009), синтеза и сборки мономера кутина (например, Li-Beisson et al., 2009 ; Domínguez et al., 2010; McFarlane et al., 2010; Girard et al., 2012; Yeats et al., 2012), а также структурные и химические реакции кутикулы на факторы биотического и абиотического стресса (например,г., Bessire et al., 2007; Isaacson et al., 2009; Kosma et al., 2009), а также в отношении различных стадий развития органов (например, España et al., 2014). Однако многие аспекты структуры кутикулы по отношению к химическому составу (Guzmán et al., 2014a; Guzmán-Delgado et al., 2016) остаются неясными, например, генез кутикулы или синтез и транспорт кутикулярных компонентов (Bird, 2008; Pollard et al. ., 2008; Khayet, Fernández, 2012; Domínguez et al. , 2015).
, 2015).
Для улучшения современного состояния знаний о природе кутикулы растений важно признать, что с 17 века было приложено много усилий для характеристики эпидермиса растений, а также кутикулы растений.Хотя некоторые авторы (например, Brongniart, 1830; von Mohl, 1847) считали, что кутикула представляет собой отдельный слой от стенки эпидермальных клеток, идея, которая все еще преобладает в наши дни, эта концепция уже вызывала споры для некоторых исследователей 19 века (например, , Meyen, 1837; Fremy et Terreil, 1868). Таким образом, с целью возобновления дискуссии о природе кутикулы растений, понимаемой как независимый и липидный слой, нанесенный на стенку эпидермальных клеток, по сравнению с частью самой стенки эпидермальных клеток, первым делом представляет исторический обзор исследований кутикулы растений. предоставлена.
Кутикула растения: прогорклая тема исследования
Термин «кутикула» был введен в области растений Грю (1672) и Мальпиги (1675) для обозначения внешней части их органов. Представление о кутикуле как отдельном слое от эпидермиса было одновременно введено Бронгниартом (1830 г.) и Хенслоу (1831 г.). Оба автора описали кутикулу как тонкую, однородную и непрерывную «пленку» (Brongniart, 1830) или «мембрану» (Henslow, 1831), покрывающую клетки эпидермиса.
Представление о кутикуле как отдельном слое от эпидермиса было одновременно введено Бронгниартом (1830 г.) и Хенслоу (1831 г.). Оба автора описали кутикулу как тонкую, однородную и непрерывную «пленку» (Brongniart, 1830) или «мембрану» (Henslow, 1831), покрывающую клетки эпидермиса.
Treviranus (1835) подтвердил существование кутикулы и считал это продолжающимся отложением «свертывающегося вещества». Мейен (1837) рассматривал кутикулу как утолщенную внешнюю стенку эпидермальных клеток. Шлейден (1842) рассматривал кутикулу как «массу», секретируемую эпидермальными клетками, которая впоследствии затвердевает и образует сеть.
Появление слоистой кутикулы было введено фон Молем (1842, 1847), что дало начало морфологической модели, которая преобладает до сих пор (рис. 2А).Фон Моль (1847) подчеркивал, что кутикулу следует отличать от нижележащих клеток эпидермиса. Этот автор ограничил термин «кутикула» внешней областью, свободной от целлюлозы (как показано на рисунке 2A). Область под ним была названа «кутикулярным слоем (клеточной стенки)». Название «эпикутикулярный воск» в настоящее время используется, чтобы отличить самые внешние химические соединения от тех, которые встречаются во внутренних областях кутикулы (т.е. «внутрикутикулярные воски»; Джеттер и Ридерер, 2016).
Название «эпикутикулярный воск» в настоящее время используется, чтобы отличить самые внешние химические соединения от тех, которые встречаются во внутренних областях кутикулы (т.е. «внутрикутикулярные воски»; Джеттер и Ридерер, 2016).
В течение 20 века были также предложены дополнительные термины для областей, которые фон Моль назвал «кутикулой» и «кутикулярным слоем».«Широкое использование терминов, связанных с« кутином »(например,« кутинизированный ») при обращении к кутикуле и ее частям, свидетельствует о важной роли, приписываемой этому полиэстеру (например, Riederer and Schönherr, 1988; Franke et al. , 2005; Pollard et al., 2008; Domínguez et al., 2015). В различных отчетах такие термины, как «слой кутина» или «кутинизированная (клеточная) стенка», часто использовались как синонимы «кутикулы» (например, Grzegorzewski et al., 2010; Domínguez et al., 2011; Krajšek et al. , 2011; Bellow et al., 2012; Petit et al., 2014). Кроме того, некоторые авторы рассматривали кутин как структурный компонент кутикулы (Колаттукуды, 1970, 2005).
При анализе кутикулы листа груши ( Pyrus communis ) Норрис и Буковац (1968) использовали термин кутикула, чтобы «включить все слои, которые могут быть отделены от подлежащей клеточной стенки целлюлозы». Однако кутикулы многих растений из разных виды и органы не могут быть изолированы от подлежащих тканей как неповрежденные слои значительного размера (например,g., Gouret et al., 1993; Fernández et al., 2014a; Guzmán et al., 2014b).
Из этого краткого исторического обзора можно сделать вывод, что примерно за два столетия несколько исследователей пытались охарактеризовать химическую и структурную природу кутикулы растений и кутикулярных слоев, что привело к появлению множества понятий и названий, таких как «кутикула», «кутикулярный слой», «собственно кутикула» или «эпикутикулярный воск». Однако также ясно, что многие споры остаются открытыми, например, когда мы используем концепцию кутикулы sensu Норрис и Буковац (1968; i.е., включая все слои, которые могут быть отделены от подлежащей клеточной стенки целлюлозы), или определение «собственно кутикулы», свободной от полисахаридов, как подчеркнуто (Guzmán et al. , 2014a, c).
, 2014a, c).
Ультраструктура кутикулы в зависимости от химического состава: сложная и непостоянная взаимосвязь
Количество исследований, непосредственно посвященных изучению взаимосвязи между внутренней структурой кутикулы и химическим составом, невелико (например, Wattendorff and Holloway, 1982; Riederer and Schönherr, 1988; Gouret et al., 1993; Viougeas et al., 1995; Крюгер и др., 1996; Домингес и Эредиа, 1999а; Граса и Ламоса, 2010; Guzmán et al., 2014a; Гусман-Дельгадо и др., 2016). Кроме того, большая часть исследований, выполненных в течение последних четырех десятилетий, была сосредоточена на кутикуле Agave americana (например, Wattendorff and Holloway, 1982; Villena et al., 1999; Reina et al., 2007) и Clivia. miniata листьев (например, Schmidt and Schönherr, 1982; Domínguez and Heredia, 1999a; Fagerström et al., 2013) или плод томата ( Lycopersicon esculentum ; например, Petracek and Bukovac, 1995; Benítez et al., 2004; López-Casado et al. , 2007; Segado et al., 2016).
, 2007; Segado et al., 2016).
Просвечивающая электронная микроскопия (ПЭМ) особенно широко применялась в начале 1980-х годов для характеристики внутренней ультраструктуры кутикулы (Holloway, 1982; Jeffree, 2006). По внешнему виду внутренних областей кутикулы Holloway (1982) предложил морфологическую классификацию, включающую шесть типов кутикулы. Тем не менее, автор подчеркивает неоднородность структуры кутикулы растений и необходимость рассматривать каждый вид индивидуально, чтобы избежать чрезмерных упрощений и обобщений.Более того, структурные различия могут наблюдаться в пределах одного и того же органа, вида и даже внутри среза кутикулы, проанализированного с помощью ПЭМ, поэтому делать общие выводы рискованно (рис. 3C; Guzmán et al., 2014b). В связи с этим отнесение кутикулы ряда видов к тому или иному морфологическому типу может варьироваться, например, в соответствии с интерпретацией авторов (Jeffree, 2006) или процедурой подготовки образца, используемой для наблюдения с помощью ПЭМ ( Guzmán et al. , 2014b).
РИСУНОК 3. Структурная неоднородность кутикулы растений, на примере поперечных срезов кутикулы листа с помощью ПЭМ: (A) груша ( Pyrus communis ; полоса 200 нм), (B) тополь ( Populus bolleana; бар, 200 нм), (C) бук Магеллана ( Nothofagus betuloides ; столбик 2 мкм) и (D) пшеница ( Triticum aestivum ; столбик 50 нм). Буквы обозначают области, соответствующие эпикутикулярным воскам (EW), кутикуле (C) и клеточной стенке (CW).Микрофотографии В. Фернандеса и П. Гусмана (2012, 2015).
На рис. 3 показана ультраструктура кутикулы листа трех различных видов растений как пример структурной неоднородности кутикулы растений. Кутикула листа груши намного толще (~ 800 нм), чем у тополя ( Populus bolleana , ~ 300 нм) и, главным образом, листа пшеницы ( Triticum aestivum ) (~ 40 нм). Это предполагает преобладание эпикутикулярных восков и развитие оловянной кутикулы на некоторых участках листьев пшеницы (Рисунок 3D; Fernández et al., 2014a) по сравнению с более толстым развитием кутикулы у листопадных листьев тополя и груши (Guzmán et al., 2014c). В отличие от этого, исследованный лист бука Магеллана ( Nothofagus betuloides ) имел нерегулярные и большие электронно-плотные области в кутикуле, подобные тем, которые наблюдались у Ficus elastica (Guzmán-Delgado et al., 2016).
Сложная и сложная физическая и химическая природа кутикулы затрудняет определение локализации отдельных составляющих и фракций в поперечных срезах кутикулы (Guzmán et al., 2014а, б; Гусман-Дельгадо и др., 2016). Кроме того, молекулярная самосборка и потенциальные механизмы сцепления между составляющими кутикулы мало изучены (Pollard et al., 2008; Kunst and Samuels, 2009). На поперечные срезы кутикулы могут влиять несколько факторов, наблюдаемые с помощью ПЭМ, а также с помощью оптических методов. Эти методы также использовались в сочетании с гистохимическим окрашиванием и / или химическим извлечением для получения информации о морфологии кутикулы и общем химическом составе (например,г., Roberts et al., 1948; Норрис и Буковац, 1968; Лопес-Касадо и др., 2007; Buda et al., 2009). Например, различные реагенты, используемые для подготовки образцов (например, органические растворители, смолы или красители), не могут легко проникать в кутикулярные нанопоры. Это может быть еще более трудным для химикатов, растворенных в воде, жидкости, имеющей высокое поверхностное натяжение, как обсуждали Guzmán et al. (2014b). Следовательно, вероятно, что зоны, которые являются более поверхностными и доступными для инфильтрации с химической и физической точки зрения, будут лучше фиксироваться, контрастировать и различаться (Guzmán et al., 2014б). Таким образом, самые внешние области кутикулы, которые онтогенетически соответствуют ее более ранним проявлениям (Riederer, Schönherr, 1988; Heide-Jørgensen, 1991; Jeffree, 1996), могут иметь более высокую степень упаковки по сравнению с областями, расположенными ниже, следовательно, имеющий более низкую степень проникновения реагентов (и маркировку конкретных компонентов, как описано ниже). Кроме того, из-за низкой специфичности некоторых широко используемых красителей (Hayat, 1993; Soukup, 2014) гистохимические анализы кутикулы также следует интерпретировать с осторожностью.
Более специфические иммунохимические исследования были применены для идентификации присутствия и расположения компонентов кутикулы, таких как полисахариды (Tenberge, 1992; Guzmán et al., 2014c) и кутин (Domínguez et al., 2010; Kwiatkowska et al., 2014 ). Однако, хотя частицы иммуно-золота указывают на присутствие таких химических компонентов кутикулы, в помеченных зонах не наблюдается никаких специфических особенностей или степени электронной плотности (например, Guzmán et al., 2014c), результаты скорее качественные, чем структурная ценность.Следует также учитывать, что отсутствие этих частиц в меченой кутикуле не подразумевает прямо отсутствие целевого компонента, который может быть замаскирован другими химическими соединениями кутикулы, как это следует из результатов Guzmán et al. (2014c по сравнению с 2014a).
Были предприняты различные попытки вывести химический состав чередующихся электроннопрозрачных и электронно-плотных ламелл, наблюдаемых во внешней области кутикулы некоторых растений (см. Jeffree, 2006), и потребуются дальнейшие испытания для изучения природы таких ламелей.Работая с кутикулами, изолированными от двух разных видов эвкалиптов ( Eucalyptus globulus и E. camaldulensis ), Guzmán et al. (2014a) наблюдали исчезновение ламеллатной структуры, возникающей под эпикутикулярным восковым слоем после экстракции органическим растворителем, в то время как та же процедура экстракции не повлияла на внешний вид пластинок, обнаруженных в кутикуле листьев F. elastica (Guzmán-Delgado et al. ., 2016). Тем не менее, экспериментальные доказательства взаимосвязи между отдельными внутрикутикулярными восковыми соединениями и ультраструктурой кутикулы до сих пор не предоставлены.Селективный анализ эпи- и внутрикутикулярных восков, полученных механическим отбором образцов с последующей экстракцией растворителем (например, Jetter and Schäffer, 2001), показал, что циклические соединения, такие как тритерпеноиды, имеют тенденцию накапливаться внутри внутрикутикулярного воскового слоя различных видов и органов (Buschhaus и Jetter, 2011; Buschhaus et al., 2015). Испытания, проведенные на кутикуле плодов Diospyros kaki var. Fuyu Цубаки и др. (2013) указывают, что тритерпеноиды в кутикулярной матрице образуют нанокомпозит и обеспечивают прочность кутикулы, действуя как нанонаполнители.Аналогичная роль внутрикутикулярного наполнителя была предложена для флавоноидов в плодах томатов España et al. (2014).
После анализа состава мономера кутина и потенциальной молекулярной структуры, принятой этим полимером в кутикулах листьев Hedera helix и плодов томата, Graça и Lamosa (2010) предположили, что линейность полимера может объяснять упорядоченные ламели, наблюдаемые в Кутикула H. helix , тогда как разветвленный полимер томата может быть основой его сетчатой структуры.Тем не менее, различия, обнаруженные в потенциальной степени ветвления в кутине E. globulus и E. camaldulensis (имеющих подобную ламеллатную структуру, чем H. helix , Viougeas et al., 1995), не могут быть отнесены к специфический структурный рисунок, отсутствие различий в составе воска (Guzmán et al., 2014a). Напротив, клеточная стенка, наблюдаемая в кутикулах этих эвкалиптов после последовательных химических экстракций, имела диффузные и геликоидальные структурные узоры во внешней и внутренней областях, соответственно, что может приводить к различной морфологии таких областей кутикулы.Однако следует учитывать возможность того, что процессы экстракции нарушили ориентацию фибрилл целлюлозы (Guzmán et al., 2014a).
Было высказано предположение, что присутствие кутаны ограничено областью кутикулы, расположенной ниже так называемой «собственно кутикулы» (Schmidt and Schönherr, 1982; Riederer and Schönherr, 1988). Однако недавние исследования (Guzmán et al., 2014a; Guzmán-Delgado et al., 2016), однако, отметили, что извлечение компонентов кутикулы, вероятно, будет неполным из-за присутствия кутикулы и что потеря внутренних областей кутикулы ( я.(т.е. те, которые расположены ближе к протопластам эпидермальных клеток) после реакций деэтерификации кутикулы также происходили в кутикулах, свободных от кутаны. Следовательно, присутствие кутана может еще больше затруднить интерпретацию ультраструктуры кутикулы по отношению к составу из-за ограниченного эффекта химического удаления (Guzmán-Delgado et al., 2016).
С 1960-х годов (например, Leyton and Armitage, 1968; Lange, 1969) сканирующая электронная микроскопия (SEM) использовалась в качестве инструмента для исследования большого количества кутикулы растений по сравнению с более ограниченным использованием TEM, вероятно, из-за более легкого процедуры подготовки проб.За некоторыми исключениями (например, Hill and Dilcher, 1990), СЭМ обычно использовался для оценки морфологических особенностей периклинальных поверхностей кутикулы и особенно эпикутикулярных восков.
В нескольких отчетах оценивалась взаимосвязь между морфологией эпикутикулярного воска (по данным SEM) и химическим составом (Baker, 1982; Barthlott et al., 1998; Jeffree, 2006). Однако доступные результаты, как правило, основаны на общем составе кутикулярного воска, т. Е. Содержащем как эпи-, так и интракутикулярный воск, а вклад конкретных соединений можно было сделать только косвенно (Buschhaus and Jetter, 2011).Выборочное извлечение и анализ эпикутикулярных восковых структур также может обеспечить более точное определение химических соединений (Buschhaus and Jetter, 2011).
Электронно-микроскопическая томография вместе с подготовкой проб путем замораживания или замораживания под высоким давлением (например, Seguí-Simarro et al., 2004; McIntosh et al., 2005; Austin, 2014) не применялась к кутикуле растений в неповрежденные или изолированные ткани и могут предоставить интересную структурную информацию.
Распределение кутикулярных восков может быть основано на физико-химических свойствах общих кутикулярных компонентов (Buschhaus and Jetter, 2011). Принимая во внимание полярные, аполярные и водородные (H) -связывающие свойства функциональных групп, образующих общие типы парафинов, таких как алканы, спирты, амирины или β-дикетоны, Khayet и Fernández (2012) рассчитали параметр растворимости различных модельных восковых соединений. . Алканы представляют собой полностью неполярные молекулы и имеют самый низкий параметр общей растворимости (т.е.е., наименьшие значения поверхностной свободной энергии), тогда как молекулы, содержащие кислород в своих функциональных группах (например, спирты, кислоты, кетоны или сложноэфирные связи), имели некоторую степень полярности и взаимодействий водородных связей и более высокий параметр общей растворимости по сравнению с алканы. Авторы предположили, что при отсутствии физических ограничений соединения с низким параметром растворимости (то есть свободной поверхностной энергией) будут стремиться мигрировать от стенки растительной клетки к эпикутикулярному восковому слою, чтобы уменьшить свободную энергию Гиббса (Khayet et al. ., 2002). Это может быть альтернативная и / или дополнительная гипотеза для объяснения миграции кутикулярного материала (например, восков, мономеров кутина или фенолов) к границе раздела воздух-растение, в отличие от кутикулярной транспирации как движущей силы (Neinhuis et al., 2001 ; Koch et al., 2004; Heredia-Guerrero et al., 2010).
Создание загадки над кутикулой: структура отдельных химических компонентов
Из-за сложности интерпретации ультраструктуры кутикулы в зависимости от химического состава, некоторые исследования были сосредоточены на оценке потенциальной структуры изолированных восков (например,g., Jeffree et al., 1975; Matas et al., 2003; Драгота и Ридерер, 2007; Dora and Wandelt, 2011), мономеры кутина (например, Ray and Stark, 1998; Heredia-Guerrero et al., 2009; Graça and Lamosa, 2010) и полисахариды (пектин-липидные наночастицы, Guzman-Puyol et al., 2015) . В нескольких исследованиях была предпринята попытка выяснить вклад отдельных химических фракций кутикулы в реологические свойства кутикулы растений, например воск (Tsubaki et al., 2013), кутин (Round et al., 2000), полисахариды (López-Casado et al., 2007) или флавоноидов (Domínguez et al., 2009), но вполне вероятно, что экстракция кутикулярных фракций (например, удаление полисахаридов из кутикулярных мембран), возможно, не была завершена из-за плотной мембранной природы изолированных кутикул, как наблюдалось с помощью ПЭМ . Испытания с восками и мономерами кутина показали, что такие молекулы могут подвергаться самосборке (Domínguez and Heredia, 1999a; Casado and Heredia, 2001; Koch et al., 2009; Heredia-Guerrero et al., 2011).
Восковая структура
С помощью SEM было предложено несколько классификаций на основе эпикутикулярной восковой структуры (Amelunxen et al., 1967), а также с учетом химического состава (Baker, 1982; Barthlott et al., 1998; Jeffree, 2006; Koch et al., 2006a). Однако методика, обычно используемая для экстракции растворимых кутикулярных липидов, то есть путем погружения органа или кутикулы в органические растворители, не позволяет различать эпи- и интракутикулярный воск. Таким образом, были разработаны различные методы селективного выделения парафинов (например, Buschhaus and Jetter, 2011).
Эффективность и перекристаллизация изолированных восков из листьев некоторых видов, выращенных на множестве искусственных субстратов, были изучены в нескольких исследованиях (например,г., Рейнхардт и Ридерер, 1994; Matas et al., 2003; Koch et al., 2004; Ensikat et al., 2006). Исследовательские усилия были сосредоточены на анализе механизмов перекристаллизации восков с трубчатой морфологией, экстрагированных, например, из Pinus halepensis, Picea pungens, Nelumbo nucifera или Tropaeolum majus (Jetter and Riederer, 1994; Matas et al., 2003). ; Koch et al., 2006b, 2009). Воски, как правило, представляют собой сложные химические смеси, и их химический состав имеет решающее значение для образования e.g., трубчатая или планарная морфология (Jeffree, 2006; Koch et al., 2006b, 2009).
Согласно Джеттеру и Ридереру (1994), трубчатые и плоские кристаллы, регулярно обнаруживаемые на одних и тех же поверхностях растений, можно понимать как две модификации твердого состояния нонакозан-10-ола, при этом канальцы формируются под кинетическим контролем, а термодинамический контроль может привести к планарной модификации. Koch et al. (2009) отметили, что фракции нонакозан-10-ола и алкандиола приводят к образованию канальцев, которые вырастают из лежащей ниже однородной пленки аморфного воска.Это говорит о том, что рост кристаллов происходит из-за процесса самосборки, как предполагают несколько авторов (например, Casado and Heredia, 2001; Matas et al., 2003; Koch et al., 2004, 2009). Несмотря на то, что некоторые аспекты механизмов образования парафина были выяснены в ходе испытаний перекристаллизации, остаются нерешенными некоторые вопросы, такие как количество и вид парафинов, необходимых для образования аморфных и кристаллизованных структур, потенциальное влияние кутикулярной матрицы на кристаллизацию парафина. , или эффект изменения окружающей среды во время роста.
Кутин и структура кутана
Кутин можно определить как нерастворимую алифатическую био-макромолекулу, обнаруженную во внешних стенках эпидермальных клеток. Это сложный полиэфир, который при деполимеризации с разрушением сложного эфира дает мономерные компоненты с гидроксильными и карбоксильными функциональными группами. Основной основной цепью структуры кутина являются C 16 и / или C 18 ω -гидроксикислоты, то есть карбоновые кислоты с гидроксильной группой на противоположном конце углеводородной цепи (CH 2 ) n .C 16 ω -гидроксикислоты могут иметь насыщенную цепь, но преимущественно во многих кутинах они имеют вторичный гидроксил, близкий к средней цепи. C 18 ω -гидроксикислоты также часто замещены в средней цепи двумя вицинальными гидроксильными группами (9,10-диол) или эпоксидом (9,10-эпокси). Состав кутина зависит, например, от вида растений, расположения эпидермиса или стадии развития. Как правило, C 16 ω -гидроксикислоты с вторичным гидроксилом в средней цепи всегда являются значительным мономером в составе всех кутинов, но тип и относительное количество C 18 ω -гидроксикислот широко варьируются.Помимо ω -гидроксикислот, кутин включает другие строительные единицы, а именно глицерин, но только в относительно небольших количествах в немногих случаях, проанализированных до сих пор (Graça et al., 2002).
Вариабельность мономерного состава показывает, что в кутинах должно существовать по крайней мере некоторое структурное разнообразие. Различные составы кутинов и макромолекулярные (или супрамолекулярные) устройства могут быть причиной ультраструктурной изменчивости, которую можно увидеть с помощью TEM в кутикуле растений (Holloway, 1982). В некоторых случаях значительное количество алифатического материала остается нерастворимым после расщепления сложного эфира деполимеризации кутина, остаток, названный кутаном (например,г., Гусман-Дельгадо и др., 2016). Это означает, что в кутине присутствуют другие типы связей помимо сложноэфирных связей, или что кутан может быть структурно другой биомакромолекулой.
Механизмы, с помощью которых C 16 и C 18 ω -гидроксикислот и другие структурные единицы кутина собираются в виде макромолекул, все еще плохо изучены. Формирование кутинсом, которые представляют собой сферические наночастицы размером приблизительно 50-200 нм в результате самосборки мономеров гидроксикислот кутина в полярной среде, было продемонстрировано in vitro (Heredia-Guerrero et al., 2008). Кутинсомы могут спонтанно полимеризоваться или сшивать мономеры кутина (Heredia-Guerrero et al., 2008, 2009). Они были предложены как строительные единицы биополиэфирного кутина (Heredia-Guerrero et al., 2011), и их присутствие было обнаружено in planta с помощью иммуно-локализации кутина (Kwiatkowska et al., 2014). Взаимодействие пектина с полигидроксилированными жирными кислотами, способствующее образованию наночастиц, было недавно продемонстрировано и может быть связано с начальной стадией образования кутина из растительного биополиэфира (Guzman-Puyol et al., 2015).
Изучение интактной структуры кутина in situ , а именно его молекулярной структуры на разных организационных уровнях, затруднялось из-за его нерастворимости, сложности и вариабельности его мономерного состава, а также трудностей в отделении его от других компонентов кутикулы. (например, полисахариды и фенолы). Как правило, структурные исследования кутина проводят в материалах, обогащенных кутином, то есть в изолированных кутикулах, из которых были извлечены воски, а полисахариды были частично удалены ферментативной или химической обработкой.В этих обогащенных кутином фракциях алифатический (ациклический или циклический, неароматический) материал может составлять от 50 до 80% от их массы. Кутин был проанализирован в его нативной (недеполимеризованной) форме твердотельными методами, такими как инфракрасная (Рамановская, FTIR) спектроскопия (Heredia-Guerrero et al., 2014) и ряд биофизических подходов. Тем не менее, большая часть структурной информации, собранной до сих пор, была получена в результате применения методов ядерного магнитного резонанса (ЯМР), кратко изложенных ниже.
Для изучения кутина как макромолекулы были использованы три типа ЯМР: методы твердотельного ЯМР, основанные на вращении под магическим углом (MAS), методы высокого разрешения (HR-MAS), применяемые к полутвердому кутину, набухшему в растворителях, и ЯМР высокого разрешения в растворе фрагментов олигомеров, полученных частичной деполимеризацией кутина. 13 C твердотельный ЯМР ( 13 C ssNMR) с использованием методов кросс-поляризации (CPMAS) и прямой поляризации (DPMAS) вместе с исследованиями спиновой релаксации позволили получить обширную информацию о структурных типах присутствующих атомов углерода, оценка их относительной численности и их молекулярной подвижности или жесткости в контексте интактного кутина. Используя эти методы, новаторская работа Stark et al. (2000) в кутине плодов лайма ( Citrus aurantifolia ) показали присутствие метиленовых (CH 2 ) цепей , первичных и вторичных сложноэфирных групп и атомов углерода, относящихся к фенольным гидроксикоричным фрагментам.Более того, более короткие времена релаксации были обнаружены для большинства метиленовых углеродов (примерно 60%) и для первичных углеродных атомов сложного эфира от головы к хвосту, что свидетельствует об относительно высокой подвижности последних в макромолекулярной структуре. Напротив, оставшиеся метилены и сложные эфиры во вторичных гидроксильных позициях средней цепи были намного более жесткими, о чем свидетельствует более длительное время релаксации их характерных атомов углерода (Zlotnikmazori and Stark, 1988; Garbow and Stark, 1990). В кутине кожуры томатов метиленовые (CH 2 ) n цепи показали два сигнала в спектрах CPMAS 13 C, один при 29 ppm, приписываемых аморфному расположению гош и антиконформаций, а другой (меньшего размера) при 33 ppm, относящихся к кристаллическим областям с цепями (CH 2 ) n в полностью транс-конформации (Deshmukh et al., 2003).
ssNMR имеет неотъемлемый недостаток — низкое разрешение с широкими и перекрывающимися сигналами. Частично это можно преодолеть с помощью методов HRMAS, если из твердого кутинового материала можно получить вязкую фазу, что дает повышенную молекулярную подвижность и позволяет значительно повысить разрешение ЯМР. HRMAS позволяет использовать методы 2D ЯМР, которые могут дать важную структурную информацию, показывая прямые и дальние связи между определенными атомами углерода и водорода. Такой подход HRMAS применялся после набухания фракций, обогащенных дейтерированным ДМСО кутином, из плодов лайма (Stark et al., 2000; Fang et al., 2001), кожуре томатов (Deshmukh et al., 2003) и листьев A. americana (Deshmukh et al., 2005). Таким образом было получено прямое подтверждение структур, предполагаемых из анализов ssNMR, а именно наличие сложных эфиров первичных и вторичных гидроксильных групп. Кроме того, был обнаружен ряд других структурных особенностей. У томатов и кутина A. americana было предложено разветвление углеводородной цепи в углероде, соседнем с карбонилом в сложноэфирных группах ( α -ветвление), на основе химического сдвига вовлеченной группы CH (44–45 и 2.4 частей на миллион соответственно; Дешмук и др., 2003, 2005). Анализ HRMAS остатка кутана в A. americana (приблизительно 30% фракции, обогащенной кутином) показал наличие свободных карбоновых кислот и гидроксильных групп, а также более высокую степень кристалличности в метиленовых (CH 2 ) n цепях (из доминирующего пика при 32 ppm для соответствующих атомов углерода) и сложноэфирные группы, которые могут быть напрямую связаны с бензольными кольцами (Deshmukh et al., 2005).
Другой подход к получению структурной информации заключается в частичной деполимеризации кутина для получения олигомеров, все еще несущих внутримолекулярные связи, существующие в интактной макромолекуле.Эти олигомеры в конечном итоге могут быть выделены из смесей деполимеризации с помощью хроматографических методов, позволяющих однозначно охарактеризовать их структуру, с применением масс-спектрометрии и методов 1D и 2D ЯМР высокого разрешения. Кроме того, некоторые конкретные типы внутримолекулярных связей могут быть более или менее целенаправленными, что добавляет структурную информацию. Однако необходимо учитывать некоторые вопросы, а именно репрезентативность полученных олигомеров и тот факт, что некоторые внутримолекулярные связи могут быть более доступными, чем другие, для применяемых методов частичного разложения.Ряд таких исследований был применен к кутину извести: были обнаружены олигомеры вплоть до тетрамеров, состоящие из C 16 ω -гидроксикислот, линейно связанных голова к хвосту посредством этерификации их первичных гидроксилов, после гидролиза йодтриметилсилана, который разрушает стерически затрудненный сложные эфиры вторичных гидроксилов (Ray et al., 1998), а также после деструктивной обработки низкотемпературным фтористым водородом (Tian et al., 2008). Альтернативно, пентамер, также включающий в основном C 16 ω -гидроксикислот, но на этот раз этерифицированный посредством вторичных гидроксилов, был получен после обработки ферментом, которая специфически расщепляла эфиры первичных гидроксилов (Ray and Stark, 1998).Более широкий набор олигомеров был получен после частичной деполимеризации кутина плодов томата в результате реакции мягкого метанолиза (Graça and Lamosa, 2010). Были обнаружены олигомеры вплоть до гептамеров, построенные из C 16 ω -гидроксикислот с вторичным гидроксилом средней цепи, доминирующим мономером в кутине томата. Как было доказано методами 2D ЯМР в состоянии раствора, присутствовали сложные эфиры как первичных ( ω, -), так и вторичных (средняя цепь) гидроксильных групп, но более поздние в основном преобладали в пропорции 4.5 к 1 (Graça and Lamosa, 2010).
Какие выводы можно сделать из приведенной выше информации относительно макромолекулярной структуры in situ кутина внутри кутикулы? Макромолекула кутина, безусловно, растет в результате линейной этерификации последовательных ω- гидроксикислот их первичными ω- гидроксилами. Однако наблюдаемая обширная этерификация вторичных гидроксилов средней цепи показывает высокую степень разветвления, которое станет еще более плотным из-за локального разветвления самой углеводородной цепи.Каким-то образом в противоречии, по крайней мере, положения первичного сложного эфира и значительная часть метиленовых цепей показывают относительно высокую молекулярную подвижность, предполагая, что они являются частью не слишком сильно сшитой сети. Часть цепей метилена (CH 2 ) n может быть частью упорядоченно упакованных областей, которые отвечают за молекулярную жесткость, которую демонстрируют некоторые из них. Предполагается, что эти предполагаемые кристаллические области являются сердцевиной кутана (Deshmukh et al., 2005). Предварительные рабочие модели были предложены для макромолекулы кутина, показывающей сетчатое расположение ω -гидроксикислот (Stark and Tian, 2006) или ее рост более дендритным образом (Graça and Lamosa, 2010).Мало что известно о роли других мономеров кутина, таких как глицерин, или о связях между алифатическим кутином и фенольными фрагментами или соседними полисахаридами. Безусловно, необходимо провести много исследований с использованием ЯМР и других методов, прежде чем мы сможем получить точную картину макромолекулярной архитектуры кутина и ее структурной изменчивости.
Назад к началу: критическое исследование преобладающей кутикулы Модель
Исследования, проведенные за последние 50 лет, позволили лучше понять состав кутикулы, в основном касающийся кутина и восков, и, в меньшей степени, структуры кутикулы некоторых видов растений и органов.Однако, как отмечают Бушхаус и Джеттер (2012): «Вклад различных компонентов кутикулы в каждую функцию кутикулы в настоящее время неясен. Точно так же вклад различных субструктур в разные роли кутикулы остается неопределенным. Нашему пониманию в основном препятствует тот факт, что предыдущие исследования были направлены на химическую и биологическую характеристику кутикулы разных видов, а затем поиск взаимосвязей между структурой и функцией на основе сравнения видов.Тем не менее, такие описательные сравнения неизбежно были сбиты с толку множеством различий кутикулы между видами, а не только одним оцениваемым фактором »-.
В нескольких исследованиях Arabidopsis thaliana (L) Heynh использовался в качестве модели для биосинтеза кутина (например, Nawrath et al., 2013; Go et al., 2014; Fabre et al., 2016; Li et al., 2016), но его кутикула по составу нетипична и не репрезентативна для большинства видов растений (Franke et al., 2005; Pollard et al., 2008; Domínguez et al., 2011). В связи с повышенной доступностью геномных ресурсов томата ( Solanum lycopersicum L.) этот фрукт также используется в качестве модели для анализа механизмов образования кутикулы (например, Martin and Rose, 2014; Petit et al., 2014). Коммерческое значение и простота выделения кутикулы плодов томата (Petit et al., 2014) делают этот вид интересным для проведения исследований кутикулы (Petit et al., 2014). Однако есть свидетельства того, что помидоры возникли в регионе Анд в Южной Америке, были одомашнены в Мексике и культивировались в Европе с 16 века, при этом процессы приручения и селекции были сосредоточены на улучшении внешнего вида и качества плодов (Paran and van der Knaap, 2007 ).В результате таких усилий по селекции и селекции на рынке появился ряд сортов томатов разных размеров, качественных характеристик и окраски, многие из которых подвержены растрескиванию (Domínguez et al., 2012). Следовательно, интенсивная селекция и отбор по качественным признакам (например, больший размер и улучшенный красный цвет) плодов томатов, которым подвергались на протяжении многих лет, могут ограничить значение этой кутикулы как модели для широкого круга органов и видов растений, поскольку она может скорее быть примером какой-то искусственной и необычной кутикулы.
Текущая ситуация такова, что мало известно о взаимосвязи между химическим составом и структурой кутикулы и о потенциальных поперечных связях внутри и между составляющими кутикулы (Pollard et al., 2008; Guzmán et al., 2014a). Кроме того, при пересмотре существующей литературы можно наблюдать тенденцию к разработке иногда подробных химических анализов кутикулы растений (например, López-Casado et al., 2007; Jetter and Riederer, 2016) без учета структуры и локализации составляющих кутикулы. что снижает значимость результатов в физиологическом и анатомическом отношении.Точно так же большинство молекулярно-биологических исследований, проведенных с использованием кутикулы растений (в основном томатов и Arabidopsis ), не учитывают ключевые химические и структурные особенности, что ограничивает их общую интерпретацию. Подводя итог, можно сказать, что существует множество исследований, посвященных определенным аспектам кутикулы растений, но существует потребность в интегративном подходе, который может помочь нам понять их формирование, структуру и функцию.
Кроме того, большинство исследователей до сих пор понимают кутикулу как липидный, гидрофобный слой, который не зависит от находящейся под ним эпидермальной клеточной стенки. Эта концепция была разработана более 150 лет назад и не подвергалась критическим исследованиям в течение десятилетий.Как указано в историческом обзоре, представленном выше, преобладающая интерпретация кутикулы недавно была поставлена под сомнение (Guzmán et al., 2014a, c).
Термины «гидрофобный» и «липофильный» широко используются в отношении кутикулы растений, хотя они являются просто качественными и неадекватными с точки зрения физико-химии. Гидрофобный и гидрофильный означают, что вещество имеет низкое или высокое сродство к воде соответственно. Большинство существующих молекул образовано функциональными группами, которые обеспечивают неполярность, полярность или водородные связи (Khayet and Fernández, 2012).Следовательно, парафины в основном неполярны (строго аполярны в случае алканов), но будут иметь некоторую степень полярности и взаимодействия водородных связей, если они содержат функциональные группы, содержащие кислород (например, кислоты, спирты или кетоны; Рисунок 1). Это также справедливо для мономеров кутина (этерификация снижает полярность и взаимодействия Н-связывания), фенольных соединений и полисахаридов (Khayet and Fernández, 2012). Таким образом, более точно обсуждать неполярность, полярность или потенциальные водород-связывающие свойства поверхностей растений, чем говорить об их гидрофобном или липофильном характере.Хотя такие качественные термины, которые широко используются, подразумевают, что соединение или материал имеет значительные полярные или неполярные компоненты, соответственно (Khayet and Fernández, 2012; Fernández and Khayet, 2015), они определенно не отражают физико-химические свойства химических составляющих кутикулы и следует использовать и интерпретировать с осторожностью.
Преобладающее представление о кутикуле растений как о независимом липидном слое в значительной степени основано на гипотезах Бронгниара (1830 г.) и фон Моля (1847 г.), которые в то время уже вызывали споры.Позднее такая модель была подтверждена наблюдениями с помощью ПЭМ кутикулы, содержащей кутан, у A. americana (Wattendorff and Holloway, 1982) и C. miniata (Schmidt and Schönherr, 1982), которые мало подвержены химическому разложению из-за высокой нерастворимая и не деэтерифицируемая природа кутана (Villena et al., 1999; Guzmán-Delgado et al., 2016). Методологические ограничения, связанные с микроскопическими и аналитическими методами, описанными выше, могут дополнительно привести к вводящим в заблуждение результатам и интерпретациям, касающимся, например, местоположения, качества, количества и роли химических компонентов кутикулы.
Более того, тесная связь между клеточной стенкой и кутикулой с ранних стадий онтогенеза органа (Schieferstein and Loomis, 1959; Tenberge, 1992; Segado et al., 2016), а также свойства проницаемости кутикулы для воды и растворенных веществ ( Fernández and Eichert, 2009; Fernández and Brown, 2013) нельзя полностью оправдать преобладающей концепцией кутикулы. Например, мнение о том, что кутикула представляет собой липидный и гидрофобный слой, нелегко согласовать с показателями проницаемости воды и электролитов (Schreiber and Schönherr, 2009), а существование «водных» или «полярных пор» имеет были выдвинуты гипотезы (например,г., Schönherr, 1976, 2000, 2006). Что касается механизмов водопроницаемости, способность кутикулы к гидратации (Chamel et al., 1991; Luque et al., 1995a, b; Domínguez and Heredia, 1999b) теоретически отражает возникновение полярных доменов в кутикуле. Эти домены в основном приписываются кутину (Schönherr and Huber, 1977; Becker et al., 1986), фенольным соединениям (Luque et al., 1995a) или полисахаридам (Chamel et al., 1991; Domínguez and Heredia, 1999b). Предполагаемая локализация полисахаридов только во внутренних областях кутикулы привела к предположению, что «полярные поры» пересекают кутикулу, чтобы объяснить перенос полярных веществ и электролитов через кутикулу (Hull, 1970; Schönherr, 1976, 2000; Schönherr and Schreiber, 2004). ; Schreiber, 2005; Niemann et al., 2013). Однако существование таких «пор» до сих пор не было продемонстрировано микроскопическими средствами, и возникновение пор как таковое кажется маловероятным, учитывая ультраструктуру кутикулы, наблюдаемую с помощью ПЭМ (рисунок 3 и см. Компиляцию микрофотографий ПЭМ Джеффри, 2006). кутикулы многих растений, о которых сообщалось до сих пор (Fernández and Eichert, 2009).
Кроме того, резкое снижение водопоглощающей способности кутикулы после экстракции полисахарида (Chamel et al., 1991; Reina et al., 2001; Domínguez et al., 2011) или относительно низкое содержание полисахаридов в кутикуле по сравнению с другими химическими фракциями (Schreiber and Schönherr, 2009), привело нас к гипотезе о том, что как количество, так и роль полисахаридов могут быть недооценены (Guzmán et al., 2014a, c), как ранее предлагалось в обзоре Domínguez et al. (2011).
Переинтерпретация кутикулы растений как липидизированной области стенки эпидермальных клеток
Тесная связь между полисахаридами и липидными составляющими кутикулы была предложена во второй половине 19 века и в начале 20 века (т.е.г., Fremy et Terreil, 1868; Кросс и Беван, 1916). Липидизированная природа кутикулы клеточной стенки была отмечена Yeats and Rose (2013) и структурно и химически наблюдалась для кутикулы листа двух видов эвкалипта Guzmán et al. (2014a). Структура клеточной стенки кутикулы эвкалипта после химического извлечения различалась между внешней и внутренней областями кутикулы обоих видов, с диффузным и спиралевидным рисунком целлюлозы, связанным с так называемой «собственно кутикулой» и «кутикулярным слоем» соответственно (Guzmán et al. al., 2014а). Присутствие целлюлозы и пектинов вдоль поперечных срезов кутикулы, т. Е. От самой внутренней поверхности кутикулы до эпикутикулярного слоя воска, было также продемонстрировано для кутикулы листа E. globulus , груши и Populus x canescens ферментативным путем. -золотая маркировка
Какими полезными свойствами обладает хурма?
Хурма известна в народной медицине как мочегонное, слабительное и защищающее печень природное имунномодулирующее средство, но ее можно и нужно использовать при профилактике и лечении многих других заболеваний.
Продукт сохраняет впечатляющие запасы антиоксидантов, таких как бета-каротин, сибатол, аскорбиновая кислота и бетулиновая кислота. Они предотвращают преждевременное старение, рак и другие опасные заболевания, укрепляют иммунную систему.
В хурме содержится катехин, обладающий мощными антибактериальными, противовоспалительными и антигеморрагическими свойствами. И, конечно же, не забывайте о разных витаминах и минералах.
1. От простуды и гриппа защищает хурма за счет высокой концентрации витамина С.Усиливает борьбу организма с симптомами простуды и гриппа. В период повышенного риска респираторных заболеваний неплохо включить в рацион не только цветочный мед и малиновое варенье, но и хурму.
2. Запор. Натуральная клетчатка и большое количество воды в составе хурмы обеспечивают мягкое слабительное действие продукта.
3. мочегонное средство Плоды хурмы обязаны калию и кальцию. Ежедневное употребление более эффективных и безопасных диуретиков, так как это не приводит к потере калия в организме (частый побочный эффект диуретиков).
4. Понижает артериальное давление. При гипертонии часто ешьте хурму. Это не только поможет снизить давление, но и защитит от сердечных заболеваний, связанных с гипертонией. Вот отличный рецепт, проверенный временем. С плодов снимите кожуру и взбейте мякоть в блендере. Смешайте жидкость со стаканом молока. Пить 3 раза в неделю 3 раза в день.
5. Рекомендуется для очистки печени и детоксикации организма, в хурме содержатся антиоксиданты, которые обеспечивают львиную долю ее полезных свойств, в том числе нейтрализуют токсины и помогают в восстановлении клеток после атаки клеток свободными радикалами. .
6. Полезные источники энергии. В хурме много сахаров, которые быстро усваиваются организмом и превращаются в энергию. Именно поэтому он подходит малышам, которые находятся в спортивных кружках и секциях, ведь упражнение требует значительных энергетических затрат.
7. За счет природного антидепрессанта сахара и калия. Пейте сок хурмы, чтобы снять стресс, избавиться от усталости и нейтрализовать последствия стресса.
8. Похудение хурмы При правильном подходе практически каждый фрукт или овощ могут помочь в таком кропотливом деле, как похудание.Хурма — еще один диетический продукт в твоей копилке с надписью «Slim». Эти сочные, ярко-оранжевые фрукты умеренно калорийны (70 калорий в одном кусочке), а высокий процент клетчатки улучшает пищеварение. Кроме того, они помогают организму усваивать больше полезных веществ даже из скудной и однообразной пищи, когда вы сидите на строгой диете.
9. Помогает усвоению питательных веществ в составе хурмы. Медь позволяет организму усваивать больше железа из пищи — необходимого для образования красных кровяных телец из минерала.Кроме того, продукт снижает потоотделение, тем самым защищая от потери полезных веществ, что особенно важно для спортсменов.
10. Защищает кожу от морщин и осветляет натуральные вяжущие компоненты, входящие в состав многих косметических средств, очищают и сужают поры. Домашние маски на основе хурмы подчеркивают овал лица, подтягивают кожу, разглаживают мелкие морщинки. Самый простой, но действенный рецепт — смесь мякоти спелых фруктов, яичного желтка и капельки лимонного сока.
11. При лечении гемофилии для приготовления народных лекарств вам понадобится 30 г сушеной хурмы и 30 г корня лотоса. Эти продукты измельчить, залить 2 стаканами воды и дать настояться 15 минут. Добавьте 10 мл меда, перемешайте и принимайте 15 дней, затем сделайте небольшой перерыв. Начните цикл снова до заметного улучшения.
12. От приступа икоты пойдет следующий рецепт: 5 стеблей хурмы, 5 маленьких кусочков свежего очищенного имбиря и 6 г ароматных бутонов гвоздики вымыть и замочить в тазе с кипятком на 10 минут.Принимать напиток следует в теплом виде.
13. Лечение аллергии Это еще одна важная полезная особенность хурмы. Вымыть, очистить от кожуры и размять в миске 500 г незрелых плодов. Залить те же 1,5 л воды, перемешать и оставить на солнце на 7 дней. Отфильтровать жидкость и мякоть, отправить в мусорное ведро. Оставить воду на солнце еще на 3 дня, а затем перелить в удобную упаковку (можно в чистой баночке из-под крема).


 Хохлов, Ю. Плугатар
Хохлов, Ю. Плугатар Наиболее представлены яблочная и лимонная кислоты.
Содержание пектинов варьировало от 0,42 до 1,16%. В 100 г сырой массы плодов хурмы (FW) среднее содержание аскорбиновой кислоты составило 21,2 мг.
Минимальное количество 12,3 мг было определено в «Хякуме», тогда как «Золотистая» — максимальное количество 59,0 мг на 100 г -1 FW. Содержание β-каротина варьировало от 1,91 («Хана Фую») до 6,33 мг на 100 г -1 FW («Южная Красавица») или в среднем 1.82 мг 100 г -1 FW. В плодах хурмы были определены полифенольные соединения: катехины, лейкоантоцианы и флавонолы.
Также определяли содержание следующих минеральных элементов: калия (K), магния (мг), железа (Fe), цинка (Zn) и меди (Cu).
В условиях Южного берега Крыма в плодах хурмы накапливается небольшое количество Zn.
Тем не менее, его содержание в «Сувенир Осени» в 2,0-2,5 раза выше, чем в других сортах.
Наиболее представлены яблочная и лимонная кислоты.
Содержание пектинов варьировало от 0,42 до 1,16%. В 100 г сырой массы плодов хурмы (FW) среднее содержание аскорбиновой кислоты составило 21,2 мг.
Минимальное количество 12,3 мг было определено в «Хякуме», тогда как «Золотистая» — максимальное количество 59,0 мг на 100 г -1 FW. Содержание β-каротина варьировало от 1,91 («Хана Фую») до 6,33 мг на 100 г -1 FW («Южная Красавица») или в среднем 1.82 мг 100 г -1 FW. В плодах хурмы были определены полифенольные соединения: катехины, лейкоантоцианы и флавонолы.
Также определяли содержание следующих минеральных элементов: калия (K), магния (мг), железа (Fe), цинка (Zn) и меди (Cu).
В условиях Южного берега Крыма в плодах хурмы накапливается небольшое количество Zn.
Тем не менее, его содержание в «Сувенир Осени» в 2,0-2,5 раза выше, чем в других сортах.