Иммунная система и защитные барьеры организма
Immunnitas (латынь) — НЕВОСПРИИМЧИВЫЙ.
Основные принципы работы иммунной системы:
1.Не допустить генетически чужеродной информации вовнутрь.
2.Если попала — опознать. Либо разрушить. Либо вывести.
Как это выглядит?
1. Специфический иммунитет. Около 20% системы занимает.
2. Неспецифический. Около 80%.
При этом, около 80% внутри неспецифического иммунитета составляет функционирование баръеров, и около 20% — мононуклеарные фагоциты, как система.
Специфический иммунитет. Прививки. Несколько слов буквально. В свое время прививки в управлении тяжелыми инфекциями сыграли огромную роль. Спасли миллионы жизней.
Сегодня происходят непонятные вещи. Практически ежедневно к нам обращаются родители с огромными по тяжести осложнениями, возникшими у их детей после применения прививок. Различных. Потеря слуха, зрения, развитие Детского Церебрального Паралича, неадекватное поведение, депрессия, шизофрения, каскадная аллергия.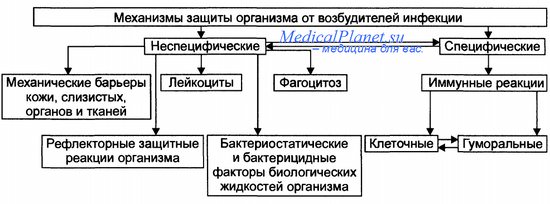
Или, обращаются взрослые девушки — по поводу развившегося рака шейки матки, после применения вакцины от папиллома вируса, который доказательно вызывает рак шейки и вакцина должна была защитить…
Не хочу продолжать. Тема страшненькая. Как я понимаю основная вина ложится на «этичных» производителей, которые продвигают на рынок неизвестно что. На условия хранения и транспортировки. Много вопросов. Страдают люди.
Прививать или нет.
Сами должны решать. Трудно советовать. Если наша старшая дочь, которой сегодня 22 года, привита по всем показаниям и возрастным правилам, то сын, которому 16 — уже очень и очень избирательно.
Намного проще и в разы эффективнее управлять барьерами.
1. Кожа (сохраняем целостность, ухаживаем).
2. Дыхательная система.
Слизистая влажная. Носова полость. В пазухах анализ состава воздуха с точки зрения иммунного ответа.
Очистить. Увлажнить. Оптимизировать температуру.
Миндальный барьер. Анализ антигенного состава пищи, воздуха и воды.
Реснитчатый эпителий. (у курильщиков не работает). Эллиминирует «грязь» в обратном направлении. Сглатывается. Санируется в желудке и 12перстной кишке. По-этому, бросает муж курить, например. Через несколько дней появляется кашель. Ночью. Он встаёт курит. Кашель проходит. Говорит жене: Вот видишь, меня сигарета лечит. Что на самом деле. Оживает реснитчатый эпителий по-немногу. Начинает работать. Пытаться очищать — Кашель. Сигарета — эпителий «В кому» — кашля нет.
3. Мочевыделительный барьер. Моча — гиперосмолярный раствор. Неудобный для жизни и размножения бактерий.
Проблемы могут быть связаны у мужчин с задержкой мочи. Аденома предстательной железы — задержка мочи — воспаление.
У женщин — уретра короткая. Рядом влагалище и анус. Современная, обтягивающая одежда из синтетических материалов. А, учитывая, что кишечная флора под воздействием многочисленных антибиотиков (в том числе в зубных постах и продуктах питания) мутировала, научилась агрессивно выживать, при проникновении в мочевые пути женщины трудноизлечима.
4. Кишечный барьер.
Желудок — в норме, кислая среда. Если у человека, например, изжога, то, чаще всего, доктор, не разбираясь в причинах возникновения симптома, назначает блокаторы ионной помпы.
Ещё Гиппократ говорил: «Симптоматическое лечение повышает чувство собственной значимости доктора, снижая его обучаемость».
Кислота желудка обязана провести химическую денатурацию белка.
Если этого нет, ферменты поджелудочной железы не имеют доступа к этим эллементам белка. Соответственно, нет стирания генетической информации. — Перегрузка иммунной системы.
Далее, должно быть достаточно желчи. Достаточно ферментов. Адекватный состав кишечной флоры.
Тогда количество антигенов оптимально-минимально.
Система не перегружается!
Все барьеры имеют эпителиальный слой.
Все эпителии активно делятся! Размножаются! Необходимы витамино — микроэллементные запитки!
Сегодня смешно слышать от некоторых коллег о нецелесообразности восполнения нутриентного дефицита Суплементами.
Тогда — как!? Где организм может всё необходимое получить? В каких продуктах? На самом деле — без вариантов.
Осталось научиться ориентироваться в рынке БАД и правильно выбирать то, что работает, не вредит, не требует неоправданно высоких затрат.
Например, для поддержания барьерных функций и митотической активности любого эпителия, красного костного мозга — нужен Цинк!
Дополнительно что влияет на барьеры? — различные интоксикации.
Дистрессовые состояния.
Все это уменьшает и ослабляет барьерные функции.
Как укреплять иммунитет?
4 механизма:
— целостность барьеров,
— витамино- и микроэллементная подпитка,
— снижение количества инфекций,
— уменьшение стресса.
Специфицеские механизмы иммунитета.
Как работают? -Тестируют:
«Моё? — Не моё!» «Не моё! — Тогда что это?» «Если не знаю — в мусор!»
Макрофаги частично перерабатывают и передают информацию в систему специфического иммунитета.
Специфические клетки, получив сигнал, включают резкое размножение и массированной атакой справляются с агрессией.
Часть армии после выполнения поставленной задачи уходит в базу клеток памяти (архив). Где сохраняется на какое-то время, либо на всю жизнь.
Самое главное в аутоиммунных процессах вернуть функциональную активность БАРЬЕРНЫМ ФУНКЦИЯМ.
Пример.
Эндометриоз экстрагенитальный — напрямую связан с нарушением всех четырёх основных защитных механизмов:
иммуннодефицит — НЕТ внутренних ресурсов — НЕТ яркой клинической картины — экссудативный характер воспалительного процесса — сокращения матки — экссудат со слущенным эндометрием за пределы матки (экссудат — это ростовой фактор, а у эндометрия ОГРОМНЫЙ МИТОТИЧЕСКИЙ РЕСУРС).
В рамках иммуннодефицитного состояния лежит избыточная митотическая активность на фоне факторов роста.
Хроническое воспаление — проявление иммуннофефицита.
И, это не из-за бактерий!
Легче убить хозяина, чем уничтожить бактерии.
Задача:
Восстановить барьеры, накормить, укрепить!
Из лекции врача-нутрициолога, гинеколога Аркадия Бибикова.
Глава VII. Естественные барьеры против инфекций
Механизмы иммунитета схематически можно разделить на следующие группы:
-кожные и слизистые барьеры;
-воспаление, фагоцитоз, ретикуло-эндотелиальная система;
-барьерная функция лимфатической ткани;
-гуморальные факторы;
-реактивность клеток организма.
Кожа непроходима для большинства бактерий. Однако кожа является не только механическим барьером для микробов. Она обладает также стерилизующими свойствами, и микробы, попавшие на кожу, быстро погибают. Большинство бактерий не способны долго существовать на поверхности кожи из-за прямого губительного воздействия молочной кислоты и жирных кислот, содержащихся в поте и секрете сальных желез.
Слизистые
оболочки также являются защитным
барьером организма в отношении микробов. Слизь, выделяемая стенками внутренних
органов, действует как защитный барьер,
препятствующий прикреплению бактерий
к эпителиальным клеткам. Микробы и
другие чужеродные частицы, захваченные
слизью, удаляются механическим путем
— за счет движения ресничек эпителия, с
кашлем и чиханием. К другим механическим
факторам, способствующим защите
поверхности эпителия, можно отнести
вымывающее действие слез, слюны и мочи.
Во многих жидкостях, секретируемых
организмом, содержатся бактерицидные
компоненты (высокая кислотность
желудочного сока, слизистая оболочка
кишечника). Бактерицидное действие
отделяемого слизистых оболочек связано
также с наличием в нем особого вещества
– лизоцима. Лизоцим содержится в слезах,
мокроте, слюне, плазме и сыворотке крови,
лейкоцитах, в курином белке, в икре рыб.
Бактерицидность слюны делает понятным
распространённый у всех животных
инстинкт вылизывания языком. Таким
вылизыванием достигается не только
механическое удаление инфекта, но и
внесение в рану бактерицидного агента.
Слизь, выделяемая стенками внутренних
органов, действует как защитный барьер,
препятствующий прикреплению бактерий
к эпителиальным клеткам. Микробы и
другие чужеродные частицы, захваченные
слизью, удаляются механическим путем
— за счет движения ресничек эпителия, с
кашлем и чиханием. К другим механическим
факторам, способствующим защите
поверхности эпителия, можно отнести
вымывающее действие слез, слюны и мочи.
Во многих жидкостях, секретируемых
организмом, содержатся бактерицидные
компоненты (высокая кислотность
желудочного сока, слизистая оболочка
кишечника). Бактерицидное действие
отделяемого слизистых оболочек связано
также с наличием в нем особого вещества
– лизоцима. Лизоцим содержится в слезах,
мокроте, слюне, плазме и сыворотке крови,
лейкоцитах, в курином белке, в икре рыб.
Бактерицидность слюны делает понятным
распространённый у всех животных
инстинкт вылизывания языком. Таким
вылизыванием достигается не только
механическое удаление инфекта, но и
внесение в рану бактерицидного агента.
Кроме лизоцима в тканях и жидкостях обнаружены и другие бактерицидные вещества.
Бактерицидные свойства молока были подробно изучены Уилсоном и Розенблюмом (1952). Особый фактор, названный лактенином, бактерицидный в отношении гемолитического стрептококка, был найден в молоке коров и овец.
Глава VIII. Как организм защищается от бактерий
Место
проникновения бактерий в организм,
называется входными воротами инфекции.
Здесь на борьбу с бактериями поднимаются
фагоцитирующие клетки. Первый сигнал
мобилизации эти клетки получают от
самих бактерий-агрессоров в виде молекул
их токсинов. Одновременно с фагоцитозом
бактерий макрофаги начинают синтезировать
и выделять воспалительные цитокины —
интерлейкин-1, фактор некроза опухолей
и другие. Под влиянием цитокинов
усиливается прилипание циркулирующих
лейкоцитов к эндотелию сосудов и
мобилизация в очаг инфекции. Те же
цитокины усиливают антибактериальную
активность фагоцитов.
Активированные Т-лимфоциты пополняют ресурсы воспалительных цитокинов, синтезируя гамма-интерферон, активирующий макрофаги. Существенную помощь фагоцитирующим клеткам в борьбе с бактериями оказывают продукты В-лимфоцитов — специфические антитела-иммуноглобулины. Взаимодействуя с антигенами бактерий, антитела как бы подготавливают бактерии в пищу фагоцитам, делают их более удобоваримыми. Кроме того, специфические антитела против бактериальных токсинов расправляются с последними самостоятельно: токсин, связавшийся со своими специфическими антителами, утрачивает токсичность и больше не представляет опасности для организма.
Микробиота и иммунные клетки на страже кишечника
Распространение COVID-19 продолжается, и мы надеемся, что у нас есть необходимые инструменты, чтобы победить инфекцию.
 С момента рождения человека его иммунная система выполняет защитные функции в тесном взаимодействии с кишечной микробиотой.
С момента рождения человека его иммунная система выполняет защитные функции в тесном взаимодействии с кишечной микробиотой.Не только коронавирус, но и любой попадающий в организм микроб — бактерия, вирус или грибок — представляет потенциальную опасность. Для удаления микроба из организма активируются защитные функции, тщательную регуляцию которых выполняют иммунные клетки и кишечная микрофлора. Защитный барьер, созданный кишечником, препятствует попаданию инородных тел в кровоток.
Кишечный барьер
Цель взаимодействия иммунной системы и кишечника — обеспечение и поддержание баланса кишечной микрофлоры в течение всей жизни человека. Кишечная микробиота создает защитную основу из микробов, которая препятствует колонизации кишечника патогенными бактериями. Баланс между клетками кишечника и микрофлорой создает условия, благоприятные для развития полезных бактерий. Напротив, любое изменение в этой экосистеме отрицательно влияет на этот баланс. Возникает порочный круг: воспаление способствует колонизации патогенными микроорганизмами, которые в свою очередь усиливают воспаление. Клетки кишечника, в свою очередь, формируют естественный физический барьер, покрытый толстым слоем слизи, который не позволяет бактериям, вирусам и грибам покидать просвет желудочно-кишечного тракта.
Возникает порочный круг: воспаление способствует колонизации патогенными микроорганизмами, которые в свою очередь усиливают воспаление. Клетки кишечника, в свою очередь, формируют естественный физический барьер, покрытый толстым слоем слизи, который не позволяет бактериям, вирусам и грибам покидать просвет желудочно-кишечного тракта.
Защитные клетки кишечника
Некоторые иммунные клетки, например, макрофаги1, реализуют врожденный иммунитет, который обеспечивает быструю реакцию, но не является специфичным2: «Я тебя вижу, я тебя поймаю, я тебя уничтожу». Остальные клетки, в том числе лимфоциты1, относятся к системе приобретенного иммунитета, который реагирует медленнее. Он обладает специфичностью3 и иммунной памятью о предыдущих инфекциях: «Я тебя узнаю, я тебя поймаю, я тебя уничтожу». Одной из функций клеток приобретенного иммунитета является выработка антител. Точное регулирование иммунной системы предотвращает избыточный воспалительный ответ на полезные бактерии, а также за счет обеспечения толерантности к питательным веществам4 не допускает развития пищевой аллергии.
Высокосинхронизированная кооперация
Бактерии находятся в постоянном взаимодействии с кишечником, как напрямую, так и за счет передачи сигналов. Полученные сообщения позволяют иммунным клеткам постоянно быть настороже и усиливать кишечный барьер там, где это необходимо. Они также способствуют активации врожденного и приобретенного иммунного ответа. По данным исследований у животных, эти взаимодействия также влияют и на другие органы. Так диета, богатая волокнами, позволяет микробиоте вырабатывать небольшие молекулы, которые оказывают благоприятный эффект на аллергические реакции со стороны легких. И действительно, микробиота может уменьшать избыточное воспаление, происходящее не только в кишечнике, снижая интенсивность и вероятность возникновения инфекции, стресса, сезонной аллергии или пищевой непереносимости5.
Стимулируем микробиом
Несмотря на то, что исследования взаимосвязи между COVID-19, микробиотой и иммунной системой пока не завершены, оптимальным способом поддержания кишечного барьера является здоровый образ жизни, способствующий сохранению микробиоты — например, за счет сбалансированной диеты.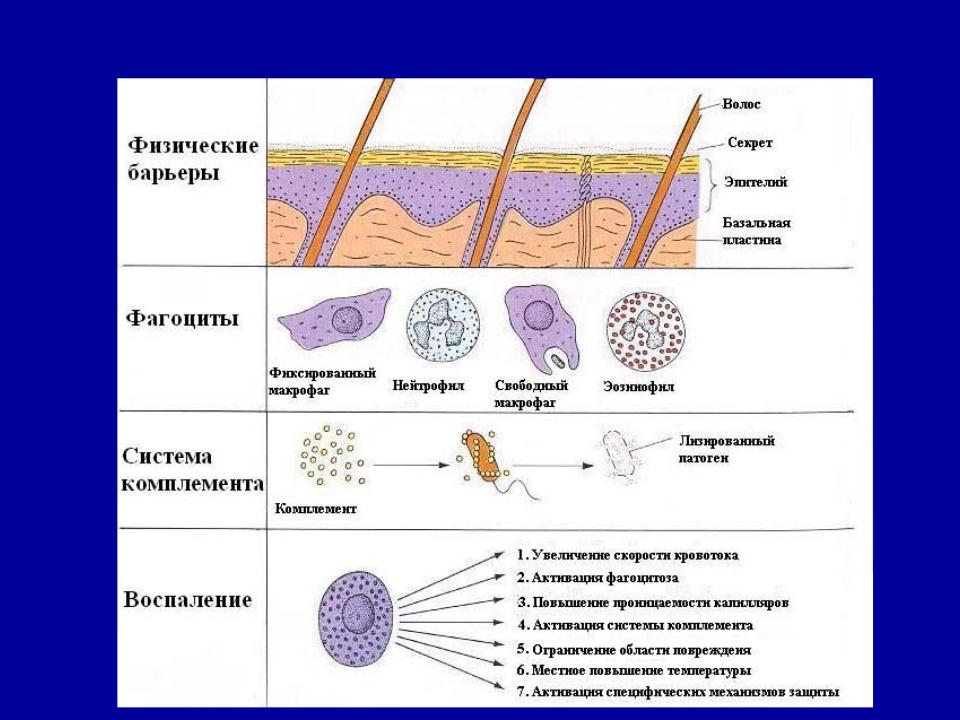
1) Макрофаги и лимфоциты — это лейкоциты, выполняющие функцию иммунных клеток. Они защищают организм за счет удаления проникших в него инородных тел.
2) Неспецифичное действие носит общий характер, оно не направлено против определенных молекул или микробов.
3) Специфичное действие направлено против определенных молекул или микробов.
4) Питательные вещества — это небольшие молекулы, которые высвобождаются в процессе переваривания пищи.
5) Пищевая непереносимость возникает, когда иммунная система неправильно распознает молекулы питательных веществ как вредные вещества.
Источники :
Gaboriau-Routhiau, Cerf-Bensussan. Microbiote intestinal et développement du système immunitaire 2016. Med Sci (Paris). 32(11): 961–967. doi: 10.1051/medsci/20163211011.
Caminero A, Meisel M, Jabri B, et al. Mechanisms by which gut microorganisms influence food sensitivities. Nat Rev Gastroenterol Hepatol. 2019;16(1):7‐18. doi:10.1038/s41575-018-0064-z
Nat Rev Gastroenterol Hepatol. 2019;16(1):7‐18. doi:10.1038/s41575-018-0064-z
https://www.futura-sciences.com/sante/questions-reponses/medecine-intestin-role-joue-t-il-immunite-11392/
https://www.futura-sciences.com/sante/actualites/nutrition-diversite-microbiote-favorise-renforcement-systeme-immunitaire-80225/
Sievietes veselība
Различается врожденный и приобретенный иммунитет. Врожденный иммунитет связан с врожденными биологоческими особенностями организма. Врожденный иммунитет является очень стабильным видом иммунитета, который наследуется от родителей. Неспецифический или врожденный иммунитет обеспечивают лимфатические ткани, находящиеся во всем теле. Неспецифический иммунитет обеспечивает три вида защиты: защитные барьеры, воспалительная реакция, защитные белки.
Приобретенный иммунитет, который разрабатывается во время жизни, образуется при соприкосновении с разными факторами внешней среды, потомки его не наследуют.
Неоспоримое положительное влияние на развитие иммунной системы ребенка имеет материнское молоко. Для женщин важным этапом иммунной системы является беременность и рождение ребенка. То, как протекает беременность и проходят роды, в большой степени характеризует действие иммунной системы женщины.
Для женщин важным этапом иммунной системы является беременность и рождение ребенка. То, как протекает беременность и проходят роды, в большой степени характеризует действие иммунной системы женщины.
Одним из видов модулирования иммунитета являются вакцины. Хотя они проявили себя как эффективное средство защиты организма от определенных болезней, они могут иметь серьёзные побочные явления. Именно по это решение о получение вакцины должно быть продуманным.
Искусственно приобретенный иммунитет достигается, вводя в организм вакцины, которые содержат соответственно обработанные возбудители — антигены. Под их влиянием в организме образуются антитела. Об образовании иммунитета можно судить только при повторном соприкосновении с возбудителем тех самых болезней; иммунный организм болеет в легкой форме или не болеет совсем. Люди к одной и той же болезни могут иметь разную надежность (индивидуальные особенности иммунитета).
Здоровый иммунитет выполняет защитные функции организма и защищает его от инфекций. Признаком плохого иммунитета является неспособность организма бороться с инфекциями. Инфекционные болезни являются нарушениями, которые вызываются разными организмами – бактериями, вирусами, грибками и паразитами. Многие из этих организмов живут в нашем теле или на нем. Обычно они не являются вредными (или даже являются пригодными), но при определенных обстоятельствах они могут вызвать заболевание. Инфекционные болезни могут передаваться от человека к человеку, через укусы инсектов или животных, а также при травмах кожи.
Борьбу первыми начинают находящиеся в крови лимфоциты, информацию передают дальше клеткам (макрофаги и нейтрофилы), которые находятся в лимфатических узлах, селезёнке и гландах, они абсорбируют врага. Потом Т лимфоциты дают сигнал защите, и В лимфоциты в костном мозгу вырабатывают антитела для борьбы со врагом — иммуноглобулины. Они привязывают и выводят чужаков из организма. В лимфоциты создают специальные, действующие против патогенных микроорганизмов эффективные антитела, создавая так называемую иммунологическую память. Поэтому в случае заболевания лимфатические узлы имеют тенденцию к увеличению.
Слишком большая стерильность в окружающей среде может даже наносить вред. Высокие гигиенические стандарты меняют иммунитет и таким образом способствуют образованию аллергии. Для образования иммунитета организму необходим контакт с бактериями и микробами.
Если иммунная система продолжительное время работала с перегрузкой, в один момент в организме происходит расстройство, и иммунитет больше не может отличить, кем являются «плохие» из вне, а кто — «свои». В результате этого организм начинает нападать и на свои ткани. Это называют автоиммунным заболеванием. Аутоиммунитет — это иммунитет против собственного тела, вместо борьбы с вирусами, бактериями и другими инородными частицами, он начинает бороться с различными тканями организма, вызывая воспаление, генеративные процессы и заболевания. Это гиперактивная реакция иммунитета на системы органов своего тела. Аутоиммунные заболевания становятся все более распространенными.
Медицинские условия для аутоиммунных состояний включают три основных фактора: генетическая предрасположенность, присутствие вирусных/ бактериальных или чужеродных тканевых антигенов в организме и синдром повышенной кишечной проницаемости. Синдром повышенной кишечной проницаемости является необходимым условием для аутоиммунного заболевания.
Если иммунитет понижается, микрофлора может стать плодородной почвой для инфекций, которые, агрессивно нападая, еще больше уменьшает иммунитет. Комплекс RTS FIBER растворимая и нерастворимая клетчатка имеет особенно существенное значение в профилактике инфекционных заболеваний, а также в борьбе против их последствий — помогает возобновить и поддерживать равновесие кишечной микрофлоры и стимулирует иммунитет, благодаря хорошим бактериям, которые кормятся клетчаткой.
Чтобы иммунитет мог защитить организм, он не должен быть ослабленным, но и не должен быть особенно активным.
Естественными защитными барьерами организма являются кожа и слизистая оболочка, которая покрывает дыхательный и пищеварительный тракт.
В наши дни не является тайной то, что иммунитет организма напрямую связан с микрофлорой кишечного тракта. Не зря кишечный тракт называют сердцем иммунной системы – именно он управляет всеми защитными функциями организма. Кишечная микрофлора очень хрупкая, её равновесие зависит от многих факторов, в очень большой мере – от питания, который в наши дни, к сожалению, является причиной многих болезней. Поэтому одной из проблем, влияющих на иммунитет, является ожирение. Жировые клетки продуцируют воспалительные вещества, которые потом могут воздействовать на образование разных хронических заболеваний. В 80% случаев здоровье человека зависит от самого человека, а не от медицины.
Живущие в кишечном такте бактерии образуют микробиом, который влияет на иммунитет, состояние кожи, вес и уровень холестерина в крови. Если стенки или слизистая оболочка кишок повреждены, в организме имеется расстройство поглощения минералов и витаминов и иммунитет человека становится хрупким. Витамины и минералы служат биологическими катализаторами для укрепления иммунный системы, и помогает поддерживать уровень антиоксидантов, которые обеспечивает противостояние организма инфекциям.
Хорошим бактериям могут наносить вред и антибиотики. Также на иммунитет влияет психоэмоциональная и физическая перегрузка, прием медикаментов, иммунитет понижается во время беременности. Используя все больше продуктов, которые сдержат химические вещества, например, консерванты и усилители вкуса, иммунитет может понизиться.
Биологически активная добавка RTS FIBER обеспечивает уникальную, правильно сбалансированную комбинацию растворяющейся и не растворяющейся клетчатки, очищающая кишечный такт, обновляет баланс микрофлоры, активизирует пищеварительную деятельность. Имеющийся в составе иммуномодулятор -1.3-1.4 бета гликан — существенно повышает иммунитет и защитные способности организма.
RTS FIBER W очищает кишечный такт, не дает холестерину осаждаться в кровеносных сосудах, уменьшает рефлюкс. RTS FIBER APi способствует очищению кишечника от паразитов, оказывает антибактериальное действие. RTS FIBER B уменьшает воспалительные процессы, улучшает функцию поджелудочной железы и регулирует уровень глюкозы в крови. RTS FIBER G укрепляет сердце и кровеносные сосуды, привлекает и выводит из организма лишнюю жидкость. RTS FIBER Y активизирует обмен веществ, сквален насыщает организм кислородом и помогает поддерживать уровень витамина D.
Регулярно принимая RTS FIBER продукты, организм оснащается необходимыми витаминами, минералами и аминокислотами. Улучшается функция желудка и кишечного тракта. Комплекс RTS FIBER растворяющейся и не растворяющейся клетчатки обновляет и поддерживает микробиом. У порядоченный микробиом и имеющийся в составе RTS FIBER бета гликан 1.3-1.4 существенно укрепляет общую иммунную систему.
Купить
Семь советов, как осенью повысить защитные силы организма — Российская газета
Специалисты подсчитали, что общий вес бактерий, живущих в организме человека, составляет два килограмма.
Только во рту обитает около 40 000 бактерий. И, скажем, во время поцелуя мы обмениваемся бактериями почти трехсот видов. А ведь есть еще и вирусы, болезнетворные грибки…. Сколько их попадает к нам вместе с пищей, дыханием, через грязные руки…. По счастью, природа вооружила нас «внутренними войсками» — иммунной системой.
Но если иммунитет ослаблен, то осенью, когда приходит время простуд, бактерии выходят из-под контроля. И тогда болезни следуют одна за другой. Не помогают даже лекарства.
Что же делать?
Не стоит сразу бежать в аптеку за лекарствами, которые искусственно подстегивают защитную систему организма. Иммуностимуляторы тоже далеко не безвредны. Как и любое лекарство, они имеют побочные эффекты. Кроме того, чрезмерная активность иммунитета опасна сама по себе. Ведь его задача — убить проникшего в организм чужака (вирус, микроб, грибок, трансплантированную ткань) во что бы то ни стало, жертвуя даже здоровыми тканями вокруг. И гиперактивная иммунная система может начать войну не только против вирусов и бактерий, но против вашего сердца, суставов, кожи, вызвать аллергические заболевания, привести к смертельно опасному инфекционно-токсическому шоку.
Но позаботиться, чтобы защитные силы всегда были на высоте, конечно, нужно. Вот семь советов для тех, у кого ослаб иммунитет.
1 Начните правильно питаться. Кишечник играет чуть ли ни основную роль в формировании иммунитета. Вот что требуется иммунной системе для нормальной работы:
Жиры, белки и углеводы в оптимальных количествах.
Из овощей и фруктов он получает витамины, минеральные вещества и клетчатку, которая регулирует его работу.
В зеленом горошке кроме всего прочего содержатся природные пребиотики, поддерживающие кишечную флору.
В луке, чесноке и зелени — фитонциды, очищающие от микробов.
Листья сельдерея укрепляют защитные силы организма, оказывают антисептическое, противовоспалительное и ранозаживляющее действие.
Малина — природный антибиотик, обладает не только потогонным и жаропонижающим, но еще противовирусным и антибактериальным действием.
Мясо, яйца и молочные продукты содержат животные белки, необходимые для формирования крепкого иммунитета.
Природные адаптогены — женьшень, лимонник китайский, родиола розовая, элеутерококк и чеснок усиливают синтез белков, активизируют обмен и повышают тонус организма, а эхинацея стимулирует работу макрофагов — внутриклеточных воинов.
2 Постарайтесь лучше высыпаться. Хорошо отдохнувший и восстановившийся за ночь организм значительно эффективнее борется с болезнями.
3 Закаляйтесь. Начинать закалку лучше, конечно, летом — с купания в речке, море, обливаний, воздушных и солнечных ванн. Но не отчаивайтесь. Закаляться можно и зимой. При этом совсем не обязательно нырять в прорубь или выливать ведро ледяной воды на голову. Это авральные методы. После купания в ледяной воде в кровь выбрасывается такое количество антител, что они могут защищать нас примерно двое суток. Это, безусловно, эффективно, но истощает резервы иммунной системы. Поэтому лучше просто начать по утрам принимать душ, постепенно снижая температуру воды с 30 градусов до 15. Или обливать холодной водой ноги, постепенно двигаясь вверх, пока не привыкнет полностью все тело.
Не забудьте про баню — это тоже очень действенное закаливающее средство.
4 Больше двигайтесь, займитесь спортом. На иммунную систему хорошо действует фитнес и бассейн. Такие занятия тренируют кровоток, выводят продукты распада и усиливают восстановительные процессы. Зимой очень полезно ходить на лыжах, кататься на коньках или просто больше гулять на свежем воздухе — лучше всего в парке или в лесу. В лесном воздухе почти нет пыли, а значит, и тяжелых ионов, угнетающе действующих на здоровье. А вот живительного кислорода — хоть отбавляй. Гектар дубового леса, например, ежегодно продуцирует 830 кг кислорода, березового — 725, соснового — 540.
5 Не игнорируйте прививки. Зачем попусту напрягать иммунитет болезнями, если от них можно заранее привиться. Современные вакцины надежно защищают от сезонных эпидемий гриппа, ОРВИ, простуд, а следовательно, и от тяжелых осложнений. Потому что лимфоциты обладают «иммунной памятью» и быстро побеждают уже знакомого врага большой армией антител. На этом принципе основаны все вакцины.
6 Больше радуйтесь жизни. Наша психика способна воздействовать на иммунную систему. Положительные эмоции, приятные впечатления, задорный смех способствуют выработке эндорфинов — гормонов радости, которые являются крепким защитным барьером от любого недуга.
7 Постарайтесь снизить нагрузку на иммунитет. Его главные враги:
Плохая экология.
Стрессы.
Несбалансированное и недостаточное питание.
Курение.
Злоупотребление алкоголем.
Бездумный прием антибиотиков.
Простудные и инфекционные заболевания.
Сезонные авитаминозы.
Это интересно
Слабый пол сильнее
Научное исследование, проведенное на грызунах в монреальском университете Макджилл, позволило ученым предположить, что женский иммунитет сильнее мужского. В ходе эксперимента мышам обоих полов вводили чужеродный белок и наблюдали за реакцией иммунной системы. Организм самцов хуже справлялся с чужаком. При более детальном изучении оказалось, что у самок внедренный белок блокировали не только иммунные клетки, но и эстрогены — женские половые гормоны. Они-то, по мнению исследователей, и являются залогом большей устойчивости к инфекциям.
Как повысить иммунитет весной
Многие из нас, пережив длинную, затяжную зиму, чувствуют себя усталыми, невыспавшимися. У нас пропадает аппетит, возникает чувство апатии. В таких случаях речь идет об ослаблении иммунной системы. Как известно, иммунитет- это защитный барьер, который не пропускает в организм патогенные микроорганизмы, а если они все-таки проникли, помогает с ними бороться. Каждую секунду человека атакуют вирусы, бактерии, грибки, микробы. Но благодаря своему иммунитету, мы даже не замечаем это невидимой борьбы, которую с нами ведут микроорганизмы.
Помните, как в фильме «Война миров», страшных инопланетных чудовищ, против которых оказалась бессильна человеческая техника, уничтожили обычные микробы. Человеческий организм за сотни тысяч лет эволюции нашел оружие против «невидимых» врагов. А гости из космоса оказались бессильны против невидимых глазу земных организмов.
Малыши, как правило, рождаются с крепкой иммунной системой, рассчитанной на долгие годы использования. Но в процессе жизни мы волей или неволей расшатываем свою цитатель, этому способствуют неправильный образ жизни, нездоровое питание, не соблюдение гигиены труда и отдыха, злоупотребление медикаментозными препаратами, особенно — антибиотиками, стрессы, а также неблагополучная экологическая обстановка.
Процесс укрепления иммунитета актуален круглый год.
Ведь хорошая иммунная система –достойный помощник в борьбе с патогенными микроорганизмами. Дети и взрослые, имеющие ослабленный иммунитет, чаще всего подвержены вирусным атакам. Частота подобных недугов помогает увидеть истинную картину, отражающую состояние иммунной системы.
Если человек болеет простудными заболеваниями 4-5 раз в год, то это серьезная причина задуматься о способах укрепления защитной функции.
Проникновение болезнетворных микроорганизмов проявляется ухудшением самочувствия, ознобом и слабостью, иногда-температурой.
Однако организм не бездействует, он мгновенно собирает все силы, чтобы начать упорную борьбу с вредоносными микроорганизмами.
Начинается выработка антител в крови к данному вирусу, к ним присоединяются лимфоциты. Иногда их называют клетками убийцами, которые беспощадно подавляют инфекцию. Когда человек выздоравливает, в крови остаются особые антитела к вирусу. Если случается рецидив, то иммунитет быстрее реагирует на проблему и уничтожает ее.
Весенний авитаминоз- это термин, характеризующий состояние человека после долгой и продолжительной зимы. Как правило, весну мы встречаем ослабленными, перенесшими простудные и вирусные заболевания, потратившими много сил на то, чтобы побороть патогенные микроорганизмы.
Самостоятельно диагностировать пониженный иммунитет достаточно просто, важно обратить внимание на некоторые нюансы, постараться прислушаться к собственному организму. Громким сигналом того, что иммунная система нуждается в помощи, поддержке, свидетельствуют слабость, утомляемость, боли в мышцах и сонливость , апатия, проблемы с концентрацией внимания, шелушение и сухость кожного покрова.
Перечисленные явления свидетельствуют о том, что иммунитет отбирает человеческие ресурсы, чтобы подключить их к борьбе с агрессором. Именно поэтому, человек становится истощенным, у него развивается нехватка сил для повседневных забот. Помимо этого, подобные процессы указывают на то, что ослабление защитной функции достигло максимального уровня, сил на сопротивление очень мало.
На следующем этапе проявляются частые простудные недуги, а период выздоровления затягивается. Например, насморк и герпес, проблемы с ЖКТ, гнойные выделения в из носа. Можно заметить явный сбой в функционировании иммунитета. Отмеченные болезни заявляют о высокой уязвимости человека к патогенным агрессорам.
Когда подключаются старые недуги, обостряются хронические, можно узнать о том, что ситуация ухудшилась. Иммунитет почти не работает, его необходимо спасать. Нервозность, раздражительность считаются постоянными спутниками ослабленной иммунной системы, ведь психическое равновесие связано с физическим здоровьем. Данная проблема серьезно расшатывает нервную систему. В таком случае важно предпринять срочные меры, чтобы восстановить полноценную работу организма.
Если хотите быть здоровыми, меняйте привычный образ жизни. Малоподвижный, сидячий и монотонный стиль жизни стоит заменить прогулками на свежем воздухе, бегу или ходьбе, физическим упражнениям и правильному питанию. Главный враг и убийца крепкого иммунитета – стресс, поэтому нужно меньше нервничать, ругаться и переживать по пустякам.
Основные способы укрепления иммунитета:
- активный образ жизни. Особую пользу приносят разнообразные физические упражнения – бег, фитнес и плавание, занятия на тренажерах, аэробика и шейпинг. Однако не нужно злоупотреблять, так как сильная нагрузка несет вред.
- закаливание. Душ контрастный, обливания помогут значительно укрепить здоровье. Важно правильно чередовать низкую, высокую температуру – это прекрасная тренировка. В таком случае вам помогут сауна, баня, бассейн.
- правильное питание. В рационе обязаны присутствовать такие продукты: морковь, киви и клубника, чай зеленый, брокколи, тыква и кабачки, орешки кедровые, молочная продукция, зелень, индейка, лимон, апельсин, рыба, мясо, яблоки, виноград, лук.
Важную роль в рационе занимают морепродукты, так как они богаты жирными кислотами, повышающими защитный барьер. Продолжительная термическая обработка нарушает полезные компоненты. Лучше всего остановить свой выбор на кальмарах и морской капусте.
- медикаменты. Иммуностимуляторы предназначены для тренировки иммунитета. Таким полезным эффектом наделены следующие медикаментозные средства: Анаферон, ИРС-19, Имудон и Биостим, Арбидол и Амиксин, Рибомунил. Наибольшая польза от них наблюдается в момент вакцинации. Правильное применение укрепляет местный, общий иммунитет. Именно поэтому препараты нужны при ОРВИ, синусите, фарингите.
- подарки природы. Натуральными средствами для повышения защитной функции считаются: лимонник и солодка, женьшень, эхинацея. Пить подобные настои, отвары нужно с профилактической, лечебной целью. Таким образом, иммунная система играет решающую роль в жизни каждого человека. В случае ее ослабления, важно своевременно начать правильное лечение.
Будьте здоровы!
F11 Аллерген гречи — ОВУМ – медицинская лаборатория в Кемерοво
Описание
Аллергия — это чрезмерная иммунная реакция организма, направленная против веществ из окружающей среды (экзогенных веществ, аллергенов), которые преодолели защитные барьеры организма.
Около 25-30% населения промышленно-развитых стран имеют аллергические заболевания. Наиболее частыми аллергическими заболеваниями, встречающимися у 10-15% населения, являются аллергический ринит, аллергический дерматит, крапивница, бронхиальная астма. Аллергия на пищевые продукты регистрируется у 2% населения.
Причины развития аллергии у человека многообразны. К ним относятся: генетическая предрасположенность — повышенный риск развития аллергических заболеваний передается по наследству; ранний контакт с аллергенами — дети, вскормленные коровьим молоком или смесями в первые 6 месяцев жизни более подвержены аллергии; воздействие атмосферных загрязнений промышленных городов, выхлопных газов автомобилей, сигаретного дыма.
Аллергеном может быть любое вещество, содержащееся в окружающей среде.
При первичном контакте с аллергеном происходит сенсибилизация организма (повышение чувствительности). При этом может не быть проявлений болезни, но в организме запускаются иммунные реакции, приводящие к образованию антиген-специфических лимфоцитов и антител.
При повторном попадании в организм аллергена происходит развитие аллергической реакции со всеми клиническими проявлениями.
По классификации Европейской Академии Аллергологии и Клинической Иммунологии (EAACI) 2001г. различают 3 типа аллергических реакций:
I– гиперчувствительность немедленного типа, атопия. Данный тип реакций опосредуется антителами IgЕ, которые связаны с тучными клетками и базофилами. Во время аллергической реакции происходит высвобождение из тучных клеток и базофилов вазоактивных веществ: гистамина, лейкотриенов, простагландинов и тд., которые приводят к развитию признаков аллергии. Типичными проявлениями этого типа реакций являются аллергический ринит, крапивница, бронхиальная астма и анафилактический шок.
II- цитотоксичность, опосредованная антителами. Реакция возникает в результате взаимодействия антител класса IgG, реже IgМ с поверхностными антигенами и приводит к повреждению клеток. Этот тип реакций характерен для иммунных форм заболеваний крови.
III- «болезнь иммунных комплексов». Если появляются антитела к растворимым аллергенам, возникают иммунные комплексы в различных концентрациях. Такие аллергенспецифические иммунные комплексы вызывают повреждение тканей и сосудов. Типичными проявлениями этого типа реакций являются сывороточная болезнь, васкулиты, поражения кожи, почек и суставов.
Различные типы аллергических реакций не являются взаимоисключающими, различные механизмы могут действовать совместно, что может усложнять течение заболевания и его лечение.
Для диагностики аллергических заболеваний врачи аллергологи пользуются методами сбора истории заболевания, который включает семейный и личный анамнез, проводят медицинский осмотр, назначают аллергопробы (кожные и провокационные тесты) и лабораторные исследования.
Определяются аллергоспецифические IgЕ к моноаллергенам и смесям аллергенов.
Анализ проводится методом ИФА, для анализа берется кровь из вены.
Анализ определяет количество аллергена, что позволяет судить о выраженности аллергической реакции, оценить степень участия конкретного аллергена в развитии заболевания, выбрать адекватную терапию, оценивать эффект от лечения.
Исследование не предусматривает контакта пациента с аллергенами, не провоцирует развитие приступов аллергии, поэтому является безопасным.
Показания для назначения исследования:
Скрининг аллергии и выявление потенциальных аллергенов. Тесты на аллергоспецифическиеIgЕ могут применяться совместно с кожными и провокационными тестами, или заменить их, если есть противопоказания к проведению аллергопроб.
Перечень аллергенов для исследований очень широк, охватывает наиболее часто встречающиеся в нашем регионе аллергены:
— Эпидермальные аллергены и белки животного происхождения
— Аллергены домашней пыли
— Плесневые и дрожжевые аллергены
— Паразитарные аллергены
— Аллергены насекомых
— Пищевые аллергены
— Лекарственные аллергены
— Профессиональные аллергены
— Аллергены сорных трав
— Аллергены луговых трав
— Аллергены деревьев
— Смеси аллергенов
Референтные интервалы аллергоспецифичкеских IgЕ в сыворотке крови, МЕ/мл:
Верхняя граница нормы -0,50;
низкий уровень 0,51-1,0;
средний уровень 1,1-5,0;
высокий уровень 5,1-25,0;
очень высокий уровень 25,0-75,0;
исключительно высокий уровень более 75,0.
При повышенном уровне аллергоспецифических IgE существует высокий риск развития аллергических заболеваний.
Встречаются ситуации, когда уровень аллергоспецифических IgE высокий, а проявлений аллергии нет. Причиной такого состояния может быть скрытая сенсибилизация к какому-то аллергену.
В некоторых ситуация уровень IgE может быть низким, однако кожные пробы бывают положительными. Такая ситуация может объясняется тем, что аллергические антитела практически все находятся в тканях, или с момента обострения аллергии прошло какое-то время, при этом IgЕ уже вывелись из кровотока (период полувыведения IgЕ составляет 2-5 дней), а в тканях еще сохраняются (до 1 месяца).
Необходимо помнить, что правильно назначить необходимые обследования и интерпретировать анализы должен врач-аллерголог.
Правила подготовки
- Необходимо исключить факторы, влияющие на результаты исследований: физическую нагрузку (бег, подъем по лестнице, подъем тяжестей), тепловые процедуры (посещение бани, сауны), эмоциональное возбуждение.
- Перед забором крови следует отдохнуть 10-15 минут в приемной, успокоиться.
- Исключить прием алкоголя за 1-2 дня до исследования.
- За 1 час до исследования исключить курение.
- Кровь не следует сдавать после рентгенографии, физиотерапевтических воздействий, после проведения диагностических или лечебных процедур.
- Практически все анализы делают натощак. «Натощак» — это когда между последним приемом пищи и взятием крови проходит не менее 8 ч (желательно — не менее 12 ч). Можно только пить воду. Накануне исследования следует избегать пищевых перегрузок.
- При исследовании крови учитывают влияние принимаемых лекарственных препаратов. Если прием лекарственного средства обязателен и исследование проводится на фоне приема препарата, об этом необходимо делать отметку на направлении
Барьерная защита и врожденный иммунный ответ
Цели обучения
К концу этого раздела вы сможете:
- Описать барьерную защиту организма
- Покажите, насколько важен врожденный иммунный ответ и как он помогает направлять и готовить организм к адаптивным иммунным ответам
- Опишите различные растворимые факторы, которые являются частью врожденного иммунного ответа.
- Объясните этапы воспаления и то, как они приводят к уничтожению патогена
- Обсудить ранние индуцированные иммунные ответы и уровень их эффективности
Иммунная система может быть разделена на два перекрывающихся механизма уничтожения патогенов: врожденный иммунный ответ, который является относительно быстрым, но неспецифическим и, следовательно, не всегда эффективным, и адаптивный иммунный ответ, который развивается медленнее во время первоначального заражения вирусом. патоген, но он очень специфичен и эффективен в борьбе с широким спектром патогенов (см. рисунок 1).
Рис. 1. Врожденная иммунная система усиливает адаптивные иммунные реакции, поэтому они могут быть более эффективными.
Любое обсуждение врожденного иммунного ответа обычно начинается с физических барьеров, которые предотвращают проникновение патогенов в организм, уничтожают их после того, как они попадают, или вымывают их, прежде чем они смогут обосноваться в благоприятной среде мягких тканей тела. Барьерная защита является частью основных защитных механизмов организма. Барьерные защиты не являются ответом на инфекции, но они постоянно работают для защиты от широкого спектра патогенов.
Различные виды барьерной защиты связаны с внешними поверхностями тела, куда патогены могут пытаться проникнуть (см. Таблицу 1). Основным барьером для проникновения микроорганизмов в организм является кожа. Мало того, что кожа покрыта слоем мертвого ороговевшего эпителия, который слишком сухой для роста бактерий, но так как эти клетки постоянно отслаиваются от кожи, они переносят с собой бактерии и другие патогены. Кроме того, пот и другие кожные выделения могут снизить pH, содержать токсичные липиды и физически вымывать микробы.
| Таблица 1. Барьерная защита | ||
|---|---|---|
| Участок | Специальная защита | Защитный аспект |
| Кожа | Поверхность эпидермиса | Кератинизированные клетки поверхности, клетки Лангерганса |
| Кожа (пот / выделения) | Потовые, сальные железы | Низкий pH, моющее действие |
| Полость рта | Слюнные железы | Лизоцим |
| Желудок | Желудочно-кишечный тракт | Низкий pH |
| Поверхности слизистой оболочки | Эпителий слизистой | Некератинизированные эпителиальные клетки |
| Нормальная флора (непатогенные бактерии) | Ткани слизистой оболочки | Предотвратить рост болезнетворных микроорганизмов на слизистых оболочках |
Другой барьер — слюна во рту, которая богата лизоцимом — ферментом, который разрушает бактерии, переваривая их клеточные стенки.Кислая среда желудка, губительная для многих патогенов, также является препятствием. Кроме того, слизистый слой желудочно-кишечного тракта, дыхательных путей, репродуктивного тракта, глаз, ушей и носа задерживает как микробы, так и мусор, и облегчает их удаление. В случае верхних дыхательных путей мерцательные эпителиальные клетки перемещают потенциально загрязненную слизь вверх к рту, где она затем попадает в пищеварительный тракт, попадая в резкую кислую среду желудка.Учитывая, как часто вы дышите по сравнению с тем, как часто вы едите или выполняете другие действия, которые подвергают вас воздействию болезнетворных микроорганизмов, неудивительно, что несколько барьерных механизмов эволюционировали, чтобы работать согласованно, чтобы защитить эту жизненно важную область.
Клетки врожденного иммунного ответа
Фагоцит — это клетка, которая способна окружать и поглощать частицу или клетку; этот процесс называется фагоцитоз . Фагоциты иммунной системы поглощают другие частицы или клетки либо для очистки области от мусора, старых клеток, либо для уничтожения патогенных организмов, таких как бактерии.Фагоциты — это быстродействующая первая линия иммунологической защиты организма от организмов, которые нарушили защитные барьеры и проникли в уязвимые ткани организма.
Фагоциты: макрофаги и нейтрофилы
Многие клетки иммунной системы обладают фагоцитарной способностью, по крайней мере, в какой-то момент своего жизненного цикла. Фагоцитоз — важный и эффективный механизм уничтожения патогенов во время врожденных иммунных реакций. Фагоцит принимает организм внутрь себя как фагосома, которая впоследствии сливается с лизосомой и ее пищеварительными ферментами, эффективно убивая многие патогены.С другой стороны, некоторые бактерии, включая Mycobacteria tuberculosis , вызывающую туберкулез, могут быть устойчивыми к этим ферментам, и поэтому их гораздо труднее вывести из организма. Макрофаги, нейтрофилы и дендритные клетки являются основными фагоцитами иммунной системы.
Макрофаг — это фагоцит неправильной формы, который является амебоидным по своей природе и является наиболее универсальным из фагоцитов в организме. Макрофаги перемещаются по тканям и протискиваются сквозь стенки капилляров с помощью псевдоподий.Они не только участвуют в врожденных иммунных ответах, но также эволюционировали, чтобы сотрудничать с лимфоцитами как часть адаптивного иммунного ответа. Макрофаги существуют во многих тканях тела, свободно перемещаясь по соединительным тканям или прикрепляясь к ретикулярным волокнам в определенных тканях, таких как лимфатические узлы. Когда патогены нарушают защитные барьеры организма, макрофаги являются первой линией защиты. В зависимости от ткани они называются по-разному: клетки Купфера в печени, гистиоциты в соединительной ткани и альвеолярные макрофаги в легких.
Нейтрофил представляет собой фагоцитарную клетку, которая посредством хемотаксиса привлекается из кровотока в инфицированные ткани. Эти сферические клетки являются гранулоцитами. Гранулоцит содержит цитоплазматические гранулы, которые, в свою очередь, содержат множество вазоактивных медиаторов, таких как гистамин. Напротив, макрофаги — это агранулоциты. В агранулоците мало или совсем нет цитоплазматических гранул. В то время как макрофаги действуют как часовые, всегда охраняющие от инфекции, нейтрофилы можно рассматривать как военное подкрепление, которое вызывается в битву, чтобы ускорить уничтожение врага.Хотя, как правило, они считаются основной клеткой, убивающей патогены воспалительного процесса врожденного иммунного ответа, новое исследование показало, что нейтрофилы также играют роль в адаптивном иммунном ответе, как и макрофаги.
Моноцит — это циркулирующая клетка-предшественник, которая дифференцируется в макрофаги или дендритные клетки, которые могут быстро привлекаться к участкам инфекции сигнальными молекулами воспаления.
| Таблица 2.Фагоцитарные клетки врожденной иммунной системы | |||
|---|---|---|---|
| Ячейка | Тип ячейки | Основное местонахождение | Функция врожденного иммунного ответа |
| Макрофаг | Агранулоцит | Полости тела / органы | Фагоцитоз |
| Нейтрофил | Гранулоцит | Кровь | Фагоцитоз |
| Моноцит | Агранулоцит | Кровь | Предшественник макрофагов / дендритных клеток |
Естественные клетки-киллеры
NK-клетки представляют собой тип лимфоцитов, которые обладают способностью вызывать апоптоз, то есть запрограммированную гибель клеток, в клетках, инфицированных внутриклеточными патогенами, такими как облигатные внутриклеточные бактерии и вирусы.NK-клетки распознают эти клетки с помощью механизмов, которые еще не совсем понятны, но которые предположительно включают их поверхностные рецепторы. NK-клетки могут вызывать апоптоз, при котором каскад событий внутри клетки вызывает ее собственную смерть одним из двух механизмов:
- NK-клетки способны реагировать на химические сигналы и экспрессировать fas-лиганд. Лиганд fas представляет собой поверхностную молекулу, которая связывается с молекулой fas на поверхности инфицированной клетки, посылая ей апоптотические сигналы, тем самым убивая клетку и патоген в ней
- Гранулы NK-клеток выделяют перфорины и гранзимы.Перфорин — это белок, который образует поры в мембранах инфицированных клеток. Гранзим представляет собой фермент, переваривающий белок, который проникает в клетку через поры перфорина и запускает внутриклеточный апоптоз.
Оба механизма особенно эффективны против инфицированных вирусом клеток. Если апоптоз индуцируется до того, как вирус будет способен синтезировать и собирать все свои компоненты, инфекционный вирус не выделяется из клетки, что предотвращает дальнейшее заражение.
Распознавание патогенов
Клетки врожденного иммунного ответа, фагоцитарные клетки и цитотоксические NK-клетки распознают паттерны патоген-специфичных молекул, таких как компоненты стенок бактериальных клеток или бактериальные жгутиковые белки, используя рецепторы распознавания паттернов. Рецептор распознавания образов (PRR) представляет собой мембранно-связанный рецептор, который распознает характерные особенности патогена и молекул, высвобождаемых стрессовыми или поврежденными клетками.
Эти рецепторы, которые, как считается, развились до адаптивного иммунного ответа, присутствуют на поверхности клетки независимо от того, нужны они или нет.Однако их разнообразие ограничено двумя факторами. Во-первых, тот факт, что каждый тип рецептора должен кодироваться определенным геном, требует, чтобы клетка распределяла большую часть или всю свою ДНК, чтобы рецепторы могли распознавать все патогены. Во-вторых, разнообразие рецепторов ограничено конечной площадью поверхности клеточной мембраны. Таким образом, врожденная иммунная система должна «обойтись», используя только ограниченное количество рецепторов, которые активны против как можно большего количества разнообразных патогенов. Эта стратегия резко контрастирует с подходом, используемым адаптивной иммунной системой, которая использует большое количество различных рецепторов, каждый из которых очень специфичен для определенного патогена.
Если клетки врожденной иммунной системы вступят в контакт с видом патогена, который они распознают, клетка свяжется с патогеном и инициирует фагоцитоз (или клеточный апоптоз в случае внутриклеточного патогена), пытаясь уничтожить микроб-злоумышленник. . Рецепторы несколько различаются в зависимости от типа клеток, но обычно они включают рецепторы для бактериальных компонентов и комплемента, обсуждаемые ниже.
Растворимые медиаторы врожденного иммунного ответа
В предыдущих обсуждениях упоминались химические сигналы, которые могут побуждать клетки к изменению различных физиологических характеристик, таких как экспрессия определенного рецептора.Эти растворимые факторы секретируются во время врожденных или ранних индуцированных ответов, а затем во время адаптивных иммунных ответов.
Цитокины и хемокины
Цитокин представляет собой сигнальную молекулу, которая позволяет клеткам общаться друг с другом на небольших расстояниях. Цитокины секретируются в межклеточное пространство, и действие цитокина побуждает принимающую клетку изменять свою физиологию. Хемокин представляет собой растворимый химический медиатор, подобный цитокинам, за исключением того, что его функция заключается в привлечении клеток (хемотаксис) с больших расстояний.
Практический вопрос
Посетите этот веб-сайт, чтобы узнать о хемотаксисе фагоцитов. Хемотаксис фагоцитов — это движение фагоцитов в соответствии с секрецией химических посредников в форме интерлейкинов и других хемокинов. Каким образом фагоцит уничтожает проглоченную бактерию?
Показать ответБактерия переваривается пищеварительными ферментами фагоцита (содержащимися в его лизосомах).
Ранние индуцированные белки
Ранние индуцированные белки — это белки, которые не присутствуют в организме конститутивно, но вырабатываются по мере необходимости на ранних этапах врожденного иммунного ответа. Интерфероны являются примером ранее индуцированных белков. Клетки, инфицированные вирусами, секретируют интерфероны, которые перемещаются в соседние клетки и побуждают их производить противовирусные белки. Таким образом, даже если исходная клетка принесена в жертву, окружающие клетки защищены. Другими ранее индуцированными белками, специфичными для компонентов бактериальной клеточной стенки, являются маннозосвязывающий белок и С-реактивный белок, вырабатываемый в печени, которые специфически связываются с полисахаридными компонентами бактериальной клеточной стенки.Фагоциты, такие как макрофаги, имеют рецепторы для этих белков, и поэтому они могут распознавать их, поскольку они связаны с бактериями. Это сближает фагоцит и бактерию и усиливает фагоцитоз бактерии с помощью процесса, известного как опсонизация. Опсонизация — это мечение возбудителя фагоцитоза путем связывания антитела или антимикробного белка.
Система дополнения
Система комплемента представляет собой серию белков, конститутивно обнаруживаемых в плазме крови.Таким образом, эти белки не считаются частью раннего индуцированного иммунного ответа , хотя они имеют общие черты с некоторыми антибактериальными белками этого класса. Вырабатываемые в печени, они выполняют множество функций при врожденном иммунном ответе, используя так называемый «альтернативный путь» активации комплемента. Кроме того, комплемент также участвует в адаптивном иммунном ответе, так называемом классическом пути. Система комплемента состоит из нескольких белков, которые ферментативно изменяют и фрагментируют более поздние белки в серии, поэтому ее называют каскадом.После активации серия реакций необратима и высвобождает фрагменты, которые имеют следующие действия:
- Связывается с клеточной мембраной возбудителя, который его активирует, маркируя его для фагоцитоза (опсонизации)
- Диффузируют от патогена и действуют как хемотаксические агенты, привлекающие фагоцитарные клетки к месту воспаления
- Образует повреждающие поры в плазматической мембране возбудителя
На рисунке 2 показан классический путь, требующий антител адаптивного иммунного ответа.Альтернативный путь не требует активации антител.
Рис. 2. Классический путь, используемый во время адаптивных иммунных ответов, происходит, когда C1 реагирует с антителами, связанными с антигеном.
Расщепление белка C3 является общим этапом для обоих путей. В альтернативном пути C3 активируется спонтанно и после реакции с молекулами фактора P, фактора B и фактора D расщепляется. Более крупный фрагмент, C3b, связывается с поверхностью патогена, а C3a, меньший фрагмент, диффундирует наружу от места активации и привлекает фагоциты к участку инфекции.Связанный с поверхностью C3b затем активирует остальную часть каскада, причем последние пять белков, C5 – C9, образуют комплекс атаки на мембрану (MAC). MAC может убивать определенные патогены, нарушая их осмотический баланс. MAC особенно эффективен против широкого спектра бактерий. Классический путь аналогичен, за исключением того, что на ранних стадиях активации требуется присутствие антитела, связанного с антигеном, и, таким образом, он зависит от адаптивного иммунного ответа. Более ранние фрагменты каскада также имеют важные функции.Фагоцитарные клетки, такие как макрофаги и нейтрофилы, привлекаются к месту инфекции за счет хемотаксического притяжения к более мелким фрагментам комплемента. Кроме того, как только они прибывают, их рецепторы для связанного с поверхностью C3b опсонизируют патоген для фагоцитоза и разрушения.
Воспалительный ответ
Отличительным признаком врожденного иммунного ответа является воспаление . Воспаление — это то, что испытывал каждый. Ударьте палец на ноге, порежьте палец или выполните какое-либо действие, которое вызывает повреждение тканей, что приведет к воспалению с его четырьмя характеристиками: жар, покраснение, боль и отек («потеря функции» иногда упоминается как пятая характеристика).Важно отметить, что воспаление не обязательно должно быть вызвано инфекцией, но также может быть вызвано повреждением тканей. Высвобождения поврежденного клеточного содержимого в место повреждения достаточно, чтобы стимулировать реакцию, даже при отсутствии разрывов в физических барьерах, которые могли бы позволить патогенам проникнуть (например, ударив молотком по большому пальцу). Воспалительная реакция приводит к попаданию фагоцитарных клеток в поврежденную область, чтобы очистить клеточный дебрис и подготовить почву для заживления ран (рис. 3).
Рисунок 3. Воспалительный процесс
Эта реакция также затрагивает клетки врожденной иммунной системы, позволяя им избавиться от источников возможной инфекции. Воспаление — это часть очень простой формы иммунного ответа. Процесс не только приводит к попаданию жидкости и клеток в участок, чтобы уничтожить патоген и удалить его и остатки с участка, но также помогает изолировать участок, ограничивая распространение патогена. Острое воспаление — это кратковременная воспалительная реакция на повреждение организма.Однако, если причина воспаления не устранена, это может привести к хроническому воспалению, которое связано с серьезным разрушением тканей и фиброзом. Хроническое воспаление — продолжающееся воспаление. Это может быть вызвано инородными телами, стойкими патогенами и аутоиммунными заболеваниями, такими как ревматоидный артрит.
Воспалительная реакция состоит из четырех важных частей:
- Травма ткани. Высвобожденное содержимое поврежденных клеток стимулирует высвобождение гранул тучных клеток, гранул и их мощных медиаторов воспаления, таких как гистамин, лейкотриены и простагландины. Гистамин увеличивает диаметр местных кровеносных сосудов (расширение сосудов), вызывая усиление кровотока. Гистамин также увеличивает проницаемость местных капилляров, вызывая утечку плазмы и образование межклеточной жидкости. Это вызывает отек, связанный с воспалением. Кроме того, поврежденные клетки, фагоциты и базофилы являются источниками медиаторов воспаления, включая простагландины и лейкотриены. Лейкотриены привлекают нейтрофилы из крови за счет хемотаксиса и увеличивают проницаемость сосудов.Простагландины вызывают расширение сосудов, расслабляя гладкие мышцы сосудов, и являются основной причиной боли, связанной с воспалением. Нестероидные противовоспалительные препараты, такие как аспирин и ибупрофен, снимают боль, подавляя выработку простагландинов.
- Расширение сосудов. Многие медиаторы воспаления, такие как гистамин, являются вазодилататорами, увеличивающими диаметр местных капилляров. Это вызывает усиление кровотока и вызывает жар и покраснение воспаленной ткани.Это обеспечивает больший доступ крови к месту воспаления.
- Повышенная проницаемость сосудов. В то же время медиаторы воспаления увеличивают проницаемость местной сосудистой сети, вызывая утечку жидкости в интерстициальное пространство, что приводит к отеку или отеку, связанному с воспалением.
- Набор фагоцитов. Лейкотриены особенно хороши в привлечении нейтрофилов из крови к месту инфекции путем хемотаксиса.После раннего инфильтрата нейтрофилов, стимулированного цитокинами макрофагов, большее количество макрофагов привлекается для очистки от мусора, оставшегося на участке. Когда местные инфекции являются серьезными, нейтрофилы в большом количестве привлекаются к участкам инфекции, и по мере того, как они фагоцитируют патогены и впоследствии умирают, их накопленные клеточные остатки видны в виде гноя на месте инфекции.
В целом воспаление ценно по многим причинам. Мало того, что болезнетворные микроорганизмы убиваются и удаляются обломки, но и увеличение проницаемости сосудов способствует проникновению факторов свертывания крови, что является первым шагом к заживлению ран.Воспаление также облегчает транспортировку антигена к лимфатическим узлам дендритными клетками для развития адаптивного иммунного ответа.
Обзор главы
Врожденные иммунные реакции имеют решающее значение для раннего контроля инфекций. В то время как барьерная защита является первой линией физической защиты организма от патогенов, врожденные иммунные реакции являются первой линией физиологической защиты. Врожденные ответы возникают быстро, но с меньшей специфичностью и эффективностью, чем адаптивный иммунный ответ.Врожденные ответы могут быть вызваны множеством клеток, медиаторов и антибактериальных белков, таких как комплемент. В течение первых нескольких дней заражения индуцируется еще одна серия антибактериальных белков, каждый из которых проявляет активность против определенных бактерий, включая опсонизацию определенных видов. Кроме того, индуцируются интерфероны, которые защищают клетки от вирусов, находящихся поблизости. Наконец, врожденный иммунный ответ не прекращается, когда развивается адаптивный иммунный ответ. Фактически, оба могут сотрудничать, и один может влиять на другого в их реакции против патогенов.
Самопроверка
Ответьте на вопросы ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе.
Вопросы о критическом мышлении
- Опишите процесс воспаления в области, которая была травмирована, но не инфицирована.
- Опишите два ранних индуцированных ответа и на какие патогены они влияют.
- Интерфероны продуцируются в инфицированных вирусами клетках и заставляют их секретировать сигналы для окружающих клеток, чтобы вырабатывать противовирусные белки.С-реактивный белок вырабатывается печенью и опсонизирует определенные виды бактерий.
- Клеточный мусор и поврежденные клетки побуждают макрофаги начать их очистку. Макрофаги выделяют цитокины, которые привлекают нейтрофилы, за которыми следуют еще макрофаги. Другие медиаторы, высвобождаемые тучными клетками, увеличивают приток крови к этой области, а также проницаемость сосудов, позволяя рекрутированным клеткам попасть из крови в место инфекции, где они могут фагоцитировать мертвые клетки и мусор, подготавливая место для заживления раны.
Глоссарий
острое воспаление: воспаление, возникающее в течение ограниченного периода времени; быстроразвивающийся
хемокин: растворимая, дальнодействующая молекула межклеточной коммуникации
хроническое воспаление: длительное воспаление
комплемент: ферментативный каскад конститутивных белков крови, обладающих антипатогенными эффектами, включая прямое уничтожение бактерий
цитокин: растворимая короткодействующая молекула межклеточной коммуникации
ранний индуцированный иммунный ответ: включает антимикробные белки, стимулированные в течение первых нескольких дней инфекции
fas лиганд: молекула, экспрессируемая на цитотоксических Т-клетках и NK-клетках, которая связывается с молекулой fas на клетке-мишени и индуцирует ее апоптоз
гранзим: Вещество, вызывающее апоптоз, содержащееся в гранулах NK-клеток и цитотоксических Т-клеток
гистамин: вазоактивный медиатор в гранулах тучных клеток и является основной причиной аллергии и анафилактического шока
воспаление: основной врожденный иммунный ответ, характеризующийся жаром, покраснением, болью и отеком
интерферонов: ранее индуцированных белков, вырабатываемых в инфицированных вирусами клетках, которые заставляют соседние клетки вырабатывать противовирусные белки
макрофаг: амебоидных фагоцитов, обнаруженных в нескольких тканях по всему телу
тучная клетка: клетка, обнаруженная в коже и слизистой оболочке клеток тела, которая содержит цитоплазматические гранулы с вазоактивными медиаторами, такими как гистамин
моноцит: предшественник макрофагов и дендритных клеток, обнаруженных в крови
нейтрофилов: фагоцитарных лейкоцитов, привлеченных из кровотока к месту инфекции через кровоток
опсонизация: усиление фагоцитоза за счет связывания антитела или антимикробного белка
рецептор распознавания образов (PRR): рецептор лейкоцитов, который связывается со специфическими компонентами клеточной стенки различных видов бактерий
перфорин: молекула в NK-клетках и цитотоксических Т-клеточных гранулах, которые образуют поры в мембране клетки-мишени
фагоцитоз: перемещение материала снаружи внутрь клеток через везикулы, образованные инвагинациями плазматической мембраны
Защиты от инфекций — Инфекции
Обычно кожа предотвращает проникновение микроорганизмов, если она не повреждена (например, в результате травмы, укуса насекомого или ожога).
Слизистые оболочки, , такие как слизистая оболочка рта, носа и век, также являются эффективными барьерами. Обычно слизистые оболочки покрыты секретами, борющимися с микроорганизмами. Например, слизистые оболочки глаз залиты слезами, которые содержат фермент лизоцим, который атакует бактерии и помогает защитить глаза от инфекции.
Дыхательные пути отфильтровывают частицы, присутствующие во вдыхаемом воздухе.Стенки носовых и дыхательных путей покрыты слизью. Микроорганизмы, находящиеся в воздухе, прилипают к слизи, которая откашливается или выходит из носа. Удаление слизи происходит за счет скоординированного удара по крошечным волосовидным выступам (ресничкам), выстилающим дыхательные пути. Реснички выводят слизь по дыхательным путям, от легких.
Пищеварительный тракт имеет ряд эффективных барьеров, включая желудочную кислоту, ферменты поджелудочной железы, желчь и кишечные выделения.Эти вещества могут убивать бактерии или препятствовать их размножению. Сокращения кишечника (перистальтика, при которой содержимое кишечника перемещается по пищеварительному тракту) и нормальное выделение клеток, выстилающих кишечник, помогают удалить вредные микроорганизмы.
Мочевыводящие пути также имеют несколько эффективных барьеров. Мочевой пузырь защищен уретрой — трубкой, по которой моча выводится из организма. У мужчин уретра достаточно длинная, чтобы бактерии редко могли пройти через нее и достичь мочевого пузыря, если только бактерии не попадают туда непреднамеренно с помощью катетеров или хирургических инструментов.У женщин уретра короче, что иногда позволяет внешним бактериям проникать в мочевой пузырь. У обоих полов, когда мочевой пузырь опорожняется, он вымывает все попавшие в него бактерии.
Влагалище обычно кислое. Кислотность влагалища предотвращает рост вредных бактерий и помогает поддерживать количество защитных бактерий.
иммунитет: неспецифическая защита | Infoplease
Неспецифическая защита включает физические и химические барьеры, воспалительную реакцию и интерфероны.Физические барьеры включают неповрежденную кожу и слизистые оболочки. Этим барьерам помогают различные противомикробные химические вещества в тканях и жидкостях. Примером такого вещества является лизоцим, фермент, присутствующий в слезах, который разрушает клеточные мембраны определенных бактерий.
Другой линией защиты является воспалительная реакция, при которой белые кровяные тельца, называемые моноцитами и гранулоцитами (например, базофилы и нейтрофилы), достигают поврежденной области. Базофилы выделяют гистамин, что приводит к усилению местного кровотока и повышенной проницаемости капилляров и позволяет фагоцитировать клетки, такие как нейтрофилы и моноциты (макрофаги), в эту область.Такая же реакция иногда приводит к лихорадке. Утечка фибриногена свертывающего белка и других веществ в поврежденную область приводит к блокированию ткани сгустками, которые ограждают поврежденную область, чтобы замедлить распространение бактерий или их токсинов.
Интерфероны — это белки, выделяемые зараженной вирусом клеткой, которые побуждают окружающие клетки производить ферменты, препятствующие репликации вируса. Они являются причиной того, что в большинстве случаев заражение одним вирусом предотвращает заражение вторым вирусом.
Невосприимчивость — это неспособность некоторых болезнетворных организмов расти в определенном виде хозяина. Невосприимчивость может быть вызвана такими условиями, как отсутствие определенных веществ роста, необходимых для заражающего микроорганизма, или температура тела, неподходящая для вторгающегося микроорганизма. Например, куры нечувствительны к сибирской язве, потому что бактерии не могут расти при температуре тела, нормальной для этого животного.
Колумбийская электронная энциклопедия, 6-е изд.Авторские права 2012, Columbia University Press. Все права защищены.
См. Другие статьи в энциклопедии по: Анатомия и физиология
20.4: Врожденная иммунная система — биология LibreTexts
Paper Cut
Это всего лишь бумажный порез, но разрыв на коже может обеспечить легкий путь патогенным микроорганизмам в ваше тело. Если бы бактерии проникли через разрез и заразили рану, ваша врожденная иммунная система быстро отреагировала бы головокружительным набором общих защитных механизмов.
Рисунок \ (\ PageIndex {1} \): PapercutСистема врожденного иммунитета — это часть иммунной системы человека, которая вызывает быстрые, но неспецифические реакции на патогены. Врожденные реакции носят общий характер, а не привязаны к конкретному патогену. На каждый встреченный патоген врожденная система реагирует одинаково. Хотя врожденная иммунная система обеспечивает немедленную и быструю защиту от патогенов, она не дает им длительного иммунитета.У большинства организмов врожденная иммунная система является доминирующей системой защиты хозяина. За исключением большинства позвоночных, включая человека, врожденная иммунная система является единственной системой защиты хозяина.
Врожденная иммунная система человека включает поверхностные барьеры, воспаление, систему комплемента и различные клеточные ответы. Поверхностные барьеры различных типов обычно удерживают большинство болезнетворных микроорганизмов вне организма. Если эти барьеры терпят неудачу, срабатывают другие врожденные защиты. Пусковым событием обычно является идентификация патогенов рецепторами распознавания образов на клетках врожденной иммунной системы.Эти рецепторы распознают молекулы, которые широко используются патогенами, но отличаются от молекул хозяина. В качестве альтернативы, другие врожденные защиты могут срабатывать, когда поврежденные, поврежденные или подвергнутые стрессу клетки посылают сигналы тревоги, многие из которых распознаются теми же рецепторами, что и те, которые распознают патогены.
Барьеры для патогенов
Первая линия защиты организма состоит из трех различных типов барьеров, которые удерживают большинство болезнетворных микроорганизмов вне тканей организма. Типы барьеров — это механические, химические и биологические барьеры.
Механические барьеры
Механические барьеры — первая линия защиты от патогенов, и они физически блокируют проникновение патогенов в организм. Кожа — самый важный механический барьер. Фактически, это самая важная защита, которую имеет тело. Внешний слой кожи, эпидермис, очень прочный, и патогенам очень трудно проникнуть через него. Он состоит из мертвых клеток, которые постоянно удаляются с поверхности тела. Это помогает удалить прилипшие к коже бактерии и другие инфекционные агенты.В эпидермисе также отсутствуют кровеносные сосуды и обычно не хватает влаги, поэтому он не является подходящей средой для большинства болезнетворных микроорганизмов. Волосы, которые являются дополнительным органом кожи, также помогают защищать от болезнетворных микроорганизмов. Волосы внутри носа могут задерживать в воздухе более крупные патогены и другие частицы, прежде чем они попадут в дыхательные пути дыхательной системы .
Слизистые оболочки обеспечивают механический барьер для патогенов и других частиц в отверстиях тела. Эти мембраны также выстилают дыхательные, желудочно-кишечные, мочевыводящие и репродуктивные тракты.Слизистые оболочки выделяют слизь, которая представляет собой слизистое и несколько липкое вещество, задерживающее болезнетворные микроорганизмы. Многие слизистые оболочки также имеют волосовидные реснички, которые сметают слизь и улавливают патогены к отверстиям тела, откуда их можно удалить. Когда вы чихаете или кашляете, слизь и болезнетворные микроорганизмы механически выбрасываются из носа и горла, как вы можете видеть на фотографии ниже. Другие механические защиты включают слезы, которые вымывают патогенные микроорганизмы из глаз, и мочу, которая вымывает болезнетворные микроорганизмы из мочевыводящих путей.
Рисунок \ (\ PageIndex {2} \): Чихание может изгнать множество патогенов из дыхательных путей. Вот почему вы всегда должны прикрывать рот и нос, когда чихаете.Химические барьеры
Химические барьеры также защищают от заражения патогенами. Они уничтожают болезнетворные микроорганизмы на внешней поверхности тела, в отверстиях тела и на внутренней подкладке тела. Пот, слизь, слезы, слюна и грудное молоко содержат антимикробные вещества, такие как фермент лизоцим, которые убивают патогены, особенно бактерии.Сальные железы в дерме кожи выделяют кислоты, которые образуют очень тонкую, слегка кислую пленку на поверхности кожи, которая действует как барьер для бактерий, вирусов и других потенциальных загрязнителей, которые могут проникнуть через кожу. Моча и выделения из влагалища также являются слишком кислыми для многих патогенных микроорганизмов. Сперма содержит цинк, который не переносится большинством патогенов, а также дефенсины, антимикробные белки, действующие в основном за счет разрушения мембран бактериальных клеток. В желудке желудочная кислота и пищеварительные ферменты, называемые протеазами, расщепляют белки, убивают большинство патогенов, попадающих в желудочно-кишечный тракт с пищей или водой.
Биологические барьеры
Биологические барьеры — это живые организмы, которые помогают защитить организм от патогенов. Триллионы безвредных бактерий обычно обитают на коже человека, в мочевых, репродуктивных и желудочно-кишечных трактах. Эти бактерии используют пищу и поверхностное пространство, что помогает предотвратить колонизацию организма болезнетворными бактериями. Некоторые из этих безвредных бактерий также выделяют вещества, которые изменяют условия окружающей среды, делая ее менее благоприятной для потенциально вредных бактерий.Например, они могут выделять токсины или изменять pH. Все эти эффекты безвредных бактерий снижают вероятность того, что патогенные микроорганизмы смогут достичь достаточного количества, чтобы вызвать болезнь.
Воспаление
Если патогенам удается преодолеть барьеры, защищающие организм, то срабатывает один из первых активных ответов врожденной иммунной системы. Этот ответ — воспаление. Основная функция воспаления — установить физический барьер против распространения инфекции.Он также устраняет первоначальную причину повреждения клеток, очищает мертвые клетки и ткани, поврежденные в результате первоначального повреждения и воспалительного процесса, и инициирует восстановление тканей. Воспаление часто является реакцией на инфекцию патогенными микроорганизмами, но есть и другие возможные причины, включая ожоги, обморожение и воздействие токсинов.
Признаки и симптомы воспаления включают покраснение, отек, тепло, боль и часто некоторую потерю функций. Эти симптомы вызваны усилением притока крови к инфицированной ткани и рядом других процессов, показанных на рисунке ниже.
Рисунок \ (\ PageIndex {3} \): этот рисунок показывает, что происходит во время воспалительной реакции.Воспаление вызывается химическими веществами, такими как цитокинов, и гистаминов, , которые высвобождаются поврежденными или инфицированными клетками или клетками иммунной системы, такими как макрофаги (описано на рисунке \ (\ PageIndex {5} \)) которые уже присутствуют в тканях. Эти химические вещества вызывают расширение капилляров и их протекание, увеличивая приток крови к инфицированной области и позволяя крови проникать в ткани.Разрушающие патогены лейкоциты и восстанавливающие ткани белки мигрируют в тканевые пространства из кровотока, чтобы атаковать патогены и восстанавливать их повреждения. Цитокины также способствуют хемотаксису, то есть миграции лейкоцитов к месту инфицирования, которые уничтожают патогены. Некоторые цитокины обладают противовирусным действием, например, прекращают синтез белка в клетках-хозяевах, которые необходимы вирусам для выживания и репликации.
Система дополнения
Система комплемента представляет собой сложный биохимический механизм, названный так из-за его способности «дополнять» уничтожение патогенов антителами, которые вырабатываются как часть адаптивного иммунного ответа.Система комплемента состоит из более чем двух десятков белков, которые обычно находятся в крови и синтезируются в печени. Белки обычно циркулируют как нефункциональные молекулы-предшественники до активации.
Как показано на рисунке \ (\ PageIndex {4} \), когда первый белок в серии комплемента активируется — обычно путем связывания антитела с антигеном на патогене — он запускает эффект домино. Каждый компонент выполняет свою очередь в точной цепочке шагов, известной как каскад дополнений.Конечный продукт представляет собой цилиндр, который пробивает дыру в клеточной мембране патогена. Это позволяет жидкостям и молекулам входить и выходить из клетки, которая разбухает и лопается.
Рисунок \ (\ PageIndex {4} \): Система комплемента — это каскад белков, который дополняет уничтожение клеток патогена антителами.Сотовые ответы
Клеточные реакции врожденной иммунной системы включают множество различных типов лейкоцитов. Многие из этих лейкоцитов циркулируют в крови и действуют как независимые одноклеточные организмы, выявляя и уничтожая патогены в организме человека-хозяина.Эти и другие иммунные клетки врожденной системы идентифицируют патогены или мусор, а затем помогают каким-то образом их устранить. Один из способов — фагоцитоз.
Фагоцитоз
Фагоцитоз — важная особенность врожденного иммунитета, который осуществляется клетками, классифицируемыми как фагоциты. В процессе фагоцитоза фагоциты поглощают и переваривают болезнетворные микроорганизмы или другие вредные частицы. Фагоциты обычно патрулируют организм в поисках патогенов, но они также могут быть вызваны в определенные места за счет высвобождения цитокинов при возникновении воспаления.Некоторые фагоциты постоянно находятся в определенных тканях.
Как показано на рисунке ниже, когда патоген, такой как бактерия, встречается с фагоцитом, фагоцит расширяет часть своей плазматической мембраны, оборачивая мембрану вокруг патогена до тех пор, пока он не окутается. Попав внутрь фагоцита, патоген оказывается заключенным во внутриклеточную везикулу, называемую фагосомой. Затем фагосома сливается с другой везикулой, называемой лизосомой, образуя фаголизосому. Пищеварительные ферменты и кислоты из лизосом убивают и переваривают патоген в фаголизосоме.Заключительным этапом фагоцитоза является выведение растворимого мусора из уничтоженного патогена посредством экзоцитоза.
Рисунок \ (\ PageIndex {5} \): Фагоцитоз — это многоступенчатый процесс, в котором патоген поглощается и переваривается иммунными клетками, называемыми фагоцитами.Лейкоциты
Типы лейкоцитов, которые убивают патогены путем фагоцитоза, включают нейтрофилы, макрофаги и дендритные клетки. Макрофаги и дендритные клетки являются производными моноцитов.
Рисунок \ (\ PageIndex {6} \): ЛейкоцитыНейтрофилы
Нейтрофилы — это лейкоциты, которые путешествуют по телу с кровью и обычно являются первыми иммунными клетками, которые достигают места инфекции.Они являются наиболее многочисленными типами фагоцитов и обычно составляют не менее половины всех циркулирующих лейкоцитов. Костный мозг нормального здорового взрослого человека производит более 100 миллиардов нейтрофилов в день. Во время острого воспаления каждый день может вырабатываться более чем в 10 раз больше нейтрофилов. Для борьбы с инфекциями необходимо много нейтрофилов, потому что после того, как нейтрофил фагоцитирует всего несколько патогенов, он обычно умирает.
Макрофаги
Макрофаги — это большие фагоцитарные лейкоциты, которые развиваются из моноцитов.Макрофаги проводят большую часть своего времени в интерстициальной жидкости тканей тела. Они являются наиболее эффективными фагоцитами и могут фагоцитировать значительное количество патогенов или других клеток. Макрофаги также являются универсальными клетками, которые производят широкий спектр химических веществ, включая ферменты, белки комплемента и цитокины, в дополнение к их фагоцитарному действию. Как фагоциты, макрофаги действуют как поглотители, которые очищают ткани от изношенных клеток и другого мусора, а также от патогенов. Кроме того, макрофаги действуют как антигенпрезентирующие клетки, активирующие адаптивную иммунную систему.(Чтобы узнать больше об антиген-презентирующих клетках, см. Концепцию адаптивной иммунной системы.)
Эозинофилы
Эозинофилы — нефагоцитарные лейкоциты, родственные нейтрофилам. Они специализируются на защите от паразитов. Они очень эффективны в уничтожении крупных паразитов, таких как черви, выделяя ряд высокотоксичных веществ при активации. Эозинофилы могут стать сверхактивными и вызвать аллергию или астму.
Базофилы
Базофилы — нефагоцитарные лейкоциты, которые также связаны с нейтрофилами.Они наименее многочисленны из всех лейкоцитов. Базофилы выделяют два типа химических веществ, которые помогают в защите организма: гистамины и гепарин. Гистамины отвечают за расширение кровеносных сосудов и увеличение их проницаемости при воспалении. Гепарин подавляет свертывание крови, а также способствует перемещению лейкоцитов в зону инфекции.
Дендритные клетки
Подобно макрофагам, дендритные клетки развиваются из моноцитов. Они находятся в тканях, контактирующих с внешней средой, поэтому расположены в основном в коже, носу, легких, желудке и кишечнике.Помимо поглощения и переваривания патогенов, дендритные клетки также действуют как антигенпрезентирующие клетки, запускающие адаптивные иммунные ответы.
Рисунок \ (\ PageIndex {7} \): дендритная клеткаТучные клетки
Тучные клетки — это нефагоцитарные лейкоциты, которые помогают инициировать воспаление, секретируя гистамины. У некоторых людей гистамины вызывают аллергические реакции, а также воспаление. Тучные клетки также могут выделять химические вещества, которые помогают защищаться от паразитов.
Естественные клетки-киллеры
Естественные клетки-киллеры входят в состав лейкоцитов, называемых лимфоцитами, которые вырабатываются лимфатической системой.Естественные клетки-киллеры уничтожают раковые или инфицированные вирусом клетки-хозяева, хотя они не атакуют напрямую вторгшиеся патогены. Естественные клетки-киллеры распознают эти клетки-хозяева по состоянию, которое они проявляют, под названием «потеря себя». Клетки с отсутствующим «я» имеют аномально низкие уровни белков клеточной поверхности главного комплекса гистосовместимости (MHC), которые обычно идентифицируют клетки тела как «я».
Врожденное уклонение от иммунитета
Многие патогены развили механизмы, которые позволяют им уклоняться от врожденной иммунной системы человека-хозяина.Некоторые из этих механизмов включают:
- вторгаются в клетки-хозяева для репликации, поэтому они «скрыты» от иммунной системы. Бактерия, вызывающая туберкулез, использует этот механизм.
- образует вокруг себя защитную капсулу, чтобы избежать разрушения клетками иммунной системы. Эта защита возникает у бактерий, таких как виды Salmonella .
- имитирует клетки-хозяева, поэтому иммунная система не распознает их как чужеродные. Некоторые виды бактерий Staphylococcus используют этот механизм.
- напрямую убивает фагоциты. Эта способность эволюционировала у нескольких видов бактерий, включая виды, вызывающие сибирскую язву.
- продуцирует молекулы, которые предотвращают образование интерферонов, которые представляют собой иммунные химические вещества, борющиеся с вирусами. Некоторые вирусы гриппа обладают такой способностью.
- образует сложные биопленки, обеспечивающие защиту клеток и белков иммунной системы. Эта способность характерна для некоторых видов бактерий и грибов. Вы можете увидеть пример бактериальной биопленки на зубах на рисунке ниже.
Сводка
- Врожденная иммунная система — это часть иммунной системы человека, которая вызывает быстрые, но неспецифические реакции на патогены.В отличие от адаптивной иммунной системы, врожденная система не дает иммунитета. Врожденная иммунная система включает поверхностные барьеры, воспаление, систему комплемента и различные клеточные реакции.
- Первая линия защиты организма состоит из трех различных типов барьеров, которые удерживают большинство болезнетворных микроорганизмов вне тканей организма. Типы барьеров — это механические, химические и биологические барьеры.
- Механические барьеры, в том числе кожа, слизистые оболочки и жидкости, такие как слезы и моча, физически блокируют проникновение патогенов в организм.Химические барьеры, такие как ферменты пота, слюны и спермы, убивают патогены на поверхностях тела. Биологические барьеры — это безвредные бактерии, которые потребляют пищу и пространство, поэтому патогенные бактерии не могут колонизировать организм.
- Если патогены нарушают защитные барьеры, возникает воспаление. Это создает физический барьер против распространения инфекции и восстанавливает повреждения тканей. Воспаление вызывается химическими веществами, такими как цитокины и гистамины, и вызывает отек, покраснение и тепло.
- Система комплемента — это сложный биохимический механизм, который помогает антителам убивать патогены. После активации система комплемента состоит из более чем двух десятков белков, которые приводят к разрушению клеточной мембраны патогенов и разрыву клеток.
- В клеточных ответах системы врожденного иммунитета участвуют различные типы лейкоцитов. Например, нейтрофилы, макрофаги и дендритные клетки фагоцитируют патогены. Базофилы и тучные клетки выделяют химические вещества, вызывающие воспаление.Естественные клетки-киллеры уничтожают раковые или инфицированные вирусом клетки, а эозинофилы убивают паразитов.
- Многие патогены развили механизмы, которые помогают им уклоняться от врожденной иммунной системы. Например, некоторые патогены образуют вокруг себя защитную капсулу, а некоторые имитируют клетки-хозяева, поэтому иммунная система не распознает их как чужеродные.
Обзор
- Что такое врожденная иммунная система?
- Определите первую линию защиты тела.
- Определите и приведите примеры механических и химических барьеров врожденной иммунной системы.
- Что такое биологические барьеры и как они защищают организм?
- Укажите цели воспаления.
- Что вызывает воспаление и какие признаки и симптомы оно вызывает?
- Определите систему дополнения. Как это помогает уничтожить болезнетворные микроорганизмы?
- Перечислите шесть различных типов лейкоцитов и укажите их роль в врожденных иммунных реакциях.
- Опишите два способа, которыми патогены могут ускользать от врожденной иммунной системы.
- Объясните, как слизь может способствовать иммунной системе как механический и химический барьер.
- Какой тип клеток иммунной системы может одновременно фагоцитировать патогены и производить химические вещества, способствующие воспалению?
A. Макрофаги
B. Естественные клетки-киллеры
C. Базофилы
D. Тучные клетки
Каким образом фагоциты могут встречаться с патогенами в организме?
Опишите два различных способа участия ферментов во врожденном иммунном ответе.
Верно или неверно. Белки комплемента могут продуцироваться макрофагами.
Верно или неверно. Основная функция воспаления — секретирование белков репарации в месте повреждения.
Узнать больше
Посмотрите это видео, чтобы узнать больше о неспецифическом врожденном иммунитете:
Посмотрите это видео, чтобы узнать о простых способах мытья рук:
Атрибуции
- Oww Papercut Лоуренс Фэкун (Flickr), CC BY 2.0, через Wikimedia Commons
- «Чихание» Джеймса Гатани; Идентификатор библиотеки изображений общественного здравоохранения CDC 11162, общественное достояние через Wikimedia Commons
- Воспалительный ответ OpenStax, CC BY 3.0
- Путь дополнения Оригинальная работа федерального правительства США, общественное достояние через Wikimedia Commons
- Фагоцитоз по OpenStax, CC BY 3.0
- Leukocytes от Suzanne Wakim по лицензии CC BY 4.0, адаптированной из:
- S8-дендритные клетки, тянущие конидии в коллагене Джудит Бенсен, Приянка Наранг, Майк Хазенберг, Франк Гунзер, Урсула Билитовски, Нина Клиппель, Манфред Роде, Матиас Брок, Аксель А.Брэхэдж, Маттиас Гунцер, CC BY 2.5 через wikimedia.org
- Гингивит до и после по DRosenbach, CC BY 3.0 через Wikimedia Commons
- Текст адаптирован из Human Biology по лицензии CK-12 CC BY-NC 3.0
Кожа и слизистые оболочки, противомикробные химические вещества, естественные клетки-киллеры, фагоцитоз, воспаление и лихорадка
НЕОБХОДИМЫЕ ЗАЩИТЫ: кожа и слизистые оболочки, противомикробные химические вещества, естественные клетки-киллеры, фагоцитоз, воспаление и лихорадка НЕТ СПЕЦИАЛЬНЫЕ ЗАЩИТЫ : Кожа и слизистые оболочки, противомикробные химические вещества, естественные клетки-киллеры, фагоцитоз, воспаление и лихорадкаI Поверхностные мембранные барьеры — кожа и слизистые оболочки
А.Кожа (эпидермис)Б. Мембраны выделяют защитные химические вещества 1. Вагинальные выделения.1. Кератин сопротивляется физическим нагрузкам, стойкий к слабым кислотам и основаниям
2. «Кислотная мантия» pH 3-5
2. Соляная кислота в желудке.
3. Слюна и слезная жидкость содержат лизоцим, бактерии. разрушающий фермент
4. Слизистая — липкая ловушка для микроорганизмовII. Сотовая и химическая A. Фагоциты — поглощают частицы, но иногда этого не достаточно. Иногда они также выделяют химические вещества, чтобы разрушить клетки, которые они собираются фагоцитировать.2 основных типа 1. Макрофаги
2. Нейтрофилы B. Естественные клетки-киллеры — тип лимфоцитов (WBC) 1. содержится в крови и лимфе
2. убить раковые клетки и клетки, инфицированные вирусом
3. неспецифический
4. нефагоцитарный C. Воспаление — предотвращает распространение повреждающих агентов. Удаляет остатки клеток и болезнетворные микроорганизмы. Готова к ремонту. Четыре кардинала Признаки: покраснение, жар, отек, боль 1. Расширение сосудов и повышение проницаемости сосудов. а. Воспалительные химические вещества из поврежденных клеток способствовать расширению сосудов.это приводит к покраснению и жару
г. Эти химические вещества также вызывают появление местных капилляров. для утечки жидкостей (в т.ч. vasc. perm) 1.) Жидкости содержат факторы свертывания и антитела.
2.) Этот «экссудат» вызывает отек (опухоль) а.) Разбавляет вредные вещества
b.) Приносит O2 и питательные вещества
c.) Белки свертывания окружают site2. Мобилизация фагоцитов — вскоре после воспаления начинается. Воспалительные химические вещества привлекают различные фогцитарные клетки к площадь.D. Антимикробные белки — комплемент и интерферон 1.Система комплемента. 20 белков плазмы. Его Основной механизм разрушения чужеродных клеток
2. Интерферон. куча неспецифических противовирусных белки. Лихорадка — системная реакция (то есть случается по всему вашему телу) 1. Преимущества: а. увеличить скорость метаболизма клеток, ускоряя ремонт
г. печень и селезенка необходимы секвестру железа и цинка бактериями 2. Недостаток: высокотемпературные денатурирующие белки (ферменты). ИММУНИТЕТ — два типа: гуморальный иммунитет, или иммунитет, опосредованный антителами, и иммунитет, опосредованный клетками
И.Антигены — вещества, провоцирующие иммунную отклик
II. Гуморальный иммунный ответ
A. Клональный отбор и дифференцировка B-клеток 1. B-клетки активируются, когда антиген связывается с его поверхность2. В-клетки быстро растут и размножаются (все идентичны = клон) а.) Большинство клеток превращаются в плазматические клетки. антитела, которые связываются с этим антигеном, маркируя его для разрушения
b.) Некоторые клонированные клетки становятся готовыми к ячейкам памяти действовать быстро в случае повторного разоблачения B. Иммунологическая память 1.«Первичный ответ» — имеет задержку 3-6 дней, пиковые уровни антител в плазме примерно через 10 дней
2. Повторное воздействие приводит к «вторичной реакции» На 2-3 дня уровень антител в крови даже выше, чем в начальной школе. Оставайся на высоте недели в месяцы
3. Это похоже на то, что происходит с Т-клетками. тоже. Активный и пассивный гуморальный иммунитет 1. Активные — антитела, вырабатываемые после воздействия. к антигену а. естественно
г. искусственно 2. Пассивные — антитела поступают из сыворотки иммунного индивидуальный (не всегда человек) а.немедленная защита
г. кратковременная защита
г. мать / плод D. Антитела — также известные как «Ig» (для иммуноглобулинов). Секретируется плазматическими клетками или активированными B-клетками 1. Базовая структура — а. «вариабельная» область — сайт связывания антигена
г. «постоянная» область (стебель) — определяет клетки и химические вещества, с которыми может связываться антитело, и как этот класс антител будет работать 2. Мишени и функции антител. Антиген-антитело комплекс является первой частью 4 различных защитных механизмов.а. нейтрализация — антитела блокируют сайты на вирусы или экзотоксины (бактериальные токсины), тогда они не могут связываться клеткам ткани и причинить им вред.
г. фиксация и активация комплемента — основная защита от клеточных антигенов. После связывания антител к антигену изменяется область C, открывая сайты связывания комплемента. Это способствует фиксации комплемента и последующему лизису клетки.
г. антитела могут связываться более чем с одним антигенным определитель. Это может привести к слиянию многих иностранных клетки.Эта агглютинация похожа на
г. осадков , только осадки когда молекулы (в отличие от клеток) собираются вместе. В обоих случаях агглютинации и осаждения, сгустки легче фагоцитируются. IV клеточный иммунитет Ответ.
Некоторые патогены размножаются внутри ваших клеток, в В этом случае антитела неэффективны (в отличие от четырех шагов выше). Клеточно-опосредованный иммунный ответ начинается с активации небольшого количества Т-клеток определенным антигеном.После активации Т-клетки могут подвергаться пролиферация и дифференцировка в клон эффекторных клеток, распознающих того же антигена и выполняют некоторые аспекты иммунной атаки.
3 основные популяции Т-клеток
цитотоксических Т-клеток (эффекторные клетки для уничтожения)Т-хелперы (регуляторные клетки)
Супрессорные Т-клетки (регуляторные клетки)
Т-клетки не распознают свободные антигены. Только они распознают и реагируют на обработанные фрагменты белка на собственном теле клетки.Таким образом они атакуют поврежденные клетки. Следовательно, один из первых Мы рассмотрим распознавание антигена. А. Клональный отбор и дифференциация Т-клеток 1. Распознавание антигена. Т-клетки ищут двоих вещи вне клетки: «я» и «не-я» до того, как они начнут действовать. Они обнаружены в «MHC», белки сигнализируют клеткам иммунной системы, которые инфекционные организмы прячутся внутри клеток. а) Белки MHC содержат кусочки антигенаб) у них тоже есть какое-то «я», которое необходимо для активации Т-клеток 2.Активация Т-клеток. Рецепторы Т-клеточного антигена (аналогично B-клеточным рецепторам) связываются с белковым комплексом антиген-MHC. В большинстве случаев для того, чтобы Т-клетки смогли сформировать клоны, требуется «костимулятор». Т-клетки увеличиваются и размножаются. Многие клоны становятся ячейками памяти. Конкретные роли Т-клеток 1. Хелперные Т-клетки: стимулируют пролиферацию другие Т-клетки а. без них нет иммунной системы
г. большинство антигенов не могут запускать В-клетки без хелперные Т-клетки
г. они выделяют химические вещества, которые усиливают неспецифические защита 2.Цитотоксические Т-клетки: атакуют и убивают других. клетки а. связывается с клеткой-мишенью, вводит цитотоксические химические вещества
г. выпускает и движется дальше, в поисках большего количества антигена-MHC комплексы3. Супрессорные Т-клетки: подавляют активность Т-клеток. и B-клетки. Полезно, когда антиген уничтожен.
физических барьеров тела животного — иммунная система
Физические барьеры на поверхности тела играют решающую роль в замедлении или блокировании вторжения микробов. Очень немногие микроорганизмы могут проникнуть через неповрежденную кожу; вместо этого захватчики обычно проникают через раны или инъекции, такие как укусы комаров.Раны на коже быстро заживают, восстанавливая защитный барьер. Сложная микробиота кожи, как правило, исключает новых захватчиков, в то время как противомикробные молекулы в поту убивают многих потенциальных захватчиков.
В дыхательных путях структура верхних дыхательных путей служит эффективным фильтром мелких частиц. Сами дыхательные пути выстланы слоем липкой слизи, которая может задерживать частицы. Слизь также содержит антимикробные белки, такие как дефенсины, лизоцим и поверхностно-активные вещества.«Грязная» слизь постоянно заменяется чистым материалом, поскольку цилиарная активность переносит ее в глотку, где она проглатывается. Кашель и чихание удаляют более крупные раздражители из дыхательных путей и носовых ходов и являются важными защитными реакциями.
Защита кишечника в значительной степени зависит от наличия огромной сложной комменсальной микробиоты. Если ничего не помогает, захватчики могут быть быстро удалены из желудочно-кишечного тракта с помощью рвоты и диареи.
Кишечная микробиота играет ключевую роль в поддержании здоровья животных.Во-первых, это источник питательных веществ, особенно у травоядных, где он обеспечивает средства использования диеты, богатой целлюлозой, и источник необходимых витаминов. Эта микробиота также играет важную роль в защите организма. Большая, хорошо адаптированная микробная популяция исключает многие потенциальные патогены посредством конкуренции. Что еще более важно, постоянный стимул, обеспечиваемый присутствием этих организмов, стимулирует развитие адаптивной иммунной системы и регулирует интенсивность воспаления, опосредованного врожденной иммунной системой.
Для дополнительной информации
Также смотрите информацию о здоровье домашних животных, касающуюся физических барьеров иммунной системы у собак, кошек и лошадей.
Защитный барьер от бактерий, вирусов и грибков
Образец цитирования: Coates M, Blanchard S, MacLeod AS (2018) Врожденный противомикробный иммунитет кожи: защитный барьер против бактерий, вирусов и грибков.PLoS Pathog 14 (12): e1007353. https://doi.org/10.1371/journal.ppat.1007353
Редактор: Дебора А. Хоган, Медицинская школа Гейзеля в Дартмуте, США
Опубликовано: 6 декабря 2018 г.
Авторские права: © 2018 Coates et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Раскрытие финансовой информации: ASM поддерживается R01AI139207 01, получает финансирование из исследовательского гранта фонда дерматологии и премии Duke Physician-Scientist Strong Start Award. ASM также получила исследовательскую поддержку для отдельного проекта, не имеющего отношения к теме этой обзорной статьи, от Silab и теперь консультирует эту компанию. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Я прочитал политику журнала и имею следующие конфликты: ASM получило исследовательскую поддержку от Silab и теперь консультирует эту компанию.
Врожденный иммунитет — важная защита от патогенов.
Эпидермис, внешний слой кожи, является физическим барьером против патогенов. Однако нарушение кожного барьера через рану приводит к попаданию множества микробов в место раны. При нарушении эпидермального барьера врожденная иммунная система и ее эффекторы играют ключевую роль в защите человека от кожных и системных инфекций [1]. Основные составляющие врожденной иммунной системы включают фагоцитарные клетки, такие как макрофаги, нейтрофилы и дендритные клетки, а также врожденные лейкоциты, такие как естественные киллеры (NK), тучные клетки, базофилы и эозинофилы.Кроме того, эпидермальные кератиноциты действуют как активные клетки врожденного иммунитета. В ответ на распознавание патоген-ассоциированных молекулярных паттернов (PAMP), экспрессируемых микробами и опасными молекулами хозяина, врожденные иммунные рецепторы, присутствующие на кератиноцитах, активируются, вызывая высвобождение воспалительных цитокинов и антимикробных молекул хозяина [2, 3].
Распознавание патогенов
Первым шагом любого иммунного ответа является распознавание потенциальных патогенов. Рецепторы распознавания образов, кодируемые зародышевой линией (PRR) распознают PAMP, присутствующие на микробах, и связанные с повреждениями молекулярные структуры (DAMP) на клетках-хозяевах (Рис. 1) [4].Четыре основные группы PRR человека — это толл-подобные рецепторы (TLR), нуклеотид-связывающие рецепторы, подобные домену олигомеризации (NLR), рецепторы геликазы, индуцируемые ретиноевой кислотой, ген 1 (RIG-I) и c-тип. лектиновые рецепторы (CLR) [4]. Давно известно, что передача сигналов через PRR важна для активации врожденного иммунного ответа. Например, стимуляция TLR2 увеличивает иммунный ответ на патогены и помогает спасти воспалительный ответ у пациентов с ослабленным иммунитетом и сепсисом [5].Хотя PRR не так специфичны, как иммунные эффекторы адаптивной иммунной системы, разные PRR эволюционировали для распознавания различных молекулярных паттернов [6]. Например, TLR2, TLR6 и нуклеотид-связывающий домен олигомеризации 2 (NOD2), по-видимому, играют важную роль в защите хозяина от золотистого стафилококка, тогда как TLR 2, 3, 7, 8 и 9 оказались активируется многими вирусами, в том числе членами герпесвирусов, папилломавирусов и поксвирусов [7, 8]. CLR и TLR 2, 4 и 9 считаются первичными рецепторами, участвующими в распознавании грибковых патогенов, таких как Candida albicans , и есть сообщения о специфических дефицитах PRR у пациентов с хроническими кожно-слизистыми инфекциями [9, 10].
Рис. 1. Антимикробные и противовирусные сигналы в коже.
* Повреждение кожи позволяет патогенным бактериям и вирусам проникать в эпидермис. PAMP и DAMP распознаются TLR, которые вызывают проекцию провоспалительных цитокинов дендритными клетками. Примеры провоспалительных цитокинов включают IL-1β, TNFα и IFNγ. Воспалительные цитокины привлекают нейтрофилы и макрофаги к месту повреждения и способствуют выработке AMP этими воспалительными клетками, а также кератиноцитами.Производимые AMP включают кателицидины (LL-37) и дефенсины (hBD2). Некоторые TLR, такие как TLR3, распознают вирусные компоненты. IL-27 продуцируется в ответ на активацию TLR3 и индуцирует трансляцию антивирусных ISG, таких как OAS2, кератиноцитами. AMP и ISG являются важными эффекторными молекулами для защиты от патогенов и заживления кожи. Комменсальные бактерии, такие как Staphylococcus epidermidis , способствуют выработке АМФ. Патогенные бактерии, такие как S . aureus , подавляют продукцию AMP; патогенные вирусы, такие как HSV, подавляют продукцию ISG.* Создано с помощью BioRender. AMP, антимикробный белок; DAMP, молекулярная структура, связанная с повреждениями; hBD2, человеческий β-дефенсин-2; HSV, вирус простого герпеса; ИЛ, интерлейкин; IFN, интерферон; ISG, ген, стимулированный интерфероном; OAS, олигоаденилатсинтетаза; PAMP, молекулярный паттерн, связанный с патогенами; TLR, толл-подобный рецептор; TNF, фактор некроза опухоли.
https://doi.org/10.1371/journal.ppat.1007353.g001
Воспалительный каскад
Активация PRR приводит к инициированию воспалительного каскада.Вскоре после гемостаза молекулы адгезии экспрессируются в ответ на провоспалительные цитокины, такие как интерлейкин-1β (IL-1β), фактор некроза опухоли-α (TNF-α) и интерферон-γ (IFNγ) [11]. Полиморфные нейтрофилы рекрутируются хемокинами CXC, содержащими мотивы аспарагин-лейцин-аргинин (ELR), такие как IL-8, которые мигрируют через стенки капилляров и взаимодействуют с молекулами адгезии [12]. Нейтрофилы начинают фагоцитоз патогенов и очищают ткани. Позднее во время воспалительного каскада макрофаги являются преобладающим типом иммунных клеток.Макрофаги провоспалительного фенотипа (M1) продолжают фагоцитоз, а также усиливают воспалительный ответ. Противовоспалительные цитокины, такие как трансформирующий фактор роста β (TGFβ), заставляют воспалительные макрофаги M1 переходить в противовоспалительный фенотип (M2), что способствует заживлению и закрытию ран [12].
Эндогенные антибактериальные и противовирусные белки помогают врожденной иммунной системе бороться с патогенными организмами.
Антимикробные белки (AMP) вырабатываются кератиноцитами, проникающими иммунными клетками и кожными комменсальными организмами и обеспечивают защиту кожи, подобную антибиотикам.AMP обладают прямым бактерицидным действием за счет лизиса клеток, причем предпочтение отдается мембранам прокариотических клеток [13]. Другие противомикробные механизмы включают ингибирование бактериального белка и синтеза ДНК. Противогрибковый механизм действия АМП заключается в разрушении митохондриальной мембраны грибов [13]. Два семейства AMP, кателицидины и дефенсины, иллюстрируют мощную активность этих белков. Кателицидины и дефенсины обеспечивают защиту широкого спектра действия от грамположительных и грамотрицательных бактерий [14].Например, кателицидин человека LL-37 обладает мощной прямой антибактериальной активностью против бактерий, таких как стрептококк группы A (GAS), а мыши с дефицитом кателицидинов, как было показано, имеют более высокую восприимчивость к инфекции GAS [15]. Сниженная экспрессия человеческого кателицидина LL-37 и человеческого β-дефенсина-2 (hBD-2) в поражениях атопического дерматита по сравнению с усиленной экспрессией при псориатических поражениях может помочь объяснить повышенную восприимчивость к вторичной бактериальной инфекции, которая наблюдается у пациентов с атопическим дерматитом. дерматит, но не псориаз [16].Некоторые дефенсины, включая hBD1, конститутивно экспрессируются в эпителиальных клетках [14], тогда как другие, такие как hBD2, конститутивно экспрессируются на очень низких уровнях с резким увеличением их продукции во время воспаления [17]. Один AMP, дермцидин, выделяется потовыми железами и проявляет широкую антимикробную активность, демонстрируя роль пота в защите от микробов [18]. Помимо прямой активности против патогенов, AMP также обладают иммуномодулирующей активностью. Например, LL-37 индуцирует хемотаксис нейтрофилов, моноцитов, тучных клеток и Т-клеток.Также отмечается, что уровни LL-37 значительно ниже в хронических язвах, чем в ранах, которые подвергаются нормальному заживлению, что подчеркивает важность этого AMP в заживлении ран, помимо врожденного иммунитета [19]. hBD2 проявляет хемокиноподобную активность по привлечению дендритных клеток и Т-клеток памяти, а также способствует высвобождению гистамина тучными клетками [14]. Наконец, регенерирующий островковый белок 3A (REG3A), AMP, присутствующий в кишечнике, а также в коже, способствует пролиферации кератиноцитов, предполагая роль AMP в заживлении ран, а также в противомикробной защите [20].
PRR также распознают вирусные компоненты, что приводит к транскрипции генов, стимулированных антивирусным интерфероном (ISG). Одним из примеров ISG является олигоаденилатсинтетаза (OAS). OAS идентифицирует вирусы посредством связывания вирусной двухцепочечной РНК (дцРНК) и активации внутриклеточной латентной РНКазы (РНКазы L), что приводит к деградации вирусной РНК [21]. Белки OAS также функционируют посредством независимого от РНКазы L механизма, в котором белки, которые высвобождаются из инфицированных вирусом клеток, действуют внеклеточно как противовирусный агент посредством паракринной передачи сигналов [22].Недавние открытия подчеркнули важность передачи сигналов IL-27 в заживлении ран и ответах ISG [23]. После стимуляции рекомбинантным IL-27 происходит сильная активация ISG в кератиноцитах эпидермиса, и было обнаружено, что у мышей, лишенных рецептора IL-27, заживление ран замедляется.
Как патогенные микробы противодействуют иммунной защите
Золотистый стафилококк является наиболее частой причиной бактериальных кожных инфекций. Механизмы, с помощью которых он уклоняется от искоренения врожденной иммунной системой, типичны для стратегий, используемых другими микробами для противодействия иммунной защите.Например, S . aureus выделяет стафилококковые суперантиген-подобные белки и токсины, которые предотвращают миграцию нейтрофилов и вызывают лизис нейтрофилов [24]. Вторая стратегия уклонения включает высвобождение мембранных везикул, содержащих факторы, инактивирующие систему комплемента. [25]. Одним из таких факторов является стафопаин А, который расщепляет эластин и инактивирует хемокиновый рецептор 2 (CXCR2) мотива C-X-C и комплемент C5b [26]. С . aureus также продуцирует металлопротеиназу, называемую ауреолизином, которая расщепляет и инактивирует AMP LL-37 [27].Другая протеаза, стафилокиназа, образует комплекс с защитными механизмами человека, что приводит к их инактивации [28]. С . aureus также способен изменять свою гидрофобность за счет продукции поверхностного белка, регулируемого железом поверхностного детерминантного белка A (IsdA), что приводит к устойчивости к hBD2 и LL-37 [29].
Вирусы, поражающие кожу, также обладают факторами вирулентности, которые помогают уклоняться от врожденной иммунной системы. Продукция IFN-α и IFN-β снижается в образцах кожи, инфицированных вирусом простого герпеса 2 (HSV2) [30].Действие OAS2 предотвращается секрецией белка Us11 HSV1 [31]. Поксвирусы, особенно вирус осповакцины, особенно хорошо умеют уклоняться от иммунитета хозяина за счет выработки пептидов, блокирующих активацию TLR [32]. Другие вирусы и патогенные микробы используют аналогичные механизмы для уклонения от иммунитета.
Комменсальные организмы способствуют искоренению патогенных бактерий и вирусов и способствуют заживлению.
Предыдущие исследования показали, что синергетические отношения между человеческим хозяином и микробиомом кожи-комменсала способствуют успешному заживлению ран и общему состоянию здоровья.Комменсальные микробы кожи, такие как S . epidermidis , продуцируют AMP, которые действуют вместе с эндогенными AMP, продуцируемыми кератиноцитами человека, обеспечивая защиту кожи, подобную антибиотикам; С . epidermidis также усиливает продукцию AMP кератиноцитами [2]. Одно исследование идентифицировало небольшую молекулу, продуцируемую S . epidermidis , который активирует передачу сигналов TLR2 и индуцирует продукцию AMP кератиноцитами [33]. Другие пептиды, производимые S . epidermidis , такие как группа растворимых в феноле модулянов, проявляют прямое противомикробное действие против патогенных бактерий, включая S . aureus [34]. С . epidermidis может даже предотвратить неконтролируемое воспаление, характерное для хронических ран [33]. Комменсальные бактерии также модулируют противовирусный иммунитет. Липотейхоевая кислота, компонент клеточной стенки грамположительных бактерий, увеличивает активность тучных клеток против вирусов вакцины [35].
Слишком много хорошего: гиперактивация иммунитета и микробная суперинфекция.
Чрезмерное воспаление лежит в основе множества распространенных кожных патологий и вредно для заживления кожи.Одно из наиболее распространенных кожных заболеваний, обыкновенные угри, характеризуется избыточной выработкой провоспалительных цитокинов и кожным воспалением. Воспаление кожи может даже предшествовать инфицированию Propionibacterium acnes [36]. Розацеа также характеризуется чрезмерным воспалением; Чувствительность к TLR2 повышена в пораженных кератиноцитах [37]. Точно так же REG3A, пептид, который способствует реэпителизации раны, ингибирует терминальную дифференцировку кератиноцитов и способствует гиперпролиферации кератиноцитов в псориатической коже [20].Помимо участия в патогенезе кожных заболеваний, избыточное воспаление препятствует заживлению, предотвращая переход в пролиферативную фазу закрытия раны. Избыточное воспаление особенно часто встречается при диабетических и венозных язвах.
Заключение
Врожденная иммунная система является неотъемлемой частью предотвращения кожных инфекций и уничтожения патогенных бактерий и играет важную роль в заживлении кожи. Распознавание бактерий и вирусов инициирует воспалительный каскад, включающий высвобождение цитокинов, привлечение иммунных клеток и производство AMP и ISG.AMP и ISG представляют собой один из наиболее важных и надежных иммунных механизмов кожи. Однако патогенные бактерии, такие как S . aureus — кожные вирусы развили механизмы противодействия врожденным иммунным механизмам. Комменсальные кожные бактерии помогают врожденной иммунной системе уничтожать патогены за счет производства AMP и повышения активности клеток врожденного иммунитета. Наконец, несмотря на важность врожденного иммунитета, избыточная активация иммунной системы лежит в основе некоторых кожных заболеваний и пагубно сказывается на заживлении ран.
Ссылки
- 1. Певица AJ, Кларк Р.А. Заживление кожных ран. Медицинский журнал Новой Англии. 1999; 341 (10): 738–46. Epub 1999/09/02. pmid: 10471461.
- 2. Галло Р.Л., Накацудзи Т. Микробный симбиоз с системой врожденной иммунной защиты кожи. Журнал исследовательской дерматологии. 2011. 131 (10): 1974–80. Epub 24.06.2011. pmid: 21697881.
- 3. Нельсон А.М., Редди С.К., Рэтлифф Т.С., Хоссейн М.З., Кацефф А.С., Чжу А.С. и др.дцРНК, высвобождаемая при повреждении тканей, активирует TLR3 для ускорения регенерации кожи. Клеточная стволовая клетка. 2015; 17 (2): 139–51. Epub 2015/08/09. pmid: 26253200.
- 4. Такеучи О., Акира С. Рецепторы распознавания образов и воспаление. Клетка. 2010. 140 (6): 805–20. Epub 2010/03/23. pmid: 20303872.
- 5. Raby AC, Holst B, Le Bouder E, Diaz C, Ferran E, Conraux L, et al. Нацеливание на корецептор CD14 TLR с пептидами, производными TLR2, модулирует иммунные ответы на патогены. Наука трансляционная медицина.2013; 5 (185): 185ra64. Epub 2013/05/17. pmid: 23677593.
- 6. de Koning HD, Simon A, Zeeuwen PL, Schalkwijk J. Рецепторы распознавания образов при инфекционных кожных заболеваниях. Микробы и инфекции. 2012; 14 (11): 881–93. Epub 2012/04/21. pmid: 22516809.
- 7. Кришна С., Миллер Л.С. Врожденные и адаптивные иммунные ответы против кожных инфекций, вызванных Staphylococcus aureus. Семинары по иммунопатологии. 2012; 34 (2): 261–80. Epub 2011/11/08. pmid: 22057887.
- 8.Кавамура Т., Огава Ю., Аоки Р., Шимада С. Врожденный и внутренний противовирусный иммунитет кожи. Журнал дерматологической науки. 2014; 75 (3): 159–66. Epub 2014/06/15. pmid: 24928148.
- 9. Платон А., Хардисон С.Е., Браун Г.Д. Рецепторы распознавания образов в противогрибковом иммунитете. Семинары по иммунопатологии. 2015; 37 (2): 97–106. Epub 2014/11/26. pmid: 25420452.
- 10. Ферверда Б., Ферверда Г., Плантинга Т.С., Вилмент Дж. А., ван Сприель А. Б., Венселаар Н. и др. Дефицит человеческого дектина-1 и кожно-слизистые грибковые инфекции.Медицинский журнал Новой Англии. 2009. 361 (18): 1760–7. Epub 2009/10/30. pmid: 19864674.
- 11. Эминг С.А., Криг Т., Дэвидсон Дж. М.. Воспаление при заживлении ран: молекулярные и клеточные механизмы. Журнал исследовательской дерматологии. 2007. 127 (3): 514–25. Epub 2007/02/15. pmid: 17299434.
- 12. MacLeod AS, Mansbridge JN. Врожденная иммунная система при острых и хронических ранах. Достижения в лечении ран. 2016; 5 (2): 65–78. Epub 2016/02/11. pmid: 26862464.
- 13.Agerberth B, Gudmundsson GH. Пептиды противомикробной защиты хозяина при заболеваниях человека. Актуальные темы микробиологии и иммунологии. 2006; 306: 67–90. Epub 2006/08/17. pmid: 16909918.
- 14. Брафф М.Х., Галло Р.Л. Противомикробные пептиды: важный компонент защитного барьера кожи. Актуальные темы микробиологии и иммунологии. 2006; 306: 91–110. Epub 2006/08/17. pmid: 16909919.
- 15. Доршнер Р.А., Пестонджамасп В.К., Тамакувала С., Отаке Т., Рудисилл Дж., Низет В. и др.Кожное повреждение вызывает высвобождение антимикробных пептидов кателицидина, активных против стрептококков группы А. Журнал исследовательской дерматологии. 2001. 117 (1): 91–7. Epub 2001/07/10. pmid: 11442754.
- 16. Онг П.Й., Отаке Т., Брандт С., Стрикленд И., Богуневич М., Ганц Т. и др. Эндогенные антимикробные пептиды и кожные инфекции при атопическом дерматите. Медицинский журнал Новой Англии. 2002. 347 (15): 1151–60. Epub 2002/10/11. pmid: 12374875.
- 17. Балс Р., Ван Х, Ву З., Фриман Т., Бафна В., Заслофф М. и др.Человеческий бета-дефенсин 2 представляет собой солеочувствительный пептидный антибиотик, экспрессирующийся в легких человека. Журнал клинических исследований. 1998. 102 (5): 874–80. Epub 1998/09/03. pmid: 9727055.
- 18. Шиттек Б., Хипфель Р., Зауэр Б., Бауэр Дж., Кальбахер Х., Стеванович С. и др. Дермцидин: новый человеческий пептид-антибиотик, секретируемый потовыми железами. Иммунология природы. 2001; 2 (12): 1133–7. Epub 2001/11/06. pmid: 11694882.
- 19. Heilborn JD, Nilsson MF, Kratz G, Weber G, Sorensen O, Borregaard N, et al.Кателицидиновый антимикробный пептид LL-37 участвует в реэпителизации кожных ран человека и отсутствует в эпителии хронических язв. Журнал исследовательской дерматологии. 2003. 120 (3): 379–89. Epub 2003/02/27. pmid: 12603850.
- 20. Lai Y, Li D, Li C, Muehleisen B, Radek KA, Park HJ, et al. Антимикробный белок REG3A регулирует пролиферацию и дифференциацию кератиноцитов после повреждения кожи. Иммунитет. 2012. 37 (1): 74–84. Epub 26.06.2012. pmid: 22727489.
- 21.Кристиансен Х., Гад Х.Х., Эскильдсен-Ларсен С., Депрес П., Хартманн Р. Семейство олигоаденилатсинтетазы: древнее семейство белков с множественной противовирусной активностью. Журнал исследований интерферона и цитокинов: официальный журнал Международного общества исследований интерферона и цитокинов. 2011; 31 (1): 41–7. Epub 2010/12/15. pmid: 21142819.
- 22. Kristiansen H, Scherer CA, McVean M, Iadonato SP, Vends S, Thavachelvam K и др. Внеклеточная 2′-5 ‘олигоаденилатсинтетаза стимулирует РНКазу L-независимую противовирусную активность: новый механизм вирус-индуцированного врожденного иммунитета.Журнал вирусологии. 2010. 84 (22): 11898–904. Epub 2010/09/17. pmid: 20844035.
- 23. Ян Б., Суванпрадид Дж., Санчес-Лагунес Р., Чой Х.В., Хоанг П., Ван Д. и др. IL-27 способствует заживлению кожных ран за счет индукции эпидермального разрастания и защиты хозяина. Журнал исследовательской дерматологии. 2017; 137 (5): 1166–75. Epub 2017/01/31. pmid: 28132857.
- 24. Zecconi A, Scali F. Факторы вирулентности Staphylococcus aureus при уклонении от врожденной иммунной защиты при заболеваниях человека и животных.Письма иммунологии. 2013; 150 (1–2): 12–22. Epub 2013/02/05. pmid: 23376548.
- 25. Ли EY, Choi DY, Kim DK, Kim JW, Park JO, Kim S и др. Грамположительные бактерии продуцируют мембранные везикулы: основанная на протеомике характеристика мембранных везикул, происходящих от Staphylococcus aureus. Протеомика. 2009. 9 (24): 5425–36. Epub 2009/10/17. pmid: 19834908.
- 26. Юско М., Потемпа Дж., Кантыка Т., Белецкая Э., Миллер Х. К., Калинска М. и др. Стафилококковые протеазы помогают уклоняться от системы комплемента человека.Журнал врожденного иммунитета. 2014; 6 (1): 31–46. Epub 2013/07/11. pmid: 23838186.
- 27. Sieprawska-Lupa M, Mydel P, Krawczyk K, Wojcik K, Puklo M, Lupa B, et al. Разложение человеческого антимикробного пептида LL-37 протеиназами, происходящими от Staphylococcus aureus. Противомикробные средства и химиотерапия. 2004. 48 (12): 4673–9. Epub 2004/11/25. pmid: 15561843.
- 28. Джин Т., Бокарева М., Фостер Т., Митчелл Дж., Хиггинс Дж., Тарковски А. Золотистый стафилококк сопротивляется человеческим дефензинам за счет производства стафилокиназы, нового механизма уклонения бактерий.Журнал иммунологии (Балтимор, Мэриленд: 1950). 2004. 172 (2): 1169–76. Epub 2004/01/07. pmid: 14707093.
- 29. Кларк С.Р., Мохамед Р., Биан Л., Раус А.Ф., Кокай-Кун Дж. Ф., Монд Дж. Дж. И др. Поверхностный белок IsdA золотистого стафилококка обеспечивает устойчивость к врожденным защитным силам кожи человека. Клетка-хозяин и микроб. 2007; 1 (3): 199–212. Epub 2007/11/17. pmid: 18005699.
- 30. Пэн Т., Чжу Дж., Клок А., Фасук К., Хуанг М.Л., Коелле Д.М. и др. Уклонение от врожденного иммунитета слизистой оболочки вирусом простого герпеса 2 типа.Журнал вирусологии. 2009. 83 (23): 12559–68. Epub 2009/10/02. pmid: 19793807.
- 31. Санчес Р., Мор I. Ингибирование клеточной 2′-5 ‘олигоаденилатсинтетазы белком Us11 вируса простого герпеса 1 типа. Журнал вирусологии. 2007. 81 (7): 3455–64. Epub 2007.01.19. pmid: 17229694.
- 32. Брэди Джи, Боуи АГ. Врожденная иммунная активация NFkappaB и его антагонизм со стороны поксвирусов. Обзоры цитокинов и факторов роста. 2014; 25 (5): 611–20. Epub 2014/08/02. pmid: 25081317.
- 33. Лай Й., Ди Нардо А., Накацудзи Т., Лейхтл А., Ян Й., Коген А. Л. и др. Комменсальные бактерии регулируют воспаление, зависимое от Toll-подобного рецептора 3, после повреждения кожи. Природная медицина. 2009. 15 (12): 1377–82. Epub 2009/12/08. pmid: 19966777.
- 34. Cogen AL, Yamasaki K, Sanchez KM, Dorschner RA, Lai Y, MacLeod DT, et al. Избирательное антимикробное действие обеспечивается фенолорастворимыми модулянами, полученными из Staphylococcus epidermidis, нормального обитателя кожи.Журнал исследовательской дерматологии. 2010. 130 (1): 192–200. Epub 2009/08/28. pmid: 19710683.
- 35. Ван З., Маклауд Д. Т., Ди Нардо А. Липотейхоевая кислота комменсальных бактерий увеличивает антимикробную активность тучных клеток кожи против вирусов осповакцины. Журнал иммунологии (Балтимор, Мэриленд: 1950). 2012. 189 (4): 1551–8. Epub 2012/07/10. pmid: 22772452.
- 36. Дайничи Т., Ханакава С., Кабашима К. Классификация воспалительных кожных заболеваний: предложение, основанное на нарушениях трехуровневой системы защиты, барьера, врожденного иммунитета и приобретенного иммунитета.Журнал дерматологической науки. 2014; 76 (2): 81–9. Epub 2014/09/23. pmid: 25242498.
- 37. Ямасаки К., Канада К., Маклеод Д. Т., Борковски А. В., Моризейн С., Накацудзи Т. и др. Экспрессия TLR2 увеличивается при розацеа и стимулирует повышенную продукцию сериновой протеазы кератиноцитами. Журнал исследовательской дерматологии. 2011. 131 (3): 688–97. Epub 2010/11/26. pmid: 21107351.


