Общий вес мышечной массы: норма и важность контроля
Человеческое тело состоит из двух типов масс: жировой и безжировой. Если первая включает в себя жировые ткани, в том числе висцеральную прослойку, то вторая – мышцы, внутренние органы и кости.
Важность сохранения нормальной мышечной массы
Ее достаток – признак здоровья. И наоборот: если начнет преобладать телесный жир, организм окажется в критическом состоянии. А все потому, что его избыток чреват огромными проблемами:
- инфаркты;
- угроза сахарного диабета;
- снижение либидо;
- ПМС;
- затяжные мигрени;
- повышение холестерина;
- риск атеросклероза;
- астма;
- аллергические реакции;
- дисбаланс гормонального фона;
- гипертония и проч.
Тогда как с ростом сухой мышечной массы повышаются энергозатраты, за счет чего исчезают избыточные отложения и потеря веса происходит естественным путем. Поэтому крайне необходимо поддерживать этот параметр в норме и постоянно отслеживать любые изменения.
Особенности контроля
С отмеченной выше задачей на отлично справятся специализированные весы с поддержкой анализа состава тела. Задав соответствующие параметры и нажав на кнопку, можно быстро и точно определить массу всей мышечной ткани. И даже больше, если, конечно, аппарат имеет функциональную поддержку посегментного определения – отдельно торс, ноги, руки и тд. Таблица сравнения моделей сегментных анализаторов состава тела
Такой подход позволит тщательно отслеживать состояние организма с регулированием физических нагрузок, диетического питания или просто для сохранения достигнутого результата. Немаловажен данный режим и при недостатке мышечной массы с преобладанием жировых скоплений.
В целом, общий вес мышечных тканей демонстрирует все мышцы суммарно, куда входят:
- скелетные;
- гладкие;
-
сердечная.

Кроме того, данный параметр учитывает и тяжесть воды, которая в них присутствует (обычно такой показатель идет отдельным пунктом). В целом, в мышечных тканях содержится от 72 до 80 процентов влаги, поэтому она косвенно учитывается при расчете общего содержания.
Норма мышечной массы
|
Женщины |
около 36% |
|
Мужчины |
от 40% до 45% |
|
Спортсмены |
от 45% до 50% |
|
Бодибилдеры |
до 70% |
Примечание. Эти параметры являются оценочными, а не эталонными, поскольку имеют индивидуальную трактовку и зависят от конкретных обстоятельств. Сюда не входят подростки, лица преклонного возраста и беременные женщины.
Как определить объем мышечной массы тела?
Существует несколько вариантов подсчетов:
- вручную;
- с помощью особых устройств.
Первый способ предполагает сбор данных методом замера и калькуляции по специальным формулам. Как правило, они дают приблизительные цифры, поскольку не учитывают многих обстоятельств.
Второй вариант заключается в использовании современных весов-анализаторов. Марка Tanita (модели BC-351 и BC-601) подходит для этого как нельзя лучше, поскольку обеспечена различными полезными функциями.
Читайте так же:
Использование материалов сайта без согласия автора строго запрещено. При копировании статьи ссылка на ресурс обязательна.
Это не просто мышечная масса.
 Обзор качества мышц, состава и метаболизма при старении
Обзор качества мышц, состава и метаболизма при старенииОписаны факторы, определяющие качество скелетных мышц во время возрастных изменений: состав мышц, обмен веществ, аэробная способность, резистентность к инсулину, жировая инфильтрация, фиброз и нервная активация. Также дается подробный обзор методов оценки качества скелетных мышц.
McGregor et al.: It is not just muscle mass: a review of muscle quality, composition and metabolism during ageing as determinants of muscle function and mobility in later life / R.A. Mcgregor, D. Cameron-Smith, S. D. Poppitt // Longevity & Healthspan 2014 3:9.
Р. МАК ГРЕГОР, Д. КЕМЕРОН С.Д. ПОППИТТ
ЭТО НЕ ПРОСТО МЫШЕЧНАЯ МАССА: ОБЗОР КАЧЕСТВА МЫШЦ, СОСТАВА И МЕТАБОЛИЗМА ВО ВРЕМЯ ВОЗРАСТНЫХ ИЗМЕНЕНИЙ, КАК ФАКТОРОВ, ОПРЕДЕЛЯЮЩИХ МЫШЕЧНЫЕ ФУНКЦИИ И МОБИЛЬНОСТЬ В ДАЛЬНЕЙШЕЙ ЖИЗНИAbstractПо мировым оценкам, к 2050 году 2 миллиарда человек будут в возрасте старше 65 лет, поэтому важной задачей является поддержание мобильности и качества жизни людей в старости. Нарушение подвижности часто приводит к функциональному ухудшению здоровья, инвалидности и утрате самостоятельности. Саркопения, представляющая возрастное снижение массы скелетных мышц, является общепризнанным фактором, связанным с ограничениями мобильности пожилых людей. Однако сейчас есть доказательства того, что изменения происходят не только в объеме мышц, существуют и другие факторы, влияющие на качество мышц: состав, обмен веществ, аэробная способность, резистентность (устойчивость) к инсулину, жировая инфильтрация, фиброз и нервная активация, которые могут также играть роль в снижении функции мышц и нарушении подвижности, связанной со старением. Важно, что изменения в качестве мышц могут предшествовать потере мышечной массы и, следовательно, предоставляют новые возможности для оценки качества мышц, особенно у людей среднего возраста, которые могут извлечь выгоду из изменений для улучшения функции мышц. В этом обзоре будут обсуждаться накопленные доказательства того, что помимо мышечной массы, существуют факторы, лежащие в основе качества мышечной ткани, влияющие на функции мышц и мобильность людей с возрастом. Дальнейшая разработка средств для оценки качества мышц в условиях общества необходима. Профилактическая диета, упражнения и лечение, особенно у людей среднего возраста с низким разнообразием мышечных функций, могут помочь сохранить мобильность в пожилом возрасте и улучшить качество жизни.
В этом обзоре будут обсуждаться накопленные доказательства того, что помимо мышечной массы, существуют факторы, лежащие в основе качества мышечной ткани, влияющие на функции мышц и мобильность людей с возрастом. Дальнейшая разработка средств для оценки качества мышц в условиях общества необходима. Профилактическая диета, упражнения и лечение, особенно у людей среднего возраста с низким разнообразием мышечных функций, могут помочь сохранить мобильность в пожилом возрасте и улучшить качество жизни.
Ключевые слова:
мышечная масса, мышечный состав, мышечный метаболизм (обмен), функция мышц, мобильность, старение, саркопения.
ВведениеПоддержание подвижности и здоровья в старости является серьезной проблемой [1,2]. Развитие двигательных ограничений приводит к уменьшению возможностей в повседневной жизни и ухудшает качество жизни [3-5]. Нарушенная мобильность часто является предвестником функционального упадка, нетрудоспособности и развития моральной неустойчивости, что, в свою очередь, приводит к увеличению спроса на лиц, осуществляющих первичный уход и поставщиков медицинских услуг. Поддержание мобильности в среднем и в пожилом возрасте зависит от нескольких компонентов мышц, костей, сухожилий, связок и суставов, а ухудшение качества любой ткани может привести к снижению мобильности, что, в свою очередь, приводит к ускоренному функциональному упадку и инвалидности. У пожилых людей ограничения мобильности были определены как неспособность самостоятельно пройти милю, подняться по лестнице или выполнить тяжелую домашнюю работу [6]. В среднем возрасте острая травма, такая как разрыв мышц, может сразу же ограничить мобильность, но мобильность и мышечная функция в противном случае изменяются в широком спектре. Длительные физические упражнения могут сохранять структуру и функцию мышц у хорошо тренированных мужчин пожилого возраста, сопоставимых с мышцами активных мужчин на четыре десятка лет моложе [7]. Даже различия в физической активности в среднем возрасте могут позитивно снизить риск нарушения мобильности в старости, хотя профессиональная физическая активность в середине жизни может отрицательно повлиять на мобильность в старости [8]. Определение способов оценки и идентификации взрослых людей среднего возраста в нижней границе спектра мышечной функциональности по сравнению со сверстниками их собственного возраста позволило бы целенаправленным вмешательствам в среднесрочной перспективе улучшить работу мышц, что, в свою очередь, может помочь сохранить мобильность в пожилом возрасте и, следовательно, повысить уровень здоровья.
Определение способов оценки и идентификации взрослых людей среднего возраста в нижней границе спектра мышечной функциональности по сравнению со сверстниками их собственного возраста позволило бы целенаправленным вмешательствам в среднесрочной перспективе улучшить работу мышц, что, в свою очередь, может помочь сохранить мобильность в пожилом возрасте и, следовательно, повысить уровень здоровья.
Саркопения, первоначально описанная более двух десятилетий назад, как возрастная потеря массы скелетных мышц [9], является хорошо установленным фактором, связанным с уменьшением мышечной силы и нарушениями мобильности [10]. Потеря мышечной массы предшествует потере костной ткани из-за физической неактивности, вызванной механической разгрузкой [11]. Исследования поперечного сечения скелетных мышц у пожилых людей и в течение всей продолжительности жизни взрослых показали, что снижение массы и силы скелетных мышц наступает с третьего или четвертого десятилетия [12, 13]. Но оценки скорости потери мышечной массы в течение года варьируют от 0,4% до 2,6% [14]. Сообщается, что скорость потери мышечной силы во время старения более чем 1% -3% в течение года, в то время как снижение мышечной мощности, еще больше [15]. Исследования поперечного сечения мышц первоначально основывались на косвенных оценках мышечной массы, таких как двойная рентгеновская абсорбциометрия (ДРА) или биоэлектрический импеданс (БИ), однако в этих исследованиях недооценивалась возрастные изменения в мышечной массе [16]. Несмотря на то, что МРТ или компьютерная томография могут обеспечить точную оценку площади поперечного сечения мышц, а также мышечной композиции [17, 18], они не применяются в спортзалах или медицинских клиниках.
Несколько длительных исследований показывают, что потеря мышечной массы не может полностью объяснить потерю мышечной силы и физической функции у пожилых людей [19-22]. Оценка скорости изменения мышечной силы в зависимости от возраста и площади поперечного сечения мышц показывает, что фактически недооценены ежегодные изменения силы мышц [19].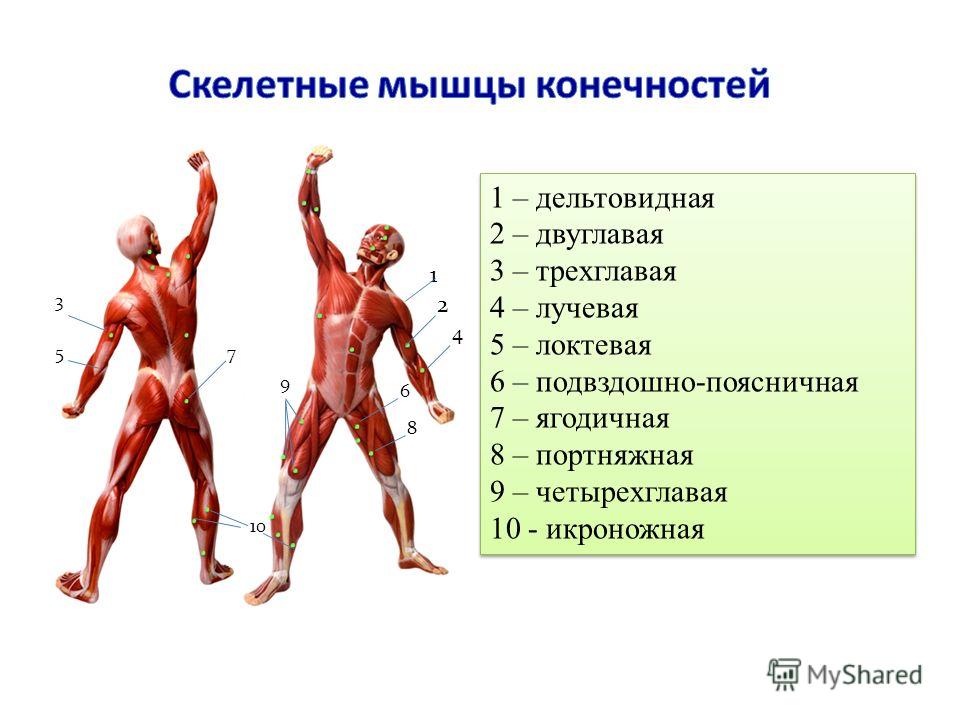 Исследования здоровья, старения и состава тела в течение 3-летнего периода наблюдения [20] показали, что снижение мышечной силы при старении у пожилых людей в возрасте 70–79 лет в два-пять раз больше, чем потеря мышечной массы. Кроме того, была широкая межиндивидуальная изменчивость в изменениях площади поперечного сечения мышц и мышечной силы у пожилых людей. У одних масса и сила скелетных мышц были хорошо сохранены, а у других — нет [20]. В небольшой группе здоровых мужчин в возрасте 65 лет, площадь поперечного сечения мышц бедра (CSA) уменьшается на 1,2% в год, в то время как сила мышц бедра снижается на 1,3% в год в течение 12-летнего периода наблюдения[23]. В здоровой скандинавской группе пожилых мужчин и женщин в возрасте 75 лет, сила мышц снизилась на 15%,в то время как безжировая масса мышц, оцененная посредством BIA, снизилась только на 2,1% за 5 лет [24]. В этом году было проведено исследование большой японской группы мужчин и женщин в возрасте 40–70 лет (n = 3952). Полученные результаты свидетельствуют о тривиальном сокращении массы скелетных мышц, измеренной посредством DXA в течение 12-летнего периода наблюдения кроме мужчин среднего возраста [25]. Однако авторы вынуждены признать, что тривиальные изменения в массе скелетных мышц, возможны из-за того, что участники эксперимента были информированы о результатах испытаний силы и тренировали силу, чтобы улучшить показатели перед последующими контрольными испытаниями[25]. Тем не менее, это подчеркивает, что образ жизни меняется и использование упражнений с отягощениями в середине жизни может помочь сохранить мышечную массу в течение следующего десятилетия. Взятые вместе доказательства несоответствия между изменениями массы и силы скелетных мышц предполагают,что и другие факторы, связанные с качеством мышц, должны вносить вклад в возрастное снижение мышечной функции и мобильности [25-27]. В то время как потеря мышечной массы способствует усилению слабости в пожилом возрасте, отношения между силой [28] и различными аспектами производства силы с размером мышц гораздо менее устойчивы у пожилых, а также людей с избыточным весом по сравнению с молодыми людьми [29,30].
Исследования здоровья, старения и состава тела в течение 3-летнего периода наблюдения [20] показали, что снижение мышечной силы при старении у пожилых людей в возрасте 70–79 лет в два-пять раз больше, чем потеря мышечной массы. Кроме того, была широкая межиндивидуальная изменчивость в изменениях площади поперечного сечения мышц и мышечной силы у пожилых людей. У одних масса и сила скелетных мышц были хорошо сохранены, а у других — нет [20]. В небольшой группе здоровых мужчин в возрасте 65 лет, площадь поперечного сечения мышц бедра (CSA) уменьшается на 1,2% в год, в то время как сила мышц бедра снижается на 1,3% в год в течение 12-летнего периода наблюдения[23]. В здоровой скандинавской группе пожилых мужчин и женщин в возрасте 75 лет, сила мышц снизилась на 15%,в то время как безжировая масса мышц, оцененная посредством BIA, снизилась только на 2,1% за 5 лет [24]. В этом году было проведено исследование большой японской группы мужчин и женщин в возрасте 40–70 лет (n = 3952). Полученные результаты свидетельствуют о тривиальном сокращении массы скелетных мышц, измеренной посредством DXA в течение 12-летнего периода наблюдения кроме мужчин среднего возраста [25]. Однако авторы вынуждены признать, что тривиальные изменения в массе скелетных мышц, возможны из-за того, что участники эксперимента были информированы о результатах испытаний силы и тренировали силу, чтобы улучшить показатели перед последующими контрольными испытаниями[25]. Тем не менее, это подчеркивает, что образ жизни меняется и использование упражнений с отягощениями в середине жизни может помочь сохранить мышечную массу в течение следующего десятилетия. Взятые вместе доказательства несоответствия между изменениями массы и силы скелетных мышц предполагают,что и другие факторы, связанные с качеством мышц, должны вносить вклад в возрастное снижение мышечной функции и мобильности [25-27]. В то время как потеря мышечной массы способствует усилению слабости в пожилом возрасте, отношения между силой [28] и различными аспектами производства силы с размером мышц гораздо менее устойчивы у пожилых, а также людей с избыточным весом по сравнению с молодыми людьми [29,30]. В исследовании здоровья [19,20], 25% мужчин и 31% женщин набрали мышечную массу в течение 3-х летнего периода наблюдения, но это не помешало возрастанию слабости у пожилых людей в возрасте 70–79 лет. Это может быть связано с увеличением BMI и ожирением. Больший прирост BMI с течением времени связан с более высоким темпом снижения качества мышц нижней конечности в зависимости от соотношения силы с мышечной массой [31]. И даже увеличение массы мышц не предотвращает потерю мышечной силы, что наблюдается в исследовании ABC Health, которое подчеркивает важность сохранения качества мышц у пожилых людей.
В исследовании здоровья [19,20], 25% мужчин и 31% женщин набрали мышечную массу в течение 3-х летнего периода наблюдения, но это не помешало возрастанию слабости у пожилых людей в возрасте 70–79 лет. Это может быть связано с увеличением BMI и ожирением. Больший прирост BMI с течением времени связан с более высоким темпом снижения качества мышц нижней конечности в зависимости от соотношения силы с мышечной массой [31]. И даже увеличение массы мышц не предотвращает потерю мышечной силы, что наблюдается в исследовании ABC Health, которое подчеркивает важность сохранения качества мышц у пожилых людей.
Более подробно строение и функции мышц описаны в моих книгах
Качество мышц тесно связано с силой мышц, так как качество мышц обычно определяется как сила мышц или их мощность на единицу мышечной массы [32], хотя пока что нет универсального согласованного определения или метода оценки качества мышц. Учитывая это можно сделать вывод, что и мышечная сила и мощность связаны с функциональной деятельность пожилых людей [33, 34]. Поэтому можно утверждать, что непосредственная оценка мышечной силы или мощности, а не мышечной массы или качества мышц является более эффективным критерием для выявления взрослых людей среднего возраста с повышенным риском нарушения мобильности в последующей жизни. Исследования силы в домашних условиях могут быть полезны для оценки изменений во времени у одного и того же человека, но трудности со стандартизацией домашнего тестирования затрудняет оценку по возрастным нормам силы мышц. Сила кисти относительно проста для оценки здоровых работающих. Также существуют возрастные нормы для сертификации взрослых по риску нарушения мобильности [35, 36]. Тем не менее, было бы полезно разработать оценку качества мышц для взрослых среднего возраста в условиях сообщества. Методы оценки качества мышц можно будет затем использовать для выявления лиц, которые выиграют от вмешательств в образ жизни, чтобы улучшить их состояние. Несколько факторов могут влиять на качество мышц: состав мышц (архитектура мышц и композиция мышечных волокон), метаболизм, инфильтрация жира, фиброз и нейронная активация. Далее мы обсудим факторы, определяющие качество мышц и потенциальные способы оценки этого показателя.
Далее мы обсудим факторы, определяющие качество мышц и потенциальные способы оценки этого показателя.
Объем мышц определяется типом мышечных волокон и их количеством. Площадь поперечного сечения мышц положительно связана с мышечной силой у молодых не имеющих избыточного веса [37]. Маленькие и слабые мышцы обычно наблюдаются у пожилых людей. Тем не менее, площадь поперечного сечения мышцы и объем скелетных мышц нижней конечности тесно связаны с большой степенью ожирения у мужчин и женщин (ИМТ 19-36) [38]. Это может быть обусловлено наличием межмышечных липидных или несократительных компонентов.
Типы мышечных волокон можно классифицировать на основе метаболических характеристик. Так волокна типа IIb преимущественно генерируют энергию посредством анаэробных путей ресинтеза АТФ для быстрого производства высокого напряжения скелетными мышцами, а мышечные волокна типа I преимущественно генерируют энергию через окислительные пути в течение длительного производства невысокого уровня силы, тогда как волокна типа IIa способны генерировать энергию с помощью аэробных и анаэробных путей [39]. Волокна типа I имеют относительно маленькую площадь поперечного сечения (CSA) по сравнению с волокнами типа IIb, но их окислительная емкость значительно больше [40]. Наблюдения над композицией мышечных волокон в пожилом возрасте указывают на то, что может быть сдвиг в композиции мышечных волокон, с прогрессирующей потерей волокон типа IIb [41]. Однако имеются другие исследования, которые показывают, что между изменением композиции и возрастом нет взаимосвязи [42]. Мышечные волокна типа IIb активируются во время активности высокой интенсивности, тогда как мышечные волокна типа I активируются во время обычной повседневной активности низкой интенсивности, такой как ходьба. Потеря определенного типа мышечных волокон с возрастом может быть связана с изменением уровня активности, что приводит к неиспользованию и денервации. Нет длительных исследований изменения композиции мышечных волокон у людей среднего возраста. Тем не менее, длительное исследование обезьян (резусов) среднего возраста показало уменьшение CSA мышечного волокна, что было значительным фактором потери мышечной массы в vastus lateralis с возрастом [43]. В последующих исследованиях было определено, что сдвиг в обмене веществ у обезьян-резусов среднего возраста у произошел до наступления саркопении и распределение типов мышечных волокон сдвигается в сторону МНС типа II и митохондриальное окислительное фосфорилирование значительно снижается [44]. У грызунов по мере старения снижается CSA мышечных волокон в течение 24 месяцев, в то время как мышечная масса и количество волокон уменьшились через 30 месяцев [45]. Относительно позднее снижение CSA мышц и их массы может быть связанными с последовательными уровнями питания и активности лабораторных грызунов. Ограниченные доказательства, доступные о пожилых людях предполагают, что есть расхождение между изменениями в типе мышечного волокна, CSA мышц и их силой [23]. На уровне одиночного волокна, сократительные свойства мышечных волокон типа I и типа II, по-видимому, сохраняются независимо от ограничения подвижности [46], хотя есть противоречивые сообщения. D’Antona et al. [47] предположили, что максимальная скорость укорочения ниже в одиночных волокнах пожилых людей из-за сдвига в распределении изоформ МНС [47]. Larsson et al. [48] наблюдали более низкие максимальной скорости укорочения в волокнах MHC I и IIa у пожилых и очень активных пожилых людей по сравнению с молодыми людьми [48]. Напротив, Trappe et al. не наблюдал связанных с возрастом различий в сократительной скорости одиночных волокон МНС I и IIa [49]. Исследования сократительной способности одиночных волокон обычно включают очень мало исследуемых. В более ранних исследованиях физическая активность, возможно, была сбивающим фактором, который может влиять на сократительные характеристики [49]. Если свойства одиночных мышечных волокон действительно сохраняются с возрастом, то можно предположить, что изменения в скелетных мышцах связаны с количественными изменениями объема мышц или количества мышечных волокон, а не качественные изменениями в сократительных свойствах мышечных волокон.
Нет длительных исследований изменения композиции мышечных волокон у людей среднего возраста. Тем не менее, длительное исследование обезьян (резусов) среднего возраста показало уменьшение CSA мышечного волокна, что было значительным фактором потери мышечной массы в vastus lateralis с возрастом [43]. В последующих исследованиях было определено, что сдвиг в обмене веществ у обезьян-резусов среднего возраста у произошел до наступления саркопении и распределение типов мышечных волокон сдвигается в сторону МНС типа II и митохондриальное окислительное фосфорилирование значительно снижается [44]. У грызунов по мере старения снижается CSA мышечных волокон в течение 24 месяцев, в то время как мышечная масса и количество волокон уменьшились через 30 месяцев [45]. Относительно позднее снижение CSA мышц и их массы может быть связанными с последовательными уровнями питания и активности лабораторных грызунов. Ограниченные доказательства, доступные о пожилых людях предполагают, что есть расхождение между изменениями в типе мышечного волокна, CSA мышц и их силой [23]. На уровне одиночного волокна, сократительные свойства мышечных волокон типа I и типа II, по-видимому, сохраняются независимо от ограничения подвижности [46], хотя есть противоречивые сообщения. D’Antona et al. [47] предположили, что максимальная скорость укорочения ниже в одиночных волокнах пожилых людей из-за сдвига в распределении изоформ МНС [47]. Larsson et al. [48] наблюдали более низкие максимальной скорости укорочения в волокнах MHC I и IIa у пожилых и очень активных пожилых людей по сравнению с молодыми людьми [48]. Напротив, Trappe et al. не наблюдал связанных с возрастом различий в сократительной скорости одиночных волокон МНС I и IIa [49]. Исследования сократительной способности одиночных волокон обычно включают очень мало исследуемых. В более ранних исследованиях физическая активность, возможно, была сбивающим фактором, который может влиять на сократительные характеристики [49]. Если свойства одиночных мышечных волокон действительно сохраняются с возрастом, то можно предположить, что изменения в скелетных мышцах связаны с количественными изменениями объема мышц или количества мышечных волокон, а не качественные изменениями в сократительных свойствах мышечных волокон.
В дополнение к наблюдениям возможных возрастных изменений композиции мышечных волокон, доказано, что меняется длина мышечных волокон и угол перистости. Мышцы бывают с параллельным или перистым строением, что определяет длину мышечного волокна (Lf), угол перистости (θ) и площадь поперечного сечения мышцы (CSA). Оценка длины пучка икроножной мышцы посредством УЗИ показала, что у пожилых людей в возрасте 70–81 лет угол перистости меньше по сравнению с молодыми людьми в возрасте 27–42 года [50]. Ускоренные модели старения, такие как постельный режим в течение нескольких недель, не показали изменение угла перистости в мышце vastus lateralis [51]. Тем не менее, небольшие улучшения в мышечной архитектуре возможны после 4–5 недель тренировок с отягощениями, и, в частности, изменения в мышечной архитектуре, кажется, предшествуют изменениям объема мышц у молодых здоровых взрослых [52]. Следовательно, неинвазивные методы, такие как УЗИ могут помочь в выявлении людей среднего возраста или пожилых людей, которые нужно улучшить архитектуру мышц. Для практической пользы, при использовании УЗИ необходимо обеспечить фиксированное положение конечности и положения датчика для ограничения погрешности измерения.
Аэробная емкость мышц
Метаболические характеристики мышц являются важными детерминантами их качества и, в свою очередь, определяют функцию мышц как у людей среднего, так и старшего возраста. Имеются доказательства того, что аэробная емкость, которая характеризуется максимальной способностью использовать кислород для удовлетворения потребностей в энергии при физической активности может снижаться ускоренными темпами после 50 лет [53]. Аэробная способность – жесткий показатель мобильности пожилых людей, который оценивается по скорости походки [54]. Аэробная емкость отражает не только сердечно-сосудистую адаптацию для транспорта кислорода, но и адаптацию мышцы в использовании кислорода для удовлетворения потребностей в энергии при физической активности. Поперечные исследования здоровых мужчин и женщин в возрасте 18–90 лет указывают на то, что митохондриальная ДНК, иРНК и производство АТФ с возрастом уменьшаются [55]. Со скоростью походки связана митохондриальная емкость скелетной мышцы и ее эффективность, а также пиковая аэробная способность организма человека [56]. Кроме того, люди которые занимаются аэробикой в молодом, среднем и более позднем возрасте имеют более высокую мышечную силу, чем их сидячие сверстники того же возраста [57]. Регулярная физическая активность является мощным стимулом сохранения или улучшения аэробной способности у взрослых среднего возраста, которая, в свою очередь, может помочь сохранить мышечную функцию и мобильность в пожилом возрасте [57]. Максимальная аэробная емкость МПК (VO2max) у взрослых людей среднего возраста является, как и мышечная масса функциональным показателем качества мышц. Хотя для прямых методов оценки МПК (VO2max) требуется газоаналитическое оборудование, косвенные методы, обладающие низкой стоимостью, могут дать оценку VO2max на основе экстраполяции частоты сердечных сокращений.
Поперечные исследования здоровых мужчин и женщин в возрасте 18–90 лет указывают на то, что митохондриальная ДНК, иРНК и производство АТФ с возрастом уменьшаются [55]. Со скоростью походки связана митохондриальная емкость скелетной мышцы и ее эффективность, а также пиковая аэробная способность организма человека [56]. Кроме того, люди которые занимаются аэробикой в молодом, среднем и более позднем возрасте имеют более высокую мышечную силу, чем их сидячие сверстники того же возраста [57]. Регулярная физическая активность является мощным стимулом сохранения или улучшения аэробной способности у взрослых среднего возраста, которая, в свою очередь, может помочь сохранить мышечную функцию и мобильность в пожилом возрасте [57]. Максимальная аэробная емкость МПК (VO2max) у взрослых людей среднего возраста является, как и мышечная масса функциональным показателем качества мышц. Хотя для прямых методов оценки МПК (VO2max) требуется газоаналитическое оборудование, косвенные методы, обладающие низкой стоимостью, могут дать оценку VO2max на основе экстраполяции частоты сердечных сокращений.
Скелетные мышцы ответственны за большую долю усвоения глюкозы в организме, поэтому возрастные изменения мышечной массы и состава могут привести к увеличению резистентности к инсулину и, следовательно, снижению емкости для инсулин-опосредованной утилизации глюкозы. В поперечных исследованиях группы здоровых недиабетиков в возрасте 65 лет, было установлено, что относительная мышечная масса обратно связана с толерантностью к глюкозе и инсулинорезистентностью [58]. Доказательства связи между мышечной силой и инсулинорезистентностью более сложны. Мышечная сила с поправкой на индекс массы тела (ИМТ), связана отрицательной зависимостью с резистентностью к инсулину. Эти исследования проведены на большой популяции (n = 968) пожилых женщин, но не мужчин [59]. С другой стороны, анализ национальной экспертизы здравоохранения и питания США Опрос (NHANES) не выявил никакой связи между силой мышц ноги и инсулинорезистентностью у мужчин или женщин старше 50 лет [60]. В некоторых исследованиях сообщалось, что скорость походки имеет обратную связь с инсулинорезистентностью. Эти выводы свидетельствуют о что резистентность к инсулину может служить индикатором плохого качества мышц, которое является основой низкого уровня физической подготовки и плохих оценок в тестах скорости походки. Как регулярные занятия аэробикой, так и упражнения с отягощениями, которые длились более полугода улучшили удаление глюкозы из крови и метаболизм скелетных мышц у пожилых мужчин с избыточным весом или ожирением в возрасте около 63 лет [61]. Также известно, что инсулинорезистентность тесно связана с межмышечным жиром [62].
В некоторых исследованиях сообщалось, что скорость походки имеет обратную связь с инсулинорезистентностью. Эти выводы свидетельствуют о что резистентность к инсулину может служить индикатором плохого качества мышц, которое является основой низкого уровня физической подготовки и плохих оценок в тестах скорости походки. Как регулярные занятия аэробикой, так и упражнения с отягощениями, которые длились более полугода улучшили удаление глюкозы из крови и метаболизм скелетных мышц у пожилых мужчин с избыточным весом или ожирением в возрасте около 63 лет [61]. Также известно, что инсулинорезистентность тесно связана с межмышечным жиром [62].
Межмышечная жировая ткань
За последнее десятилетие межмышечная жировая ткань (IMAT) стала важным фактором, лежащим в основе качества мышц. Она также может являться предиктором мышечной функции у пожилых людей [27]. IMAT представляет собой депо жировой ткани, расположенное под фасцией внутри мышцы. IMAT включает в себя множество взаимозаменяемых терминов, таких как внутримышечный жир и низкую плотность мышечной ткани, которые описывают жир, накопленный между мышечными волокнами и межмышечный жир, расположенный под фасцией [63]. IMAT можно оценить косвенно, используя мышечное затухание, рассчитанное по компьютерной томографии (КТ) или магнитно-резонансному сканированию (МРТ), которое тесно связано с прямыми измерениями содержания липидов в мышцах [18]. Индивидуумы, имеющие одинаковую окружность бедра, могут иметь разные мышечные функции из-за соотношения IMAT к сократительным элементам. У пожилых людей с различными сопутствующими заболеваниями IMAT, оцененный с помощью МРТ, был представлен как самый сильный предиктор мобильности, хотя сила и состояние четырехглавой мышцы объясняли некоторые вариации мобильности в этом исследовании [64]. Хранение жира и его инфильтрация в мышцу также могут быть хорошими маркерами метаболического профиля. Например, у молодых взрослых среднего возраста (24–48 лет) с разным составом тела от худого до с высокой степенью ожирения, IMAT, оцененный по КТ был сильно связан с инсулинорезистентностью [62]. В другом исследовании сообщалось, что IMAT положительно коррелирует с более высоким уровнем глюкозы в плазме натощак и снижением толерантности к глюкозе у пожилых людей [65].
В другом исследовании сообщалось, что IMAT положительно коррелирует с более высоким уровнем глюкозы в плазме натощак и снижением толерантности к глюкозе у пожилых людей [65].
IMAT связан обратной зависимостью с физической активностью. Один отчет показал, что после 6 месяцев аэробной тренировки и потери веса уменьшили IMAT ноги, в то время как были одновременно улучшены значения глюкозы в плазме натощак и толерантность к глюкозе у мужчин в возрасте 60 лет [65]. Наоборот, у здоровых молодых людей 4 недели принудительного снижения физической активности, вызванное односторонней подвесом конечности привела к увеличению IMAT на 15-20% в мышцах бедра и голени соответственно [66]. Была зарегистрирована потеря мышечной силы, которая была связана с увеличением IMAT после поправки на потерю мышечной массы и начальные значения при базовом уровне [66]. Прогрессивное накопление IMAT у людей среднего и пожилого возраста может привести к фиброзу и дальнейшему ухудшению мышечной функции и подвижности. Было бы выгодно разработать способы оценки качества мышц на основе IMAT с использованием методов, кроме КТ или МРТ, которые можно использовать в условиях на практике. Интенсивность эха, рассчитанная по УЗИ, отрицательно коррелирует с радиологической плотностью, рассчитанной на основе компьютерной томографии и может использоваться как косвенная мера оценки IMAT и несократительных элементов мышц [67]. У активных пожилых женщин интенсивность эха отрицательно коррелирует с функциональным показатели эффективности, включая время подъема из положения сидя в положение стоя и обычную скорость походки [68]. Кроме того, у здоровых женщин в возрасте 51–87 лет интенсивность эха сильно коррелирует с силой четырехглавой мышцы после поправки на возраст и толщину мышц [69]. Однако портативному аппарату УЗИ по-прежнему требуется опытный врач для выполнения сканирования и интерпретации результатов. Кроме того, значения интенсивности эха не сопоставимы между исследованиями из-за различий в УЗИ аппаратах. Альтернативная технология электроимпедансной миографии (EIM) которая позволяет оценивать многочастотный электрический импеданс имеет свои ограничения, так как здоровая мышца демонстрирует различное реактивное сопротивление и фазовую зависимость на разных частотах. Как сообщается, EIM может быть потенциальным биомаркером нейродегенеративного расстройства при боковом амиотрофическом склерозе (БАС) [70]. EIM у пожилых людей с ограниченными возможностями в возрасте 78 лет коррелирует с ослаблением мышцы по КТ и силой [71]. Кроме того, в большой группе лиц в возрасте 19–50 лет и 60–85 лет, было использовано небольшое портативное устройство EMI для оценки нескольких мышц нижней и верхней конечности [72]. Были установлено, что у пожилых людей значения реактивного сопротивления в нижней конечности мышцы ниже по сравнению с молодыми людьми. Однако этот вывод не относится к мышцам верхней конечности [72]. Эти различия были более выражены у мужчин, чем у женщин [72]. В будущем будет важно проверить надежность и достоверность EIM для измерения и мониторинга изменения качества мышц с течением времени в ответ на вмешательства в образ жизни, включая упражнения или диету.
Альтернативная технология электроимпедансной миографии (EIM) которая позволяет оценивать многочастотный электрический импеданс имеет свои ограничения, так как здоровая мышца демонстрирует различное реактивное сопротивление и фазовую зависимость на разных частотах. Как сообщается, EIM может быть потенциальным биомаркером нейродегенеративного расстройства при боковом амиотрофическом склерозе (БАС) [70]. EIM у пожилых людей с ограниченными возможностями в возрасте 78 лет коррелирует с ослаблением мышцы по КТ и силой [71]. Кроме того, в большой группе лиц в возрасте 19–50 лет и 60–85 лет, было использовано небольшое портативное устройство EMI для оценки нескольких мышц нижней и верхней конечности [72]. Были установлено, что у пожилых людей значения реактивного сопротивления в нижней конечности мышцы ниже по сравнению с молодыми людьми. Однако этот вывод не относится к мышцам верхней конечности [72]. Эти различия были более выражены у мужчин, чем у женщин [72]. В будущем будет важно проверить надежность и достоверность EIM для измерения и мониторинга изменения качества мышц с течением времени в ответ на вмешательства в образ жизни, включая упражнения или диету.
Мышечный фиброз
Мышечный фиброз может возникнуть из-за нарушения в процессе восстановления мышц после травмы. Процесс фиброза включает в себя отложение коллагена и внеклеточных матричных белков (ECM) вместо белков необходимых для восстановления функции тканей [73]. Фиброз также наблюдается в разных тканях из-за избыточного накопления жира [74,75]. Развитие патологического фиброза в ткани является конечным результатом ряда событий, включая травмы, инфильтрацию воспалительных клеток, дегенерацию тканей и пролиферация фибробластов, что приводит к ремоделированию тканевой архитектуры [73]. Нет прямых доказательств мышечного фиброза с возрастом у людей из-за того, что его трудно оценить в популяционных исследованиях. Данные исследований посредством микрочипов показывают, что связанные с фиброзом транскрипты дифференциально экспрессируются в старшем возрасте (65–80 лет) по сравнению с более молодыми людьми (19–29 лет) [76]. Данные, полученные на старых мышах, показывают, что мышечные стволовые клетки имеют тенденцию превращаться из миогенного в фиброгенный тип [77]. Кроме того, у пожилых людей популяция мышечных стволовых клеток ниже, чем у более молодых коллег [78]. В настоящее время предположения о наличии фиброза в скелетных мышцах пожилых людей носят спекулятивный характер, однако это не исключает, что молекулярные изменения, регулирующие клеточную структуру и ремоделирование, приводят к тому, что происходит образование коллагена и фиброз ткани. Фиброз ткани выявляется с помощью МРТ, КТ или УЗИ, но в основном используется для выявления патологических состояний, таких как фиброз печени. Вклад фиброза как фактора, лежащего в основе качества мышц, требует дальнейших исследований.
Данные, полученные на старых мышах, показывают, что мышечные стволовые клетки имеют тенденцию превращаться из миогенного в фиброгенный тип [77]. Кроме того, у пожилых людей популяция мышечных стволовых клеток ниже, чем у более молодых коллег [78]. В настоящее время предположения о наличии фиброза в скелетных мышцах пожилых людей носят спекулятивный характер, однако это не исключает, что молекулярные изменения, регулирующие клеточную структуру и ремоделирование, приводят к тому, что происходит образование коллагена и фиброз ткани. Фиброз ткани выявляется с помощью МРТ, КТ или УЗИ, но в основном используется для выявления патологических состояний, таких как фиброз печени. Вклад фиброза как фактора, лежащего в основе качества мышц, требует дальнейших исследований.
Компоненты нервно-мышечной системы и нервно-мышечная активация являются другими потенциальными факторами, лежащими в основе качества мышц в среднем и пожилом возрасте. Скелетные мышечные волокна организованы в пучки двигательных единиц (ДЕ). Каждая ДЕ иннервируется мотонейроном. ДЕ подвергаются ремоделированию, денервации и реиннервации на протяжении всей жизни. Количество ДЕ оценивается на основе поверхностной или внутримышечной электромиографии во время изометрических сокращений. Установлено, что количество ДЕ уменьшается в передней большеберцовой мышце у мужчин в возрасте 65 лет и далее у мужчин в возрасте более 80 лет по сравнению с молодыми людьми в возрасте25 лет [79]. Тем не менее, уменьшенное количество ДЕ связано с силой только у мужчин в возрасте старше 80 лет [79]. Ранняя потеря ДЕ из-за смерти мотонейронов или аксональной дегенерации не могут привести к потере силы мышц из-за успешного ремоделирования и реиннервации соседним мотонейроном. На нервно-мышечную активацию влияют показатели развития силы и мощность мышц, необходимые для динамического движения. Улучшения в нервно-мышечной активации предшествуют увеличению мышечной массы в ответ на тренировку с отягощением. Следовательно, нервно-мышечная активация может быть предложена в качестве еще одного критерия качества мышц [80]. Поверхностная электромиография (ЭМГ) может быть использована для оценки нервно-мышечной активности. Недавнее исследование пожилых людей показало, ограничение нервно-мышечной активности и ускорения во время динамического разгибания ног к коленном суставе у людей с пониженной мобильностью по сравнению с мобильными пожилыми людьми [81]. Был обнаружен разрыв между появлением ЭМГ и движением, а также скоростью и величиной сигнала ЭМГ у пожилых людей с ограниченной мобильностью. Скорость нервно-мышечной активации была тесно связана с уровнем физического развития [81]. Среди людей среднего и старшего возраста без ограничений мобильности, не было значительных различий в показателях ЭМГ и нервно-мышечной активации [81]. Поэтому не ясно, действительно ли нервно-мышечное нарушение предшествует развитию ограничений в мобильности. ЭМГ-сигнал на поверхности мышцы чувствителен к количеству жировой ткани. Следовательно, изменения в жировой ткани из-за потери веса или физических упражнений может затруднить интерпретацию сигнала ЭМГ, хотя это может быть преодолено с помощью регистрации внутримышечной ЭМГ, вместо поверхностной ЭМГ.
Следовательно, нервно-мышечная активация может быть предложена в качестве еще одного критерия качества мышц [80]. Поверхностная электромиография (ЭМГ) может быть использована для оценки нервно-мышечной активности. Недавнее исследование пожилых людей показало, ограничение нервно-мышечной активности и ускорения во время динамического разгибания ног к коленном суставе у людей с пониженной мобильностью по сравнению с мобильными пожилыми людьми [81]. Был обнаружен разрыв между появлением ЭМГ и движением, а также скоростью и величиной сигнала ЭМГ у пожилых людей с ограниченной мобильностью. Скорость нервно-мышечной активации была тесно связана с уровнем физического развития [81]. Среди людей среднего и старшего возраста без ограничений мобильности, не было значительных различий в показателях ЭМГ и нервно-мышечной активации [81]. Поэтому не ясно, действительно ли нервно-мышечное нарушение предшествует развитию ограничений в мобильности. ЭМГ-сигнал на поверхности мышцы чувствителен к количеству жировой ткани. Следовательно, изменения в жировой ткани из-за потери веса или физических упражнений может затруднить интерпретацию сигнала ЭМГ, хотя это может быть преодолено с помощью регистрации внутримышечной ЭМГ, вместо поверхностной ЭМГ.
Направления дальнейших исследований
В будущем нужно лучше понять основные факторы, которые лежат в основе возрастных изменений качества мышц и предшествуют изменениям мышечной массы или имеют большое функциональное значение в стареющих мышцах. Кроме того, необходимо разработать методы оценки качества мышц. Качество мышц обычно используется для описания мышечной силы или мощности, приходящихся на единицу мышечной массы. Однако они не учитывают аэробную емкость мышц, которая тесно связана с мобильностью и очень важна для повседневной жизни. Большинство исследований по качеству мышц на сегодняшний день сосредоточены на пожилых людях в возрасте 65 лет. В настоящее время существует большой разрыв в наших знаниях о первичных детерминантах качества мышц у людей среднего возраста, что значительно тормозит возможность вмешательства посредством программ, ориентированных на диету и / или соответствующую физическую деятельность. Разработка методов оценки качества мышц, которые чувствительны к малыми изменениям в мышцах, предшествующих снижению мышечной массы позволит людям принимать профилактические шаги для поддержания здоровых мышц. Неинвазивная визуализация мышцы с помощью МРТ, КТ и УЗИ может оценить несколько факторов, связанных с качеством мышц, таких как объем, состав мышц, внутримышечный жир и фиброз в условиях исследования. Тем не менее, необходимы новые способы оценки качества мышц, которые практичны в условиях сообщества. Учитывая, что возрастные изменения в скелетных мышцах происходят медленно, открываются большие перспективы для исследования воздействий, направленных на улучшение качества мышц и разработки рекомендаций, способствующих здоровому старению.
Разработка методов оценки качества мышц, которые чувствительны к малыми изменениям в мышцах, предшествующих снижению мышечной массы позволит людям принимать профилактические шаги для поддержания здоровых мышц. Неинвазивная визуализация мышцы с помощью МРТ, КТ и УЗИ может оценить несколько факторов, связанных с качеством мышц, таких как объем, состав мышц, внутримышечный жир и фиброз в условиях исследования. Тем не менее, необходимы новые способы оценки качества мышц, которые практичны в условиях сообщества. Учитывая, что возрастные изменения в скелетных мышцах происходят медленно, открываются большие перспективы для исследования воздействий, направленных на улучшение качества мышц и разработки рекомендаций, способствующих здоровому старению.
Выводы
Качество мышц все чаще признается в качестве важного определителя мышечной функции. Объем мышц, композиция мышечных волокон, архитектура мышц, аэробная емкость, межмышечная жировая ткань, фиброз и нервно-мышечная активация все эти факторы потенциально влияют на качество мышц. Разработка методов оценки качества мышц, которые могут быть использованы в обществе, особенно у взрослых людей среднего возраста, являются приоритетными. Очень важно оценить информативность и надежность новых методов. Наконец, вмешательство в образ жизни людей, ориентируясь на взрослых среднего возраста в нижней части спектра мышечной функции позволит удерживать их потенциал, чтобы сохранить мобильность в пожилом возрасте и улучшить здоровье.
References
- Christensen K, Doblhammer G, Rau R, Vaupel JW: Ageing populations: the challenges ahead. Lancet 2009, 374:1196–1208.
- Brown CJ, Flood KL: Mobility limitation in the older patient: a clinical review. J Am Med Assoc 2013, 310:1168–1177.
- Brown DW, Balluz LS, Heath GW, Moriarty DG, Ford ES, Giles WH, Mokdad AH: Associations between recommended levels of physical activity and health-related quality of life. Findings from the 2001 Behavioral Risk Factor Surveillance System (BRFSS) survey.
 Prev Med 2003, 37:520–528.
Prev Med 2003, 37:520–528. - Brown DR, Carroll DD, Workman LM, Carlson SA, Brown DW: Physical activity and health-related quality of life: US adults with and without limitations. Qual Life Res Int J Qual Life Asp Treat Care Rehabil 2014, 23:2673–2680.
- Thorpe RJ Jr, Clay OJ, Szanton SL, Allaire JC, Whitfield KE: Correlates of mobility limitation in African Americans. J Gerontol A Biol Sci Med Sci 2011, 66:1258–1263.
- Dufour AB, Hannan MT, Murabito JM, Kiel DP, McLean RR: Sarcopenia definitions considering body size and fat mass are associated with mobility limitations: the Framingham Study. J Gerontol A Biol Sci Med Sci 2013, 68:168–174.
- Zampieri S, Pietrangelo L, Loefler S, Fruhmann H, Vogelauer M, Burggraf S, Pond A, Grim-Stieger M, Cvecka J, Sedliak M, Tirpáková V, Mayr W, Sarabon N, Rossini K, Barberi L, De Rossi M, Romanello V, Boncompagni S, Musarò A, Sandri M, Protasi F, Carraro U, Kern H: Lifelong physical exercise delays age-associated skeletal muscle decline. J Gerontol A Biol Sci Med Sci 2014. doi:10.1093/gerona/glu006.
- Hinrichs T, von Bonsdorff MB, Törmäkangas T, von Bonsdorff ME, Kulmala J, Seitsamo J, Nygård C-H, Ilmarinen J, Rantanen T: Inverse effects of midlife occupational and leisure time physical activity on mobility limitation in old age—a 28-year prospective follow-up study. J Am Geriatr Soc 2014, 62:812–820.
- Rosenberg IH: Sarcopenia: origins and clinical relevance. J Nutr 1997, 127(5 Suppl):990S–991S.
- Nair KS: Aging muscle. Am J Clin Nutr 2005, 81:953–963.
- Lloyd SA, Lang CH, Zhang Y, Paul EM, Laufenberg LJ, Lewis GS, Donahue HJ: Interdependence of muscle atrophy and bone loss induced by mechanical unloading. J Bone Miner Res 2013, 29:1118–1130.
- Janssen I, Heymsfield SB, Wang ZM, Ross R: Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol 2000, 89:81–88.
- Silva AM, Shen W, Heo M, Gallagher D, Wang Z, Sardinha LB, Heymsfield SB: Ethnicity-related skeletal muscle differences across the lifespan.
 Am J Hum Biol 2010, 22:76–82.
Am J Hum Biol 2010, 22:76–82. - Mitchell WK, Williams J, Atherton P, Larvin M, Lund J, Narici M: Sarcopenia, dynapenia, and the impact of advancing age on human skeletal muscle size and strength; a quantitative review. Front Physiol 2012, 3:260.
- Kostka T: Quadriceps maximal power and optimal shortening velocity in 335 men aged 23-88 years. Eur J Appl Physiol 2005, 95:140–145.
- Maden-Wilkinson TM, Degens H, Jones DA, McPhee JS: Comparison of MRI and DXA to measure muscle size and age-related atrophy in thigh muscles. J Musculoskelet Neuronal Interact 2013, 13:320–328.
- Zoico E, Rossi A, Di Francesco V, Sepe A, Olioso D, Pizzini F, Fantin F, Bosello O, Cominacini L, Harris TB, Zamboni M: Adipose tissue infiltration in skeletal muscle of healthy elderly men: relationships with body composition, insulin resistance, and inflammation at the systemic and tissue level. J Gerontol A Biol Sci Med Sci 2010, 65:295–299. McGregor et al. Longevity & Healthspan 2014, 3:9 Page 6 of 8 http://www.longevityandhealthspan.com/content/3/1/9
- Goodpaster BH, Kelley DE, Thaete FL, He J, Ross R: Skeletal muscle attenuation determined by computed tomography is associated with skeletal muscle lipid content. J Appl Physiol 2000, 89:104–110.
- Hughes VA, Frontera WR, Wood M, Evans WJ, Dallal GE, Roubenoff R, Fiatarone Singh MA: Longitudinal muscle strength changes in older adults: influence of muscle mass, physical activity, and health. J Gerontol A Biol Sci Med Sci 2001, 56:B209–B217.
- Goodpaster BH, Park SW, Harris TB, Kritchevsky SB, Nevitt M, Schwartz AV, Simonsick EM, Tylavsky FA, Visser M, Newman AB: The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. J Gerontol A Biol Sci Med Sci 2006, 61:1059–1064.
- Schaap LA, Koster A, Visser M: Adiposity, muscle mass, and muscle strength in relation to functional decline in older persons. Epidemiol Rev 2013, 35:51–65.
- Auyeung TW, Lee SWJ, Leung J, Kwok T, Woo J: Age-associated decline of muscle mass, grip strength and gait speed: a 4-year longitudinal study of 3018 community-dwelling older Chinese.
 Geriatr Gerontol Int 2014, 14(Suppl 1):76–84.
Geriatr Gerontol Int 2014, 14(Suppl 1):76–84. - Frontera WR, Hughes VA, Fielding RA, Fiatarone MA, Evans WJ, Roubenoff R: Aging of skeletal muscle: a 12-yr longitudinal study. J Appl Physiol 2000, 88:1321–1326.
- Dey DK, Bosaeus I, Lissner L, Steen B: Changes in body composition and its relation to muscle strength in 75-year-old men and women: a 5-year prospective follow-up study of the NORA cohort in Göteborg, Sweden. Nutrition 2009, 25:613–619.
- Shimokata H, Ando F, Yuki A, Otsuka R: Age-related changes in skeletal muscle mass among community-dwelling Japanese: a 12-year longitudinal study. Geriatr Gerontol Int 2014, 14(Suppl 1):85–92.
- Delmonico MJ, Harris TB, Visser M, Park SW, Conroy MB, Velasquez-Mieyer P, Boudreau R, Manini TM, Nevitt M, Newman AB, Goodpaster BH: Longitudinal study of muscle strength, quality, and adipose tissue infiltration. Am J Clin Nutr 2009, 90:1579–1585.
- Beavers KM, Beavers DP, Houston DK, Harris TB, Hue TF, Koster A, Newman AB, Simonsick EM, Studenski SA, Nicklas BJ, Kritchevsky SB: Associations between body composition and gait-speed decline: results from the Health, Aging, and Body Composition study. Am J Clin Nutr 2013, 97:552–560.
- Clark BC, Manini TM: Sarcopenia =/= dynapenia. J Gerontol A Biol Sci Med Sci 2008, 63:829–834.
- Morse CI, Thom JM, Davis MG, Fox KR, Birch KM, Narici MV: Reduced plantarflexor specific torque in the elderly is associated with a lower activation capacity. Eur J Appl Physiol 2004, 92:219–226.
- Goodpaster BH, Carlson CL, Visser M, Kelley DE, Scherzinger A, Harris TB, Stamm E, Newman AB: Attenuation of skeletal muscle and strength in the elderly: the Health ABC Study. J Appl Physiol 2001, 90:2157–2165.
- Cooper R, Hardy R, Bann D, Aihie Sayer A, Ward KA, Adams JE, Kuh D, MRC National Survey of Health and Development Scientific and Data Collection Team: Body mass index from age 15 years onwards and muscle mass, strength, and quality in early old age: findings from the MRC National Survey of Health and Development.
 J Gerontol A Biol Sci Med Sci 2014, 69:1253–1259.
J Gerontol A Biol Sci Med Sci 2014, 69:1253–1259. - Barbat-Artigas S, Rolland Y, Zamboni M, Aubertin-Leheudre M: How to assess functional status: a new muscle quality index. J Nutr Health Aging 2012, 16:67–77.
- Cruz-Jentoft AJ, Baeyens JP, Bauer JM, Boirie Y, Cederholm T, Landi F, Martin FC, Michel J-P, Rolland Y, Schneider SM, Topinková E, Vandewoude M, Zamboni M: Sarcopenia: European consensus on definition and diagnosis: report of the European Working Group on Sarcopenia in Older People. Age Ageing 2010, 39:412–423.
- Bean JF, Kiely DK, Herman S, Leveille SG, Mizer K, Frontera WR, Fielding RA: The relationship between leg power and physical performance in mobility-limited older people. J Am Geriatr Soc 2002, 50:461–467.
- McLean RR, Shardell MD, Alley DE, Cawthon PM, Fragala MS, Harris TB, Kenny AM, Peters KW, Ferrucci L, Guralnik JM, Kritchevsky SB, Kiel DP, Vassileva MT, Xue Q-L, Perera S, Studenski SA, Dam T-TL: Criteria for clinically relevant weakness and low lean mass and their longitudinal association with incident mobility impairment and mortality: the foundation for the National Institutes of Health (FNIH) sarcopenia project. J Gerontol A Biol Sci Med Sci 2014, 69:576–583.
- Alley DE, Shardell MD, Peters KW, McLean RR, Dam T-TL, Kenny AM, Fragala MS, Harris TB, Kiel DP, Guralnik JM, Ferrucci L, Kritchevsky SB, Studenski SA, Vassileva MT, Cawthon PM: Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci 2014, 69:559–566.
- Maughan RJ, Watson JS, Weir J: Strength and cross-sectional area of human skeletal muscle. J Physiol 1983, 338:37–49.
- Lafortuna CL, Tresoldi D, Rizzo G: Influence of body adiposity on structural characteristics of skeletal muscle in men and women. Clin Physiol Funct Imaging 2014, 34:47–55.
- Zierath JR, Hawley JA: Skeletal muscle fiber type: influence on contractile and metabolic properties. PLoS Biol 2004, 2:e348.
- Van Wessel T, de Haan A, van der Laarse WJ, Jaspers RT: The muscle fiber type-fiber size paradox: hypertrophy or oxidative metabolism? Eur J Appl Physiol 2010, 110:665–694.

- Verdijk LB, Snijders T, Beelen M, Savelberg HHCM, Meijer K, Kuipers H, Van Loon LJC: Characteristics of muscle fiber type are predictive of skeletal muscle mass and strength in elderly men. J Am Geriatr Soc 2010, 58:2069–2075.
- Grimby G, Aniansson A, Zetterberg C, Saltin B: Is there a change in relative muscle fibre composition with age? Clin Physiol 1984, 4:189–194.
- McKiernan SH, Colman R, Lopez M, Beasley TM, Weindruch R, Aiken JM: Longitudinal analysis of early stage sarcopenia in aging rhesus monkeys. Exp Gerontol 2009, 44:170–176.
- Pugh TD, Conklin MW, Evans TD, Polewski MA, Barbian HJ, Pass R, Anderson BD, Colman RJ, Eliceiri KW, Keely PJ, Weindruch R, Beasley TM, Anderson RM: A shift in energy metabolism anticipates the onset of sarcopenia in rhesus monkeys. Aging Cell 2013, 12:672–681.
- Lushaj EB, Johnson JK, McKenzie D, Aiken JM: Sarcopenia accelerates at advanced ages in Fisher 344xBrown Norway rats. J Gerontol A Biol Sci Med Sci 2008, 63:921–927.
- Reid KF, Pasha E, Doros G, Clark DJ, Patten C, Phillips EM, Frontera WR, Fielding RA: Longitudinal decline of lower extremity muscle power in healthy and mobility-limited older adults: influence of muscle mass, strength, composition, neuromuscular activation and single fiber contractile properties. Eur J Appl Physiol 2014, 114:29–39.
- D’Antona G, Pellegrino MA, Adami R, Rossi R, Carlizzi CN, Canepari M, Saltin B, Bottinelli R: The effect of ageing and immobilization on structure and function of human skeletal muscle fibres. J Physiol 2003, 552(Pt 2):499–511.
- Larsson L, Li X, Frontera WR: Effects of aging on shortening velocity and myosin isoform composition in single human skeletal muscle cells. Am J Physiol 1997, 272(2 Pt 1):C638–C649.
- Trappe S, Gallagher P, Harber M, Carrithers J, Fluckey J, Trappe T: Single muscle fibre contractile properties in young and old men and women. J Physiol 2003, 552(Pt 1):47–58.
- Stenroth L, Peltonen J, Cronin NJ, Sipilä S, Finni T: Age-related differences in Achilles tendon properties and triceps surae muscle architecture in vivo.
 J Appl Physiol 2012, 113:1537–1544.
J Appl Physiol 2012, 113:1537–1544. - Kawakami Y, Akima H, Kubo K, Muraoka Y, Hasegawa H, Kouzaki M, Imai M, Suzuki Y, Gunji A, Kanehisa H, Fukunaga T: Changes in muscle size, architecture, and neural activation after 20 days of bed rest with and without resistance exercise. Eur J Appl Physiol 2001, 84:7–12.
- Seynnes OR, de Boer M, Narici MV: Early skeletal muscle hypertrophy and architectural changes in response to high-intensity resistance training. J Appl Physiol 2007, 102:368–373.
- Fleg JL, Morrell CH, Bos AG, Brant LJ, Talbot LA, Wright JG, Lakatta EG: Accelerated longitudinal decline of aerobic capacity in healthy older adults. Circulation 2005, 112:674–682.
- Fiser WM, Hays NP, Rogers SC, Kajkenova O, Williams AE, Evans CM, Evans WJ: Energetics of walking in elderly people: factors related to gait speed. J Gerontol A Biol Sci Med Sci 2010, 65:1332–1337.
- Short KR, Bigelow ML, Kahl J, Singh R, Coenen-Schimke J, Raghavakaimal S, Nair KS: Decline in skeletal muscle mitochondrial function with aging in humans. Proc Natl Acad Sci 2005, 102:5618–5623.
- Coen PM, Jubrias SA, Distefano G, Amati F, Mackey DC, Glynn NW, Manini TM, Wohlgemuth SE, Leeuwenburgh C, Cummings SR, Newman AB, Ferrucci L, Toledo FGS, Shankland E, Conley KE, Goodpaster BH: Skeletal muscle mitochondrial energetics are associated with maximal aerobic capacity and walking speed in older adults. J Gerontol A Biol Sci Med Sci 2013, 68:447–455.
- Crane JD, MacNeil LG, Tarnopolsky MA: Long-term aerobic exercise is associated with greater muscle strength throughout the life span. J Gerontol A Biol Sci Med Sci 2013, 68:631–638. McGregor et al. Longevity & Healthspan 2014, 3:9 Page 7 of 8 http://www.longevityandhealthspan.com/content/3/1/9
- Bijlsma AY, Meskers CGM, van Heemst D, Westendorp RGJ, de Craen AJM, Maier AB: Diagnostic criteria for sarcopenia relate differently to insulin resistance. Age 2013, 35:2367–2375.
- Abbatecola AM, Ferrucci L, Ceda G, Russo CR, Lauretani F, Bandinelli S, Barbieri M, Valenti G, Paolisso G: Insulin resistance and muscle strength in older persons.
 J Gerontol A Biol Sci Med Sci 2005, 60:1278–1282.
J Gerontol A Biol Sci Med Sci 2005, 60:1278–1282. - Kuo C-K, Lin L-Y, Yu Y-H, Wu K-H, Kuo H-K: Inverse association between insulin resistance and gait speed in nondiabetic older men: results from the U.S. National Health and Nutrition Examination Survey (NHANES) 1999-2002. BMC Geriatr 2009, 9:49.
- Ferrara CM, Goldberg AP, Ortmeyer HK, Ryan AS: Effects of aerobic and resistive exercise training on glucose disposal and skeletal muscle metabolism in older men. J Gerontol A Biol Sci Med Sci 2006, 61:480–487.
- Goodpaster BH, Thaete FL, Simoneau JA, Kelley DE: Subcutaneous abdominal fat and thigh muscle composition predict insulin sensitivity independently of visceral fat. Diabetes 1997, 46:1579–1585.
- Addison O, Marcus RL, LaStayo PC, Ryan AS: Intermuscular fat: a review of the consequences and causes. Int J Endocrinol 2014, 2014:e309570.
- Marcus RL, Addison O, Dibble LE, Foreman KB, Morrell G, Lastayo P: Intramuscular adipose tissue, sarcopenia, and mobility function in older individuals. J Aging Res 2012, 2012:629637.
- Prior SJ, Joseph LJ, Brandauer J, Katzel LI, Hagberg JM, Ryan AS: Reduction in midthigh low-density muscle with aerobic exercise training and weight loss impacts glucose tolerance in older men. J Clin Endocrinol Metab 2007, 92:880–886.
- Manini TM, Clark BC, Nalls MA, Goodpaster BH, Ploutz-Snyder LL, Harris TB: Reduced physical activity increases intermuscular adipose tissue in healthy young adults. Am J Clin Nutr 2007, 85:377–384.
- Sipilä S, Suominen H: Muscle ultrasonography and computed tomography in elderly trained and untrained women. Muscle Nerve 1993, 16:294–300.
- Rech A, Radaelli R, Goltz FR, da Rosa LHT, Schneider CD, Pinto RS: Echo intensity is negatively associated with functional capacity in older women. Age 2014, 36:9708.
- Fukumoto Y, Ikezoe T, Yamada Y, Tsukagoshi R, Nakamura M, Mori N, Kimura M, Ichihashi N: Skeletal muscle quality assessed from echo intensity is associated with muscle strength of middle-aged and elderly persons.
 Eur J Appl Physiol 2012, 112:1519–1525.
Eur J Appl Physiol 2012, 112:1519–1525. - Rutkove SB, Caress JB, Cartwright MS, Burns TM, Warder J, David WS, Goyal N, Maragakis NJ, Benatar M, Sharma KR, Narayanaswami P, Raynor EM, Watson ML, Shefner JM: Electrical impedance myography correlates with standard measures of ALS severity. Muscle Nerve 2014, 49:441–443.
- Anderson DE, D’Agostino JM, Bruno AG, Demissie S, Kiel DP, Bouxsein ML: Variations of CT-based trunk muscle attenuation by age, sex, and specific muscle. J Gerontol A Biol Sci Med Sci 2013, 68:317–323.
- Kortman HGJ, Wilder SC, Geisbush TR, Narayanaswami P, Rutkove SB: Age- and gender-associated differences in electrical impedance values of skeletal muscle. Physiol Meas 2013, 34:1611–1622.
- Mann CJ, Perdiguero E, Kharraz Y, Aguilar S, Pessina P, Serrano AL, Muñoz- Cánoves P: Aberrant repair and fibrosis development in skeletal muscle. Skelet Muscle 2011, 1:21.
- Do G-M, Oh HY, Kwon E-Y, Cho Y-Y, Shin S-K, Park H-J, Jeon S-M, Kim E, Hur C-G, Park T-S, Sung M-K, McGregor RA, Choi M-S: Long-term adaptation of global transcription and metabolism in the liver of high-fat diet-fed C57BL/6 J mice. Mol Nutr Food Res 2011, 55:173–185.
- Kwon E-Y, Shin S-K, Cho Y-Y, Jung UJ, Kim E, Park T, Park JHY, Yun JW, McGregor RA, Park YB, Choi M-S: Time-course microarrays reveal early activation of the immune transcriptome and adipokine dysregulation leads to fibrosis in visceral adipose depots during diet-induced obesity. BMC Genomics 2012, 13:450.
- Kusko RL, Banerjee C, Long KK, Darcy A, Otis J, Sebastiani P, Melov S, Tarnopolsky M, Bhasin S, Montano M: Premature expression of a muscle fibrosis axis in chronic HIV infection. Skelet Muscle 2012, 2:10.
- Brack AS, Conboy MJ, Roy S, Lee M, Kuo CJ, Keller C, Rando TA: Increased Wnt signaling during aging alters muscle stem cell fate and increases fibrosis. Science 2007, 317:807–810.
- Kadi F, Charifi N, Denis C, Lexell J: Satellite cells and myonuclei in young and elderly women and men.
 Muscle Nerve 2004, 29:120–127.
Muscle Nerve 2004, 29:120–127. - McNeil CJ, Doherty TJ, Stashuk DW, Rice CL: Motor unit number estimates in the tibialis anterior muscle of young, old, and very old men. Muscle Nerve 2005, 31:461–467.
- Häkkinen K, Kraemer WJ, Kallinen M, Linnamo V, Pastinen UM, Newton RU: Bilateral and unilateral neuromuscular function and muscle crosssectional area in middle-aged and elderly men and women. J Gerontol A Biol Sci Med Sci 1996, 51:B21–B29.
- Clark DJ, Pojednic RM, Reid KF, Patten C, Pasha EP, Phillips EM, Fielding RA: Longitudinal decline of neuromuscular activation and power in healthy older adults. J Gerontol A Biol Sci Med Sci 2013, 68:1419–1425. doi:10.1186/2046-2395-3-9 Cite this article as: McGregor et al.: It is not just muscle mass: a review of muscle quality, composition and metabolism during ageing as determinants of muscle function and mobility in later life. Longevity & Healthspan 2014 3:9.
Самсонова А.В.
Abstract — Ткачук В.Л.
Введение — Ладвез В.В., Вознесенская З.О.
Расшифровка ваших измерений
Указывает, что у вас здоровый уровень висцерального жира. Продолжайте отслеживать свой рейтинг, чтобы убедиться, что он остается в пределах здорового диапазона.
Указывает, что у вас избыточный уровень висцерального жира. Подумайте о том, чтобы внести изменения в свой образ жизни, возможно, путем изменения диеты и / или увеличения физических упражнений.
Содержание воды , %
(относится к возрасту 18-99 лет)
Общее процентное содержание воды в организме — это количество воды в Вашем теле, выраженное в процентах. Вода играет жизненно важную роль во многих процессах, протекающих в организме, и входит в состав всех клеток, тканей и органов. Поддержание нормального значения общего процентного содержания воды в организме обеспечит правильное функционирование всех систем организма и уменьшит риск возникновения проблем со здоровьем.
Средний диапазон для здорового человека:
- Женщины от 45 до 60%
- Мужчины от 50 до 65%
При увеличении процентного содержания жира в теле общее процентное содержание воды в организме уменьшается. При высоком процентном содержании жира в теле значение процентного содержания воды в организме может быть ниже среднего. При уменьшении количества жира в теле общее процентное содержание воды в организме должно постепенно приближаться к указанному выше типичному диапазону.
Индекс массы тела
(относится к возрасту 5-99 лет)
Показатель, который используется в качестве общей оценки состояния здоровья. Ваш ИМТ — это величина, позволяющая оценить степень соответствия массы человека и его роста и, тем самым, косвенно определить, является ли масса недостаточной, нормальной или избыточной (ожирение)ИМТ является хорошим усредненным показателем для общей оценки, но имеет серьезные недостатки при оценке на индивидуальном уровне.
Ваш ИМТ — это величина, позволяющая оценить степень соответствия массы человека и его роста и, тем самым, косвенно определить, является ли масса недостаточной, нормальной или избыточной (ожирение)ИМТ является хорошим усредненным показателем для общей оценки, но имеет серьезные недостатки при оценке на индивидуальном уровне.
Мышечная масса
(относится к возрасту 18-99 лет)
Эта функция прибора позволяет определить вес мышц Вашего тела. Мышечная масса включает скелетные мышцы, гладкие мышцы (такие как сердечная мышца и мышцы пищеварительного аппарата), а также воду, содержащуюся в этих мышцах.Мышцы играют важную роль, выполняя функцию двигателя, потребляющего энергию. При увеличении мышечной массы увеличивается потребление энергии, что помогает естественным образом снизить избыточное количество жира и вес тела.
Тип телосложения
(относится к возрасту 18-99 лет)
На основании измерений мышечной и жировой массы Tanita определит к какому из 9-ти типов тела относитесь вы. По мере изменения уровня вашей активности баланс жира в организме и мышечная масса будет постепенно меняться, что влияет на ваше общее телосложение. Оценка физического состояния, которую обеспечивает Tanita дает Вам представление о том, какой тип тела у вас есть в настоящий момент.
Указанные ниже лица могут получить варьирующие значения и должны использовать приведенные значения только в качестве справочной информации: пожилые люди, женщины во время или после менопаузы, лица, получающие гормональную терапию.
Рейтинг телосложения 1: скрытое ожирение
Скрытое ожирение означает, что в организме высокий процент жира и низкий уровень мышечной массы. Даже если со стороны вы выглядите среднестатистически, у вас слишком высокий уровень жира. Это может привести к ожирению, что может привести к серьезным проблемам со здоровьем. При правильном питании и повышении физической активности вы сможете снизить уровень жира.
Рейтинг телосложения 2: Тучный
Ожирение означает, что у вас высокий процент жира и стандартный уровень мышечной массы. Люди с ожирением должны быть осторожны. Ожирение может привести к серьезным проблемам со здоровьем. Проконсультируйтесь с профессионалом, чтобы помочь вам, когда вы думаете, что вы можете быть ожирением.
Рейтинг телосложения 3: Твердо сложенный
Это означает, что у вас высокий процент жира в организме и высокий уровень мышечной массы. Даже несмотря на то, что вы можете выглядеть большим снаружи, у вас на самом деле много мышечной массы внизу.
Рейтинг телосложения 4: Недостаток
Недостаточная тренировка означает, что у вас среднее количество жира в организме и низкий уровень мышечной массы. Вы должны начать набирать мышечную массу, регулярно тренируясь.
Рейтинг телосложения 5: Стандарт
Стандартный тип тела означает, что у вас есть средний уровень жира и мышечной массы. Люди со стандартным типом телосложения могут много прогрессировать, когда они начинают тренироваться.
Рейтинг телосложения 6: стандартная мышечная
Это означает, что у вас средний процент содержания жира и высокий уровень мышечной массы. Это здоровый рейтинг телосложения, которым вы можете гордиться. Это рейтинг, который есть у некоторых спортсменов.
Рейтинг телосложения 7: Тонкий
Это означает, что у вас низкое количество жира в организме и низкий уровень мышечной массы. Быть слишком худым может привести к серьезным проблемам со здоровьем, однако, быть немного худым — это нормально.
Рейтинг телосложения 8: тонкий и мышечный
Это означает, что у вас небольшое количество жира и стандартный уровень мышечной массы. Бикини тело! Осторожно, люди могут быть очень ревнивыми!
Рейтинг телосложения 9: очень мускулистый
У очень мускулистых людей мало жира и много мышечной массы.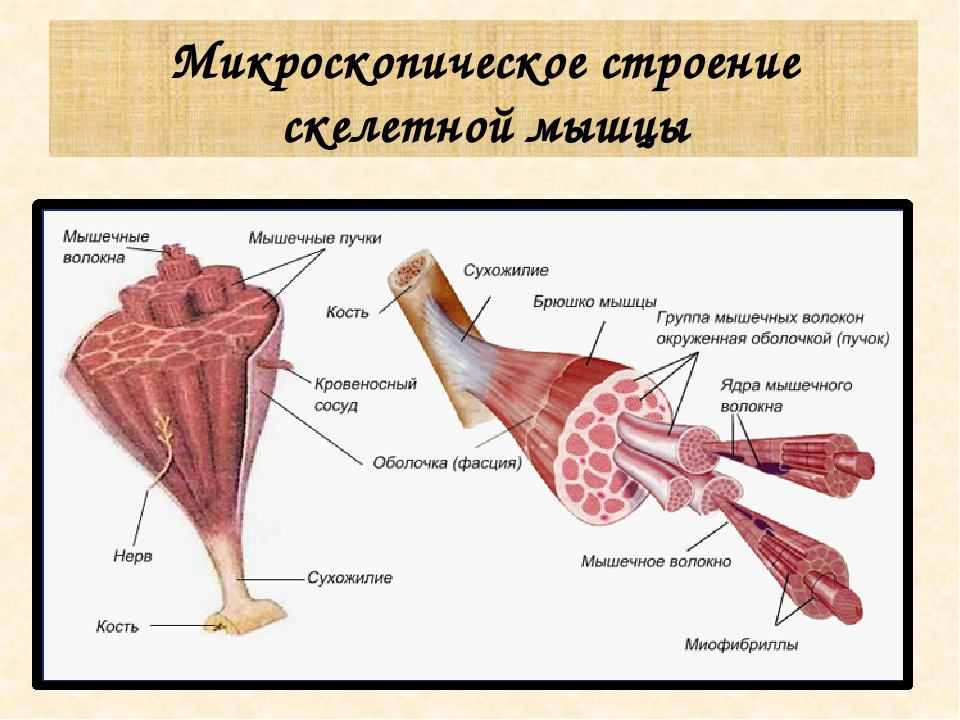
Костная масса
(относится к возрасту 18-99 )
Эта функция прибора позволяет определить количество костной массы (содержание неорганического вещества, входящего в состав кости, такого как кальций или иное неорганическое вещество) в Вашем теле. Он определяет только костную массу, но не плотность и состояние костей.
Необходимо и важно следить за своей костной массой, поддерживать сбалансированным питанием, богатыми кальцием продуктами, а так же важно укреплять и поддерживать весь организм специальными упражнениями. Лица, подозревающие у себя наличие заболеваний опорно-двигательного аппарата, должны проконсультироваться у своего врача. Лица, страдающие от остеопороза или от пониженной плотности костной ткани вследствие возрастных изменений, беременности, гормональной терапии или других причин, могут не получить правильной оценки массы своей костной ткани.
Ниже приведены результаты расчета массы костной ткани.
Метаболический возраст
(относится к возрасту 18-99 лет)
Эта функция прибора позволяет рассчитать BMR и значение среднего возраста, соответствующего данному типу метаболизма. Если ваш метаболический возраст выше, чем ваш фактический возраст, это признак того, что вам нужно улучшить свой метаболический уровень. Увеличение физической нагрузки позволит увеличить мышечную массу, в результате чего метаболический возраст уменьшается. Полученное значение обычно находится в диапазоне от 12 до 90. Значения меньше, чем 12, отображаются как «12», а значения больше, чем 90,отображаются как «90».
Суточное потребление калорий (DCI)(относится к возрасту 18-99 лет)
Суточное потребление калорий (DCI)» — это сумма калорий, необходимая для обеспечения основного обмена, обмена веществ, связанного с повседневной деятельностью (включая повседневную работу по дому), и термогенеза, связанного с потреблением пищи (энергия, использующаяся в процессах пищеварения, всасывания, обмена веществ и других видах пищевой активности).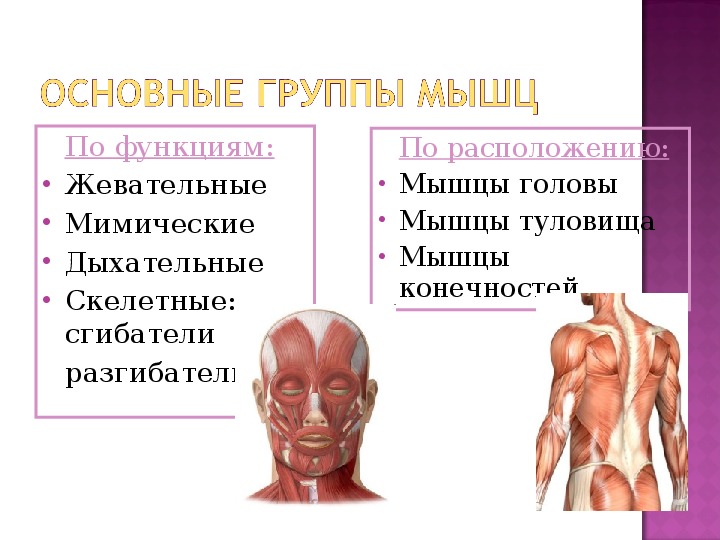 Позволяет определить, сколько калорий Вы можете поглотить за последующие 24 часа для поддержания веса Вашего тела.
Позволяет определить, сколько калорий Вы можете поглотить за последующие 24 часа для поддержания веса Вашего тела.
DCI=BMR x Уровень активности
Уровень активности
Основной обмен веществ (BMR)
(относится к возрасту 18-99 лет)
Основной обмен (BMR) — это минимальное количество энергии, необходимое в покое для нормальной работы организма, включая органы дыхания и кровообращения, нервную систему, печень, почки и другие органы. Калории сжигаются даже во время сна. Около 70% всех поглощаемых ежедневно калорий затрачивается на обеспечение основного обмена. Кроме того, энергия расходуется при любом виде активности; чем выше уровень активности, тем больше сжигается калорий. Это происходит вследствие того, что скелетные мышцы (составляющие около 40% веса тела) играют роль метаболического двигателя, использующего большое количество энергии. Основной обмен зависит от количества мускулатуры, поэтому, увеличивая мышечную массу, Вы повышаете свой основной обмен. При исследованиях, выполненных на здоровых людях, было обнаружено, что с возрастом происходит изменение скорости метаболизма. При взрослении ребенка наблюдается увеличение основного обмена, который достигает пикового значения в возрасте 16-17 лет, а затем обычно постепенно снижается. При высоком основном обмене расходуется большое количество калорий и легче уменьшить содержание жира в теле. При низком основном обмене труднее уменьшить содержание жира в теле и вес тела.
Показатель качества мышцИспользуется только в моделях : BC-953 и RD-545-SV
Указывает на качество / состояние мышц, которое меняется в зависимости от таких факторов, как возраст и физическая форма.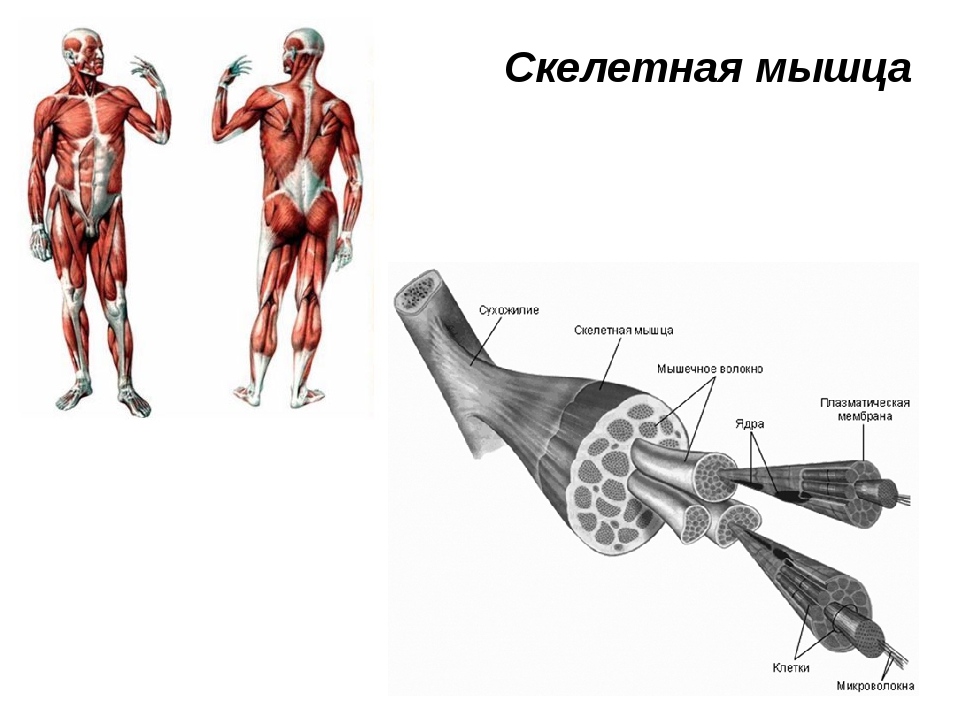
Качество мышц молодых людей или тех, кто регулярно занимается, как правило, хорошее.Состояние мышц ухудшается у пожилых людей и у тех, кто малоактивен. Анализаторы с Dual Body Composition используют 2 разные частоты для измерения биоэлектрического импеданса, и эти результаты позволяют оценить качество мышц.
Оценка качества происходит путем сравнения количества мышечной массы и роста человека. Чем больше число, тем лучше.
Сегментарная масса мышц
Используется только в моделях : BC-601,BC-545N и RD-545-SV
Процентное содержание жира в организме для пяти сегментов тела: основной области живота, каждой руки и ноги.Мониторинг сегментарного жира в процентах для каждой из ваших рук, ног и области живота поможет вам увидеть и понять влияние вашей физической программы с течением времени.Вы также можете использовать эту информацию для устранения дисбаланса мышц и предотвращения травм.
Сегментарный процент жировых отложений
Используется только в моделях : BC-601,BC-545N и RD-545-SV
Процентное содержание жира в организме для пяти сегментов тела: основной области живота, каждой руки и ноги.
Мониторинг сегментарного жира в процентах для каждой из ваших рук, ног и области живота поможет вам увидеть и понять влияние Вашей физической программы с течением времени.
Мышечная масса контролирует вес и аппетит
Автор — Наталья Резник.
Долой адипоцентризм!
При обсуждении животрепещущей темы переедания и избыточного веса большинство исследователей полагают причиной всех бед высокое содержание жира в организме. Лишь немногие отвергают этот адипоцентризм и уделяют должное внимание другой ткани — свободной от жира скелетной мускулатуре.
К их числу принадлежит и физиолог Абдул Даллу (Abdul G. Dulloo), профессор Фрибургского университета (Швейцария). В статье, недавно опубликованной в журнале «Obesity», он пишет о том, как изменение мышечной массы связано с избыточным потреблением калорий и ожирением.
Первое сообщение о том, что аппетит зависит от мышечной массы, появилось в 1989 году. Специалисты Корнельского университета (США) обнаружили, что у женщин — участниц программы по исследованию суточного рациона количество калорий, необходимых для поддержания веса, не связано с массой жира или с его процентным содержанием в организме, при этом оно положительно коррелирует с массой мышечной ткани. В течение 20 лет эти данные игнорировали или считали ошибочными, пока в 2012 году ученые из университета Лидса (Великобритания) не подтвердили, что в тех случаях, когда человек с избыточным весом или ожирением сам определяет свой рацион, количество съеденного зависит именно от мышечной, а не от жировой массы. В 1997 году сам Даллу с коллегами переосмыслил результаты классических экспериментов, проведенных в 1944—1945 годах в университете Миннесоты. Там изучали последствия длительного недоедания, фактически голодания, и методы правильного выхода из него. Когда голодание заканчивается, и человек получает возможность есть вволю, он часто переедает. Абдул Даллу и его соавторы пришли к выводу, что степень переедания прямо зависит от меры истощения мышечной ткани, но не от того, сколько жира было потеряно в период недоедания.
Эти работы, а также анализ других опубликованных результатов привели автора к мысли, что и увеличение, и потеря мышечной массы усиливают потребление калорий, однако механизм регуляции аппетита в разных случаях разный.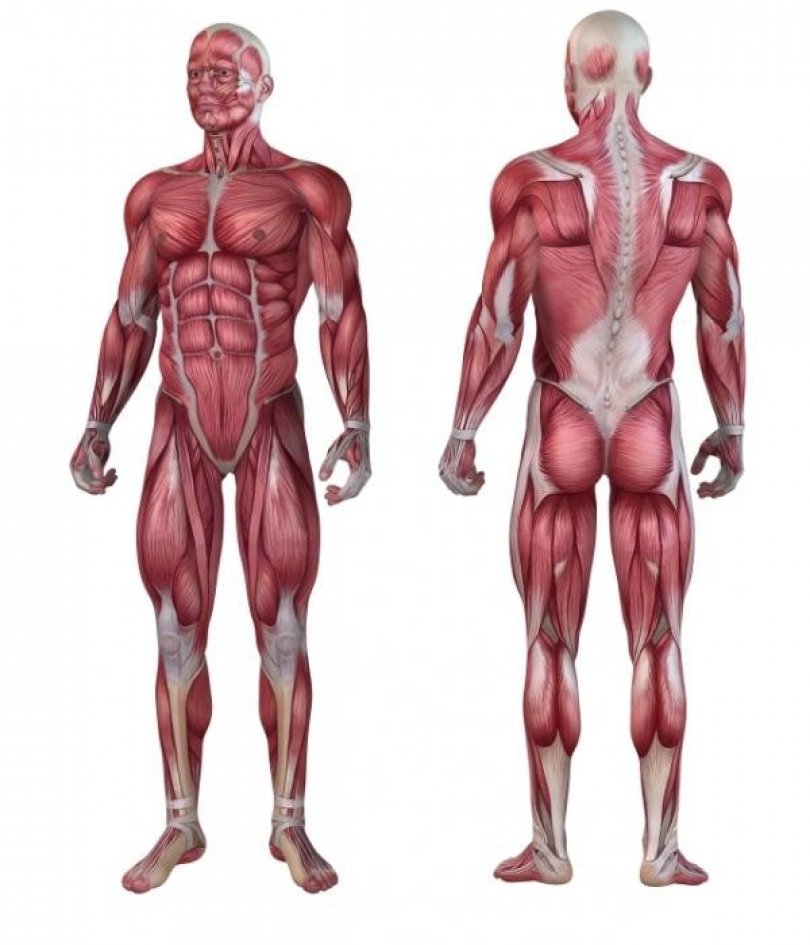
Ситуация первая. Человек переедает
Если человек слишком много ест, он толстеет. Крупному телу нужно больше энергии для поддержания базовых потребностей, поэтому аппетит располневшего индивидуума возрастает. Однако неправильно приравнивать набор веса к увеличению жировых запасов, примерно 20—30% прироста приходится на мышечную ткань. Ее базовая метаболическая активность значительно выше, чем у жировой ткани; именно возросшие энергетические потребности скелетной мускулатуры ответственны примерно за 70% увеличения скорости обмена веществ у располневшего человека. Иными словами, люди с избыточным весом и ожирением больше едят, главным образом, потому, что у них увеличилась масса скелетных мышц.
Автор ссылается на статистические модели, связывающие состав тела, расход энергии и ее потребление. Согласно этим моделям, масса мышечной ткани, определяя скорость метаболизма в состоянии покоя, косвенно влияет на ежедневное энергетические потребности, чувство голода и размер порции. Более того, существует связь между мышечной массой, чувством голода и силой кровотока в специальных структурах среднего мозга, контролирующих аппетит. Такая связь может представлять собой часть системы, трансформирующей энергетические потребности мышечной ткани в пищевое поведение. Пока механизм действия этой системы не выяснен, специалисты предполагают существование автоматической связи между расходом энергии и желанием поесть.
Ситуация вторая. Истощенный человек отъедается
Истощенный человек теряет мышечную массу, его энергетические потребности падают и, теоретически, должен уменьшиться и аппетит. Однако анализ данных, полученных в ходе Минесотского эксперимента, показал, что, когда истощенный человек больше не страдает от недостатка пищи, он начинает объедаться. Обычно гиперфагия сохраняется до тех пор, пока пострадавший не восстановит мышечную массу, которая была у него до начала голодания. Не исходный вес тела, не жировые запасы, а именно массу скелетной мускулатуры. В этом случае, по мнению исследователей, должны существовать специальные сигналы, контролирующие аппетит и исходящие от мышечной, а не от жировой ткани.
Не исходный вес тела, не жировые запасы, а именно массу скелетной мускулатуры. В этом случае, по мнению исследователей, должны существовать специальные сигналы, контролирующие аппетит и исходящие от мышечной, а не от жировой ткани.
Обе ситуации схематически представлены на рисунке 1.
Рисунок 1.
Схема влияния мышечной массы на потребление энергии у человека с нормальной массой тела. Он должен съедать достаточно, чтобы удовлетворять базовые энергетические потребности. Это состояние обозначено на схеме кружком — точкой равновесия. Если человек переедает, увеличиваются его вес, масса мышечной ткани и энергетические потребности. Он больше ест, и когда возросшие запросы удовлетворяются количеством поступающей пищи, возникает новая точка равновесия для нового веса. Потребности возрастают, в основном, за счет прироста мышечной массы. Равновесие устанавливается за счет пассивного влияния мышечной массы на потребление энергии.
Когда человек нормального веса недоедает и теряет мышечную массу, эта утрата действует как триггер, запускающий цепочку сигналов, призывающих к усиленному питанию. Система действует, пока мышечная масса не восстановится до первоначального значения, как показано на рисунке 2.
Существование системы, которая обеспечивает восстановление утраченной мышечной массы, имеет несколько следствий, очень важных для людей, следящих за своим весом.
Две спутницы вечных — похудение и ожирение
Прежде всего, когда располневший человек садится на диету, чтобы вернуть себе былые формы, он теряет не только жир, но и мышцы. Потеря мышечной массы снизит его метаболические потребности (что хорошо), и то же время усилит аппетит (что плохо). Возникшая ситуация отображена на рисунке 2.
Рисунок 2.
Схема развития сопутствующего ожирения. Дефицит массы скелетной мускулатуры снижает энергетические потребности. С другой стороны, он активирует сигнальную систему, управляющую потреблением энергии. Она вызывает гиперфагию и работает до восстановления первоначальной мышечной массы. При этом система учитывает соотношение мышечной и жировой ткани (С).
С другой стороны, он активирует сигнальную систему, управляющую потреблением энергии. Она вызывает гиперфагию и работает до восстановления первоначальной мышечной массы. При этом система учитывает соотношение мышечной и жировой ткани (С).
Существование отрицательной зависимости между мышечной массой и потреблением энергии позволяет объяснить тот факт, что люди, сбросившие вес в результате диеты, очень быстро его набирают, когда перестают этой диете следовать. В результате они могут весить даже больше, чем до начала борьбы с лишним весом. А люди, которые решили похудеть, имея нормальный вес, рискуют даже больше, чем страдающие ожирением. Дело в том, что при похудении худощавые индивидуумы теряют мышечную массу быстрее полных, а при наборе веса все происходит наоборот: масса жира восстанавливается раньше мышечной.
Эту особенность в полной мере ощущают на себе люди нормального телосложения, решившие похудеть под влиянием моды или вынужденные восстанавливать вес после нервной анорексии, болезненной кахексии (истощения) или голодания. У них развивается гиперфагия, и она сохраняется до восстановления мышечной массы. Человек, который исходную массу жира уже набрал, а мышечную — еще нет, продолжает есть. Мышцы растут, но и жир откладывается, и в итоге человек приобретает больше жира, чем потерял. Подтверждением служат данные, полученные во время экспериментов 1940-х годов в Миннесоте, согласно которым жировые запасы при восстановлении веса растут тем быстрее, чем меньше их было изначально. К сожалению, люди с нормальным весом все чаще садятся на диету, что повышает у них риск развития ожирения.
Спортсмены ведут активный образ жизни, потребляют много энергии и много едят. Мышцы у них ого-го! Когда они снижают нагрузку или вообще переходят на «диванный» образ жизни, часть скелетной мускулатуры атрофируется, и возникший дефицит мышечной массы запускает механизм ее восстановления. Часто бывшие спортсмены много едят и набирают вес. У кого в школе была полная учительница физкультуры?
У кого в школе была полная учительница физкультуры?
Существование системы контроля между мышечной массой и аппетитом подразумевает наличие сигналов, поступающих от скелетной мускулатуры, а также сенсоров, воспринимающих эти сигналы. Пока еще не ясно, на что именно эти сенсоры реагируют: на массу белка, размеры скелетной мускулатуры или какого-то другого органа, метаболическую активность. Мышцы секретируют сотни разных молекул, которые могли бы служить сигналами, поступающими в мозг, в центры контроля аппетита. Все это еще предстоит выяснить.
Жир и мышцы в нашем теле идут рука об руку, и попытки тела восстановить утраченную мышечную массу, увеличив потребление энергии, неизбежно приведут к увеличению жировых запасов. Пока не ясно, до какой степени этот феномен «сопутствующего ожирения» будет действовать в старости, когда мышцы слабеют, а питание часто некачественное. От «сопутствующего ожирения» есть одно спасение — здоровое, сбалансированное питание и физическая активность, которая защищает от потери мышц. На диеты надежды плохи.
От нейронов до гормонов. Современные научные знания о геронтологии
Издательство «Эксмо» представляет книгу Валерия Михайловича Новосёлова «От нейронов до гормонов. Современные научные знания о геронтологии и советы, как защитить свое тело и мозг от преждевременного старения».
Старение неизбежно, но есть целый ряд процессов, на которые может повлиять человек, чтобы прожить здоровым и активным как можно дольше. К таким относятся режим сна, гомеостаз, гормональный фон, метаболизм, стресс, питание и физическая активность. Валерий Новосёлов, врач-гериатр с 30-летним опытом работы, невролог, в своей новой книге рассказывает, какие процессы в организме меняются с возрастом, как правильно заботиться о себе, чтобы не допустить проблем в будущем, и что делать, если уже беспокоят возрастзависимые заболевания.
Предлагаем прочитать фрагмент книги, посвященный саркопении.
Всё больше внимания мир уделяет проблеме саркопении. Данный термин в 1989 году предложил I. Rosenberg, а диагностическая концепция синдрома сформирована позднее, в 1998 году. В последние годы мы наблюдаем буквально взрыв интереса к данной теме, и странно даже, что эту гигантскую, а не частную и мелкую проблему не замечали так долго в нашем катастрофически стареющем мире.
Вы часто видите таких людей: они потихоньку, поддерживая друг друга, идут рядом с вами по улице. Или в супермаркетах, где они двигаются, как бы уложив верхнюю часть своего тела на тележку для опоры и толкая ее перед собой. Просто вы не думаете о них именно как о пациентах, считая, что это нормально. Ведь они часть нашего мира.
Так что же такое саркопения? Это снижение объема и силы скелетной мускулатуры. Сам процесс тесно связан именно с возрастом, с процессами инволюции нашей мышечной ткани. Проявляется он снижением физической активности, мышечной слабостью, повышенной утомляемостью. Приводит к снижению, а затем и утрате способности выполнять повседневную работу, сначала интенсивную, затем и менее интенсивную, а в итоге и к гипомобильности. По мере своего развития он серьезно снижает качество жизни пожилого и старого человека.
Таким образом, саркопения — атрофическое дегенеративное изменение скелетной мускулатуры, ассоциированное с возрастом и приводящее к постепенной потере мышечной массы и ее силы. Саркопения — это синдром, который характеризуется прогрессивным и генерализированным снижением скелетной мышечной массы, ее силы и риском развития таких осложнений, как нарушение подвижности, снижение качества жизни и смерть (EWGSOP, 2009).
Люди с этим синдромом ощущают мышечную слабость, снижение скорости своих движений, им сложнее выполнять именно быстрые движения, требующие мышечной силы и выносливости (бег, длительная ходьба в быстром темпе). На продвинутых стадиях постепенно нарастает зависимость от посторонней помощи.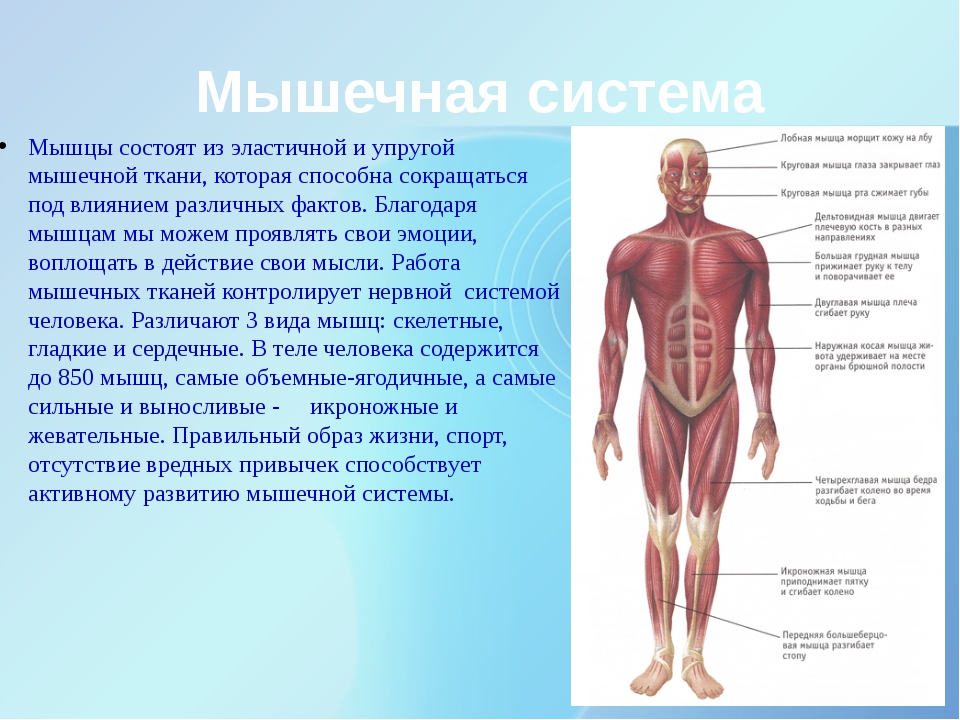
Саркопения часто ассоциируется с различными патологическими состояниями, например, с повышенной инсулинорезистентностью, деменцией, падениями, переломами, и в итоге приводит к обвалу жизнеспособности, госпитализации и смерти пациента. Ранее саркопенией считалось снижение тощей массы на два стандартных отклонения, измеренных при двухэнергетической рентгеновской абсорбциометрии по отношению к молодому здоровому взрослому человеку того же пола. Такой подход имел целый ряд преимуществ: он был понятен, а диагностика могла проводиться в ходе обследования по остеопорозу.
В 2010 году концепция саркопении была пересмотрена. Европейская ассоциация клинического питания и метаболизма предложила определять ее при снижении мышечной массы более двух стандартных отклонений, и, что важно, это должно обязательно сочетаться со снижением скорости ходьбы человека ниже 0,8 м/с.
Вопросы классификации саркопении окончательно не решены, а многие из них спорны. Однако мы выделяем пресаркопению (или динопению) — снижение мышечной силы без нарушения функции передвижения, и собственно саркопению, когда и происходит снижение мышечной силы, и наступает гипомобильность. Европейская рабочая группа по изучению саркопении у пожилых людей предложила выделять три стадии синдрома: снижение мышечной массы, снижение мышечной массы и силы, и третья — снижение всех параметров.
Точной статистики по представленности саркопении, даже если кто-то говорит, что она есть, не существует по многим причинам. Это и разные методы оценки, разные подходы, отсутствие единых критериев в разных популяциях. Например, когда говорят, что среди лиц пожилого возраста 60–74 лет синдром саркопении есть у 22 % людей, встает вопрос: а разве можно такие разные возрастные группы, как 60 и старше 70, вообще включать в одну фокус-группу?
Напомню, что максимальное развитие мышц у человека приходится на возраст около 25–30 лет, к 50 годам мышечная масса уменьшается. В большинстве случаев средняя потеря мышечной массы у человека составляет около 1 % в год в возрасте после 35–40 лет. После 50 лет мышечная масса снижается на 1–2 %, мышечная сила — на 1,5–3 % в год, у мужчин это более выражено, чем у женщин.
После 50 лет мышечная масса снижается на 1–2 %, мышечная сила — на 1,5–3 % в год, у мужчин это более выражено, чем у женщин.
В молодом и среднем возрасте под влиянием физической нагрузки происходит формирование микротравмы в ткани скелетной мускулатуры. В область микротравмы мигрируют стволовые клетки, которые приходят в активное состояние и начинают продуцировать разнообразные миогенные факторы, что приводит к слиянию имеющихся мышечных волокон и стволовых клеток с формированием нового, увеличенного в объеме и обладающего большей силой мышечного волокна (гиперплазия). Эти процессы в старости нарушаются.
В качестве эталона силы мышц используется определение силы четырехглавой мышцы бедра, которая снижается в возрасте 80 лет на 20–40 % по сравнению с лицами 25-летнего возраста. Двуглавая мышца плеча (всем хорошо известный бицепс) в 30 лет весит 174 грамма, к 60 годам теряет 20 граммов, к 70 — еще 35 граммов.
Мышцы в старости на секции выглядят бледными, суховатыми и тугими, как бы натянутыми, падает их васкуляризация. Важно, что эти изменения мы видим во всей скелетной мускулатуре. Патофизиологические изменения мускулатуры характеризуются тотальным снижением числа мышечных волокон, а также выраженной инфильтрацией скелетных мышц фиброзной и жировой тканью. На уровне мышечного волокна происходит дегенерационная атрофия миоцитов, снижается количество нейромускулярных единиц, снижается количество мышечных волокон второго типа, которые являются волокнами быстрого сокращения и обеспечивают, прежде всего, быстрые действия человека (например, бег).
В развитии саркопении играет роль:
– системное воспаление;
– циркуляционная и тканевая гипоксия;
– уменьшение синтеза белка;
– алиментарные факторы: плохое питание, нарушения моторики желудочно-кишечного тракта;
– гормональные изменения: возрастное снижение уровней СТГ, тестостерона, эстрогена и инсулиноподобного фактора роста;
– снижение содержания иммуноглобулина А, G, противоспалительных цитокинов;
– усиление оксидативных процессов;
– возрастное снижение активности альфа-мотонейрона спинного мозга;
– снижение способности мышечной ткани к регенерации;
– возрастзависимая патология, включающая в себя на всех этапах и уровнях развития саркопению (остеопороз, диабет 2-го типа, болезнь Альцгеймера, сердечно-сосудистые заболевания), она как бы дает дополнительное ускорение синдрому.
Профилактика синдрома саркопении
1. Адекватная физическая нагрузка с обязательными силовыми упражнениями.
2. Увеличение потребления белка при отсутствии противопоказаний со стороны почек. Суммарное потребление белка должно составлять 1,2 г/кг веса/сутки, дополнительное назначение пациентам с саркопенией белка в дозе 0,25 г/кг/cутки вызывает достоверное повышение «тощей» массы.
3. Использование протеиновых смесей и аминокислот (лейцин, изолейцин, валин).
4. Выделю еще четыре вещества: L-карнитин, карнозин, L-аргинин, креатинин.
5. Терапия препаратами тестостерона для мужчин (если нет противопоказаний).
6. Терапия эстрогенами (для женщин, доказательств почти нет).
7. Низкодозный СТГ (это назначение только off-label, кроме того, непонятно, надо ли его использовать, если его показания в рамках референтных значений), данные о пользе данного гормона крайне противоречивы.
8. Витамин D3, полиненасыщенные жирные кислоты.
9. Терапия основной патологии старости (диабет 2-го типа, макроангиопатии, нейродегенеративные и прочие).
Эффективность физических нагрузок превышает результаты других видов лечения саркопении, применявшихся без сочетания с физической нагрузкой (различные варианты заместительной гормональной терапии, коррекция питания). Идеальный вид физических нагрузок для пожилых людей — скандинавская ходьба, в которой используется техника ходьбы с палками. Скандинавская ходьба имеет ряд преимуществ для лиц в возрасте, так как проста в технике и не имеет возрастных ограничений, а при занятиях ею задействованы более 90 % мышц.
Мы можем попытаться вмешаться в цепочку «физическая нагрузка — умеренная тканевая гипоксия — активация гипоксических факторов — экспрессия генов — адаптация» с помощью специальных интервальных гипоксических упражнений, воздействуя на синтез гипоксия-индуцируемым фактором (HIF), гетеродимерами, которые влияют на 2 % всех генов человека и запускают каскад сложных адаптационных биохимических реакций. В этом случае мы даем нагрузку на механизмы биохимической и эпигенетической адаптации, а человек при этом лежит или сидит в кресле. Но на вопрос, как и насколько гипоксические интервальные тренировки могут нам помочь в борьбе с саркопенией, ответит только будущее.
В этом случае мы даем нагрузку на механизмы биохимической и эпигенетической адаптации, а человек при этом лежит или сидит в кресле. Но на вопрос, как и насколько гипоксические интервальные тренировки могут нам помочь в борьбе с саркопенией, ответит только будущее.
Недавно 90-летний бегун-любитель Earl Fee пробежал 400 метров за 1:30.76 (прежний рекорд составил 1:46.78) и дистанцию 800 метров за 3:42.50. Нам уже в ближайшем будущем следует ожидать просто дождя рекордов в группах ветеранов старших возрастных групп.
В саркопении важны три характеристики этого синдрома: он прогрессирует, повышает вероятность смерти и — самое важное для нас — мы можем на него повлиять.
Легче проводить профилактику саркопении, чем с ней бороться.
Сохранение объемов скелетной мускулатуры — это одна из основ активного и здорового долголетия.
Занимайтесь физическими нагрузками на постоянной основе как можно дольше.
Силовые нагрузки — обязательный компонент борьбы с саркопенией.
Саркопения глазами эндокринолога | Мокрышева
Одним из синдромов, существенно влияющих на здоровье и жизнь пациента, является саркопения. Саркопения (от греч. sarx – тело, плоть + penia – снижение) – состояние, характеризующееся прогрессирующей и генерализованной утратой мышечной массы и силы с повышением риска неблагоприятных событий, таких как ухудшение качества жизни, инвалидизация и смерть (Европейский консенсус по саркопении 2010 года) [1]. Снижение мышечной силы описывал еще Гиппократ, однако термин «саркопения» впервые предложил в 1989 г. американский профессор I. Rosenberg [2]. Диагностические, профилактические и лечебные мероприятия при саркопении должны разрабатываться с учетом повышения коморбидности с возрастом. Это особенно актуально в практике эндокринолога, так как множество эндокринопатий может приводить к формированию данного синдрома.
Эпидемиология
Распространенность саркопении в популяции по разным источникам варьирует от 4,3% до 73,3% и зависит от возрастных критериев включения и особенностей исследуемых групп (пациенты, получающие амбулаторную помощь, и жители домов престарелых имеют значимые отличия). Чаще встречаются данные о распространенности в диапазоне 5–13% среди лиц 60–70 лет и на уровне 50% – в группе старше 80 лет [3, 4]. В российской популяции частота составила 13% у пациентов старше 85 лет [5].
Этиология
Этиологически саркопению разделяют на первичную и вторичную. Первичную саркопению рассматривают в рамках возрастных изменений мышечной ткани, вторичную – как следствие других заболеваний и патологических состояний (онкологической патологии, сахарного диабета (СД) 2 типа, хронической сердечной недостаточности, гиподинамии и прочего, а также вследствие приема некоторых лекарственных препаратов).
Также обсуждается и генетическая предрасположенность к саркопении. Например, доказана связь генов ACE (кодирует ангиотензинпревращающий фермент), ACTN3 (кодирует альфаактинин 3), MSTN (кодирует миостатин), CNTF (кодирует цилиарный нейротрофический фактор), IGF1 (кодирует ИФР-1), IL-6 (кодирует интерлейкин 6) и VDR (кодирует рецептор витамина D) с силой и/или массой мышечной ткани. Особый интерес для изучения представляют такие гены-кандидаты, как GREM1 (кодирует Gremlin1), TRHR (кодирует рецептор тиреотропин-рилизинг гормона), ACVR1B (кодирует рецептор активина 1B). В ряде двойных слепых исследований продемонстрировано, что наследуемость некоторых показателей мышечной массы и силы достигает 80% [6, 7].
Патогенез
Саркопения – это мультиэтиологичный синдром со сложным патогенезом, в котором эндокринные факторы играют одну из ведущих ролей. Патогенез данного состояния изучен недостаточно, однако уже известно, что на развитие саркопении значимое влияние оказывает снижение уровня гормона роста (ГР), инсулиноподобного фактора роста-1 (ИФР-1), половых гормонов, витамина D, инсулинорезистентность.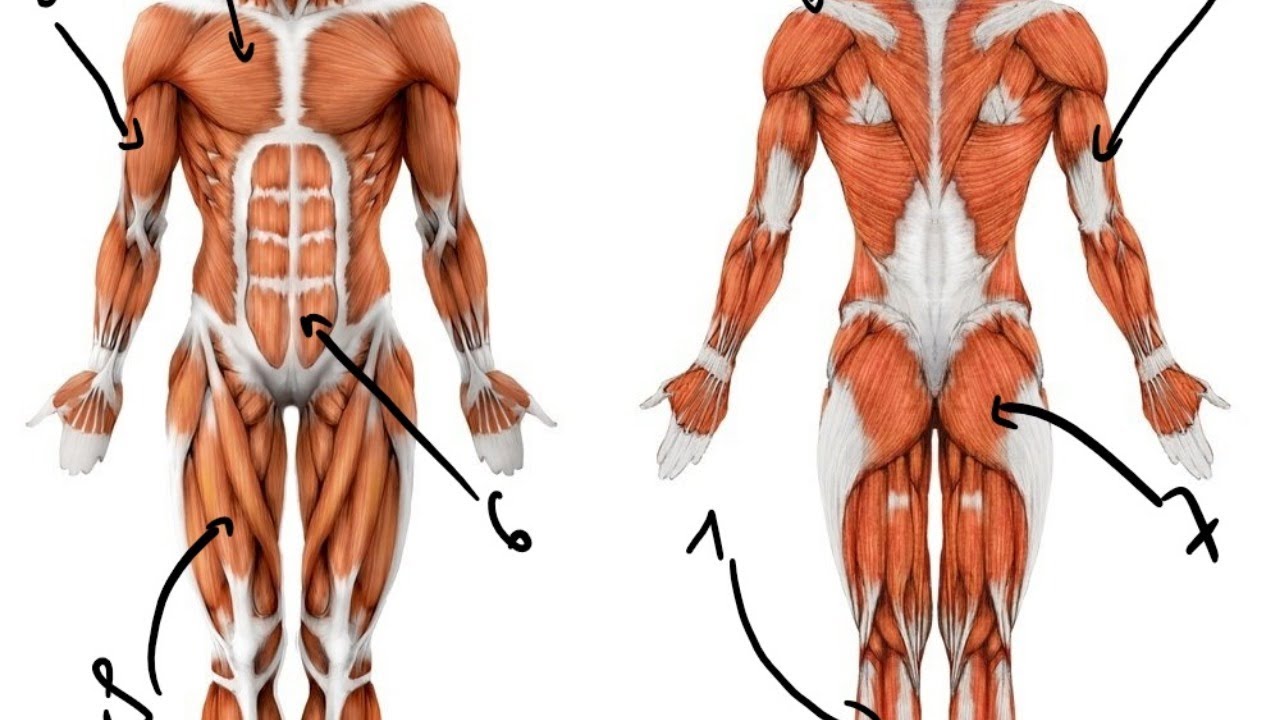 В то же время активно изучаются такие факторы, способствующие развитию саркопении, как особенности образа жизни (качество питания, физическая активность, иммобилизация) и пищевой статус. Снижение последнего приводит к недостаточному синтезу белка, развитию дегенеративных процессов, митохондриальной дисфункции и атрофии мышечных волокон, вследствие чего происходит потеря мышечной массы и силы [8]. На развитие саркопении также может влиять течение гестационного периода матери, окружающая среда в раннем детском возрасте, вес тела при рождении и в младенчестве, который прямо связан с мышечной массой и ее функциональными возможностями в старшем возрасте [6].
В то же время активно изучаются такие факторы, способствующие развитию саркопении, как особенности образа жизни (качество питания, физическая активность, иммобилизация) и пищевой статус. Снижение последнего приводит к недостаточному синтезу белка, развитию дегенеративных процессов, митохондриальной дисфункции и атрофии мышечных волокон, вследствие чего происходит потеря мышечной массы и силы [8]. На развитие саркопении также может влиять течение гестационного периода матери, окружающая среда в раннем детском возрасте, вес тела при рождении и в младенчестве, который прямо связан с мышечной массой и ее функциональными возможностями в старшем возрасте [6].
В основе патогенеза саркопении лежит утрата мышечной массы. Зрелые мышечные волокна состоят из многоядерных клеток, неспособных к делению, поэтому рост и регенерация мышц происходят за счет пролиферации клеток-сателлитов. При саркопении в первую очередь снижается количество клеток-сателлитов и волокон II типа, приводя к невозможности совершения пациентом быстрых движений [9]. Будучи ключевым звеном большинства клеточных процессов (обеспечение энергией, регуляция внутриклеточного гомеостаза кальция, активация клеточной пролиферации), митохондриальная дисфункция и дальнейшая потеря целостности митохондрий в миоцитах приводят к снижению окислительной способности, нарастанию уровня оксидативного стресса, повреждению клеток и развитию атрофии мышечных волокон (рис. 1).
Рис. 1. Этиология и патогенез саркопении.
Значительную роль играют системное воспаление, трансформация митохондрий и их взаимное усиление дегенеративного влияния на мышцы. В скелетных мышцах происходит повреждение транспортной цепи электронов, которое может определяться фокально в миоцитах или в дискретных областях отдельной клетки, и приводит к снижению активности цитохрома С-оксидазы и повышению активности сукцинатдегидрогеназы (СДГ) [10].
Доказательства, подтверждающие ключевую роль мутаций митохондриальной ДНК (мтДНК) в патогенезе старения, были получены в эксперименте на животных моделях, у которых имела место ошибка считывания в мтДНК-полимеразе γ (PolG), что проявлялось преждевременным старением, характеризующимся алопецией, кифозом, потерей слуха, остеопорозом, саркопенией и сокращением продолжительности жизни. У этих мышей накапливались соматические мутации мтДНК и демонстрировали системную дисфункцию митохондрий, включая снижение функции дыхательной цепи, ускоренный апоптоз в постмитотических тканях, при этом повышенного уровня окислительного стресса у них не наблюдалось. Интересно, что делеции мтДНК локализуются совместно с мутациями транспортной цепи электронов и при повышении определенного порога значений приводят к нарушению ее активности. В целом эти данные подтверждают гипотезу о том, что делеции мтДНК, накапливаясь в мышечных волокнах, компрометируют митохондриальную биоэнергетику и способствуют развитию атрофии мышц [10].
У этих мышей накапливались соматические мутации мтДНК и демонстрировали системную дисфункцию митохондрий, включая снижение функции дыхательной цепи, ускоренный апоптоз в постмитотических тканях, при этом повышенного уровня окислительного стресса у них не наблюдалось. Интересно, что делеции мтДНК локализуются совместно с мутациями транспортной цепи электронов и при повышении определенного порога значений приводят к нарушению ее активности. В целом эти данные подтверждают гипотезу о том, что делеции мтДНК, накапливаясь в мышечных волокнах, компрометируют митохондриальную биоэнергетику и способствуют развитию атрофии мышц [10].
Другой путь, регулирующий метаболизм митохондрий во время старения, включает ИФР-1. Этот путь осуществляется путем фосфорилирования АТФ-цитрат-лиазы, фермента, катализирующего митохондриальное производное цитрат в оксалоацетат и ацетил-КоА. Предполагается, что возрастное снижение уровня ИФР-1 может нарушать митохондриальную активность посредством снижения АТФ-цитрат-лиазы, способствуя развитию саркопении [10].
Наличие воспалительной реакции также тесно связано с риском развития саркопении. Повышение фактора некроза опухоли-α способствует развитию воспаления через активацию ядерного фактора k-B, что приводит к потере мышечной массы (см. рис. 1) [11].
Таким образом, ИФР-1, механизмы контроля качества митохондрий и воспалительный путь являются основными звеньями, контролирующими мышечную массу.
Повреждения на любом уровне контроля состояния митохондрий сохраняются на протяжении их жизни, таким образом накапливаются поврежденные органеллы. Как следствие, увеличение отношения AMФ/ATФ и оксидативный стресс активируют катаболический путь, который приводит к атрофии мышц. Этот путь включает в себя как посредников, связанных с аутофагами, так и индукторов мышечного катаболизма (MuRF-1, атрогин), приводящих к деградации митохондрий и белка для обеспечения альтернативных источников энергии [11].
В исследовании, изучавшем взаимосвязь скелетной мышечной массы с сохранностью капиллярной сети при старении, сравнивались данные гистологического исследования мышечной ткани между группами молодых здоровых лиц (средний возраст – 22 года, мужчины (n=14), женщины (n=5)) и пожилых лиц (средний возраст – 74 года, мужчины (n=22), женщины (n=6)). Степень мышечной капилляризации и распределения капилляров определяли методом капиллярных доменов. Окислительную способность мышечных волокон оценивали с помощью количественной гистохимии. Обеспечение капиллярами волокон определялось главным образом размером волокна и лишь в малой степени окислительной способностью. Несмотря на атрофию волокон II типа на 18% (p=0,019) и снижение количества капилляров на одну клетку на 23% (р<0,002) у пожилых людей, существенных различий в распределении капилляров между молодыми и пожилыми людьми выявлено не было. При исследовании активности СДГ максимальное потребление кислорода, поддерживаемое капилляром, не сильно различалось между молодыми и пожилыми людьми, но волокна I типа имели, как и ожидалось, более высокую активность СДГ по сравнению с волокнами II типа [12].
Степень мышечной капилляризации и распределения капилляров определяли методом капиллярных доменов. Окислительную способность мышечных волокон оценивали с помощью количественной гистохимии. Обеспечение капиллярами волокон определялось главным образом размером волокна и лишь в малой степени окислительной способностью. Несмотря на атрофию волокон II типа на 18% (p=0,019) и снижение количества капилляров на одну клетку на 23% (р<0,002) у пожилых людей, существенных различий в распределении капилляров между молодыми и пожилыми людьми выявлено не было. При исследовании активности СДГ максимальное потребление кислорода, поддерживаемое капилляром, не сильно различалось между молодыми и пожилыми людьми, но волокна I типа имели, как и ожидалось, более высокую активность СДГ по сравнению с волокнами II типа [12].
Клиническая картина саркопении
Клиническая картина характеризуется снижением объема мышц, их силы и общей активности пациента. Больные отмечают трудности в выполнении привычных действий, выраженную мышечную и общую слабость, боли в мышцах, невозможность самостоятельного передвижения и самообслуживания, что постепенно приводит к инвалидизации и снижению продолжительности жизни. С целью предотвращения таких тяжелых последствий необходимо выявлять данный синдром на самом раннем этапе его развития.
Диагностические методы
Заподозрить саркопению возможно с помощью опросников. Наиболее часто используются опросники SarQol (Sarcopenia and Quality of Life – качество жизни при саркопении) и SARC-F (Strength, Assistance with walking, Rise from a chair, Climb stairs and Falls – сила, помощь при ходьбе, подъем со стула, подъем по лестнице и падения). Опросник SarQol разработан в 2015 г. французской научной группой для пациентов старше 65 лет в целях оценки мышечной функции и качества жизни. Он состоит из 22 вопросов, разделенных на модули: физическое и психическое здоровье, активность, состав тела, функциональность, деятельность в повседневной жизни и во время досуга [3].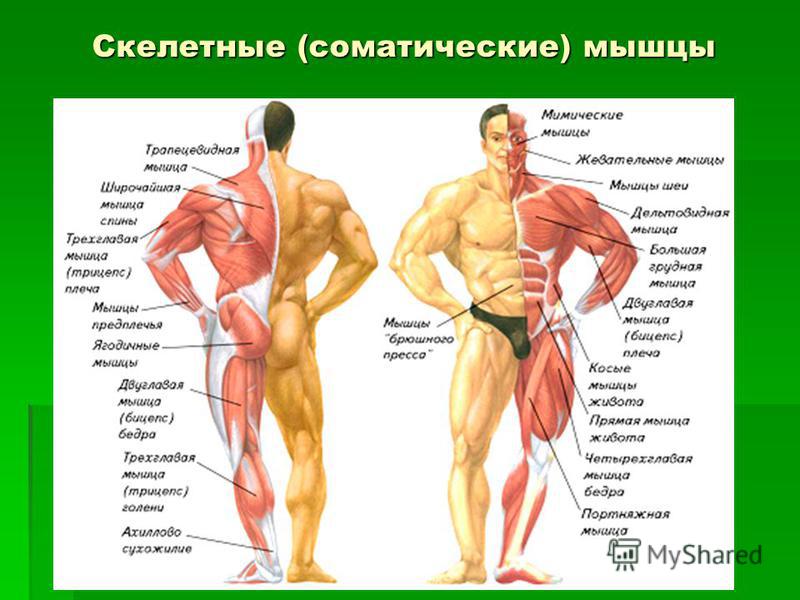 Опросник SARC-F состоит из 5 вопросов и является скрининговым методом обследования, позволяющим быстро оценить мышечную функцию (чувствительность 4–10%, специфичность 94–99%).
Опросник SARC-F состоит из 5 вопросов и является скрининговым методом обследования, позволяющим быстро оценить мышечную функцию (чувствительность 4–10%, специфичность 94–99%).
Европейская рабочая группа по изучению саркопении у пожилых людей (EWGSOP) рекомендует в качестве стандартного метода оценки физического состояния пациента определять скорость ходьбы на короткое расстояние (4 м). Отрезной точкой является скорость 0,8 м/с, ниже которой необходимо заподозрить саркопению. Вторым этапом следует анализ мышечной силы и массы. Сила мышц оценивается с помощью динамометрии, а масса – с помощью денситометрии (двухэнергетической рентгеновской абсорбциометрии, DXA) и биоимпедансного анализа [13]. Для оценки мышечной силы определяют силу сжатия кисти с помощью кистевых динамометров. Наиболее часто используется в зарубежных исследованиях динамометр Jamar. У пациентов с заболеваниями суставов более предпочтителен Martin Vigorimeter, который измеряет давление обхватывающей руки и не зависит от размера кисти. Для более достоверной оценки мышечной силы требуется выполнение двух методик. При проведении проспективного когортного исследования «Хрусталь» в Северо-Западном регионе России был произведен расчет возрастных норм результатов кистевой динамометрии для здоровых людей старше 65 лет. Средняя скорость снижения силы сжатия кисти в российской популяции у мужчин была выше, чем у женщин, и составила примерно 1 кг/год в возрасте от 65 до 76 лет и 0,5 кг/год в возрасте старше 76 лет. Средняя скорость снижения силы сжатия у женщин была 2 кг за 5 лет. Представленные результаты согласуются с результатами других исследований: например, средняя скорость снижения силы сжатия в исследовании H. Frederiksen и соавт., основанном на анализе трех крупных популяционных исследований, была также выше у мужчин по сравнению с женщинами и составила 0,65±0,02 кг/год, в то время как у женщин – 0,34±0,01 кг/год. В исследовании «Возраст и здоровье женщин II» (The Women’s Health and Aging Study II) скорость снижения силы сжатия у женщин была в среднем 1,10–1,31 кг в возрасте от 70 до 75 и 0,50–0,39 кг в возрасте старше 75 лет [14].
Однако кистевые динамометры не могут достоверно отобразить силу мышц верхних и нижних конечностей. В настоящее время ни один из инструментальных методов не может быть рекомендован для оценки мышечной силы в рутинной клинической практике. Функциональные тесты более информативны, однако также имеют ряд ограничений, например, у пациентов с заболеваниями суставов, неврологическими расстройствами, нарушением координации, головокружением и других. Тест SPPB (Short Physical Performance Battery – характеристика короткой физической активности) позволяет оценить кратковременную физическую активность и включает определение скорости ходьбы на короткое расстояние (4 м), а также 5-кратное вставание со стула и возможность удержания равновесия в положении стоя в течение 10 с [15].
При оценке индекса тощей массы (ИТМ) скелетных мышц с помощью двухэнергетической рентгеновской абсорбциометрии (денситометрии, DXA) рассчитывается частное аппендикулярной мышечной массы (АММ – полученной как сумма тощей массы рук и ног) и роста человека в квадратных метрах, то есть АММ/рост², и измеряется в кг/м². Саркопения диагностируется при снижении ИТМ более чем на 2 стандартных отклонения, что, по разным источникам, соответствует ИТМ у мужчин менее 7,26–8,5 кг/м², а у женщин – менее 5,5–5,75 кг/м² [16, 17].
Биоэлектрический импедансный анализ является альтернативой денситометрии, будучи более дешевым, легко воспроизводимым и мобильным методом диагностики. В таблице 1 представлены референсные значения ИТМ для диагностики саркопении.
Таблица 1. Критерии саркопении по данным биоимпедансного анализа
ИТМ | Муж. | Жен. |
Норма | >10,75 кг/м² | >6,75 кг/м² |
Обратимая саркопения | 8,51–10,75 кг/м² | 5,76–6,75 кг/м² |
Выраженная саркопения | 8,5 кг/м² | 5,75 кг/м2 |
Вместе с тем биоимпедансный метод исследования недостаточно точен, особенно у пациентов с заболеваниями, проявляющимися отечным синдромом (хроническая сердечная недостаточность, почечная недостаточность и лимфедема).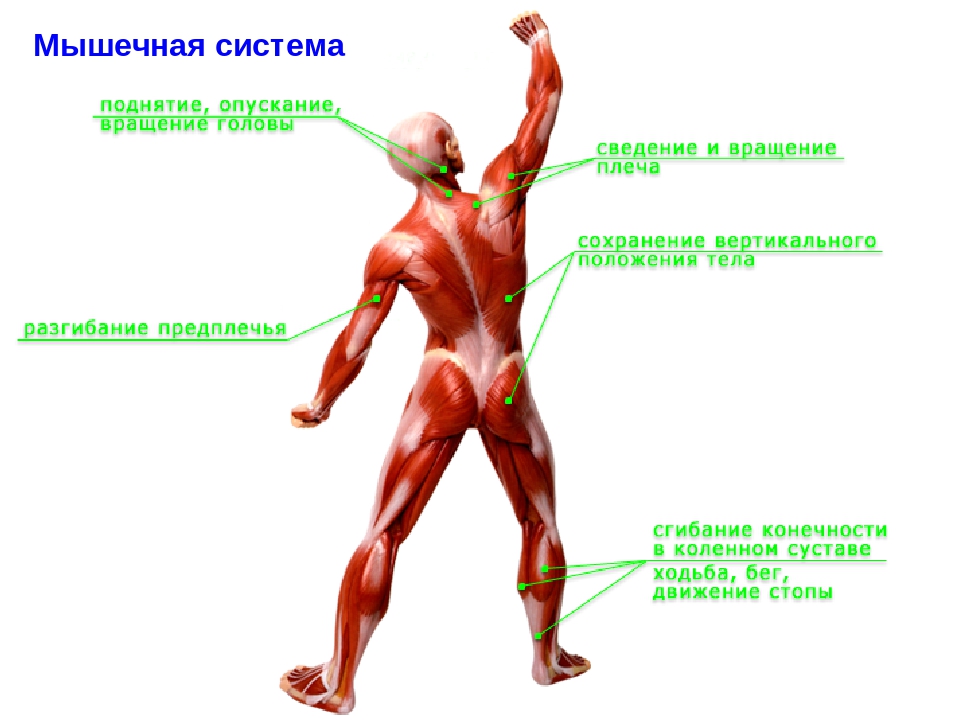 Антропометрические измерения, такие как окружность икроножной мышцы или толщина кожной складки, неточны главным образом потому, что ожирение, отеки, а также изменения в жировой ткани и потеря эластичности кожи, связанные с возрастом, снижают специфичность метода в оценке мышечной массы. Они не рекомендуются для использования в целях диагностики саркопении, но могут быть альтернативными в случае отсутствия других методов [16, 18]. Антропометрический метод недостаточно информативен и при саркопеническом ожирении, включающем критерии саркопении и увеличение объема подкожной жировой клетчатки у мужчин ≥25%, у женщин ≥35%. При данном состоянии наблюдается жировое перерождение клеток-сателлитов, жировая инфильтрация мышц, которые способствуют снижению силы нижних конечностей и гиподинамии – возникает порочный круг. Однако на данный момент невозможно оценить, что развивается первично: саркопения или ожирение, так как при ожирении наблюдается хроническое воспаление, которое, в свою очередь, приводит к снижению мышечной массы и силы [16].
Антропометрические измерения, такие как окружность икроножной мышцы или толщина кожной складки, неточны главным образом потому, что ожирение, отеки, а также изменения в жировой ткани и потеря эластичности кожи, связанные с возрастом, снижают специфичность метода в оценке мышечной массы. Они не рекомендуются для использования в целях диагностики саркопении, но могут быть альтернативными в случае отсутствия других методов [16, 18]. Антропометрический метод недостаточно информативен и при саркопеническом ожирении, включающем критерии саркопении и увеличение объема подкожной жировой клетчатки у мужчин ≥25%, у женщин ≥35%. При данном состоянии наблюдается жировое перерождение клеток-сателлитов, жировая инфильтрация мышц, которые способствуют снижению силы нижних конечностей и гиподинамии – возникает порочный круг. Однако на данный момент невозможно оценить, что развивается первично: саркопения или ожирение, так как при ожирении наблюдается хроническое воспаление, которое, в свою очередь, приводит к снижению мышечной массы и силы [16].
Остеосаркопения
Остеосаркопения – это относительно новое понятие, включающее в себя сочетание низкой мышечной массы и сниженной минеральной плотности костной ткани (МПК), связанное со старением и общим патогенезом [19]. Учитывая повышение риска развития как саркопении, так и остеопороза у пожилых лиц, требуется оценка состояния мышечной ткани у таких пациентов [20].
Состав тела пациентов с остеосаркопенией характеризуется снижением мышечной массы, МПК, ИМТ и индекса общего жира по сравнению с пациентами с изолированным остеопорозом или саркопенией. Клинические проявления остеосаркопении характеризуются слабостью, низкой скоростью ходьбы, потерей подвижности. В настоящее время отсутствуют специфические маркеры остеосаркопении, однако отмечено, что у пациентов с данной патологией уровень тестостерона, витамина D и гемоглобина ниже, чем у пациентов с изолированным остеопорозом или саркопенией.
Помимо возраста, существует ряд других факторов, которые способствуют развитию остеосаркопении. Генетические полиморфизмы GLYAT, METTL21C, MSTN, ACTN3 PGC-1α и MEF-2C связаны с потерей костной и мышечной ткани. Эндокринные заболевания (в основном СД, нарушение функции щитовидной железы и низкий уровень витамина D, половых гормонов, ГР, ИФР-1), алиментарная недостаточность, ожирение и прием кортикостероидов также влияют на развитие остеосаркопении [19]. Отмечено, что саркопения и мышечная слабость, так же как и частота переломов, встречаются чаще у пациентов с СД 2 типа, чем у здоровых людей [21].
Генетические полиморфизмы GLYAT, METTL21C, MSTN, ACTN3 PGC-1α и MEF-2C связаны с потерей костной и мышечной ткани. Эндокринные заболевания (в основном СД, нарушение функции щитовидной железы и низкий уровень витамина D, половых гормонов, ГР, ИФР-1), алиментарная недостаточность, ожирение и прием кортикостероидов также влияют на развитие остеосаркопении [19]. Отмечено, что саркопения и мышечная слабость, так же как и частота переломов, встречаются чаще у пациентов с СД 2 типа, чем у здоровых людей [21].
Жировая инфильтрация мышц у пожилых вносит свой вклад в развитие остеосаркопении, что, возможно, связано с отрицательным воздействием продукции воспалительных цитокинов костным мозгом и жировой тканью. Установлено, что пациенты с саркопенией и остеопенией имеют высокие концентрации воспалительных цитокинов, преобладание интерлейкина-6 (IL-6) и фактора некроза опухолей альфа (ФНО-α), которые связаны как с системной, так и с локальной липотоксичностью. Кроме того, изменения в костном мозге тесно ассоциированы с изменениями мышечной массы. Скелетная и мышечная ткань взаимодействуют механически, физически, а также биохимически посредством паракринных и эндокринных факторов. В этом процессе существует много возможных путей, которые могут объяснить развитие и прогрессирование остеосаркопении. Один из них включает остеокальцин, который стимулирует пролиферацию β-клеток, секрецию инсулина и действует непосредственно на скелетную мышцу, коррелируя с мышечной силой. Другим внутренним механизмом, связывающим мышцы и кость, является секреция сосудистого эндотелиального фактора роста (VEGF) с помощью мезенхимальных стромальных клеток костного мозга, что стимулирует пролиферацию миобластов. Мышцы также секретируют несколько гормонов и активных веществ, влияющих на кость, таких как ИФР-1, остеоглицин, ирисин, остеонектин, фактор роста фибробластов-2, IL-6, IL-15 и миостатин. Миостатин является членом надсемейства бета-трансформирующего фактора роста, экспрессируемого в основном в скелетных мышцах. Изучен его эффект на рост мышц и влияние на кость. Дефицит гена MSTN и системное введение ACVR2B-Fc (inhibitor of the Activin Receptor 2B – блокатора рецептора активина 2B) приводят к гипертрофии мышечной ткани и увеличению костной массы [18]. Мышечная ткань также секретирует декорин, который, связывая миостатин, способствует росту мышечной ткани. Обнаружен и его противоопухолевый эффект. При изучении генетически модифицированных животных с выключенным геном DCN, кодирующим декорин, зафиксирован спонтанный рост опухолей. Однако влияние этого белка на физиологию человека изучено недостаточно.
Изучен его эффект на рост мышц и влияние на кость. Дефицит гена MSTN и системное введение ACVR2B-Fc (inhibitor of the Activin Receptor 2B – блокатора рецептора активина 2B) приводят к гипертрофии мышечной ткани и увеличению костной массы [18]. Мышечная ткань также секретирует декорин, который, связывая миостатин, способствует росту мышечной ткани. Обнаружен и его противоопухолевый эффект. При изучении генетически модифицированных животных с выключенным геном DCN, кодирующим декорин, зафиксирован спонтанный рост опухолей. Однако влияние этого белка на физиологию человека изучено недостаточно.
Постменопаузальная остеосаркопения, развитие которой обусловлено генетическими факторами, изменением состава тела, низкой физической активностью, дефицитом эстрогенов и витамина D, приводит к снижению мышечной массы, силы, функциональных возможностей, а также к снижению МПК, что в сочетании с коморбидностью пожилых пациентов реализуется в увеличении частоты переломов, инвалидизации и смертности [20].
Также существует такое понятие как остеосаркопеническое ожирение, критериями которого являются снижение МПК по Т-критерию ≤-1,0 SD по данным DXA, снижение ИТМ <5,5 кг/м2 для женщин и <7,23 кг/м2 для мужчин, повышение массы жира ≥38% для женщин и ≥28% для мужчин, а также соотношение висцерального/подкожного жирового соотношения >1 (для андроидного типа ожирения) или <1 (для гиноидного типа ожирения). Распространенность остеосаркопенического ожирения, по данным перекрестного исследования в Италии, составила 6,86%, из которых частота гиноидного и андроидного ожирения составила соответственно 2,1% и 4,7%.
В группе пациентов с остеосаркопеническим висцеральным ожирением (по сравнению с другими когортами) отмечен более высокий уровень С-реактивного белка (>2,34 мг/дл), гликемии (>112 мг/дл), а также более высокий риск переломов (FRAX>15%, r=0,316; p<0,05) [22].
Саркопения и витамин D
Установлено, что витамин D играет важную роль в метаболических процессах в мышечной и костной ткани. Так, снижение его уровня на 10 нг/мл приводит к увеличению частоты развития саркопении в 1,5 раза в течение последующих 5 лет. Однако результаты рандомизированных контролируемых исследований не смогли установить патогенетическую роль витамина D в развитии заболеваний мышечной системы [23].
Так, снижение его уровня на 10 нг/мл приводит к увеличению частоты развития саркопении в 1,5 раза в течение последующих 5 лет. Однако результаты рандомизированных контролируемых исследований не смогли установить патогенетическую роль витамина D в развитии заболеваний мышечной системы [23].
Было показано, что прием витамина D в дозе от 700 до 800 МЕ/день повышает прочность мышц и костей, снижает риск падений, переломов бедренной кости и смертности, однако оптимальная доза приема витамина D все еще остается неопределенной. Европейское общество по клиническим и экономическим аспектам остеопороза, остеоартрита и скелетно-мышечных заболеваний (ESCEO) также оценивает адекватное потребление витамина D в 800 МЕ/день для поддержания сывороточного уровня 25-гидроксивитамина D>30 нг/мл (50 нмоль/л) [18]. Баланс между витамином D и паратиреоидным гормоном (ПТГ) является ключевым регулятором мышечной силы: ПТГ способен модулировать работу мышечной ткани через увеличение внутриклеточного кальция.
Лечение и профилактика саркопении
В настоящее время отсутствует специфическое лечение саркопении, первичной является профилактика. Физические упражнения, особенно постепенно увеличивающиеся силовые нагрузки, являются стимулом для синтеза мышечного белка. Выполнение физических упражнений в течение минимум 20 минут в неделю значительно повышает мышечную и костную массу, силу, снижает функциональные ограничения, предотвращает падения и переломы у пожилых людей. Однако у пациентов с тяжелыми сопутствующими заболеваниями (такими как нейрокогнитивные и сердечные-сосудистые патологии) могут возникнуть сложности в достижении рекомендуемого уровня физической активности [18].
В ходе мета-анализа, включившего 37 исследований, 34 рандомизированных клинических исследования, оценивали влияние физических упражнений на мышечную массу у пожилых людей (почти в 80% случаев мышечная масса увеличилась с помощью физических упражнений). Влияние дополнительного питания на мышечную массу было зафиксировано только в 23,5% случаев. Мышечная сила увеличилась в 82,8% исследований после повышения физической активности, а пищевые добавки показали дополнительные преимущества только в небольшом количестве исследований (22,8%). Таким образом, физические упражнения оказывают положительное влияние на мышечную массу и силу или физическую работоспособность у здоровых лиц в возрасте от 60 лет и старше [24].
Мышечная сила увеличилась в 82,8% исследований после повышения физической активности, а пищевые добавки показали дополнительные преимущества только в небольшом количестве исследований (22,8%). Таким образом, физические упражнения оказывают положительное влияние на мышечную массу и силу или физическую работоспособность у здоровых лиц в возрасте от 60 лет и старше [24].
Белок пищи оказывает косвенное влияние на ключевые регуляторные белки и факторы роста, связанные со здоровьем мышц и костей, за счет увеличения абсорбции кальция, подавления ПТГ и увеличения секреции ИФР-I (костного и мышечного анаболического стимулятора). Потребление белка более 0,8 мг/кг массы тела в день, в основном животного происхождения, усиливает анаболизм мышечного белка наряду с защитой от возрастной потери мышц и костной ткани. У пациентов в возрасте 70–79 лет содержание белка в пище в количестве 1,1 г/кг массы тела в день приводит к отсутствию мышечной потери при 3-летнем наблюдении.
ESCEO рекомендует потребление белка с пищей от 1,0 до 1,2 г/кг массы тела в день, минимум 20–25 г чистого белка в каждой порции. Европейское общество клинического питания и обмена веществ (ESPEN) и Исследовательская группа PROT-AGE рекомендуют такое же потребление белка для здоровых людей старшего возраста, от 1,2 до 1,5 г/кг массы тела в день, а для пациентов с тяжелыми заболеваниями и недостаточным питанием – свыше 2 г/кг в сутки [18]. Пациенты с хронической болезнью почек (ХБП) додиализных стадий для профилактики саркопении должны снизить потребление белка до 0,2–0,5 г/кг в сутки (при СКФ <20 мл/мин/1,73 м²) вследствие возможного развития метаболического ацидоза [25]. Кроме того, потребление белка совместно с физическими упражнениями улучшает синтез мышечного белка и положительно влияет на состав тела, способствуя снижению жировой массы, увеличению или поддержанию мышечной ткани и сохранению кости [18] (табл. 2).
Таблица 2. Рекомендуемое количество потребления белка в сутки различным группам людей
Критерий | Количество потребляемого белка в сутки, г/кг массы тела |
Здоровые люди старшего возраста | 1,0–1,2 |
Пациенты с острыми и хроническими заболеваниями | 1,2–1,5 |
Саркопения первичная (пожилые пациенты с недостаточным питанием) | свыше 2 |
Пациенты с ХБП С5 (до начала гемодиализа) | 0,2–0,5 |
ХБП С1–3 А2 | не более 1,0 |
ХБП С1–3 А3 | 0,6–0,8 |
ХБП С4 | 0,6–0,8 |
ХБП С5 | 0,2–0,5 |
ХБП С5Д (гемодиализ) | не более 1,2 |
ХБП С5Д (перитонеальный диализ) | не более 1,4 |
ХБП (после трансплантации почки) | 0,8–1,0 |
Таким образом для профилактики развития саркопении следует придерживаться рекомендаций ESCEO об оптимальном потреблении белка c пищей 1,0–1,2 г/кг тела в день с содержанием по меньшей мере 20–25 г белка на каждый основной прием пищи, об адекватном потреблении витамина D 800 МЕ/сут, а также потреблении кальция в дозе 1000 мг/сут в сочетании с регулярными физическими упражнениями 3–5 раз в неделю [26].
Активно изучаются возможности патогенетического лечения саркопении. Рандомизированное клиническое исследование 2 фазы показало, что введение антител к миостатину приводит к увеличению аппендикулярной мышечной массы по сравнению с плацебо. Однако остаются нерешенными вопросы о клинической эффективности и безопасности этого метода лечения, поскольку миостатин также наблюдается в сердечной мышечной ткани и его ингибирование потенциально может привести к развитию кардиомиопатии. Исследование антител к миостатину все еще находится в экспериментальной фазе испытаний для оценки эффективности и безопасности данного лечения.
В экспериментальных условиях показано, что ACVR2B/Fc, блокатор рецептора активина 2B, сохраняет мышечную массу и увеличивает костную в животных моделях с несовершенным остеогенезом и мышечной дистрофией [27]. Применение цитруллина (непротеиногенная аминокислота), как показали исследования на крысах и молодых взрослых людях, увеличивает мышечную массу, синтез белка, а также липолиз в адипоцитах [28].
В результате экспериментального введения ГР мышам после длительной иммобилизации конечности наблюдалось увеличение мышечной массы, а введение ПТГ привело к улучшению микроархитектоники костей, повышению МПК. Комбинированная терапия ГР и ПТГ оказала более выраженное влияние на параметры костной ткани, не улучшив при этом показатели мышечной массы по сравнению с монотерапией ГР. Однако клинические исследования, проведенные на людях, не дали ожидаемого результата и по применению ГР: мышечная масса увеличилась незначительно [29, 30].
Различные другие фармакологические препараты, такие как тестостерон, ИФР-1, витамин D, ПТГ и т.д., оцениваются как потенциальные средства для лечения саркопении, однако необходимый эффект не был достигнут [18]. Таким образом, в настоящее время можно говорить только о профилактике данного состояния, в которую входят адекватные физические нагрузки и питание с достаточным потреблением белка.
Заключение
Наиболее изученным последствием саркопении является повышение смертности: метаанализ 17 исследований показал, что риск смерти в 4 раза выше у пациентов с саркопенией, риск снижения функциональных возможностей мышц или инвалидности в 3 раза выше, чем у лиц того же возраста без данного синдрома [3]. Это подчеркивает клиническую и социальную значимость саркопении, необходимость тщательного изучения данного состояния, поиск ее предикторов и эффективного лечения.
Это подчеркивает клиническую и социальную значимость саркопении, необходимость тщательного изучения данного состояния, поиск ее предикторов и эффективного лечения.
Дополнительная информация
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы внесли значимый вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
1. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing. 2010;39(4):412-423. doi: 10.1093/ageing/afq034.
2. Rosenberg I.H. Epidemiologic and methodologic problems in determining nutritional status of older persons. Proceedings of a conference. Albuquerque, New Mexico, October 19-21, 1988. Am. J. Clin. Nutr. 1989;50(5 Suppl):1121-1235.
3. Wright JM, Beaudart C, Zaaria M, et al. Health Outcomes of Sarcopenia: A Systematic Review and Meta-Analysis. PLoS One. 2017;12(1):e0169548. doi: 10.1371/journal.pone.0169548.
4. Morley JE, Anker SD, von Haehling S. Prevalence, incidence, and clinical impact of sarcopenia: facts, numbers, and epidemiology-update 2014. Journal of Cachexia, Sarcopenia and Muscle. 2014;5(4):253-259. doi: 10.1007/s13539-014-0161-y.
5. Safonova Y, Zotkin E, Lila A. Prevalence of sarcopenia in elderly northwestern region of the Russian Federation. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. p. 238. doi: 10.13140/RG.2.2.22677.01768
WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. p. 238. doi: 10.13140/RG.2.2.22677.01768
6. Scott D. Reducing the burden of sarcopenia: a healthy lifestyle throughout the lifetime D. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. p. 99.
7. Tan L-J, Liu S-L, Lei S-F, et al. Molecular genetic studies of gene identification for sarcopenia. Hum. Genet. 2011;131(1):1-31. doi: 10.1007/s00439-011-1040-7.
8. Ali S, Garcia JM. Sarcopenia, Cachexia and Aging: Diagnosis, Mechanisms and Therapeutic Options — A Mini-Review. Gerontology. 2014;60(4):294-305. doi: 10.1159/000356760.
9. Sayer AA, Robinson SM, Patel HP, et al. New horizons in the pathogenesis, diagnosis and management of sarcopenia. Age Ageing. 2013;42(2):145-150. doi: 10.1093/ageing/afs191.
10. Picca A, Calvani R, Bossola M, et al. Update on mitochondria and muscle aging: all wrong roads lead to sarcopenia. Biol. Chem. 2018;399(5):421-436. doi: 10.1515/hsz-2017-0331.
11. Radic M. Autoimmune sarcopenia – current knowledge and perspective. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р. 135
12. Barnouin Y, McPhee JS, Butler-Browne G, et al. Coupling between skeletal muscle fiber size and capillarization is maintained during healthy aging. Journal of Cachexia, Sarcopenia and Muscle. 2017;8(4):647-659. doi: 10.1002/jcsm.12194.
Coupling between skeletal muscle fiber size and capillarization is maintained during healthy aging. Journal of Cachexia, Sarcopenia and Muscle. 2017;8(4):647-659. doi: 10.1002/jcsm.12194.
13. Ji H-M, Han J, Won Y-Y. Sarcopenia and Osteoporosis. Hip & Pelvis. 2015;27(2):72. doi: 10.5371/hp.2015.27.2.72.
14. Турушева А.В., Фролова Е.В., Дегриз Я.-М. Расчет возрастных норм результатов кистевой динамометрии для здоровых людей старше 65 лет в Северо-Западном регионе России: результаты проспективного когортного исследования «Хрусталь» // Российский семейный врач. – 2017. – Т. 21. – №4. – С. 29-35. [Turusheva AV, Frolova EV, Degryse J-M. Development of reference ranges of handgrip strength among healthy adults 65+ in Northwest Russia: a prospective population-based cohort Crystal study. Russian Family Doctor. 2017;21(4):29-35. (In Russ.)] doi: 10.17816/rfd2017429-35.
15. Bauer J. M. Principles for the standardization of the assessment of muscle strength and power. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р. 75.
16. Rolland Y, Czerwinski S, van Kan GA, et al. Sarcopenia: Its assessment, etiology, pathogenesis, consequences and future perspectives. The Journal of Nutrition Health and Aging. 2008;12(7):433-450. doi: 10.1007/bf02982704.
17. Carnevale V, Castriotta V, Piscitelli PA, et al. Assessment of Skeletal Muscle Mass in Older People: Comparison Between 2 Anthropometry-Based Methods and Dual-Energy X-ray Absorptiometry. J. Am. Med. Dir. Assoc. 2018;19(9):793-796. doi: 10.1016/j.jamda.2018.05.016.
Dir. Assoc. 2018;19(9):793-796. doi: 10.1016/j.jamda.2018.05.016.
18. Hirschfeld HP, Kinsella R, Duque G. Osteosarcopenia: where bone, muscle, and fat collide. Osteoporos. Int. 2017;28(10):2781-2790. doi: 10.1007/s00198-017-4151-8.
19. Frisoli A. Clinical and biochemical phenotype of osteosarcopenia. WCO-IOF-ESCEO World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2017 March 23-26, Florence, Italy. Springer; 2017. р.106.
20. Sirola J, Kröger H. Similarities in Acquired Factors Related to Postmenopausal Osteoporosis and Sarcopenia. Journal of Osteoporosis. 2011;2011:1-14. doi: 10.4061/2011/536735.
21. Trierweiler H, Kisielewicz G, Hoffmann Jonasson T, et al. Sarcopenia: a chronic complication of type 2 diabetes mellitus. Diabetol. Metab. Syndr. 2018;10(1). doi: 10.1186/s13098-018-0326-5.
22. Perna S, Spadaccini D, Nichetti M, et al. Osteosarcopenic Visceral Obesity and Osteosarcopenic Subcutaneous Obesity, Two New Phenotypes of Sarcopenia: Prevalence, Metabolic Profile, and Risk Factors. Journal of Aging Research. 2018;2018:1-8. doi: 10.1155/2018/6147426.
23. Bruyère O. Vitamin D and muscle function. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р.124.
24. Beaudart C. Outcomes of the IOF-ESCEO sarcopenia working groups. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р.77-78.
World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р.77-78.
25. National Kidney F. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am. J. Kidney Dis. 2003;42(4 Suppl 3):S1-201.
26. Reginster J.-Y. Dairy products in the prevention and treatment of sarcopenia: outcomes of the ESCEO Working Groups. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р. 78.
27. Barreto R, Kitase Y, Matsumoto T, et al. ACVR2B/Fc counteracts chemotherapy-induced loss of muscle and bone mass. Sci. Rep. 2017;7(1). doi: 10.1038/s41598-017-15040-1.
28. Aubertin-Leheudre M. Citruline and muscle function. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р.124.
29. Brent MB, Brüel A, Thomsen JS. PTH (1–34) and growth hormone in prevention of disuse osteopenia and sarcopenia in rats. Bone. 2018;110:244-253. doi: 10.1016/j.bone.2018.02.017.
Возраст 70+ Как сохранить свое здоровье?
С возрастом состав нашего тела меняется: количество мышечной ткани снижается, мышцы уменьшаются в размерах, кости становятся более хрупкими и сильнее подвержены переломам, а количество жировой ткани увеличивается. Поскольку мышечная масса с возрастом уменьшается, энергии тоже нужно меньше и, следовательно, необходимо сократить питание.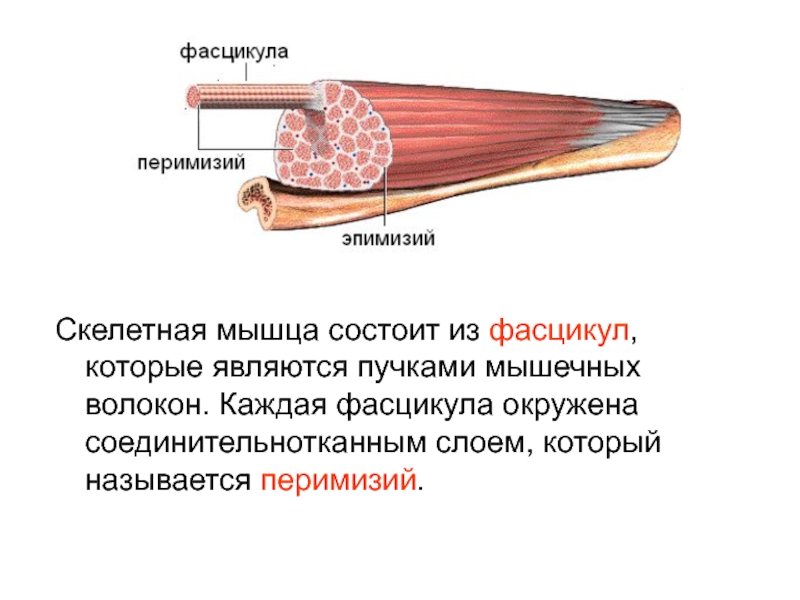
Кроме того, старение может привести к снижению физической активности. Чем меньше мы тренируемся, тем меньше нужно еды. Таким образом, с возрастом человеку необходимо меньше калорий, и очень важно, чтобы то, что он ест, содержало достаточное количество питательных веществ, таких как белки, витамины и минералы.
С возрастом хрупкость костей повышается. Они становятся менее плотными и в какой-то момент может развиться остеопороз. В этом случае шанс получить перелом костей возрастает в разы. Остеопороз особенно распространен у женщин в постменопаузе из-за гормональных изменений. Мужчины также страдают от остеопороза, но развивается он медленнее и в более старшем, чем у женщин, возрасте.
Позаботьтесь о своих костях: употребляйте достаточное количество кальция, который является наиболее важным строительным материалом для зубов и скелета. Много кальция содержится в молочных продуктах и сыре, а также в овощах, орехах и бобовых. Если вы по каким-то причинам не можете употреблять молочные продукты, то напитки из сои с добавлением кальция и витамина В12 могут стать хорошей альтернативой.
Принимайте витамин D, однако не забудьте предварительно проконсультироваться с врачом. Витамин D обеспечивает лучшее усвоение кальция. Наш организм может вырабатывать витамин D под воздействием на кожу солнечного света. Кроме того, он содержится в некоторых продуктах – в жирной рыбе, мясе и яйцах. Пожилым людям рекомендуется принимать 20 мкг дополнительного витамина D в день.
Не забывайте о физической активности. Движение и достаточные физические нагрузки улучшают качество и прочность костной ткани.
Потеря мышечной массы с возрастом называется саркопения. Скелетная мускулатура, её сила и масса, играет большую роль в сохранении здоровья и увеличении продолжительности активной жизни. В пожилом возрасте распад мышечных волокон происходит быстрее, чем их синтез. Основной причиной саркопении является старение, однако снижение физической активности и различные заболевания также играют роль. Процесс потери мышечной массы начинается в организме в возрасте 30 лет. Это процесс длительный, но спустя десятилетия он приводит к заметному уменьшению мышечной массы. После 70 лет саркопения может привести к тому, что человек не сможет подняться по лестнице или встать со стула.
Процесс потери мышечной массы начинается в организме в возрасте 30 лет. Это процесс длительный, но спустя десятилетия он приводит к заметному уменьшению мышечной массы. После 70 лет саркопения может привести к тому, что человек не сможет подняться по лестнице или встать со стула.
К сожалению, предотвратить уменьшение мышечной массы невозможно. Однако этот процесс можно значительно замедлить, если продолжать заниматься спортом и употреблять достаточное количество белка. Белком особенно богаты молочные продукты, рыба, мясо, яйца и заменители мяса — соевые бобы и тофу.
Известно, что физические упражнения снижают риск хронических заболеваний. В более старшем возрасте выполнение физических упражнений приводит к снижению риска переломов костей, повышению мышечной силы и сохранению скорости ходьбы. Также есть исследования, указывающие, что достаточная физическая активность в пожилом возрасте может снизить риск развития деменции и болезни Альцгеймера. Умеренные занятия спортом, по крайней мере 2,5 часа в неделю, благотворно скажутся на вашем здоровье. В качестве физической нагрузки можно ездить на велосипеде, заниматься скандинавской ходьбой, плавать или работать в саду.
Помочь укрепить кости и мышцы помогут также подъем по лестнице, быстрая ходьба и силовые тренировки минимум 2 раза в неделю. Определенные упражнения, например, тай-чи или йога, позволят обеспечить лучший баланс. И, наконец, постарайтесь не сидеть на месте слишком много. Прогулка вверх и вниз по лестнице, недолгий променад по району и даже короткое, но регулярное, передвижение по квартире, улучшит ваше самочувствие.
У многих пожилых людей с возрастом появляются проблемы с кишечником. Для здоровья желудочно-кишечного тракта важно пить достаточно воды и употреблять много клетчатки, которой богаты овощи, фрукты и цельнозерновые продукты — хлеб и макароны из цельнозерновой муки и коричневый рис.
Также с возрастом следует ограничить количество соли в рационе, чтобы предотвратить повышение кровяного давления и повреждение почек. Повышенное кровяное давление увеличивает риск развития сердечно-сосудистых заболеваний. Функция почек ухудшается с возрастом, что приводит к худшему выведению соли из организма.
Важно также пить достаточно воды для нормальной работы почек и кишечника. Особенно важно следить за употреблением воды в жаркую погоду.
Если вам 70+ и вы хотите похудеть, то не стоит заниматься этим самостоятельно. Обязательно обратитесь к врачу и худейте под его контролем.
А если вы теряете вес? Это может быть из-за того, что вы чаще болеете, у вас плохой аппетит, ухудшились обоняние и вкус, вы быстрее насыщаетесь, уменьшилось чувство жажды или возникли проблемы с жеванием и глотанием.
Когда вы худеете, вы получаете слишком мало энергии и питательных веществ. Тогда организм начинает использовать запасы, представленные жировой и мышечной тканями наш организма, то есть фактически вы теряете жир и мышцы. Потеря мышечной массы особенно опасна, ведь это может привести к появлению новых сложностей в повседневной жизни. При потере мышечной массы увеличивается вероятность падения, быстрее появляется чувство усталости, снижается аппетит, повышается риск и заболеваний и тяжесть их протекания, раны заживают хуже, а также требуется больше времени для выздоровления.
Следите за своим весом и обратитесь к врачу, если потеряли без приложения каких-либо усилий более 1 кг за месяц или более 3 кг за последние шесть месяцев.
Протеом человека в скелетных мышцах
Основная функция скелетных мышц — сокращение, которое обеспечивает устойчивость и движение тела. Скелетная мышца состоит из поперечно-полосатых мышечных клеток, которые сливаются в длинные мышечные волокна. Анализ транскриптома показывает, что 70% (n = 13839) всех белков человека (n = 19670) экспрессируются в скелетных мышцах, и 907 из этих генов демонстрируют повышенную экспрессию в скелетных мышцах по сравнению с другими типами тканей.
- 907 повышенных генов
- 111 обогащенных генов
- 202 групповых обогащенных гена
- Скелетная мышца имеет наибольшую групповую экспрессию генов, общих с языком
Транскриптом скелетных мышц
Анализ транскриптома скелетных мышц может быть визуализирован в отношении специфичности и распределения транскрибируемых молекул мРНК (рис. 1).Специфичность показывает количество генов с повышенной или не повышенной экспрессией в скелетных мышцах по сравнению с другими тканями. Повышенное выражение включает три подкатегории типа повышенного выражения:
- Обогащенная ткань: как минимум в четыре раза выше уровень мРНК в скелетных мышцах по сравнению с любыми другими тканями.
- Обогащенная группа: по крайней мере, в четыре раза выше средний уровень мРНК в группе из 2-5 тканей по сравнению с любой другой тканью.
- Улучшенная ткань: как минимум в четыре раза выше уровень мРНК в скелетных мышцах по сравнению со средним уровнем во всех других тканях.
Распределение, с другой стороны, показывает, сколько генов имеет или не имеет обнаруживаемых уровней (NX≥1) транскрибированных молекул мРНК в скелетных мышцах по сравнению с другими тканями. Как видно из Таблицы 1, все гены, повышенные в скелетных мышцах, классифицируются как:
- Обнаружено в одиночном: обнаружено в отдельной ткани
- Обнаружен в некоторых: Обнаружен более чем в одной, но менее чем в одной трети тканей
- Обнаружен во многих: Обнаружен по крайней мере в трети, но не во всех тканях
- Обнаружен во всех: Обнаружен во всех тканях
Рисунок 1.(A) Распределение всех генов по пяти категориям на основе специфичности транскрипта в скелетных мышцах, а также во всех других тканях. (B) Распределение всех генов по шести категориям на основе обнаружения транскриптов (NX? 1) в скелетных мышцах, а также во всех других тканях.
Как показано на рисунке 1, 907 генов демонстрируют некоторый уровень повышенной экспрессии в скелетных мышцах по сравнению с другими тканями. Три категории генов с повышенной экспрессией в скелетных мышцах по сравнению с другими органами показаны в таблице 1.В таблице 2 определены 12 генов с наибольшим обогащением скелетных мышц.
Таблица 1. Количество генов в подразделяемых категориях повышенной экспрессии в скелетных мышцах.
Таблица 2. 12 генов с наивысшим уровнем экспрессии в скелетных мышцах. «Тканевое распределение» описывает обнаружение транскрипта (NX? 1) в скелетных мышцах, а также во всех других тканях. «мРНК (ткань)» показывает уровень транскрипта в скелетных мышцах в виде значений NX.«Оценка тканевой специфичности (TS)» соответствует кратному изменению между уровнем экспрессии в скелетных мышцах и тканях со вторым по величине уровнем экспрессии.
| Ген | Описание | Распределение тканей | мРНК (ткань) | Оценка тканевой специфичности |
|---|---|---|---|---|
| IDI2 | изопентенил-дифосфат-дельта-изомераза 2 | Обнаружен в некоторых | 141.6 | 125 |
| DUPD1 | фосфатаза с двойной специфичностью и домен произомеразы, содержащий 1 | Обнаружен в одиночном | 38,9 | 71 |
| МХ2 | тяжелая цепь миозина 1 | Обнаружен в некоторых | 428,9 | 31 |
| LRRC30 | богатый лейцином повтор, содержащий 30 | Обнаружен в одиночном | 18.7 | 30 |
| МХ5 | тяжелая цепь миозина 4 | Обнаружен в одиночном | 15,1 | 29 |
| SMTNL1 | Smoothelin как 1 | Обнаружен в некоторых | 118,9 | 28 |
| ACTN3 | актинин альфа 3 (ген / псевдоген) | Обнаружен в некоторых | 185,5 | 24 |
| PPP1R27 | Регуляторная субъединица протеинфосфатазы 1 27 | Обнаружен в некоторых | 211.0 | 22 |
| MYADML2 | маркер дифференцировки, связанный с миелоидом, такой как 2 | Обнаружен в некоторых | 44,5 | 20 |
| АНКРД23 | анкириновый повторяющийся домен 23 | Обнаружен в некоторых | 184,5 | 15 |
| UCP3 | разобщающий белок 3 | Обнаружен в некоторых | 99.6 | 15 |
| CHRNA10 | холинергический рецептор никотиновая альфа 10 субъединица | Обнаружен в некоторых | 33,6 | 15 |
Повышенная экспрессия белков в скелетных мышцах
Углубленный анализ повышенных генов в скелетных мышцах с использованием профилей белков на основе антител позволил нам визуализировать паттерны экспрессии этих белков в различных функциональных компартментах, включая белки, связанные с i) сокращением, ii) функцией кальция и iii) ферментативной активностью. .
Белки, связанные с сокращением, экспрессируются в скелетных мышцах
Первичные структурные белки в скелетных миоцитах, связанные с сокращением, — это миозиновые и актиновые филаменты, образующие полосатый рисунок, который можно наблюдать при электронной микроскопии. Другое семейство белков, связанных с мышечным сокращением, — это семейство тропонинов, регулирующих связывание миозина с актином через конформационные изменения, зависящие от концентрации ионов кальция в клетках. Примеры членов семейств миозина и тропонина, экспрессируемых исключительно в скелетных мышцах, включают MYh3 и TNNT1, при этом MYh3 экспрессируется в быстрых (тип II) волокнах, а TNNT1 — в медленных (тип I) волокнах.Другим примером белка, участвующего в сокращении скелетных мышц, является миозинсвязывающий белок MYBPC1, который влияет на сокращение за счет образования поперечных мостиков в саркомере.
MYh3
TNNT1
MYBPC1
Белки, связанные с функцией кальция, экспрессируются в скелетных мышцах
Как в сердце, так и в скелетных мышцах сокращение зависит от уровня внутриклеточного кальция.Однако, в отличие от кардиомиоцитов, где высвобождение кальция регулируется посредством связывания ионов кальция из внешней среды с потенциалозависимыми кальциевыми каналами, скелетные миоциты хранят кальций в саркоплазматическом ретикулуме до тех пор, пока нейрональный импульс не вызовет приток кальция вдоль миофиламентов. Три примера, связанных с функцией кальция с избирательной экспрессией в скелетных мышцах, — это RYR1, CASQ1 и JPh2. RYR1 — это рецептор рианодина, действующий как канал высвобождения кальция, в то время как CASQ1 необходим для хранения кальция в саркоплазматическом ретикулуме.JPh2 способствует функциональному взаимодействию между клеточной поверхностью и внутриклеточными каналами высвобождения кальция.
RYR1
CASQ1
JPh2
Белки, связанные с ферментативной активностью, экспрессируемой в скелетных мышцах
Ферментативная активность — важная функция физиологии скелетных мышц, которая связана с различными процессами, такими как метаболизм, накопление и регенерация гликогена.Примеры трех белков, участвующих в ферментативной активности с избирательной экспрессией в скелетных мышцах, включают AMPD1, PYGM и ENO3. AMPD1 — это фермент, участвующий в пуриновом нуклеотидном цикле, и он играет решающую роль в энергетическом обмене, в то время как фермент PYGM необходим для метаболизма углеводов и гликогенолиза. ENO3 — это изофермент, который, как предполагается, играет роль в развитии и регенерации мышц, с мутациями, связанными с болезнью накопления гликогена.
AMPD1
PYGM
ENO3
Экспрессия гена разделяется между скелетными мышцами и другими тканями
В скелетных мышцах экспрессируется 202 гена, обогащенных группами.Обогащенные группы гены определяются как гены, показывающие в 4 раза более высокий средний уровень экспрессии мРНК в группе из 2-5 тканей, включая скелетные мышцы, по сравнению со всеми другими тканями.
Чтобы проиллюстрировать связь ткани скелетных мышц с другими типами тканей, был создан сетевой график, отображающий количество генов с общей экспрессией между различными типами тканей.
Рис. 2. Интерактивный сетевой график обогащенных и группированных генов скелетных мышц, связанных с их соответствующими обогащенными тканями (серые круги).Красные узлы представляют количество генов, обогащенных скелетными мышцами, а оранжевые узлы представляют количество генов, обогащенных группой. Размеры красных и оранжевых узлов связаны с количеством генов, отображаемых в узле. На каждый узел можно щелкнуть мышью, и в результате отображается список всех обогащенных генов, связанных с выделенными краями. Сеть ограничена групповыми обогащенными генами в комбинациях до 5 тканей, но полученные списки показывают полный набор групповых обогащенных генов в конкретной ткани.
Скелетные мышцы разделяют большую часть экспрессии генов, обогащенных группой, с сердцем, что ожидается, поскольку и сердце, и скелетные мышцы являются поперечнополосатыми мышцами со многими сходными чертами. Двумя примерами белков с общей экспрессией в сердце и скелетных мышцах являются MYH7 и LDB3. MYH7 связан с сокращением и показывает дифференциальную экспрессию между медленными (тип I) и быстрыми (тип II) мышечными волокнами. LDB3 участвует в организации саркомеров и отчетливо экспрессируется в Z-дисках сердца.
MYH7 — скелетная мышца
MYH7 — сердечная мышца
LDB3 — скелетная мышца
LDB3 — сердечная мышца
Скелетная мышца — один из крупнейших органов человеческого тела, и до 50% общей массы тела составляют скелетные мышцы. Основная функция скелетных мышц — сокращение, которое приводит к движению тела, но также необходимо для осанки и устойчивости тела.В отличие от сердечной мышцы, другой поперечно-полосатой мышцы, похожей по структуре, сокращение скелетных мышц находится под произвольным контролем и инициируется импульсами из мозга. Еще одна важная функция скелетных мышц — регулирование температуры тела. Тепло выделяется, когда мышцы сокращаются и вызывают расширение кровеносных сосудов кожи. Таким образом, скелетные мышцы также участвуют в регуляции кровотока.
Скелетные мышцы вместе с сердечной мышцей состоят из поперечно-полосатой мышечной ткани, образующей параллельные мышечные волокна.Поперечно-полосатая мышечная ткань состоит из миоцитов, расположенных в виде длинных и тонких многоядерных волокон, которые пересекаются правильным рисунком из тонких красных и белых линий, что придает мышце ее характерный вид и ее название. Существует два типа мышечных волокон (быстрые и медленные) в зависимости от типа присутствующего миозина. Эти типы волокон невозможно различить при обычном окрашивании гематоксилин-эозином (НЕ).
Развитие и нормальная деятельность скелетных мышц зависят от нервной системы и тесно связаны с ней.Скелетные мышцы прикрепляются к кости и сокращаются добровольно (посредством нервной стимуляции), в отличие от других распространенных типов мышц, то есть сердечной мышцы и гладкой мышцы.
Основным типом клеток скелетных мышц является миоцит. Миоциты сливаются во время развития, образуя большие многоядерные клетки, называемые синцитиями. Клетки богаты митохондриями и в значительной степени содержат белки актина и миозина, расположенные в повторяющихся единицах, называемых саркомерами. Гистологически это высокоструктурированное расположение саркомеров выглядит как темные (A-полосы) и светлые (I-полосы) полосы, которые хорошо видны на микроскопическом изображении.Помимо мышечных волокон, скелетные мышцы также состоят из прилегающих полос соединительной и жировой ткани. Ткань скелетных мышц сильно васкуляризована с тонкой сетью капилляров, проходящих между волокнами.
Используя световую микроскопию и иммуноокрашивание, мы можем детально изучить и визуализировать сложность скелетных мышц. На видео ниже скелетные мышцы показаны красным цветом, а сложная сеть нервов — бирюзовым. Полная версия видео находится здесь.
Гистологию скелетных мышц человека, включая подробные изображения и информацию о различных типах клеток, можно просмотреть в гистологическом словаре белкового атласа.
Здесь описаны и охарактеризованы гены, кодирующие белок, экспрессируемые в скелетных мышцах, вместе с примерами иммуногистохимически окрашенных срезов ткани, которые визуализируют соответствующие паттерны экспрессии белков генов с повышенной экспрессией в скелетных мышцах.
Профилирование транскриптов было основано на комбинации трех наборов данных транскриптомики (HPA, GTEx и FANTOM5, что соответствует в общей сложности 483 образцам из 37 различных типов нормальных тканей человека. Использовалось окончательное согласованное нормализованное значение экспрессии (NX) для каждого типа ткани) для классификации всех генов в соответствии с тканеспецифической экспрессией на две разные категории на основе специфичности или распределения.
Uhlén M et al., Тканевая карта протеома человека. Science (2015)
PubMed: 25613900 DOI: 10.1126 / science.1260419
Yu NY et al., Дополнительная характеристика ткани путем интеграции профилей транскриптомов из Атласа белков человека и консорциума FANTOM5. Nucleic Acids Res. (2015)
PubMed: 26117540 DOI: 10.1093 / nar / gkv608
Fagerberg L et al., Анализ тканеспецифической экспрессии человека путем полногеномной интеграции транскриптомики и протеомики на основе антител. Протеомика клеток Mol. (2014)
PubMed: 24309898 DOI: 10.1074 / mcp.M113.035600
Lindskog C et al., Протеомы сердечных и скелетных мышц человека, определенные с помощью транскриптомики и профилирования на основе антител. BMC Genomics. (2015)
PubMed: 26109061 DOI: 10.1186 / s12864-015-1686-y
Гистологический словарь — скелетные мышцы
Скелетные мышцы как предпочтительная экспериментальная модель для изучения старения и омоложения тканей | Скелетная мышца
Toh WS, Brittberg M, Farr J, Foldager CB, Gomoll AH, Hui JHP и др. Клеточное старение при старении и остеоартрите. Acta Orthop. 2016; 87: 6–14.
PubMed PubMed Central Статья Google Scholar
Милхолланд Б., Сух Ю., Виджг Дж. Мутация и катастрофа в стареющем геноме. Exp Gerontol. 2017; 94: 34–40.
CAS PubMed PubMed Central Статья Google Scholar
Austad SN, Hoffman JM. Повсеместно ли антагонистическая плейотропия встречается в биологии старения? Evol Med Public Health. 2018; 2018: 287–94.
PubMed PubMed Central Статья Google Scholar
van den Heuvel J, English S, Uller T. Теория одноразовой сомы и эволюция материнского воздействия на старение. PLoS One. 2016; 11: e0145544 [цитировано 31 мая 2019 г.] Доступно по адресу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709080/.
PubMed PubMed Central Статья CAS Google Scholar
Kaushik S, Cuervo AM. Протеостаз и старение. Nat Med. 2015; 21: 1406–15.
CAS PubMed Статья Google Scholar
Блэкберн Э. Х., Эпель Э. С., Лин Дж. Биология теломер человека: способствующий и взаимодействующий фактор в старении, рисках заболеваний и защите. Наука. 2015; 350: 1193–8.
CAS PubMed Статья Google Scholar
Conboy IM, Conboy MJ, Wagers AJ, Girma ER, Weissman IL, Rando TA.Омоложение старых клеток-предшественников путем воздействия молодой системной среды. Природа. 2005; 433: 760–4.
CAS PubMed Статья Google Scholar
Брак А.С., Конбой М.Дж., Рой С., Ли М., Куо С.Дж., Келлер С. и др. Повышенная передача сигналов Wnt во время старения изменяет судьбу мышечных стволовых клеток и увеличивает фиброз. Наука. 2007; 317: 807–10.
CAS PubMed Статья Google Scholar
Villeda SA, Luo J, Mosher KI, Zou B, Britschgi M, Bieri G, et al. Системная среда старения негативно регулирует нейрогенез и когнитивные функции. Природа. 2011; 477: 90–4.
CAS PubMed PubMed Central Статья Google Scholar
Конбой И.М., Конбой М.Дж., Ребо Дж. Системные проблемы: взгляд на старение и омоложение стволовых клеток. Старение (Олбани, штат Нью-Йорк). 2015; 7: 754–65.
CAS Статья Google Scholar
Конбой И.М., Рандо Т.А. Гетерохронный парабиоз для изучения влияния старения на стволовые клетки и их ниши. Клеточный цикл. 2012; 11: 2260–7.
CAS PubMed PubMed Central Статья Google Scholar
Наваррете-Рейес А.П., Сото-Перес-де-Селис Э., Хуррия А. Рак и старение: сложная биологическая ассоциация. Rev Investigation Clin. 2016; 68: 17–24.
CAS Google Scholar
Лопес-Отин С., Бласко М.А., Партридж Л., Серрано М., Кремер Г. Признаки старения. Клетка. 2013; 153: 1194–217.
PubMed PubMed Central Статья CAS Google Scholar
Конбой И.М., Рандо Т.А. Старение, стволовые клетки и регенерация тканей: уроки мышц. Клеточный цикл. 2005; 4: 407–10.
CAS PubMed Статья Google Scholar
Hardeland R. Старение, мелатонин и про- и противовоспалительные сети. Int J Mol Sci. 2019; 20: 1223.
CAS PubMed Central Статья PubMed Google Scholar
Садыги Аха А.А. Старение и иммунная система: обзор. J Immunol Methods. 2018; 463: 21–6.
CAS PubMed Статья Google Scholar
Эриксон М.А., Бэнкс, Вашингтон.Возрастные изменения иммунной системы и крови — барьерные функции мозга. Int J Mol Sci. 2019; 20: 1632.
CAS PubMed Central Статья PubMed Google Scholar
Fougère B, Boulanger E, Nourhashémi F, Guyonnet S, Cesari M. Хроническое воспаление: ускоритель биологического старения. J Gerontol A Biol Sci Med Sci. 2017; 72: 1218–25.
PubMed Статья CAS Google Scholar
Prattichizzo F, Micolucci L, Cricca M, De Carolis S, Mensà E, Ceriello A, et al. Иммуномодуляция на основе экзосом во время старения: наноперспектива воспаления-старения. Mech Aging Dev. 2017; 168: 44–53.
CAS PubMed Статья Google Scholar
Сюй Д., Тахара Х. Роль экзосом и микроРНК в старении и старении. Adv Drug Deliv Rev.2013; 65: 368–75.
CAS PubMed Статья Google Scholar
Nanayakkara S, Marwick TH, Kaye DM. Старение сердца: системное и коронарное кровообращение. Сердце. 2018; 104: 370–6.
CAS PubMed Статья Google Scholar
Нагата К., Ямадзаки Т., Такано Д., Маеда Т., Фудзимаки Ю., Накасе Т. и др. Церебральное кровообращение при старении. Aging Res Rev. 2016; 30:49.
PubMed Статья Google Scholar
Эпштейн С.Е., Лассанс-Соарес Р.М., Фабер Дж.Э., Бернетт М.С.Влияние старения на коллатеральное кровообращение и терапевтические последствия. Тираж. 2012; 125: 3211–9.
PubMed Статья Google Scholar
Fabbri E, An Y, Zoli M, Simonsick EM, Guralnik JM, Bandinelli S, et al. Старение и бремя мультиморбидности: ассоциации с воспалительными и анаболическими гормональными биомаркерами. J Gerontol. 2015; 70: 63–70.
CAS Статья Google Scholar
Фудзисава К. Некоторые наблюдения за скелетной мускулатурой старых крыс. I. Гистологические аспекты. J Neurol Sci. 1974; 22: 353–66.
CAS PubMed Статья Google Scholar
Фудзисава К. Некоторые наблюдения за скелетной мускулатурой старых крыс. Часть 2. Тонкая морфология пораженных мышечных волокон. J Neurol Sci. 1975. 24: 447–69.
CAS PubMed Статья Google Scholar
Tomonaga M. Гистохимические и ультраструктурные изменения в скелетных мышцах человека старческого возраста. J Am Geriatr Soc. 1977; 25: 125–31.
CAS PubMed Статья Google Scholar
Марцетти Э., Левенбург К. Апоптоз скелетных мышц, саркопения и слабость в пожилом возрасте. Exp Gerontol. 2006; 41: 1234–8.
CAS PubMed Статья Google Scholar
Aiken J, Bua E, Cao Z, Lopez M, Wanagat J, McKenzie D, et al. Делеционные мутации митохондриальной ДНК и саркопения. Ann N Y Acad Sci. 2002; 959: 412–23.
CAS PubMed Статья Google Scholar
Szczesny B, Tann AW, Mitra S. Возрастные и тканеспецифические изменения активности эксцизионной репарации митохондриальных и ядерных оснований ДНК у мышей: восприимчивость скелетных мышц к окислительному повреждению. Mech Aging Dev. 2010; 131: 330–7.
CAS PubMed PubMed Central Статья Google Scholar
Крейлинг Дж. А., Тамамори-Адачи М., Секстон А. Н., Джеяпалан Дж. К., Муньос-Наджар Ю., Петерсон А. Л. и др. Возрастное увеличение гетерохроматиновых меток в тканях мышей и приматов. Ячейка старения. 2011; 10: 292–304.
CAS PubMed Статья Google Scholar
Ярашески К.Е., Пак-Лодука Дж., Хастен Д.Л., Оберт К.А., Браун М.Б., Sinacore DR.Тренировки с отягощениями увеличивают скорость синтеза смешанного мышечного белка у ослабленных женщин и мужчин старше 76 лет. Am J Phys. 1999; 277: E118–25.
CAS Google Scholar
Hasten DL, Pak-Loduca J, Obert KA, Yarasheski KE. Упражнения с отягощениями резко увеличивают скорость синтеза MHC и смешанного мышечного белка в возрасте 78–84 и 23–32 лет. Am J Physiol Endocrinol Metab. 2000; 278: E620–6.
CAS PubMed Статья Google Scholar
Wohlgemuth SE, Seo AY, Marzetti E, Lees HA, Leeuwenburgh C. Аутофагия и апоптоз скелетных мышц во время старения: эффекты ограничения калорий и упражнений на протяжении всей жизни. Exp Gerontol. 2010. 45: 138–48.
CAS PubMed Статья Google Scholar
Beregi E, Regius O, Hüttl T, Göbl Z. Возрастные изменения в клетках скелетных мышц. Z Gerontol. 1988. 21: 83–6.
CAS PubMed Google Scholar
Hütter E, Skovbro M, Lener B, Prats C, Rabøl R, Dela F и др. Окислительный стресс и митохондриальные нарушения можно отделить от накопления липофусцина в скелетных мышцах пожилого человека. Ячейка старения. 2007; 6: 245–56.
PubMed Статья CAS Google Scholar
Snow LM, Fugere NA, Thompson LV. Повышенное накопление конечного продукта гликирования и связанная с ним модификация белка в скелетных мышцах II типа с возрастом.J Gerontol A Biol Sci Med Sci. 2007; 62: 1204–10.
PubMed Статья Google Scholar
Ямагути Т., Араи Х, Катаяма Н., Исикава Т., Кикумото К., Атоми Ю. Возрастное увеличение нерастворимых, фосфорилированных малых белков теплового шока в скелетных мышцах человека. J Gerontol A Biol Sci Med Sci. 2007; 62: 481–9.
PubMed Статья Google Scholar
Драммонд MJ, Маккарти JJ, Sinha M, Spratt HM, Volpi E, Esser KA, et al.Старение и экспрессия микроРНК в скелетных мышцах человека: микрочип и биоинформатический анализ. Physiol Genomics. 2011; 43: 595–603.
CAS PubMed Статья Google Scholar
Cristea A, Qaisar R, Edlund PK, Lindblad J, Bengtsson E, Larsson L. Влияние старения и пола на пространственную организацию ядер в отдельных клетках скелетных мышц человека. Ячейка старения. 2010. 9: 685–97.
CAS PubMed Статья Google Scholar
Oh J, Lee YD, Wagers AJ. Старение стволовых клеток: механизмы, регуляторы и терапевтические возможности. Nat Med. 2014; 20: 870–80.
CAS PubMed PubMed Central Статья Google Scholar
Невес Дж., Соуза-Виктор П., Джаспер Х. Стратегии омоложения для лечения старения на основе стволовых клеток. Стволовая клетка клетки. 2017; 20: 161–75.
CAS PubMed PubMed Central Статья Google Scholar
Feige P, Brun CE, Ritso M, Rudnicki MA. Ориентация мышечных стволовых клеток на регенерацию при гомеостазе, старении и болезнях. Стволовая клетка клетки. 2018; 23: 653–64.
CAS PubMed PubMed Central Статья Google Scholar
Waltz TB, Fivenson EM, Morevati M, Li C, Becker KG, Bohr VA, et al. Саркопения, старение и перспективные интервенционные стратегии. Curr Med Chem. 2018; 25: 5588–96.
CAS PubMed PubMed Central Статья Google Scholar
Ларссон Л., Дегенс Х., Ли М., Сальвиати Л., Ли Ю.И., Томпсон В. и др. Саркопения: потеря мышечной массы и функции, связанная со старением. Physiol Rev.2019; 99: 427–511.
PubMed Статья Google Scholar
Далле С., Россмейслова Л., Коппо К. Роль воспаления в возрастной саркопении. Front Physiol. 2017; 8: 1045.
PubMed PubMed Central Статья Google Scholar
Снайдерс Т., Париз Г. Роль мышечных стволовых клеток в саркопении. Curr Opin Clin Nutr Metab Care. 2017; 20: 186.
CAS PubMed Статья Google Scholar
Laurent MR, Dedeyne L, Dupont J, Mellaerts B, Dejaeger M, Gielen E. Возрастная потеря костной массы и саркопения у мужчин. Maturitas. 2019; 122: 51–6.
PubMed Статья Google Scholar
Конбой И.М., Рандо Т.А.Регуляция передачи сигналов Notch контролирует активацию сателлитных клеток и детерминацию клеточной судьбы в постнатальном миогенезе. Dev Cell. 2002; 3: 397–409.
CAS PubMed Статья Google Scholar
Brack AS, Conboy IM, Conboy MJ, Shen J, Rando TA. Временное переключение с передачи сигналов notch на Wnt в мышечных стволовых клетках необходимо для нормального миогенеза взрослых. Стволовая клетка клетки. 2008; 2: 50–9.
CAS PubMed Статья Google Scholar
Конбой И.М., Конбой М.Дж., Смайт GM, Рандо Т.А. Notch-опосредованное восстановление регенеративного потенциала старых мышц. Наука. 2003. 302: 1575–7.
CAS PubMed Статья Google Scholar
Чаккалакал СП, Джонс К.М., Бассон М.А., Брак А.С. Старая ниша нарушает покой мышечных стволовых клеток. Природа. 2012; 490: 355–60.
CAS PubMed PubMed Central Статья Google Scholar
Price FD, von Maltzahn J, Bentzinger CF, Dumont NA, Yin H, Chang NC и др. Ингибирование передачи сигналов JAK-STAT стимулирует функцию взрослых сателлитных клеток. Nat Med. 2014; 20: 1174–81.
CAS PubMed PubMed Central Статья Google Scholar
Мауро А. Сателлитная клетка волокон скелетных мышц. J Biophys Biochem Cytol. 1961; 9: 493–5.
CAS PubMed PubMed Central Статья Google Scholar
Монтаррас Д. Прямая изоляция сателлитных клеток для регенерации скелетных мышц. Наука. 2005; 309: 2064–7.
CAS PubMed Статья Google Scholar
Mesires NT, Doumit ME. Пролиферация и дифференцировка сателлитных клеток во время постнатального роста скелетных мышц свиней. Am J Phys-Cell Phys. 2002; 282: C899–906.
CAS Google Scholar
Mau M, Oksbjerg N, Rehfeldt C. Создание и условия для роста и дифференцировки клеточной линии миобластов, полученных из полуперепончатой мышцы новорожденных поросят. In vitro Cell Dev Biol Anim. 2008; 44: 1–5.
PubMed Статья Google Scholar
Meech R, Gonzalez KN, Barro M, Gromova A, Zhuang L, Hulin J-A, et al. Barx2 экспрессируется в сателлитных клетках и необходим для нормального роста и регенерации мышц.Стволовые клетки. 2012; 30: 253–65.
CAS PubMed PubMed Central Статья Google Scholar
Аллен Р. Э., Шихан С. М., Тейлор Р. Г., Кендалл Т. Л., Райс Г. М.. Фактор роста гепатоцитов активирует покоящиеся сателлитные клетки скелетных мышц in vitro. J. Cell Physiol. 1995; 165: 307–12.
CAS PubMed Статья Google Scholar
Фукада С., Уэдзуми А., Икемото М., Масуда С., Сегава М., Танимура Н. и др.Молекулярная подпись покоящихся сателлитных клеток в скелетных мышцах взрослых. Стволовые клетки. 2007. 25: 2448–59.
CAS PubMed Статья Google Scholar
Gnocchi VF, White RB, Ono Y, Ellis JA, Zammit PS. Дальнейшая характеристика молекулярной сигнатуры покоящихся и активированных сателлитных мышечных клеток мыши. PLoS One. 2009; 4: e5205.
PubMed PubMed Central Статья CAS Google Scholar
Beauchamp JR, Heslop L, Yu DS, Tajbakhsh S, Kelly RG, Wernig A, et al. Экспрессия CD34 и Myf5 определяет большинство покоящихся сателлитных клеток скелетных мышц взрослых. J Cell Biol. 2000; 151: 1221–34.
CAS PubMed PubMed Central Статья Google Scholar
Болдрин Л., Мунтони Ф, Морган Дж. Действительно ли сателлитные клетки человека и мыши одинаковы? J Histochem Cytochem. 2010; 58: 941–55.
CAS PubMed PubMed Central Статья Google Scholar
Castiglioni A, Hettmer S, Lynes MD, Rao TN, Tchessalova D, Sinha I, et al. Выделение предшественников, которые проявляют миогенную / остеогенную бипотентность in vitro, путем сортировки активируемых флуоресценцией клеток из мышц плода человека. Отчеты о стволовых клетках. 2014; 2: 92–106.
CAS PubMed PubMed Central Статья Google Scholar
Ratajczak MZ, Majka M, Kucia M, Drukala J, Pietrzkowski Z, Peiper S, et al. Экспрессия функционального CXCR4 мышечными сателлитными клетками и секреция SDF-1 мышечными фибробластами связана с присутствием как мышечных предшественников в костном мозге, так и гемопоэтических стволовых / предшественников клеток в мышцах.Стволовые клетки. 2003; 21: 363–71.
CAS Статья Google Scholar
Шервуд Р.И., Кристенсен Дж.Л., Конбой И.М., Конбой М.Дж., Рандо Т.А., Вайсман И.Л. и др. Выделение миогенных предшественников взрослых мышей: функциональная гетерогенность клеток внутри и приживление скелетных мышц. Клетка. 2004. 119: 543–54.
CAS Статья Google Scholar
Чепмен М.Р., Балакришнан К., Ли Дж., Конбой М.Дж., Хуанг Х., Моханти С.К. и др.Сортировка отдельных сателлитных клеток из отдельных миофибрилл выявляет неоднородность маркеров клеточной поверхности и миогенной способности. Интегр Биол (Камб). 2013; 5: 692–702.
CAS Статья Google Scholar
Maesner CC, Almada AE, Wagers AJ. Установленные маркеры клеточной поверхности эффективно изолируют сильно перекрывающиеся популяции сателлитных клеток скелетных мышц с помощью сортировки клеток, активируемой флуоресценцией. Скелетная мышца. 2016; 6: 35 [Цитировано 31 мая 2019 г.] Доступно по адресу: https: // www.ncbi.nlm.nih.gov/pmc/articles/PMC5100091/.
PubMed PubMed Central Статья CAS Google Scholar
Buckingham M, Bajard L, Chang T, Daubas P, Hadchouel J, Meilhac S, et al. Формирование скелетной мускулатуры: от сомита до конечности. J Anat. 2003. 202: 59–68.
PubMed PubMed Central Статья Google Scholar
Корнелисон DDW, Филла М.С., Стэнли Х.М., Рапрэгер А.С., Олвин ББ.Синдекан-3 и синдекан-4 специфически маркируют сателлитные клетки скелетных мышц и участвуют в поддержании сателлитных клеток и регенерации мышц. Dev Biol. 2001; 239: 79–94.
CAS PubMed Статья Google Scholar
Сил П., Сабурин Л.А., Гиргис-Габардо А, Мансури А., Грусс П., Рудницки М.А. Pax7 необходим для спецификации миогенных сателлитных клеток. Клетка. 2000; 102: 777–86.
CAS PubMed Статья Google Scholar
Инь Х, Цена F, Рудницкий М.А. Клетки-сателлиты и ниша мышечных стволовых клеток. Physiol Rev.2013; 93: 23–67.
CAS PubMed PubMed Central Статья Google Scholar
Sacco A, Doyonnas R, Kraft P, Vitorovic S, Blau HM. Самообновление и разрастание одиночных пересаженных мышечных стволовых клеток. Природа. 2008; 456: 502–6.
CAS PubMed PubMed Central Статья Google Scholar
Саху А., Мамия Х., Шинде С.Н., Шейхи А., Винтер Л.Л., Во Н.В. и др. Связанное с возрастом снижение митохондриальной дисфункции клеток-предшественников α-Klotho и нарушение регенерации мышц. Nat Commun. 2018; 9: 4859.
CAS PubMed PubMed Central Статья Google Scholar
Джонс NC, Тайнер KJ, Nibarger L, Stanley HM, Cornelison DDW, Fedorov YV, et al. MAPK p38α / β функционирует как молекулярный переключатель для активации покоящейся сателлитной клетки.J Cell Biol. 2005. 169: 105–16.
CAS PubMed PubMed Central Статья Google Scholar
Мацуёси Ю., Акахоши М., Накамура М., Тацуми Р., Мизуноя В. Выделение и очистка сателлитных клеток от молодых крыс центрифугированием в градиенте плотности перколла. Методы Мол биол. 2019; 1889: 81–93.
CAS PubMed Статья Google Scholar
Рандо Т.А., Павлат Г.К., Блау Х.М. Судьба миобластов после трансплантации в зрелую мышцу. Exp Cell Res. 1995; 220: 383–389.
CAS PubMed Статья Google Scholar
Конбой М.Дж., Конбой И.М. Получение взрослых стволовых клеток / клеток-предшественников, связанных с мышечными волокнами. Методы Мол биол. 2010; 621: 149–63.
CAS PubMed Статья Google Scholar
Mehdipour M, Liu Y, Liu C, Kumar B, Kim D, Gathwala R, et al. Ключевые возрастные изменения в передаче сигналов, ответственные за снижение функции стволовых клеток. Subcell Biochem. 2018; 90: 119–43.
CAS PubMed Статья Google Scholar
Думит М.Э., Меркель РА. Условия выделения и культивирования миогенных сателлитных клеток свиней. Тканевая клетка. 1992; 24: 253–62.
CAS PubMed Статья Google Scholar
Заммит П.С., Партридж Т.А., Яблонька-Реувени З. Сателлитная клетка скелетных мышц: стволовые клетки, пришедшие с холода. J Histochem Cytochem. 2006; 54: 1177–91.
CAS PubMed Статья Google Scholar
Вэй Й, Ли Й, Чен С., Стулзель К., Кауфманн А.М., Альберс А.Э. Стволовые клетки, полученные из скелетных мышц человека, сохраняют свойства стволовых клеток после размножения в культуре миосферы. Exp Cell Res. 2011; 317: 1016–27.
CAS PubMed Статья Google Scholar
Chirieleison SM, Feduska JM, Schugar RC, Askew Y, Deasy BM. Популяции клеток человеческого мышечного происхождения, выделенные по разным скоростям адгезии: фенотип и вклад в регенерацию скелетных мышц у мышей Mdx / SCID. Tissue Eng Часть A. 2012; 18: 232–41.
CAS PubMed Статья Google Scholar
Ли Дж., Хан С., Кузен В., Конбой И.М. Возрастные функциональные эпигенетические изменения в p21 и p16 в активированных повреждением сателлитных клетках.Стволовые клетки. 2015; 33: 951–61.
PubMed PubMed Central Статья CAS Google Scholar
Кузен В., Хо М.Л., Десаи Р., Тхам А., Чен Р.Й., Кунг С. и др. Регенерационная способность старых мышечных стволовых клеток снижается без значительного накопления повреждений ДНК. PLoS One. 2013; 8: e63528.
PubMed PubMed Central Статья Google Scholar
Элабд К., кузен В., Упадхьяюла П., Чен Р. Ю., Чулджиан М. С., Ли Дж. И др. Окситоцин — это возрастной циркулирующий гормон, необходимый для поддержания и восстановления мышц. Nat Commun. 2014; 5: 4082.
CAS PubMed PubMed Central Статья Google Scholar
Паливал П., Пишеша Н, Виджая Д., Конбой И.М. Возрастное повышение уровня остеопонтина тормозит регенерацию скелетных мышц. Старение (Олбани, штат Нью-Йорк).2012; 4: 553–66.
CAS PubMed Central Статья PubMed Google Scholar
Christov C, Chrétien F, Abou-Khalil R, Bassez G, Vallet G, Authier FJ, et al. Мышечные сателлитные клетки и эндотелиальные клетки: близкие соседи и привилегированные партнеры. Mol Biol Cell. 2007; 18: 1397–409.
CAS PubMed PubMed Central Статья Google Scholar
Rocheteau P, Gayraud-Morel B, Siegl-Cachedenier I, Blasco MA, Tajbakhsh S. Субпопуляция взрослых стволовых клеток скелетных мышц сохраняет все цепочки матричной ДНК после деления клеток. Клетка. 2012; 148: 112–25.
CAS PubMed Статья Google Scholar
Verdijk LB, Snijders T., Drost M, Delhaas T., Kadi F, van Loon LJC. Клетки-сателлиты в скелетных мышцах человека; от рождения до преклонного возраста. Возраст (Дордр). 2014; 36: 545–57.
CAS Статья Google Scholar
Алмада А.Е., Ставки А.Дж. Молекулярная схема судьбы стволовых клеток при регенерации скелетных мышц, старении и болезнях. Nat Rev Mol Cell Biol. 2016; 17: 267–79.
CAS PubMed PubMed Central Статья Google Scholar
Шефер Дж., Раунер Дж., Яблонка-Реувени З., Бенаяху Д. Уменьшение количества сателлитных клеток и миогенной способности при старении можно уменьшить с помощью упражнений на выносливость.PLoS One. 2010; 5: e13307.
PubMed PubMed Central Статья CAS Google Scholar
Day K, Shefer G, Shearer A, Yablonka-Reuveni Z. Истощение сателлитных клеток скелетных мышц с возрастом сопровождается снижением способности одиночных предшественников производить резервное потомство. Dev Biol. 2010; 340: 330–43.
CAS PubMed PubMed Central Статья Google Scholar
Шефер Г., Ван де Марк Д. П., Ричардсон Дж. Б., Яблонка-Реувени З. Размер пула сателлитных клеток имеет значение: определение миогенной силы стареющих скелетных мышц. Dev Biol. 2006. 294: 50–66.
CAS PubMed PubMed Central Статья Google Scholar
Bosnakovski D, Xu Z, Li W, Thet S, Cleaver O, RCR P, et al. Перспективное выделение стволовых клеток скелетных мышц с помощью репортера Pax7. Стволовые клетки. 2008. 26: 3194–204.
CAS PubMed PubMed Central Статья Google Scholar
Соуза-Виктор П., Гутарра С., Гарсия-Прат Л., Родригес-Убрева Дж., Ортет Л., Руис-Бонилья В. и др. Гериатрические мышечные стволовые клетки переключают обратимое состояние покоя в старение. Природа. 2014; 506: 316–21.
CAS PubMed Статья Google Scholar
Brack AS, Муньос-Кановес П.Все плюсы и минусы старения мышечных стволовых клеток. Скелетная мышца. 2016; 6: 1 [Цитировано 31 октября 2019 г.] Доступно по адресу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4716636/.
PubMed PubMed Central Статья CAS Google Scholar
Brack AS, Rando TA. Внутренние изменения и внешние влияния на функцию миогенных стволовых клеток во время старения. Стволовые клетки Ред. 2007; 3: 226–37.
CAS PubMed Статья Google Scholar
Рандо Т.А., Блау Х.М. Первичная очистка миобластов мыши, характеристика и трансплантация для клеточно-опосредованной генной терапии. J Cell Biol. 1994; 125: 1275–87.
CAS PubMed Статья Google Scholar
Пьетросемоли Н., Мелла С., Йеннек С., Багдади М.Б., Сакаи Н., Самбасиван Р. и др. Сравнение нескольких транскриптомов выявляет унифицированные и различные характеристики покоящихся и активированных стволовых клеток скелетных мышц.Скелетная мышца. 2017; 7: 28.
PubMed PubMed Central Статья CAS Google Scholar
Bachman JF, Klose A, Liu W, Paris ND, Blanc RS, Schmalz M, et al. Для роста скелетных мышц в препубертатном периоде необходим вклад миоядерных клеток, экспрессирующих Pax7, сателлитных клеток. Разработка. 2018; 145: dev167197.
PubMed PubMed Central Статья CAS Google Scholar
Бишофф Р. Регенерация сателлитных клеток и мышц. Миология. 1994; [Цитировано 4 июня 2019 г.]; Доступно по ссылке: https://ci.nii.ac.jp/naid/10018625843/.
Snow MH. Влияние старения на сателлитные клетки в скелетных мышцах мышей и крыс. Cell Tissue Res. 1977; 185: 399–408.
CAS PubMed Статья Google Scholar
Гибсон М.К., Шульц Э. Распределение сателлитных клеток и их связь с конкретными типами волокон в камбаловидной мышце и длинном разгибателе пальцев.Анат Рек. 1982; 202: 329–37.
CAS PubMed Статья Google Scholar
Эгнер И.М., Брюусгаард Дж. К., Гундерсен К. Истощение сателлитных клеток предотвращает гипертрофию волокон в скелетных мышцах. Разработка. 2016; 143: 2898–906.
CAS PubMed Статья Google Scholar
Родригес Дж., Вернус Б., Челх И., Кассар-Малек И., Габиллард Дж. К., Хадж Сасси А. и др.Миостатин и сигнальные пути атрофии и гипертрофии скелетных мышц. Cell Mol Life Sci. 2014; 71: 4361–71.
CAS PubMed Статья Google Scholar
Мурач К.А., Фрай С.С., Кирби Т.Дж., Джексон Дж.Р., Ли Дж.Д., Уайт С.Х. и др. В главной или второстепенной роли? Регулировка размеров сателлитных клеток и волокон скелетных мышц. Физиология (Bethesda). 2018; 33: 26–38.
CAS Google Scholar
Маккарти Дж. Дж., Мула Дж., Миядзаки М., Эрфани Р., Гаррисон К., Фаруки А. Б. и др. Эффективная гипертрофия волокон в скелетных мышцах, лишенных сателлитных клеток. Разработка. 2011; 138: 3657–66.
CAS PubMed PubMed Central Статья Google Scholar
Murach KA, Confides AL, Ho A, Jackson JR, Ghazala LS, Peterson CA, et al. Истощение сателлитных клеток Pax7 + не влияет на адаптацию диафрагмы к бегу у молодых или старых мышей.J Physiol. 2017; 595: 6299–311.
CAS PubMed PubMed Central Статья Google Scholar
Фрай К.С., Ли Дж. Д., Джексон Дж. Р., Кирби Т. Дж., Стаско С. А., Лю Х. и др. Регулирование микросреды мышечных волокон активированными сателлитными клетками во время гипертрофии. FASEB J. 2014; 28: 1654–65.
CAS PubMed PubMed Central Статья Google Scholar
Лю В., Клозе А., Форман С., Париж Северная Дакота, Вей-Лапьер Л., Кортес-Лопес М. и др. Потеря взрослых стволовых клеток скелетных мышц приводит к возрастной дегенерации нервно-мышечных соединений. eLife. 2017; 6: e26464.
PubMed PubMed Central Статья Google Scholar
Коллинз С.А., Олсен И., Заммит П.С., Хеслоп Л., Петри А., Партридж Т.А. и др. Функция стволовых клеток, самообновление и неоднородность поведения клеток из ниши взрослых мышечных сателлитных клеток.Клетка. 2005; 122: 289–301.
CAS PubMed Статья Google Scholar
Харди Д., Беснар А., Латиль М., Джувион Дж., Бриан Д., Тепенье С. и др. Сравнительное исследование моделей травм для изучения регенерации мышц у мышей. PLoS One. 2016; 11 [цитировано 2 ноября 2019 г.] Доступно по адресу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4726569/.
PubMed PubMed Central Статья CAS Google Scholar
Бокхольд К.Дж., Розенблатт Д.Д., Партридж Т.А. Старение нормальной и дистрофической мышцы мыши: анализ миогенности в культурах живых одиночных волокон. Мышечный нерв. 1998. 21: 173–83.
CAS PubMed Статья Google Scholar
Collins CA, Zammit PS, Ruiz AP, Morgan JE, Partridge TA. Популяция миогенных стволовых клеток, которые выживают при старении скелетных мышц. Стволовые клетки. 2007. 25: 885–94.
CAS PubMed Статья Google Scholar
Бернет Дж. Д., Доулс Дж. Д., Холл Дж. К., Келли Танака К., Картер Т. А., Олвин Б. Б.. Передача сигналов p38 MAPK лежит в основе клеточно-автономной потери самообновления стволовых клеток в скелетных мышцах старых мышей. Nat Med. 2014; 20: 265–71.
CAS PubMed PubMed Central Статья Google Scholar
Cosgrove BD, Gilbert PM, Porpiglia E., Mourkioti F, Lee SP, Corbel SY, et al. Омоложение популяции мышечных стволовых клеток восстанавливает силу травмированных старых мышц.Nat Med. 2014; 20: 255–64.
CAS PubMed PubMed Central Статья Google Scholar
Тирни М.Т., Айдогду Т., Сала Д., Малекова Б., Гатто С., Пури П.Л. и др. Передача сигналов STAT3 контролирует расширение сателлитных клеток и восстановление скелетных мышц. Nat Med. 2014; 20: 1182–6.
CAS PubMed PubMed Central Статья Google Scholar
Доулз Дж., Сторер М., Коззуто Л., Рома Дж., Киз ВМ.Воспаление, связанное с возрастом, подавляет функцию эпидермальных стволовых клеток. Genes Dev. 2012; 26: 2144–53.
CAS PubMed PubMed Central Статья Google Scholar
Цзян Х., Тиан А., Цзян Дж. Ответ кишечных стволовых клеток на повреждение: уроки дрозофилы. Cell Mol Life Sci. 2016; 73: 3337–49.
CAS PubMed PubMed Central Статья Google Scholar
Чжан Р., Энглер А., Тейлор В. Нотч: интерактивный игрок в нейрогенезе и болезнях. Cell Tissue Res. 2018; 371: 73–89.
CAS PubMed Статья Google Scholar
Moparthi L, Koch S. Передача сигналов Wnt при воспалении кишечника. Дифференциация. 2019; 108: 24–32.
CAS PubMed Статья Google Scholar
Копан Р., Най Дж. С., Вайнтрауб Х.Внутриклеточный домен Notch мыши: конститутивно активированный репрессор миогенеза, направленный на основную область спираль-петля-спираль MyoD. Разработка. 1994; 120: 2385–96.
CAS PubMed Google Scholar
Шаубер С., Нофцигер Д., Хсие Дж.Д., Линдселл С., Бёглер О., Хейворд Д. и др. Передача сигналов Notch ингибирует дифференцировку мышечных клеток посредством CBF1-независимого пути. Разработка. 1996; 122: 3765–73.
CAS PubMed Google Scholar
Lindsell CE, Shawber CJ, Boulter J, Weinmaster G. Jagged: лиганд млекопитающих, который активирует Notch2. Клетка. 1995; 80: 909–17.
CAS PubMed Статья Google Scholar
Nofziger D, Miyamoto A, Lyons KM, Weinmaster G. Передача сигналов Notch накладывает два различных блока на дифференцировку миобластов C2C12. Разработка. 1999; 126: 1689–702.
CAS PubMed Google Scholar
Kuang S, Kuroda K, Le Grand F, Rudnicki MA. Асимметричное самообновление и обязательство сателлитных стволовых клеток в мышцах. Клетка. 2007; 129: 999–1010.
CAS PubMed PubMed Central Статья Google Scholar
Foster RF, Thompson JM, Kaufman SJ. Субстрат ламинина способствует миогенезу в культурах скелетных мышц крыс: анализ репликации и развития с использованием антидесмина и моноклональных антител против BrdUrd.Dev Biol. 1987; 122: 11–20.
CAS PubMed Статья Google Scholar
Ocalan M, Goodman SL, Kühl U, Hauschka SD, von der Mark K. Ламинин изменяет форму клеток и стимулирует подвижность и пролиферацию скелетных миобластов мышей. Dev Biol. 1988. 125: 158–67.
CAS PubMed Статья Google Scholar
Лукьяненко Л., Юнг М.Дж., Хегде Н., Перрюиссо-Карриер С., Мильявакка Е., Розо М. и др.Потеря фибронектина из ниши старых стволовых клеток влияет на регенеративную способность скелетных мышц у мышей. Nat Med. 2016; 22: 897–905.
CAS PubMed PubMed Central Статья Google Scholar
Трой А., Кадвалладер А.Б., Федоров Ю., Тайнер К., Танака К.К., Олвин Б.Б. Координация активации и самообновления сателлитных клеток за счет зависимой от Par-комплекса асимметричной активации p38α / β MAPK. Стволовая клетка клетки. 2012; 11: 541–53.
CAS PubMed PubMed Central Статья Google Scholar
Paris ND, Soroka A, Klose A, Liu W, Chakkalakal JV. Smad4 ограничивает дифференцировку, чтобы способствовать размножению предшественников, происходящих из сателлитных клеток, во время регенерации скелетных мышц. Вейджерс А.Дж., редактор. eLife. 2016; 5: e19484.
Садех М. Влияние старения на регенерацию скелетных мышц. J Neurol Sci. 1988. 87: 67–74.
CAS PubMed Статья Google Scholar
Хан В.М., Андерсон С.Е., Мохиуддин М., Баррос Д., Нахай С.А., Шин Э. и др. Синтетический матрикс усиливает приживление трансплантированных сателлитных клеток в дистрофических и старых скелетных мышцах с сопутствующей травмой. Sci Adv. 2018; 4: eaar4008.
CAS PubMed PubMed Central Статья Google Scholar
Tichy ED, Sidibe DK, Greer CD, Oyster NM, Rompolas P, Rosenthal NA, et al. Надежная мышь Pax7EGFP, которая позволяет визуализировать динамическое поведение мышечных стволовых клеток.Скелетная мышца. 2018; 8: 27.
PubMed PubMed Central Статья CAS Google Scholar
Cerletti M, Jang YC, Finley LWS, Haigis MC, Wagers AJ. Кратковременное ограничение калорий улучшает функцию стволовых клеток скелетных мышц. Стволовая клетка клетки. 2012; 10: 515–9.
CAS PubMed PubMed Central Статья Google Scholar
Day K, Shefer G, Richardson JB, Enikolopov G, Yablonka-Reuveni Z.Экспрессия репортера Nestin-GFP определяет состояние покоя сателлитных клеток скелетных мышц. Dev Biol. 2007; 304: 246–59.
CAS PubMed Статья Google Scholar
Монтаррас Д., Морган Дж., Коллинз С., Релеикс Ф, Заффран С., Кумано А. и др. Прямая изоляция сателлитных клеток для регенерации скелетных мышц. Наука. 2005; 309: 2064–7.
CAS PubMed Статья Google Scholar
Mourikis P, Sambasivan R, Castel D, Rocheteau P, Bizzarro V, Tajbakhsh S. Критическое требование для передачи сигналов notch в поддержании состояния покоящихся стволовых клеток скелетных мышц. Стволовые клетки. 2012; 30: 243–52.
CAS PubMed Статья Google Scholar
Boppart MD, Burkin DJ, Kaufman SJ. α7β1-Интегрин регулирует механотрансдукцию и предотвращает повреждение скелетных мышц. Am J Physiol-Cell Physiol. 2006; 290: C1660–5.
CAS PubMed Статья Google Scholar
Carlson BM, Faulkner JA. Трансплантация мышц между молодыми и старыми крысами: возраст хозяина определяет выздоровление. Am J Physiol-Cell Physiol. 1989; 256: C1262–6.
CAS Статья Google Scholar
Sinha M, Jang YC, Oh J, Khong D, Wu EY, Manohar R, et al. Восстановление системных уровней GDF11 обращает вспять возрастную дисфункцию скелетных мышц мышей.Наука. 2014; 344: 649–52.
CAS PubMed PubMed Central Статья Google Scholar
Ребо Дж., Мехдипур М., Гатвала Р., Кози К., Лю Й., Конбой М. Дж. И др. Однократный гетерохронный обмен крови показывает быстрое угнетение нескольких тканей старой кровью. Nat Commun. 2016; 7: 13363.
CAS PubMed PubMed Central Статья Google Scholar
Pratiwi YS, Lesmana R, Goenawan H, Sylviana N, Setiawan I, Tarawan VM, et al. Экстракт мускатного ореха увеличивает массу скелетных мышц у стареющих крыс частично за счет пути IGF1-AKT-mTOR и ингибирования аутофагии. Evid Based Complement Alternat Med. 2018; 2018: 2810840.
PubMed PubMed Central Статья Google Scholar
Hinken AC, Powers JM, Luo G, Holt JA, Billin AN, Russell AJ. Отсутствие доказательств того, что GDF11 как омолаживающее средство для сателлитных клеток старых скелетных мышц.Ячейка старения. 2016; 15: 582–4.
CAS PubMed PubMed Central Статья Google Scholar
McPherron AC, Huynh TV, Lee SJ. Избыточность функции миостатина и фактора роста / дифференцировки 11. BMC Dev Biol. 2009; 9: 24.
PubMed PubMed Central Статья CAS Google Scholar
Джинплонг Ф., Фалконер С.Дж., Томас М., Мэтьюз К.Г., Олдхэм Дж. М., Уотсон Т. и др.Фактор роста и дифференцировки-11 регулируется в скелетных мышцах и подавляет дифференцировку миобластов. OJMIP. 2012; 02: 127–38.
Артикул CAS Google Scholar
Mehdipour M, Etienne J, Chen C-C, Gathwala R, Rehman M, Kato C, et al. Омоложение мозга, печени и мышц путем одновременной фармакологической модуляции двух сигнальных детерминант, которые меняются с возрастом в противоположных направлениях. Старение (Олбани, штат Нью-Йорк).2019; 11: 5628–45.
PubMed Central PubMed Google Scholar
Эгерман М.А., Кадена С.М., Гилберт Дж. А., Мейер А., Нельсон Н. Н., Суолли С. Е. и др. GDF11 увеличивается с возрастом и подавляет регенерацию скелетных мышц. Cell Metab. 2015; 22: 164–74.
CAS PubMed PubMed Central Статья Google Scholar
McPherron AC, Lawler AM, Lee SJ.Регулирование формирования переднего / заднего паттерна осевого скелета с помощью фактора роста / дифференцировки 11. Nat Genet. 1999; 22: 260.
CAS PubMed Статья Google Scholar
Hammers DW, Merscham-Banda M, Hsiao JY, Engst S, Hartman JJ, Sweeney HL. Супрафизиологические уровни GDF11 вызывают атрофию поперечно-полосатых мышц. EMBO Mol Med. 2017; 9: 531–44.
CAS PubMed PubMed Central Статья Google Scholar
McPherron AC, Лоулер AM, Ли SJ. Регулирование массы скелетных мышц у мышей новым членом суперсемейства TGF-бета. Природа. 1997; 387: 83–90.
CAS PubMed Статья Google Scholar
Ли С.Дж., Ли И.С., Циммерс Т.А., Сулеймани А., Мацук М.М., Цучида К. и др. Регулирование мышечной массы фоллистатином и активинами. Мол Эндокринол. 2010; 24: 1998–2008.
CAS PubMed PubMed Central Статья Google Scholar
Ли И-С, Ли С-Дж. Регуляция активности GDF-11 и миостатина с помощью GASP-1 и GASP-2. Proc Natl Acad Sci U S. A. 2013; 110: E3713–22.
CAS PubMed PubMed Central Статья Google Scholar
Йокоэ Т., Омачи Т., Иноуэ Х, Мимори К., Танака Ф., Кусуноки М. и др. Клиническое значение фактора дифференциации роста 11 при колоректальном раке. Int J Oncol. 2007; 31: 1097–101.
CAS PubMed Google Scholar
Zhang Y, Pan L, Pang Y, Yang J, Lv M, Liu F и др. GDF11 / BMP11 как новый онкомаркер рака печени. Exp Ther Med. 2018; 15: 3495.
CAS PubMed PubMed Central Google Scholar
Чжан Дж., Ли Й, Ли Х, Чжу Б., Ван Л., Го Б. и др. GDF11 улучшает ангиогенную функцию EPC при диабетической ишемии конечностей. Сахарный диабет. 2018; 67: 2084–95.
CAS PubMed Статья Google Scholar
Ю Икс, Чен Х, Дун Чжэн Х, Чжан Дж., Чжао Х, Лю И и др. Фактор дифференцировки роста 11 способствует аномальной пролиферации и ангиогенезу эндотелиальных клеток легочной артерии. Гипертония. 2018; 71: 729 ГИПЕРТЕНЗИЯ AHA.117.10350.
CAS PubMed Статья Google Scholar
Гулас С, Кондер Р, Кноблич Я. Комплекс Par и интегрины направляют асимметричное деление клеток в стволовых клетках кишечника взрослых. Стволовая клетка клетки.2012; 11: 529–40.
CAS PubMed PubMed Central Статья Google Scholar
Urciuolo A, Quarta M, Morbidoni V, Gattazzo F, Molon S, Grumati P, et al. Коллаген VI регулирует самообновление сателлитных клеток и регенерацию мышц. Nat Commun. 2013; 4: 1964.
PubMed PubMed Central Статья CAS Google Scholar
Гилберт П.М., Хавенстрайт К.Л., Магнуссон КЕГ, Сакко А., Леонарди Н.А., Крафт П. и др.Эластичность субстрата регулирует самообновление стволовых клеток скелетных мышц в культуре. Наука. 2010; 329: 1078–81.
CAS PubMed PubMed Central Статья Google Scholar
Podleski TR, Greenberg I, Schlessinger J, Yamada KM. Фибронектин задерживает слияние миобластов L6. Exp Cell Res. 1979; 122: 317–26.
CAS PubMed Статья Google Scholar
Ямада М., Тацуми Р., Кикуири Т., Окамото С., Ноношита С., Мизуноя В. и др. Матричные металлопротеиназы участвуют в активации сателлитных клеток скелетных мышц, вызванной механическим растяжением. Мышечный нерв. 2006; 34: 313–9.
CAS PubMed Статья Google Scholar
Шимомура Т., Кондо Дж., Очиаи М., Нака Д., Миядзава К., Моримото Ю. и др. Активация зимогена активатора фактора роста гепатоцитов тромбином.J Biol Chem. 1993; 268: 22927–32.
CAS PubMed Google Scholar
Фрай К.С., Ли Дж. Д., Мула Дж., Кирби Т. Дж., Джексон Дж. Р., Лю Ф. и др. Индуцируемое истощение сателлитных клеток у взрослых малоподвижных мышей ухудшает способность к регенерации мышц, не влияя на саркопению. Nat Med. 2015; 21: 76–80.
CAS PubMed Статья Google Scholar
Лабат-Роберт Дж., Роберт Л.Взаимодействие между клетками и внеклеточным матриксом: передача сигналов интегринами и рецептором эластина-ламинина. В: Macieira-Coelho A, редактор. Передача сигналов через матрицу клеток. Берлин, Гейдельберг: Спрингер; 2000. с. 57–70. [Цитировано 29 октября 2019 г.]. https://doi.org/10.1007/978-3-642-59766-4_4.
Google Scholar
Matrbian LM. Металлопротеиназы и их ингибиторы в ремоделировании матрикса. : 5.
Thorsteinsdóttir S, Deries M, Cachaço AS, Bajanca F.Размер внеклеточного матрикса развития скелетных мышц. Dev Biol. 2011; 354: 191–207.
PubMed Статья CAS Google Scholar
Котари П., Пестана Р., Месрауа Р., Эльчаки Р., Хан КМФ, Данненберг А.Дж. и др. IL-6-опосредованная индукция MMP-9 модулируется JAK-зависимой экспрессией IL-10 в макрофагах. J Immunol. 2014; 192: 349 [цитировано 6 июля 2019 г.] Доступно по адресу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3872272/.
CAS PubMed Статья Google Scholar
Kherif S, Lafuma C, Dehaupas M, Lachkar S, Fournier J-G, Verdière-Sahuqué M, et al. Экспрессия матриксных металлопротеиназ 2 и 9 в регенерирующих скелетных мышцах: исследование на экспериментально поврежденных и поврежденных мышцах. Dev Biol. 1999; 205: 158–70.
CAS PubMed Статья Google Scholar
Ю Дж, Деуэл Т.Ф., Ким Х.Р.Рецептор-альфа фактора роста тромбоцитов (PDGF) активирует c-Jun Nh3-терминальную киназу-1 и противодействует фенотипической трансформации, индуцированной рецептором-бета-рецептором PDGF. J Biol Chem. 2000; 275: 19076–82.
CAS PubMed Статья Google Scholar
Филиппу А., Маридаки М., Кутсилиерис М. Роль активатора плазминогена урокиназного типа (uPA) и трансформирующего фактора роста бета 1 (TGFbeta1) в регенерации мышц. In Vivo.2008; 22: 735–50.
CAS PubMed Google Scholar
Маршалл П.А., Уильямс П.Е., Голдспинк Г. Накопление коллагена и измененные соотношения типов волокон как индикаторы аномальной экспрессии мышечных генов у мышей с дистрофией MDX. Мышечный нерв. 1989; 12: 528–37.
CAS PubMed Статья Google Scholar
Алексакис К., Партридж Т., Боу-Гариос Г.Участие сателлитных клеток в дистрофическом мышечном фиброзе: самовоспроизводящийся механизм перепроизводства коллагена. Am J Phys Cell Phys. 2007; 293: C661–9.
CAS Статья Google Scholar
Lacraz G, Rouleau A-J, Couture V, Söllrald T, Drouin G, Veillette N, et al. Повышенная жесткость старых скелетных мышц снижает пролиферативную активность клеток-предшественников мышц. PLoS One. 2015; 10: e0136217.
PubMed PubMed Central Статья CAS Google Scholar
Wood LK, Kayupov E, Gumucio JP, Mendias CL, Claflin DR, Brooks SV. Внутренняя жесткость внеклеточного матрикса в скелетных мышцах мышей увеличивается с возрастом. J Appl Physiol. 2014; 117: 363–9.
PubMed PubMed Central Статья Google Scholar
Врачко Р., Бендитт Э.П. Базальная пластинка: каркас для упорядоченного замещения клеток. Наблюдения за регенерацией поврежденных волокон и капилляров скелетных мышц. J Cell Biol.1972; 55: 406–19.
CAS PubMed PubMed Central Статья Google Scholar
Sanes JR. Реиннервация базальной пластинки мышечных волокон после удаления миофибрилл. Дифференциация регенерирующих аксонов в исходных синаптических сайтах. J Cell Biol. 1978; 78: 176–98.
CAS PubMed Статья Google Scholar
Sanes JR. Базальная мембрана / базальная пластинка скелетных мышц.J Biol Chem. 2003. 278: 12601–4.
CAS PubMed Статья Google Scholar
Lv H, Li L, Sun M, Zhang Y, Chen L, Rong Y, et al. Механизм регуляции дифференцировки стволовых клеток по жесткости матрикса. Stem Cell Res Ther. 2015; 6: 103.
PubMed PubMed Central Статья CAS Google Scholar
Dupont S, Morsut L, Aragona M, Enzo E, Giulitti S, Cordenonsi M, et al.Роль YAP / TAZ в механотрансдукции. Природа. 2011; 474: 179–83.
CAS PubMed PubMed Central Статья Google Scholar
Пелисье Ф.А., Гарбе Дж.С., Анантанараянан Б., Мияно М., Лин С., Джокела Т. и др. Возрастная дисфункция механотрансдукции нарушает дифференцировку предшественников эпителия молочной железы человека. Cell Rep. 2014; 7: 1926–39.
CAS PubMed PubMed Central Статья Google Scholar
Stearns-Reider KM, D’Amore A, Beezhold K, Rothrauff B, Cavalli L, Wagner WR, et al. Старение внеклеточного матрикса скелетных мышц вызывает фиброгенную конверсию стволовых клеток. Ячейка старения. 2017; 16: 518–28.
CAS PubMed PubMed Central Статья Google Scholar
Гальдер Г., Дюпон С., Пикколо С. Трансдукция механических и цитоскелетных сигналов с помощью YAP и TAZ. Nat Rev Mol Cell Biol. 2012; 13: 591–600.
CAS PubMed Статья Google Scholar
Грэм Д.М., Берридж К. Механотрансдукция и ядерная функция. Curr Opin Cell Biol. 2016; 40: 98–105.
CAS PubMed PubMed Central Статья Google Scholar
Smith L, Cho S, Discher DE. Механочувствительность матрикса стволовыми клетками: от гетерогенности матрикса, сократимости и миграции ядра до кардиогенеза и мышечных стволовых клеток in vivo. Semin Cell Dev Biol. 2017; 71: 84–98.
CAS PubMed PubMed Central Статья Google Scholar
Лю Л., Чеунг Т.Х., Чарвилл Г.В., Хурго ВМС, Ливитт Т., Ши Дж. И др. Модификации хроматина как детерминанты покоя мышечных стволовых клеток и хронологического старения. Cell Rep. 2013; 4: 189–204.
CAS PubMed PubMed Central Статья Google Scholar
Бенаюн Б.А., Поллина Е.А., Сингх П.П., Махмуди С., Харел И., Кейси К.М. и др. Ремоделирование эпигеномных и транскриптомных ландшафтов с возрастом у мышей показывает широко распространенную индукцию воспалительных реакций.Genome Res. 2019; 29: 697–709.
CAS PubMed PubMed Central Статья Google Scholar
Мертенс Дж., Пакула ACM, Ку М., Хэтч Е, Бонке Л., Ладжеварди С. и др. Непосредственно перепрограммированные нейроны человека сохраняют связанные со старением транскриптомные сигнатуры и выявляют связанные с возрастом ядерно-цитоплазматические дефекты. Стволовая клетка клетки. 2015; 17: 705–18.
CAS PubMed PubMed Central Статья Google Scholar
Fan X, Khaki L, Zhu TS, Soules ME, Talsma CE, Gul N, et al. Блокада пути NOTCH истощает CD133-положительные клетки глиобластомы и подавляет рост опухолевых нейросфер и ксенотрансплантатов. Стволовые клетки. 2010; 28: 5–16.
CAS PubMed PubMed Central Google Scholar
Шаллер М.А., Лог Х., Мукерджи С., Линделл Д.М., Коэльо А.Л., Линкольн П. и др. Дельта-подобный 4 дифференциально регулирует экспансию мышиных CD4 T-клеток через BMI1.PLoS One. 2010; 5: e12172.
PubMed PubMed Central Статья CAS Google Scholar
Jacobs JJ, Kieboom K, Marino S, DePinho RA, van Lohuizen M. Онкоген и ген bmi-1 группы Polycomb регулирует пролиферацию и старение клеток через локус ink4a. Природа. 1999; 397: 164–8.
CAS PubMed Статья Google Scholar
Bracken AP, Kleine-Kohlbrecher D, Dietrich N, Pasini D, Gargiulo G, Beekman C, et al.Белки группы Polycomb связываются по всему локусу INK4A-ARF и диссоциируют в стареющих клетках. Genes Dev. 2007; 21: 525–30.
CAS PubMed PubMed Central Статья Google Scholar
Barski A, Cuddapah S, Cui K, Roh T-Y, Schones DE, Wang Z, et al. Профилирование метилирования гистонов в геноме человека с высоким разрешением. Клетка. 2007. 129: 823–37.
CAS PubMed Статья Google Scholar
Ку М., Коче Р.П., Райнбай Э., Менденхолл Е.М., Эндох М., Миккельсен Т.С. и др. Полногеномный анализ занятости PRC1 и PRC2 идентифицирует два класса двухвалентных доменов. PLoS Genet. 2008; 4: e1000242.
PubMed PubMed Central Статья CAS Google Scholar
Огуро Х., Юань Дж., Итикава Х., Икава Т., Ямадзаки С., Кавамото Х. и др. Возможная спецификация клонов в мультипотенциальных гематопоэтических стволовых и прогениторных клетках с помощью белка polycomb Bmi1.Стволовая клетка клетки. 2010. 6: 279–86.
CAS PubMed Статья Google Scholar
Robson LG, Di Foggia V, Radunovic A, Bird K, Zhang X, Marino S. Bmi1 экспрессируется в постнатальных миогенных сателлитных клетках, контролирует их поддержание и играет важную роль в повторной регенерации мышц. PLoS One. 2011; 6: e27116.
CAS PubMed PubMed Central Статья Google Scholar
Юсеф Х., Конбой М.Дж., Моргенталер А., Шлезингер С., Бугай Л., Паливал П. и др. Системное ослабление пути TGF-β одним лекарством одновременно омолаживает нейрогенез и миогенез гиппокампа у одного и того же старого млекопитающего. Oncotarget. 2015; 6: 11959–78.
PubMed PubMed Central Статья Google Scholar
Schwörer S, Becker F, Feller C, Baig AH, Köber U, Henze H, et al. Ответы на эпигенетический стресс вызывают старение мышечных стволовых клеток с помощью сигналов развития Hoxa9.Природа. 2016; 540: 428–32.
PubMed Статья CAS Google Scholar
Лю Л., Рандо Т.А. Проявления и механизмы старения стволовых клеток. J Cell Biol. 2011; 193: 257–66.
CAS PubMed PubMed Central Статья Google Scholar
Bigot A, Duddy WJ, Ouandaogo ZG, Negroni E, Mariot V, Ghimbovschi S, et al. Связанное с возрастом метилирование подавляет SPRY1, что приводит к нарушению восстановления покоя и потере пула резервных стволовых клеток в мышцах пожилого возраста.Cell Rep. 2015; 13: 1172–82.
CAS PubMed Статья Google Scholar
Schultz E, Gibson MC, Champion T. Сателлитные клетки митотически неподвижны в зрелых мышцах мыши: ЭМ и радиоавтографическое исследование. J Exp Zool. 1978; 206: 451–6.
CAS PubMed Статья Google Scholar
Montarras D, L’honoré A, Buckingham M. Низко лежащий, но готовый к действию: покоящаяся мышечная сателлитная клетка.FEBS J. 2013; 280: 4036–50.
CAS PubMed Статья Google Scholar
Sudo K, Ema H, Morita Y, Nakauchi H. Возрастные характеристики гемопоэтических стволовых клеток мыши. J Exp Med. 2000; 192: 1273–80.
CAS PubMed PubMed Central Статья Google Scholar
Берман И., Бхаттачарья Д., Занди С., Сигвардссон М., Вайсман И.Л., Брайдер Д. и др.Функционально различные гемопоэтические стволовые клетки модулируют потенциал гемопоэтических клонов во время старения посредством механизма клональной экспансии. PNAS. 2010; 107: 5465–70.
CAS PubMed Статья Google Scholar
Иномата К., Аото Т., Бинь Н.Т., Окамото Н., Танимура С., Вакаяма Т. и др. Генотоксический стресс препятствует обновлению стволовых клеток меланоцитов, вызывая их дифференцировку. Клетка. 2009; 137: 1088–99.
CAS PubMed Статья Google Scholar
Мартин К., Поттен С.С., Робертс С.А., Кирквуд ТБ. Измененная регенерация стволовых клеток в облученных криптах кишечника стареющих мышей. J Cell Sci. 1998; 111: 2297–303.
CAS PubMed Google Scholar
Маслов А.Ю., Бароне Т.А., Планкетт Р.Дж., Прюитт СК. Обнаружение нервных стволовых клеток, характеристика и возрастные изменения в субвентрикулярной зоне мышей. J Neurosci. 2004; 24: 1726–33.
CAS PubMed PubMed Central Статья Google Scholar
Лейбович С.Дж., Росс Р. Роль макрофагов в заживлении ран. Исследование с гидрокортизоном и антимакрофагальной сывороткой. Am J Pathol. 1975. 78: 71–100.
CAS PubMed PubMed Central Google Scholar
Даффилд Дж. С., Форбс С. Дж., Констандину С. М., Клей С., Партолина М., Вутури С. и др. Селективное истощение макрофагов выявляет различные противоположные роли при повреждении и восстановлении печени. J Clin Invest. 2005; 115: 56–65.
CAS PubMed PubMed Central Статья Google Scholar
Такаянаги Х. Воспалительная деструкция кости и остеоиммунология. J Periodontal Res. 2005; 40: 287–93.
CAS PubMed Статья Google Scholar
Griffin CA, Apponi LH, Long KK, Pavlath GK. Экспрессия хемокинов и контроль миграции мышечных клеток во время миогенеза.J Cell Sci. 2010; 123: 3052–60.
CAS PubMed PubMed Central Статья Google Scholar
Costamagna D, Costelli P, Sampaolesi M, Penna F. Роль воспаления в гомеостазе мышц и миогенезе. Mediat Inflamm. 2015; [Цитировано 1 ноября 2019 г.]. Доступно по адресу: https://www.hindawi.com/journals/mi/2015/805172/.
Deasy BM, Feduska JM, Payne TR, Li Y, Ambrosio F, Huard J. Влияние VEGF на регенеративную способность мышечных стволовых клеток в дистрофических скелетных мышцах.Mol Ther. 2009; 17: 1788–98.
CAS PubMed PubMed Central Статья Google Scholar
Frey SP, Jansen H, Raschke MJ, Meffert RH, Ochman S. VEGF улучшает регенерацию скелетных мышц после острой травмы и реконструкцию конечности на модели кролика. Clin Orthop Relat Res. 2012; 470: 3607–14.
PubMed PubMed Central Статья Google Scholar
Рантанен Дж., Ранне Дж., Хурме Т., Калимо Х. Денервированные сегменты поврежденных волокон скелетных мышц реиннервируются вновь образованными нервно-мышечными соединениями. J Neuropathol Exp Neurol. 1995; 54: 188–94.
CAS PubMed Статья Google Scholar
Вайттинен С., Лукка Р., Сальгрен С., Хурме Т., Рантанен Дж., Лендаль Ю. и др. Экспрессия нестина промежуточного филаментного белка по сравнению с виментином и десмином в регенерирующих скелетных мышцах.J Neuropathol Exp Neurol. 2001; 60: 588–97.
CAS PubMed Статья Google Scholar
Tidball JG, Villalta SA. Регуляторные взаимодействия между мышцами и иммунной системой во время регенерации мышц. Am J Phys Regul Integr Comp Phys. 2010; 298: R1173–87.
CAS Google Scholar
Gordon S, Taylor PR. Гетерогенность моноцитов и макрофагов.Nat Rev Immunol. 2005. 5: 953–64.
CAS PubMed Статья Google Scholar
Фадок В.А., Браттон Д.Л., Гатри Л., Хенсон П.М. Дифференциальные эффекты апоптотических и лизированных клеток на продукцию цитокинов макрофагами: роль протеаз. J Immunol. 2001. 166: 6847–54.
CAS PubMed Статья Google Scholar
Арнольд Л., Генри А., Порон Ф., Баба-Амер И., ван Ройен Н., Плонке А. и др.Воспалительные моноциты, набранные после повреждения скелетных мышц, превращаются в противовоспалительные макрофаги для поддержки миогенеза. J Exp Med. 2007. 204: 1057–69.
CAS PubMed PubMed Central Статья Google Scholar
Патсалос А., Симанди З., Хайс Т.Т., Пелокин М., Хаджиан М., Рестрепо I и др. Введение GDF3 in vivo устраняет связанную со старением задержку регенерации мышц после острого стерильного повреждения. Ячейка старения.2018; 17: e12815.
PubMed PubMed Central Статья CAS Google Scholar
Mounier R, Théret M, Arnold L, Cuvellier S, Bultot L, Göransson O, et al. AMPKα1 регулирует перекос макрофагов во время разрешения воспаления во время регенерации скелетных мышц. Cell Metab. 2013; 18: 251–64.
CAS PubMed Статья Google Scholar
Lei H, Schmidt-Bleek K, Dienelt A, Reinke P, Volk H-D. Регуляторные Т-клеточные противовоспалительные эффекты способствуют успешному восстановлению тканей как косвенным, так и прямым образом. Front Pharmacol. 2015; 6 [Цитировано 1 ноября 2019 г.]. Доступно по адресу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4557110/.
Burzyn D, Kuswanto W., Kolodin D, Shadrach JL, Cerletti M, Jang Y, et al. Особая популяция регуляторных Т-клеток усиливает восстановление мышц. Клетка. 2013; 155: 1282–95.
CAS PubMed PubMed Central Статья Google Scholar
Gandolfo MT, Jang HR, Bagnasco SM, Ko G-J, Agreda P, Satpute SR и др. Регуляторные Т-клетки Foxp3 + участвуют в восстановлении острого ишемического повреждения почек. Kidney Int. 2009. 76: 717–29.
CAS PubMed Статья Google Scholar
Nosbaum A, Prevel N, Truong H-A, Mehta P, Ettinger M, Scharschmidt TC, et al. Передний край: регуляторные Т-клетки способствуют заживлению кожных ран. J Immunol. 2016; 196: 2010–4.
CAS PubMed PubMed Central Статья Google Scholar
Raposo C, Graubardt N, Cohen M, Eitan C, London A, Berkutzki T. и др. Для восстановления ЦНС требуются как эффекторные, так и регуляторные Т-клетки с различными временными и пространственными профилями. J Neurosci. 2014; 34: 10141–55.
PubMed PubMed Central Статья CAS Google Scholar
Weirather J, Hofmann UDW, Beyersdorf N, Ramos GC, Vogel B, Frey A, et al. Foxp3 + CD4 + Т-клетки улучшают заживление после инфаркта миокарда, модулируя дифференцировку моноцитов / макрофагов.Circ Res. 2014; 115: 55–67.
CAS PubMed Статья Google Scholar
Кусванто В., Бурзин Д., Пандуро М., Ван К.К., Янг Ю.С., Вейджерс А.Дж. и др. Плохое восстановление скелетных мышц у стареющих мышей отражает дефект местного, зависимого от интерлейкина-33 накопления регуляторных Т-клеток. Иммунитет. 2016; 44: 355–67.
CAS PubMed PubMed Central Статья Google Scholar
Asakura A, Seale P, Girgis-Gabardo A, Rudnicki MA. Миогенная спецификация клеток боковой популяции скелетных мышц. J Cell Biol. 2002; 159: 123–34.
CAS PubMed PubMed Central Статья Google Scholar
Gussoni E, Soneoka Y, Strickland CD, Buzney EA, Khan MK, Flint AF, et al. Экспрессия дистрофина у мышей mdx восстанавливалась трансплантацией стволовых клеток. Природа. 1999; 401: 390–4.
CAS PubMed Google Scholar
LaBarge MA, Blau HM. Биологический прогресс от взрослого костного мозга к мононуклеарным мышечным стволовым клеткам и к многоядерным мышечным волокнам в ответ на повреждение. Клетка. 2002; 111: 589–601.
CAS PubMed Статья Google Scholar
Vauchez K, Marolleau J-P, Schmid M, Khattar P, Chapel A, Catelain C, et al. Активность альдегиддегидрогеназы позволяет идентифицировать популяцию клеток скелетных мышц человека с высокими миогенными способностями.Mol Ther. 2009; 17: 1948–58.
CAS PubMed PubMed Central Статья Google Scholar
Mitchell KJ, Pannérec A, Cadot B, Parlakian A, Besson V, Gomes ER, et al. Идентификация и характеристика предшественников несателлитных клеток в мышцах во время постнатального развития. Nat Cell Biol. 2010. 12: 257–66.
CAS Статья Google Scholar
Полесская А, Сил П, Рудницкий МА. Передача сигналов Wnt индуцирует миогенную спецификацию резидентных CD45 + взрослых стволовых клеток во время регенерации мышц. Клетка. 2003. 113: 841–52.
CAS PubMed Статья Google Scholar
Торренте Ю., Белички М., Марчези К., Д’Антона Дж., Когиаманиан Ф., Писати Ф. и др. Аутологичная трансплантация CD133 + стволовых клеток мышечного происхождения пациентам с мышцами Дюшенна. Трансплантация клеток. 2007; 16: 563–77.
CAS PubMed Статья Google Scholar
Dammone G, Karaz S, Lukjanenko L, Winkler C, Sizzano F, Jacot G, et al. PPARγ контролирует эктопический адипогенез и перекрестно взаимодействует с миогенезом во время регенерации скелетных мышц. Int J Mol Sci. 2018; 19: 2044.
PubMed Central Статья CAS PubMed Google Scholar
Лукьяненко Л., Караз С., Стулзац П., Гурриаран-Родригес Ю., Мишо Дж., Даммон Г. и др.Старение нарушает функцию мышечных стволовых клеток, нарушая секрецию матрично-клеточного WISP1 фибро-адипогенными предшественниками. Стволовая клетка клетки. 2019; 24: 433–446.e7.
CAS PubMed Статья Google Scholar
Бирбрайр А., Чжан Т., Ван З-М, Месси М.Л., Эниколопов Г.Н., Минц А. и др. Роль перицитов в регенерации скелетных мышц и накоплении жира. Stem Cells Dev. 2013; 22: 2298–314.
CAS PubMed PubMed Central Статья Google Scholar
Rotini A, Martínez-Sarrà E, Duelen R, Costamagna D, Di Filippo ES, Giacomazzi G, et al. Старение влияет на регенеративный потенциал мезоангиобластов человека in vivo. Ячейка старения. 2018; 17 [цитируется 1 июня 2019 г.] Доступно по адресу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5847873/.
PubMed Central Статья CAS PubMed Google Scholar
Джо AWB, Йи Л., Натараджан А., Ле Гранд Ф, Со Л., Ван Дж. И др. Повреждение мышцы активирует резидентные фибро / адипогенные предшественники, которые способствуют миогенезу.Nat Cell Biol. 2010; 12: 153–63.
CAS PubMed PubMed Central Статья Google Scholar
Эредиа Дж. Э., Мукундан Л., Чен Ф.М., Мюллер А.А., Део Р.С., Локсли Р.М. и др. Врожденные сигналы типа 2 стимулируют фибро / адипогенные клетки-предшественники, что способствует регенерации мышц. Клетка. 2013; 153: 376–88.
CAS PubMed PubMed Central Статья Google Scholar
Contreras O, Rebolledo DL, Oyarzún JE, Olguín HC, Brandan E. Клетки соединительной ткани, экспрессирующие маркеры фибро / адипогенных предшественников, увеличиваются при хроническом повреждении: значение для дифференцировки фибробластов и миофибробластов и фиброза скелетных мышц. Cell Tissue Res. 2016; 364: 647–60.
CAS PubMed Статья Google Scholar
Ганнон В.Л., Сайкс Р.С. Рекомендации Американского общества маммологов по использованию диких млекопитающих в исследованиях.J Mammal. 2007; 88: 15.
Google Scholar
Фитинги DA. Этика и количество животных: неформальный анализ, неопределенный размер выборки, неэффективное воспроизведение и ошибки типа I. J Am Assoc Lab Anim Sci. 2011; 50: 445–53.
CAS PubMed PubMed Central Google Scholar
Джонс С., Карли С., Харрисон М. Введение в оценку мощности и размера выборки.Emerg Med J. 2003; 20: 453–8.
CAS PubMed PubMed Central Статья Google Scholar
Lenth RV. Некоторые практические рекомендации по эффективному определению размера выборки. Am Stat. 2001; 55: 187–93.
Артикул Google Scholar
Charan J, Kantharia ND. Как рассчитать размер выборки при исследованиях на животных? J Pharmacol Pharmacother. 2013; 4: 303–6.
PubMed PubMed Central Статья Google Scholar
Festing MFW, Altman DG. Руководство по планированию и статистическому анализу экспериментов с лабораторными животными. ИЛАР J. 2002; 43: 244–58.
CAS PubMed Статья Google Scholar
Festing MFW. Дизайн и статистические методы в исследованиях с использованием животных моделей развития.ИЛАР J. 2006; 47: 5–14.
CAS PubMed Статья Google Scholar
Мид Р., Гилмор С.Г., Мид А. Статистические принципы планирования экспериментов: приложения к реальным экспериментам. Кембридж: Издательство Кембриджского университета; 2012. [Цитировано 12 июля 2019 г.]. Доступно по ссылке: http://ebooks.cambridge.org/ref/id/CBO978113
Google Scholar
Арифин В.Н., Захируддин В.М.Расчет размера выборки в исследованиях на животных с использованием подхода уравнения ресурсов. MJMS. 2017; 24: 101–5.
PubMed Статья Google Scholar
Клейтон Дж. А., Коллинз Ф. С. Политика: NIH стремится сбалансировать пол в исследованиях клеток и животных. Новости природы. 2014; 509: 282.
Артикул Google Scholar
Джордани Л., Хе Г.Дж., Негрони Э., Сакаи Х., Закон JYC, Сиу М.М. и др. Высокомерная одноклеточная картография выявляет новые популяции клеток, резидентных в скелетных мышцах.Mol Cell. 2019; 74: 609–621.e6.
CAS PubMed Статья Google Scholar
LSDA: эксперимент — 96-E400
В настоящее время люди занимают Международную космическую станцию (МКС) в течение шести месяцев, а на горизонте — миссии по исследованию космоса продолжительностью от одного до трех лет, сохранение здоровья и физической формы членов экипажа является одной из основных целей международного космического сообщества. Упражнения были основной полезностью, используемой космическими агентствами для защиты здоровья сердечно-сосудистой системы, костей и скелетных мышц во время длительного пребывания в космосе.
Целью этого исследования было задокументировать программу упражнений, используемую членами экипажа на борту МКС, и изучить ее эффективность для сохранения размера и функции скелетных мышц. Основное внимание в исследовании уделялось икроножным мышцам, поскольку было показано, что они атрофируются больше, чем другие мышцы ног и верхней части тела при разгрузке. Чтобы получить исчерпывающий профиль скелетных мышц до и после полета, исследователи использовали магнитно-резонансную томографию (МРТ) для оценки объема мышц, статическое и динамическое мышечное тестирование для оценки работоспособности мышц, а также биопсию мышц икроножной и камбаловидной мышц для оценки типа волокна. сократительная функция и микроанатомия.
ПОДХОД:В расследовании участвовали десять членов экипажа. Исследуемая популяция состояла из американских астронавтов и российских космонавтов. В течение шести месяцев члены экипажа находились на МКС, у них был доступ к беговой дорожке (беговая дорожка с системой виброизоляции), двум велоэргометрам (велоэргометру с системой виброизоляции и Велосипед, т. Е. Российскому устройству для велотренажера) и временному устройству. резистивное устройство для упражнений (iRED).Члены экипажа также имели доступ к эластичным шнурам, которые они могли использовать для выполнения упражнений с отягощениями для различных групп мышц.
Для определения объема икроножной мышцы членам экипажа была проведена МРТ за 40 ± 3 (L — 40) дней до запуска и через 4 ± 1 (R + 4) дня после возвращения с МКС. Дополнительная МРТ была получена каждому члену экипажа через 19 ± 2 (R + 19) дней после возвращения из космоса. Все предполетные МРТ-сканирования проводились в Клир-Лейк, штат Техас, а все послеточные (R + 4) МРТ-сканирования проводились в Москве, Россия.
Максимальное произвольное сокращение и изокинетическая сила икроножных мышц левой ноги оценивали с помощью динамометра скорости крутящего момента. Каждый член экипажа провел два ознакомительных сеанса перед предполетными испытаниями. Перед запуском каждый член экипажа провел четыре полных сеанса испытаний в течение четырех месяцев (L — 127 ± 13, L — 87 ± 13, L — 40 ± 4 и L — 27 ± 1). После полета динамометрические измерения крутящего момента и скорости были получены при R + 7 и R + 13 для всех испытуемых.
Биопсия мышцы была взята из боковой головки икроножной и камбаловидной мышцы каждого члена экипажа перед запуском (L — 55 ± 2) и в день посадки (R + 0).Биопсия мышц в день приземления обычно выполнялась в середине или конце дня, примерно через шесть-восемь часов после приземления. Члены экипажа были доставлены к основным медицинским объектам для наблюдения. После периода личной активности члены экипажа были доставлены в центр сбора данных для биопсии мышц. Перед процедурой биопсии мышцы члены экипажа выполняли очень легкие амбулаторные процедуры.
Во время полета потребление пищи и жидкости контролировалось в соответствии с тем же графиком, но субъекты использовали автоматизированную систему сканирования штрих-кода, в которой каждый индивидуально упакованный продукт питания был помечен.Диета во время полета была разработана с учетом требований к питанию для миссий на МКС, установленных НАСА и Российским космическим агентством. Ни диета, ни уровни активности не были ограничены ни в один из периодов отбора проб. Данные о потреблении в полете сохранялись в считывателе штрих-кода и загружались на землю.
РЕЗУЛЬТАТЫ:
Профиль тренировки с упражнениями
В среднем испытуемые выполняли 138 ± 26 минут в неделю циклических упражнений, которые обычно находились в диапазоне от 100 до 150 Вт (Вт).Находясь на орбите, члены экипажа использовали велоэргометр примерно 60% рабочих дней миссии. Четверо членов экипажа использовали велоэргометр примерно 81% или более дней миссии, тогда как четыре других в среднем использовали примерно 37% дней миссии, а один член экипажа выполнял минимальную езду на велосипеде. В упражнении на беговой дорожке испытуемые в среднем тратили 146 ± 34 минут в неделю на уровне уровня на скорости от 2,1 до 5,5 миль в час. Беговая дорожка, по-видимому, использовалась реже по сравнению с велоэргометром, составляя менее 50% от общего количества рабочих дней.Тем не менее, беговая дорожка использовалась в широком диапазоне: четыре члена экипажа имели большой объем (200 минут в неделю) ходьбе / беге. Остальные пять членов экипажа гораздо реже использовали беговую дорожку (85 минут в неделю).
Объем мышц
Икроножная мышца (медиальная и латеральная) и камбаловидная мышца были меньше (P Производительность мышц
MVC был сокращен (P Тип мышечного волокна
Исследователи выделили и проанализировали профиль MHC в общей сложности 4328 одиночных мышечных волокон икроножной и камбаловидной мышц до и после полета.Разрыв составил 1960 мышечных волокон икроножной мышцы и 2368 мышечных волокон камбаловидной мышцы. Икроножная мышца уменьшилась на 12% (P Питание
Члены экипажа имели среднесуточное потребление калорий 2 377 ± 118 ккал (диапазон = 1874–2 902 ккал). Процент разложения углеводов, жиров и белков с пищей составлял 48, 33 и 18% соответственно.
Среднее количество потери мышечной массы (-13%) при космическом полете было несколько меньше, чем при предыдущих длительных пребываниях на космической станции «Мир» (-17%).Текущая потеря объема икроножных мышц ISS и предыдущая «Мир» составляет примерно половину от результатов длительных (от 60 до 120 дней) исследований постельного режима, показывающих снижение на 29% среди контрольных субъектов без контрмер. Эти данные предполагают, что упражнения в космосе имеют положительный эффект, но не являются полным: камбаловидную мышцу защитить труднее, чем икроножную мышцу.
Для получения более подробных результатов, пожалуйста, обратитесь к статье PubMed «Упражнения в космосе», которая находится в свободном доступе на веб-сайте PubMed или на веб-сайте Journal of Applied Physiology, http: // jap.Physiology.org/.
Результаты могут привести к созданию более эффективных методов создания мышечных клеток из стволовых клеток — ScienceDaily
Междисциплинарная группа исследователей из Центра регенеративной медицины и исследования стволовых клеток Эли и Эдит Брод при Калифорнийском университете в Лос-Анджелесе разработала первый в своем роде Добрый план развития скелетных мышц человека, включая формирование мышечных стволовых клеток.
Исследование, опубликованное в рецензируемом журнале Cell Stem Cell , выявило различные типы клеток, присутствующие в тканях скелетных мышц, от раннего эмбрионального развития до зрелого возраста.Сосредоточившись на мышечных клетках-предшественниках, которые способствуют формированию мышц до рождения, и мышечных стволовых клетках, которые способствуют формированию мышц после рождения и регенерации после травм на протяжении всей жизни, группа определила, как генные сети клеток — какие гены активны. и неактивные — изменяются по мере созревания клеток.
Дорожная карта имеет решающее значение для исследователей, которые стремятся разработать в лаборатории мышечные стволовые клетки, которые можно использовать в регенеративной клеточной терапии разрушительных мышечных заболеваний, включая мышечные дистрофии и саркопению, возрастную потерю мышечной массы и силы.
«Потеря мышечной массы из-за старения или болезни часто является результатом дисфункциональных мышечных стволовых клеток», — сказала Эйприл Пайл, старший автор статьи и член Исследовательского центра широких стволовых клеток. «Эта карта идентифицирует точные генные сети, присутствующие в мышечных предшественниках и стволовых клетках в процессе развития, что важно для разработки методов создания этих клеток в чашке для лечения мышечных расстройств».
Исследователи из лаборатории Пайла и других ученых по всему миру уже имеют возможность генерировать клетки скелетных мышц из плюрипотентных стволовых клеток человека — клетки, которые обладают способностью самообновляться и превращаться в клетки любого типа в организме.Однако до сих пор у них не было способа определить, где эти клетки попадают в континуум человеческого развития.
«Мы знали, что мышечные клетки, которые мы создавали в лаборатории, были не такими функциональными, как полностью созревшие мышечные стволовые клетки, обнаруженные у людей», — сказал Хайбин Си, первый автор новой статьи и помощник научного сотрудника проекта в лаборатории Пайла. «Поэтому мы решили создать эту карту в качестве справочной информации, которую наша и другие лаборатории могут использовать для сравнения генетических сигнатур клеток, которые мы создаем, с сигнатурами реальной ткани скелетных мышц человека.«
Для создания этого ресурса группа собрала высокоспецифичные данные о двух разных группах клеток скелетных мышц: клетки человеческого тела, начиная с пятой недели эмбрионального развития и до среднего возраста, и полученные из плюрипотентных стволовых клеток человека, полученные исследователями. в лаборатории. Затем они сравнили генетические подписи клеток из обоих источников.
Группа получила 21 образец ткани скелетных мышц человека от своих сотрудников из Калифорнийского университета в Лос-Анджелесе и от коллег из Университета Южной Калифорнии и Университета Тюбингена в Германии.Для мышечных клеток, полученных из плюрипотентных стволовых клеток, группа оценивала клетки, созданные с использованием их собственного уникального метода и методов нескольких других групп.
Лаборатория Пайла в сотрудничестве с лабораторией Катрин Плат, профессора биологической химии Калифорнийского университета в Лос-Анджелесе и члена Исследовательского центра широких стволовых клеток, провела высокопроизводительное капельное секвенирование одноклеточной РНК всех образцов. Эта технология позволяет исследователям идентифицировать генные сети, присутствующие в одной клетке, и обрабатывать тысячи клеток одновременно.Используя мощь этой технологии и биоинформатический опыт лаборатории Plath, группа определила генетические сигнатуры различных типов клеток из человеческих тканей и плюрипотентных стволовых клеток.
Затем они разработали вычислительные методы, чтобы сосредоточиться на мышечных предшественниках и стволовых клетках, и нанесли на карту их генные сети, связанные с каждой стадией развития. Это позволило группе сопоставить генетические сигнатуры, обнаруженные в мышечных клетках, полученных из плюрипотентных стволовых клеток, с их соответствующими местоположениями на карте развития мышц человека.
Группа обнаружила, что мышечные клетки, полученные из плюрипотентных стволовых клеток, полученные всеми методами, которые они пробовали, напоминали мышечные клетки-предшественники на раннем этапе развития и не соответствовали взрослым мышечным стволовым клеткам.
Помимо определения истинной зрелости клеток, полученных в лаборатории, этот анализ также предоставил подробную информацию о других типах клеток, присутствующих в ткани скелетных мышц в процессе развития и в популяциях, полученных из плюрипотентных стволовых клеток человека. Эти клетки могут играть важную роль в созревании мышечных клеток и могут иметь решающее значение для улучшения методов создания и поддержки мышечных стволовых клеток в чашке.
«Мы обнаружили, что некоторые методы создания мышечных клеток в чашке также производят уникальные типы клеток, которые, вероятно, поддерживают мышечные клетки», — сказал Пайл, который также является членом Универсального онкологического центра UCLA Jonsson. «Итак, теперь наши вопросы: что делают эти клетки? Могут ли они быть ключом к производству и поддержанию зрелых и функциональных мышечных стволовых клеток в чашке?»
Двигаясь вперед, Пайл и ее коллеги сосредоточатся на использовании этого нового ресурса для разработки более эффективных методов получения мышечных стволовых клеток из плюрипотентных стволовых клеток человека в лаборатории.Она надеется, что, сосредоточив внимание на сетях экспрессии генов, связанных со стволовыми клетками, и на поддерживающих типах клеток, которые они идентифицировали, они смогут производить мощные мышечные стволовые клетки, которые могут быть полезны для будущих методов регенеративной терапии.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
12.2 Введение в мышечную систему — Биология человека
Создано CK-12 Foundation / Адаптировано Кристин Миллер
Рисунок 12.2.1 Наталья Заболотная, Олимпиада-2012.Приводит ли слово мускул к мысли о хорошо развитой мускулатуре штангиста, как у женщины на рисунке 12.2.1? Ее зовут Наталья Заболотная, она российская олимпийская чемпионка. Мышцы, которые используются для подъема тяжестей, легко ощутить и увидеть, но это не единственные мышцы в человеческом теле. Многие мышцы находятся глубоко внутри тела, где они образуют стенки внутренних органов и других структур. Вы можете сгибать бицепсы по своему желанию, но вы не можете контролировать внутренние мышцы, как эти. Хорошо, что эти внутренние мышцы работают без каких-либо сознательных усилий с вашей стороны, потому что движение этих мышц необходимо для выживания.Мышцы — это органы мышечной системы.
Мышечная система состоит из всех мышц тела. Наибольший процент мышц в мышечной системе составляют скелетные мышцы, которые прикреплены к костям и обеспечивают произвольные движения тела (показано на рисунке 12.2.2). В теле человека почти 650 скелетных мышц, многие из которых показаны на рис. 12.2.2. Помимо скелетных мышц, мышечная система также включает сердечную мышцу, которая составляет стенки сердца, и гладкие мышцы, которые контролируют движения в других внутренних органах и структурах.
Рис. 12.2.2 Многие скелетные мышцы в мышечной системе человека показаны на этом рисунке человеческого тела.Структура и функция мышц
Мышцы — это органы, состоящие в основном из мышечных клеток, которые также называются мышечными волокнами (в основном в скелетных и сердечных мышцах) или миоцитами (в основном в гладких мышцах). Мышечные клетки — это длинные тонкие клетки, которые выполняют функцию сокращения. Они содержат белковые нити, которые скользят друг по другу, используя энергию АТФ.Скользящие нити увеличивают напряжение в мышечных клетках или укорачивают их длину, вызывая сокращение. Сокращения мышц ответственны практически за всех движений тела, как изнутри, так и снаружи.
Скелетные мышцы прикрепляются к костям скелета. Когда эти мышцы сокращаются, они двигают тело. Они позволяют нам использовать наши конечности по-разному, от ходьбы до поворота колес телеги. Скелетные мышцы также поддерживают осанку и помогают нам сохранять равновесие.
Гладкие мышцы стенок кровеносных сосудов сокращаются, вызывая сужение сосудов, что может помочь сохранить тепло тела. Расслабление этих мышц вызывает расширение сосудов, что может помочь телу терять тепло. В органах пищеварительной системы гладкие мышцы проталкивают пищу через желудочно-кишечный тракт, последовательно сокращаясь, образуя волну мышечных сокращений, называемую перистальтикой . Представьте себе, как распылять зубную пасту через тюбик, последовательно оказывая давление снизу вверх, и вы получите хорошее представление о том, как пища перемещается мышцами через пищеварительную систему.Перистальтика гладких мышц также перемещает мочу по мочевыводящим путям.
Ткань сердечной мышцы находится только в стенках сердца. Когда сердечная мышца сокращается, это заставляет сердце биться. Насосное действие бьющегося сердца поддерживает кровоток в сердечно-сосудистой системе.
Мышцы могут увеличиваться в размерах, или гипертрофия. Обычно это происходит из-за более частого употребления, хотя гормональные и другие факторы также могут иметь значение. Например, повышение уровня тестостерона у мужчин в период полового созревания вызывает значительное увеличение размера мышц.Физические упражнения, включающие весовые нагрузки или тренировки с отягощениями, могут увеличить размер скелетных мышц практически у всех. Упражнения (например, бег), которые увеличивают частоту сердечных сокращений, также могут увеличивать размер и силу сердечной мышцы. Размер мышцы, в свою очередь, является основным фактором, определяющим мышечную силу, которую можно измерить силой, которую может приложить мышца.
Мышцы также могут уменьшаться в размерах или атрофироваться , что может произойти из-за недостатка физической активности или голодания.Люди, находящиеся в неподвижном состоянии на любой срок — например, из-за перелома кости или хирургического вмешательства, — относительно быстро теряют мышечную массу. Люди в концентрационных лагерях или лагерях голода могут быть настолько истощены, что теряют большую часть своей мышечной массы, становясь буквально «кожей и костями». Астронавты на Международной космической станции также могут потерять значительную мышечную массу из-за невесомости в космосе (см. Рисунок 12.2.3).
Рис. 12.2.3 Для астронавтов важно выполнять упражнения на борту Международной космической станции, чтобы помочь противостоять потере мышечной массы, которая происходит из-за их невесомости без земной гравитации.Многие заболевания, включая рак и СПИД, часто связаны с атрофией мышц. Атрофия мышц также бывает с возрастом. По мере взросления люди постепенно снижают способность поддерживать массу скелетных мышц, известную как саркопения . Точная причина саркопении неизвестна, но одна из возможных причин — снижение чувствительности к факторам роста, которые необходимы для поддержания мышечной массы. Поскольку размер мышц определяет силу, атрофия мышц вызывает соответствующее снижение мышечной силы.
И при гипертрофии, и при атрофии количество мышечных волокон не изменяется. Что меняется, так это размер мышечных волокон. При гипертрофии мышц отдельные волокна становятся шире. При атрофии мышц волокна становятся более узкими.
Мышцы не могут сокращаться сами по себе. Для сокращения скелетным мышцам требуется стимуляция двигательных нейронов. Точка, где двигательный нейрон прикрепляется к мышце, называется нервно-мышечным соединением . Допустим, вы решили поднять руку в классе.Ваш мозг посылает электрические сообщения через моторные нейроны к вашей руке и плечу. Моторные нейроны, в свою очередь, стимулируют сокращение мышечных волокон руки и плеча, заставляя руку подниматься.
Непроизвольные сокращения гладких и сердечных мышц также управляются электрическими импульсами, но в случае этих мышц импульсы исходят от вегетативной нервной системы (гладкие мышцы) или специализированных клеток сердца (сердечная мышца). Гормоны и некоторые другие факторы также влияют на непроизвольные сокращения сердечных и гладких мышц.Например, гормон борьбы или бегства адреналин увеличивает скорость сокращения сердечной мышцы, тем самым ускоряя сердцебиение.
Мышцы не могут самостоятельно двигать телом. Им нужна скелетная система, чтобы действовать. Эти две системы вместе часто называют костно-мышечной системы . Скелетные мышцы прикреплены к скелету прочной соединительной тканью, называемой сухожилиями . Многие скелетные мышцы прикреплены к концам костей, которые встречаются в суставе.Мышцы охватывают сустав и соединяют кости. Когда мышцы сокращаются, они тянут кости, заставляя их двигаться. Скелетная система представляет собой систему рычагов, которые позволяют телу двигаться. Мышечная система обеспечивает силу, которая перемещает рычаги.
- Мышечная система состоит из всех мышц тела. Существует три типа мышц: скелетная мышца (которая прикреплена к костям и обеспечивает произвольные движения тела), сердечная мышца (которая составляет стенки сердца и заставляет его биться) и гладкие мышцы (которые находятся в стенках сердца). внутренние органы и другие внутренние структуры и контролирует их движения).
- Мышцы — это органы, состоящие в основном из мышечных клеток, которые также можно назвать мышечными волокнами или миоцитами. Мышечные клетки специализируются на функции сокращения, которое происходит, когда белковые нити внутри клеток скользят друг по другу, используя энергию АТФ.
- Мышцы могут увеличиваться в размерах или гипертрофироваться. Обычно это происходит в результате более частого использования (физических упражнений), хотя гормональные и другие факторы также могут иметь значение. Мышцы также могут уменьшаться в размерах или атрофироваться. Это может произойти из-за неиспользования, голодания, некоторых болезней или старения.И при гипертрофии, и при атрофии изменяется размер, но не количество мышечных волокон. Размер мышц — главный фактор, определяющий мышечную силу.
- Скелетным мышцам для сокращения нужен стимул мотонейронов, а для движения тела им нужна скелетная система, на которую она воздействует. Непроизвольные сокращения сердечных и гладких мышц контролируются специальными клетками сердца, нервами вегетативной нервной системы, гормонами или другими факторами.
- Что такое мышечная система?
- Опишите мышечные клетки и их функции.
- Укажите три типа мышечной ткани и укажите, где находится каждый из них.
- Определяет мышечную гипертрофию и мышечную атрофию.
- Каковы возможные причины гипертрофии мышц?
- Назовите три причины возможной атрофии мышц.
- Как мышцы меняются, когда они увеличиваются или уменьшаются в размерах?
- Как изменение размера мышц влияет на силу?
- Объясните, почему космонавты могут легко терять мышечную массу в космосе.
- Опишите, как соотносятся друг с другом термины мышечные клетки , мышечные волокна и миоциты .
- Назовите две системы в теле, которые работают вместе с мышечной системой для выполнения движений.
- Опишите один из способов, которым мышечная система участвует в регулировании температуры тела.
Как работает ваша мышечная система — Эмма Брайс, TED-Ed, 2017.
Медицинская 3D-анимация — Перистальтика толстой кишки / кишечника || ABP ©, AnimatedBiomedical, 2013.
Мышцы имеют значение: д-р Брендан Иган на TEDxUCD, TEDx Talks, 2014 г.
Атрибуты
Рисунок 12.2.1
Natalia_Zabolotnaya_2012b Саймона Q на Wikimedia Commons используется под лицензией CC BY 2.0 (https://creativecommons.org/licenses/by/2.0/deed.en).
Рисунок 12.2.2
Bougle_whole2_, ретушированный Бугле, Жюльеном из Национальной медицинской библиотеки (NLM) на Wikimedia Commons, находится в открытом доступе (https://en.wikipedia.org/wiki/Public_domain).
Рисунок 12.2,3
Daniel_Tani_iss016e027910, снимки НАСА / Международной космической станции на Викискладе находится в общественном достоянии (https://en.wikipedia.org/wiki/Public_domain).
Список литературы
AnimatedBiomedical. (2013, 30 января). 3D Медицинская анимация — Перистальтика толстой кишки / кишечника || ABP ©. YouTube. https://www.youtube.com/watch?v=Ujr0UAbyPS4&feature=youtu.be
Бугле, Ж. (1899). Le corps humain en grandeur naturelle: planches coloriées et superposées, avec texte explicatif.J. B. Baillière et fils. В Исторические анатомии в Интернете . http://www.nlm.nih.gov/exhibition/historicalanatomies/bougle_home.html
TED-Ed. (2017, 26 октября). Как работает ваша мышечная система — Эмма Брайс. YouTube. https://www.youtube.com/watch?v=VVL-8zr2hk4&feature=youtu.be
TEDx Talks. (2014, 27 июня). Мышцы имеют значение: доктор Брендан Иган из TEDxUCD. YouTube. https://www.youtube.com/watch?v=LkXwfTsqQgQ&feature=youtu.be
авторов Википедии.(2020, 15 июня). Наталья Заболотная. В Википедии. https://en.wikipedia.org/w/index.php?title=Natalya_Zabolotnaya&oldid=962630409
Body Cardio — Каковы нормальные диапазоны для состава тела? — Withings
Жировая масса + Костная масса + Мышечная масса = 100% состава тела.
Поскольку в мышцах и жирах есть вода, массу воды нельзя добавлять к другим показателям при расчете состава тела.
Водная масса
Общее количество воды в организме — это общее количество жидкости в организме.Он включает внутриклеточную воду и внеклеточную воду , которые представляют количество воды, содержащейся как в клетках, так и в тканях.
Например, телесный жир содержит примерно 10% воды, а мышцы — примерно 75% воды.
Нормальные диапазоны для водной массы следующие:
Масса жира
Жир состоит из ткани, содержащей жировые клетки. Жир имеет тенденцию накапливаться на бедрах (известное как ожирение гиноид ) у женщин и вокруг живота (известное как ожирение андроид ) у мужчин.
Жировая масса противоположна безжировой массе тела, которая состоит из мышц, внутренних органов и костей.
Нормальные диапазоны жировой массы следующие:
Мышечная масса
Мышечная масса — это вес мышц вашего тела. Мышечная масса состоит из 3 типов мышц : скелетная, гладкая и сердечная.
Скелетная мышца также называется поперечно-полосатой мышцей и находится под произвольным контролем.Как пример: двуглавая мышца — это скелетная мышца.
Гладкая мышца — это непроизвольная мышца без поперечно-полосатой линии , которая сокращается автономно без каких-либо произвольных мыслей. Кишечник — это пример гладкой мускулатуры.
Сердечная мышца представляет собой смесь скелетных и гладких мышц: это непроизвольно поперечно-полосатая мышца.
Нормальные диапазоны мышечной массы следующие:
Костная масса
Костная масса — это масса костей вашего тела.Учитывается только сухая обезжиренная масса скелета.



 Prev Med 2003, 37:520–528.
Prev Med 2003, 37:520–528. Am J Hum Biol 2010, 22:76–82.
Am J Hum Biol 2010, 22:76–82. Geriatr Gerontol Int 2014, 14(Suppl 1):76–84.
Geriatr Gerontol Int 2014, 14(Suppl 1):76–84. J Gerontol A Biol Sci Med Sci 2014, 69:1253–1259.
J Gerontol A Biol Sci Med Sci 2014, 69:1253–1259.
 J Appl Physiol 2012, 113:1537–1544.
J Appl Physiol 2012, 113:1537–1544. J Gerontol A Biol Sci Med Sci 2005, 60:1278–1282.
J Gerontol A Biol Sci Med Sci 2005, 60:1278–1282.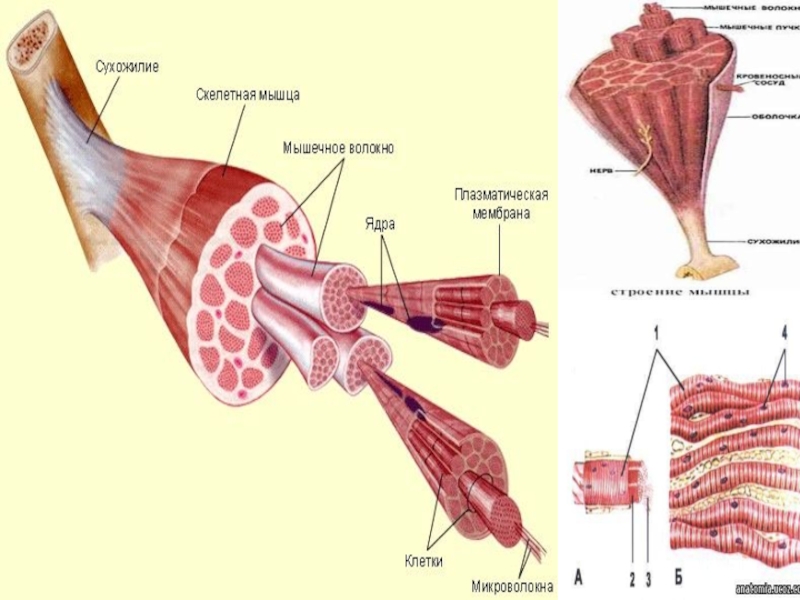 Eur J Appl Physiol 2012, 112:1519–1525.
Eur J Appl Physiol 2012, 112:1519–1525.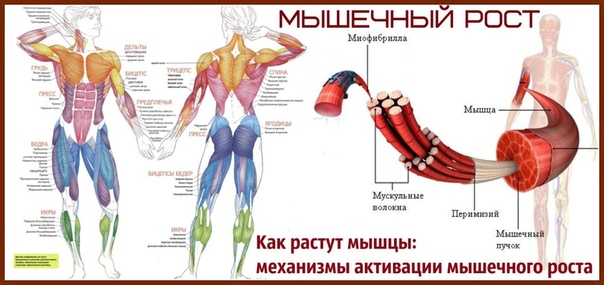 Muscle Nerve 2004, 29:120–127.
Muscle Nerve 2004, 29:120–127.