Из чего состоят мышцы?
Дано краткое описание компонентов, из которых состоят скелетные мышцы человека (состав скелетных мышц человека): мышечные волокна, соединительно-тканные образования, сухожилия, кровеносные и лимфатические сосуды, нервы, рецепторы и тканевая жидкость.
Давайте разберемся, из каких крупных компонентов состоят скелетные мышцы человека. Или другими словами: «Каков состав скелетных мышц?».
Состав скелетных мышц
Можно назвать восемь основных компонентов из которых состоят скелетные мышцы:
- Мышечные волокна;
- Соединительно-тканные образования;
- Сухожилия;
- Кровеносные сосуды;
- Лимфатические сосуды
- Нервы
- Рецепторы;
- Тканевая жидкость.
Более подробно строение и функции мышц описаны в моих книгах
Мышечные волокна представляют собой основной компонент мышцы. В мышце достаточно много: от нескольких десятков тысяч до миллиона. В среднем можно считать, что в скелетной мышце насчитывается несколько сотен тысяч мышечных волокон.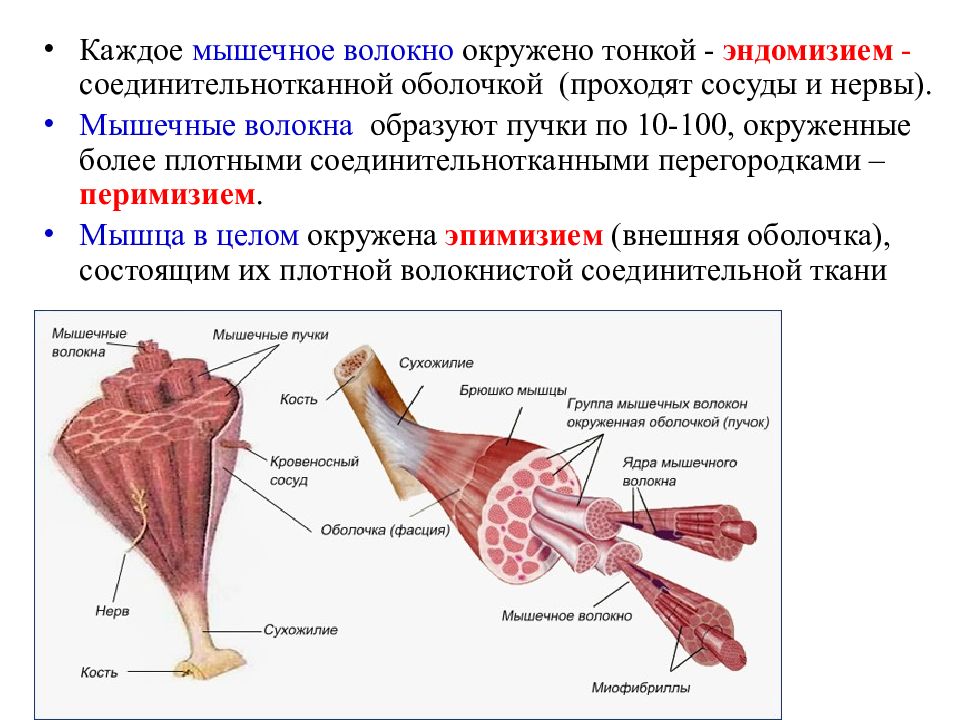
Соединительно-тканные образования окружают каждое мышечное волокно, пучки мышечных волокон и всю мышцу в целом. Анатомы относят их к вспомогательным элементам мышц, однако соединительно-тканные образования являются не только футлярами, в которые упакованы мышечные волокна, пучки мышечных волокон и вся мышца в целом. Они также участвуют в передаче усилия от мышцы сухожилию.
Сухожилия соединяют мышечные волокна с костью и передают усилие, развиваемое мышечными волокнами кости.
Кровеносные сосуды обеспечивают мышцу кислородом и питательными веществами и уносят из мышцы углекислый газ и продукты обмена веществ (метаболизма).
Лимфатические сосуды выполняют дренажную функцию и выводят из мышцы продукты метаболизма, которые не удалось удалить через кровеносные сосуды.
Нервы обеспечивают прохождение импульсов из центральной нервной системы (ЦНС) к мышце и от мышцы к ЦНС. Благодаря этому мышца сокращается или, другими словами, развивает напряжение.
Рецепторы расположены между мышечными волокнами и внутри сухожилия. Они отвечают за информацию, которая поступает в ЦНС о длине и скорости сокращения мышцы, о напряжении мышцы, а также о боли.
Тканевая жидкость является как бы внутренней средой мышцы. Через тканевую жидкость мышечные волокна получают питательные вещества и отдают продукты обмена веществ.
Компоненты мышцы, описанные выше представляют собой макрообъекты. В дальнейшем я расскажу о более мелких структурных элементах мышцы.
Чтобы ознакомиться более подробно с изложенной выше информацией рекомендую посмотреть следующую литературу.
Литература
- Самсонова, А.В. Гипертрофия скелетных мышц человека. – СПб: Кинетика, 2018. – 159 с. (В этом учебном пособии состав скелетных мышц описан подробно, текст ориентирован на неподготовленного читателя).
- Мак-Комас А. Дж. Скелетные мышцы человека. – Киев: Олимпийская литература, 2001.- 407 с. (Текст этой монографии А.
 Дж. Мак-Комаса ориентирован на подготовленного читателя.)
Дж. Мак-Комаса ориентирован на подготовленного читателя.) - Ткачук М.Г., Степаник И.А. Анатомия. – М.: Советский спорт, 2010. 392 с. (для неподготовленного читателя)
- Ванек Ю. Спортивная анатомия.- М.: Академия, 2008.- 304 с.
С уважением, А.В. Самсонова
Twig-Bilim
Информация о фильме
Краткое содержание фильма
В человеческом теле существует более 600 мышц. Один из основных типов – скелетные мышцы, удерживают скелет в положении и помогают двигаться.
Ключевые факты
- Скелетные мышцы состоят из удлинённых стержнеобразных клеток, известных как мышечные волокна.
- Мышечные волокна содержат тысячи белковых нитей, называемых миофибриллами.
- Миофибриллы скользят друг о друга, когда мышца сокращается, что приводит к движению.
- Мышцы могут только тянуть и расположены парами, чтобы обеспечить все типы движения, работая вместе.
Транскрипт
Без скелетных мышц мы не смогли бы двигаться. Они прикреплены к скелету и при сокращении приводят в…Пожалуйста, авторизуйтесь, чтобы просмотреть и загрузить весь транскрипт
Похожие фильмы
Древний ОлимпиецКости
Ловкие большие пальцы рук
Болезни роста
Сердечные и гладкие мышцы
Что происходит, когда мы хрустим пальцами?
МОРФОЛОГИЧЕСКАЯ ОРГАНИЗАЦИЯ ПОПЕРЕЧНО-ПОЛОСАТОЙ МЫШЦЫ.
 «БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.Ф. Поперечно-полосатая
мышца состоит из многочисленных удлиненных волокон , или мышечных клеток.
Двигательные нервы входят в различных точках в мышечное волокно и передают ему
электрический импульс, вызывающий сокращение. Мышечное волокно обычно
рассматривают как многоядерную клетку гигантских размеров, покрытую эластичной
оболочкой – сарколеммой (рис. 20.1). Диаметр функционально зрелого
поперечно-полосатого мышечного волокна обычно составляет от 10 до 100 мкм, а
длина волокна часто соответствует длине мышцы.
«БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.Ф. Поперечно-полосатая
мышца состоит из многочисленных удлиненных волокон , или мышечных клеток.
Двигательные нервы входят в различных точках в мышечное волокно и передают ему
электрический импульс, вызывающий сокращение. Мышечное волокно обычно
рассматривают как многоядерную клетку гигантских размеров, покрытую эластичной
оболочкой – сарколеммой (рис. 20.1). Диаметр функционально зрелого
поперечно-полосатого мышечного волокна обычно составляет от 10 до 100 мкм, а
длина волокна часто соответствует длине мышцы.В каждом
мышечном волокне в полужидкой саркоплазме по длине волокна расположено, нередко
в форме пучков, множество нитевидных образований – миофибрилл (толщина их
обычно менее 1 мкм), обладающих, как и все волокно в целом, поперечной
исчерченностью. Поперечная исчерченность волокна, зависящая от оптической
неоднородности белковых веществ, локализованных во всех миофибриллах на одном
уровне, легко выявляется при исследовании волокон скелетных мышц в
поляризационном или фазово-контрастном микроскопе.
Рис. 20.1. Структура волокна скелетной мышцы (по Гассельбаху).
I — А-диск; II — I-диск; III — Н-зона; 1 — Z-линия; 2 — Т-система; 3 — саркоплазматическая сеть; 4 — устье Т-системы; 5 — гликоген; 6 — митохондрия; 7 — сарколемма.
В саркоплазме мышечных волокон обнаруживается и ряд других структур: митохондрии, микросомы, рибосомы, трубочки и цистерны сарко-плазматической сети, различные вакуоли, глыбки гликогена и включения липидов, играющие роль запасных энергетических материалов, и т.д. (см. рис. 20.1).
Повторяющимся
элементом поперечно-полосатой миофибриллы является саркомер – участок
миофибриллы, границами которого служат узкие Z-линии. Каждая миофибрилла
состоит из нескольких сот саркомеров. Средняя длина саркомера 2,5–3,0 мкм. В
середине саркомера находится зона протяженностью 1,5–1,6 мкм, темная в
фазово-контрастном микроскопе. В поляризованном свете она дает сильное двойное
лучепреломление.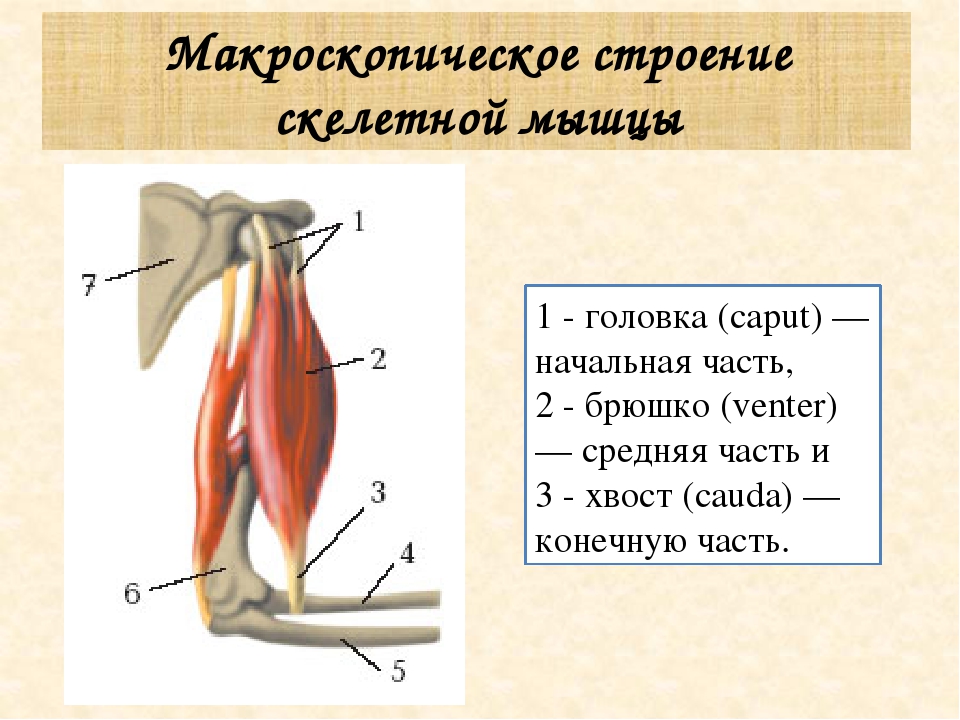
Рис. 20.2. Строение саркомера скелетной мышцы.
а - схематическое изображение структуры саркомера; б — расположение толстых и тонких нитей (поперечное сечение).
Согласно современным
представлениям, в дисках А расположены толстые нити, состоящие главным образом
из белка миозина, и тонкие нити, состоящие, как правило, из второго компонента
актомиозиновой системы – белка актина. Тонкие (актиновые) нити начинаются в
пределах каждого саркомера у Z-линии, тянутся через диск I, проникают
в диск А и прерываются в области зоны Н (рис. 20.2).
20.2).
При исследовании тонких срезов мышц под электронным микроскопом было обнаружено, что белковые нити расположены строго упорядоченно. Толстые нити диаметром 12–16 нм и длиной примерно 1,5 мкм уложены в форме шестиугольника диаметром 40–50 нм и проходят через весь диск А. Между этими толстыми нитями расположены тонкие нити диаметром 8 нм, простираясь от Z-линии на расстояние около 1 мкм. Изучение мышцы в состоянии сокращения показало, что диски I в ней почти исчезают, а область перекрывания толстых и тонких нитей увеличивается (в скелетной мышце в состоянии сокращения саркомер укорачивается до 1,7–1,8 мкм).
Согласно модели, предложенной Э. Хаксли и Р. Нидергерке, а также X. Хаксли и Дж. Хенсон, при сокращении миофибрилл одна система нитей проникает в другую, т.е. нити начинают как бы скользить друг по другу, что и является причиной мышечного сокращения.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ
Биомеханическая модель скелетной мышцы Текст научной статьи по специальности «Экономика и бизнес»
_МЕЖДУНАРОДНЫЙ НАУЧНЫЙ ЖУРНАЛ «СИМВОЛ НАУКИ» №1/2016 ISSN 2410-700Х_
УДК 531/539:61
Бегун Петр Иосифович
докт.
г. Санкт Петербург, РФ E-mail: [email protected]
БИОМЕХАНИЧЕСКАЯ МОДЕЛЬ СКЕЛЕТНОЙ МЫШЦЫ
Аннотация
Предложена модель передачи усилия от миофиламентов к сухожилию, позволяющая рассматривать последовательность процессов, происходящих в скелетной мышце при различных режимах сокращения.
Ключевые слова
Cкелетная мышца, модель, сокращение, филаменты, сухожилия, режимы
Скелетные мышцы, составляющие около 40% тела человека, содержат множество волокон диаметром от 10 до 80 мкм. В большинстве скелетных мышц каждое волокно вытянуто во всю длину мышцы. На концах мышечного волокна поверхностный слой сарколеммы сливается с сухожильными волокнами.
Цитоскелет мышечного волокна образуют нитевидные упругие молекулы ряда белков, обеспечивающих фиксацию каждой миофибриллы друг к другу, а также ряд белков, соединяющих Z-диски одной миофибриллы. Костамеры скелетных мышц, также содержащие несколько белков, соединяют Z-диски периферических миофибрилл с сарколеммой, являясь ребрами жесткости цитоскелета (рис. 1). Толщина нити цитоскелета 10 нм. Можно предположить, что расположенные в цитоскелете молекулы являются матрицей, определяющей положения начальных участков сократительных нитей.
а б в
Рисунок 1 — Схемы структур скелетной мышцы: а — локализация костамеров в мышечном волокне (1 —
миофибриллы, 2 — Z -диск, 3 — костамеры, 4 — сарколемма), б — привязка Z — дисков к элементам цитоскелета (1 — Z -линии, 2 — плазмолемма, 3 — миофибриллы, 4 — промежуточные филаменты, 5 — Z -диск,
6 — цитоскелетные филаменты), в — структура Z -дисков
В литературе рассмотрены различные гипотезы, объясняющие процессы, происходящие в мышцах при различных характерах нагружения. К сожалению, представленные и обсуждаемые в публикациях модели процессов передачи усилия от миофиламентов к сухожилию (представляющих одну из интереснейших проблем мышечного сокращения) не отражают адекватно современное представление о функционировании
_МЕЖДУНАРОДНЫЙ НАУЧНЫЙ ЖУРНАЛ «СИМВОЛ НАУКИ» №1/2016 ISSN 2410-700Х_
мышцы. Наиболее часто в публикациях приводится трехкомпонентная модель мышцы [1, с. 147]. Основной недостаток этой модели состоит в том, что в скелетной мышце, в отличие от модели, миофибриллы не сопрягаются с сухожилиями. В модель мышцы, приведенной в [2, с. 11], не включены структуры, определяющие расположение саркомеров внутри сарколеммы.
Наиболее часто в публикациях приводится трехкомпонентная модель мышцы [1, с. 147]. Основной недостаток этой модели состоит в том, что в скелетной мышце, в отличие от модели, миофибриллы не сопрягаются с сухожилиями. В модель мышцы, приведенной в [2, с. 11], не включены структуры, определяющие расположение саркомеров внутри сарколеммы.
На рис. 2 приведена предлагаемая модель сокращенного мышечного волокна, а на рис. 3 — схема мышцы, которая сокращается в концентрическом режиме (рс, рв, рп, рэ, — давление соответственно в сарколемме, волокне, перемизиуме, эпимизиуме).
Рисунок 2 — Схема деформированного мышечного волокна: 1 -сухожилие, 2 — эндомизиум, 3- базилярная мембрана, 4 сарколемма, 5 — костамеры, 6,7 — продольные и поперечные филаменты (волокна) цитоскелета
Рисунок 3 — Схема мышцы, сжатой при концентрическом режиме: 1 -сухожилие, 2 — эпимизиум, 3-перемизиум, 4- эндомизиум с базилярной мембраной, 5 — сарколемма, 6, 7 — миофибриллы
Сарколемма связана с сухожилием. При сокращении саркомеров уменьшается продольный размер сарколеммы, стягиваемой костамерами, соединенными с Ъ — дисками. Несжимаемая внутритканиевая жидкость, перемещаясь, создает давление и расширяет сарколемму. Деформированная сарколемма перемещает внутритканиевую жидкость и деформирует базальную мембрану и эндомизий. Деформация мышечных волокон вызывает последовательно деформацию перемизиума и эпимизиума. При этом внутритканиевая жидкость, находящаяся в промежутках между соединительно — тканными структурами, перемещаясь создает давления рс, рв, рп, рэ, и деформирует их. Деформированные соединительно — тканные структуры и уравновешивают ту нагрузку, которую преодолевает мышца.
При сокращении саркомеров уменьшается продольный размер сарколеммы, стягиваемой костамерами, соединенными с Ъ — дисками. Несжимаемая внутритканиевая жидкость, перемещаясь, создает давление и расширяет сарколемму. Деформированная сарколемма перемещает внутритканиевую жидкость и деформирует базальную мембрану и эндомизий. Деформация мышечных волокон вызывает последовательно деформацию перемизиума и эпимизиума. При этом внутритканиевая жидкость, находящаяся в промежутках между соединительно — тканными структурами, перемещаясь создает давления рс, рв, рп, рэ, и деформирует их. Деформированные соединительно — тканные структуры и уравновешивают ту нагрузку, которую преодолевает мышца.
При концентрическом и эксцентрическом режимах расширению сарколеммы препятствуют поперечные элементы цитоскелета, связывающие миофибриллы. Они разрушаются, если напряжения, возникающие в них, превышают допускаемые. При их разрушении нарушается ориентация миофибрилл.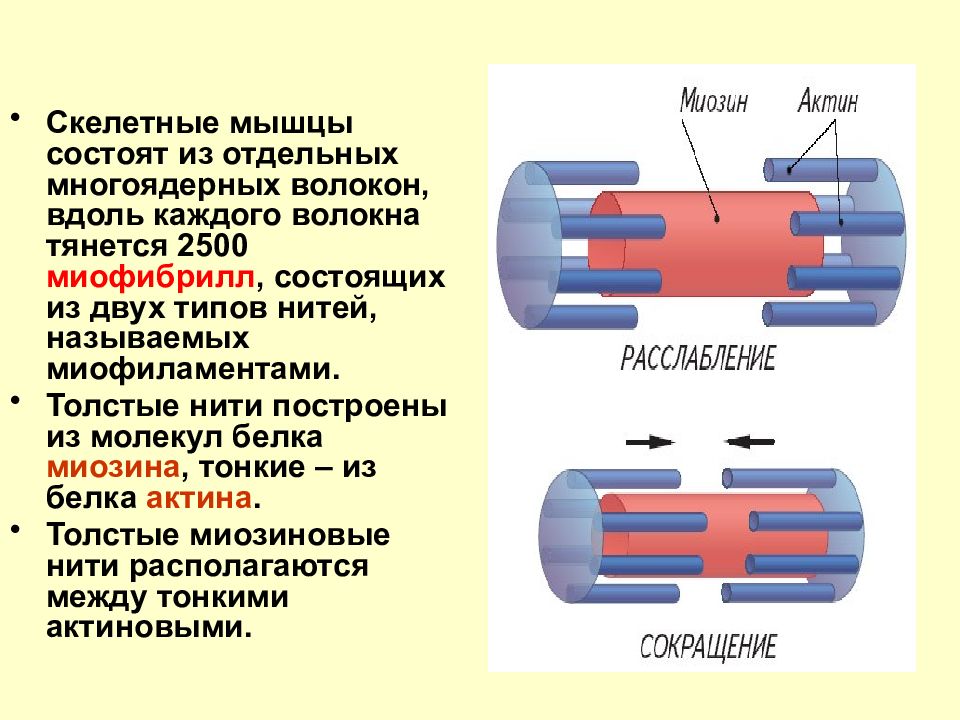 Повреждаются Ъ-диски, сарколемма, а также саркоплазматический ретикулум, содержащий кальций.
Повреждаются Ъ-диски, сарколемма, а также саркоплазматический ретикулум, содержащий кальций.
МЕЖДУНАРОДНЫЙ НАУЧНЫЙ ЖУРНАЛ «СИМВОЛ НАУКИ»
№1/2016
ISSN 2410-700Х
Повреждение сарколеммы приводит к активации клеток-сателлитов. За этим следует их деление и последующая гипертрофия мышечного волокна. При эксцентрическом режиме к изгибным деформациям соединительно — тканных структур добавляются деформации растяжения. Расширенная сарколемма вытягивается. Вытягиваются продольные волокна — филаменты цитоскелета. Список использованной литературы:
1. Бегун П.И., Шукейло Ю.А. Биомеханика: Учебник для ВУЗов.— СПб.: Политехника, 2000. — 463 с.
2. Вайн А. А. Явление передачи механического напряжения в скелетной мышце. Тарту: Изд. Тартуского университета, 1990. — 34 с.
Тарту: Изд. Тартуского университета, 1990. — 34 с.
© П.И. Бегун, 2016
УДК 504.05
Ковалева Екатерина Геннадьевна
канд. техн. наук, ст. преподаватель БГТУ им. В.Г, Шухова,
Северин Николай Николаевич д-р пед. наук, профессор БГТУ им. В.Г, Шухова, Ермоленко Сергей Анатольевич преподаватель БЮИ, г. Белгород, РФ E-mail: [email protected]
СИСТЕМА УПРАВЛЕНИЯ ПРИРОДНЫМИ РИСКАМИ
Аннотация
На основе научно-методического аппарата анализа природных рисков возникновения чрезвычайных ситуаций приведены схемы управления природными рисками в масштабе страны
Ключевые слова
природный риск, управление, опасность, идентификация, поражающий фактор.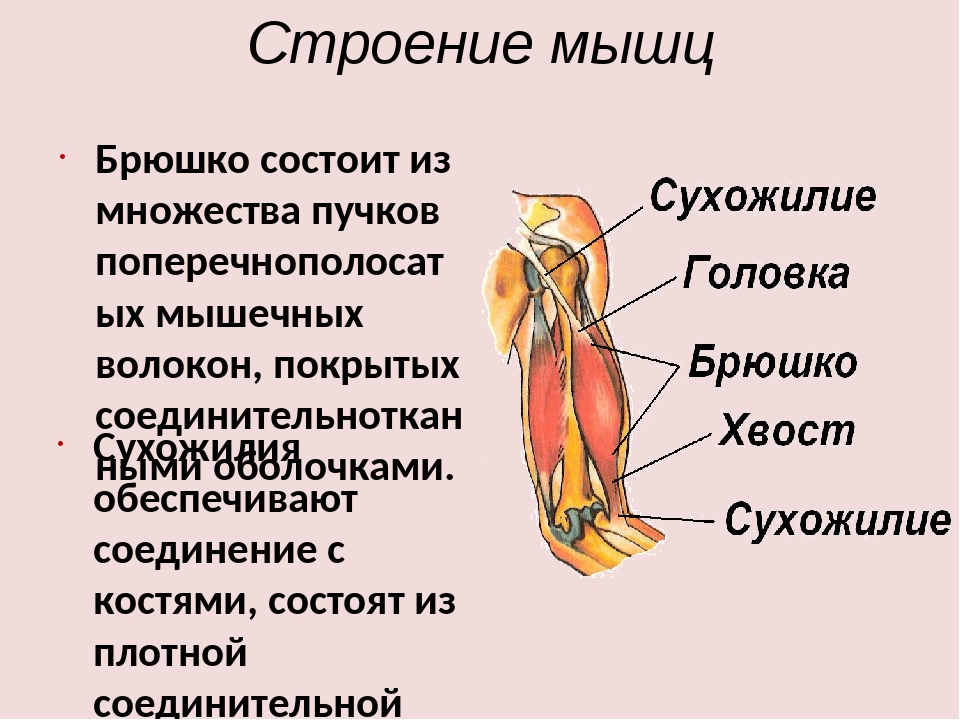
Одной из актуальных проблем обеспечения устойчивого развития как в долгосрочном, так и в краткосрочном плане является управление природными рисками (рисками стихийных бедствий). Под природным риском понимается возможность нежелательных последствий от природных процессов и явлений. Природный риск измеряется вероятной величиной потерь за определенный промежуток времени. Заблаговременное предвидение риска, выявление влияющих факторов, принятие мер по его снижению путем целенаправленного изменения этих факторов с учетом эффективности принимаемых мер составляет управление риском [1, c.41].
Управление должно быть рациональным. Так, в последнее десятилетие в России и во всем мире наблюдается негативная тенденция увеличения потерь от стихийных бедствий. Одной из причин этого явления является направленность государственной политики обеспечения безопасности населения и объектов хозяйства в основном на ликвидацию последствий стихийных бедствий, а не на их профилактику. Необходимость экономии расходов государства потребовала переоценки представлений о сложившемся (как правило, стихийно) соотношении затрат на превентивные меры по снижению рисков и смягчению последствий ЧС, на ликвидацию их последствий [2, c. 138]. Целесообразность проведения мер защиты должна быть обоснована с учетом экономических (в условиях жестких финансовых ограничений) и социальных факторов. Так, повышение уровня защищенности объектов на один порядок требует больших усилий в научно-технической сфере и существенных затрат, сопоставимых с 10-20% стоимости проекта.
Необходимость экономии расходов государства потребовала переоценки представлений о сложившемся (как правило, стихийно) соотношении затрат на превентивные меры по снижению рисков и смягчению последствий ЧС, на ликвидацию их последствий [2, c. 138]. Целесообразность проведения мер защиты должна быть обоснована с учетом экономических (в условиях жестких финансовых ограничений) и социальных факторов. Так, повышение уровня защищенности объектов на один порядок требует больших усилий в научно-технической сфере и существенных затрат, сопоставимых с 10-20% стоимости проекта.
Строение мышц и их значение
Мышцы как активная часть опорно-двигательной системы выполняют функцию движения. Они осуществляют дыхательные движения, движения глаз, глотание, обеспечивают мимику и образование звуков. Мышцы вместе со скелетом придают форму телу, удерживают его в равновесии и перемещают в пространстве.
У человека более 400 скелетных мышц. Они составляют около 1/3 массы тела взрослого человека. Общая масса скелетной мускулатуры у взрослого человека составляет 30–40% массы тела, у новорожденных – 20–22%. У пожилых и старых людей масса скелетных мышц несколько уменьшается (25–30%), если снижается мышечная активность. При высокой мышечной активности масса мышц сохраняется до глубокой старости.
Они составляют около 1/3 массы тела взрослого человека. Общая масса скелетной мускулатуры у взрослого человека составляет 30–40% массы тела, у новорожденных – 20–22%. У пожилых и старых людей масса скелетных мышц несколько уменьшается (25–30%), если снижается мышечная активность. При высокой мышечной активности масса мышц сохраняется до глубокой старости.
Среди скелетных мышц различают мышцы короткие и толстые, широкие и плоские, расположенные в основном на туловище, а также длинные и тонкие, которые находятся на конечностях.
Мышцы бывают гладкие, поперечно-полосатые скелетные и сердечные.
Гладкие мышцы входят состав стенок сосудов и составляют внутренние органы. Гладкая мышечная ткань состоит из одноядерных веретенообразных клеток. Возбуждение по ним проводится медленно и неподвластно воли и желанию человека, т. е. сокращение происходит непроизвольно.
Поперечно-полосатые мышцы (скелетные) состоят из мышечных пучков, покрытых одной общей гладкой соединительнотканной оболочкой. Между мышечными пучками расположены кровеносные сосуды и нервы. Мышечные пучки в свою очередь образованы поперечно-полосатыми мышечными волокнами.
Между мышечными пучками расположены кровеносные сосуды и нервы. Мышечные пучки в свою очередь образованы поперечно-полосатыми мышечными волокнами.
Строение мышц
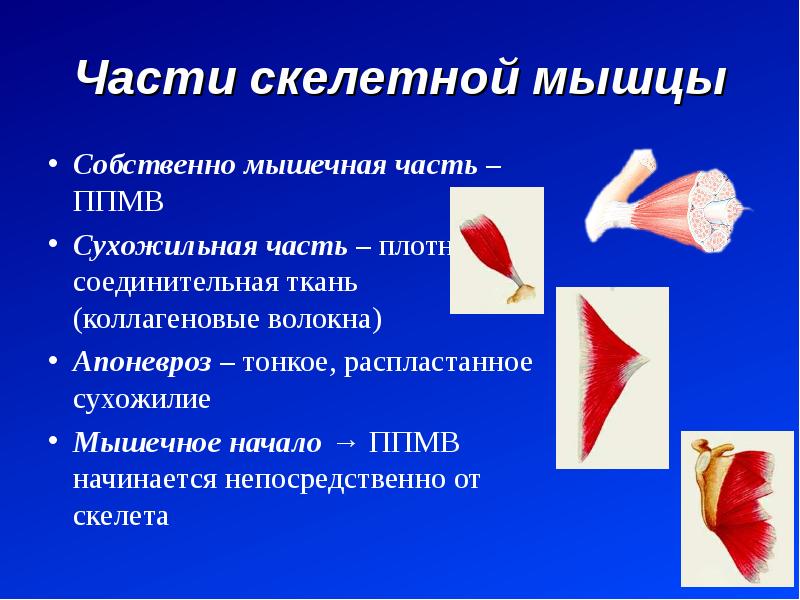
В каждой мышце различают сокращающуюся часть – мышечное брюшко (тело), и не сокращающуюся – сухожилие, с помощью которого мышцы прикрепляются к костям. Сухожилия обладают большой прочностью. Скелетные мышцы обоими концами прикрепляются к костям, что обеспечивает движение частей тела. Только мимические мышцы прикреплены одним концом к кости, а вторым – к коже.
Работа мышц
Сокращаясь, мышца укорачивается, утолщается и движется относительно соседних мышц. Укорочение мышцы сопровождается сближением ее концов и костей, к которым она прикрепляется. В каждом движении участвует обычно несколько групп мышц.
Мышцы одной группы, например передние мышцы плеча, сокращаются одновременно – синергисты.
Мышцы противоположной группы в это время расслабляются. Это мышцы-антагонисты (сгибатель – двуглавая мышца; разгибатель – трехглавая).
Это мышцы-антагонисты (сгибатель – двуглавая мышца; разгибатель – трехглавая).
В каждом движении участвуют мышцы, совершающие его и противодействующие ему, что придает движению точность и плавность.
Скелетная мышечная ткань (микроскопическое строение скелетных мышц) | Биология. Реферат, доклад, сообщение, краткое содержание, лекция, шпаргалка, конспект, ГДЗ, тест
Тема: Ткани организма
Есть три вида мышечной ткани: поперечнополосатая, гладкая и сердечная мышца.
| Рис. 32. Строение скелетной мышцы: 1 — мышца; 2 — мышечные пучки; 3 — перимизий; 4 — капилляр; 5 — мышечные волокна; 6 — миофибрилла; 7 — саркомер; 8 — тонкий миофиламент; 9 — толстый миофиламент; 10 — тропомиозин; 11 — актин; 12 — головка молекулы миозина; 13 — хвост молекулы миозина |
Скелетные мышцы — поперечнополосатые и состоят из огромного количества мышечных волокон цилиндрической формы, расположенных параллельно. Их диаметр — 0,01-0,1 мм, а длина может достигать нескольких сантиметров (рис. 32). Количество таких волокон неодинаково в разных мышцах: в мелких — несколько сотен, в больших — несколько тысяч. Их сила определяется площадью поперечного сечения всех волокон мышцы, то есть их количеством и толщиной.
Их диаметр — 0,01-0,1 мм, а длина может достигать нескольких сантиметров (рис. 32). Количество таких волокон неодинаково в разных мышцах: в мелких — несколько сотен, в больших — несколько тысяч. Их сила определяется площадью поперечного сечения всех волокон мышцы, то есть их количеством и толщиной.
Считается, что у взрослого человека численность мышечных волокон постоянная, а их диаметр зависит от тренированности мышц. Чем чаще и интенсивней работает мышца, тем её волокна толще, а, следовательно, она более сильная. Постоянные тренировки, физический труд способствуют увеличению диаметра мышечного волокна иногда даже вдвое.
Многоядерные клетки скелетных мышц — миоциты — имеют специфические органеллы — сократительные волокна, или миофибриллы (с гр. мышца и латин. волокно, нить), двух видов — толстые и тонкие. Это они придают мышце поперечную исчерчённость, которую можно увидеть под микроскопом. Миофибриллы образуют сократительные белковые молекулы чрезвычайно сложного строения, которые называются актином (образует тонкие волокна) и миозином (образует толстые волокна). Материал с сайта http://worldofschool.ru
В клетках мышцы есть огромные запасы гликогена. Он нужен ей как источник энергии во время сокращения (после превращения в глюкозу). Поскольку работа мышечной клетки очень напряжённая и требует много энергии и кислорода, в ней содержится много митохондрий.
Мышечные волокна образуют пучки, окружённые соединительной оболочкой — фасцией (с латин. повязка, связка). Она отделяет разные группы мышц, что обеспечивает уникальные сложные движения разных частей тела.
На этой странице материал по темам:2. микроскопическое строение скелетной мышцы.
Строение миофибрилл микроскопическое
Назовите типы мышечной ткани.
Объясните взаимосвязь микроскопического строения скелетной мышцы с его функцией.
Объясните особенности строения миофибрилл.
Из каких тканей состоят скелетные мышцы и их сухожилия?
ческая культура – одно из средств укрепления здоровья, все стороннего развития, подготовки к труду и защите родины. средствами ф. к. являются , спорт туризм, методы закаливания организма.
правительство всемерно поощряю развитие ф. к. и спорта среди населения страны, способствуют внедрению их в повседневный быт.
воспитание, начиная с самого раннего детского возраста, крепкого молодого поколения с гармоническим развитием и духовных сил. это требует всемерного поощрения всех видов массового спорта и культуры, в том числе в школах, вовлечения в физкультурное движение все более широких слоев населения, особенно молодежи.
физкультурное движение должно носить подлинно общенародный характер, базировался на научно-обоснованной системы воспитания, последовательно охватывающей всей группы населения, начиная с детского возраста.
занятие и спортом укрепляют здоровье детей, способствуют их правильному развитию. установлено, что большие умственные нервные нагрузки, не сочетаются с соответствующими нагрузками, крайне неблагоприятным влиянием окружающей среды, инфекциям. научные наблюдения показывают, что люди, регулярно занимающиеся с соблюдением правил личной гигиены, реже болеют, продуктивнее трудятся, дольше живут.
занятия культурой и спортом приобретают особенно большое значение в период научно-технической революции, когда мышечная деятельность все больше вытесняется применением техники. культура развитие патологических и предпатологических изменений, в развитии которых в той или иной степени играет роль недостаточная двигательная активность.
применение средств культуры с лечебной целью в больницах, санитарно-курортных учреждениях при заболеваниях опорно-двигательного аппарата, сердечно-сосудистой и дыхательной систем, нарушениях обмена веществ, после хирургических операций и др. повышает эффективность комплексного лечения, способствует различных осложнений, ускоряет сроки выздоровления и восстановления трудоспособности, является одним из компонентов реабилитации больных.
2. влияние вредных привычек на здоровье человека
одним из главных проблем xxi века во всем мире стали: табакокурение, алкоголизм и наркомания. во многих странах законы по борьбе с этим негативным явлением.
социально обусловленные и психологические причины этих явлений.
под психологическими причинами понимается совокупность мотивов, отдельные личности к употреблению спиртного, табака, наркотиков. трудности приспособление к внешней среде, конфликты с окружающим, неудовлетворенность одиночества, робость и т. д. вызывают психологическое состояния дискомфорта. связи с этим человек старается выйти из этого состояния с табакокурения, алкоголя и наркотиков. это вызывает ложное чувство решимости всех проблем. действия этих средств быстро проходят и вместе с этим возвращаются все проблемы.
распространение этих явлений среди молодежи способствует так же ложное мнение о тонизирующем действием алкоголя, бытующие представление, что потребление спиртных напитков – показатель зрелости, самостоятельности, силы и мужества, но это не так.
лечебная физкультура широко используется в системе комплексного лечения в больницах, поликлиниках, санаториях. она является ведущим методом медицинской реабилитации — восстановительного лечения. правильное применение лечебной физкультуры способствует ускорению выздоровления, восстановлению нарушенной трудоспособности и возращению больных активных трудовой деятельности.
основным средством лечебной физкультуры является – мышечные движения, являющиеся мощным биологическим стимулятором жизненных функций человека. лечебная физкультура использует весь арсенал средств, накопленный физкультурой. с лечебной целью применяют , специально подобранные и методически разработанные. предназначение врач учитывает особенности заболевания, характер и степень изменений системах и органов, стадию болезненного процесса, сведенья о параллельно проводимом лечении, и т. д. в основе лечебного действия лежит строго дозированная тренировка, под которой применительно к больным и ослабленным людям следует понимать целенаправленный процесс восстановления и совершенствования нарушенных функций целостного организма и отдельных его систем и органов. различают общую тренировка, последующую цель общего оздоровления и укрепления организма, и специальную тренировка направленную на устранение нарушенных функций определенных системах и органах.
в результате систематического применения развивается функциональная адаптация организма к постепенным возрастающим нагрузкам и коррекция (выравнивание) возн6икающих в процессе заболеваний нарушений.
Скелетная мышца — обзор
Митохондриальный гомеостаз и диабет
Скелетная мышца является важной тканью в метаболизме организма, и она играет важную роль в метаболизме и гомеостазе всего тела, отвечая за большую часть инсулина. индуцировал поглощение глюкозы (Thiebaud et al., 1982). GLUT4 (переносчик глюкозы 4 типа) является переносчиком глюкозы, ответственным за захват глюкозы мышечной тканью и адипоцитами. Количество этого переносчика при сахарном диабете II типа и инсулинорезистентности снижается (Schreiber et al., 2017) и его транслокация нарушена (Jaldin-Fincati et al., 2017). ATX накапливается в скелетных мышцах, что приводит к активации IRS-1, фосфорилированию Akt и транслокации GLUT4 в скелетных мышцах, что приводит к увеличению секреции и чувствительности к инсулину и снижению уровня глюкозы в крови (Sztretye et al., 2019).
Окислительный стресс в результате увеличения производства АФК или снижения уровня антиоксидантной ферментной системы приводит к заболеванию. Часто дисфункция митохондрий участвует в возникновении заболеваний, связанных с окислительным стрессом.ATX — мощный антиоксидант, поддерживающий метаболическую эффективность митохондрий; следовательно, это потенциальный терапевтический агент для предотвращения или замедления прогрессирования заболевания.
Вольф и его коллеги обнаружили, что ATX поддерживает функцию митохондрий, защищает митохондриальный окислительно-восстановительный баланс, значительно снижает окислительный стресс и поддерживает митохондрии в восстановленном состоянии. Он также предотвращает потерю ММП и увеличивает потребление митохондриального кислорода (Wolf et al., 2010). Кроме того, он может предотвратить дисфункцию митохондрий (Zhang et al., 2016; Куроки и др., 2013). Он также подавляет генерацию АФК, индуцированную 1-метил-4-фенилпиридинием +, увеличивая активность СОД и каталазы, тем самым предотвращая уменьшение открытия ММП и переходной поры проницаемости митохондрий (Lee et al., 2011).
ATX снижает уровни ROS и увеличивает MMP в модели воспалительной преэклампсии in vitro (Xuan et al., 2016). В другом исследовании in vivo окислительное повреждение было смягчено, нарушенная функция митохондрий была восстановлена, а содержание митохондрий, выработка АТФ и активность сложной дыхательной цепи были увеличены, что позволяет предположить, что ATX увеличивает митохондриальную эффективность и предотвращает старение (Park et al., 2013).
Было исследовано влияние ATX на митохондриальную дисфункцию у ишемизированных мышей. Результаты показали, что митохондрии, изолированные из ишемизированного миокарда мышей, демонстрируют более высокие уровни продукции mtROS и митохондриальной деполяризации. Обработка ATX снижает продукцию mtROS, деполяризацию и набухание митохондрий (Pongkan et al., 2017).
Исследование показало, что ATX ингибирует высвобождение цитохрома c в результате проницаемости митохондрий и, таким образом, предотвращает апоптотическую смерть, опосредованную митохондриями (Kim and Kim, 2018).
Диабет — серьезное заболевание, от которого страдают миллионы людей во всем мире. Гипергликемия и другие метаболические синдромы, повышающие риск диабета, стимулируют выработку АФК в митохондриях (Ballinger, 2005). Окислительный стресс приводит к хроническому воспалительному состоянию, связанному с повышенным производством АФК, вызывая клеточную дисфункцию и апоптоз (Ballinger, 2005; Murillo and Fernandez, 2016). ATX снижает продукцию ROS и активных форм азота (RNS), вызванную гипергликемией, особенно в митохондриях (Kim et al., 2009а). Он также подавляет воспалительную передачу сигналов и апоптоз, которые возникают при диабете (Otton et al., 2010), снижает окислительный стресс и улучшает метаболический профиль глюкозы и жирных кислот, предотвращая повреждение и клеточную дисфункцию в органах (Naito et al., 2004 ; Xu et al., 2015; Yeh et al., 2016).
Он также облегчает диабетические осложнения, такие как нейропатия, ретинопатия и нефропатия (Naito et al., 2004; Xu et al., 2015; Yeh et al., 2016; Kim and Kim, 2018). Исследования на животных также показали, что ATX снижает гипергликемию и увеличивает секрецию инсулина и чувствительность за счет улучшения метаболизма глюкозы и дисфункции β-клеток за счет регуляции GLUT4 (Ishiki et al., 2013; Бхуванесвари и Анурадха, 2012). Было показано, что ATX у мышей обладает антигипергликемическим действием, сохраняет функцию β-клеток и снижает гликотоксичность (Naito et al., 2004; Uchiyama et al., 2002).
В мезенхимальных клетках человека (NHMC), стимулированных высокими уровнями глюкозы, ATX снижает продукцию mtROS и ингибирует активацию NF-κB, индуцированную высоким уровнем глюкозы. Он снижает уровни аддуктов 4-гидрокси-2,3-ноненаля, маркеров окисления липидов, в митохондриях NHMCs (Manabe et al., 2008).
Часто у пациентов с сахарным диабетом наблюдается высокий уровень окислительного стресса. Исследования показали, что ATX при диабете улучшает уровни глюкозы и инсулина в сыворотке, снижает окислительный стресс (Uchiyama et al., 2002) и защищает β-клетки поджелудочной железы от гликотоксичности (Otton et al., 2010).
В клинических испытаниях изучались эффекты приема добавок ATX у людей с диабетом II типа. Они отметили снижение артериального давления, жировых отложений и триглицеридов крови, а также улучшение метаболизма глюкозы (Mashhadi et al., 2018). Кроме того, в том же исследовании наблюдалась обратная связь между адипонектином и холестерином ТГ и липопротеинами очень низкой плотности (ЛПОНП). Усиление катаболизма ЛПОНП за счет увеличения экспрессии липопротеинлипазы и рецептора ЛПОНП, связанное с повышенной инсулинорезистентностью, считается механизмом, лежащим в основе снижения концентрации ТГ в сыворотке (Hussein et al., 2007; Yoshida et al., 2010).
38.4B: Волокна скелетных мышц — Биология LibreTexts
Скелетные мышцы состоят из поперечно-полосатых субъединиц, называемых саркомерами, которые состоят из миофиламентов актина и миозина.
Цели обучения
- Обрисовать структуру волокна скелетных мышц
Ключевые моменты
- Мышцы состоят из длинных пучков миоцитов или мышечных волокон.
- Миоциты содержат тысячи миофибрилл.
- Каждая миофибрилла состоит из множества саркомеров, функциональной сократительной области поперечно-полосатой мышцы. Саркомеры состоят из миофиламентов миозина и актина, которые взаимодействуют, используя модель скользящей нити и цикл поперечного мостика для сокращения.
Ключевые термины
- саркоплазма : Цитоплазма миоцита.
- саркоплазматическая сеть : эквивалент гладкой эндоплазматической сети в миоците.
- сарколемма : клеточная мембрана миоцита.
- саркомер : Функциональная сократительная единица миофибриллы поперечно-полосатой мышцы.
Структура волокон скелетных мышц
Миоциты, иногда называемые мышечными волокнами, образуют основную массу мышечной ткани.Они связаны перимизием, оболочкой из соединительной ткани, в пучки, называемые пучками, которые, в свою очередь, соединяются вместе, образуя мышечную ткань. Миоциты содержат множество специализированных клеточных структур, которые способствуют их сокращению и, следовательно, сокращению мышцы в целом.
Высокоспециализированная структура миоцитов привела к созданию терминологии, которая отличает их от общих клеток животных.
Родовая клетка> Миоцит
Цитоплазма> Саркоплазма
Клеточная мембрана> Sarcolemma
Гладкая эндоплазматическая сеть> Саркоплазматическая сеть
Структура миоцитов
Миоциты могут быть невероятно большими, диаметром до 100 микрометров и длиной до 30 сантиметров.Саркоплазма богата гликогеном и миоглобином, которые хранят глюкозу и кислород, необходимые для выработки энергии, и почти полностью заполнена миофибриллами, длинными волокнами, состоящими из
миофиламентов, которые способствуют сокращению мышц.
Сарколемма миоцитов содержит многочисленные впячивания (ямки), называемые поперечными канальцами, которые обычно перпендикулярны длине миоцита. Поперечные канальцы играют важную роль в снабжении миоцитов ионами Ca + , которые играют ключевую роль в сокращении мышц.
Каждый миоцит содержит несколько ядер из-за того, что они произошли от нескольких миобластов, клеток-предшественников, которые дают начало миоцитам. Эти миобласты расположены на периферии миоцита и сплюснуты так, чтобы не влиять на сокращение миоцитов.
Рисунок \ (\ PageIndex {1} \): Миоцит: клетка скелетных мышц : клетка скелетных мышц окружена плазматической мембраной, называемой сарколеммой, с цитоплазмой, называемой саркоплазмой. Мышечное волокно состоит из множества миофибрилл, собранных в упорядоченные единицы.Структура миофибрилл
Каждый миоцит может содержать многие тысячи миофибрилл. Миофибриллы проходят параллельно миоциту и обычно проходят по всей его длине, прикрепляясь к сарколемме с обоих концов. Каждая миофибрилла окружена саркоплазматической сетью, которая тесно связана с поперечными канальцами. Саркоплазматический ретикулум действует как приемник ионов Ca + , которые высвобождаются при передаче сигналов из поперечных канальцев.
Саркомеры
Миофибриллы состоят из длинных миофиламентов актина, миозина и других связанных белков.Эти белки организованы в области, называемые саркомерами, функциональной сократительной областью миоцита. Внутри саркомерного актина и миозина миофиламенты переплетаются друг с другом и скользят друг по другу посредством модели сокращения скользящей нити. Регулярная организация этих саркомеров придает скелетным и сердечным мышцам характерный полосатый вид.
Рисунок \ (\ PageIndex {1} \):Саркомер : Саркомер — это функциональная сократительная область миоцита, определяющая область взаимодействия между набором толстых и тонких нитей.
Миофиламенты (толстые и тонкие)
Миофибриллы состоят из более мелких структур, называемых миофиламентами. Существует два основных типа миофиламентов: толстые и тонкие. Толстые филаменты состоят в основном из белков миозина, хвосты которых соединяются вместе, оставляя головки открытыми для переплетенных тонких нитей. Тонкие нити состоят из актина, тропомиозина и тропонина. Молекулярная модель сокращения, которая описывает взаимодействие между актином и миозиновыми миофиламентами, называется циклом поперечных мостиков.
границ | Внеклеточный матрикс скелетных мышц — что мы знаем о его составе, регуляции и физиологической роли? Повествовательный обзор
Введение
Скелетные мышцы являются важным компонентом состава тела человека, обычно составляя более 40% и 30% общей массы тела у мужчин и женщин, соответственно (Kim et al., 2002). Наиболее очевидная функция скелетных мышц — генерировать силы, необходимые для поддержания вертикальной позы и движения.Однако скелетные мышцы также играют важную роль во многих других физиологических процессах, включая термогенез (Rowland et al., 2015), метаболизм (Baskin et al., 2015) и секрецию многочисленных пептидов для связи с другими тканями (Pedersen and Febbraio , 2012). Таким образом, укрепление и поддержание здоровья скелетных мышц имеет жизненно важное значение. Хотя в последние годы фармакологические имитаторы упражнений вызывают все больший научный интерес (Fan and Evans, 2017), именно физические упражнения по-прежнему считаются наиболее мощным и универсально применимым инструментом для этих целей.
За последние десятилетия были выполнены тысячи тренировочных исследований в попытке определить методы упражнений, наиболее подходящие для увеличения размера мышц и улучшения их функциональных характеристик в разных когортах (например, на момент написания этой рукописи Pubmed дал больше более 24 000 результатов по операторам поиска «упражнения» и «сила мышц»). Результаты этих исследований послужили источником вдохновения для различных рекомендаций по упражнениям, вероятно, наиболее известными из которых являются стенды с позициями, публикуемые и обновляемые нерегулярно Американским колледжем спортивной медицины (2009), Garber et al.(2011). Большинство исследований основывают свою оценку эффективности тренировочных вмешательств на исследовании сократительных мышечных клеток. Часто изучаемые параметры включают размер мышц, измеренный на уровне органа (Fisher et al., 2011) или на клеточном уровне (Schoenfeld, 2010), распределение типов волокон (Adams et al., 1993), архитектуру (Aagaard et al., 2001) как а также нервный импульс к мышцам (Folland and Williams, 2007).
Несмотря на обилие информации о пластичности скелетных мышц, часто упускается из виду тот факт, что мышечные волокна встроены во внеклеточный матрикс (ЕСМ), состоящий из сетки коллагеновых компонентов, а также смеси других макромолекул, таких как различные гликопротеины и протеогликаны.Недавние исследования показали, что ECM играет важную роль в развитии (Thorsteinsdóttir et al., 2011), росте (Fry et al., 2017) и восстановлении мышц (Calve et al., 2010), а также передаче сократительная сила (Street, 1983). Несмотря на то, что доказательства, демонстрирующие податливость ЕСМ, существуют, лишь в небольшом количестве исследований сообщается о его реакции на различные формы тренировок, предполагая, что физиологическая роль ЕСМ еще не полностью оценена специалистами по физическим упражнениям.Стремясь стимулировать дальнейшие исследования тренировочных реакций неконтрактильных компонентов скелетных мышц, мы предлагаем обзор текущего состояния знаний о составе, структуре и регуляции внеклеточного матрикса, его физиологической роли, нарушениях регуляции, связанных со старением и метаболизмом. расстройства, а также адаптации к физическим нагрузкам.
Состав и структура скелетных мышц ECM
ECM скелетных мышц представляет собой сложную сеть, состоящую из коллагенов, гликопротеинов, протеогликанов и эластина (Takala and Virtanen, 2000; Halper and Kjaer, 2014).Коллагены образуют сеть внутримышечной соединительной ткани (IMCT), то есть центральные фиброзные компоненты ECM. IMCT обычно изображается в виде трех слоев: (i) эндомизий, представляющий самый внутренний слой, который охватывает отдельные мышечные волокна, (ii) группы мышечных волокон, связывающие перимизий, и (iii) эпимизий, охватывающий всю мышцу. Большая структурная сложность сети ММКИ, подтвержденная сканирующими электронными микрофотографиями, предполагает, что эта традиционная классификация может быть упрощенной и что организация ЕСМ более высокого порядка еще нуждается в определении (Gillies and Lieber, 2011).Исследования фасциальных тканей также рассматривают слои IMCT как часть сложной системы взаимосвязанных и переплетенных соединительных тканей, которая «окружает, переплетается между собой и проникает во все органы, мышцы, кости и нервные волокна, обеспечивая тело функциональной структурой, и создание среды, которая позволяет всем системам организма работать интегрированно » (Adstrum et al., 2017; Stecco et al., 2018). Эта система, которую обычно называют фасциальной системой, все чаще признается важной мишенью в спортивной медицине (Zügel et al., 2018).
IMCT содержит различные формы коллагенов, среди которых наиболее распространены типы I и III (Duance et al., 1977; Light and Champion, 1984; Gillies and Lieber, 2011; McKee et al., 2019). Эндомизий взаимодействует с сарколеммой миофибр на специальной базальной мембране, которая состоит в основном из коллагена IV типа и ламинина (Sanes, 1982; Martin and Timpl, 1987; Kjaer, 2004). Было обнаружено, что концентрация этих двух компонентов различается в зависимости от типа мышечных волокон, при этом медленно сокращающиеся волокна характеризуются значительно более высокими концентрациями коллагена IV, но более низкими концентрациями ламинина (Kovanen et al., 1988). Ламинин, в свою очередь, служит лигандом для двух сарколеммальных рецепторов — гликопротеинового комплекса, ассоциированного с дистрофином, и интегрина α7β1 (Grounds et al., 2005) — расположенных на костамерах, которые представляют собой мембранные белковые структуры, выровненные в соответствии с Z- диски миофибрилл. Считается, что интегрины действуют двунаправленным образом, позволяя внутриклеточным сигнальным молекулам регулировать внешнюю адгезию (передача сигналов «Inside-Out») и передавать внешние стимулы для воздействия на клеточные процессы (передача сигналов «Outside-In») (Boppart and Mahmassani, 2019) .Таким образом, явный стресс цитоскелета индуцирует внутриклеточное связывание белков, таких как талин, винкулин или киндлин, что приводит к изменению конформации рецептора интегрина и позволяет внеклеточным доменам рецептора распространяться в направлении белков внутри ЕСМ. Кроме того, лиганды интегринов из внеклеточного пространства, такие как ламинин, коллаген или фибронектин, способствуют формированию высокоаффинного вертикального состояния, что приводит к усилению связывания с белками ЕСМ и кластеризации интегринов, особенно вдоль комплексов фокальной адгезии (Boppart and Mahmassani, 2019) .Гликопротеиновый комплекс, связанный с дистрофином, является еще одним важным фактором в обеспечении механической связи между сократительными компонентами скелетных мышц (т. Е. Актином) и взаимосвязанными слоями IMCT (Ervasti, 1993; Peter et al., 2011). Основные компоненты, связывающие сократительные элементы мышцы с интерстициальным матриксом, показаны на рисунке 1.
Рисунок 1. Основные компоненты внеклеточного матрикса скелетных мышц и его связь с сократительными компонентами мышцы.
Суперсемейство коллагена состоит в общей сложности из 28 различных членов, из которых типы I, III, IV, V, VI, XII, XIII, XIV, XV, XVIII и XXII, как было показано, присутствуют в зрелых скелетных мышцах в гене и / или уровень белка (Таблица 1). Формирующие фибриллы типы I и III, безусловно, наиболее многочисленны, и протеомные исследования показывают, что они вместе составляют примерно 75% от общего мышечного коллагена (McKee et al., 2019). Предполагается, что прочные параллельные волокна коллагена I типа, присутствующие в эндо-, пери- и эпимизиуме, придают мышцам прочность на разрыв и жесткость, тогда как коллаген III типа образует рыхлую сеть волокон, которая придает эластичность мышцам. эндо- и перимизий (Кованен, 2002).Коллаген типа IV, спиральная молекула, образует сетчатую структуру, которая составляет основу базальной пластинки (Sanes, 2003). Коллаген типа VI был обнаружен в эпимизиальном, перимизиальном и эндомизиальном интерстиции, но, в частности, в окрестностях базальной мембраны, где он взаимодействует с карбоксиконцевым глобулярным доменом коллагена типа IV (Kuo et al., 1997). Интересно, что коллаген VI имеет нетипичные неколлагеновые участки, образующие отчетливую микрофибриллярную сеть в большинстве соединительных тканей (Maaß et al., 2016). Мутации коллагена VI приводят к заболеваниям с сочетанным вовлечением мышц и соединительной ткани, включая врожденную мышечную дистрофию Ульриха, миопатию Бетлема, аутосомно-доминантную мышечную дистрофию пояса конечностей и аутосомно-рецессивный миосклероз (Bushby et al., 2014).
Таблица 1. Обзор коллагеновых компонентов внеклеточного матрикса скелетных мышц.
Коллаген типов XII, XIV, XIX и XXII относится к коллагенам, ассоциированным с фибриллами, с прерывистыми тройными спиралями (FACIT; Chiquet et al., 2014; Calvo et al., 2020), посредством чего коллаген типа XXII, по-видимому, экспрессируется исключительно в тканевых соединениях, таких как мышечно-сухожильные соединения в скелетных и сердечных мышцах (Koch et al., 2004).
Биоинформатические инструменты для скрининга протеома человека нормальных и больных тканей позволили охарактеризовать глобальный состав протеома ЕСМ, или «матрисомы». В общей сложности 1027 генов были связаны с ЕСМ, посредством чего основные белки матрисомы (гликопротеины ЕСМ, коллагены и протеогликаны) можно было отличить от белков, связанных с матрисомами (аффилированные с ЕСМ белки, регуляторы ЕСМ и секретируемые факторы, которые могут взаимодействовать с основными белками). Белки ЕСМ) (Naba et al., 2016). Учитывая сложность ткани скелетных мышц человека, включающей многоядерные мышечные волокна, иммунные клетки, эндотелиальные клетки, мышечные стволовые клетки, немиогенные мезенхимальные предшественники и другие мононуклеарные клетки (Bentzinger et al., 2013a), для выяснения этого потребуются будущие исследования. вклад каждой из этих клеток в структуру и реконструкцию IMCT. Сигнатуры генов, полученные, например, из последовательности РНК изолированных мышечных волокон и других типов клеток, представляют собой многообещающий инструмент для деконволюции основной массы скелетной мышечной ткани (Rubenstein et al., 2020).
Физиологическая регуляция генов ЕСМ
Гомеостаз ЕСМ поддерживается посредством точно настроенных анаболических и катаболических процессов, которые регулируются различными факторами роста, протеогликанами и ферментами, ответственными за деградацию коллагена. Было обнаружено, что после связывания с мембранно-связанными рецепторами факторы роста, принадлежащие к суперсемейству трансформирующих факторов роста бета (TGF-β), индуцируют фосфорилирование белков Smad, которые передают внеклеточные сигналы в ядро, где они активируют транскрипцию нижележащих генов, что приводит к продукции коллагена. (Макдональд и Кон, 2012).Другим, хотя и менее описанным, фактором аналогичной функции является фактор роста соединительной ткани (CTGF), избыточная экспрессия которого, как сообщается, провоцирует дистрофический мышечный фиброз и функциональные нарушения (Morales et al., 2011).
Функция этих анаболических факторов в основном регулируется небольшими протеогликанами, богатыми лейцином (SLRP). Декорин, прототип этого семейства, деактивирует профибротический TGF-β и CTGF (Zhu et al., 2007; Brandan and Gutierrez, 2013), а также ограничивает фибриллогенез путем прямого связывания с коллагеном I типа (Reese et al., 2013). Другой SLRP представлен бигликаном, который конкурирует с декорином за тот же сайт связывания на коллагене (Schönherr et al., 1995) и, вероятно, играет роль как в формировании, так и в регенерации мышц (Brandan et al., 2008).
Транскрипционная регуляция образования белков, по-видимому, является важным фактором пластичности ECM. В этом отношении было показано, что экспрессия белка в скелетных мышцах слабо регулируется на уровне мРНК, что приводит к большим различиям в содержании мРНК и белка в различных тканях (Wang et al., 2019). Интересно, что характер регуляции белка зависит от функции белка, посредством чего ассоциация между мРНК и белком выше для ECM и организации фибрилл коллагена (Makhnovskii et al., 2020). Другим интересным аспектом регуляции количества белков ЕСМ является тот факт, что индукция транскрипции для коллагена, по-видимому, довольно медленная, поскольку для полной индукции транскрипции требуется почти 3 дня. Напротив, скорость секреции адаптируется быстро, поскольку она повышается менее чем за 1 час.В клетках с высоким уровнем продуцирования коллагена этот путь контролируется посттранскрипционной регуляцией, которая требует контроля с обратной связью между скоростями секреции и трансляции (обзор у Schwarz, 2015).
Что касается ремоделирования ткани, два семейства ферментов, матриксные металлопротеиназы (MMP) и тканевые ингибиторы металлопротеиназ (TIMP), участвуют в регуляции гомеостаза ECM. ММП представляют собой протеолитические ферменты, которые разрушают различные типы коллагенов и ингибируются ТИМП (Visse and Nagase, 2003; Alameddine, 2012).В частности, MMP-1 и MMP-8 инициируют деградацию коллагенов I и III (преобладающих в эндо-, пери- и эпимизии), тогда как MMP-2 и MMP-9 расщепляют коллаген IV типа (основной коллагеновый компонент базальная мембрана) (Corcoran et al., 1996). ТИМП-1, -2 и -4 способны ингибировать все известные ММП (Christensen and Purslow, 2016).
ЕСМ и сила скелетных мышц
Взаимодействие актина и миозина, а также многих других саркомерных белков приводит к укорочению мышечных волокон.Традиционные биомеханические модели часто изображают мышечно-сухожильные единицы как системы, в которых силы, возникающие в результате укорочения волокна, передаются продольно вдоль мышечного волокна и далее в мышечно-сухожильном соединении на сухожилие. Рядом с мышечно-сухожильным соединением миофибриллы имеют отростки, похожие на пальцы, которые образованы из инвагинаций плазматической мембраны (Knudsen et al., 2015). Эта структура увеличивает площадь поверхности, доступную для передачи усилия. Ожидается, что передача силы будет происходить между пальцевидными отростками мышечного волокна и коллагеновыми волокнами, расположенными внутри инвагинаций, посредством срезания базальной пластинки (Huijing, 1999).Содержащиеся здесь коллагены относятся к типу XXII, который образует внутренний слой, а также к III, VI, XII и XIV, которые расположены дальше от мембраны мышечных волокон (Jakobsen et al., 2017). Хотя его точная роль до сих пор неясна, интересно отметить, что в мышцах коллаген XXII располагается исключительно в мышечно-сухожильном соединении. У рыб-зебр дефицит коллагена XXII, как было обнаружено, приводит к мышечной дистрофии (Charvet et al., 2013), предполагая, что этот коллаген может служить для поддержания структурной целостности и стабилизации мышечно-сухожильного соединения.
Однако, учитывая тот факт, что значительная часть волокон в длинных мышцах оканчивается внутрипучко, не достигая непосредственно сухожилия (Barrett, 1962; Hijikata et al., 1993), очевидно, что мышечно-сухожильный путь не может представлять собой единственный механизм передачи силы. . Внутрисосудистые концевые волокна должны полагаться на среду, расположенную параллельно им, чтобы передавать свои силы на пассивные компоненты опорно-двигательной системы (Sheard, 2000). Как впервые было обнаружено Street (1983), именно сеть IMCT в ECM способствует такой боковой передаче сократительной силы.Передача силы через сеть IMCT происходит от сократительных белков через костамеры к эндомизию (Bloch and Gonzalez-Serratos, 2003; Peter et al., 2011) — как показывают исследования моделирования, посредством сдвига (Sharafi and Blemker, 2011; Zhang and Gao, 2012). ) — и далее в перимизий, который окончательно сливается с апоневрозами и сухожилиями (Passerieux et al., 2007). Первые сведения о пропорциях передачи продольной и поперечной силы в поперечнополосатых мышцах получены из элегантных экспериментов Huijing et al.(1998). После разрыва прямых соединений нескольких головок длинного разгибателя пальцев большого пальца крысы, соответствующих 55% общей мышечной массы, от суставного сухожилия, Huijing et al. (1998) наблюдали, что сила поддерживалась на уровне 84% от силы неповрежденной мышцы. Совсем недавно Ramaswamy et al. (2011) использовали коромысло для прямого измерения сил, передаваемых по продольным и поперечным путям. Их результаты не только подтвердили, что более 50% силы передавалось в боковом направлении, но также показали, что передача боковой силы была значительно снижена как у дистрофических, так и у старых грызунов.Позже их результаты были подтверждены Чжаном и Гао (2014).
Некоторые аргументы предполагают, что боковая передача силы является биомеханической необходимостью для поддержания целостности мышц и повышения эффективности сокращения. Во-первых, он помогает распределять сократительные силы по всей поверхности миофибрилл, что снижает механическое напряжение и защищает волокна от чрезмерного растяжения. Это может быть особенно важно в концевых областях волокон, которые обычно имеют конус и поэтому не подходят для выдерживания чрезмерных усилий (Monti et al., 1999). Косвенная поддержка этой гипотезы обеспечивается исследованиями с участием пожилых людей (Hughes et al., 2016) или пациентов, страдающих дистрофией Дюшенна (Virgilio et al., 2015), у которых дистрофин (то есть костамерный белок, который устанавливает механическую связь между цитоскелет, сарколемма и ECM и, таким образом, способствует передаче латеральной силы) либо утрачены, либо нарушены, а восприимчивость к травмам от растяжения мышц увеличивается.
Кроме того, считается, что передача латеральной силы приводит к сокращению волокон моста либо в разное время, либо в неравной степени (Yucesoy et al., 2006), что поможет поддерживать выравнивание волокон и, таким образом, структурную целостность мышцы (Purslow, 2002). Недавно Dieterich et al. (2017) сравнили начало сокращения, определенное электромиографией и УЗИ в M-режиме. Как ни странно, авторы обнаружили, что начало движения предшествует электромиографическому сигналу в ~ 20% исследований, что можно объяснить переносом боковой силы. Действительно, хотя продольная передача сил может быть задержана из-за необходимости натягивать эластичные элементы, размещенные последовательно с мышцей (Nordez et al., 2009), трансламинарное сцепление сдвига между мышечными волокнами и сетью IMCT может обеспечить немедленную передачу силы. Наконец, передача боковой силы обеспечивает механизм, посредством которого сила может по-прежнему генерироваться и передаваться от мышечных волокон, которые прерваны из-за микротравм или во время роста мышц (Purslow, 2010).
Помимо своей роли в латеральной передаче сократительной силы, ECM может также влиять на укорочение мышечных волокон. Часто предполагается, что сократительная способность миофибрилл ограничивается геометрией составляющих его саркомеров: саркомера и, таким образом, укорочение волокна прекращается, когда полосы z входят в контакт с миозиновыми нитями.Однако эти идеи рассматривают только поведение саркомера как независимого исполнительного механизма. В условиях in vivo мышечные волокна встраиваются в сеть IMCT, что может препятствовать укорочению волокон. Действительно, принцип постоянного объема (Baskin and Paolini, 1967) диктует, что во время укорачивания мышечные волокна должны подвергаться радиальному расширению, что уже давно экспериментально подтверждено даже на саркомерном уровне (Brandt et al., 1967). Новые вычислительные модели и измерений in situ в мышцах лягушки Азизи и др.(2017) продемонстрировали, что сокращение мышц затруднено, когда радиальное расширение ограничено физическими ограничениями. Следовательно, изменения количества и механических свойств сети IMCT, в которую встроены мышечные волокна, могут напрямую влиять на сократимость скелетных мышц. Такой сценарий может быть представлен мышечным фиброзом (Gillies et al., 2017).
ECM в развитии, росте и восстановлении скелетных мышц
Помимо передачи силы, ECM скелетных мышц выполняет несколько важных функциональных ролей.Очевидно, сеть ММКИ обеспечивает механическую поддержку мышечным волокнам, а также поддерживающим их нервам и кровеносным сосудам. Кровеносные капилляры проходят в промежутках, занятых эндомизием, их количество и плотность зависят от размера мышечных волокон (Janácek et al., 2009). Помимо этой наиболее очевидной роли, взаимодействие между миобластами, дифференцированными мышечными волокнами и компонентами внеклеточного матрикса имеет центральное значение для эмбриогенного развития, дальнейшего роста и восстановления мышечной ткани.
Клеточным источником коллагеновых компонентов мышечного ECM являются специальные фибробласты IMCT, которые происходят из различных эмбриогенных источников, включая сомиты (Nowicki et al., 2003), мезодерму латеральной пластинки (Pearse et al., 2007) и нервную систему. клетки гребня (Olsson et al., 2001). Поскольку они продуцируют не только фибробласты, но и адипогенные клетки, фибробласты IMCT могут рассматриваться как фиброипогенные предшественники (Uezumi et al., 2010). Недавние исследования предоставили доказательства того, что, помимо этих очевидных ролей, фибробласты IMCT и производимые ими соединительные ткани влияют на миогенез (т.е.д., образование мышечных предшественников и их дифференциация в многоядерные миофибриллы) и морфогенез мышц (то есть процесс, в котором миофибры собираются в мышцы), таким образом действуя как важные регуляторы развития мышц. Эти сложные регуляторные процессы, происходящие во время эмбриогенного развития, здесь подробно не рассматриваются, но были подробно рассмотрены в других источниках (Nassari et al., 2017; Sefton and Kardon, 2019). Вкратце, IMCT направляет мышечных предшественников к их назначенным областям-мишеням посредством комбинации привлекательных (фактор роста гепатоцитов, фактор, производный стромальными клетками) и отталкивающих сигналов (эфрин) (Dietrich et al., 1999; Swartz et al., 2001). Посредством множества факторов транскрипции, экспрессируемых в фибробластах IMCT, IMCT затем способствует пролиферации, выживанию и дифференцировке соседних миобластов в зрелые миофибриллы (Kardon et al., 2003; Hasson et al., 2010; Iwata et al., 2013; Vallecillo -García et al., 2017). Таким образом, можно предположить, что IMCT служит мезодермальным препаттерном, который контролирует участки дифференцировки миофибрилл и, следовательно, окончательное положение, размер и форму мышц.
Как постмитотические ткани, скелетные мышцы зависят от сателлитных клеток для адаптации и регенерации на протяжении всей жизни. Эти стволовые клетки располагаются в специализированных нишах между сарколеммой мышечных волокон и их инкапсулирующими базальными мембранами. Поддержание, активация и дифференцировка сателлитных клеток регулируются сложными каскадами факторов транскрипции. Для подробного обзора этих сотовых схем читатели могут обратиться к недавнему обзору Almada and Wagers (2016). Имея особое отношение к этой рукописи, растущее количество доказательств указывает на то, что на судьбу сателлитных клеток также сильно влияют взаимодействия с нишей ECM, в которой они находятся.Действительно, как динамическая среда ниша стволовых клеток передает механические и химические сигналы, которые действуют, защищая покоящиеся стволовые клетки или индуцируя активацию, пролиферацию и дифференцировку.
В состоянии покоя сателлитные клетки экспрессируют канонический клеточный регулятор спаренный бокс-белок 7 (PAX7) (Olguin and Olwin, 2004). Исследования in vitro показали, что большая часть сателлитных клеток экспрессирует PAX7 при культивировании на матригеле, смеси белков ЕСМ и факторов роста (Wilschut et al., 2010; Грефте и др., 2012). Дальнейшее подтверждение идеи, что ECM активно участвует в поддержании покоя сателлитных клеток, происходит из сообщений о том, что сателлитные клетки, удаленные из своей ниши, быстро входят в клеточный цикл и теряют свою способность к миогенной дифференцировке (Gilbert et al., 2010). Интересно, что сателлитные клетки, по-видимому, также способны воспринимать различные механические свойства ECM и реагировать на них. Фактически, экспрессия PAX7 и выживаемость сателлитных клеток выше при культивировании на гидрогелях, имитирующих физиологическую жесткость мышц (Gilbert et al., 2010). Кроме того, сателлитные клетки, культивируемые на мягком гидрогеле, обладают большей функциональной способностью после трансплантации в мышцу реципиента (Cosgrove et al., 2014).
Кроме того, было показано, что компоненты ECM влияют на деление стволовых клеток. В частности, белки фибронектин (Bentzinger et al., 2013b) и коллаген VI (Urciuolo et al., 2013), а также протеогликаны синдекан 3, синдекан 4, перлекан и декорин (Cornelison et al., 2001; Brack et al. ., 2008) были определены как составляющие ниши, влияющие на баланс между дифференцировкой и самообновлением и, таким образом, на поддержание регенеративной способности скелетных мышц.
При мышечной травме или в ответ на повышенную нагрузку обычно в основном покоящиеся сателлитные клетки активируются и дифференцируются в миобласты, чтобы окончательно слиться в зрелые миофибриллы. Хотя этот процесс требует своевременной экспрессии различных факторов транскрипции, таких как миогенный фактор 5, белок миогенной детерминации или миогенин (Almada and Wagers, 2016), несколько исследований указывают на влияние ECM на каждый из этих этапов. Эксперименты с миобластами мышей (Grefte et al., 2012) или свиней (Wilschut et al., 2010) показали, что на слияние миобластов положительно влияет матригель, но не отдельные субстраты, присутствующие в нише ECM. Вклад отдельных белков все еще плохо изучен, однако одновременное присутствие поли- D -лизина и ламинина (Boonen et al., 2009), гликозаминогликанов (Rønning et al., 2013) и протеогликанов сульфата гепарина (Gutiérrez и Brandan, 2010), по-видимому, играют важную роль в пролиферации и дифференцировке сателлитных клеток. После активации стволовых клеток скелетных мышц локальное ремоделирование ВКМ сопровождается отложением ламинина-α1 и ламинина-α5 в базальной пластинке ниши сателлитных клеток (Rayagiri et al., 2018). На мышах было показано, что мышечные сателлитные клетки продуцируют коллагены ЕСМ для поддержания покоя клеточно-автономным образом, при этом коллаген V является критическим компонентом покоящейся ниши, поскольку истощение приводит к аномальному вхождению в клеточный цикл и постепенному уменьшению стволовых клеток. бассейн (Багдади и др., 2018). Так же, как для поддержания покоя, адекватные механические свойства ниши ECM также могут быть важны для созревания сателлитных клеток. Действительно, было обнаружено, что миотрубки оптимально дифференцируются на субстратах с мышечной жесткостью (Engler et al., 2004). В совокупности эти данные предполагают, что усиление жесткости ВКМ, сопровождающее как различные скелетно-мышечные нарушения, так и процесс старения, может отрицательно влиять на регенеративную способность мышцы.
Ремоделирование мышц ECM со старением
В более старшем возрасте скелетные мышцы обычно демонстрируют фиброзную морфологию (Lieber and Ward, 2013). В отличие от фасциального уплотнения, при котором может сохраняться общая структура коллагенов (Pavan et al., 2014), возрастной мышечный фиброз характеризуется потерей четкой двунаправленной ориентации решетки здоровых перимизиальных волокон коллагена и его замещением. из-за неустойчивой оптоволоконной сети со сниженным образованием складок (Ярвинен и др., 2002). Кроме того, может увеличиваться абсолютное содержание коллагена и (неферментативное) сшивание коллагеновых волокон (Haus et al., 2007b). Таким образом, модуль упругости ЕСМ может быть увеличен примерно в 35 раз (с ~ 12 кПа в молодых до ~ 418 кПа в старых мышцах; Yin et al., 2013), причем этот эффект обусловлен накоплением плотно упакованных и сильно сшитый коллаген (Wood et al., 2014). У крупных и долгоживущих животных, таких как тюлени Уэдделла, наблюдалось увеличение внеклеточного пространства на 35-40% по мере увеличения общего и относительного содержания коллагена с возрастом.Однако это увеличение связано со сдвигом в сторону более высокого отношения коллагена типа I к коллагену типа III (Hindle et al., 2009). Более того, концентрация коллагена IV типа повышается в базальной пластинке медленно сокращающихся мышц, тогда как концентрация ламинина, по-видимому, снижается с возрастом (Kovanen et al., 1988). Было также показано, что повышенное отложение белков базальной пластинки вытесняет сателлитные клетки из их ниш, что влияет на регуляцию делений сателлитных клеток (Snow, 1977) и может объяснять меньшее количество сателлитных клеток, обычно подсчитываемых в старых мышцах по сравнению с молодыми мышцами. (Brack et al., 2007). Утрата и функциональная инактивация стволовых клеток, которые негативно влияют на гомеостаз тканей, могут рассматриваться как общий признак старения (López-Otín et al., 2013), который следует рассматривать как универсальную силу, приводящую к старению мышц (Brack and Muñoz-Cánoves, 2016) и другие ткани (Oh et al., 2014). Помимо воздействия на сателлитные клетки, нерегулируемая базальная пластинка также, как ожидается, нарушит регенеративную способность мышц из-за неадекватной поддержки мышечных волокон и дезорганизованной ориентации каркаса (Sanes, 2003).Обзор, включающий обширный обзор эффектов старения на ECM скелетных мышц, был недавно опубликован Etienne et al. (2020).
Интересно, что данные транскрипционного профилирования мышц молодых и старых крыс предполагают, что из 682 наборов зондов, которые значительно различались между молодыми и старыми животными, 347 генов фактически уменьшились (а не увеличились) в старых / саркопенических мышцах по сравнению с молодыми мышцами. Было показано, что из этих генов 24% играют биологическую роль в ECM и клеточной адгезии (Pattison et al., 2003). Эти данные подтверждают гипотезу о том, что возрастные изменения в ECM могут быть вызваны сниженной способностью к деградации, а не повышенным синтезом коллагеновых структур. В частности, ММП, по-видимому, играют важную роль в этих процессах (de Sousa Neto et al., 2018). Это также подтверждается данными, которые предполагают снижение способности структур ВКМ к ремоделированию структур ВКМ в старых мышцах, вызванное упражнениями с отягощениями (Wessner et al., 2019). Хотя механизмы еще полностью не изучены, также считается, что эти изменения напрямую ухудшают функцию мышц, препятствуя сократимости волокон (Azizi et al., 2017) и передача поперечной силы (Sharafi and Blemker, 2011).
Нарушение регуляции ECM скелетных мышц вследствие метаболических нарушений
Хорошо известно, что скелетные мышцы играют важную роль в стимулированном инсулином поглощении глюкозы (Richter and Hargreaves, 2013). Роль ECM в этом контексте может быть менее ясной. Мышцы-специфичные интегрин-β1-дефицитные мыши демонстрируют снижение скорости инфузии глюкозы, стимулированной инсулином, и клиренса глюкозы, несмотря на отсутствие изменений в приеме пищи, весе, глюкозе натощак, уровнях инсулина и экспрессии белка GLUT4 (Zong et al., 2009), подтверждая связь между аберрантной передачей сигналов интегрина и развитием диабета 2 типа. Более того, на животной модели диабета было показано, что нарушение чувствительности к инсулину связано со снижением уровней белка изоформы дистрофина Dp427 и субкомплекса альфа / бета-дистрогликана (Mulvey et al., 2005).
Повышенное количество коллагена типа I и III было обнаружено как у пациентов с диабетом 2 типа, так и у недиабетиков с ожирением (Berria et al., 2006), а перекорм у людей был связан с увеличением экспрессии генов, связанных с IMCT (коллагены I, III, IV, V, SPARC, интегрин; Tam et al., 2014) и изменения в генных путях, связанных с взаимодействием рецепторов ECM, фокальной адгезией и сращиванием (Tam et al., 2017). Однако кормление мышей диетой с высоким содержанием жиров привело к снижению уровней экспрессии генов COL1, COL3 и COL6, но не уровня белка (Tam et al., 2015).
Деградация коллагенов посредством MMPs, как было показано, является важным компонентом ремоделирования ECM (Cui et al., 2017). Может ли это быть правдой и в контексте диабета, было исследовано в исследовании на животных.Интересно, что генетическое истощение MMP9 не вызывало инсулинорезистентности у худых мышей, несмотря на то, что приводило к увеличению коллагена IV. Однако, когда мышей кормили диетой с высоким содержанием жиров, делеция вызывала глубокое состояние инсулинорезистентности. Эти результаты еще больше усиливают роль компонентов ММКИ в развитии мышечной инсулинорезистентности, особенно в состоянии переедания (Kang et al., 2014).
Наконец, гиалуронан, основной компонент ЕСМ, увеличивается при ожирении у мышей, вызванном диетой с высоким содержанием жиров.Для лечения инсулинорезистентности с сопутствующим уменьшением жировой массы, размера адипоцитов, а также печеночной и мышечной инсулинорезистентности (Kang et al., 2013) предлагается лечение с помощью PEGPh30, который дозозависимо снижает гиалуронан в мышечном ECM.
Подводя итог, можно сказать, что различные компоненты ECM влияют на различные стадии диабета. Исследования о том, связан ли диабет со слабостью мышц, противоречивы (Leong et al., 2015; Li et al., 2016), и еще предстоит выяснить, имеют ли непосредственное отношение к этому контексту изменения в проводящих путях, связанных с ECM.
Адаптация к физическому воспитанию и неиспользование
Первые свидетельства, указывающие на гибкость ММКИ в ответ на физическую активность, были опубликованы еще в 1970-х годах, когда Suominen и Heikkinen (1975) и Suominen et al. (1977) обнаружили более высокие уровни пролилгидроксилазы (фермента, способствующего биосинтезу коллагена) у тренированных на выносливость спортсменов, а также в продольном исследовании после восьми недель аэробных тренировок. Позже было обнаружено, что влияние упражнений на выносливость на активность проколлагеновых ферментов более выражено в красных мышцах по сравнению с белыми мышцами (Takala et al., 1983). Прямые измерения содержания коллагена, впервые проведенные в конце 1980-х годов, подтвердили, что содержание коллагена (тип IV) увеличилось в устойчивой к усталости камбаловидной мышце крыс после пожизненных тренировок на выносливость (Kovanen et al., 1988). Несмотря на вызванное физическими упражнениями увеличение коллагена, Gosselin et al. (1998) обнаружили, что укреплению мышц, наблюдаемому с возрастом, можно противодействовать с помощью упражнений на выносливость, которые авторы связывают с уменьшением сшивания гидроксилизилпиридинолином коллагеновых волокон.
Эффекты иммобилизации на ECM скелетных мышц не совсем однозначны. Ранние исследования Karpakka et al. (1990, 1991) обнаружили, что у крыс снижается как активность гидроксилазы, так и содержание гидроксипролина (аминокислоты, составляющей коллагены). Позже было обнаружено, что изменения содержания коллагена в ответ на кратковременную иммобилизацию или неиспользование были довольно небольшими (Savolainen et al., 1988; Haus et al., 2007a), что можно объяснить относительно низкой скоростью обновления. В более позднем исследовании, напротив, было обнаружено, что содержание коллагена I и биомеханические свойства (модуль упругости, максимальное напряжение и предел текучести) фасции голени, окружающей трехглавую мышцу surae крысы, значительно увеличиваются уже после 21 дня разгрузки задней конечности (Хуанг и др., 2018). Интересно, что эти изменения можно предотвратить, применяя вибрацию к задним лапам крыс дважды в день. У людей, не занимающихся спортом, иммуногистохимическое окрашивание показало отсутствие изменений плотности сети коллагена I после 60 дней постельного режима. Напротив, у субъектов, выполняющих протокол контрмер, состоящий из реактивных прыжков на санях, иммунореактивность коллагена I была снижена по сравнению с исходными уровнями (Schoenrock et al., 2018).
Еще одна модель, которая позволяет изучить адаптивность ECM мышц, — это функциональная перегрузка, вызванная устранением хирургического синергиста.В одном из первых соответствующих исследований Уильямс и Голдспинк (1981) перерезали сухожилия подошвенных и икроножных мышц самцов крыс, чтобы перегрузить камбаловидные мышцы. Гипертрофия мышц, наблюдаемая через три недели после тенотомии, сопровождалась увеличением концентрации IMCT (> 45%) и отношения IMCT к мышечной ткани. Гистологический анализ также показал, что увеличение IMCT в основном связано с утолщением эндомизия. Сосредоточившись на мышечно-сухожильном соединении, Zamora и Marini (1988) провели аналогичные эксперименты и изолировали подошвенную мышцу крысы с помощью тенотомии камбаловидной мышцы и удаления икроножных мышц.По сравнению с контрольными животными фибробласты, расположенные в мышечно-сухожильном соединении, развивали более высокую степень активации цитоплазмы, ядра и ядрышка уже после одной-двух недель функциональной перегрузки. В более недавнем исследовании было проверено влияние ИЛ-6 на ремоделирование ВКМ, вызванное перегрузкой, путем сравнения мышей дикого типа и мышей с нокаутом по ИЛ-6 (White et al., 2009). В то время как увеличение площади поперечного сечения миофибрилл было одинаковым после 21 дня функциональной перегрузки, увеличение сырого веса мышц было значительно больше у мышей с нокаутом по IL-6.Гистологический анализ подтвердил, что этот избыточный прирост мышечной массы можно объяснить значительно большим увеличением содержания несократительной ткани и концентрации гидроксипролина, что свидетельствует о содержании коллагена и фиброзе. В соответствии с этим наблюдением, уровни мРНК проколлагена-1, IGF-1 и TGF-β были значительно выше у мышей с дефицитом IL-6. Напротив, экспрессия мРНК MyoD, фактора транскрипции, необходимого для мио-, а не фиброгенной дифференцировки сателлитных клеток (Zammit, 2017), была значительно ослаблена у животных, лишенных IL-6.В совокупности эти результаты показывают, что устранение синергиста вызывает увеличение содержания IMCT и, в частности, утолщение эндомизиальных структур в перегруженных мышцах. Эти адаптации могут служить для модуляции несокращающихся структур мышц в соответствии с повышенными функциональными требованиями. IGF-1, по-видимому, играет важную роль в регуляции этого процесса, поскольку было показано, что недостаток IGF-1 приводит к чрезмерному накоплению IMCT и, возможно, к нарушению регенеративного потенциала мышц.
Одно из первых исследований по тестированию и сравнению различных форм упражнений с отягощениями у мужчин было проведено Brown et al.(1999), которые сообщили, что после одного приступа концентрических сокращений маркеры распада коллагена (гидроксипролин и коллаген сывороточного типа I) не увеличивались. Напротив, эксцентрическое действие мышц увеличивало уровень коллагена в сыворотке более чем на 40% в течение 9 дней после тренировки, что указывает на то, что эксцентрические сокращения могут быть более эффективными в стимулировании распада коллагена. Эти результаты были подтверждены в двух более поздних исследованиях, аналогичным образом использовавшихся с использованием высокоинтенсивных эксцентрических упражнений, которые выявили как повышенный процессинг проколлагена и содержание коллагена типа IV, так и более высокую активность ММП и ТИМП (Crameri et al., 2004; Mackey et al., 2004). Интересно, что Crameri et al. (2004, 2007) также сообщили об увеличении тенасцина С, гликопротеина, присутствующего в ЕСМ, который, как предполагается, направляет миграцию клеток после повреждения, независимо от того, было ли повреждение мышц вызвано произвольным или электрически индуцированным повреждением мышц. Временное повышение активности тенасцина С и других гликопротеинов ЕСМ (например, фибронектина и гиалуроновой кислоты) обычно называют «переходной матрицей», появление которой считается важным первым шагом для успешного восстановления мышц, так как дает важные сигналы, управляющие регенеративный потенциал мышечных стволовых клеток (Calve et al., 2010; Tierney et al., 2016). Сообщается, что высвобождение гликопротеинов ECM сопровождается повышенной активностью MMP-9 у молодых, но снижением активности MMP-9 и MMP-15 у пожилых людей (Wessner et al., 2019). Эти данные свидетельствуют о том, что острые упражнения с отягощениями вызывают катаболический ответ в молодых мышцах, но этот эффект может быть нарушен в более старшем возрасте. Последующая анаболическая реакция, характеризующаяся усилением регуляции структурных коллагенов (I, III, IV) и ламинина, как было обнаружено, происходит со значительной задержкой, что позволяет предположить, что восстановление мышц, вызванное острым приступом повреждающих (удлинительных) сокращений, следует за двухфазный характер (Mackey et al., 2011; Hyldahl et al., 2015). Интересно, что недавнее исследование Sorensen et al. (2018) обнаружили, что внешний вид переходной матрицы у физически активных пожилых людей притупляется по сравнению с молодыми людьми. Это наблюдение поддерживает представление о том, что дисрегулируемые сигналы ECM могут быть ответственны за увеличение отложения ECM и снижение активности стволовых клеток, обычно наблюдаемых в более старых мышцах (Grounds, 1998).
Одно из первых исследований по прямому сравнению различных форм мышечных сокращений с точки зрения их острого ремоделирующего потенциала ВКМ было опубликовано Heinemeier et al.(2007). Эти авторы провели исследование на грызунах и обнаружили, что активность генов, связанных с биосинтезом коллагена (например, коллагенов I и III), а также факторов роста (например, TGF-β1) повышается после всех форм физических упражнений, но в большей степени это происходит. после эксцентрической тренировки. У людей также было предложено увеличить скорость фракционного синтеза белка коллагена после острой эксцентрической тренировки по сравнению с концентрической тренировкой (Holm et al., 2017), хотя это понятие не бесспорно (Moore et al., 2005). В совокупности эти результаты предполагают, что особенно эксцентрические упражнения являются мощным стимулом, который вызывает микротравмы и обмен клеток IMCT, причем последний, как предполагается, представляет собой попытку организма предотвратить повторное повреждение мышцы (Mackey et al., 2011; Hyldahl et al. , 2015; Takagi et al., 2016). Фактически, снижение активности ММП после продолжительной тренировки, состоящей из электрически вызванных изометрических сокращений у крыс, может отражать успешное усиление ВКМ (Ogasawara et al., 2014), тогда как продолжительное повышение активности ММП и ТИМП в подошвенной мышце мышей после хирургического удаления икроножной и камбаловидной мышц может указывать на продолжающееся ремоделирование ВКМ (Mendias et al., 2017).
Помимо режима сокращения, ECM скелетных мышц также может быть чувствительным к интенсивности упражнений. Carmeli et al. (2005) протестировали влияние бега на беговой дорожке с высокой или низкой интенсивностью на крысах и обнаружили, что MMP-2 (один из ферментов, ответственных за расщепление коллагена IV, в основном присутствующего в базальной мембране мышц) повышается после упражнений высокой интенсивности. Только. На людях, напротив, одно исследование Holm et al. (2010) сравнили эффекты односторонних упражнений на разгибание колен, выполняемых с низкой или высокой (16% или 70% от индивидуального максимума одного повторения, соответственно) интенсивностью, с количеством повторений, скорректированным в соответствии с вмешательствами для общей нагрузки. поднял.В этом исследовании скорость фракционного синтеза коллагена была равномерно увеличена после обоих вмешательств.
Что касается адаптации ЕСМ к длительным тренировкам с отягощениями, существуют только данные исследований на животных. де Соуза Нето и др. (2018) сообщили, что 12 недель тренировок с отягощениями, состоящих из подъемов по лестнице с прогрессивными дополнительными нагрузками, эквивалентными 65–100% максимальной несущей способности каждого человека, активировали активность ММП-2 в подошвенных мышцах старых крыс, в то же время подавляя ММП-2. 2 и ММП-9 в кровообращении.Вывод авторов о том, что тренировки с отягощениями могут, таким образом, быть полезным инструментом для поддержания ремоделирования ВКМ в более старшем возрасте, недавно получил эмпирическую поддержку в другом исследовании обучения на крысах, которое использовало тот же протокол обучения и показало пониженное отложение соединительной ткани у тренированных пожилых людей. мышцы (Guzzoni et al., 2018).
Подводя итог, можно сказать, что несколько исследований, изучающих острые эффекты физической активности как у грызунов, так и у мужчин, показали, что упражнения могут стимулировать как деградацию, так и синтез коллагена в скелетных мышцах.Восстановление микротравм, вызванных физической нагрузкой, следует двухфазному паттерну, при котором гликопротеины сначала создают переходную матрицу для управления катаболическими процессами, а анаболические процессы, укрепляющие структуру IMCT, происходят со значительной задержкой. Потенциал упражнений для ремоделирования ВКМ, по-видимому, зависит от режима сокращения, при этом эксцентрические сокращения вызывают большую реакцию, чем концентрическое или изометрическое мышечное действие. Доступно немного исследований, в которых проверяются результаты упражнений с различной интенсивностью, и пока результаты показывают, что расщепление белка (но не синтез) может быть сильнее спровоцировано более высокой интенсивностью.Неиспользование резко снижает активность ферментов, связанных с биосинтезом коллагенов, хотя на уровне белка изменения происходят с медленной скоростью. Поперечные сравнения с участием (в основном тренированных на выносливость) грызунов показывают, что хроническая физическая активность может привести к усилению фенотипа ММКИ. Единственные доступные на сегодняшний день долгосрочные долгосрочные обучающие исследования были выполнены на грызунах и предполагают, что длительные тренировки с отягощениями могут быть полезны для противодействия чрезмерному накоплению ММКИ в более старшем возрасте.Физиологические и функциональные последствия ремоделирования ММКИ, вызванного тренировкой, требуют дальнейшего изучения.
Заключение
Настоящий обзор направлен на то, чтобы дать обзор текущего состояния знаний о ECM скелетных мышц, который играет важную, хотя часто недооцениваемую роль в поддержании мышечного гомеостаза, влияет на мышечную функцию и адаптацию и может быть ключом к лечению. мышечных и метаболических нарушений, вызванных старением или болезнью.
Как сложная сеть различных коллагенов, гликопротеинов, протеогликанов и эластина, ECM включает сократительные мышечные волокна и через интегрины и гликопротеиновый комплекс, связанный с дистрофином, служит биохимическим и механическим интерфейсом между мышечными клетками и их окружением. Сборке его коллагенового каркаса в основном способствуют факторы роста TGF-β и CTGF, которые регулируются различными протеогликанами, такими как декорин и бигликан. Более того, протеолитические ферменты (MMP), а также их ингибиторы (TIMP) участвуют в регуляции ECM.
Функционально ECM служит средой для передачи сократительной силы, которая может служить не только для повышения эффективности мышечного сокращения, но также для защиты мышечных волокон от чрезмерного напряжения и облегчения заживления микротравм. Помимо своей функциональной роли, ЕСМ активно участвует в регуляции пула сателлитных клеток в мышцах. Ниши ВКМ, образованные между сарколеммой и базальной мембраной, защищают сателлитные клетки от входа в клеточный цикл и, таким образом, помогают поддерживать регенеративный потенциал мышц.Конкретные компоненты ЕСМ, такие как фибронектин, коллаген VI и различные протеогликаны, могут дополнительно способствовать делению стволовых клеток. И наоборот, ламинин, гликозаминогликаны и другие протеогликаны способствуют дифференцировке сателлитных клеток и их слиянию в зрелые миофибриллы.
Научные данные также демонстрируют, что ECM скелетных мышц является податливой тканью, которая может подвергаться процессам ремоделирования в результате старения, болезней, физических тренировок или неиспользования.В частности, старение обычно приводит к общему увеличению отложения коллагеновой ткани, изменениям в составе коллагена (переход к более высокому типу коллагена I к типу III) и увеличению неферментативного сшивания коллагена (за счет конечных продуктов гликирования). Эти изменения, которые, возможно, опосредованы снижением активности ММП, приводят к усилению жесткости ECM мышцы и могут ухудшить функцию и регенеративный потенциал мышцы.
Ремоделирование внеклеточного матрикса также может быть связано с метаболическими нарушениями, такими как диабет.Было обнаружено, что чрезмерное потребление пищи приводит к повышенной экспрессии генов, связанных с ECM (коллагены I, III, IV, V, SPARC, интегрин). В свою очередь, такое ремоделирование может нарушать передачу сигналов интегрина, тем самым снижая чувствительность к инсулину. Другими компонентами ЕСМ, потенциально представляющими мишени для инсулинорезистентности, являются гиалуронан, комплекс дистрофин-дистрогликан, а также ММР9.
Наконец, ремоделирование ECM может быть вызвано физическими упражнениями. Хотя фактических исследований тренировок немного, есть доказательства того, что упражнения могут резко способствовать как увеличению синтеза коллагена (коллагены I, III, TGF-β1), так и деградации (MMP2, MMP9).Поперечные исследования на людях и продольные исследования на грызунах также предполагают, что такой повышенный обмен коллагена может привести к усилению коллагеновых структур у хронически тренированных субъектов и предотвратить чрезмерное отложение коллагена (то есть фиброз) в мышцах пожилого возраста. Исследования, изучающие последствия длительного неиспользования, показали противоречивые результаты. В то время как в ранних исследованиях сообщалось о снижении активности гидроксилазы и содержания гидроксипролина после кратковременной иммобилизации, в более поздних работах было обнаружено повышение содержания коллагена I после 21 дня разгрузки задних конечностей у крыс, но не изменилось после 60 дней постельного режима у людей.Необходимы дальнейшие исследования и, в частности, обучение людей, чтобы изучить влияние различных методов обучения на структуру и состав ECM.
Авторские взносы
RC участвовал в литературных исследованиях и подготовил рукопись. MG и BW внесли свой вклад в литературные исследования и отредактировали рукопись. Все авторы одобрили окончательную версию рукописи и согласились нести ответственность за все аспекты работы. Все лица, обозначенные как авторы, имеют право на авторство, и все, кто имеет право на авторство, перечислены в списке.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы с благодарностью отмечаем финансовую поддержку этого исследования, полученную от Австрийского научного фонда (FWF): KLI 738-B27.
Список литературы
Aagaard, P., Andersen, J. L., Dyhre-Poulsen, P., Leffers, A.-M., Wagner, A., Магнуссон, С. П. и др. (2001). Механизм увеличения сократительной силы перистых мышц человека в ответ на силовую тренировку: изменения в архитектуре мышц. J. Physiol. 534, 613–623. DOI: 10.1111 / j.1469-7793.2001.t01-1-00613.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Адамс, Г. Р., Хазер, Б. М., Болдуин, К. М., и Дадли, Г. А. (1993). Состав тяжелых цепей миозина скелетных мышц и тренировки с отягощениями. J. Appl. Physiol. 74, 911–915. DOI: 10.1152 / jappl.1993.74.2.911
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Adstrum, S., Hedley, G., Schleip, R., Stecco, C., and Yucesoy, C.A. (2017). Определение фасциальной системы. J. Bodyw. Mov. Ther. 21, 173–177. DOI: 10.1016 / j.jbmt.2016.11.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Алмада, А. Э., и Уэйджерс, А. Дж. (2016). Молекулярная схема судьбы стволовых клеток при регенерации скелетных мышц, старении и болезнях. Нат. Rev. Mol. Cell Biol. 17, 267–279. DOI: 10.1038 / nrm.2016.7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Американский колледж спортивной медицины. (2009). Позиционный стенд Американского колледжа спортивной медицины. Модели прогресса в тренировках с отягощениями для здоровых взрослых. Med. Sci. Спортивные упражнения. 41, 687–708. DOI: 10.1249 / mss.0b013e3181915670
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Азизи, Э., Деслорье, А.Р., Холт, Н. К., Итон, К. Э. (2017). Устойчивость к радиальному расширению ограничивает мышечное напряжение и работу. Biomech. Модель. Механобиол. 16, 1633–1643. DOI: 10.1007 / s10237-017-0909-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Багдади, М. Б., Кастель, Д., Мачадо, Л., Фукада, С., Бирк, Д. Э., Релэикс, Ф. и др. (2018). Реципрокная передача сигналов с помощью Notch-Collagen V-CALCR удерживает мышечные стволовые клетки в их нише. Природа 557, 714–718. DOI: 10.1038 / s41586-018-0144-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барретт Б. (1962). Длина и способ окончания отдельных мышечных волокон портняжной и задней бедренной мышцы человека. Acta Anat. 48, 242–257. DOI: 10.1159 / 000141843
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бенцингер, К. Ф., Ван, Ю. X., Дюмон, Н. А., и Рудницки, М. А. (2013a). Клеточная динамика в нише мышечных сателлитных клеток. EMBO Rep. 14, 1062–1072. DOI: 10.1038 / embor.2013.182
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бенцингер, К. Ф., Ван, Ю. X., фон Мальцан, Дж., Сулеймани, В. Д., Инь, Х., и Рудницки, М. А. (2013b). Фибронектин регулирует передачу сигналов Wnt7a и рост сателлитных клеток. Стволовые клетки клетки 12, 75–87. DOI: 10.1016 / j.stem.2012.09.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беррия, Р., Ван, Л., Ричардсон, Д. К., Финлейсон, Дж., Белфорт, Р., Пратипанаватр, Т. и др. (2006). Повышенное содержание коллагена в инсулинорезистентных скелетных мышцах. Am. J. Physiol. Эндокринол. Метаб. 290, E560 – E565. DOI: 10.1152 / ajpendo.00202.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Блох, Р. Дж., И Гонсалес-Серратос, Х. (2003). Передача боковой силы через костамеры в скелетных мышцах. Exerc. Sport Sci. Ред. 31, 73–78. DOI: 10.1097 / 00003677-200304000-00004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боонен, К.Дж. М., Розария-Чак, К. Ю., Баайенс, Ф. П. Т., ван дер Шафт, Д. В. Дж., И Пост, М. Дж. (2009). Важнейшие экологические сигналы из ниши сателлитных клеток: оптимизация пролиферации и дифференцировки. Am. J. Physiol. Cell Physiol. 296, C1338 – C1345. DOI: 10.1152 / ajpcell.00015.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боппарт, М. Д., и Махмассани, З. С. (2019). Передача сигналов интегрина: связь механической стимуляции с гипертрофией скелетных мышц. Am. J. Physiol. Cell Physiol. 317, C629 – C641. DOI: 10.1152 / ajpcell.00009.2019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брак А. С., Конбой И. М., Конбой М. Дж., Шен Дж. И Рандо Т. А. (2008). Временное переключение с передачи сигналов notch на Wnt в мышечных стволовых клетках необходимо для нормального миогенеза взрослых. Стволовые клетки клетки 2, 50–59. DOI: 10.1016 / j.stem.2007.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брак, А.С., Конбой, М. Дж., Рой, С., Ли, М., Куо, К. Дж., Келлер, К. и др. (2007). Повышенная передача сигналов Wnt во время старения изменяет судьбу мышечных стволовых клеток и увеличивает фиброз. Наука 317, 807–810. DOI: 10.1126 / science.1144090
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Brandan, E., Cabello-Verrugio, C., and Vial, C. (2008). Новые механизмы регуляции протеогликанов, декорина и бигликана во время формирования мышц и мышечной дистрофии. Matrix Biol. 27, 700–708. DOI: 10.1016 / j.matbio.2008.07.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Brandt, P. W., Lopez, E., Reuben, J. P., and Grundfest, H. (1967). Взаимосвязь между плотностью упаковки миофиламентов и длиной саркомера в поперечно-полосатой мышце лягушки. J. Cell Biol. 33, 255–263. DOI: 10.1083 / jcb.33.2.255
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браун С., Дэй С. и Доннелли А. (1999).Косвенные доказательства повреждения скелетных мышц человека и распада коллагена после эксцентрических действий мышц. J. Sports Sci. 17, 397–402. DOI: 10.1080 / 026404199365911
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бушби, К. М., Коллинз, Дж., И Хикс, Д. (2014). «Коллагеновые миопатии типа VI», в Progress in Heritage Soft Connective Tissue Diseases , ed. Дж. Халпер, (Дордрехт: Спрингер), 185–199. DOI: 10.1007 / 978-94-007-7893-1_12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Calve, S., Одельберг, С. Дж., И Саймон, Х.-Г. (2010). Переходный внеклеточный матрикс управляет поведением клеток во время регенерации мышц. Dev. Биол. 344, 259–271. DOI: 10.1016 / j.ydbio.2010.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кальво, А.С., Морено, Л., Морено, Л., Тойвонен, Дж. М., Манзано, Р., Молина, Н. и др. (2020). Коллаген типа XIX: перспективный биомаркер базальных мембран. Neural Regen. Res. 15, 988–995. DOI: 10.4103 / 1673-5374.270299
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кармели, Э., Моас, М., Леннон, С., и Пауэрс, С. К. (2005). Упражнения высокой интенсивности увеличивают экспрессию матричных металлопротеиназ в быстрых волокнах скелетных мышц: упражнения и ММП в быстрых волокнах скелета. Exp. Physiol. 90, 613–619. DOI: 10.1113 / expphysiol.2004.029462
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шарве, Б., Гиро, А., Malbouyres, M., Zwolanek, D., Guillon, E., Bretaud, S., et al. (2013). Нокдаун гена col22a1 у рыбок данио вызывает мышечную дистрофию за счет нарушения мышечно-сухожильного соединения. Dev. Camb. Англ. 140, 4602–4613. DOI: 10.1242 / dev.096024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чике М., Бирк Д. Э., Беннеманн К. Г. и Кох М. (2014). Коллаген XII: защита целостности костей и мышц за счет организации фибрилл коллагена. Внутр. Дж.Биохим. Cell Biol. 53, 51–54. DOI: 10.1016 / j.biocel.2014.04.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кристенсен, С., Пурслоу, П. П. (2016). Роль матриксных металлопротеиназ в развитии мышечной и жировой ткани и качестве мяса: обзор. Meat Sci. 119, 138–146. DOI: 10.1016 / j.meatsci.2016.04.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коркоран, М. Л., Хьюитт, Р. Э., Кляйнер, Д.Э. младший и Стетлер-Стивенсон У. Г. (1996). ММП-2: экспрессия, активация и ингибирование. Ферментный белок 49, 7–19. DOI: 10.1159 / 000468613
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корнелисон, Д. Д., Филла, М. С., Стэнли, Х. М., Рапрэгер, А. С., и Олвин, Б. Б. (2001). Синдекан-3 и синдекан-4 специфически маркируют сателлитные клетки скелетных мышц и участвуют в поддержании сателлитных клеток и регенерации мышц. Dev. Биол. 239, 79–94.DOI: 10.1006 / dbio.2001.0416
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Косгроув, Б. Д., Гилберт, П. М., Порпилья, Э., Муркиоти, Ф., Ли, С. П., Корбел, С. Ю. и др. (2014). Омоложение популяции мышечных стволовых клеток восстанавливает силу травмированных старых мышц. Нат. Med. 20, 255–264. DOI: 10,1038 / нм 3464
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Crameri, R.M., Aagaard, P., Qvortrup, K., Langberg, H., Олесен, Дж., И Кьяер, М. (2007). Повреждение миофибрилл в скелетных мышцах человека: эффекты электростимуляции по сравнению с произвольным сокращением : равномерная по сравнению с гетерогенной активацией мышечных волокон. J. Physiol. 583, 365–380. DOI: 10.1113 / jphysiol.2007.128827
CrossRef Полный текст | Google Scholar
Crameri, R.M., Langberg, H., Teisner, B., Magnusson, P., Schrøder, H.D., Olesen, J.L., et al. (2004). Усиление обработки проколлагена в скелетных мышцах после однократной эксцентрической нагрузки у людей. Matrix Biol. 23, 259–264. DOI: 10.1016 / j.matbio.2004.05.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цуй, Н., Ху, М., и Халил, Р. А. (2017). Биохимические и биологические признаки матричных металлопротеиназ. Прог. Мол. Биол. Пер. Sci. 147, 1–73. DOI: 10.1016 / bs.pmbts.2017.02.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
де Соуза Нето, И. В., Дуриган, Дж. Л. К., Гуццони, В., Тибана, Р.A., Prestes, J., de Araujo, H. S. S. и др. (2018). Влияние тренировок с отягощениями на активность матричной металлопротеиназы в скелетных мышцах и кровообращение при старении. Фронт. Physiol. 9: 190. DOI: 10.3389 / fphys.2018.00190
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дитрих, А. В., Боттер, А., Виейра, Т. М., Пеолссон, А., Петцке, Ф., Дэйви, П. и др. (2017). Пространственная вариация и несоответствие между оценками начала мышечной активации по ЭМГ и УЗИ. Sci. Отчет 7: 42011. DOI: 10.1038 / srep42011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dietrich, S., Abou-Rebyeh, F., Brohmann, H., Bladt, F., Sonnenberg-Riethmacher, E., Yamaai, T., et al. (1999). Роль SF / HGF и c-Met в развитии скелетных мышц. Dev. Camb. Англ. 126, 1621–1629.
PubMed Аннотация | Google Scholar
Duance, V.C., Restall, D.J., Beard, H., Bourne, F.J., и Bailey, A.J. (1977). Расположение трех типов коллагена в скелетных мышцах. FEBS Lett. 79, 248–252. DOI: 10.1016 / 0014-5793 (77) 80797-7
CrossRef Полный текст | Google Scholar
Эклунд, Л., Пиухола, Дж., Комулайнен, Дж., Сормунен, Р., Онгваррасопоне, К., Фасслер, Р., и др. (2001). Недостаток коллагена типа XV вызывает у мышей скелетную миопатию и сердечно-сосудистые дефекты. Proc. Natl. Акад. Sci. США 98, 1194–1199. DOI: 10.1073 / pnas.031444798
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Энглер, А.Дж., Гриффин, М. А., Сен, С., Беннеман, К. Г., Суини, Х. Л. и Дишер, Д. Е. (2004). Миотрубки оптимально дифференцируются на субстратах с тканевой жесткостью: патологические последствия для мягких или жестких микросред. J. Cell Biol. 166, 877–887. DOI: 10.1083 / jcb.200405004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Этьен, Дж., Лю, К., Скиннер, К. М., Конбой, М. Дж., И Конбой, И. М. (2020). Скелетные мышцы как экспериментальная модель выбора для изучения старения и омоложения тканей. Скелет. Мышца 10: 4. DOI: 10.1186 / s13395-020-0222-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фишер, Дж., Стил, Дж., Брюс-Лоу, С., и Смит, Д. (2011). Рекомендации по тренировкам с отягощениями, основанные на фактах. Med. Спорт. 15, 147–162. DOI: 10.2478 / v10036-011-0025-x
CrossRef Полный текст | Google Scholar
Фолланд, Дж. П., и Уильямс, А. Г. (2007). Адаптация к силовым тренировкам: морфологический и неврологический вклад в увеличение силы. Sports Med. 37, 145–168. DOI: 10.2165 / 00007256-200737020-00004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фрай, К. С., Кирби, Т. Дж., Космак, К., Маккарти, Дж. Дж., И Петерсон, К. А. (2017). Миогенные клетки-предшественники контролируют продукцию внеклеточного матрикса фибробластами во время гипертрофии скелетных мышц. Стволовые клетки 20, 56–69. DOI: 10.1016 / j.stem.2016.09.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гарбер, К.E., Blissmer, B., Deschenes, M. R., Franklin, B. A., Lamonte, M. J., Lee, I.-M., et al. (2011). Количество и качество упражнений для развития и поддержания кардиореспираторной, скелетно-мышечной и нейромоторной формы у практически здоровых взрослых: руководство по назначению упражнений. Med. Sci. Спортивные упражнения. 43, 1334–1359. DOI: 10.1249 / MSS.0b013e318213fefb
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гилберт, П. М., Хэвенстрайт, К. Л., Магнуссон, К.Э. Г., Сакко А., Леонарди Н. А., Крафт П. и др. (2010). Эластичность субстрата регулирует самообновление стволовых клеток скелетных мышц в культуре. Science 329, 1078–1081. DOI: 10.1126 / science.11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гиллис А. Р., Чепмен М. А., Бушонг Э. А., Деринк Т. Дж., Эллисман М. Х. и Либер Р. Л. (2017). Трехмерная реконструкция с высоким разрешением внеклеточного матрикса фиброзных скелетных мышц: организация внеклеточного матрикса фиброзных мышц. J. Physiol. 595, 1159–1171. DOI: 10.1113 / JP273376
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Госселин, Л. Е., Адамс, К., Коттер, Т. А., Маккормик, Р. Дж., И Томас, Д. П. (1998). Влияние физических упражнений на пассивную жесткость опорно-двигательных скелетных мышц: роль внеклеточного матрикса. J. Appl. Physiol. 85, 1011–1016. DOI: 10.1152 / jappl.1998.85.3.1011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грефте, С., Vullinghs, S., Kuijpers-Jagtman, A.M., Torensma, R., and Von den Hoff, J. W. (2012). Матригель, но не коллаген I, поддерживает способность к дифференцировке мышечных клеток in vitro . Biomed. Матер. 7: 055004. DOI: 10.1088 / 1748-6041 / 7/5/055004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Grounds, M. D. (1998). Возрастные изменения реакции клеток скелетных мышц на упражнения и регенерацию. Ann. Акад.Sci. 854, 78–91. DOI: 10.1111 / j.1749-6632.1998.tb09894.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Основания, М. Д., Сорокин, Л., Уайт, Дж. (2005). Сила на границе межклеточного матрикса и мышцы. Сканд. J. Med. Sci. Спорт 15, 381–391. DOI: 10.1111 / j.1600-0838.2005.00467.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гийон, Э., Брето, С., Руджеро, Ф. (2016). Предшественники медленных мышц откладывают отпечаток пальца матрицы XV коллагена, чтобы направлять навигацию по моторным аксонам. J. Neurosci. 36, 2663–2676. DOI: 10.1523 / JNEUROSCI.2847-15.2016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гутьеррес, Дж., И Брандан, Э. (2010). Новый механизм связывания фактора роста фибробластов 2 с помощью глипикана в липидных рафтах, позволяющий дифференцировать скелетные мышцы. Мол. Клетка. Биол. 30, 1634–1649. DOI: 10.1128 / mcb.01164-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гуццони, В., Рибейро, М.Б. Т., Лопес, Г. Н., де Касия Маркети, Р., де Андраде, Р. В., Селистр-де-Араужо, Х. С. и др. (2018). Влияние тренировки с отягощениями на адаптацию внеклеточного матрикса в скелетных мышцах старых крыс. Фронт. Physiol. 9: 374. DOI: 10.3389 / fphys.2018.00374
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Халпер, Дж., И Кьяер, М. (2014). «Основные компоненты соединительной ткани и внеклеточного матрикса: эластин, фибриллин, фибулины, фибриноген, фибронектин, ламинин, тенасцины и тромбоспондины», в Progress in Heritable Soft Connective Tissue Diseases , ed.Дж. Халпер, (Дордрехт: Спрингер), 31–47. DOI: 10.1007 / 978-94-007-7893-1_3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Härönen, H., Zainul, Z., Tu, H., Naumenko, N., Sormunen, R., Miinalainen, I., et al. (2017). Коллаген XIII обеспечивает пре- и постсинаптическую целостность нервно-мышечного синапса. Hum. Мол. Genet. 26, 2076–2090. DOI: 10.1093 / hmg / ddx101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хассон П., ДеЛорье А., Беннетт, М., Григорьева, Э., Найче, Л. А., Папайоанну, В. Э. и др. (2010). Tbx4 и tbx5, действующие в соединительной ткани, необходимы для формирования рисунка мышц конечностей и сухожилий. Dev. Cell 18, 148–156. DOI: 10.1016 / j.devcel.2009.11.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаус, Дж. М., Карритерс, Дж. А., Кэрролл, К. К., Теш, П. А., и Траппе, Т. А. (2007a). Содержание белка сократительной и соединительной ткани в скелетных мышцах человека: эффекты 35- и 90-дневного моделирования микрогравитации и контрмеры при физической нагрузке. Am. J. Physiol. Regul. Интегр. Комп. Physiol. 293, R1722 – R1727. DOI: 10.1152 / ajpregu.00292.2007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаус, Дж. М., Карритерс, Дж. А., Траппе, С. У. и Траппе, Т. А. (2007b). Коллаген, сшивание и конечные продукты гликирования в стареющих скелетных мышцах человека. J. Appl. Physiol. 103, 2068–2076. DOI: 10.1152 / japplphysiol.00670.2007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хейккинен, А., Härönen, H., Norman, O., and Pihlajaniemi, T. (2019). Коллаген XIII и другие компоненты ECM в сборке и заболевании нервно-мышечного соединения. Анат. Рек. doi: 10.1002 / ar.24092 [Epub перед печатью].
CrossRef Полный текст | PubMed Аннотация | Google Scholar
Heinemeier, K. M., Olesen, J. L., Haddad, F., Langberg, H., Kjaer, M., Baldwin, K. M., et al. (2007). Экспрессия коллагена и родственных факторов роста в сухожилиях и скелетных мышцах крысы в ответ на определенные типы сокращения: экспрессия коллагена и TGF-β-1 в тренированных сухожилиях и мышцах. J. Physiol. 582, 1303–1316. DOI: 10.1113 / jphysiol.2007.127639
CrossRef Полный текст | Google Scholar
Heljasvaara, R., Aikio, M., Ruotsalainen, H., and Pihlajaniemi, T. (2017). Коллаген XVIII в гомеостазе и нарушении регуляции тканей — уроки, извлеченные из модельных организмов и пациентов-людей. Matrix Biol. 57–58, 55–75. DOI: 10.1016 / j.matbio.2016.10.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хидзиката, Т., Вакисака Х. и Ниида С. (1993). Функциональная комбинация сужающихся профилей и перекрывающихся расположений в нерасширяющихся волокнах скелетных мышц, оканчивающихся внутрипучкообразно. Анат. Рек. 236, 602–610. DOI: 10.1002 / ar.1092360403
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хиндл, А.Г., Хорнинг, М., Меллиш, Дж .-А. Э. и Лоулер Дж. М. (2009). Погружение в старость: мускульное старение у крупнотелого долгоживущего млекопитающего, тюленя Уэдделла ( Leptonychotes weddellii ). J. Exp. Биол. 212, 790–796. DOI: 10.1242 / jeb.025387
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Холм, Л., Рахбек, С. К., Фаруп, Дж., Вендельбо, М. Х., и Виссинг, К. (2017). Режим сокращения и потребление сывороточного протеина влияют на скорость синтеза внутримышечной соединительной ткани: краткие отчеты. Мышечный нерв 55, 128–130. DOI: 10.1002 / mus.25398
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Холм, Л., ван Холл, Г., Роуз, А. Дж., Миллер, Б. Ф., Дёссинг, С., Рихтер, Э. А. и др. (2010). Интенсивность сокращения и питание по-разному влияют на скорость синтеза коллагена и миофибриллярного белка в скелетных мышцах человека. Am. J. Physiol. Эндокринол. Метаб. 298, E257 – E269. DOI: 10.1152 / ajpendo.00609.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг, Ю., Фань, Ю., Саланова, М., Янг, X., Сан, Л., и Блоттнер, Д. (2018). Влияние подошвенной вибрации на кости и глубокую фасцию в модели неиспользования разгрузки задней конечности крысы. Фронт. Physiol. 9: 616. DOI: 10.3389 / fphys.2018.00616
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хьюз, Д. К., Маркотт, Г. Р., Маршалл, А. Г., Уэст, Д. В. Д., Баер, Л. М., Уоллес, М. А., и др. (2016). Возрастные различия дистрофина: влияние на белки передачи силы, целостность мембран и стабильность нервно-мышечных соединений. J. Gerontol. A. Biol. Sci. Med. Sci. 72, 640–648. DOI: 10.1093 / gerona / glw109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуцзин, П.А. (1999). Мышцы как композит, армированный коллагеновыми волокнами: обзор передачи силы в мышце и всей конечности. J. Biomech. 32, 329–345. DOI: 10.1016 / s0021-9290 (98) 00186-9
CrossRef Полный текст | Google Scholar
Хьюцзин П.А., Баан Г.С. и Ребел Г.Т. (1998). Немышухожильная передача силы в длинном разгибателе пальцев большого пальца крысы. J. Exp. Биол. 201, 683–691.
Google Scholar
Хилдал, Р. Д., Нельсон, Б., Xin, L., Welling, T., Groscost, L., Hubal, M.J., et al. (2015). Ремоделирование внеклеточного матрикса и его вклад в защитную адаптацию после удлинения сокращений в мышцах человека. FASEB J. 29, 2894–2904. DOI: 10.1096 / fj.14-266668
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ивата, Дж., Судзуки, А., Пеликан, Р. К., Хо, Т.-В., и Чай, Ю. (2013). Передача сигналов неканонического трансформирующего фактора роста β (TGFβ) в клетках краниального нервного гребня вызывает дефекты развития мышц языка. J. Biol. Chem. 288, 29760–29770. DOI: 10.1074 / jbc.M113.493551
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Якобсен, Дж. Р., Макки, А. Л., Кнудсен, А. Б., Кох, М., Кьяер, М., и Крогсгаард, М. Р. (2017). Состав и адаптация мышечно-сухожильных суставов человека и соседних мышечных волокон к тяжелым тренировкам с отягощениями. Сканд. J. Med. Sci. Спорт 27, 1547–1559. DOI: 10.1111 / sms.12794
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Яначек, Я., Цебашек, В., Кубинова, Л., Рибарич, С., и Эрзен, И. (2009). Трехмерная визуализация и измерение капилляров, снабжающих метаболически различные типы волокон в длинном разгибателе пальцев большого пальца крысы во время денервации и реиннервации. J. Histochem. Cytochem. 57, 437–447. DOI: 10.1369 / jhc.2008.953018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ярвинен, Т. А. Х., Йожа, Л., Каннус, П., Ярвинен, Т. Л. Н., и Ярвинен, М. (2002). Организация и распределение внутримышечной соединительной ткани в нормальных и неподвижных скелетных мышцах.Иммуногистохимическое, поляризационное и сканирующее электронно-микроскопические исследования. J. Muscle Res. Cell Motil. 23, 245–254. DOI: 10.1023 / A: 10208336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канг, Л., Лантье, Л., Кеннеди, А., Боннер, Дж. С., Мэйс, В. Х., Брейси, Д. П. и др. (2013). Гиалуронан накапливается при кормлении с высоким содержанием жиров и способствует инсулинорезистентности. Диабет 62, 1888–1896. DOI: 10.2337 / db12-1502
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канг, Л., Мэйс, У. Х., Джеймс, Ф. Д., Брейси, Д. П., и Вассерман, Д. Х. (2014). Матричная металлопротеиназа 9 противодействует индуцированной диетой мышечной инсулинорезистентности у мышей. Diabetologia 57, 603–613. DOI: 10.1007 / s00125-013-3128-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кардон, Г., Харф, Б. Д. и Табин, К. Дж. (2003). Tcf4-позитивная мезодермальная популяция обеспечивает предпаттерн для формирования мышечного паттерна конечностей позвоночных. Dev. Cell 5, 937–944. DOI: 10.1016 / с 1534-5807 (03) 00360-5
CrossRef Полный текст | Google Scholar
Карпакка, Й., Вяэнянен, К., Орава, С., и Такала, Т. Э. (1990). Эффекты предварительной иммобилизации и иммобилизации на синтез коллагена в скелетных мышцах крыс. Внутр. J. Sports Med. 11, 484–488. DOI: 10.1055 / с-2007-1024842
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карпакка, Дж., Виртанен, П., Ваананен, К., Орава, С., и Такала, Т. Е. (1991).Синтез коллагена в скелетных мышцах крысы во время иммобилизации и ремобилизации. J. Appl. Physiol. 70, 1775–1780. DOI: 10.1152 / jappl.1991.70.4.1775
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Khaleduzzaman, M., Sumiyoshi, H., Ueki, Y., Inoguchi, K., Ninomiya, Y., and Yoshioka, H. (1997). Структура гена коллагена человека типа XIX (COL19A1), которая предполагает, что он произошел от гена-предка семейства FACIT. Genomics 45, 304–312.DOI: 10.1006 / geno.1997.4921
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким Дж., Ван З., Хеймсфилд С. Б., Баумгартнер Р. Н. и Галлахер Д. (2002). Общая масса скелетных мышц: оценка с помощью нового метода двухэнергетической рентгеновской абсорбциометрии. Am. J. Clin. Nutr. 76, 378–383. DOI: 10.1093 / ajcn / 76.2.378
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кнудсен, А.Б., Ларсен, М., Макки, А.Л., Хьорт, М., Hansen, K. K., Qvortrup, K., et al. (2015). Человеческое мышечно-сухожильное соединение: ультраструктурное исследование и трехмерный анализ. Сканд. J. Med. Sci. Sports 25, e116 – e123. DOI: 10.1111 / sms.12221
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Koch, M., Schulze, J., Hansen, U., Ashwodt, T., Keene, D.R., Brunken, W.J., et al. (2004). Новый маркер тканевых соединений, коллаген XXII. J. Biol. Chem. 279, 22514–22521. DOI: 10.1074 / jbc.M400536200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кованен, В., Суоминен, Х., Ристели, Дж., И Ристели, Л. (1988). Коллаген IV типа и ламинин в медленных и быстрых скелетных мышцах крыс — Влияние возраста и тренировок на выносливость на протяжении всей жизни. Сб. Relat. Res. 8, 145–153. DOI: 10,1016 / s0174-173x (88) 80026-8
CrossRef Полный текст | Google Scholar
Куо, Х. Дж., Маслен, К. Л., Кин, Д. Р., и Гланвилл, Р. У. (1997). Коллаген VI типа закрепляет базальные мембраны эндотелия, взаимодействуя с коллагеном IV типа. J. Biol. Chem. 272, 26522–26529. DOI: 10.1074 / jbc.272.42.26522
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леонг, Д. П., Тео, К. К., Рангараджан, С., Лопес-Харамилло, П., Авесум, А., Орландини, А., и др. (2015). Прогностическое значение силы хвата: результаты проспективного исследования городской и сельской эпидемиологии (PURE). Lancet Lond. Англ. 386, 266–273. DOI: 10,1016 / s0140-6736 (14) 62000-6
CrossRef Полный текст | Google Scholar
Ли, Дж.Дж., Виттерт, Г. А., Винсент, А., Атлантис, Э., Ши, З., Эпплтон, С. Л. и др. (2016). Сила мышечного захвата позволяет прогнозировать развитие диабета 2 типа: популяционное когортное исследование. Метаболизм 65, 883–892. DOI: 10.1016 / j.metabol.2016.03.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Либер, Р. Л., и Уорд, С. Р. (2013). Клеточные механизмы тканевого фиброза. 4. Структурные и функциональные последствия фиброза скелетных мышц. Am. J. Physiol.Cell Physiol. 305, C241 – C252. DOI: 10.1152 / ajpcell.00173.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лопес-Отин, К., Бласко, М.А., Партридж, Л., Серрано, М., и Кремер, Г. (2013). Признаки старения. Cell 153, 1194–1217. DOI: 10.1016 / j.cell.2013.05.039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Maaß, T., Bayley, C.P., Mörgelin, M., Lettmann, S., Bonaldo, P., Paulsson, M., et al. (2016).Неоднородность микрофибрилл коллагена VI: структурный анализ неколлагеновых участков. J. Biol. Chem. 291, 5247–5258. DOI: 10.1074 / jbc.M115.705160
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mackey, A. L., Brandstetter, S., Schjerling, P., Bojsen-Moller, J., Qvortrup, K., Pedersen, M. M., et al. (2011). Последовательный ответ мертвых клеток внеклеточного матрикса и фиброзных регуляторов после повреждения мышц участвует в защите скелетных мышц человека от будущих повреждений. FASEB J. 25, 1943–1959. DOI: 10.1096 / fj.10-176487
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mackey, A. L., Donnelly, A. E., Turpeenniemi-Hujanen, T., and Roper, H.P. (2004). Содержание коллагена в скелетных мышцах у людей после эксцентрических сокращений большой силы. J. Appl. Physiol. 97, 197–203. DOI: 10.1152 / japplphysiol.01174.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Махновский П.А., Згода В.Г., Боков Р.О., Шагимарданова Е.И., Газизова Г.Р., Гусев О.А. и др. (2020). Регуляция белков в скелетных мышцах человека: роль транскрипции. Sci. Отчет 10: 3514.
Google Scholar
Мартин, Г. Р., и Тимпл, Р. (1987). Ламинин и другие компоненты базальной мембраны. Annu. Rev. Cell Biol. 3, 57–85. DOI: 10.1146 / annurev.cb.03.110187.000421
CrossRef Полный текст | Google Scholar
Макки, Т.Дж., Перлман, Г., Моррис, М., Комарова, С. В. (2019). Состав внеклеточного матрикса соединительной ткани: систематический обзор и метаанализ. Sci. Отчет 9: 10542.
Google Scholar
Мендиас, К. Л., Шварц, А. Дж., Грекин, Дж. А., Гумусио, Дж. П., и Сугг, К. Б. (2017). Изменения сократимости мышечных волокон и продукции внеклеточного матрикса при гипертрофии скелетных мышц. J. Appl. Physiol. 122, 571–579. DOI: 10.1152 / japplphysiol.00719.2016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Монти, Р.Дж., Рой, Р. Р., Ходжсон, Дж. А., и Реджи Эджертон, В. (1999). Передача сил в скелетных мышцах млекопитающих. J. Biomech. 32, 371–380. DOI: 10.1016 / s0021-9290 (98) 00189-4
CrossRef Полный текст | Google Scholar
Мур, Д. Р., Филлипс, С. М., Бабрадж, Дж. А., Смит, К., и Ренни, М. Дж. (2005). Синтез миофибриллярных и коллагеновых белков в скелетных мышцах человека у молодых мужчин после максимального сокращения и удлинения сокращений. Am. J. Physiol.Эндокринол. Метаб. 288, E1153 – E1159. DOI: 10.1152 / ajpendo.00387.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моралес, М. Г., Кабельо-Верруджио, К., Сантандер, К., Кабрера, Д., Гольдшмединг, Р., и Брандан, Э. (2011). Сверхэкспрессия CTGF / CCN-2 может напрямую вызывать признаки дистрофии скелетных мышц. J. Pathol. 225, 490–501. DOI: 10.1002 / путь.2952
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Малви, К., Харно, Э., Кинан, А., и Олендик, К. (2005). Экспрессия комплекса дистрофин-дистрогликан скелетных мышц и комплекса синтрофин-оксид азота серьезно нарушена у крыс Goto-Kakizaki с диабетом 2 типа. Eur. J. Cell Biol. 84, 867–883. DOI: 10.1016 / j.ejcb.2005.06.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Наба А., Клаузер К. Р., Динг Х., Уиттакер К. А., Карр С. А. и Хайнс Р. О. (2016). Внеклеточный матрикс: инструменты и идеи для эпохи «омиков». Matrix Biol. 49, 10–24. DOI: 10.1016 / j.matbio.2015.06.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нассари, С., Дюпре, Д., Фурнье-Тибо, К. (2017). Немиогенный вклад в развитие мышц и гомеостаз: роль соединительных тканей. Фронт. Cell Dev. Биол. 5:22. DOI: 10.3389 / fcell.2017.00022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Nordez, A., Gallot, T., Catheline, S., Гевель А., Корню К. и Хуг Ф. (2009). Электромеханическая задержка пересмотрена с использованием ультразвука с очень высокой частотой кадров. J. Appl. Physiol. 106, 1970–1975. DOI: 10.1152 / japplphysiol.00221.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Новицки Дж. Л., Такимото Р. и Берк А. С. (2003). Латеральная сомитная граница: дорсо-вентральные аспекты передне-задней регионализации у эмбрионов птиц. мех. Dev. 120, 227–240. DOI: 10.1016 / s0925-4773 (02) 00415-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Огасавара, Р., Наказато К., Сато К., Боппарт М. Д. и Фудзита С. (2014). Упражнения с отягощениями увеличивают экспрессию активного белка MMP и бета1-интегрина в скелетных мышцах. Physiol. Отчет 2: e12212. DOI: 10.14814 / phy2.12212
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Olguin, H.C., и Olwin, B.B. (2004). Повышающая регуляция Pax-7 ингибирует миогенез и прогрессию клеточного цикла в сателлитных клетках: потенциальный механизм самообновления. Dev. Биол. 275, 375–388.DOI: 10.1016 / j.ydbio.2004.08.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Олссон, Л., Фальк, П., Лопес, К., Кобб, Дж., И Ханкен, Дж. (2001). Клетки черепного нервного гребня вносят вклад в соединительную ткань в черепных мышцах бесхвостых амфибий, Bombina orientalis . Dev. Биол. 237, 354–367. DOI: 10.1006 / dbio.2001.0377
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Passerieux, E., Rossignol, R., Летелье Т. и Делаж Дж. (2007). Физическая непрерывность перимизиума от миофибрилл к сухожилиям: участие в передаче латеральной силы в скелетных мышцах. J. Struct. Биол. 159, 19–28. DOI: 10.1016 / j.jsb.2007.01.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паттисон, Дж. С., Фолк, Л. К., Мэдсен, Р. У., Чайлдс, Т. Э. и Бут, Ф. У. (2003). Транскрипционное профилирование выявляет обширное подавление экспрессии гена внеклеточного матрикса в саркопенической камбаловидной мышце крысы. Physiol. Геномика 15, 34–43. DOI: 10.1152 / Physiolgenomics.00040.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паван, П. Г., Стекко, А., Стерн, Р., и Стекко, К. (2014). Болезненные связи: уплотнение или фиброз фасции. Curr. Боль Головная боль Rep. 18: 441.
Google Scholar
Пирс Р. В., Шерц П. Дж., Кэмпбелл Дж. К. и Табин К. Дж. (2007). Анализ клеточного происхождения зачатка куриной конечности. Dev. Биол. 310, 388–400. DOI: 10.1016 / j.ydbio.2007.08.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Питер А. К., Ченг Х., Росс Р. С., Ноултон К. У. и Чен Дж. (2011). Костамер соединяет саркомеры с сарколеммой поперечно-полосатой мышцы. Прог. Педиатр. Кардиол. 31, 83–88. DOI: 10.1016 / j.ppedcard.2011.02.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перслоу П. П. (2002). Структура и функциональное значение изменений соединительной ткани в мышцах. Комп. Биохим. Physiol. Мол. Интегр. Physiol. 133, 947–966. DOI: 10.1016 / s1095-6433 (02) 00141-1
CrossRef Полный текст | Google Scholar
Рамасвами, К. С., Палмер, М. Л., ван дер Мейлен, Дж. Х., Рену, А., Костроминова, Т. Ю., Мишель, Д. Е. и др. (2011). Боковая передача силы нарушена в скелетных мышцах дистрофических мышей и очень старых крыс: латеральная передача силы в скелетных мышцах мышей и крыс. J. Physiol. 589, 1195–1208.DOI: 10.1113 / jphysiol.2010.201921
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райагири, С. С., Ранальди, Д., Рэйвен, А., Мохамад Азхар, Н. И. Ф., Лефевр, О., Заммит, П. С. и др. (2018). Ремоделирование базальной пластинки в нише стволовых клеток скелетных мышц опосредует самообновление стволовых клеток. Нат. Commun. 9: 1075.
Google Scholar
Риз, С. П., Андервуд, К. Дж., И Вайс, Дж. А. (2013). Влияние протеогликана декорина на фибриллогенез, ультраструктуру и механику коллагеновых гелей типа I. Matrix Biol. 32, 414–423. DOI: 10.1016 / j.matbio.2013.04.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Реннинг, С. Б., Педерсен, М. Э., Андерсен, П. В., и Холлунг, К. (2013). Комбинация гликозаминогликанов и фиброзных белков улучшает пролиферацию клеток и раннюю дифференцировку первичных клеток скелетных мышц крупного рогатого скота. Дифференциация 86, 13–22. DOI: 10.1016 / j.diff.2013.06.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роуленд, Л.А., Бал, Н. К., Периасами, М. (2015). Роль термогенных механизмов скелетных мышц в эндотермии позвоночных. Biol. Преподобный Камб. Филос. Soc. 90, 1279–1297. DOI: 10.1111 / brv.12157
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рубенштейн, А. Б., Смит, Г. Р., Рауэ, У., Бег, Г., Минчев, К., Руф-Замойски, Ф., и др. (2020). Одноклеточные профили транскрипции в скелетных мышцах человека. Sci. Отчет 10: 229.
Google Scholar
Сабателли, П., Гуаланди, Ф., Гара, С. К., Грумати, П., Зампарелли, А., Мартони, Э. и др. (2012). Экспрессия α5 и α6 цепей коллагена VI в мышцах человека и при мышечном фиброзе, связанном с мышечной дистрофией Дюшенна. Matrix Biol. 31, 187–196. DOI: 10.1016 / j.matbio.2011.12.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Санес, Дж. Р. (1982). Ламинин, фибронектин и коллаген в синаптических и внесинаптических частях базальной мембраны мышечных волокон. Дж.Cell Biol. 93, 442–451. DOI: 10.1083 / jcb.93.2.442
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саволайнен, Дж., Вяэнянен, К., Пуранен, Дж., Такала, Т. Э., Комулайнен, Дж., И Вихко, В. (1988). Синтез коллагена и протеолитическая активность в скелетных мышцах крыс: эффект гипсовой иммобилизации в удлиненных и укороченных положениях. Arch. Phys. Med. Rehabil. 69, 964–969.
PubMed Аннотация | Google Scholar
Шенфельд, Б.Дж. (2010). Механизмы гипертрофии мышц и их применение в тренировках с отягощениями. J. Strength Cond. Res. 24, 2857–2872. DOI: 10.1519 / JSC.0b013e3181e840f3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schoenrock, B., Zander, V., Dern, S., Limper, U., Mulder, E., Veraksitš, A., et al. (2018). Постельный режим, противодействие физическим упражнениям и восстанавливающее воздействие на систему мышечного тонуса человека в состоянии покоя. Фронт. Physiol. 9: 810. DOI: 10.3389 / fphys.2018.00810
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schönherr, E., Witsch-Prehm, P., Harrach, B., Robenek, H., Rauterberg, J., and Kresse, H. (1995). Взаимодействие бигликана с коллагеном I типа. J. Biol. Chem. 270, 2776–2783. DOI: 10.1074 / jbc.270.6.2776
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шварц Р. И. (2015). Коллаген I и фибробласты: высокая экспрессия белка требует новой парадигмы посттранскрипционной регуляции с обратной связью. Biochem. Биофиз. Rep. 3, 38–44. DOI: 10.1016 / j.bbrep.2015.07.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сефтон, Э. М., и Кардон, Г. (2019). Связующее развитие мышц, врожденные дефекты и эволюция: важная роль соединительной ткани мышц. Curr. Вершина. Dev. Биол. 132, 137–176. DOI: 10.1016 / bs.ctdb.2018.12.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шарафи Б. и Блемкер С.С. (2011). Математическая модель передачи силы от оканчивающихся внутри ячеек мышечных волокон. J. Biomech. 44, 2031–2039. DOI: 10.1016 / j.jbiomech.2011.04.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Соренсен, Дж. Р., Скоузен, К., Холланд, А., Уильямс, К., и Хилдал, Р. Д. (2018). Острый внеклеточный матрикс, воспалительная реакция и реакция MAPK на удлинение сокращений в скелетных мышцах пожилого человека. Exp. Геронтол. 106, 28–38.DOI: 10.1016 / j.exger.2018.02.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Street, S. F. (1983). Боковая передача напряжения в миофибриллах лягушки: миофибриллярная сеть и поперечные цитоскелетные связи являются возможными передатчиками. J. Cell. Physiol. 114, 346–364. DOI: 10.1002 / jcp.1041140314
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сумиёси, Х., Лауб, Ф., Йошиока, Х., и Рамирес, Ф. (2001).Эмбриональная экспрессия коллагена типа XIX преходяща и ограничена мышечными клетками. Dev. Дин. 220, 155–162. DOI: 10.1002 / 1097-0177 (2000) 9999: 9999 <:: aid-dvdy1099> 3.0.co; 2-w
CrossRef Полный текст | Google Scholar
Суоминен, Х., Хейккинен, Э. (1975). Активность ферментов в мышечной и соединительной ткани M. Vastus lateralis у мужчин в возрасте от 33 до 70 лет, которые обычно тренируются и ведут малоподвижный образ жизни. Eur. J. Appl. Physiol. 34, 249–254. DOI: 10.1007 / bf00999938
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Суоминен, Х., Хейккинен, Э., и Паркатти, Т. (1977). Влияние восьминедельной физической подготовки на мышцы и соединительную ткань M. Vastus lateralis у 69-летних мужчин и женщин. J. Gerontol. 32, 33–37. DOI: 10.1093 / geronj / 32.1.33
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Swartz, M. E., Eberhart, J., Pasquale, E. B., and Krull, C.Э. (2001). Взаимодействия EphA4 / эфрин-A5 при миграции клеток-предшественников мышц в передних конечностях птиц. Dev. Camb. Англ. 128, 4669–4680.
PubMed Аннотация | Google Scholar
Такаги Р., Огасавара Р., Цутаки А., Наказато К. и Исии Н. (2016). Региональная адаптация коллагена в скелетных мышцах к повторяющимся сериям напряженных эксцентрических упражнений. Pflugers Arch. 468, 1565–1572. DOI: 10.1007 / s00424-016-1860-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такала, Т.Э. и Виртанен П. (2000). Биохимический состав внеклеточного матрикса мышц: эффект нагрузки. Сканд. J. Med. Sci. Спорт 10, 321–325. DOI: 10.1034 / j.1600-0838.2000.010006321.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Takala, T. E. S., Myllylä, R., Salminen, A., Anttinen, H., and Vihko, V. (1983). Повышенная активность пролил-4-гидроксилазы и галактозилгидроксилизилглюкозилтрансферазы, ферментов биосинтеза коллагена, в скелетных мышцах мышей, тренированных на выносливость. Pflügers Arch. 399, 271–274. DOI: 10.1007 / BF00652751
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Там, К. С., Чаудхури, Р., Хатчисон, А. Т., Самоча-Бонет, Д., и Хейлбронн, Л. К. (2017). Ремоделирование внеклеточного матрикса скелетных мышц после кратковременного переедания у здоровых людей. Метаболизм 67, 26–30. DOI: 10.1016 / j.metabol.2016.10.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Там, К.С., Ковингтон, Дж. Д., Баджпей, С., Чукалова, Ю., Бурк, Д., Йоханнсен, Д. Л. и др. (2014). Увеличение веса показывает резкое увеличение ремоделирования внеклеточного матрикса скелетных мышц. J. Clin. Эндокринол. Метаб. 99, 1749–1757. DOI: 10.1210 / jc.2013-4381
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Там, С. С., Пауэр, Дж. Э., Маркович, Т. П., Йи, К., Морш, М., МакЛеннан, С. В. и др. (2015). Влияние питания с высоким содержанием жиров на физическую функцию и внеклеточный матрикс скелетных мышц. Nutr. Диабет 5: e187. DOI: 10.1038 / nutd.2015.39
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Thorsteinsdóttir, S., Deries, M., Cachaço, A. S., and Bajanca, F. (2011). Размер внеклеточного матрикса развития скелетных мышц. Dev. Биол. 354, 191–207. DOI: 10.1016 / j.ydbio.2011.03.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тирни, М. Т., Громова, А., Сесилло, Ф. Б., Сала, Д., Спенле, К., Orend, G., et al. (2016). Автономное ремоделирование внеклеточного матрикса контролирует прогрессивную адаптацию регенеративной способности мышечных стволовых клеток во время развития. Cell Rep. 14, 1940–1952. DOI: 10.1016 / j.celrep.2016.01.072
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уэдзуми А., Фукада С., Ямамото Н., Такеда С. и Цучида К. (2010). Мезенхимальные предшественники, отличные от сателлитных клеток, способствуют образованию эктопических жировых клеток в скелетных мышцах. Нат. Cell Biol. 12, 143–152. DOI: 10.1038 / ncb2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Uhlen, M., Oksvold, P., Fagerberg, L., Lundberg, E., Jonasson, K., Forsberg, M., et al. (2010). К основанному на знаниях Атласу белков человека. Нат. Biotechnol. 28, 1248–1250. DOI: 10.1038 / nbt1210-1248
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Урчиуоло, А., Куарта, М., Морбидони, В., Гаттаццо, Ф., Молон С., Грумати П. и др. (2013). Коллаген VI регулирует самообновление сателлитных клеток и регенерацию мышц. Нат. Commun. 4: 1964. DOI: 10.1038 / ncomms2964
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vallecillo-García, P., Orgeur, M., Vom Hofe-Schneider, S., Stumm, J., Kappert, V., Ibrahim, D. M., et al. (2017). Odd skipped-related 1 идентифицирует популяцию эмбриональных фибро-адипогенных предшественников, регулирующих миогенез во время развития конечностей. Нат. Commun. 8: 1218.
Google Scholar
Вирджилио, К. М., Мартин, К. С., Пирс, С. М., и Блемкер, С. С. (2015). Многомасштабные модели скелетных мышц показывают комплексное влияние мышечной дистрофии на механику тканей и восприимчивость к повреждениям. Интерфейс Focus 5: 20140080. DOI: 10.1098 / rsfs.2014.0080
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Visse, R., and Nagase, H. (2003). Матричные металлопротеиназы и тканевые ингибиторы металлопротеиназ: структура, функция и биохимия. Circ. Res. 92, 827–839. DOI: 10.1161 / 01.RES.0000070112.80711.3D
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wang, D., Eraslan, B., Wieland, T., Hallström, B., Hopf, T., Zolg, D. P., et al. (2019). Атлас обилия протеома и транскриптомов 29 здоровых тканей человека. Мол. Syst. Биол. 15: e8503. DOI: 10.15252 / msb.20188503
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Весснер, Б., Либенштайнер, М., Nachbauer, W., and Csapo, R. (2019). Возрастной ответ внеклеточного матрикса скелетных мышц на упражнения с отягощениями: пилотное исследование. Eur. J. Sport Sci. 19, 354–364. DOI: 10.1080 / 17461391.2018.1526974
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уайт, Дж. П., Риси, Дж. М., Вашингтон, Т. А., Сато, С., Ле, М. Е., Дэвис, Дж. М. и др. (2009). Вызванное перегрузкой ремоделирование внеклеточного матрикса скелетных мышц и рост миофибрилл у мышей, лишенных IL-6. Acta Physiol. 197, 321–332. DOI: 10.1111 / j.1748-1716.2009.02029.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вильшут, К. Дж., Хаагсман, Х. П., и Ролен, Б. А. Дж. (2010). Компоненты внеклеточного матрикса определяют поведение стволовых клеток мышц свиньи. Exp. Cell Res. 316, 341–352. DOI: 10.1016 / j.yexcr.2009.10.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wood, L. K., Kayupov, E., Gumucio, J. P., Мендиас, К. Л., Клафлин, Д. Р., Брукс, С. В. (2014). Внутренняя жесткость внеклеточного матрикса в скелетных мышцах мышей увеличивается с возрастом. J. Appl. Physiol. 117, 363–369. DOI: 10.1152 / japplphysiol.00256.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Yucesoy, C.A., Maas, H., Koopman, B.H.F.J.M., Grootenboer, H.J., и Huijing, P.A. (2006). Механизмы, вызывающие влияние положения мышц на проксимально-дистальные различия мышечной силы при передаче внемышечной миофасциальной силы. Med. Англ. Phys. 28, 214–226. DOI: 10.1016 / j.medengphy.2005.06.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Заммит П. С. (2017). Функция миогенных регуляторных факторов Myf5, MyoD, Myogenin и MRF4 в скелетных мышцах, сателлитных клетках и регенеративном миогенезе. Семин. Cell Dev. Биол. 72, 19–32. DOI: 10.1016 / j.semcdb.2017.11.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, К., и Гао, Ю. (2012). Конечно-элементный анализ механики боковой передачи силы в одиночном мышечном волокне. J. Biomech. 45, 2001–2006. DOI: 10.1016 / j.jbiomech.2012.04.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhu, J., Li, Y., Shen, W., Qiao, C., Ambrosio, F., Lavasani, M., et al. (2007). Взаимосвязь между трансформирующим фактором роста-β1, миостатином и декорином: последствия для фиброза скелетных мышц. J. Biol. Chem. 282, 25852–25863.DOI: 10.1074 / jbc.M704146200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zong, H., Bastie, C.C., Xu, J., Fassler, R., Campbell, K.P., Kurland, I.J., et al. (2009). Инсулинорезистентность у мышей с дефицитом рецептора интегрина бета1, специфичных для поперечно-полосатых мышц. J. Biol. Chem. 284, 4679–4688. DOI: 10.1074 / jbc.M807408200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цюгель, М., Маганарис, К. Н., Вильке, Дж., Юркат-Ротт, К., Klingler, W., Wearing, S.C., et al. (2018). Исследование фасциальных тканей в спортивной медицине: от молекул до адаптации тканей, травм и диагностики: консенсусное заявление. руб. J. Sports Med. 52: 1497. DOI: 10.1136 / bjsports-2018-099308
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Определение и примеры скелетных мышц
Определение
существительное, множественное число: скелетные мышцы
Произвольная поперечнополосатая (позвоночная) мышца, которая связана со скелетом и, таким образом, перемещает части скелетной системы
Дополнение
Мышечная система позвоночных состоит из различных мышц.Существует три основных типа мышц: скелетные мышцы, гладкие мышцы и сердечные мышцы. Скелетная мышца — это тип мышц, который известен своей многоядерностью (синцитией), длинными цилиндрическими мышечными волокнами, поперечными отметинами на мышечных волокнах (как видно под микроскопом) и прикреплением к костям (сухожилиями). Скелетная мышца состоит из пучков мышечных волокон. Каждое из этих волокон содержит пучок более мелких миофибрилл. Каждая миофибрилла состоит из двух миофиламентов: тонких и толстых.Миофиламенты расположены таким образом, что появляется повторяющийся узор из светлых и темных полос. Каждая из повторяющихся единиц светлых и темных полос называется саркомером. Саркомер считается основным механизмом, отвечающим за сокращение мышц. Скелетные мышцы отвечают за движущиеся части скелета (например, при передвижении). Эти мышцы находятся под контролем соматической нервной системы, части периферической нервной системы, связанной с произвольными сокращениями мышц.
Волокна скелетных мышц можно классифицировать в соответствии с их способностью к сокращению, т. Е. Быстро сокращающиеся мышцы и медленно сокращающиеся мышцы. Быстро сокращающиеся мышцы — это волокна скелетных мышц, обладающие высокой миофибриллярной активностью АТФазы, высокой активностью гликолитических ферментов и промежуточным содержанием гликогена, которые вызывают быстрое сокращение. Есть два типа: (1) быстро утомляемые волокна, также называемые белыми волокнами (с низким содержанием миоглобина, небольшим содержанием митохондрий и быстрой утомляемостью из-за ограниченного содержания гликогена и низкой способности к окислительному метаболизму) и (2) быстрая утомляемость. -резистентные волокна — также называемые красными волокнами (с большим содержанием митохондрий и высоким содержанием миоглобина, что способствует их устойчивости к утомлению).
Медленно сокращающиеся мышцы — это волокна скелетных мышц, имеющие низкую активность миофибриллярной АТФазы 63b, низкое содержание гликогена и высокое содержание миоглобина, высокую активность митохондриальных окислительных ферментов и промежуточное содержание митохондрий, которые вызывают медленное сокращение и устойчивы к усталости.
Сравните:
См. Также:
Связанные термины:
- желудочек скелетной мышцы
- Сателлитная клетка скелетной мышцы
Последнее обновление 1 марта 2021 г.
Ткани животных.Мышцы. Атлас гистологии растений и животных.
Мышечная ткань производит движение тела и органов. Мышечные клетки известны как миоциты или мышечные волокна. У них есть способность уменьшать свою длину, что, в свою очередь, вызывает сокращение мышц. Мышечные клетки организованы в пучки или в листы. Сократительная способность этих клеток зависит от ассоциации актиновых нитей и нитей моторного белка миозина II в цитоплазме.
Мышечные клетки делятся на три типа: скелетные, гладкие и сердечные.Клетки скелетных мышц — это очень длинные клетки с темными полосами, которые перпендикулярны продольной оси клетки при наблюдении под световой микроскопией. Следовательно, их также называют клетками поперечно-полосатых скелетных мышц. Клетки сердечной мышцы или кардиомиоциты короче, разветвлены и также имеют бороздки. Клетки гладкой мускулатуры имеют веретеновидную форму и не имеют бороздок, поэтому название гладкое.
1. Поперечно-полосатая скелетная мышца
Клетки поперечно-полосатых скелетных мышц.Поперечно-полосатая скелетная мышца также называется произвольной, потому что она отвечает за сознательные или произвольные движения. Его иннервируют нервные волокна, идущие от центральной нервной системы. Поперечно-полосатые скелетные мышцы обычно прикрепляются к костям напрямую или чаще через сухожилия. Однако есть мышцы, не связанные с костями, такие как мышцы глаза, верхнего отдела пищевода и языка.
Скелетные мышцы состоят из поперечно-полосатых клеток скелетных мышц, также известных как мышечные волокна или миоциты, а также соединительной ткани, нервов и кровеносных сосудов.Клетки поперечно-полосатых скелетных мышц соединяются вместе, образуя пучки, а пучки образуют скелетные мышцы (рис. 1 и 2), которые в основном отвечают за движения животных. Мышечные клетки окружены особой внеклеточной матрицей, известной как базальная пластинка, а также ретикулярными и коллагеновыми волокнами, которые вместе образуют эндомизий. Каждый пучок окружен слоем соединительной ткани, называемым перимизием, а вся мышца покрыта эпимизием, который также является соединительной тканью (рис. 1).Кровеносные сосуды и нервные волокна входят в мышцу через эти слои соединительной ткани. Нервные волокна управляют сокращениями мышц.
Рисунок 1. Организация поперечно-полосатой скелетной мышцы. Рисунок 2. Поперечно-полосатая скелетная мышца после окрашивания трихомом по Массону.ИЗОБРАЖЕНИЯ СТРИТИЧЕСКОЙ МЫШЦЫ СКЕЛЕТА, НЕ СВЯЗАННОЙ С СУХИМАМИ
Закрыть XКак упоминалось выше, мышцы, не связанные с костями, по крайней мере, не связанные посредством сухожилий, демонстрируют иную организацию в области закрепления.Таким образом, они прикрепляются к соединительной ткани структур, которые необходимо переместить, таких как глаза, язык и пищевод.
Клетки поперечно-полосатой скелетной мускулатуры — очень длинные и неразветвленные клетки, расположенные параллельно в виде листов и пучков. Они могут иметь длину от нескольких до 30 см и диаметр от 10 до 100 мкм. У них много ядер (синцитий: цитоплазма, разделяемая двумя или более ядрами), расположенных чуть ниже плазматической мембраны. Полосы являются следствием расположения актиновых и миозиновых нитей в цитоплазме.Обе филаменты образуют пучки, известные как миофибриллы, которые ориентированы параллельно длинной оси клетки. Наложение актиновых и миозиновых нитей приводит к темным полосам, а прозрачные полосы соответствуют только актиновым нитям.
Поперечно-полосатая клетка скелетных мышц.Хотя поперечно-полосатые клетки скелетных мышц могут увеличиваться и уменьшаться в размерах (гипертрофия), они не могут делиться. В послеродовой период увеличение количества клеток (гиперплазия) является следствием пролиферативной активности сателлитных клеток.Это стволовые клетки скелетных мышц, находящиеся между клеточной мембраной зрелых мышечных клеток и их базальной пластинкой. Клетки-сателлиты содержат одно ядро и могут делиться, давая новые поперечно-полосатые клетки скелетных мышц, обладающие сократительной способностью.
Клетки поперечно-полосатых скелетных мышц находятся под контролем нейронов (мотонейронов) головного и спинного мозга. Эта иннервация производит произвольные движения. Каждый мотонейрон может иннервировать несколько мышечных клеток. Моторная единица — это группа мышечных клеток, иннервируемых аксоном мотонейрона, а также сам аксон.Двигательные единицы могут быть большими, более 100 мышечных клеток, иннервируемых одним и тем же аксоном, или такими маленькими, как несколько десятков иннервируемых мышечных клеток. Количество нейронов двигательной единицы зависит от точности движения, которое требуется каждой части тела. Более точное движение означает меньшие единицы. Кроме того, есть два типа мышечных клеток относительно скорости сокращения. Быстро сокращающиеся мышечные клетки меньше и темнее, с более высокой концентрацией миоглобина и большим количеством митохондрий. Медленно сокращающиеся мышечные клетки крупнее и четче и содержат меньшую плотность митохондрий.Медленно сокращающиеся мышечные клетки активны во время продолжительных движений и для поддержания положения тела, тогда как быстро сокращающиеся мышечные клетки задействуются во время коротких и интенсивных движений. Оба типа мышечных клеток встречаются почти в каждой скелетной мышце тела, хотя и имеют разные пропорции.
2. Сердечная мышца
Клетки сердечной мышцы.Сердечная мышца, или миокард, является основным компонентом стенок сердца. Он качает кровь по артериям, сокращая стенки желудочков сердца.
Сердечная мышца состоит из кардиомиоцитов. Они показывают только одно ядро, находящееся в центральном положении, они короче (около 80 мкм) и шире (около 15 мкм), чем клетки поперечно-полосатых скелетных мышц, и представляют собой разветвленные клетки. Кардиомиоциты также показывают поперечные полосы с рисунком, аналогичным узору поперечно-полосатых клеток скелетных мышц, с темными полосами, соответствующими перекрытию актиновых и миозиновых нитей, а светлые полосы — только актиновые нити.Клеточная мембрана поперечно-полосатых мышечных клеток, как сердечных, так и скелетных, известна как сарколемма. У млекопитающих сарколемма кардиомиоцитов показывает множество инвагинаций, которые образуют так называемые поперечные канальцы диаметром от 5 до 20 нм.
Кардиомиоциты прикреплены друг к другу с помощью так называемых вставных дисков, которые после общего гистологического окрашивания можно увидеть в виде темных полос. Интеркалированные диски состоят из многих комплексов клеточной адгезии, в основном десмосом и адгезивных соединений.Роль всех этих комплексов клеточной адгезии состоит в том, чтобы держать кардиомиоциты плотно связанными друг с другом, поскольку они являются местами закрепления цитоскелета. Щелевые соединения также могут быть обнаружены в плазматической мембране соседних кардиомиоцитов, ответственных за синхронизацию сокращения сердечной стенки, обеспечивая прямую связь между цитоплазмами соседних кардиомиоцитов. Сердечная мышца не прикрепляется к сухожилиям.
Ритм сердечных сокращений находится под контролем вегетативной нервной системы, которая регулирует частоту и интенсивность сокращений сердечной мышцы.Однако ритмическая активность генерируется некоторыми специальными кардиомиоцитами, работающими как кардиостимуляторы. Вот почему сердечная мышца считается мышцей с непроизвольным сокращением. Щелевые соединения между соседними мышечными клетками помогают синхронизировать сокращения, напрямую соединяя их цитоплазмы. Благодаря этому нет необходимости в нервной иннервации каждого кардиомиоцита, а требуется только кардиомиоциты, задающие ритм. На частоту сердечных сокращений также влияют гормоны.
Кардиомиоциты содержат очень мало гликогена, поэтому они не могут получить много энергии от гликолиза.Таким образом, большая часть энергии поступает за счет окислительного фосфорилирования в митохондриях, что означает очень высокую потребность в кислороде. Таким образом, когда происходит прекращение подачи кислорода из-за обструкции кровеносных сосудов, кардиомиоциты быстро повреждаются.
3. Гладкая мышца
Гладкомышечные клетки.Гладкая мышца также известна как непроизвольная мышца. Он обнаружен в тех органах, которые не нуждаются в произвольных движениях, таких как пищеварительный тракт, дыхательная система, некоторые железы, желчный пузырь, мочевой пузырь, кровеносные и лимфатические сосуды, матка и т. Д.
Гладкомышечные клетки имеют длину от 20 до 500 мкм и диаметр от 8 до 10 мкм. В миометрии матки они могут достигать 800 мкм в длину. Это веретеновидные клетки, иногда с разветвленными концами и содержащие одно удлиненное ядро в центре клетки. На обоих полюсах ядра находятся участки цитоплазмы, содержащие большую часть клеточных органелл и некоторые филаменты цитоскелета. Остальная цитоплазма выглядит однородной и содержит сократительную систему.В отличие от сердечных и скелетных мышц, гладкомышечные клетки не организуют актиновые и миозиновые филаменты должным образом, поэтому при наблюдении под световой микроскопией нет полос. Гладкая мышца получила название из-за отсутствия штрихов. Гладкомышечные клетки окружены слоем внеклеточного матрикса, известным как базальная пластинка. Есть некоторые части гладкомышечной клетки без базальной пластинки, которые обеспечивают прямой контакт между соседними клетками, где устанавливаются щелевые соединения.
В цитоплазме гладкомышечных клеток есть большие плотные агрегаты белков, называемые плотными тельцами (рис. 3), которые содержат большое количество альфа-актина и являются точками прикрепления актиновых филаментов.Функция плотных тел аналогична Z-дискам поперечно-полосатых клеток скелетных мышц. В клеточной мембране также есть плотные структуры, к которым прикрепляются филаменты цитоскелета. Более мелкие темные точки в цитоплазме соответствуют миозиновым нитям в поперечном направлении. В цитоплазме можно наблюдать разбросанные актиновые филаменты, которые вместе с миозиновыми филаментами вызывают сокращение клеток. На миозиновую нить приходится около 15 актиновых филаментов (соотношение в поперечно-полосатых скелетных мышцах составляет 6: 1).Промежуточные волокна, такие как десмин и виментин, также присутствуют в гладкомышечных клетках. В целом содержание белка в гладкомышечных клетках на 50% ниже, чем в поперечно-полосатых скелетных мышцах. Концентрация миозина особенно ниже. Однако концентрация актина и тропомиозина одинакова в обоих типах мышечных клеток. В гладкомышечных клетках миозин должен фосфорилироваться, чтобы активировать актиновые филаменты, так что скорость сокращения снижается. Клетки гладкой мускулатуры не содержат тропонин.
Рисунок 3. Изображение, полученное с помощью просвечивающей электронной микроскопии, гладкомышечных клеток кишечника в поперечном сечении.Гладкая мускулатура находится во многих частях тела, где клетки гладкой мускулатуры организованы по-разному в соответствии со своими функциями. Таким образом, их можно найти разбросанными в некоторых соединительных тканях, как тонкие пучки в дерме, прикрепленные к волосяным фолликулам и организованные слоями в пищеварительном канале. Роль гладкой мускулатуры в полых органах двойная: тоническое сокращение, чтобы сохранить размеры органа против потенциально опасных растяжений и способствовать определенной функции этого органа, такой как обеспечение перистальтических движений в кишечнике и регулирование кровяного давления в кишечнике. сердечно-сосудистая система.
Сокращение гладкомышечных клеток запускается аксонами вегетативной нервной системы. Функционально гладкомышечные клетки организованы двумя способами: единичные и множественные (рис. 4). В единичных единицах гладкомышечные клетки расположены слоями, так что концы клеток расположены между средними частями окружающих клеток. Таким образом, клеточные мембраны соседних клеток расположены очень близко и могут образовывать щелевые соединения. Нервные волокна контактируют только с несколькими клетками, а прямая связь цитоплазма-цитоплазма синхронизирует сокращение всей группы связанных клеток, образующих единое целое.В многоэлементной организации каждая клетка иннервируется независимо и изолирована от других соединительной тканью.
Рисунок 4. Организация гладкомышечных клеток в отдельных единицах и в нескольких единицах. Коричневые линии между ячейками изображают щелевые соединения.В некоторых органах, таких как мышцы пищеварительного тракта и трахеи, есть внутренние нейрональные сплетения, которые могут независимо активировать гладкомышечные клетки. Бывает даже при тяжелых повреждениях спинного мозга.Эта нейронная иннервация называется внутренней иннервацией. Однако большинство гладких мышц также получают входные данные от внешних источников автономной нервной системы, как симпатической, так и парасимпатической. Примечательно, что, независимо от источника иннервации, нет никаких специализированных структур на контактах нервного волокна с мембраной гладкой мускулатуры (в отличие от поперечно-полосатых клеток скелетных мышц, где моторные пластинки представляют собой отдельные и большие структуры, образованные входящими окончаниями аксонов и мембраной сотовый).
Помимо иннервации нервными окончаниями, клетки гладких мышц могут сокращаться аутокринными и паракринными химическими сигналами. Есть рецепторы, связанные с ионными каналами в плазматической мембране, для обнаружения этих типов молекул. Кроме того, есть рецепторы, которые ощущают растяжение клетки. Хотя гладкая мышца может развивать механическую силу, аналогичную поперечно-полосатым клеткам скелетных мышц, скорость сокращения намного ниже.
Миоэпителиальные клетки находятся между базальной пластинкой и эпителием.Они проявляют сократительную способность и помогают во время высвобождения продуктов, синтезируемых такими железами, как слюнные, молочные, слезные и сладкие железы. Миоэпителиальные клетки похожи на клетки гладких мышц. Вот почему они здесь упоминаются. Однако миоэпителиальные клетки происходят из эктодермы, а мышечные клетки развиваются из мезодермы.
мышечных волокон | BioNinja
Понимание:
• Волокна скелетных мышц многоядерные и содержат специализированный эндоплазматический ретикулум
• Мышечные волокна содержат множество миофибрилл
Организация скелетных мышц
- Скелетные мышцы состоят из плотно упакованных мышечных пучков (пучков), окруженных соединительной тканью (перимизий)
- Каждый пучок содержит несколько мышечных волокон , которые образуются, когда отдельные мышечные клетки сливаются вместе
- Мышечные волокна содержат трубчатые миофибриллы , которые проходят по длине волокна и отвечают за мышечное сокращение
- Миофибриллы можно разделить на повторяющиеся участки, называемые саркомеры , каждая из которых представляет собой единую сократительную единицу
Структурное устройство скелетных мышц
Структура мышечных волокон
Каждое отдельное мышечное волокно имеет следующие специальные особенности, предназначенные для облегчения мышечного сокращения:
- Они многоядерные (волокна образуются из слияния отдельных мышечных клеток и, следовательно, имеют много ядер)
- Они имеют большое количество митохондрий (сокращение мышц требует гидролиза АТФ)
- У них есть специализированный эндоплазматический ретикулум (он называется саркоплазматическим ретикулумом и хранит ионы кальция)
- Они содержат трубчатые миофибриллы, состоящие из двух разных миофиламентов — тонких волокон (актин) и толстая нить (миозин)
- Непрерывная мембрана, окружающая мышечное волокно, называется сарколеммой и содержит инвагинации, называемые Т-канальцами
Компоненты волокна скелетных мышц
Из чего состоят мышечные волокна?
Вы можете быть удивлены, узнав, что в вашем теле имеется до 840 различных мышц.Они бывают разных типов: сердечные мышцы, гладкие мышцы и скелетные мышцы. Сердечная мышца образует стенку сердца, а гладкие мышцы находятся внутри кровеносных сосудов, матки, стенок кишечника и внутренних мышц глаза. Большинство мышц вашего тела — это скелетные мышцы, которые прикреплены к костям, а иногда и к коже, например, к лицевым мышцам. Скелетные мышцы напрягаются, чтобы помочь конечностям и другим частям тела двигаться.
TL; DR (слишком длинный; не читал)
Мышца состоит из множества отдельных мышечных волокон — длинных цилиндрических клеток, состоящих из пучка миофибрилл, нитей, расположенных в сегментах, известных как саркомеры.
Структура мышечных волокон
Если вы представите поперечное сечение мышцы, вы увидите пучки волокон, известные как пучки, которые окружены соединительной тканью, называемой перимизием. Каждый пучок содержит от 10 до 100 мышечных волокон, в зависимости от конкретной мышцы. Большая и сильная мышца, например, четырехглавая мышца, имеет большое количество волокон в каждом пучке. Мышцы меньшего размера, например, в руке, содержат гораздо меньше волокон на пучок.
Мышечное волокно — это отдельная клетка, состоящая из пучка миофибрилл, нитей, расположенных сегментами, известными как саркомеры. Тонкие нити состоят из нитей протеина, называемого актином, который скручен вокруг нитей протеина, называемого тропомиозином. Толстые волокна состоят из белка, называемого миозином.
Каждое отдельное мышечное волокно покрыто изолирующей волокнистой соединительной тканью, называемой эндомизием. Мышечные волокна имеют диаметр от 10 до 80 микрометров и длину до 35 см.
Типы волокон скелетных мышц
Два основных типа волокон скелетных мышц — это медленно сокращающиеся (ST или Тип I) волокна и быстро сокращающиеся (FT или Тип II) волокна. Медленно сокращающиеся волокна сокращаются в течение длительного периода времени и медленно утомляются. Существует три различных типа быстросокращающихся волокон. Тип IIa имеет умеренно быстрое время сокращения и относительно длительное сопротивление усталости. Тип IIx имеет быстрое время сжатия и умеренное сопротивление усталости, а тип IIb имеет очень быстрое время сжатия, но очень быстро утомляется.
Медленно сокращающиеся и быстро сокращающиеся мышцы
Для удовлетворения различных требований организма необходимы различные типы мышечных волокон, и большинство мышц имеют комбинацию медленных и быстро сокращающихся волокон. Медленно сокращающиеся волокна могут удерживать сокращения в течение длительных периодов времени, в то время как быстро сокращающиеся волокна создают короткие сильные сокращения.
Вы задействуете медленно сокращающиеся мышцы в аэробных упражнениях, требующих низкого уровня нагрузки в течение длительного периода времени, таких как сидение, ходьба, езда на велосипеде и бег на длинные дистанции.


