что такое и как выводить
Молочная кислота и лактат давно обрели репутацию главных врагов в спорте на выносливость. Их обвиняют в плохих результатах, боли и жжении в мышцах, а некоторые вообще в интоксикации организма. В статье расскажем некоторые важные факты о лактате и поясним, почему лактат в мышцах – наш друг, а не враг.
Молочная кислота и лактат: в чем разница
Лактат часто называют молочной кислотой и наоборот. Уточним: лактат — это соль молочной кислоты. Образовавшаяся в скелетных мышцах молочная кислота превращается в лактат. Из мышц лактат попадает в кровь, оттуда — в органы и другие мышцы, где используется для образования энергии. Фактически, молочная кислота не может накапливаться в организме, накапливается лактат.
Лактат и молочная кислота. Источник: massagefitnessmag.com
Как образуется молочная кислота в мышцах?
Молочная кислота образуется при распаде углеводов — гликолизе. Это сложный химический процесс из нескольких реакций, но мы опишем его более примитивно. Он бывает аэробным (с участием кислорода) и анаэробным (без участия кислорода).
Он бывает аэробным (с участием кислорода) и анаэробным (без участия кислорода).
Аэробный гликолиз происходит, когда энергия в организме вырабатывается кислородной энергосистемой. Это обычная жизнедеятельность или легкие физические нагрузки низкой и средней интенсивности. Такой гликолиз проходит в 2 этапа:
- Из глюкозы и молекул АДФ образуется молочная кислота и энергия
- Молочная кислота нейтрализуется при взаимодействии с кислородом и молекулами АДФ, в результате реакции выделяется энергия, образуются углекислый газ и вода
Пока работает кислородная система, молочная кислота не задерживается в мышцах.
Во время интенсивных нагрузок нужна быстрая энергия. Кислородная система медленная, поэтому на помощь приходит лактатная энергосистема — она работает без участия кислорода, не тратит время на его транспортировку, поэтому быстро производит энергию. Происходит анаэробный гликолиз: глюкоза расщепляется до молочной кислоты и энергии. Без участия кислорода молочная кислота не нейтрализуется, как при аэробном гликолизе, а накапливается в мышцах в виде лактата.
От чего зависит уровень лактата?
Уровень лактата в крови спортсмена зависит от интенсивности тренировки и способности организма утилизировать молочную кислоту. Во время интенсивных занятий подключается лактатный механизм образования энергии, где вместе с АТФ образуется лактат. Чем быстрее бежать или чем чаще крутить педали — тем больше требуется энергии, а вместе с ней образуется и накапливается лактат. Накопление лактата объясняется тем, что скорость образования лактата при интенсивной нагрузке выше, чем скорость его переработки. Суть тренировок на уровне ПАНО — научить организм эффективнее использовать лактат и не позволять ему накапливаться.
В состоянии покоя концентрация лактата в крови примерно равна 1-1,5 ммоль/л. Во время физических упражнений уровень лактата повышается и может достигать значений 30 ммоль/л при тяжелых нагрузках.
Забор крови на лактат из мочки уха. Источник: core4endurance.com.au
Зачем спортсмену измеряют лактат?
В профессиональном спорте лактат используют как индикатор интенсивности нагрузки. Уровень лактата повышается с увеличением интенсивности, поэтому по количеству лактата в крови определяют тип тренировки и вычисляют зоны интенсивности. Концентрация лактата в крови в разных зонах интенсивности:
Уровень лактата повышается с увеличением интенсивности, поэтому по количеству лактата в крови определяют тип тренировки и вычисляют зоны интенсивности. Концентрация лактата в крови в разных зонах интенсивности:
- в аэробной зоне — 2 ммоль/л
- в транзитной зоне — 4-10 ммоль/л
- в анаэробной зоне — более 10 ммоль/л
Проведя лактатный тест, можно наиболее точно определить ПАНО спортсмена или лактатный порог. Уровень лактата 4 ммоль/л считается примерным уровнем ПАНО — моментом, когда организм переключается с преимущественно аэробного режима на анаэробный. Многие спортсмены-любители занимаются до изнеможения, ошибочно полагая, что чем интенсивнее тренировка — тем выше результат. Усталость и сбитая координация, как правило, признак высокого уровня лактата в крови. Частые тренировки на высокой интенсивности не только не приносят результата, но и ухудшают физическую форму и приводят к перетренированности.
Замер уровня лактата в крови. Источник: trackanalysis. co.uk
co.uk
Зная свой лактатный порог, можно построить эффективный тренировочный план и тренироваться с нужной интенсивностью. Например: тренировки на уровне лактатного порога (то есть при концентрации лактата в крови около 4 ммоль/л) развивают пороговую скорость спортсмена и повышают ПАНО. Тренировки на уровне лактата 0,5-1,5 ммоль/л считаются восстановительными, а при концентрации лактата 2-4 ммоль/л выполняются аэробные тренировки, которые составляют основную часть тренировочного плана спортсмена на выносливость.
Во время тренировочного цикла по уровню лактата следят за эффективностью подготовки спортсмена. Если со временем уровень лактата при одних и тех же нагрузках снижается — это говорит о росте спортивной формы, если повышается — о спаде формы. В последнем случае корректируют тренировочный план.
Как выводить молочную кислоту из организма
Лучший способ быстрее избавиться от избытка лактата — заминка или восстановительный кросс. Это активизирует аэробный обмен, тогда организм быстрее использует излишки лактата. Но даже без заминки уже через несколько часов содержание лактата в крови приходит в норму. Массаж, баня и другие процедуры помогают общему процессу восстановления, но не влияют на молочную кислоту и лактат.
Это активизирует аэробный обмен, тогда организм быстрее использует излишки лактата. Но даже без заминки уже через несколько часов содержание лактата в крови приходит в норму. Массаж, баня и другие процедуры помогают общему процессу восстановления, но не влияют на молочную кислоту и лактат.
Лактат в мышцах: 7 фактов
- Лактат — важный источник энергии в организме, который используется мышцами, сердцем, головным мозгом, печенью и другими органами
- Лактат вырабатывается в организме постоянно, даже при достаточном поступлении кислорода. В состоянии покоя или слабой нагрузки лактат используется организмом и не накапливается
- Лактат используется для синтеза гликогена в мышцах
- Тренированные и нетренированные спортсмены вырабатывают примерно одинаковое количество лактата, но тренированные используют его более эффективно
- Чем выше нагрузка, тем больше производится лактата
- Лактат — естественный предохранитель организма от перегрузок и показатель уровня нагрузки
- Лактат не вызывает боль в мышцах.
 Несколько дней после тренировки мышцы болят не из-за лактата, а из-за микроповреждений и процесса восстановления. Концентрация лактата в мышцах и крови снижается уже через несколько часов после нагрузки
Несколько дней после тренировки мышцы болят не из-за лактата, а из-за микроповреждений и процесса восстановления. Концентрация лактата в мышцах и крови снижается уже через несколько часов после нагрузки
Занимайтесь спортом, двигайтесь и путешествуйте! Если нашли ошибку или хотите обсудить статью – пишите в комментариях.
Подписывайтесь на нас в Telegram, Яндекс Дзен и Вконтакте
5 способов облегчить боль после тренировки
Новички часто ассоциируют тренировки с болью в мышцах. Неопытные любители считают, что дискомфорт в мускулах признак результативности занятий. Профессионалы знают — у боли есть свои причины.
Первая причина — скопление молочной кислоты в организме. Она жжёт мышцы изнутри, от чего и возникают неприятные ощущения. Кислота выделяется в организме во время тренировок. Чем больше подходов, тем больше закисляются мышцы.
Она жжёт мышцы изнутри, от чего и возникают неприятные ощущения. Кислота выделяется в организме во время тренировок. Чем больше подходов, тем больше закисляются мышцы.
|30 секунд — столько нужно работать с одной группой мышц, прежде чем молочная кислота начнёт скапливаться|
Для производства энергии в организме используется глюкоза. Во время тренировок она расщепляется и образуется ион молочной кислоты — лактат. Из-за интенсивных нагрузок он не успевает выводиться и скапливается. Избыток лактата становится причиной жжения.
Сохраняется “молочка” не долго. Научными экспериментами доказано, что кислота расходуется организмом во время и в последующий час после тренировки, после чего уровень снижается, а боль уходит.
Вторая причина дискомфорта в мышцах после тренировки — микротравмы. Из-за них тело может отзываться болью даже несколько дней спустя после тренировки. Травмы образуются от перегрузки мускул. Процесс заживления порванных мышц вызывает в организме дискомфорт, но именно он помогает расти рельефу.
Облегчить ощущение боли после тренировки можно несколькими способами:
- Правильно пить. Вода помогает вывести из организма скопившуюся молочную кислоту.
- Делать заминку и разминку. Растяжка мышц разгоняет кровь в организме. Это помогает быстрее избавиться от накопленной кислоты
- Отдыхать. Контрастный душ, сауна или массаж после занятия расслабляют перегруженные мускулы и усиляют кровообращение.
- Провести ещё одну тренировку. Несколько регулярных упражнений заставят мускулы привыкнуть к нагрузке и не отзываться болью. Вскоре тренировка одной и той же группы мышц перестанет быть “шоком” для тела.
- Насыщать организм. Верно организованный приём пищи с достаточным содержанием белка поможет мышцам быстрее восстановиться. Добрать недостающий в суточном приёме протеин можно из продукции Bombbar. Перекусы не содержат сахара и помогают восполнить недостаток белка.
Молочная кислота в мышцах и как ее вывести
- После окончания тренировки стоит обязательно проводить легкие аэробные нагрузки.
 Или в течение 10 минут проехаться в медленном темпе на велотренажере, пробежаться трусцой ни дорожке или снизить темп, если вы до этого бежали интенсивно.
Или в течение 10 минут проехаться в медленном темпе на велотренажере, пробежаться трусцой ни дорожке или снизить темп, если вы до этого бежали интенсивно.
Человек, который после интенсивной тренировки уделяет внимание легкой разминке, делает правильно. И он будет намного лучше себя чувствовать на утро, нежели тот, кто закончил занятие в зале на поднятии самого тяжелого веса или на самой высокой скорости на тренажере.
- Конечным этапом каждой тренировки должна быть растяжка мышц. Это гарантирует их эластичность завтра и способствует расслаблению после интенсивной нагрузки. Растяжка в конце занятия ускорит также восстановительный процесс, что в свою очередь снизит неприятные ощущения от него.
В качестве профилактических мер после тренировок, которые ускорят вывод молочной кислоты, или же просто помогут расслабить натруженные мышцы и вернуть себя в строй, предлагают еще несколько практических советов: массаж, горячую ванну, сауну, медицинские препараты, большое количество жидкости, полный покой.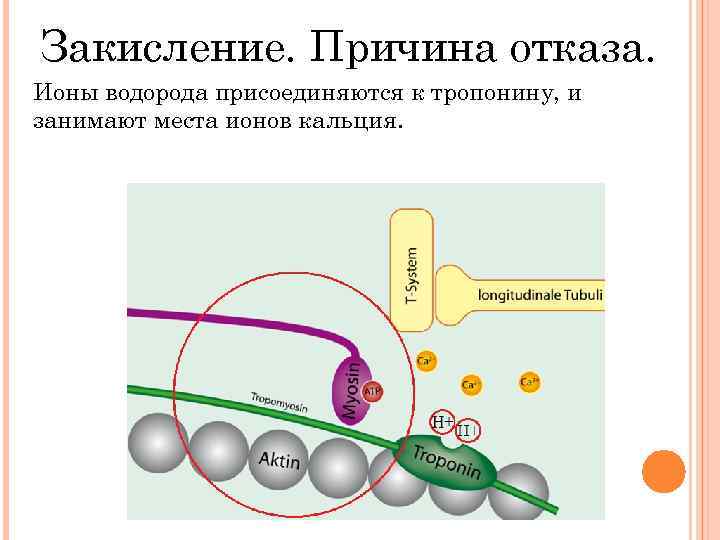
Однако, применение любого из вышеперечисленных методов и тех, о которых мы расскажем дальше, можно и разрешено только после консультации с доктором и личным тренером. Особенно, если вы находитесь в интересном положении или страдаете хроническими заболеваниями.
Если же вы определили, что в организме накоплено чрезмерное количество молочной кислоты, которое срочно нужно оттуда вывести, то стоит прибегать к вспомогательным методам. Опытные спортсмены предлагают несколько способов, как облегчить свое самочувствие и восстановится после активной тренировки. Остановимся конкретнее на том, как быстрее вывести накопленную молочную кислоту из организма после тренировки.
Горячая ванная
Вывод молочной кислоты из мышц – это дело нескольких часов, максимум 2 суток. Но в это время дискомфорт и болевые ощущения могут мешать нормальной жизни. Облегчить существование после активной тренировки помогает горячая ванная (она противопоказана при менструации, если вы страдаете гипертонией или беременны).
Нужно набрать горячую воду и погрузиться в ванну так, чтобы область сердца осталась над водой. Находитесь в воде в течение 10 минут. После этого стоит ополоснуться прохладной водой и повторить процедуру. Максимальное число подходов – 5. В самом конце стоит растереться полотенцем до появления красного оттенка кожи.
Поход в сауну
Смена интенсивности тренировки – гарантия того, что кровоток улучшиться и молочная кислота выйдет быстрее. Но этот метод подходит только на время тренировок. Что же делать, если вы забыли сменить нагрузку на меньшую, и желаете быстрее вывести молочную кислоту из вашего организма. Большое количество кислоты выходит с потом.
Молочная кислота в мышцах | Как ее вывести из организма?
2. Питание
 Мы знаем, что белок отвечает за строение мышц и что чем больше мышц, тем лучше метаболизм. Содержится он в мясе, рыбе, твороге, бобовых, яйцах. Главное — соблюдать баланс, так как излишнее потребление белка может привести к нарушениям в работе кишечника и печени.
Мы знаем, что белок отвечает за строение мышц и что чем больше мышц, тем лучше метаболизм. Содержится он в мясе, рыбе, твороге, бобовых, яйцах. Главное — соблюдать баланс, так как излишнее потребление белка может привести к нарушениям в работе кишечника и печени.Жиры незаменимы в сбалансированном питании, они отвечают за здоровье кожи, волос, ногтей. Недостаточное их потребление может сказаться не только на вашей внешней красоте, но и на самочувствии (мышечная слабость, упадок сил).
Углеводы – самый главный источник энергии, при недостаточном количестве углеводов наблюдается упадок сил, а это сказывается на эффективности тренировок.
Таким образом, при несоблюдении правильного соотношения КБЖУ, вы не только не сможете добиться результата, но и можете навредить своему здоровью.
3. Питьевой режим
Следует потреблять достаточное количество воды. Человек состоит из воды на 70%. Большее количество воды находится в мышцах, из этого следует, что достаточное ее потребление положительно влияет на длительность и интенсивность нагрузок. Благодаря достаточному потреблению воды, кровь разжижается, улучшается ее циркуляция, что тоже помогает избавиться от боли. Для того, чтобы определить, сколько же нужно пить, можно воспользоваться формулой для женщин: вес тела надо умножить на 31. Вы получите объём воды в миллилитрах (к примеру, 65 кг х 31 = 2015 мл, то есть два литра в сутки). Мужчины вес тела умножают на 35. У вас получится необходимый объём воды в миллилитрах (например, 86 кг х на 35 = 3010 мл, то есть 3 литра в сутки). При высоких нагрузках или в жаркую погоду этот объём нужно увеличивать на 0,5-1л в сутки.
Благодаря достаточному потреблению воды, кровь разжижается, улучшается ее циркуляция, что тоже помогает избавиться от боли. Для того, чтобы определить, сколько же нужно пить, можно воспользоваться формулой для женщин: вес тела надо умножить на 31. Вы получите объём воды в миллилитрах (к примеру, 65 кг х 31 = 2015 мл, то есть два литра в сутки). Мужчины вес тела умножают на 35. У вас получится необходимый объём воды в миллилитрах (например, 86 кг х на 35 = 3010 мл, то есть 3 литра в сутки). При высоких нагрузках или в жаркую погоду этот объём нужно увеличивать на 0,5-1л в сутки.
4. Сауны и горячие ванны
Для избавления от молочной кислоты можно также посещать сауну или принимать горячую ванну — это действенный способ от избавления от боли и жжения. Горячий душ сразу после тренировки помогает улучшить кровоток.
5. Массаж
У многих профессиональных спортсменов есть массажисты, так как восстановление без массажа у них длилось бы намного дольше. Массаж можно делать не только в салонах или фитнес-клубах, но и разминать мышцы самостоятельно.
Массаж можно делать не только в салонах или фитнес-клубах, но и разминать мышцы самостоятельно.
6. Режим
Если тренироваться регулярно, то организм начинает лучше адаптироваться к нагрузкам. С течением времени молочная кислота утилизируется быстрее. У спортсменов, занимающихся профессионально, уровень концентрации намного меньше, чем у новичков.
Заключение
Спорт должен стать неотъемлемой составляющей образа жизни здорового человека. Слушая свое тело и ориентируясь на свои ощущения в ходе тренировок, вы научитесь выбирать правильную интенсивность тренировок, вовремя обеспечивать мышцам отдых и правильно восстанавливаться после тренировок. Вышеприведенные советы помогут вам избежать болей после тренировки и ускорить прогресс. Будьте здоровы!
Боль в мышцах
Вы наверняка слышали, что причину болезни в мышцах связывают со скоплением в них молочной кислоты. Но это не так. Молочная кислота образуется в организме по причине распада глюкозы. Это происходит ВО ВРЕМЯ тренировочных нагрузок. Вам знакомо это жжение в мышцах, когда выполняете упражнение. Вот как раз так проявляет себя молочная кислота. Она выводится из организма в течение пары часов после тренировки. Значит, она сама не может быть причиной боли в теле через 1-2 дня.
Это происходит ВО ВРЕМЯ тренировочных нагрузок. Вам знакомо это жжение в мышцах, когда выполняете упражнение. Вот как раз так проявляет себя молочная кислота. Она выводится из организма в течение пары часов после тренировки. Значит, она сама не может быть причиной боли в теле через 1-2 дня.
Что происходит с нашими мышцами во время нагрузок?
Нужно отметить, что есть ещё одна причина болезненных ощущений в мышцах после тренировки. Это закисление мышц. Закисление происходит из-за активной выработки ионов водорода во врем тренировки. Количество ионов водорода превышает привычную норму, и это приводит к разрушению сократительных структур мышц.
Вашей ошибкой будет лежать и не двигаться из-за мышечной боли после тренировочного дня. Ваша задача разогнать кровь в организме, и дать ему понять, что эта боль — нормальное явление.
Если постоянно тренироваться до закисления, вы однозначно приведёте себя к высокой степени утомления, перетренированности, и, как результат, получите не рост мышц, а их разрушение. Поэтому будьте разумнее, не «убивайте» свой организм огромным количеством повторений.
Очень важно будет хорошенько поспать. Не менее 8-ми часов. Именно во время сна происходит восстановление всех микроповреждений, полученных на тренировке.
 Не нужно бежать закидываться жирными бургерами и сладкой газировкой. Восстанавливаете сбалансированно: белки, жиры, углеводы, клетчатка. Здоровая качественная еда будет вашим хорошим помощником к восстановлению организма и росту мышц. И не забывайте пить воду. Старайтесь выпивать от 2ух литров воды в день.
Не нужно бежать закидываться жирными бургерами и сладкой газировкой. Восстанавливаете сбалансированно: белки, жиры, углеводы, клетчатка. Здоровая качественная еда будет вашим хорошим помощником к восстановлению организма и росту мышц. И не забывайте пить воду. Старайтесь выпивать от 2ух литров воды в день. Кардио нагрузка — бег, плавание, велосипед, активная прогулка, танцы, йога, растяжка и т.п.. Многие профессиональные спортсмены и обычные люди подтверждают, что от мышечной боли их спасал небольшой кросс или велопрогулка. Самое сложное тут — перебороть себя в первые минут 10. Далее тело разогревается, и процесс не кажется таким уж мучительным. И после — становится действительно сильно легче.
Расслабляющий массаж. Это излюбленный способ избавления от мышечной боли + ускорение восстановительных процессов для большого количества людей. Массаж помогает разогнать лимфу, повышает эластичность мышц и убирает зажимы.
 Вы можете дополнить свои тренировками программой по массажу и восстановлению с помощью ролла.
Вы можете дополнить свои тренировками программой по массажу и восстановлению с помощью ролла.Баня, сауна и горячая ванна. При высоких температурах наши сосуды расширяются и это увеличивает объём крови в мышцах. Это влияет на увеличение скорости вывода токсинов и процесс восстановления.
Водные процедуры
Кстати, у нас в приложении вы можете найти большое количество разнообразных тренировок для растяжки, йоги и медитации.
С заботой о вас, FitStars ❤️
Молочная кислота — ваш друг, что бы ни говорил фитнес-тренер
Что такое молочная кислота и лактат
Нашему телу постоянно нужна энергия для работы органов и сокращения мышц. С пищей в организм поступают углеводы. В кишечнике они расщепляются до глюкозы, которая затем попадает в кровь и транспортируется в клетки организма, включая мышечные.
В цитоплазме клеток происходит гликолиз — окисление глюкозы до пирувата (пировиноградной кислоты) с образованием АТФ (аденозинтрифосфат, основное топливо организма).
Как видим, молочная кислота и лактат — это не одно и то же. Накапливается в мышцах, выводится и перерабатывается именно лактат. Поэтому говорить о молочной кислоте в мышцах некорректно.
До 1970 года лактат считался побочным продуктом, который возникает в работающих мышцах из-за недостатка кислорода. Однако исследования последних десятилетий опровергли это утверждение. Например, Мэтью Рогатски (Matthew J. Rogatzki) в 2015 году выяснил , что гликолиз всегда заканчивается образованием лактата.
Это же утверждает Джордж Брукс (George A. Brooks) из Калифорнийского университета, изучающий молочную кислоту более 30 лет. Накопление лактата показывает только баланс между его производством и устранением и не имеет отношения к аэробному или анаэробному метаболизму.
Лактат всегда формируется во время гликолиза вне зависимости от наличия или недостатка кислорода. Он производится даже в состоянии покоя.
Почему многие не любят молочную кислоту
Миф 1. Молочная кислота вызывает боль в мышцах
Этот миф давно уже опровергли, однако некоторые фитнес-тренеры до сих пор винят лактат в крепатуре, или отложенной боли в мышцах. На самом деле уровень лактата сильно снижается уже через несколько минут после прекращения нагрузки и полностью приходит в норму где-то через час после тренировки.
Таким образом, лактат никак не может вызывать боль в мышцах через 24–72 часа после тренировки. О том, какие механизмы заставляют ваши мышцы болеть после тренировки, можно почитать в этой статье.
Миф 2. Молочная кислота «закисляет» мышцы и вызывает их утомление
Существует распространённое мнение о том, что уровень лактата в крови влияет на работу мышц. Однако на самом деле в этом виноват не лактат, а ионы водорода, которые повышают кислотность тканей.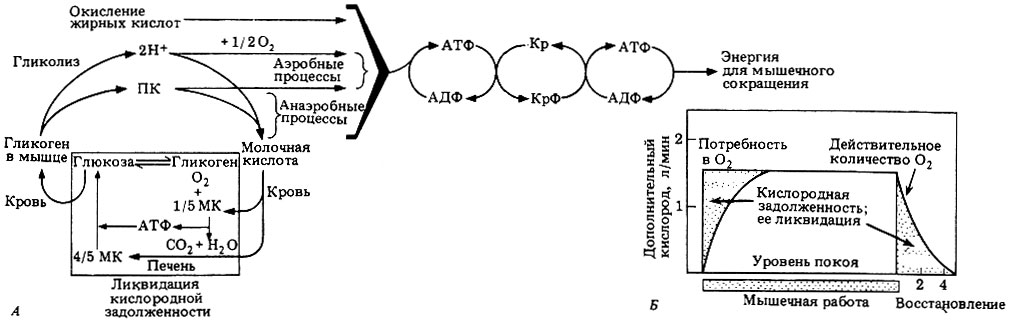
В научной статье «Биохимия метаболического ацидоза, вызванного физическими упражнениями» Роберта Робергса (Robert A. Robergs) указано, что ионы водорода высвобождаются каждый раз, когда АТФ расщепляется до АДФ (аденозиндифосфат) и неорганического фосфата с выделением энергии.
Когда вы работаете со средней интенсивностью, ионы водорода используются митохондриями для окислительного фосфорилирования (восстановления АТФ из АДФ). Когда интенсивность упражнений и потребность организма в энергии возрастает, восстановление АТФ происходит в основном за счёт гликолитической и фосфагенной систем. Это вызывает увеличенное высвобождение протонов и, как следствие, ацидоз.
В таких условиях увеличивается производство лактата для защиты организма от накопления пирувата и поставки NAD+, необходимого для второй фазы гликолиза. Робергс предположил, что лактат помогает справиться с ацидозом, поскольку может переносить ионы водорода из клетки. Таким образом, без увеличенного производства лактата ацидоз и мышечная усталость наступили бы гораздо быстрее.
Робергс предположил, что лактат помогает справиться с ацидозом, поскольку может переносить ионы водорода из клетки. Таким образом, без увеличенного производства лактата ацидоз и мышечная усталость наступили бы гораздо быстрее.
Лактат не виноват в том, что во время интенсивной нагрузки у вас устают мышцы. Усталость вызывает ацидоз — накопление ионов водорода и смещение pH организма в кислую сторону. Лактат, наоборот, помогает справиться с ацидозом.
Чем лактат полезен для здоровья и физической подготовки
Лактат является источником энергии
В 80–90-х годах Джоржд Брукс доказал , что лактат переходит из мышечных клеток в кровь и транспортируется в печень, где восстанавливается до глюкозы в цикле Кори. После этого глюкоза вновь транспортируется по крови в работающие мышцы и может использоваться для производства энергии и запасаться в виде гликогена.
Более того, даже мышцы могут использовать лактат в качестве топлива. В 1999 году Брукс обнаружил , что тренировки на выносливость снижают уровень лактата в крови, даже когда клетки продолжают производить его в том же количестве. В 2000 году он выяснил, что у выносливых атлетов увеличивается количество молекул-переносчиков лактата, которые быстро перемещают лактат из цитоплазмы клетки в митохондрии.
В 1999 году Брукс обнаружил , что тренировки на выносливость снижают уровень лактата в крови, даже когда клетки продолжают производить его в том же количестве. В 2000 году он выяснил, что у выносливых атлетов увеличивается количество молекул-переносчиков лактата, которые быстро перемещают лактат из цитоплазмы клетки в митохондрии.
В дальнейших экспериментах учёные обнаружили внутри митохондрий не только белки-переносчики, но и лактатный энзим дегидрогеназу, которая запускает превращение лактата в энергию.
Учёные сделали вывод, что лактат переносится в митохондрии и сжигается там при участии кислорода для добычи энергии.
Лактат служит источником энергии для мышц. В печени он восстанавливается до глюкозы, которая затем снова используется мышцами или запасается в них в виде гликогена. Кроме того, лактат может сжигаться непосредственно в мышцах для производства энергии.
Лактат увеличивает выносливость
Лактат помогает увеличить потребление кислорода, что тоже положительно влияет на выносливость. Исследование 2006 года показало, что лактат, в отличие от глюкозы, увеличивает количество кислорода, потребляемого митохондриями, что позволяет им выработать больше энергии.
Исследование 2006 года показало, что лактат, в отличие от глюкозы, увеличивает количество кислорода, потребляемого митохондриями, что позволяет им выработать больше энергии.
А в 2014 году выяснилось , что лактат снижает ответ на стресс и увеличивает производство генов, вовлечённых в создание новых митохондрий.
Лактат увеличивает количество потребляемого кислорода, так что ваше тело сможет дольше переносить нагрузки.
Лактат защищает мозг
Лактат предотвращает вызванную L-глутаматом эксайтотоксичность. Это патологическое состояние, при котором из-за чрезмерной активности нейронов повреждаются их митохондрии и мембраны и клетка гибнет. Эксайтотоксичность может стать причиной рассеянного склероза, инсульта, болезни Альцгеймера и других заболеваний, связанных с повреждением нервной ткани.
Исследование 2013 года доказало, что лактат регулирует активность нейронов, защищая мозг от эксайтотоксичности.
Кроме того, лактат обеспечивает мозгу альтернативный источник питания, когда глюкозы не хватает. В том же 2013 году учёные выяснили , что незначительное увеличение циркуляции лактата позволяет мозгу нормально функционировать в условиях гипогликемии.
Более того, исследование 2011 года показало, что глюкозы недостаточно для обеспечения энергии во время интенсивной активности синапсов, а лактат может быть эффективным источником энергии, который поддерживает и усиливает метаболизм мозга.
И, наконец, исследование 2014 года доказало, что лактат увеличивает количество норэпинефрина, нейротрансмиттера, который необходим для снабжения мозга кровью и концентрации внимания.
Лактат защищает мозг от эксайтотоксичности, служит источником энергии и улучшает концентрацию внимания.
Лактат способствует росту мышц
Лактат создаёт хорошие условия для роста мышц. Исследование 2015 года доказало, что добавка из кофеина и лактата увеличивает рост мышц даже во время тренировок низкой интенсивности, активируя стволовые клетки и анаболические сигналы: повышая экспрессию миогенина и фоллистатина.
Ещё 20 лет назад учёные обнаружили , что после введения лактата и физических упражнений (плавания) у самцов мышей увеличивается количество тестостерона в плазме крови. Кроме того, повышается количество лютеинизирующего гормона, который также способствует секреции тестостерона. И это, в свою очередь, положительно сказывается на росте мышц.
Лактат увеличивает секрецию гормонов, необходимых для роста мышц.
Как увеличить количество лактата
- Съешьте за час перед тренировкой что-нибудь богатое углеводами: сладкие фрукты, шоколад, злаки. Помните: лактат образуется при распаде глюкозы.
- Постарайтесь выложиться по полной. Например, попробуйте спринт или высокоинтенсивный интервальный тренинг (ВИИТ). Устраивайте такие тренировки два раза в неделю в дополнение к своим обычным нагрузкам, и постепенно ваше тело приучится вырабатывать больше лактата для увеличения выносливости, роста мышц и защиты мозга.
Молочная кислота в мышцах — что это? Как вывести ее из организма?
Связь молочной кислоты с утомляемостью мышц не так однозначна, как это обычно считается.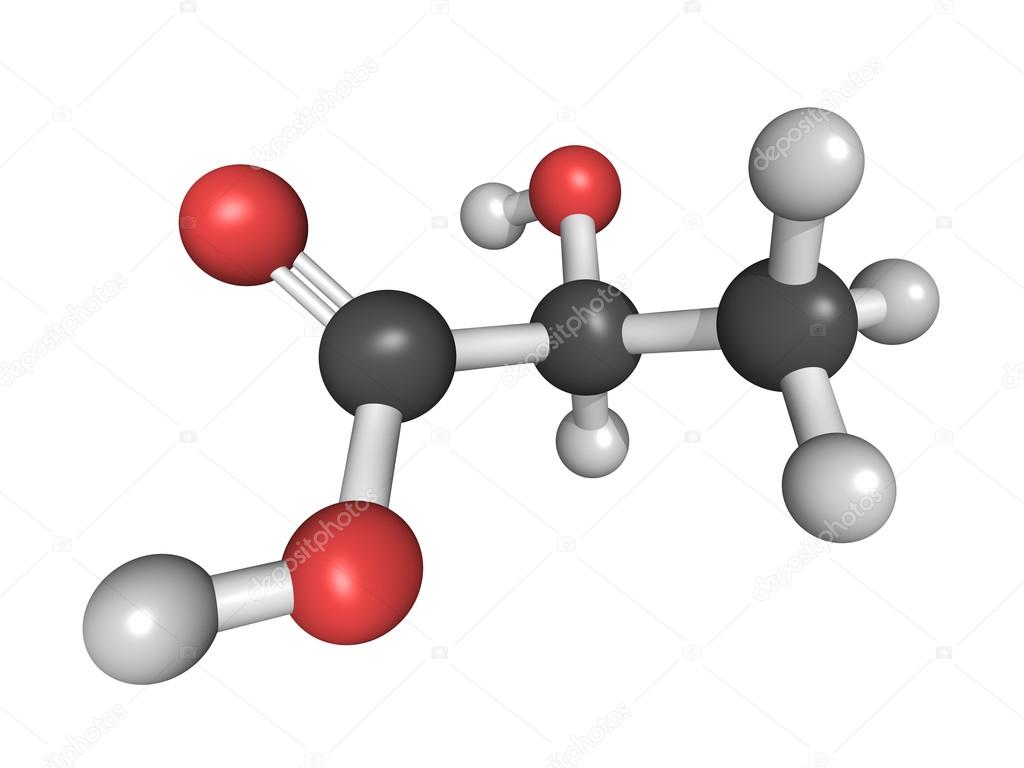 С одной стороны, характерное жжение в мускулах на 2-3 день после тренировки не связано с накоплением молочной кислотой — обычно она выводится из организма за несколько часов.
С одной стороны, характерное жжение в мускулах на 2-3 день после тренировки не связано с накоплением молочной кислотой — обычно она выводится из организма за несколько часов.
С другой стороны, молочная кислота все-таки может стать причиной боли в мышцах непосредственно во время выполнения упражнений — особенно у начинающих атлетов и у женщин. При этом ее роль не всегда отрицательна — в частности, лактат повышает уровень гормона роста.
// Молочная кислота — что это?
Молочная кислота — это продукт распада глюкозы и одно из типичных веществ биохимических реакций организма. Причиной, по которой она образуется в мышцах, является недостаточное количество энергии — около 15-20% от общего количества молочной кислоты превращается в гликоген.
Отметим, что полностью убрать молочную кислоту невозможно — организм вырабатывает ее при любых физических нагрузках. Проблемы в виде болей возникают лишь тогда, когда уровень нагрузок становится чрезмерно высоким — в этом случае тело не успевает перерабатывать побочные продукты метаболизма.
Свое название молочная кислота получила из-за того, что впервые ее выделили именно из прокисшего молока — она образуется при брожении сахаров. С химической точки зрения представляет собой карбоновую кислоту с тремя углерода, а ее соли и эфиры называются лактатом.
Роль в организме человека
Основными видами энергии для мышц являются глюкоза и гликоген — продукты переработки углеводов. Гликоген накапливается в мышечной ткани, а глюкоза свободно циркулирует в крови. Для того, чтобы использовать глюкозу, необходим гормон инсулин — именно он позволяет ей проникать внутрь клеток.
Поскольку молекула молочной кислоты в два раза меньше молекулы глюкозы, она способна проникать внутрь клеток без помощи инсулина — что делает ее источником максимально быстрой энергии. Это особенно важно в случае высокоинтенсивных нагрузок, когда запасы другой энергии подходят к концу.
// Читать дальше:
Почему вызывает боль в мышцах?
Чем интенсивнее тренируется спортсмен, тем больше его организм нуждается в легкодоступной энергии — и тем активнее тело вырабатывает молочную кислоту при переработке углеводов. Однако ее избыточное накопление способно вызывать характерное жжение и легкую боль в мышцах, мешая выполнению упражнений¹.
Однако ее избыточное накопление способно вызывать характерное жжение и легкую боль в мышцах, мешая выполнению упражнений¹.
Порядка 90% молочной кислоты утилизируется в течение часа после окончания тренировки — то есть, она выводится из организма и не может являться причиной боли на следующий день. Несмотря на это, молочная кислота снижает уровень pH в мышцах — что влияет на их биохимию.
Отметим и то, что выше нагрузка и чем ниже уровень физической подготовки человека, тем большее вырабатывается молочной кислоты — но причина кроется не в генетических отличиях, а в способности организма накапливать (и использовать) достаточное количество гликогена.
Связана ли боль с набором массы?
Некоторые атлеты считают, что молочная кислота помогает стимулировать выработку тестостерона — и используют специальную стратегию тренировок для ее повышения. Прежде всего, речь идет о тренировках на пампинг и выполнении упражнений по схеме пирамиды или до отказа.
Частично это верно. Высокий уровень молочной кислоты и низкий pH действительно повышают выработку гормона роста — однако далеко не в том количестве, которое принципиально изменит метаболизм у новичка². Другими словами, данная методика подходит лишь профессионалам.
Высокий уровень молочной кислоты и низкий pH действительно повышают выработку гормона роста — однако далеко не в том количестве, которое принципиально изменит метаболизм у новичка². Другими словами, данная методика подходит лишь профессионалам.
Как убрать молочную кислоту?
Еще раз отметим, что молочная кислота — типичное для организма вещество. Другими словами, ее невозможно полностью убрать — она всегда присутствует в мышцах во время выполнения упражнений. Чувство боли и скованности вызвано вовсе не самим лактатом, а реакцией на чрезмерно интенсивные тренировки.
Отдельную роль играют и запасы гликогена в мышцах — недостаток энергии повышает утомляемость и провоцирует выработку молочной кислоты. При появлении неприятных ощущений рекомендуется прекратить тренировку и дать организму 30-40 секунд на восстановление — это уменьшит болевые ощущения.
// Как вывести молочную кислоту:
- сделайте паузу на 30-40 секунд
- уменьшите интенсивность упражнения
- первые 10-15 мин тренировки посвящайте разминке
- в конце тренировки используйте МФР ролик
Как уменьшить жжение в мышцах?
Если жжение в мышцах появляется после выполнения 5-7 повторов упражнения, то речь идет о повышенной выработке молочной кислоты на фоне недостатка энергии. Чаще всего это говорит о низком количестве углеводов в питании — по сути, а у организма не остается запасов гликогена и глюкозы.
Чаще всего это говорит о низком количестве углеводов в питании — по сути, а у организма не остается запасов гликогена и глюкозы.
Исследования также говорят о том, что механизмы выработки и утилизации молочной кислоты отличаются у профессиональных атлетов и у начинающих³. По сути, чем больше суммарный стаж тренировок, тем быстрее организм человека выводит молочную кислоту.
***
Повышенная утомляемость и жжение в мышцах — типичная проблема начинающих атлетов (и, в особенности женщин). Несмотря на то, что боль действительно может быть вызвана выработкой молочной кислоты, причина чаще всего кроется в недостатке углеводов в питании и чрезмерно высоком уровне нагрузки.
Научные источники:
- Lactic Acidosis and Exercise: What You Need to Know, source
- Lactic Acid Training: Everything You Need To Know, source
- Lactate kinetics at the lactate threshold in trained and untrained men, source
- Exercise-induced muscle pain, soreness, and cramps, source
В продолжение темы
Дата последнего обновления материала — 4 сентября 2020
Уменьшает накопление молочной кислоты & vert; Complete Nutrition, Inc
Во время интенсивных упражнений, таких как спринт или поднятие тяжестей, вашему телу требуется больше энергии, чем обычно, для поддержания работы мышц. В этом случае тело метаболизирует глюкозу, чтобы доставить энергию мышцам.
В этом случае тело метаболизирует глюкозу, чтобы доставить энергию мышцам.
Метаболизируемая глюкоза, называемая пируватом, превращается в лактат. Когда лактат накапливается в больших количествах в крови и мышцах, он создает кислотность, называемую лактоацидозом, которая вызывает мышечную усталость и при высоких уровнях может мешать восстановлению мышц.Накопление молочной кислоты может вызвать чувство жжения, которое может нарушить вашу спортивную активность.
Знать симптомы накопления молочной кислоты
Хотя наиболее частыми симптомами накопления молочной кислоты являются усталость и чувство усталости, есть несколько вредных симптомов, которые могут возникнуть в результате лактоацидоза. Проконсультируйтесь с врачом, если вы испытываете два или более из следующих симптомов:
- Общая слабость
- Пожелтение кожи и / или глаз
- Неглубокое или учащенное дыхание
- Быстрое сердцебиение
- Мышечные судороги
- Боль и дискомфорт в животе
- Головные боли
- Проблемы с аппетитом
- Диарея, тошнота и / или рвота
Не стоит беспокоиться о нормальной усталости, поскольку она проходит сама по себе. Чтобы избавиться от усталости, нужен просто хороший сон или несколько часов отдыха. Однако слишком много молочной кислоты может вызвать лактоацидоз, о котором необходимо позаботиться.
Чтобы избавиться от усталости, нужен просто хороший сон или несколько часов отдыха. Однако слишком много молочной кислоты может вызвать лактоацидоз, о котором необходимо позаботиться.
Какое решение проблемы накопления молочной кислоты?
Есть решение практически для всего, и с накоплением молочной кислоты тоже легко справиться. Вот несколько мер предосторожности, которые помогут уменьшить накопление молочной кислоты.
Шаг 1 — Пейте больше и больше воды!Пейте воду или напиток с заменой электролитов, который может сыграть жизненно важную роль в предотвращении накопления водорастворимой молочной кислоты.Не ждите, пока почувствуете жажду. К тому времени вы, вероятно, уже обезвожены. Американский совет по физическим упражнениям рекомендует употреблять от 16 до 20 унций воды за два-три часа до тренировки, а затем от 7 до 10 дополнительных унций воды на каждые 20-30 минут тренировки.
- Выпивайте не менее 12 стаканов воды в день, если хотите вести здоровый образ жизни.

- Глубоко дышите во время тренировки и попробуйте вдохнуть через нос и выдохнуть через рот.
Ключом к здоровым и полезным упражнениям является постоянная активность. Если вы хотите быть в хорошей физической форме, вам нужно часто заниматься спортом. Это сделает ваше тело приспособленным к дополнительной выработке энергии, и вам потребуется меньше глюкозы для сжигания энергии, что в конечном итоге означает меньшее накопление молочной кислоты.
- Согласно WebMD, физически здоровый человек имеет более высокий порог лактата, показатель состояния кровеносных сосудов и сердца.
- Тренироваться несколько раз в неделю обязательно, но дать мышцам отдых на день или два творит чудеса.
Хотя это правда, что поддержание мотивации к ежедневным тренировкам — это ключ к здоровому образу жизни, но чрезмерная нагрузка на мышцы может привести к негативным результатам. Чрезмерные тренировки каждый день без какого-либо распорядка или цикла могут вызвать сильную болезненность мышц.
Чрезмерные тренировки каждый день без какого-либо распорядка или цикла могут вызвать сильную болезненность мышц.
- Обязательно продолжайте бросать вызов, но не увеличивайте интенсивность слишком быстро или сразу.
- Постепенно увеличивайте вес, количество повторов, минут или миль в течение заданного периода времени, чтобы поддерживать здоровый уровень молочной кислоты.
Несмотря на то, что мы делаем упор на постоянных тренировках и поддержании достаточной мотивации для достижения желаемых результатов, вы должны знать, когда следует отступить. Когда вы почувствуете, что мышцы горят или вам трудно дышать, замедляйте движение, пока не отдышитесь, чтобы ваше тело могло доставить больше кислорода к мышцам.Более того, чередуйте периоды активности с периодами активного и неактивного отдыха по мере необходимости.
- Будьте предельно осторожны при поднятии тяжестей, так как это упражнение вызывает накопление большего количества молочной кислоты.

- Постепенно увеличивайте продолжительность тренировки с тяжелой атлетикой, учитывая веса и количество повторений.
Сделайте растяжку сразу после тренировки. Растяжка после тренировки способствует высвобождению молочной кислоты и дает немедленное облегчение вашим мышцам, предотвращая накопление молочной кислоты и болезненность мышц.
- Для растворения молочной кислоты после тренировки может потребоваться от 30 минут до часа, поэтому не забудьте правильно остыть и сразу после этого потянуться.
- Различные эксперты по спортивной медицине, такие как доктор Герберт Хаупт, даже рекомендуют выполнять растяжку после длительной тренировки, чтобы уменьшить накопление молочной кислоты.
Использование валика из поролона на ваших мышцах расслабляет напряженные мышцы и снижает накопление молочной кислоты, поскольку это действие стимулирует кровоток и способствует лимфатическому дренажу.
- Вы также можете массировать мышцы роликом из поролона перед интенсивной тренировкой.
- Для облегчения и расслабления можно регулярно прикладывать к мышцам валик из поролона.
Помимо вышеперечисленных шагов, включение определенных продуктов в ваш ежедневный рацион может помочь контролировать накопление молочной кислоты и избежать лактоацидоза. По мнению экспертов, рекомендуются продукты и овощи с магнием, жирными кислотами и витамином B.
- Продукты, богатые витамином B, — это листовые зеленые овощи, злаки, горох и фасоль, рыба, говядина, птица, яйца и молочные продукты.
- Овощи, такие как шпинат, зелень капусты, зелень репы, морская фасоль, фасоль и семена, такие как тыква, кунжут и семена подсолнечника, являются отличными источниками магния.
Заключение:
Нелегко избежать накопления молочной кислоты при интенсивных тренировках, но вы, несомненно, можете уменьшить его, чтобы минимизировать связанные с этим последствия и риски. Приятных занятий!
научных фактов или научной фантастики? Накопление молочной кислоты вызывает мышечную усталость и болезненность
Каждому, кто прошел интенсивную тренировку, знакомо «ощущение жжения» — это ощущение усталости и боли, которое возникает, когда вы повторно подвергаете свои мышцы подъему тяжелых грузов или бегу на короткие дистанции. все вон.
Это ощущение жжения связано с накоплением кислоты в мышцах во время интенсивных упражнений, и долгое время считалось, что молочная кислота является виновником этого накопления кислоты, известного как ацидоз.Молочная кислота — это побочный продукт анаэробного метаболизма, при котором организм вырабатывает энергию без использования кислорода.
С момента открытия молочной кислоты популярно мнение, что она ответственна за мышечную усталость, а также за повреждение тканей, вызванное молочной кислотой после интенсивной тренировки. Фактически, это было общепринятым объяснением даже в научном сообществе до 1970-х годов.
Но что наука говорит о том, действительно ли молочная кислота является виновником мышечной усталости и так называемой отсроченной мышечной болезненности?
Что происходит во время анаэробных упражнений?
Когда организм подключается к анаэробному метаболизму, он использует запасы сахара, известные как гликоген, без потребности в кислороде.Одним из побочных продуктов сжигания гликогена — процесса, известного как гликолиз, — является молочная кислота.
Немецкий врач Отто Мейерхоф показал, используя лягушачьи лапки в герметичном сосуде, что молочная кислота образуется из мышечного гликогена в отсутствие кислорода. Это исследование в конечном итоге привело к тому, что он вместе с другим пионером в этой области, британским физиологом Арчибальдом Хиллом, получил Нобелевскую премию по физиологии и медицине в 1922 году. кислоты в мышцах, и что они перестали сокращаться после многократных стимуляций — что привело к теории, что молочная кислота ответственна за мышечную усталость. Но более современные исследования показали, что их выводы применимы к отслоившейся мышце земноводных, но не к живым млекопитающим, включая человека.
Но более современные исследования показали, что их выводы применимы к отслоившейся мышце земноводных, но не к живым млекопитающим, включая человека.
Молочная кислота как топливо для мышц
Исследования также установили, что молочная кислота, также известная как лактат, на самом деле является важным источником топлива для мышц и что накопление лактата не препятствует способности скелетных мышц сокращаться.
Более того, представление о том, что молочная кислота ответственна за отсроченное начало болезненности мышц, или DOMS, было опровергнуто в 1980-х годах.Исследования показывают, что болезненность является результатом каскада физиологических эффектов в ответ на микроскопическую травму, полученную во время интенсивных упражнений. Этот каскад включает воспаление мышц в ответ на микротравму.
Как и во многих других областях науки, исследования молочной кислоты и ее связи с мышечной усталостью развивались за последнее столетие. И это указывает на то, что молочная кислота не является виновником мышечной усталости, как когда-то считалось.
Как молочная кислота влияет на ваши спортивные результаты
Среди спортсменов и любителей спорта существует неправильное представление о молочной кислоте.Тем не менее, в последние годы было проведено множество исследований о молочной кислоте, которые развенчивают многие мифы о том, что лактат ухудшает работоспособность. Фактически, теперь считается, что молочная кислота является еще одним источником топлива для работающих мышц.
Что такое молочная кислота?
Молочная кислота образуется из глюкозы и используется работающими мышцами для получения энергии. Сейчас считается, что мышечные клетки превращают глюкозу или гликоген в молочную кислоту, которая поглощается митохондриями в мышечных клетках и превращается в топливо.
Молочная кислота — новое топливо для мышц
Молочная кислота по-прежнему может быть причиной жжения во время интенсивных упражнений, но новое исследование подтвердило, что отсроченная болезненность мышц возникает из-за микроскопических разрывов и травм в результате физического напряжения. Молочная кислота всегда рассматривалась как побочный продукт метаболизма глюкозы. для энергии и отходов жизнедеятельности, вызывающих ощущение жжения в мышцах.
Молочная кислота всегда рассматривалась как побочный продукт метаболизма глюкозы. для энергии и отходов жизнедеятельности, вызывающих ощущение жжения в мышцах.
Однако исследования показывают, что накопление лактата может помочь облегчить ожог или мышечные судороги, возникающие во время высокоинтенсивной физической активности.Взаимодействие с другими людьми
Тренировка лактатного порога и максимальная производительность
Считается, что при тренировках с высокой интенсивностью (тренировка с порогом лактата) организм вырабатывает дополнительные белки, которые помогают поглощать и преобразовывать молочную кислоту в энергию. В состоянии покоя и при упражнениях с низкой интенсивностью происходит равномерное производство молочной кислоты и удаление лактата из крови.
По мере того, как интенсивность упражнений увеличивается, дисбаланс вызывает повышение уровня лактата в крови, что и приводит к достижению порога лактата.При этом пороге лактата кровоток снижается, а двигательная способность быстро сокращается.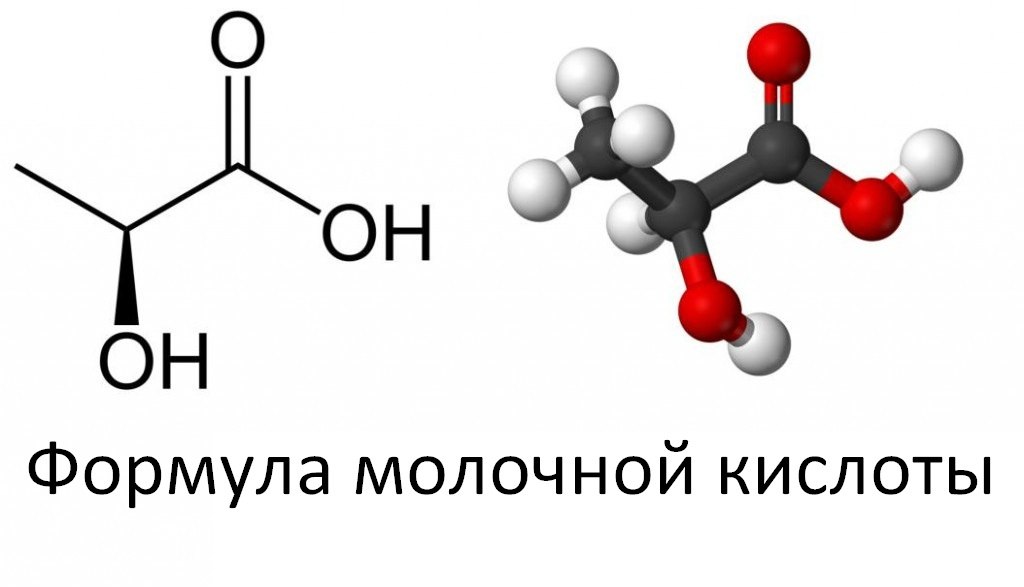 Этот пиковый уровень производительности называется тренировкой по лактатному порогу.
Этот пиковый уровень производительности называется тренировкой по лактатному порогу.
Аэробные и анаэробные тренировки
Ваш лактатный порог знаменует переход от аэробной тренировки к анаэробной тренировке. Обращаясь к вашей тренировочной зоне, тренеры предлагают, чтобы для повышения выносливости и эффективности вы должны тренироваться в анаэробной зоне, то есть за пределами лактатного порога.
Тренер сборной США по бегу Деннис Баркер объясняет, что аэробные тренировки не улучшают работоспособность, потому что в этом состоянии ваше тело получает достаточно кислорода для удовлетворения потребностей упражнения. Однако во время анаэробных упражнений ваше тело не получает достаточно кислорода.
Достижение этого порога помогает вашему организму стать более эффективным, тренируясь на уровне лактатного порога или чуть ниже него, поэтому анаэробные тренировки необходимы для улучшения ваших спортивных результатов.
Частота пульса, лактатный порог и пиковая производительность
У всех максимальная частота пульса.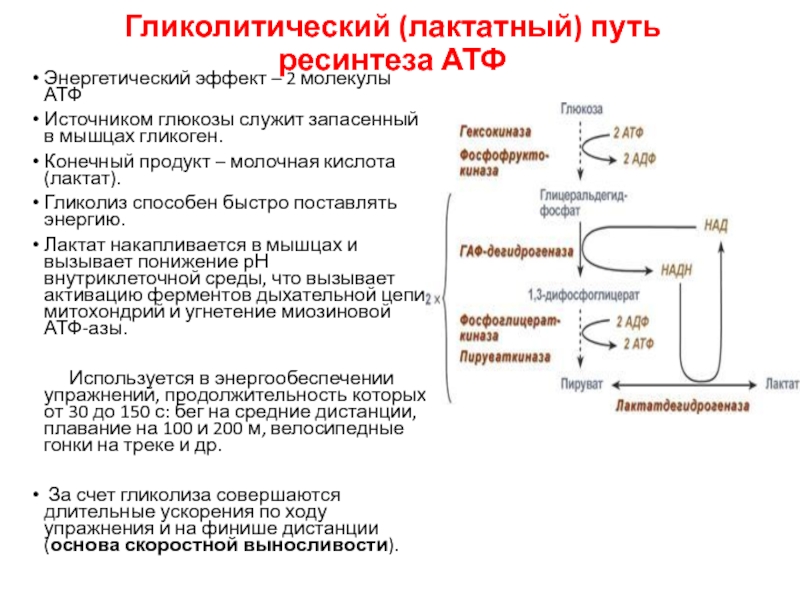 Если это 205 ударов в минуту, то ваш лактатный порог будет всего около 185 ударов в минуту. Это сделает вашу зону аэробной тренировки между 125 и 185 ударами в минуту.
Если это 205 ударов в минуту, то ваш лактатный порог будет всего около 185 ударов в минуту. Это сделает вашу зону аэробной тренировки между 125 и 185 ударами в минуту.
Чтобы поддерживать аэробную форму, вы должны работать в той зоне, в которой вы сможете комфортно разговаривать. Однако, чтобы улучшить свои аэробные тренировки, вам придется тренироваться на уровне или почти на уровне лактатного порога.
В конце концов, молочная кислота (или толчок к вашему порогу лактата) — действительно хорошая вещь, которая может улучшить ваши спортивные результаты, если вы будете стремиться к своему пику.
Настройка окисления жирных кислот в скелетных мышцах с помощью пищевых жиров и физических упражнений
Батталья, Дж. М., Чжэн, Д., Хикнер, Р. К. и Хумард, Дж. А. Влияние физических упражнений на метаболическую гибкость в ответ на диету с высоким содержанием жиров тучные люди. Am. J. Physiol. Эндокринол. Метаб. 303 , E1440 – E1445 (2012). Это исследование показывает, что люди с ожирением не гибки в адаптации липидного метаболизма к диете с высоким содержанием жиров, но физические упражнения могут вызвать улучшение липидного обмена у людей с ожирением .
CAS Google ученый
Lundsgaard, A. M. et al. Механизмы сохранения действия инсулина при повышенном потреблении жиров с пищей. Cell Metab. 29 , 229 (2019). Статья, показывающая, что 6 недель эукалорийной диеты с высоким содержанием жиров у молодых мужчин сохраняют чувствительность к инсулину и вызывают липидную метаболическую адаптацию .
CAS Google ученый

Chokkalingam, K. et al. Диета с высоким содержанием жиров и низким содержанием углеводов снижает стимулированное инсулином окисление углеводов, но стимулирует неокислительное удаление глюкозы у людей: важная роль киназы пируватдегидрогеназы 4 скелетных мышц. J. Clin. Эндокринол. Метаб. 92 , 284–292 (2007).
CAS Google ученый
Thomas, C. D. et al. Баланс питательных веществ и расход энергии при неограниченном кормлении людей с высоким содержанием жиров и углеводов. Am. J. Clin. Nutr. 55 , 934–942 (1992). Исследования, демонстрирующие, что потребление диеты с высоким содержанием жиров увеличивает окисление жирных кислот у худых людей, но не у людей с ожирением .
CAS Google ученый
Blaak, E. E. et al. Окисление жиров до и после высокой жировой нагрузки при ожирении в инсулинорезистентном состоянии. J. Clin. Эндокринол. Метаб. 91 , 1462–1469 (2006).
CAS Google ученый
Allick, G. et al. Низкоуглеводная / высокожировая диета улучшает глюкорегуляцию при сахарном диабете 2 типа за счет снижения постабсорбтивного гликогенолиза. J. Clin. Эндокринол. Метаб. 89 , 6193–6197 (2004).
CAS Google ученый
Кинс, Б., Эссен-Густавссон, Б., Кристенсен, Н. Дж. И Салтин, Б.Использование субстрата скелетных мышц во время субмаксимальных упражнений у человека: эффект тренировки на выносливость. J. Physiol. 469 , 459–478 (1993). Исследование, показывающее, что физические упражнения улучшают способность человека окислять жирные кислоты во время упражнений .
469 , 459–478 (1993). Исследование, показывающее, что физические упражнения улучшают способность человека окислять жирные кислоты во время упражнений .
CAS Google ученый
Кристенсен, Э. Х. и Хансен, О. В. Респираторный коэффициент и O 2 -aufnahme [немецкий]. Skand.Arch. Physiol. 81 , 160–171 (1939).
Google ученый
Blaak, E. E. Основные нарушения метаболизма жирных кислот в скелетных мышцах при ожирении и сахарном диабете 2 типа. Proc. Nutr. Soc. 63 , 323–330 (2004).
CAS Google ученый
Келли Д. Э., Гудпастер Б., Винг Р. Р. и Симоно Дж. А.Метаболизм жирных кислот в скелетных мышцах в связи с инсулинорезистентностью, ожирением и потерей веса. Am. J. Physiol. 277 , E1130 – E1141 (1999).
CAS Google ученый
Лителл, Х., Якобс, И., Вессби, Б., Хеллсинг, К. и Карлссон, Дж. Снижение активности липопротеинлипазы в скелетных мышцах человека во время кратковременного режима питания, богатого углеводами . Особое внимание уделяется концентрациям холестерина ЛПВП, аполипопротеинов и инсулина. Метаболизм 31 , 994–998 (1982).
CAS Google ученый
Киенс, Б., Эссен-Густавссон, Б., Гад, П. и Лителл, Х. Активность липопротеинлипазы и внутримышечные запасы триглицеридов после длительных диет с высоким содержанием жиров и углеводов у физически тренированных мужчин . Clin. Physiol. 7 , 1–9 (1987).
Clin. Physiol. 7 , 1–9 (1987).
CAS Google ученый
Kiens, B. et al. Липидсвязывающие белки и активность липопротеинлипаз в скелетных мышцах человека: влияние физической активности и пола. J. Appl. Physiol. 97 , 1209–1218 (2004).
CAS Google ученый
Никкила, Э. А., Таскинен, М. Р., Рехунен, С. и Харконен, М. Активность липопротеинлипазы в жировой ткани и скелетных мышцах бегунов: отношение к липопротеинам сыворотки. Метаболизм 27 , 1661–1667 (1978).
CAS Google ученый

Svedenhag, J., Lithell, H., Juhlin-Dannfelt, A. & Henriksson, J. Увеличение липопротеидной липазы в скелетных мышцах после тренировки на выносливость у человека. Атеросклероз 49 , 203–207 (1983).
CAS Google ученый
Кинс, Б. и Лителл, Х. Метаболизм липопротеинов под влиянием вызванных тренировкой изменений в скелетных мышцах человека. J. Clin. Вкладывать деньги. 83 , 558–564 (1989).
CAS Google ученый
Chabowski, A., Garski, J., Luiken, J. J., Glatz, J. F. и Bonen, A. Доказательства согласованного действия FAT / CD36 и FABPpm для увеличения транспорта жирных кислот через плазматическую мембрану. Prostaglandins Leukot. Ессент. Жирные кислоты 77 , 345–353 (2007).
CAS Google ученый
Джорди, А. Б. и др. Чувствительность к инсулину не зависит от движения липид-связывающих белков на плазматической мембране скелетных мышц человека: эффект трехдневной диеты с высоким содержанием жиров. Am. J. Physiol. Regul. Интегр. Комп. Physiol. 307 , R1136 – R1145 (2014).
CAS Google ученый
Cameron-Smith, D. et al. Кратковременная диета с высоким содержанием жиров активирует липидный обмен и экспрессию генов в скелетных мышцах человека. Am. J. Clin. Nutr. 77 , 313–318 (2003).
CAS Google ученый
Tunstall, R.J. et al. Физические упражнения увеличивают экспрессию генов липидного обмена в скелетных мышцах человека. Am. J. Physiol. Эндокринол. Метаб. 283 , E66 – E72 (2002).
CAS Google ученый
Talanian, J. L. et al. Физические упражнения увеличивают сарколемму и митохондриальные транспортные белки жирных кислот в скелетных мышцах человека. Am. J. Physiol. Эндокринол. Метаб. 299 , E180 – E188 (2010). Эта статья показывает, что тренировки увеличивают переносчики липидов в сарколемме скелетных мышц человека .
CAS Google ученый
Perry, C.G., Heigenhauser, G.J., Bonen, A. & Spriet, L.L. Высокоинтенсивные интервальные аэробные тренировки повышают метаболизм жиров и углеводов в скелетных мышцах человека.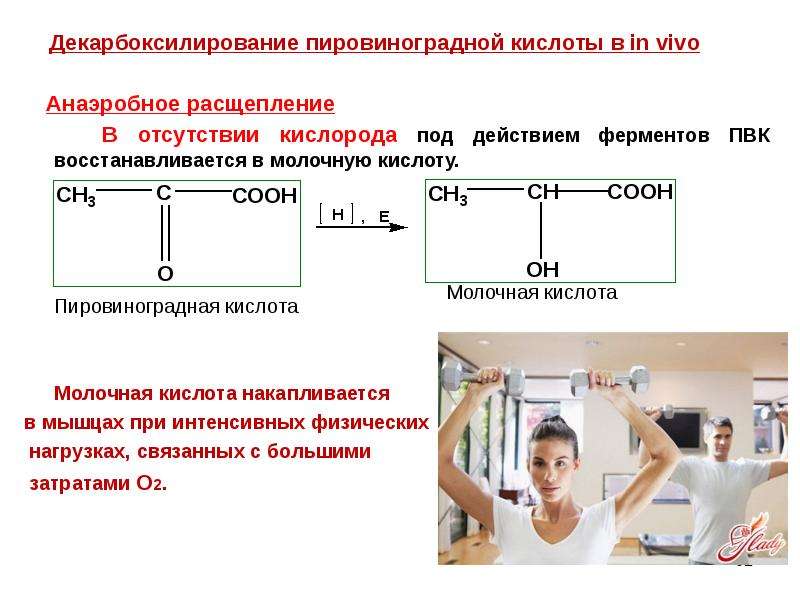 Заявл. Physiol. Nutr. Метаб. 33 , 1112–1123 (2008).
Заявл. Physiol. Nutr. Метаб. 33 , 1112–1123 (2008).
CAS Google ученый
Wolfrum, C. Цитоплазматический белок, связывающий жирные кислоты, воспринимающий жирные кислоты для активации рецептора, активируемого пролифератором пероксисом. Cell Mol. Life Sci. 64 , 2465–2476 (2007).
CAS Google ученый
Киенс, Б., Кристиансен, С., Jensen, P., Richter, E. A. & Turcotte, L. P. Мембранно-ассоциированный белок, связывающий жирные кислоты (FABPpm) в скелетных мышцах человека увеличивается при тренировках на выносливость. Biochem. Биофиз. Res. Commun. 231 , 463–465 (1997).
CAS Google ученый
Jeppesen, J. et al. Повышенное окисление жирных кислот и экспрессия белка FATP4 после тренировки на выносливость в скелетных мышцах человека. PLoS ONE 7 , e29391 (2012).
CAS Google ученый
Таланян, Дж. Л., Галлоуэй, С. Д., Хейгенхаузер, Г. Дж., Бонен, А. и Спрайт, Л. Л. Две недели высокоинтенсивных интервальных аэробных тренировок повышают способность женщин к окислению жиров во время упражнений. J. Appl. Physiol. 102 , 1439–1447 (2007).
CAS Google ученый
Simoneau, J. A., Veerkamp, J.H., Turcotte, L.P. & Kelley, D.E. Маркеры способности использовать жирные кислоты в скелетных мышцах человека: связь с инсулинорезистентностью и ожирением, а также эффекты потери веса.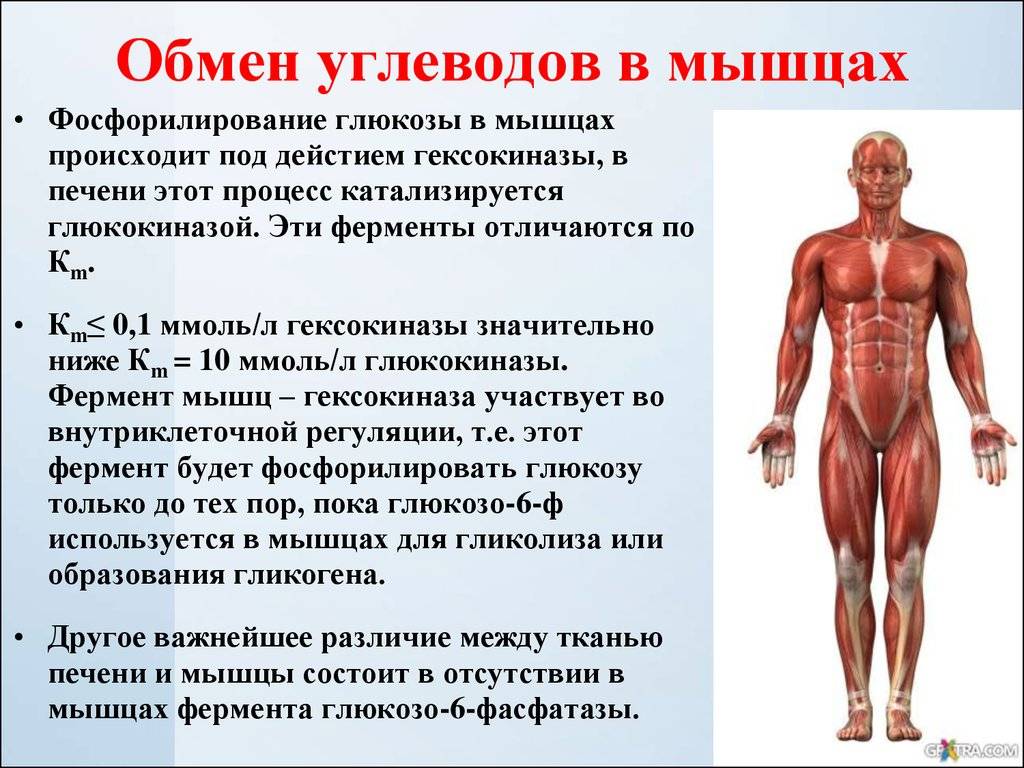 FASEB J. 13 , 2051–2060 (1999).
FASEB J. 13 , 2051–2060 (1999).
CAS Google ученый
Roepstorff, C., Helge, J. W., Vistisen, B. & Kiens, B. Исследования белков, связывающих жирные кислоты плазматической мембраны, и других липид-связывающих белков в скелетных мышцах человека. Proc. Nutr. Soc. 63 , 239–244 (2004).
CAS Google ученый
Казанцис, М. и Шталь, А. Транспортные белки жирных кислот, значение для физиологии и болезней. Biochim. Биофиз. Acta 1821 , 852–857 (2012).
CAS Google ученый
Lefai, E. et al. У мужчин, ведущих сидячий образ жизни с избыточной массой тела, тренировки улучшают жировой обмен независимо от общих затрат энергии, но не восстанавливают фенотип постного метаболизма. Внутр. J. Obes. 41 , 1728–1736 (2017).
et al. У мужчин, ведущих сидячий образ жизни с избыточной массой тела, тренировки улучшают жировой обмен независимо от общих затрат энергии, но не восстанавливают фенотип постного метаболизма. Внутр. J. Obes. 41 , 1728–1736 (2017).
CAS Google ученый
Goedecke, J.H. et al. Метаболическая адаптация к диете с высоким содержанием жиров у велосипедистов на выносливость. Метаболизм 48 , 1509–1517 (1999).
CAS Google ученый
Fisher E. C., et al. in Biochemistry of Exercise (eds Knuttgen, H.Г., Фогель, Дж. А. и Портманс, Дж.) 497–501 (Human Kinetics, 1983).
Jong-Yeon, K., Hickner, R. C., Dohm, G. L. & Houmard, J. A. Окисление длинноцепочечных и среднецепочечных жирных кислот увеличивается в скелетных мышцах человека, тренируемых с помощью физических упражнений. Метаболизм 51 , 460–464 (2002).
Google ученый
Бертон, П. М., Хоулетт, Р. А., Хейгенхаузер, Г. Дж. И Спрайт, Л. Л. Активность карнитин-пальмитоилтрансферазы I в скелетных мышцах человека, определенная в изолированных интактных митохондриях. J. Appl. Physiol. 85 , 148–153 (1998).
CAS Google ученый
Starritt, E.C., Howlett, R.A., Heigenhauser, G.J. и Spriet, L.L. Чувствительность CPT I к малонил-КоА в тренированных и нетренированных скелетных мышцах человека. Am. J. Physiol. Эндокринол. Метаб. 278 , E462 – E468 (2000).
Am. J. Physiol. Эндокринол. Метаб. 278 , E462 – E468 (2000).
CAS Google ученый
Брюс, К. Р. и др. Тренировки на выносливость у людей с ожирением улучшают толерантность к глюкозе и окисление митохондриальных жирных кислот, а также изменяют содержание липидов в мышцах. Am. J. Physiol. Эндокринол. Метаб. 291 , E99 – E107 (2006).
CAS Google ученый
Lundsgaard, A. M. et al. Противоположное регулирование чувствительности к инсулину с помощью пищевых липидов по сравнению с избытком углеводов. Диабет 66 , 2583–2595 (2017).
CAS Google ученый
Спаркс, Л. М. и др. Диеты с высоким содержанием жиров и низким содержанием углеводов регулируют метаболизм глюкозы через долгосрочную петлю транскрипции. Метаболизм 55 , 1457–1463 (2006).
CAS Google ученый
Аркинстолл, М. Дж., Танстолл, Р. Дж., Камерон-Смит, Д. и Хоули, Дж. А. Регулирование метаболических генов в скелетных мышцах человека с помощью краткосрочных упражнений и манипуляций с диетой. Am. J. Physiol. Эндокринол. Метаб. 287 , E25 – E31 (2004).
CAS Google ученый
Bergouignan, A. et al. Увеличение количества пищевых жиров вызывает аналогичные изменения в окислении жиров и маркеров окислительной способности мышц у худых и страдающих ожирением людей.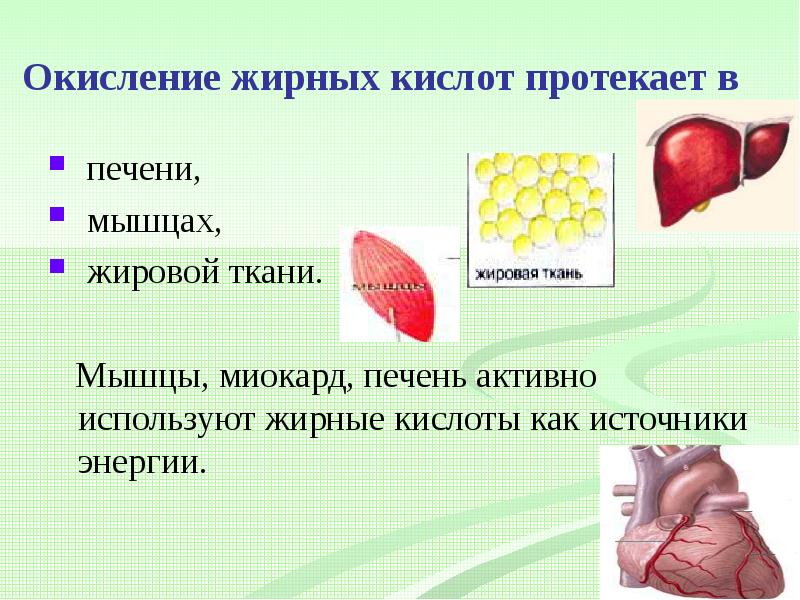 PLoS ONE 7 , e30164 (2012).
PLoS ONE 7 , e30164 (2012).
CAS Google ученый
Бойл К.E. et al. Диета с высоким содержанием жиров вызывает разные реакции генов, координирующих окислительный метаболизм в скелетных мышцах худых и страдающих ожирением людей. J. Clin. Эндокринол. Метаб. 96 , 775–781 (2011). В этой статье показано, что диета с высоким содержанием жиров увеличивает экспрессию липидных метаболических генов у худых людей, но не у людей с ожирением .
CAS Google ученый
Peters, S.J. et al. Активность киназы ПДГ в скелетных мышцах человека и экспрессия изоформ во время 3-дневной диеты с высоким содержанием жиров / низким содержанием углеводов. Am. J. Physiol. Эндокринол. Метаб. 281 , E1151 – E1158 (2001).
Physiol. Эндокринол. Метаб. 281 , E1151 – E1158 (2001).
CAS Google ученый
Pehleman, T. L., Peters, S. J., Heigenhauser, G. J. & Spriet, L. L. Ферментативная регуляция утилизации глюкозы в скелетных мышцах человека после диеты с высоким содержанием жиров и низким содержанием углеводов. Дж.Appl. Physiol. 98 , 100–107 (2005).
CAS Google ученый
Петерс, С. Дж., Сент-Аманд, Т. А., Хоулетт, Р. А., Хейгенхаузер, Г. Дж. И Спрайт, Л. Л. Активность киназы пируватдегидрогеназы скелетных мышц человека увеличивается после низкоуглеводной диеты. Am. J. Physiol. 275 , E980 – E986 (1998).
CAS Google ученый
Turvey, E.A., Heigenhauser, G.J., Parolin, M. & Peters, S.J. Повышенное содержание жирных кислот n-3 в рационе с высоким содержанием жиров ослабляет повышение активности киназы PDH, но не активности PDH в скелетных мышцах человека. J. Appl. Physiol. 98 , 350–355 (2005).
CAS Google ученый
St Amand, T. A., Spriet, L. L., Jones, N. L. & Heigenhauser, G. J. Пируват отменяет ингибирование PDH во время упражнений после низкоуглеводной диеты. Am. J. Physiol. Эндокринол. Метаб. 279 , E275 – E283 (2000).
Google ученый
Stellingwerff, T. et al. Снижение активации ПДГ и гликогенолиза во время упражнений после жировой адаптации с восстановлением углеводов. Am. J. Physiol. Эндокринол. Метаб. 290 , E380 – E388 (2006).
Am. J. Physiol. Эндокринол. Метаб. 290 , E380 – E388 (2006).
CAS Google ученый
Helge, J. W. et al. Четырехнедельные тренировки на одной ноге и диета с высоким содержанием жиров не изменяют экспрессию белка PPARalpha или мРНК в скелетных мышцах человека. Eur. J. Appl. Physiol. 101 , 105–114 (2007).
CAS Google ученый
ЛеБлан, П. Дж., Петерс, С. Дж., Танстолл, Р. Дж., Камерон-Смит, Д. и Хейгенхаузер, Г. Дж. Влияние аэробных тренировок на пируватдегидрогеназу и пируватдегидрогеназу киназу в скелетных мышцах человека. J. Physiol. 557 , 559–570 (2004).
CAS Google ученый
Gudiksen, A. et al. Состояние тренировки и регуляция ПДГ натощак в скелетных мышцах человека. Pflugers Arch. 470 , 1633–1645 (2018).
CAS Google ученый
Anderson, A. S. et al. Ранняя адаптация скелетных мышц к краткосрочной диете с высоким содержанием жиров до изменения чувствительности к инсулину. Ожирение 23 , 720–724 (2015).
CAS Google ученый
Skovbro, M., Boushel, R., Hansen, C. N., Helge, J. W. & Dela, F. Питание с высоким содержанием жиров подавляет вызванное физической нагрузкой увеличение митохондриального дыхательного потока в скелетных мышцах. J. Appl. Physiol. 110 , 1607–1614 (2011).
CAS Google ученый
Helge, J. W. & Kiens, B. Активность мышечных ферментов у людей: роль доступности субстрата и обучение. Am. J. Physiol. 272 , R1620 – R1624 (1997).
CAS Google ученый
Alsted, T. J. et al. Липаза триглицеридов жировой ткани в скелетных мышцах человека активируется тренировками. Am. J. Physiol. Эндокринол. Метаб. 296 , E445 – E453 (2009).
CAS Google ученый
Daugaard, J. R. et al. Специфическая для типа волокна экспрессия GLUT4 в скелетных мышцах человека: влияние тренировок. Диабет 49 , 1092–1095 (2000).
Диабет 49 , 1092–1095 (2000).
CAS Google ученый
Kristiansen, S., Gade, J., Wojtaszewski, J. F., Kiens, B. & Richter, E. A. Поглощение глюкозы в тренированных мышцах по сравнению с нетренированными мышцами увеличивается во время тяжелых упражнений. J. Appl. Physiol. 89 , 1151–1158 (2000).
CAS Google ученый
Burgomaster, K. A. et al. Аналогичная метаболическая адаптация во время упражнений после интервала спринта небольшого объема и традиционных тренировок на выносливость у людей. J. Physiol. 586 , 151–160 (2008).
CAS Google ученый
Leckey, J. J. et al. Высокое потребление жиров с пищей увеличивает окисление жиров и снижает митохондриальное дыхание скелетных мышц у тренированных людей. FASEB J. 32 , 2979–2991 (2018).
CAS Google ученый
Вигелсо, А., Андерсен, Н. Б. и Дела, Ф. Взаимосвязь между активностью митохондриальной цитрат-синтазы скелетных мышц и адаптациями поглощения кислорода всем телом в ответ на тренировку с физической нагрузкой. Внутр. J. Physiol. Патофизиол. Pharmacol. 6 , 84–101 (2014).
Google ученый
Fritzen, A. M. et al. Адаптация митохондриальной ферментативной активности происходит независимо от геномной дозировки в ответ на аэробные упражнения и разрушение скелетных мышц человека. Ячейки 8 , 237 (2019).
Ячейки 8 , 237 (2019).
CAS Google ученый
Fiorenza, M. et al. Высокоинтенсивные упражнения повышают эффективность митохондриального окислительного фосфорилирования в зависимости от температуры в скелетных мышцах человека: последствия для выполнения упражнений. FASEB J. 33 , 8976–8989 (2019).
CAS Google ученый
Pesta, D. et al. Сходные качественные и количественные изменения митохондриального дыхания после тренировок на силу и выносливость при нормоксии и гипоксии у людей, ведущих малоподвижный образ жизни. Am. J. Physiol. Regul. Интегр. Комп. Physiol. 301 , R1078 – R1087 (2011).
CAS Google ученый
Hancock, C.R. et al. Диеты с высоким содержанием жиров вызывают резистентность к инсулину, несмотря на увеличение митохондрий в мышцах. Proc. Natl Acad. Sci. США 105 , 7815–7820 (2008).
CAS Google ученый
Turner, N. et al. Избыточная доступность липидов увеличивает окислительную способность митохондриальных жирных кислот в мышцах: доказательства против роли пониженного окисления жирных кислот в индуцированной липидами резистентности к инсулину у грызунов. Диабет 56 , 2085–2092 (2007).
CAS Google ученый
Сими, Б., Семпоре, Б., Майет, М. Х. и Фавье, Р. Дж. Аддитивное влияние тренировок и диеты с высоким содержанием жиров на энергетический обмен во время упражнений. J. Appl. Physiol. 71 , 197–203 (1991).
J. Appl. Physiol. 71 , 197–203 (1991).
CAS Google ученый
van den Broek, N. M. et al.Повышенное содержание митохондрий восстанавливает окислительную способность мышц in vivo у крыс, которые длительное время получали пищу с высоким содержанием жиров. FASEB J. 24 , 1354–1364 (2010).
Google ученый
Kleinert, M. et al. Количественная протеомная характеристика клеточных путей, связанных с изменением чувствительности к инсулину в скелетных мышцах после кормления с высоким содержанием жиров и физических упражнений. Sci. Отчет 8 , 10723–28540 (2018). Этот протеомный анализ показывает, что диета с высоким содержанием жиров и физические упражнения вызывают несколько аналогичных липидных метаболических адаптаций в скелетных мышцах мышей .
Google ученый
Берггрен, Дж. Р., Бойл, К. Э., Чепмен, В. Х. и Хумард, Дж. А. Окисление липидов скелетных мышц и ожирение: влияние потери веса и физических упражнений. Am. J. Physiol. Эндокринол. Метаб. 294 , E726 – E732 (2008).
CAS Google ученый
Bisschop, P.H. et al. Содержание жира в пище изменяет опосредованный инсулином метаболизм глюкозы у здоровых мужчин. Am. J. Clin. Nutr. 73 , 554–559 (2001).
CAS Google ученый
Катлер Д. Л. и др. Низкоуглеводная диета изменяет внутриклеточный метаболизм глюкозы, но не влияет на ее утилизацию в целом у тренированных субъектов. Метаболизм 44 , 1264–1270 (1995).
Метаболизм 44 , 1264–1270 (1995).
CAS Google ученый
Лундсгаард А. М., Фритцен А. М. и Киенс Б. Важность жирных кислот как питательных веществ во время восстановления после упражнений. Питательные вещества 12 , nu12020280 (2020).
Google ученый
Bergman, B.C. et al. Оценка физических упражнений и тренировок на метаболизм липидов в мышцах. Am. J. Physiol. 276 , E106 – E117 (1999).
CAS Google ученый
Горовиц, Дж. Ф., Леоне, Т. К., Фенг, В., Келли, Д. П. и Кляйн, С. Влияние тренировок на выносливость на липидный обмен у женщин: потенциальная роль PPARalpha в метаболическом ответе на тренировку. Am. J. Physiol. Эндокринол. Метаб. 279 , E348 – E355 (2000).
Am. J. Physiol. Эндокринол. Метаб. 279 , E348 – E355 (2000).
CAS Google ученый
Хельге, Дж. У., Рихтер, Э. А. и Кинс, Б. Взаимодействие тренировок и диеты на метаболизм и выносливость во время упражнений у человека. J. Physiol. 492 , 293–306 (1996). Это исследование показало, что 7 недель диеты с высоким содержанием жиров и физических упражнений улучшают липидный обмен .
CAS Google ученый
Ван, П. К., Шлуфчик, К., Ниленс, Х., Рамаекерс, М. и Хеспель, П. Благоприятные метаболические адаптации, обусловленные тренировками на выносливость натощак. J. Appl. Physiol. 110 , 236–245 (2011).
Google ученый
Фридлендер, А. Л., Казацца, Г. А., Хорнинг, М. А., Буддингер, Т. Ф. и Брукс, Г. А. Влияние интенсивности упражнений и тренировок на липидный обмен у молодых женщин. Am. J. Physiol. 275 , E853 – E863 (1998).
CAS Google ученый
Merrill, J.R. et al. Гиперлипемическая реакция молодых тренированных и нетренированных мужчин на жирную пищу. Артериосклероз 9 , 217–223 (1989).
CAS Google ученый
Коэн, Дж. К., Ноукс, Т. Д. и Бенаде, А. Дж. Постпрандиальная липемия и клиренс хиломикронов у спортсменов и мужчин, ведущих малоподвижный образ жизни. Am. J. Clin. Nutr. 49 , 443–447 (1989).
CAS Google ученый
Podl, T. R. et al. Активность липопротеинлипазы и клиренс триглицеридов плазмы повышены у тренированных на выносливость женщин. Метаболизм 43 , 808–813 (1994).
CAS Google ученый
Диксон, Н. К., Херст, Т. Л., Талбот, Д. К., Тиррелл, Р. М. и Томпсон, Д. Активные мужчины среднего возраста имеют более низкие маркеры воспаления натощак, но постпрандиальная воспалительная реакция минимальна и не зависит от статуса физической активности. J. Appl. Physiol. 107 , 63–68 (2009).
CAS Google ученый
Зиогас, Г. Г., Томас, Т. Р. и Харрис, У. С. Физические упражнения, постпрандиальная гипертриглицеридемия и распределение субфракций ЛПНП.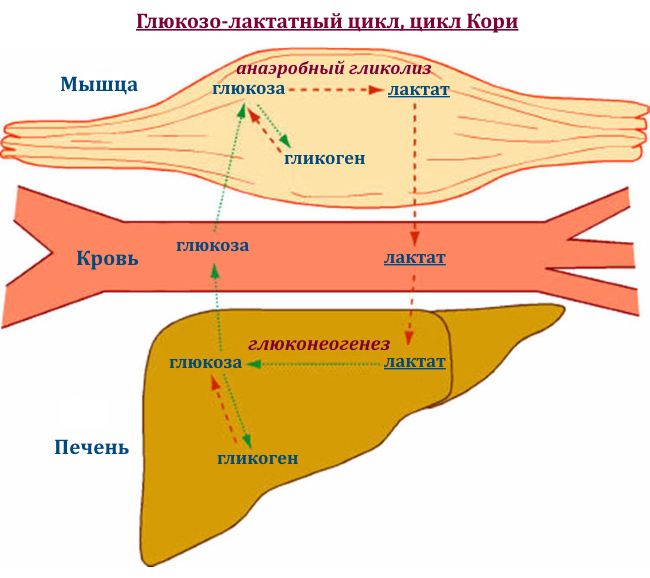 Med. Sci. Спортивные упражнения. 29 , 986–991 (1997).
Med. Sci. Спортивные упражнения. 29 , 986–991 (1997).
CAS Google ученый
Олдред, Х. Э., Хардман, А.Э. и Тейлор С. Влияние 12 недель тренировок быстрой ходьбой на постпрандиальную липемию и инсулинемию у малоподвижных женщин среднего возраста. Метаболизм 44 , 390–397 (1995).
CAS Google ученый
Херд, С. Л., Хардман, А. Э., Бубис, Л. Х. и Кэрнс, К. Дж. Влияние 13 недель беговых тренировок с последующими 9 днями сброса на постпрандиальную липемию. Br. J. Nutr. 80 , 57–66 (1998).
CAS Google ученый
Перри, К. Г. Р. и Хоули, Дж. А. Молекулярные основы индуцированного физической нагрузкой митохондриального биогенеза скелетных мышц: исторические достижения, текущие знания и будущие проблемы. Cold Spring Harb. Перспектива. Med. 8 , а029686 (2018).
Google ученый
Худ, Д. А., Трайон, Л. Д., Картер, Х. Н., Ким, Ю. и Чен, С. С. Разгадка механизмов, регулирующих биогенез митохондрий в мышцах. Biochem. J. 473 , 2295–2314 (2016).
CAS Google ученый
Иган Б. и Зиерат Дж. Р. Метаболизм упражнений и молекулярная регуляция адаптации скелетных мышц. Cell Metab. 17 , 162–184 (2013).
CAS Google ученый
Худ, Д. А., Мемме, Дж. М., Оливейра, А. Н. и Триоло, М. Поддержание митохондрий скелетных мышц при здоровье, физических упражнениях и старении. Annu. Rev. Physiol. 81 , 19–41 (2019).
CAS Google ученый
Хоули, Дж. А., Харгривз, М., Джойнер, М. Дж. И Зиерат, Дж. Р. Интегративная биология упражнений. Cell 159 , 738–749 (2014).
CAS Google ученый
Йост, Т. Дж., Йенсен, Д. Р., Хауген, Б. Р. и Эккель, Р. Х. Влияние диетической композиции макроэлементов на тканеспецифическую активность липопротеинлипазы и действие инсулина у субъектов с нормальным весом. Am. J. Clin. Nutr. 68 , 296–302 (1998).
CAS Google ученый
Labbe, S. M. et al. Органоспецифическое поглощение жирных кислот с пищей у людей с использованием позитронно-эмиссионной томографии в сочетании с компьютерной томографией. Am. J. Physiol. Эндокринол. Метаб. 300 , E445 – E453 (2011).
CAS Google ученый
Romijn, J. A. et al. Регулирование эндогенного жирового и углеводного обмена в зависимости от интенсивности и продолжительности упражнений. Am. J. Physiol. 265 , E380 – E391 (1993).
CAS Google ученый
Вулф Р.Р., Кляйн, С., Карраро, Ф. и Вебер, Дж. М. Роль цикла триглицеридов и жирных кислот в контроле метаболизма жиров у людей во время и после физических упражнений. Am. J. Physiol. 258 , E382 – E389 (1990).
Am. J. Physiol. 258 , E382 – E389 (1990).
CAS Google ученый
Bahr, R., Hostmark, A. T., Newsholme, E. A., Gronnerod, O. & Sejersted, O. M. Влияние физических упражнений на восстановительные изменения в плазменных уровнях FFA, глицерина, глюкозы и катехоламинов. Acta Physiol. Сканд. 143 , 105–115 (1991).
CAS Google ученый
Кимбер, Н. Э., Хейгенхаузер, Дж. Дж., Спрайт, Л. Л. и Дайк, Д. Дж. Жир в скелетных мышцах и метаболизм углеводов во время восстановления после истощающих гликоген упражнений у людей. J. Physiol. 548 , 919–927 (2003).
CAS Google ученый
Кинс Б. и Рихтер Е. А. Использование триацилглицерина скелетных мышц во время восстановления после тренировки у людей. Am. J. Physiol. 275 , E332 – E337 (1998). Эта статья показывает важность окисления жирных кислот в скелетных мышцах во время восстановления после физических упражнений у людей .
CAS Google ученый
Hagenfeldt, L. & Wahren, J. Оборот свободных жирных кислот во время восстановления после физических упражнений. J. Appl. Physiol. 39 , 247–250 (1975).
CAS Google ученый
Ватт, М. Дж., Хейгенхаузер, Г. Дж., О’Нил, М. и Спрайт, Л. Л. Активность гормоночувствительной липазы и содержание жирного ацил-КоА в скелетных мышцах человека при длительных физических нагрузках.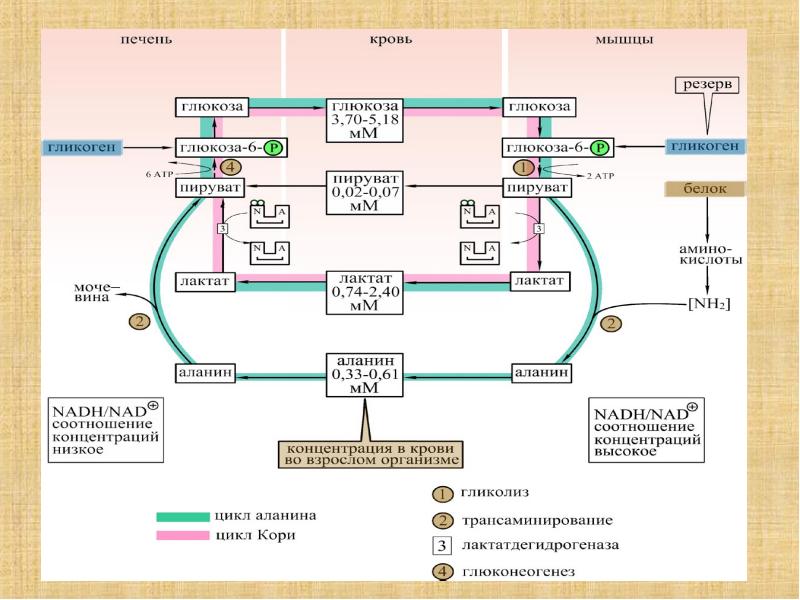 J. Appl. Physiol. 95 , 314–321 (2003).
J. Appl. Physiol. 95 , 314–321 (2003).
CAS Google ученый
Roepstorff, C. et al. Гендерные различия в использовании субстрата во время субмаксимальных упражнений у испытуемых, тренированных на выносливость. Am. J. Physiol. Эндокринол. Метаб. 282 , E435 – E447 (2002).
CAS Google ученый
Киенс, Б. Липидный обмен в скелетных мышцах при физических нагрузках и инсулинорезистентность. Physiol. Ред. 86 , 205–243 (2006).
CAS Google ученый
ван, Х. Г., Саккетти, М., Радегран, Г. и Салтин, Б. Метаболизм жирных кислот и глицерина в скелетных мышцах человека во время отдыха, упражнений и восстановления. J. Physiol. 543 , 1047–1058 (2002).
и Салтин, Б. Метаболизм жирных кислот и глицерина в скелетных мышцах человека во время отдыха, упражнений и восстановления. J. Physiol. 543 , 1047–1058 (2002).
Google ученый
Pilegaard, H. et al. Доступность субстрата и регуляция транскрипции метаболических генов в скелетных мышцах человека во время восстановления после упражнений. Метаболизм 54 , 1048–1055 (2005).
CAS Google ученый
Эренборг, Э. и Крук, А. Регулирование физиологии и метаболизма скелетных мышц дельта рецептора, активируемого пролифератором пероксисом. Pharmacol. Ред. 61 , 373–393 (2009).
CAS Google ученый
Tanaka, T. et al. Активация дельта-рецептора, активируемого пролифератором пероксисом, вызывает бета-окисление жирных кислот в скелетных мышцах и ослабляет метаболический синдром. Proc. Natl Acad. Sci. США 100 , 15924–15929 (2003). Исследование, показывающее, что фармакологическая активация PPAR вызывает липидную метаболическую адаптацию в скелетных мышцах мышей .
CAS Google ученый
Fan, W. et al. PPARdelta способствует повышению выносливости при беге за счет сохранения глюкозы. Cell Metab. 25 , 1186–1193 (2017).
CAS Google ученый
Константин Д. и др. Агонизм PPARdelta вызывает изменение метаболизма топлива и активацию программы атрофии, но не нарушает функцию митохондрий в скелетных мышцах крыс. J. Physiol. 583 , 381–390 (2007).
J. Physiol. 583 , 381–390 (2007).
CAS Google ученый
Константин-Теодосиу, Д., Бейкер, Д. Дж., Константин, Д. и Гринхафф, П. Л. Агонизм PPARdelta подавляет активность PDC скелетных мышц, выработку митохондриального АТФ и выработку силы во время длительного сокращения. J. Physiol. 587 , 231–239 (2009).
CAS Google ученый
Garcia-Roves, P. et al. Повышение концентрации жирных кислот в плазме вызывает усиление биогенеза митохондрий в скелетных мышцах. Proc. Natl Acad. Sci. США 104 , 10709–10713 (2007).
CAS Google ученый
Banner, C. D. et al.Систематический аналитический подход к химии / клеточному анализу для выделения активаторов орфанных ядерных рецепторов из биологических экстрактов: характеристика активаторов рецепторов, активируемых пролифератором пероксисом, в плазме. J. Lipid Res. 34 , 1583–1591 (1993).
CAS Google ученый
Forman, B.M., Chen, J. & Evans, R.M. Гиполипидемические препараты, полиненасыщенные жирные кислоты и эйкозаноиды являются лигандами альфа- и дельта-рецепторов, активируемых пролифератором пероксисом. Proc. Natl Acad. Sci. USA 94 , 4312–4317 (1997).
CAS Google ученый
Krey, G. et al. Жирные кислоты, эйкозаноиды и гиполипидемические агенты, идентифицированные как лиганды рецепторов, активируемых пролифератором пероксисом, с помощью анализа коактиватор-зависимого рецепторного лиганда. Мол. Эндокринол. 11 , 779–791 (1997).
Мол. Эндокринол. 11 , 779–791 (1997).
CAS Google ученый
Haemmerle, G. et al. ATGL-опосредованный катаболизм жиров регулирует сердечную митохондриальную функцию через PPAR-альфа и PGC-1. Нат. Med. 17 , 1076–1085 (2011).
CAS Google ученый
Gerhart-Hines, Z. et al. Метаболический контроль функции митохондрий мышц и окисления жирных кислот через SIRT1 / PGC-1alpha. EMBO J. 26 , 1913–1923 (2007).
CAS Google ученый
Vila, L. et al. Опосредованная AAV сверхэкспрессия Sirt1 в скелетных мышцах активирует окислительную способность, но не предотвращает резистентность к инсулину. Мол. Ther. Методы клин. Dev. 5 , 16072 (2016).
Мол. Ther. Методы клин. Dev. 5 , 16072 (2016).
Google ученый
Feige, J. N. et al. Специальная активация SIRT1 имитирует низкий уровень энергии и защищает от нарушений обмена веществ, вызванных диетой, за счет усиления окисления жиров. Cell Metab. 8 , 347–358 (2008).
CAS Google ученый
Brandon, A. E. et al. Сверхэкспрессия SIRT1 в скелетных мышцах крыс не изменяет индуцированную глюкозой резистентность к инсулину. PLoS ONE 10 , e0121959 (2015).
Google ученый
Draznin, B. , Wang, C., Adochio, R., Leitner, J. W. & Cornier, M.A. Влияние диетической композиции макроэлементов на экспрессию AMPK и SIRT1 и активность в скелетных мышцах человека. Horm. Метаб. Res. 44 , 650–655 (2012).
, Wang, C., Adochio, R., Leitner, J. W. & Cornier, M.A. Влияние диетической композиции макроэлементов на экспрессию AMPK и SIRT1 и активность в скелетных мышцах человека. Horm. Метаб. Res. 44 , 650–655 (2012).
CAS Google ученый
Canto, C. et al. Взаимозависимость AMPK и SIRT1 для метаболической адаптации скелетных мышц к голоданию и упражнениям. Cell Metab. 11 , 213–219 (2010).
CAS Google ученый
Fritzen, A. M. et al. 5 АМФ-активированная протеинкиназа альфа контролирует метаболизм субстратов во время восстановления после тренировки посредством регуляции пируватдегидрогеназы киназы 4. J. Physiol. 593 , 4765–4780 (2015).
CAS Google ученый
Гурд, Б. Дж., Перри, К. Г., Хейгенхаузер, Г. Дж., Сприет, Л. Л. и Бонен, А. Интервальная тренировка высокой интенсивности увеличивает активность SIRT1 в скелетных мышцах человека. Заявл. Physiol. Nutr. Метаб. 35 , 350–357 (2010).
CAS Google ученый
Мензис, К. Дж., Сингх, К., Салим, А. и Худ, Д. А. Сиртуин-1-опосредованные эффекты упражнений и ресвератрола на митохондриальный биогенез. J. Biol. Chem. 288 , 6968–6979 (2013).
CAS Google ученый
Philp, A. & Schenk, S. Раскрытие сложностей SIRT1-опосредованной митохондриальной регуляции в скелетных мышцах. Упражнение. Спорт. Sci. Ред. 41 , 174–181 (2013).
Раскрытие сложностей SIRT1-опосредованной митохондриальной регуляции в скелетных мышцах. Упражнение. Спорт. Sci. Ред. 41 , 174–181 (2013).
Google ученый
Canto, C. et al. AMPK регулирует расход энергии, модулируя метаболизм NAD + и активность SIRT1. Nature 458 , 1056–1060 (2009).
CAS Google ученый
Fritzen, A. M. et al. Регулирование SIRT1, специфичное для жирных кислот, не влияет на чувствительность к инсулину скелетных мышц человека. FASEB J. 33 , 5510–5519 (2019). В этой статье показано, что белок SIRT1 и его активность в скелетных мышцах повышаются за счет диеты с высоким содержанием жиров, обогащенной насыщенными жирными кислотами, у людей, но на нее не влияет диета с высоким содержанием жиров и ненасыщенных жирных кислот .
CAS Google ученый
Bakke, S. S. et al. Пальмитиновая кислота следует другим путем метаболизма, чем олеиновая кислота, в клетках скелетных мышц человека; более низкая скорость липолиза, несмотря на повышенный уровень липазы триглицеридов жировой ткани. Biochim. Биофиз. Acta 1821 , 1323–1333 (2012).
CAS Google ученый
Garcia-Martinez, C. et al. Влияние на метаболизм жирных кислот и дифференциальную локализацию белков FATP1 и FAT / CD36, доставленных в культивируемые мышечные клетки человека. Am. J. Physiol. Cell Physiol. 288 , C1264 – C1272 (2005).
CAS Google ученый
Джонс, П. Дж., Пенчарз, П. Б. и Кландинин, М. Т. Окисление пищевых жирных кислот в организме в целом: последствия для использования энергии. Am. J. Clin. Nutr. 42 , 769–777 (1985).
CAS Google ученый
Schmidt, D. E., Allred, J. B. & Kien, C. L. Фракционное окисление олеата, полученного из хиломикрона, сильнее, чем у пальмитата, у здоровых взрослых, которых кормили часто небольшими порциями. Дж.Lipid Res. 40 , 2322–2332 (1999).
CAS Google ученый
ДеЛани, Дж. П., Виндхаузер, М. М., Шампань, К. М. и Брей, Г. А. Дифференциальное окисление отдельных пищевых жирных кислот у людей. Am. J. Clin. Nutr. 72 , 905–911 (2000).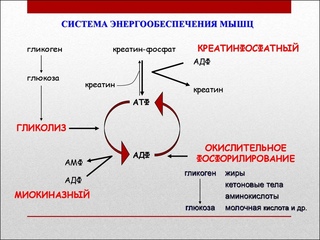
CAS Google ученый
Hagenfeldt, L. & Wahren, J.Метаболизм мышц предплечья человека во время тренировки. II. Поглощение, высвобождение и окисление отдельных FFA и глицерина. Сканд. J. Clin. Лаборатория. Вкладывать деньги. 21 , 263–276 (1968).
CAS Google ученый
Fentz, J. et al. AMPKalpha имеет решающее значение для увеличения использования жирных кислот скелетных мышц во время упражнений in vivo у мышей. FASEB J. 29 , 1725–1738 (2015).
CAS Google ученый
Fentz, J. et al. AMPKalpha важен для острой реакции генов, вызванной физической нагрузкой, но не для вызванной тренировкой адаптации скелетных мышц мышей. Am. J. Physiol. Эндокринол. Метаб. 309 , E900 – E914 (2015).
Am. J. Physiol. Эндокринол. Метаб. 309 , E900 – E914 (2015).
CAS Google ученый
Lantier, L. et al. AMPK контролирует выносливость при упражнениях, окислительную способность митохондрий и целостность скелетных мышц. FASEB J. 28 , 3211–3224 (2014).
CAS Google ученый
Войташевский, Дж. Ф., Нильсен, П., Хансен, Б. Ф., Рихтер, Э. А. и Кинс, Б. Изоформа-специфическая и зависимая от интенсивности нагрузки активация 5’-AMP-активированной протеинкиназы в скелетных мышцах человека. J. Physiol. 528 , 221–226 (2000).
CAS Google ученый
Samovski, D. et al. Регулирование активации AMPK с помощью CD36 связывает поглощение жирных кислот с окислением. Диабет 64 , 353–359 (2015). Исследование, демонстрирующее, что AMPK активируется в скелетных мышцах мышей жирными кислотами посредством активации CD36 .
CAS Google ученый
Ватт, М. Дж., Стейнберг, Г. Р., Чен, З. П., Кемп, Б. Э. и Феббрайо, М. А. Жирные кислоты стимулируют АМФ-активированную протеинкиназу и усиливают окисление жирных кислот в мышечных трубках L6. J. Physiol. 574 , 139–147 (2006).
CAS Google ученый
Hoeg, L. D. et al. Инсулинорезистентность, индуцированная липидами, меньше поражает женщин, чем мужчин, и не сопровождается воспалением или нарушением проксимальной передачи сигналов инсулина.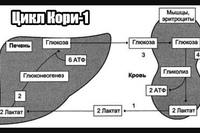 Диабет 60 , 64–73 (2011).
Диабет 60 , 64–73 (2011).
Google ученый
Pehmoller, C. et al. Упражнения снижают индуцированную липидами резистентность к инсулину во взаимодействии передачи сигналов скелетными мышцами человека на уровне члена 4 семейства доменов TBC1. Диабет 61 , 2743–2752 (2012).
Google ученый
Yeo, W. K. et al. Адаптация к жирам с последующим восстановлением углеводов увеличивает активность AMPK в скелетных мышцах тренированных людей. J. Appl. Physiol. 105 , 1519–1526 (2008).
CAS Google ученый

Jeppesen, J. et al. LKB1 регулирует окисление липидов во время упражнений независимо от AMPK. Диабет 62 , 1490–1499 (2013).
CAS Google ученый
Лундсгаард А. М., Фритцен А. М. и Киенс Б. Молекулярная регуляция окисления жирных кислот в скелетных мышцах во время аэробных упражнений. Trends Endocrinol. Метаб. 29 , 18–30 (2018).
CAS Google ученый
Hingst, J. R. et al.Индуцируемая делеция AMPKα скелетных мышц показывает, что AMPK необходим для баланса нуклеотидов, но незаменим для поглощения мышечной глюкозы и окисления жиров во время упражнений. Мол. Метаб. 40 , 101028 (2020).
CAS Google ученый
Хашимото Т. и Брукс Г. А. Митохондриальный комплекс окисления лактата и адаптивная роль в производстве лактата. Med. Sci. Спортивные упражнения. 40 , 486–494 (2008).
CAS Google ученый
Налбандиан М. и Такеда М. Лактат как сигнальная молекула, регулирующая адаптацию, вызванную физической нагрузкой. Биология 5 , 38 (2016).
Google ученый
Брукс, Г. А. Лактат как точка опоры метаболизма. Редокс. Биол. 35 , 101454 (2020).
CAS Google ученый

Вестертерп, К. Р., Смитс, А., Лежен, М. П., Воутерс-Адриаенс, М. П. и Вестертерп-Плантенга, М. С. Окисление жиров в питании как функция жировых отложений. Am. J. Clin. Nutr. 87 , 132–135 (2008).
CAS Google ученый
Kim, J. Y., Hickner, R. C., Cortright, R. L., Dohm, G. L. & Houmard, J. A. Окисление липидов снижается в скелетных мышцах человека с ожирением. Am. J. Physiol. Эндокринол.Метаб. 279 , E1039 – E1044 (2000).
CAS Google ученый
Bandyopadhyay, G. K., Yu, J. G., Ofrecio, J. & Olefsky, J. M. Повышенные уровни малонил-КоА в мышцах у субъектов с ожирением и диабетом 2 типа приводят к снижению окисления жирных кислот и усилению липогенеза; Лечение тиазолидиндионом устраняет эти дефекты.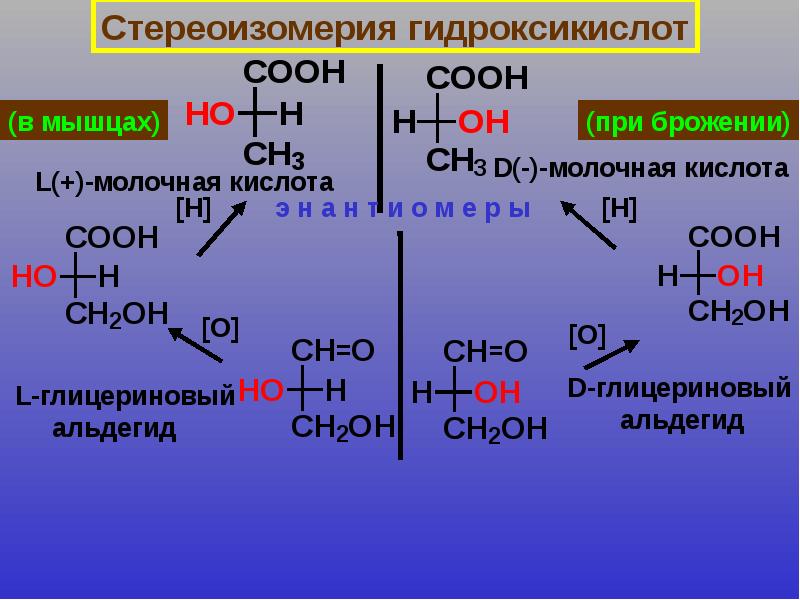 Диабет 55 , 2277–2285 (2006).
Диабет 55 , 2277–2285 (2006).
CAS Google ученый
Hulver, M. W. et al. Липидный обмен скелетных мышц при ожирении. Am. J. Physiol. Эндокринол. Метаб. 284 , E741 – E747 (2003).
CAS Google ученый
Стейнберг, Г. Р., Паролин, М. Л., Хейгенхаузер, Г. Дж. И Дайк, Д. Дж. Лептин увеличивает окисление ЖК в худых, но не страдающих ожирением скелетных мышцах человека: свидетельство периферической резистентности к лептину. Am. J. Physiol. Эндокринол. Метаб. 283 , E187 – E192 (2002).
CAS Google ученый
Bonen, A. et al. Накопление триацилглицерина при ожирении и диабете 2 типа связано с увеличением скорости транспорта жирных кислот в скелетных мышцах и увеличением сарколеммы FAT / CD36. FASEB J. 18 , 1144–1146 (2004).
CAS Google ученый
Holloway, G.P. et al. Содержание FAT / CD36 в митохондриях скелетных мышц и окисление пальмитата не снижаются у женщин с ожирением. Am. J. Physiol. Эндокринол. Метаб. 292 , E1782 – E1789 (2007).
CAS Google ученый
Anderson, E.J. et al. Эмиссия митохондрий h3O2 и окислительно-восстановительное состояние клеток связывают избыточное потребление жиров с инсулинорезистентностью как у грызунов, так и у людей. J. Clin. Вкладывать деньги. 119 , 573–581 (2009).
J. Clin. Вкладывать деньги. 119 , 573–581 (2009).
CAS Google ученый
Риндерс, К. А., Блан, С., ДеЙонг, Н., Бессезен, Д. Х. и Бергуиньян, А. Сидячий образ жизни является ключевым фактором, определяющим метаболическую негибкость. J. Physiol. 596 , 1319–1330 (2018).
CAS Google ученый
Dohlmann, T. L., Hinds,. М., Дела, Ф., Хельге, Дж. У. и Ларсен, С. Интервальные тренировки высокой интенсивности по-разному изменяют дыхательную способность митохондрий в жировой ткани и скелетных мышцах. Physiol. Отчет 6 , e13857 (2018).
Google ученый
Devries, M.C. et al. Тренировка на выносливость регулирует внутримиоцеллюлярную компартментализацию и морфологию липидов в скелетных мышцах худых и полных женщин. J. Clin. Эндокринол. Метаб. 98 , 4852–4862 (2013).
CAS Google ученый
Брюс, К.Р., Крикетос, А. Д., Куни, Г. Дж. И Хоули, Дж. А. Диссоциация содержания триглицеридов в мышцах и чувствительности к инсулину после физических упражнений у пациентов с диабетом 2 типа. Диабетология 47 , 23–30 (2004).
CAS Google ученый
Gillen, J. B. et al. Три минуты непрерывных упражнений с перерывами в неделю увеличивают окислительную способность скелетных мышц и улучшают кардиометаболическое здоровье. PLoS ONE 9 , e111489 (2014).
PLoS ONE 9 , e111489 (2014).
Google ученый
de Matos, M. A. et al. Интервальные тренировки высокой интенсивности улучшают маркеры окислительного метаболизма в скелетных мышцах людей с ожирением и инсулинорезистентностью. Фронт. Physiol. 9 , 1451 (2018).
Google ученый
Louche, K. et al. Тренировки на выносливость повышают уровень липолитических белков и снижают содержание триглицеридов в скелетных мышцах людей с ожирением. J. Clin. Эндокринол. Метаб. 98 , 4863–4871 (2013).
CAS Google ученый
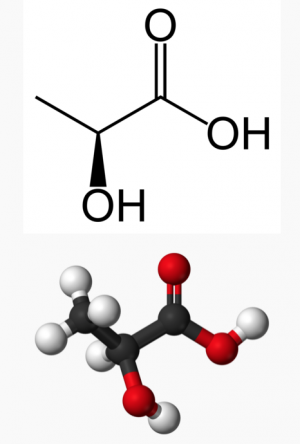
Blaak, E. E., Wolffenbuttel, B.H., Saris, W.H., Pelsers, M. M. & Wagenmakers, A.J. Снижение веса и нарушение окисления свободных жирных кислот из плазмы у пациентов с диабетом 2 типа. J. Clin. Эндокринол. Метаб. 86 , 1638–1644 (2001).
CAS Google ученый
Albers, P.H. et al. Усиление передачи сигналов инсулина в скелетных мышцах и жировой ткани человека после операции обходного желудочного анастомоза. Am. J. Physiol. Regul. Интегр. Комп. Physiol. 309 , R510 – R524 (2015).
CAS Google ученый
Ватт, М. Дж. И Хевенер, А. Л. Приведение митохондрий к инсулинорезистентности. Cell Metab. 7 , 5–6 (2008).
CAS Google ученый
Dobbins, R. L. et al. Длительное ингибирование мышечной карнитин-пальмитоилтрансферазы-1 способствует внутримиоклеточному накоплению липидов и инсулинорезистентности у крыс. Диабет 50 , 123–130 (2001).
CAS Google ученый
Timmers, S. et al. Увеличение содержания диацилглицерина и триацилглицерина в мышцах путем блокирования окисления жирных кислот не снижает чувствительности к инсулину. Proc. Natl Acad.Sci. США 109 , 11711–11716 (2012).
CAS Google ученый
Hubinger, A., Knode, O., Susanto, F., Reinauer, H. & Gries, F. A. Влияние ингибитора карнитина-ацилтрансферазы на чувствительность к инсулину, расход энергии и окисление субстрата при NIDDM. Horm. Метаб. Res. 29 , 436–439 (1997).
Horm. Метаб. Res. 29 , 436–439 (1997).
Google ученый
Keung, W. et al. Ингибирование активности карнитинпальмитоилтрансферазы-1 снижает резистентность к инсулину у мышей с ожирением, вызванным диетой. Диабет 62 , 711–720 (2013).
CAS Google ученый
Рэндл П. Дж., Гарланд П. Б., Хейлз К. Н. и Ньюсхолм Е. А. Цикл жирно-кислотного цикла глюкозы. Его роль в чувствительности к инсулину и метаболических нарушениях при сахарном диабете. Ланцет 1 , 785–789 (1963).
CAS Google ученый

Lundsgaard, A. M. et al. Глюкометаболические последствия острого и длительного угнетения окисления жирных кислот. J. Lipid Res. 61 , 10–19 (2020).
CAS Google ученый
Галгани, Дж. Э., Моро, С. и Равуссин, Э. Метаболическая гибкость и инсулинорезистентность. Am. J. Physiol. Эндокринол.Метаб. 295 , E1009 – E1017 (2008).
CAS Google ученый
Бранис, Н. М., Этесами, М., Уокер, Р. В., Берк, Э. С. и Албу, Дж. Б. Влияние однонедельной эукалорийной диеты с умеренно высоким содержанием жиров на периферическую чувствительность к инсулину у здоровых женщин в пременопаузе. BMJ Open. Diabetes Res. Уход 3 , e000100 (2015).
Google ученый
von Frankenberg, A.D. et al. Диета с высоким содержанием жиров и насыщенных жиров снижает чувствительность к инсулину без изменения содержания жира в брюшной полости у взрослых с избыточным весом и ожирением со стабильным весом. Eur. J. Nutr. 56 , 431–443 (2015).
Google ученый
van Herpen, NA, Schrauwen-Hinderling, VB, Schaart, G., Mensink, RP & Schrauwen, P. Три недели диеты с высоким содержанием жиров увеличивают накопление внутрипеченочных липидов и снижают метаболическую гибкость у здоровых мужчин с избыточным весом. . J. Clin. Эндокринол. Метаб. 96 , E691 – E695 (2011).
Google ученый
Stettler, R. et al. Взаимодействие диетических липидов и отсутствия физической активности на чувствительность к инсулину и внутримиоклеточные липиды у здоровых мужчин. Уход за диабетом 28 , 1404–1409 (2005).
Уход за диабетом 28 , 1404–1409 (2005).
CAS Google ученый
Боркман, М., Кэмпбелл, Л. В., Чисхолм, Д. Дж. И Сторлиен, Л. Х. Сравнение влияния на чувствительность к инсулину диет с высоким содержанием углеводов и жиров у нормальных субъектов. J. Clin. Эндокринол. Метаб. 72 , 432–437 (1991).
CAS Google ученый
Vogt, M. et al. Влияние диетического жира на мышечные субстраты, метаболизм и производительность спортсменов. Med. Sci. Спортивные упражнения. 35 , 952–960 (2003).
CAS Google ученый

Хоппелер, Х., Биллетер, Р., Хорват, П. Дж., Ледди, Дж. Дж. И Пендергаст, Д. Р. Структура мышц при диетах с низким и высоким содержанием жиров у хорошо подготовленных бегунов-мужчин. Внутр. J. Sports Med. 20 , 522–526 (1999).
CAS Google ученый
Nielsen, J. et al. Пластичность плотности митохондриальных крист позволяет изменять метаболическую способность скелетных мышц человека. J. Physiol. 595 , 2839–2847 (2017).
CAS Google ученый
Хоппелер, Х., Люти, П., Клаассен, Х., Вейбель, Э. Р. и Ховальд, Х. Ультраструктура нормальной скелетной мышцы человека. Морфометрический анализ нетренированных мужчин, женщин и хорошо подготовленных ориентировщиков. Pflugers Arch. 344 , 217–232 (1973).
Pflugers Arch. 344 , 217–232 (1973).
CAS Google ученый
Moors, C.C., van der Zijl, N.J., Diamant, M., Blaak, E.E. & Goossens, G.H. Нарушение чувствительности к инсулину сопровождается нарушениями в обработке жирных кислот в скелетных мышцах у субъектов с нарушенным метаболизмом глюкозы. Внутр. J. Obes. 36 , 709–717 (2012).
CAS Google ученый
Константин-Теодосиу, Д., Седерблад, Г. и Халтман, Э. Активность PDC и накопление ацетильных групп в скелетных мышцах во время длительных упражнений. J. Appl. Physiol. 73 , 2403–2407 (1992).
CAS Google ученый
Хосино, Д., Тамура, Ю., Масуда, Х., Мацунага, Ю. и Хатта, Х. Влияние снижения накопления лактата после введения дихлорацетата на индуцированную тренировкой митохондриальную адаптацию в скелетных мышцах мышей. Physiol. Отчет 3 , 3–9 (2015). Эта работа показывает, что фармакологическое подавление выработки лактата во время упражнений у мышей нарушает метаболические адаптации, вызванные тренировкой .
Google ученый
Китаока, Ю., Такеда, К., Тамура, Ю. и Хатта, Х. Введение лактата увеличивает экспрессию мРНК PGC-1alpha и UCP3 в скелетных мышцах мышей. Заявл. Physiol. Nutr. Метаб. 41 , 695–698 (2016).
CAS Google ученый
Такахаши К., Китаока Ю., Мацунага Ю. и Хатта Х. Влияние введения лактата на активность митохондриальных ферментов и переносчиков монокарбоксилата в скелетных мышцах мышей. Physiol. Отчет 7 , e14224 (2019).
CAS Google ученый
Cerda-Kohler, H. et al. Введение лактата активирует пути ERK1 / 2, mTORC1 и AMPK по-разному в зависимости от типа скелетных мышц мыши. Physiol. Отчет 6 , e13800 (2018).
Google ученый
Takahashi, H. et al. TGF-бета2 — это адипокин, индуцированный физической нагрузкой, который регулирует метаболизм глюкозы и жирных кислот. Нат. Метаб. 1 , 291–303 (2019).
CAS Google ученый
Zhang, D. et al. Метаболическая регуляция экспрессии генов путем лактилирования гистонов. Nature 574 , 575–580 (2019).
CAS Google ученый
Вы действительно хотите избавиться от молочной кислоты?
Вы когда-нибудь участвовали в гонке или тренировке, чувствуя себя сильным, бегая быстрее, чем когда-либо раньше, и начинаете думать о том, как здорово будет, когда вы пересечете финишную черту со своим большим пиаром?
Но внезапно ваше тело начинает отключаться.Вы сильно ударяетесь об стену и еле двигаете ногами. Каждый шаг похож на попытку вытащить ноги из грязи, и ноги немеют или даже начинают покалывать.
Время ускользает, но кажется, что каждая секунда уходит вечно. Вы понимаете, что ваш самый быстрый пробег давно прошел, и вы чувствуете себя подавленным и сбитым с толку.
Что со мной случилось?
Что ж, вы, наверное, слышали, как люди бросают слово лактат или, в зависимости от того, кого вы спросите, накопление молочной кислоты .
Его обвиняли в усталости, болезненности, перетренированности и, возможно, в многом другом, но до недавнего времени феномен накопления лактата во время интенсивных упражнений был плохо изучен.
Сегодня мы развеем некоторые мифы о пороге лактата, о том, как избежать накопления молочной кислоты во время бега и как можно предотвратить усталость, улучшив при этом клиренс лактата.
Как на самом деле действует молочная кислота (лактат)?
Лактат, или молочная кислота, как ее обычно называют, получил плохую репутацию из-за ошибочной науки 1970-х годов.
В то время как избыточное накопление лактата способствует замедлению бегунов в конце забега, молочная кислота сама по себе не отвечает за мышечную усталость, которая заставляет вас танцевать скелет в конце забега.
Фактически, лактат является источником энергии.
Как вы, наверное, уже знаете, ваше тело расщепляет глюкозу для получения энергии, и побочным продуктом этого процесса является лактат.
Но для каждой молекулы лактата, производимой организмом, также образуется один ион водорода.Ионы водорода понижают pH крови и делают мышцы кислыми.
Во время легкого бега ваше тело преобразует и перерабатывает этот лактат обратно в энергию (через цикл Кори) и уносит с собой ионы водорода.
Следовательно, производство лактата и клиренс водорода будут оставаться относительно постоянными при беге в легком аэробном темпе, который не требует огромных затрат энергии.
По мере того, как вы продолжаете бегать быстрее и требуете больше энергии, производство молочной кислоты будет медленно увеличиваться.
В какой-то момент, будь то слишком быстрый темп или слишком долгое удержание постоянного темпа, производство молочной кислоты резко возрастет, и ваше тело больше не сможет преобразовывать лактат обратно в энергию.
В этот момент лактат не может захватить свой водородный ион, чтобы снизить концентрацию водорода в мышечной клетке . И эта кислотность раздражает нервные окончания мышц и вызывает ту боль, тяжесть и жжение, которые ошибочно приписывают молочной кислоте.
И эта кислотность раздражает нервные окончания мышц и вызывает ту боль, тяжесть и жжение, которые ошибочно приписывают молочной кислоте.
Почему мы думали, что молочная кислота так вредна для нас?
Ранние физиологи изучали причины мышечной усталости с помощью электрических импульсов, посылаемых в мышцы рассеченными лягушками.
Даже эти расчлененные мышцы утомляются через некоторое время, что доказывает, что в усталости есть химический компонент.
Когда эти мышечные волокна анализируются, они показывают высокую концентрацию лактата и ионов кислоты (водорода). Поэтому физиологи пришли к выводу, что причиной мышечной усталости во время упражнений является накопление соединения, называемого молочной кислотой.
Эта теория оставалась более или менее неоспоримой на протяжении большей части двадцатого века.
Только после того, как системы энергоснабжения организма были подвергнуты строгому биохимическому учету, обнаружились некоторые расхождения.
Во-первых, организм на самом деле не производит молочную кислоту, а только отрицательно заряженный ион, лактат.
«Кислота» (ионы водорода) действительно производится, но не на той же самой биохимической стадии.
Кроме того, соотношение лактата и ионов водорода, вырабатываемых во время упражнений, не 1: 1, как можно было бы ожидать, если бы вырабатывалась молочная кислота.
Эти неоднозначности привели к пересмотру и, в конечном итоге, пересмотру «парадигмы лактата» в начале 2000-х годов, возглавляемой Роджером Робергсом.
Что делает лактат?
Поясним:
Робергс, опытный биохимик, внимательно изучил каждый этап метаболического процесса, который превращает сахар (глюкозу в крови и гликоген в мышцах) в энергию при выполнении упражнений.
Большинство бегунов слышали следующую историю об энергетических путях:
Аэробное дыхание превращает сахар в топливо с использованием кислорода и не имеет никаких вредных побочных продуктов.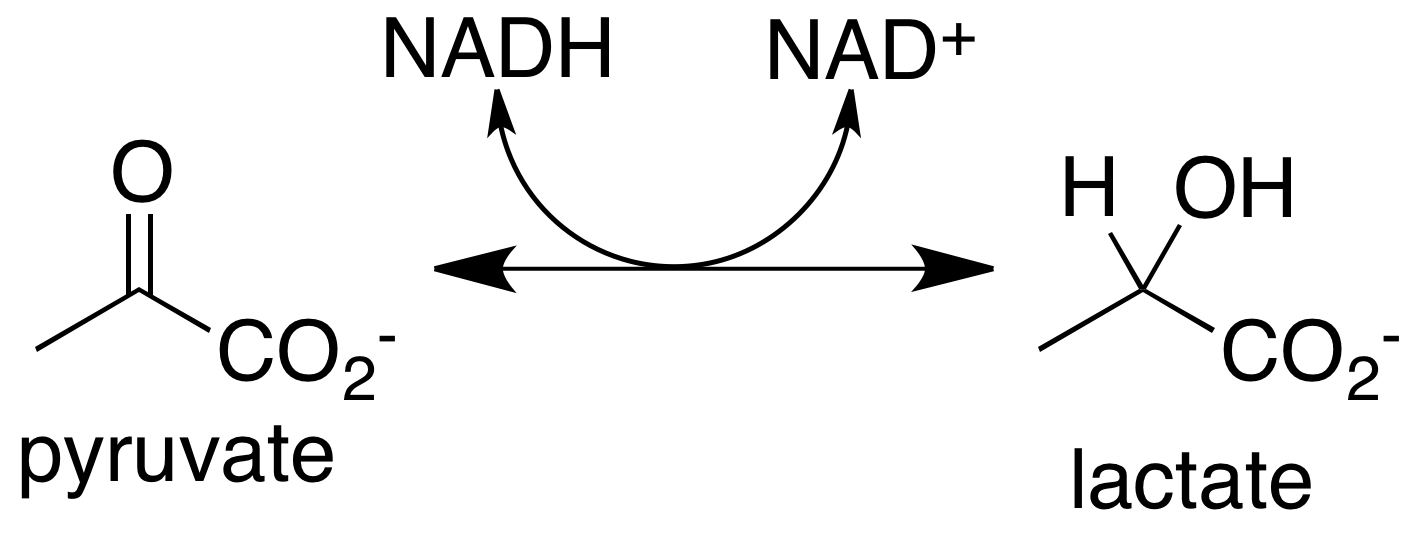
Анаэробное дыхание, которое не включается, пока вы не превысите свой аэробный предел, может генерировать энергию из сахара без использования кислорода, но приводит к образованию отходов — лактату и кислоте.
Робергс и другие показали, что это общее понимание имеет некоторые недостатки.
Оказывается, анаэробное дыхание функционирует постоянно, превращая сахар в соединение, называемое пируватом, одновременно выделяя ионы водорода.
Аэробное дыхание работает для очистки пирувата, используя кислород для превращения пирувата в углекислый газ и воду, которые можно выдыхать.
При аэробном процессе также расходуется кислота (ионы водорода), которая замедляет накопление кислоты в мышцах.
Выработка лактата на самом деле является побочной реакцией: когда начинает накапливаться избыток пирувата и кислоты (когда скорость анаэробного дыхания превышает способность аэробной системы удалять отходы), организм использует молекулу пирувата и ион водорода для создания лактата. , еще один способ замедлить накопление кислоты.
, еще один способ замедлить накопление кислоты.
Лактат также может выводиться из мышц в кровь и сжигаться в других частях тела для получения дополнительной энергии.
Как я могу предотвратить замедление выработки лактатом?
Вся эта биохимия может быть очень интересна физиологу, но как насчет остальных из нас, которые просто хотят знать, как предотвратить это в будущем?
Мы можем сразу извлечь из этого несколько уроков:
Развивайте свою аэробную систему
Это доказывает, что ваша аэробная сила является огромным фактором вашей производительности.
Хотя в вашем организме есть различные механизмы для буферизации кислоты, вырабатываемой во время интенсивных усилий, все они ограничены.
Только повышение аэробной формы позволит вам существенно увеличить расстояние и скорость бега.
Правильно управляйте своим темпом или порогом
Лактат играет более важную роль, чем просто вызывающая усталость, позволяет лучше понять место высокоинтенсивных тренировок, достигающих или превышающих «лактатный порог». ”
”
Эти тренировки — это не просто интенсивный бег ради интенсивного бега — они тренируют ваше тело вырабатывать, перерабатывать и сжигать лактат (как топливо!) С большей скоростью.
Это может улучшить вашу выносливость в гонках короткой и средней продолжительности, таких как 5 км и 10 км.
Научите свое тело преодолевать боль
Наконец, существует неизбежная усталость, связанная с перегрузкой кислоты.
В более коротких гонках это действительно невозможно.
Вы можете выполнять интенсивные интервальные тренировки и гонки, чтобы улучшить свою способность буферизовать кислоту, вырабатываемую при беге на очень высоких скоростях, но в конечном итоге каждый ограничен кислотностью в мышцах и крови.
Чтобы лучше подготовиться, попробуйте применить интервальную технику под названием «Интервалы молота», которая научит вас преодолевать эту усталость.
Последнее слово о лактате и молочной кислоте
Итак, существует ли во время упражнений «выработка молочной кислоты»?
Не совсем.
Ваше тело, безусловно, вырабатывает кислоту во время упражнений, а также вырабатывает лактат. Но именно первое, а не второе является основной причиной усталости.
Тем не менее, скорее всего, пройдет еще много времени, прежде чем мы перестанем слышать о накоплении молочной кислоты и так далее.
Шумиха вокруг терминологии может быть преувеличена, но понимание реальных механизмов работы, когда мы много бегаем и устаем, может помочь понять цель и важность различных тренировок, которые вы используете на тренировках.
Если вы хотите узнать больше о клиренсе лактата, мы объясним это более подробно.
Молочная кислота не вызывает боли в мышцах
Устранение некоторых неправильных представлений о причине мышечной болезненности.
Кен Кашубара, CSCS, USATF-1
Появление информационных технологий произвело революцию в образовании. Сегодня вечером сегодняшние студенты могут прочитать исследования, опубликованные сегодня утром. Никогда раньше новейшая информация не была так доступна.Учащиеся старших классов в AP-классах и студенты-спортсмены знают больше, чем когда-либо прежде.
Никогда раньше новейшая информация не была так доступна.Учащиеся старших классов в AP-классах и студенты-спортсмены знают больше, чем когда-либо прежде.
Тренерам необходимо доверие и уважение спортсменов, чтобы тренеры помогали спортсменам полностью раскрыть свой потенциал. Студенты собираются на занятия и узнают, что молочная кислота не является причиной мышечной боли. Молочная кислота даже не причина «ожога». Студенты читают доказательства и изучают факты для своих тестов. Затем, когда они идут на тренировку и слышат, как тренер говорит о восстановительных пробежках «смыв молочной кислоты», студенты могут потерять некоторое уважение к этому тренеру.Они могут задавать вопросы тренеру, думая: «Что ж, если они так думают, а это неправильно, в чем еще они ошибаются?»
Мы, тренеры, в основном ссылаемся на то, чему нас учили. Нас учили лучшей информации, доступной в то время. Даже сейчас, когда вы выполняете поиск в Интернете, сотни статей о тренировках, болезненности и восстановлении содержат неверную информацию о молочной кислоте.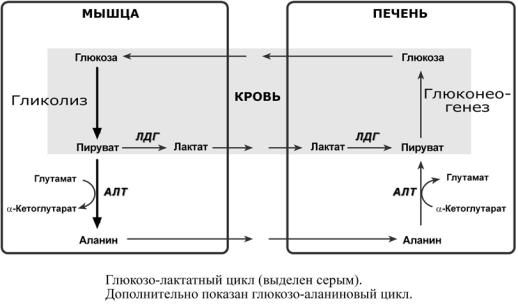
Цель этой статьи — помочь тренерам донести последнюю научную информацию до сегодняшних спортсменов в понятной для них форме.
Почему нас учили, что молочная кислота была причиной
Возникновение молочной кислоты как виновника болезненности начинается с цикла Кребса (он же цикл лимонной кислоты), продолжается циклом Кори (он же цикл молочной кислоты) и заканчивается порогом лактата. Все три этих биологических процесса являются реальными и достоверными научными фактами.
Цикл Кребса — это серия химических реакций, генерирующих энергию для всех аэробных организмов (1). Интенсивность энергетических потребностей определяет субстраты для получения энергии.В процессах меньшей интенсивности в качестве субстрата используются жиры. Когда движение становится затруднительным, глюкоза используется как более быстрый источник энергии. Фосфокреатин используется в качестве субстрата, когда потребность в энергии немедленная. Независимо от потребности в энергии, все субстраты должны преобразовываться в АТФ (аденинтрифосфат) для производства энергии.
Цикл Кори становится важным в спорте по мере увеличения потребности в энергии. Человеческое тело нуждается в постоянной энергии топлива АТФ во время упражнений. Когда упражнение является аэробным (с кислородом), глюкоза расщепляется на пируват и входит в цикл Кребса.Когда упражнения требуют анаэробной энергии (без кислорода), глюкоза становится пируватом, а пируват превращается в лактат (2). Затем лактат попадает с кровотоком в печень. В печени лактат снова превращается в пируват, который затем превращается в глюкозу.
КАРТА ЦИКЛА CORI
Лактатный порог возникает, когда лактат в крови начинает экспоненциально увеличиваться во время анаэробного дыхания. Ранние исследования показали, что уровень лактата в крови повышается во время упражнений высокой интенсивности (3).Лактат вырабатывается быстрее, чем кровоток может удалить его из мышц во время упражнений высокой интенсивности.
Исходя из этой информации, ранний вывод заключался в том, что, поскольку лактат в крови (он же молочная кислота) был повышен во время упражнений высокой интенсивности, он был причиной мышечного ожога. Кроме того, поскольку упражнения высокой интенсивности часто вызывают мышечную болезненность, причиной должна быть молочная кислота.
Кроме того, поскольку упражнения высокой интенсивности часто вызывают мышечную болезненность, причиной должна быть молочная кислота.
Это был лучший вывод на тот момент. К сожалению, это не так.
В чем причина ожога?
Распад АТФ для получения энергии вызывает выброс ионов водорода в кровоток. Этот процесс ускоряется при выполнении упражнений с более высокой интенсивностью, таких как спринт и удары ногой в конце забегов на средние и длинные дистанции. Эти ионы водорода (ион H +) являются протонами и являются причиной «ожога». Они ухудшают работоспособность, подавляя анаэробное производство АТФ, что препятствует процессу сокращения мышц и увеличивает кислотность крови, что в конечном итоге приводит к мышечной недостаточности.
У людей может возникнуть рвота после чрезмерных физических нагрузок. Это происходит потому, что накопление ионов H + снижает уровень pH крови, делая ее кислой. Уже кислые желудочные кислоты достигают недопустимого уровня, и тело рвет, чтобы снизить кислотность тела.
Спортсмены адаптируются к улучшению своей физической формы за счет увеличения буферной способности этих ионов водорода (4). Буферы устойчивы к изменению pH. Клеточные буферы первой линии — это белки; вторичные буферы крови включают гемоглобин.Возможно, лучшее приспособление для предотвращения изменения pH — это вентиляция. Повышенное потребление кислорода, лучшее клеточное дыхание, повышенное количество митохондрий, более высокий анаэробный порог и увеличенный VO2 max — все это способствует сопротивлению изменениям pH во время упражнений.
Человек может заболеть, не преодолев анаэробный порог
Возьмите хорошо подготовленного легкоатлета. Заставьте его / ее принять участие в шестидесятиминутном уроке по гимнастике на растяжке элитного уровня. Во время занятия большинство положений тела статичны и пассивны.Атлету предлагается расслабиться и позволить силе тяжести сделать работу. Частота пульса спортсмена существенно не увеличится. Он не сожжет значительное количество калорий по сравнению с тренировками на беговой дорожке. Он не приблизится к лактатному порогу. Однако уже на следующий день легкоатлет высокого уровня заболит. Фактически, он едва сможет встать с постели. Как это возможно, если он не превышает порог лактата?
Он не приблизится к лактатному порогу. Однако уже на следующий день легкоатлет высокого уровня заболит. Фактически, он едва сможет встать с постели. Как это возможно, если он не превышает порог лактата?
Отсроченное начало мышечной болезненности (DOMS) определяется как возникновение боли через 24-48 часов после приступа непривычной мышечной активности (5).Болезненность стебли от незначительных слез опорно-двигательного аппарата. Боль возникает из-за воспаления, которое является первой фазой заживления тканей. Мышца восстанавливается за счет увеличения выработки коллагена, а затем реконструируется с правильным выравниванием коллагеновых волокон и увеличивает прочность тканей (6).
Ключевая фраза в предыдущем абзаце — «непривычная мышечная активность». Люди приспосабливаются к требованиям своих программ обучения. Возьмите любого спортсмена высокого уровня и включите его в тренировочную программу с совершенно другими требованиями к производительности, и у спортсмена начнутся боли. Здесь также действует принцип перегрузки. Мышцы могут болеть по принципу перегрузки, потому что организм не привык к повышенному объему работы.
Тренеры также должны помнить, что болезненные ощущения нельзя полностью устранить во время тренировок. Спортсменам не обязательно болеть на каждой тренировке, чтобы стать лучше. Однако при сильном повреждении мышц возникнет болезненность, независимо от мер предосторожности и добавок. Тренеры знают, как ограничить интенсивность мышечной болезненности.Тренировки должны включать в себя общую разминку, конкретную разминку, вводить упражнения от простого к сложному, от простого к сложному и включать время восстановления во всех тренировках.
Лактат — это хорошо, но это не молочная кислота
Производство лактата не вызывает ацидоз, на самом деле все наоборот. Производство лактата во время интенсивных упражнений предотвращает накопление пирувата и обеспечивает НАД (+), необходимый для фазы 2 гликолиза (7). Лактат задерживает мышечную усталость и помогает поддерживать высокую работоспособность.
Другая причина мифа о молочной кислоте, вызывающей ацидоз в организме, может быть связана с неправильным представлением о том, что молочная кислота и лактат — одно и то же соединение. Они не. Молочная кислота — это кислота, которая может выделять ион водорода при падении pH ниже 7,0 (8). Однако человеческий организм НЕ производит молочную кислоту. Лактат (не кислота) является продуктом побочной реакции гликолиза.
Лактат может быть в мышцах во время восстановления. Однако в течение нескольких часов после завершения тренировки лактат полностью удаляется из мышц.На следующий день, когда проводится восстановительная тренировка, его не будет в мышцах.
Почему запуски восстановления действительно работают?
Recovery работает. Больные легкоатлеты чувствуют себя лучше после их завершения, что очень похоже на «промывочные» тренировки в бодибилдинге старой школы. (Кстати, легкая атлетика — не единственный вид спорта, в котором восстановительные тренировки до сих пор называются «промыванием молочной кислоты». Распространенная ошибка — это почти эпидемия в словарях западных спортивных тренеров, и это первоисточник этой статьи.)
Распространенная ошибка — это почти эпидемия в словарях западных спортивных тренеров, и это первоисточник этой статьи.)
Понимание восстановления — это ключ к пониманию того, почему восстановление работает нормально. Восстановление можно определить как способность организма повторять или превосходить производительность после усилия. Это включает в себя нормализацию физиологических функций (артериальное давление и частоту сердечных сокращений), восстановление запаса энергии (глюкозы и гликогена) и восполнение клеточных ферментов (таких как фосфофруктокиназа). Восстановление также характеризуется непрерывным удалением конечных продуктов метаболизма (9 ). Восстановление мышц происходит во время и после тренировок.
Восстановление важно во всех тренировках и планируется в микро- и макроциклах. Как долго отдыхать между подходами, чтобы повторить выступление? Как долго между тренировками можно повысить производительность? Эти вопросы особенно важны в легкой атлетике. В таких видах спорта, как баскетбол или американский футбол, спортсмены должны уметь прыгать и ускоряться, когда они не полностью оправились от усилий.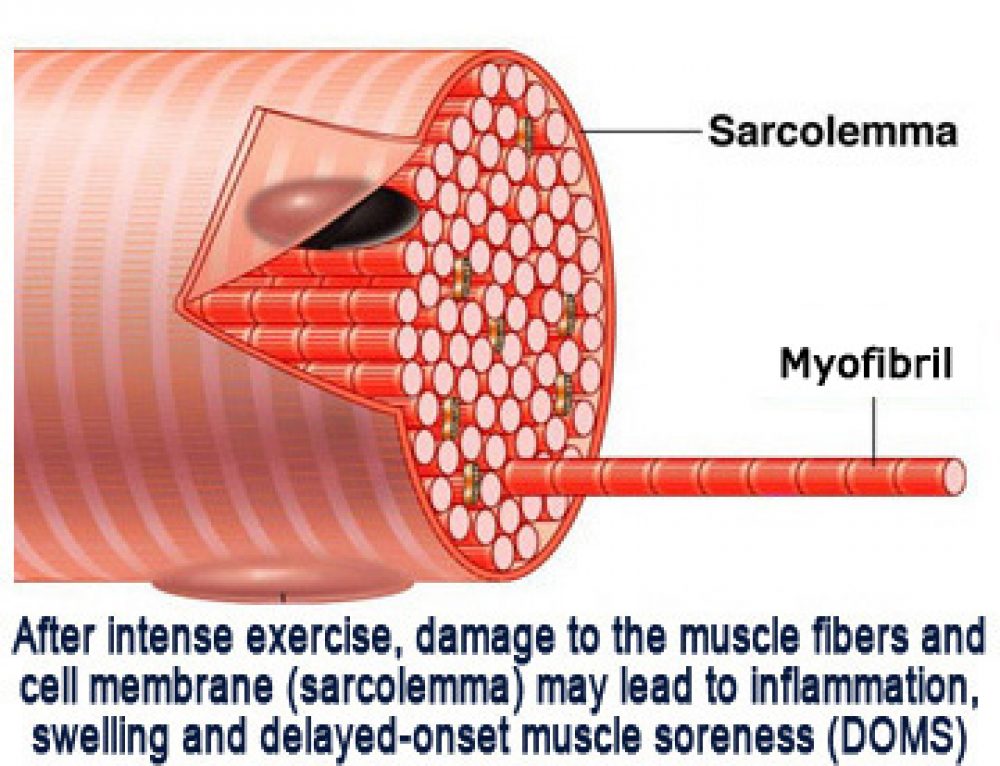 Тренеры по бегу могут планировать регулярные интервалы отдыха во время тренировки.
Тренеры по бегу могут планировать регулярные интервалы отдыха во время тренировки.
Восстановительные тренировки помогают организму за счет кислорода, разогревающего эффекта, тренировочного эффекта и гормонов роста. Восстановительная тренировка увеличивает частоту сердечных сокращений и, в свою очередь, увеличивает потребление кислорода. Кровь доставляет кислород в мышцы, а кислород способствует заживлению. Восстановительные бега также разогревают мышцы, что снимает боль от скованности.
Легкие тренировки по-прежнему дают телу тренировочный эффект. Тренировки способствуют моделированию мышц и увеличивают выработку гормонов роста.Эти соединения в сочетании с кислородом уменьшают воспаление и восстанавливают поврежденные мышцы, снимая болезненность и улучшая функции.
Заключение
Целью этой статьи было перевести терминологию восстановительной тренировки в слова, которые современные спортсмены понимают и уважают. Современное общество очень чувствительно к лексике. Как сказано в Tao Te Ching : «Идеальные слова не оставляют сомнений».
Как сказано в Tao Te Ching : «Идеальные слова не оставляют сомнений».
Тренеры больше не могут использовать слова «молочная кислота» при описании причины жжения или болезненности мышц.Молочная кислота отсутствует в организме человека. Ионы водорода вызывают ожог. Лактат действительно способствует гликолизу. Тело болит из-за повреждения мышц и последующего воспаления. К моменту восстановления на следующий день лактата в мышцах нет.
Тренеры больше не могут использовать фразу «промыть молочную кислоту», чтобы объяснить, почему спортсмены завершают бег. Скажите: «Это упражнение способствует заживлению мышц за счет увеличения количества кислорода и гормонов роста в воспаленных мышцах» или просто «этот восстановительный бег заставит вас почувствовать себя лучше.”
Сегодняшний ученик хочет знать, почему он делает то, что делает, и его учат задавать вопросы. Тренеры должны быть готовы к правильным ответам.
Каталожные номера:
1. Джей Дж. Вейцман PD (1987). Цикл лимонной кислоты Кребса: полвека и все еще меняется. Лондон: Биохимическое общество , стр. 25
Джей Дж. Вейцман PD (1987). Цикл лимонной кислоты Кребса: полвека и все еще меняется. Лондон: Биохимическое общество , стр. 25
2. Смит, А. Д., Датта, С. П., Смит, Г. Ховард, Кэмпбелл, П. Н., Бентли, Р., (редакторы) и др. (1997) Оксфордский словарь по биохимии и молекулярная биология .Нью-Йорк: Издательство Оксфордского университета.
3. Моран, Пол; Причард, Джонатан Дж. Ансли, Лес; Ховатсон, Глин. Влияние места взятия пробы лактата крови на назначение упражнений. Журнал исследований силы и кондиционирования , февраль 2012 г. — том 26 — выпуск 2 — стр. 563-567
4. Оуэн Андерсон, доктор философии. Буферы, истребители водорода, Runner’s World , 27 февраля 2017 г.
5. Циммерман, К. Leidl, K; Kasha, C, et al. Центральная проекция боли, возникающей из-за отсроченного начала мышечной болезненности (DOMS) у людей. PLoS One , 2012 г .; 7 (10): e47230. DOI: 10.1371 / journal.pone.0047230
6. Томас Р. Бэкл, Роджер У. Эрл, редакторы. Основы силовых тренировок и кондиционирования . Третье издание. Национальная ассоциация силы и физической подготовки.
Основы силовых тренировок и кондиционирования . Третье издание. Национальная ассоциация силы и физической подготовки.
7. Робергс Р.А., Гайсианд Ф. и Паркер Д. 2004. Биохимия метаболического ацидоза, вызванного физической нагрузкой. Американский журнал физиологии — регуляторная, интегративная и сравнительная физиология , 287, R502-16
8. Лен Кравиц, доктор философии. Ассоциация здоровья и фитнеса IDEA . Лактат — невиновен по обвинению. 01 июня 2005 г.
9. Джонатан Н. Майк, М.С. и Лен Кравиц, доктор философии. Восстановление на тренировке: важнейший ингредиент. Ассоциация здоровья и фитнеса IDEA . 02 февраля 2009 г.
Кен Кашубара является сертифицированным специалистом по силовой и кондиционной подготовке и сертифицированным тренером USTF уровня 1. Он имеет сертификаты личного тренера Национальной академии спортивной медицины и Американского совета по упражнениям, а также имеет множество других сертификатов, связанных со спортом и фитнесом. Он тренировал участников национальной квалификации по легкой атлетике, теннису, художественной гимнастике и фигурному катанию. Кен опубликовал более 255 статей о здоровье и фитнесе, а его труды вошли в три книги. Он руководит одобренным USATF клубом Sport Heaven в своем тренажерном зале в Блумфилд-Хиллз, штат Мичиган.
Он тренировал участников национальной квалификации по легкой атлетике, теннису, художественной гимнастике и фигурному катанию. Кен опубликовал более 255 статей о здоровье и фитнесе, а его труды вошли в три книги. Он руководит одобренным USATF клубом Sport Heaven в своем тренажерном зале в Блумфилд-Хиллз, штат Мичиган.
Мышцы как предполагаемый продуцент кислой α-глюкозидазы для генной терапии гликогеноза II типа | Молекулярная генетика человека
Аннотация
Гликогеноз II типа (GSD II) — это лизосомное заболевание, поражающее скелетные и сердечные мышцы.При младенческой форме заболевания у пациентов наблюдается нарушение сердечной деятельности, которое приводит к летальному исходу до 2 лет жизни. Пациенты с ювенильными или взрослыми формами могут иметь поражение диафрагмы, ведущее к дыхательной недостаточности. Ферментативный дефект в GSD II является результатом мутаций в гене кислой α-глюкозидазы (GAA), который кодирует белок 76 кДа, участвующий во внутрилизосомном гидролизе гликогена. Ранее мы сообщали об использовании аденовирусного вектора, экспрессирующего GAA (AdGAA), для трансдукции культур миобластов и мышечных трубок от пациентов с GSD II.Трансдуцированные клетки секретировали GAA в среде, и GAA интернализовался посредством рецептор-опосредованного захвата, что позволяло гидролиз гликогена в нетрансдуцированных клетках. В этом исследовании на мышиной модели GSD II мы оценили возможность генной терапии GSD II с использованием мышц в качестве секреторного органа. Аденовирусный вектор, кодирующий AdGAA, вводили новорожденным в икроножную мышцу. Мы обнаружили сильную экспрессию GAA в инъецированной мышце, секрецию в плазму и захват периферическими скелетными мышцами и сердцем.Более того, в этих тканях было снижено содержание гликогена. Электронная микроскопия показала исчезновение очагов деструкции, обычно присутствующих у нелеченных мышей. Таким образом, мы впервые демонстрируем, что мышцы можно рассматривать как безопасный и легко доступный орган для генной терапии GSD II.
Ранее мы сообщали об использовании аденовирусного вектора, экспрессирующего GAA (AdGAA), для трансдукции культур миобластов и мышечных трубок от пациентов с GSD II.Трансдуцированные клетки секретировали GAA в среде, и GAA интернализовался посредством рецептор-опосредованного захвата, что позволяло гидролиз гликогена в нетрансдуцированных клетках. В этом исследовании на мышиной модели GSD II мы оценили возможность генной терапии GSD II с использованием мышц в качестве секреторного органа. Аденовирусный вектор, кодирующий AdGAA, вводили новорожденным в икроножную мышцу. Мы обнаружили сильную экспрессию GAA в инъецированной мышце, секрецию в плазму и захват периферическими скелетными мышцами и сердцем.Более того, в этих тканях было снижено содержание гликогена. Электронная микроскопия показала исчезновение очагов деструкции, обычно присутствующих у нелеченных мышей. Таким образом, мы впервые демонстрируем, что мышцы можно рассматривать как безопасный и легко доступный орган для генной терапии GSD II.
ВВЕДЕНИЕ
Болезнь накопления гликогена типа II (GSD II) — аутосомно-рецессивное заболевание, вызванное мутациями в гене кислой α-глюкозидазы (GAA) (EC 3.2.1.3), который у человека расположен в 17q23 (1, 2). Физиологическая роль GAA заключается в гидролизе внутрилизосомального гликогена путем расщепления гликозидных связей α-1,4 и α-1,6 при кислом pH. Таким образом, глюкоза, попадающая в цитозоль, используется для энергетических нужд клеток.
При дефиците GAA гликоген накапливается в лизосомах, что приводит к повреждению тканей, в основном в скелетных мышцах, сердце и диафрагме. У пациентов с младенческой формой заболевания наблюдается генерализованная гипотония и тяжелая кардиомиопатия, приводящая к смерти до 2 лет жизни.У молодых и взрослых пациентов развивается прогрессирующая мышечная слабость, а в некоторых случаях поражение диафрагмы может вызвать дыхательную недостаточность. Гетерогенность фенотипов в определенной степени отражает множественность мутаций (3–5). В настоящее время для пациентов с GSD II не существует лечебного лечения.
В настоящее время для пациентов с GSD II не существует лечебного лечения.
Созревание GAA является результатом многоступенчатой обработки прекурсорных форм. Фермент синтезируется в виде предшественника 110 кДа, который гликозилируется и фосфорилируется по остаткам маннозы в эндоплазматическом ретикулуме и аппарате Гольджи (6).Эти модификации позволяют ему перемещаться через рецептор манноза-6-фосфата (M6P), который является общим для всех лизосомальных гидролаз (7). Предшественник может идти к лизосомам двумя разными путями. Он главным образом нацелен на лизосомы после внутриклеточного переноса рецепторов M6P, но также может секретироваться во внеклеточную среду. Внеклеточный GAA может поглощаться повсеместно распространенными рецепторами M6P на клеточной поверхности и следовать по пути эндоцитоза к лизосомам. Также был описан M6P-независимый путь поглощения GAA (8).Промежуточный предшественник 95 кДа образуется в поздней эндосоме / лизосоме. Формы белка 76 и 70 кДа образуются в результате последнего внутрилизосомного расщепления предшественников тиоловыми протеиназами при кислом pH (6). Таким образом, этот паттерн трафика GAA обеспечивает основу терапевтической стратегии GSD II, поскольку присутствие GAA в кровотоке позволяет распространяться во все периферические органы. В пользу этой терапевтической стратегии достаточно частичной коррекции на 20% нормального уровня ферментов, чтобы избежать симптомов: «пациенты с псевдодефицитом» с такой активностью> 20% не имеют симптомов.
Таким образом, этот паттерн трафика GAA обеспечивает основу терапевтической стратегии GSD II, поскольку присутствие GAA в кровотоке позволяет распространяться во все периферические органы. В пользу этой терапевтической стратегии достаточно частичной коррекции на 20% нормального уровня ферментов, чтобы избежать симптомов: «пациенты с псевдодефицитом» с такой активностью> 20% не имеют симптомов.
Были созданы хорошо охарактеризованные мышиные модели GSD II (9, 10). Эти мыши с нокаутом ( GAA — / — ) полностью дефицитны по GAA и имеют общее внутрилизосомное накопление гликогена (10). У них проявляются как ранние, так и поздние признаки болезни, с огромным накоплением гликогена в сердце и прогрессирующим мышечным истощением.
Один из способов доставки GAA — это прямая внутривенная инъекция рекомбинантного фермента. Bijvoet et al. (11, 12) показали, что «замена фермента» исправляет дефицит фермента и накопление гликогена в модели GSD II на мышах. Кроме того, в настоящее время проводятся клинические испытания для изучения возможности замены ферментов у пациентов с GSD II (13, 14). Это лечение уже разработано для лечения болезни Гоше (15), и результаты клинических испытаний болезни Фабри также убедительны (16, 17). Тем не менее, замена ферментов очень дорога и ограничивает пациентов. Более того, у некоторых пациентов повторная инъекция рекомбинантного фермента индуцирует нейтрализующие антитела, появление которых ставит под угрозу успех лечения (18).В качестве альтернативного подхода генная терапия может минимизировать эти неудобства, обеспечивая непрерывное производство-секрецию-повторный захват фермента. Действительно, трансдукция ограниченного пула клеток должна обеспечивать системную секрецию фермента и его захват пораженными периферическими органами. Два основных органа — печень и мышцы — успешно используются для производства и секреции терапевтических белков в кровоток. Мышцы — привлекательная цель, учитывая, что мышечная масса составляет значительную часть тела.Успешная секреция в кровоток была получена для фактора IX (19), эритропоэтина (20) и нейротрофического фактора NT-3 (21). Печень является хорошим продуцентом лизосомальных ферментов (22, 23). Группа Амальфитано (24) сообщила об использовании аденовирусного вектора для трансдукции печени у мышей GAA — / — и последующей ферментативной коррекции в периферических органах.
Здесь мы исследовали потенциал мышечной генной терапии для лечения GSD II.Внутримышечная инъекция — безопасный и простой способ введения вектора. Ранее в нашей лаборатории был сконструирован аденовирусный вектор, кодирующий человеческий GAA (AdGAA), и охарактеризовал его in vitro (25). AdGAA трансдуцировал миобласты и мышечные трубки от пациентов с GSD II. Трансдуцированные клетки сверхэкспрессировали GAA в среду, и внеклеточный GAA поглощался нетрансдуцированными клетками. Более того, в исправленных нетрансдуцированных клетках накопление гликогена было снижено. Здесь мы изучили потенциал этого вектора in vivo в мышцах мышей GAA — / — .AdGAA вводили на 4-й день после рождения в икроножную мышцу. Мы полагаем, что наши результаты обнадеживают, поскольку мы получили ферментативную коррекцию в пораженных периферических органах, что привело к значительному снижению содержания внутрилизосомального гликогена, демонстрируя, что секреция скелетными мышцами позволяет широко корректировать GSD II.
РЕЗУЛЬТАТЫ
Внутримышечное введение AdGAA приводит к сверхэкспрессии GAA в инъецированной мышце
Чтобы проверить способность AdGAA in vivo выводить GAA на терапевтическом уровне, мыши GAA — / — получали 5 × 10 8 БОЕ AdGAA в правую икроножную мышцу на 4-й день после рождения.Используя AdLacZ в качестве контроля, мы оценили, что приблизительно 30% всех волокон икроножной мышцы трансдуцировались через 2 недели после инъекции (не показано). Активность GAA оценивали в инъецированной мышце через 2, 4 и 13 недель после инъекции и достигли 138 ± 11, 295 ± 39 и 786 ± 66 нмоль / ч / мг белка, соответственно (рис. 1). Эти активности превышали те, которые были проанализированы в нормальной мышце (C57 / B16), которые показали 7,5 ± 0,3 нмоль / ч / мг белка, тогда как у необработанных мышей GAA — / — активность GAA была равна 0.3 ± 0,06 нмоль / ч / мг белка.
Чтобы дополнительно охарактеризовать GAA в инъецированной мышце, мы проанализировали изоферменты с помощью ионообменной хроматографии на колонках DEAE-целлюлоза (рис. 2). Анализировали как кислотную (pH 4,0, черные точки), так и нейтральную (pH 6,5, белые точки) активности α-глюкозидазы. Вся активность кислой α-глюкозидазы из нормальной мышцы выражалась в двух пиках: один элюировался 0,02 м NaCl, а второй — градиентом 0,02–0,3 м NaCl (рис. 2 A). Как определено с помощью вестерн-блоттинга (не показан), эти два пика соответствуют зрелым полипептидам кислой α-глюкозидазы 70 и 76 кДа.Никакой активности не было обнаружено у мышей GAA — / — , проанализированных в идентичных условиях (фиг. 2B). В инъецированной мышце мышей GAA — / — , обработанных AdGAA, восстановились две зрелые формы кислой α-глюкозидазы (фиг. 2С). Примечательно, что активность этих двух пиков была в сто раз выше нормального уровня. Характер элюирования и относительное распределение активности GAA были идентичны тем, которые наблюдались в нормальных мышцах. Кроме того, обработка AdGAA вызвала дополнительный пик активности, не удерживаемый колонкой (слева).Этот дополнительный пик соответствовал форме предшественника (вестерн-блоттинг не показан). Эта форма никогда не выявлялась в нормальных мышцах. Активность GAA при нейтральном pH анализировали в качестве контроля: она выражалась в нескольких пиках в нормальной мышце, и картина у мышей GAA — / — , леченных или нет, имела по существу тот же профиль.
На рисунке 3 A мы сообщаем о характере экспрессии GAA в инъецированной мышце. Он показывает очень высокие количества зрелых форм 70 и 76 кДа и внутриклеточного предшественника 95 кДа.Более того, сверхэкспрессия GAA визуализируется присутствием предшественника 110 кДа, который является секретируемой формой фермента.
Секреция GAA в плазму
Чтобы проверить, секретируется ли сверхэкспрессированный GAA в инъецированной мышце в кровоток, тестировали присутствие GAA в плазме. GAA не обнаруживался в плазме мышей дикого типа и в необработанной GAA — / — плазме. Вестерн-блоттинг показал, что форма предшественника 110 кДа присутствует в плазме мышей, которым инъецировали AdGAA (рис.3 В).
Перед тем, как проанализировать распределение фермента в периферических органах, мы задались вопросом, является ли системный GAA следствием непрямой трансдукции других тканей после внутримышечной инъекции. Печень является предпочтительной мишенью циркулирующего аденовирусного вектора (26). Таким образом, если векторные частицы могут попасть в кровоток, некоторые печеночные клетки могут трансдуктироваться, что приведет к системной секреции ферментов. Чтобы исключить эту возможность, мы проанализировали активность β-галактозидазы (окрашивание X-gal) в печени животных, которым в мышцу вводили вектор AdLacZ; однако окрашивания X-gal обнаружено не было (данные не показаны).Более того, чтобы проверить, присутствуют ли вирусные частицы в этой ткани, мы проанализировали ДНК из печени с помощью ПЦР-амплификации фрагмента, перекрывающего аденовирусный остов и кДНК человеческого GAA. В качестве положительного контроля использовали образец ДНК печени животного, которому внутривенно вводили AdGAA (рис. 4). В образцах животных, которым внутримышечно вводили этот вектор, амплификации не получено. Этот результат свидетельствует об отсутствии или очень ограниченном прохождении вирусных частиц через кровоток во время внутримышечной инъекции.
Активность GAA восстанавливается в пораженных периферических мышцах после внутримышечной инъекции
Как описано выше, наши данные показывают, что мышца, в которую инъецировали AdGAA, способна секретировать GAA в кровоток. Контралатеральная икроножная мышца служила регулятором поглощения ферментов на расстоянии. Мы обнаружили активность GAA в контралатеральной мышце через 2 недели (5,6 ± 2,9 нмоль / час / мг белка), через 4 недели (17 ± 6 нмоль / час / мг белка) и через 13 недель после введения (4,5 ± 1,3 нмоль / час / мг белка). мг белка), тогда как он находился на фоновом уровне в GAA — / — необработанной мышце (рис.5).
АктивностьGAA в контралатеральной мышце мышей GAA — / — , обработанных AdGAA, также анализировали с помощью ионообменной хроматографии, как описано выше. Паттерн кислой α-глюкозидазы был сопоставим с паттерном, наблюдаемым для инъецированной мышцы, с тремя пиками сортировки, соответствующими двум зрелым формам и форме-предшественнику (фиг. 2 D). Общая активность была в пределах нормы по сравнению с мышами дикого типа (C57 / B16).
Сердце, орган, пораженный в основном детской формой GSD II, также был протестирован на восстановление GAA.Активность фермента в сердце обработанных мышей GAA — / — , проанализированных через 2, 4 и 13 недель после инъекции, соответствовала 0,4 ± 0,2, 0,35 ± 0,2 и 0,52 ± 0,4 нмоль / ч / мг белков, соответственно. Активность GAA в нормальном сердце достигала 4,0 нмоль / ч / мг белка, тогда как в сердце с дефицитом GAA она находилась на фоновом уровне (рис. 6).
Внутриклеточный клиренс гликогена у мышей, получавших внутримышечное введение AdGAA
Для определения функциональности секретируемого мышцами фермента количественно определяли внутриклеточный гликоген в скелетных мышцах (см. Материалы и методы).У животных, получавших AdGAA, гликоген снижался как в инъецированной мышце с 3 ± 1,2 нмоль высвобожденной глюкозы / час / мг белка, так и в контралатеральной мышце с 5 ± 1,8 нмоль высвобожденной глюкозы / час / мг белка, по сравнению с GAA. — / — мышцы (47 ± 18 нмоль высвобожденной глюкозы / час / мг белка) через 13 недель (рис. 7).
Мы также проверили содержание внутриклеточного гликогена с помощью гистологического анализа. Окрашивание периодической кислотой-Шиффом (PAS) подтвердило, что запасы гликогена были уменьшены в мышцах мышей, получавших AdGAA, с более низкой интенсивностью окрашивания как в инъецированных, так и в неинъектированных контрлатеральных мышцах по сравнению с мышцами GAA — / — (рис.8). Уровни оказались близкими к нормальным (очень слабое окрашивание). В сердце окрашивание PAS также показало видимое снижение содержания гликогена у мышей, обработанных AdGAA, с незначительным розовым окрашиванием по сравнению с интенсивным окрашиванием, наблюдаемым у контрольных мышей GAA — / — .
Электронно-микроскопический анализ мышц после обработки AdGAA
Кроме того, мы исследовали с помощью электронной микроскопии структурный аспект мышечной ткани и внутрилизосомный материал.Многочисленные заполненные гликогеном вакуоли (черная стрелка) были обнаружены в мышце GAA — / — (рис.9 B, F) и сопровождались большими очагами деструкции, состоящими из мультимембранных вакуолей, присутствующих в каждом миофибрилле (рис. 9 В). Эти патологические проявления отсутствовали в нормальной мышце (рис. 8А). Наши результаты показали, что мышца, инъецированная AdGAA, напоминала нормальную мышцу без вакуолей или очагов разрушения (рис. 9 C). Однако контралатеральная мышца все еще содержала заполненные гликогеном вакуоли, хотя мы не обнаружили гранул деструкции (рис.9 D).
ОБСУЖДЕНИЕ
Генная терапия, по-видимому, является привлекательным методом лечения лизосомных заболеваний, поскольку трансдукция ограниченного пула клеток, способных секретировать лизосомальный фермент в кровотоке, может позволить широко распространенную ферментативную коррекцию. Лизосомные ферменты, попав в кровоток, могут интернализоваться повсеместно распространенными рецепторами M6P и затем доставляться в лизосомы через эндоцитарный путь. Терапевтическому процессу способствует тот факт, что частичного восстановления примерно 10–20% нормальной ферментативной активности достаточно для предотвращения клинического исхода.Печень может быть мишенью для переноса генов, и о ее использовании для секреции GAA уже сообщалось в модели GSD II на мышах (27). Здесь мы исследовали внутримышечную доставку терапевтического гена, поскольку это проще, чем внутривенная инъекция.
Используя AdGAA, мы продемонстрировали, что мышцы могут обеспечивать эффективную системную секрецию GAA. Аденовирусный вектор вводили в неонатальном периоде, поскольку трансдукция усиливается за счет присутствия незрелых мышечных клеток с более высокой плотностью рецепторов интернализации, чем на поверхности зрелых мышечных клеток (28).Более того, иммунный ответ против аденовирусных векторов первого поколения был ограничен на этой стадии, что увеличивало продолжительность экспрессии, как описано ранее (29, 30). Используя эти условия, мы получили высокую экспрессию GAA в инъецированной мышце через 13 недель после инъекции. Инъецированная мышца продуцировала лизосомные зрелые формы фермента 70 и 76 кДа, как и в нормальной мышце, но также и сильную экспрессию формы-предшественника 110 кДа. Эта сверхэкспрессированная форма-предшественник частично секретировалась в кровоток.Форма, обнаруженная в плазме, имеет кажущуюся молекулярную массу немного выше, чем в контрольном образце, но это различие можно объяснить очень высокой концентрацией белка в образцах плазмы после концентрирования, что нарушает миграцию. Ссылаясь на литературу, этот секретируемый предшественник должен иметь форму 110 кДа. Затем этот предшественник был обнаружен на расстоянии, так как он был обнаружен в нетрансдуцированной контралатеральной мышце. Перекрестная коррекция подтверждается тем, что в инъецированной мышце появился третий пик (рис.2С, слева) в дополнение к двум пикам зрелых форм, присутствующих в нормальной мышце. Этот дополнительный пик соответствовал сверхэкспрессированной форме предшественника, которая также присутствовала в контралатеральной мышце в качестве маркера поглощения предшественника из кровообращения, который еще не был переработан в зрелые формы. Более того, этот предшественник перемещался в лизосомы, что подтверждается присутствием двух зрелых форм GAA в контрлатеральной мышце. Общая активность зрелых ферментов достигала пика, превышающего половину нормального уровня в любой момент исследования как в трансдуцированных, так и в нетрансдуцированных мышцах.Однако у нас еще нет объяснения, почему в контрлатеральной мышце активность GAA была выше через 4 недели после инъекции, чем через 13 недель после инъекции, в то время как активность в инъецированной мышце увеличивалась. Этот эффект можно объяснить сниженным потенциалом секреции GAA зрелыми мышцами по сравнению с более молодой тканью. Следовательно, уменьшение секреции, скорее всего, приведет к увеличению внутриклеточной активности GAA в инъецированной мышце и снижению коррекции GAA на расстоянии.Тем не менее, восстановленная ферментативная активность была достаточной для уменьшения накопленного гликогена, количественно определяемого биохимическими анализами, а также визуализированного с помощью гистологического анализа, и для улучшения внешнего вида фенотипа как в инъецированных, так и в контрлатеральных мышцах. Электронная микроскопия подтвердила заметные положительные эффекты рекомбинантного фермента в скелетных мышцах через 13 недель. Большие вакуоли, заполненные накопленным гликогеном, присутствовали повсеместно в мышце GAA — / — , но полностью отсутствовали в инъецированной мышце обработанных животных.Однако вакуоли были уменьшены, но все еще присутствовали в контралатеральной мышце обработанных животных, у которых активность GAA была намного ниже, чем в инъецированной мышце. Примечательно, что большие литические очаги были обнаружены в каждой клетке мышцы GAA — / — , что свидетельствует о разрушении ткани, что может отражать миопатический фенотип, связанный с заболеванием. Фенотип инъецированной мышцы был в основном нормальным, показывая лишь небольшую неравномерность структуры. Такие эффекты можно объяснить введением аденовирусного вектора.Однако мы можем утверждать, что улучшение произошло за счет коррекции GAA, а не за счет инъекции аденовируса, поскольку ткани животных, получавших AdLacZ, были аналогичны тканям необработанных животных в отношении разрушения и количества вакуолей (данные не показаны). В противоположной мышце разрушение ткани также предотвращалось рекомбинантным ферментом. В сердечной ткани восстановление ферментов было умеренным. Тем не менее, этот уровень оказался достаточным для гидролиза захваченного гликогена, что продемонстрировано окрашиванием PAS.
Таким образом, данное исследование является первым отчетом, демонстрирующим способность мышц секретировать лизосомальный фермент после трансдукции in vivo вирусным вектором. Однако другое исследование с использованием той же модели GSD II на мышах продемонстрировало, что после внутримышечной инъекции секреция GAA не наблюдалась (27). Это различие можно объяснить (i) тем фактом, что инъекцию аденовирусного вектора проводили взрослым мышам, в то время как эффективность трансдукции зрелых мышечных клеток этим вектором является слабой (28) и (ii) более низкой способностью зрелых ткань, чтобы секретировать GAA.Наш результат согласуется с результатом Raben et al. (31), показывающий, что условная мышечно-специфическая экспрессия GAA может спасти GAA — / — мышей, что приводит к секреции фермента и коррекции периферических органов. Альтернативный путь переноса, не охарактеризованный четко, но независимый от рецептора M6P, также может способствовать секреции мышцами этого конкретного лизосомального фермента (8).
С целью использования мышц как органа, продуцирующего ферменты, вектор аденоассоциированного вируса (AAV) может рассматриваться как хороший терапевтический инструмент.Было показано, что такой вектор очень эффективно трансдуцирует мышечные клетки, обеспечивая долгосрочную экспрессию (32). Тем не менее его использование для терапии GSD II ограничено его низкой способностью к клонированию. Альтернативный способ введения генов в мышцы — электроперенос голой ДНК. Этот метод представляется потенциально безопасным, неинвазивным и недорогим терапевтическим подходом, который доказал свою эффективность в отношении секреции терапевтических молекул в кровоток (33, 34). Более того, перенос генов в мышцах обеспечивает лучшую долгосрочную секрецию на животных моделях (32, 35).Поэтому с использованием этого органа были начаты некоторые клинические испытания (36).
В дополнение к эффективной доставке мышцами терапевтические белки можно модифицировать, чтобы улучшить их способность пересекать биологические мембраны путем связывания с доменом трансдукции белка (37, 38). Это улучшение может быть очень привлекательным для терапии GSD II, поскольку оно может увеличить доступ GAA ко всем мышцам и особенно к сердцу, где в нашем исследовании наблюдалось ограниченное проникновение.Этот метод также может позволить ферменту преодолеть гематоэнцефалический барьер и широко распространиться по мозгу. Недавно было высказано предположение о возможном патологическом участии накопления гликогена в центральной нервной системе (ЦНС) при младенческой форме GSD II (39). Таким образом, такая модификация терапевтических белков может открыть новые перспективы в лечении лизосомных нарушений с поражением ЦНС.
Между тем, наши результаты демонстрируют, что GAA может секретироваться после эффективной трансдукции мышцы, а затем повторно захватываться нетрансдуцированными тканями, включая скелетные мышцы и сердце.Уровень ферментативной коррекции в этих тканях, расположенных на расстоянии от вводимой мышцы, достаточен для уменьшения перегрузки гликогеном и предотвращения образования очагов деструкции. Эти данные позволяют с оптимизмом смотреть на перспективы генной терапии GSD II.
МАТЕРИАЛЫ И МЕТОДЫ
Животные и введение рекомбинантного аденовирусного вектора
Мы использовали вектор аденовируса с делецией E1 – E3, содержащий кДНК GAA человека под контролем промотора цитомегаловируса (AdGAA) (25, 40).Аденовирусный вектор, кодирующий ген β-галактозидазы Escherichia coli (AdLacZ), использовали в той же дозе, что служило контролем для внутримышечной инъекции.
GAA-нокаутных ( GAA — / — ) мышей были получены путем замены гена и были полностью дефицитны по активности GAA (10). Они получили 5 × 10 8 БОЕ аденовирусного вектора на 4-й постнатальный день в правую икроножную мышцу. Каждая анализируемая группа мышей (обработанная и контрольная) состояла из трех животных.Контралатеральную (левую) икроножную мышцу использовали для оценки периферического поглощения фермента скелетными мышцами. Животных, которым инъецировали вектор AdLacZ, умерщвляли через 2 недели после инъекции. Животных, которым вводили вектор AdGAA, умерщвляли через 2, 4 или 13 недель после инъекции. Для анализа плазмы образцы крови собирали ретроорбитальным отбором проб в гепаринизированные пробирки непосредственно перед умерщвлением.
Кислотная α-глюкозидаза и анализ белка
Ткани гомогенизировали в буфере (Трис 50 мкм, NaCl 150 мкм, Nonidet P40 0.05% и ДТТ 1 м м) после замораживания в жидком азоте. Анализы проводили на супернатантах, полученных после центрифугирования гомогенатов (20 000 г , 30 мин). Концентрации белка измеряли в соответствии с методом Брэдфорда (набор реагентов для анализа белка Кумасси, PIERCE, 23200).
АктивностьGAA определяли путем расщепления искусственного субстрата, 4-метилумбеллиферил-α- d-глюкозида, при pH 4. Десять микролитров каждого экстракта инкубировали с 50 мкл искусственного субстрата в 96-луночных микротитровальных планшетах в течение 30 минут. мин при 37 ° C.Реакции останавливали добавлением 100 мкл 1,0 М глицина, pH 10. Активность выражали в нмоль / час / мг белка.
DEAE – целлюлозная хроматография
Образцы тканей гомогенизировали в 25 мМ натрий-фосфатном буфере, pH 6,0, а затем обрабатывали ультразвуком и инкубировали в 0,1% (об. / Об.) Детергенте Nonidet P40. Все процедуры выполнялись при 4 ° C. Гомогенаты центрифугировали при 36 000 g в течение 20 мин и супернантанты загружали в колонку объемом 1 мл, предварительно уравновешенную 25 мМ натрий-фосфатным буфером, pH 6.0. После промывания загрузочным буфером белки, оставшиеся на колонке, элюировали 30 мл 0,02 м NaCl в 25 мМ натрий-фосфатном буфере, pH 6,0, с последующим линейным градиентом 0,02–0,3 м NaCl в 60 мл того же раствора. буфер. Наконец, колонку промывали 5 мл 1,0 м NaCl. Скорость потока 0,5 мл / мин. Фракции (1 мл) собирали и анализировали на кислотную и нейтральную α-глюкозидазную активность с использованием 3 мМ 4-метилумбеллиферил-α- d-глюкозида в 0,1 м лимонной кислоте / 0,2 м Na буфере 2 PO 4 , при pH 4 .0 и pH 6,5 соответственно. Реакцию останавливали добавлением 2,850 мл 0,2 м глицин-NaOH буфера, pH 10,4. Флуоресценцию измеряли на флуориметре Perkin Elmer LS 3 (возбуждение 360 нм, испускание 446 нм). Удельные активности выражали в единицах / мг белка.
Вестерн-блот-детекция GAA
Для обнаружения GAA в инъецированной мышце 60 мкг растворимых белков (полученных, как описано ранее) от мыши, которым инъецировали AdGAA, через 4 недели после инъекции, подвергали электрофорезу в SDS – 8% полиакриламидном геле, затем обрабатывали, как описано выше для плазмы. образцы.
Для обнаружения GAA в плазме мы использовали образцы от нормальных мышей C57 / B16, необработанных GAA — / — и обработанных AdGAA мышей GAA — / — через 4 недели после инъекции. GAA сначала иммунопреципитировали с использованием козьих поликлональных антител против человеческого GAA: 100 мкл плазмы смешивали с 50 мкл суспензионного буфера (50 мМ Трис, 150 мМ NaCl, 0,05% Nonidet P40 и 1,0 мМ DTT) и поликлональных козьих антител против человека. GAA-антитела и инкубируют в течение 1 ч при 4 ° C. Протеин-G-агароза (набор для иммунопреципитации (Protein G) Boheringer Mannheim) добавляли к смеси и инкубировали в течение 4 ч при 4 ° C.Затем иммунокомплекс промывали три раза в 50 мМ Трис, 300 мМ NaCl, 0,05% Nonidet P40 и 1,0 мМ DTT и ресуспендировали в буфере Лемлли. Образцы подвергали электрофорезу в SDS – 8% полиакриламидном геле и электропереносили на нитроцеллюлозную мембрану. Мембраны блокировали в 5% обезжиренном молоке, инкубировали с поликлональным козьим антителом против человеческого GAA и зондировали с помощью связанного с пероксидазой антитела против козьего IgG (против козьего IgG, конъюгированного с HRP, Santa Cruz Biotechnology). Сигналы визуализировали с использованием системы обнаружения хемилюминесценции (набор для обнаружения ECL, Amersham Pharmacia).
ПЦР-определение вектора AdGAA в ткани печени
Мы проанализировали ткань мышей через 4 недели после инъекции. ДНК выделяли из образцов печени путем инкубации при 37 ° C в буфере для лизиса (100 мМ Трис – HCl, 5 мМ ЭДТА, 0,2% SDS, 200 мМ NaCl и 100 мкг / мл протеиназы К) и центрифугирования в течение 10 мин при 20 000 г . Выделяли супернатанты и осаждали ДНК равным объемом изопропанола. Затем ДНК очищали классическим фенол-хлороформным методом.ПЦР-амплификацию проводили в условиях, описанных ранее (27).
Определение содержания внутриклеточного гликогена
Внутриклеточный гликоген количественно определяли путем определения высвобождения глюкозы из природного субстрата гликогена, рассчитанного как нмоль / час / мг белка, ферментативным методом с использованием гексокиназы (набор Gluco-quant, Roche). Гомогенаты тканей обрабатывали 33% КОН, кипятили 15 мин и затем хранили на льду 15 мин. Для осаждения гликогена добавляли сульфат натрия и абсолютный этанол, и образцы центрифугировали (1500 г , 10 мин, 4 ° C).Осадок ресуспендировали в 300 мкл раствора уксусной кислоты. Концентрацию гликогена определяли анализом высвобождения глюкозы после переваривания 100 мкл раствора с 0,1 ед. Амилоглюкозидазы Aspergillus niger (Sigma) при 55 ° C в течение 30 мин.
Оптическая и электронная микроскопия для анализа гликогена
Для окрашивания PAS ткани фиксировали в 4% формальдегиде, а затем помещали в парафин. Срезы тканей (5 мкм) окрашивали PAS стандартными методами.
Для электронно-микроскопического анализа ткани фиксировали 2,5% глутаровым альдегидом в течение 1 ч, а затем 0,6% глутаровым альдегидом в физиологическом растворе с фосфатным буфером. Затем ткани фиксировали в 1% OsO 4 в фосфатно-солевом буфере и заливали смолой Epon. Готовили ультратонкие срезы и окрашивали уранил / свинец стандартными методами.
БЛАГОДАРНОСТИ
Мы благодарим Э. Крамер и ее команду за техническую помощь в области электронной микроскопии.Мы благодарим J.E. Guidotti за научные советы и критические комментарии к рукописи и F. Francis за скрупулезное прочтение рукописи. Мы благодарим Vector Core Университета Нанта при поддержке Французской ассоциации миопатий (AFM) за предоставление аденовирусных векторов. Эта работа была поддержана грантами Франкоязычной ассоциации гликогенеза (AFG) и Vaincre les Maladies Lysosomales (VML).
*Кому корреспонденцию следует направлять по адресу: Département de Génétique, Développement et Pathologie Moléculaire, Institut Cochin, INSERM U567, 24 rue du faubourg Saint-Jacques, 75014 Paris, France.Тел: +33 1 44412401; Электронная почта: [email protected]
†Текущий адрес: INSERM U505, Institut des Cordeliers, Париж, Франция.
‡Нынешний адрес: Institut de Génétique Moléculaire de Montpellier, CNRS UMR 5535, Монпелье, Франция.
Рис. 1. Активность фермента GAA в мышцах, которым вводили AdGAA. Мышам вводили на 4-й постнатальный день в икроножную мышцу 5 × 10 8 БОЕ AdGAA. Анализ проводили через 2, 4 и 13 недель после инъекции у мышей C57 / B16 дикого типа, необработанных GAA — / — и обработанных AdGAA GAA — / — мышей.Ферментативные анализы выявили высокое восстановление GAA в инъецированных мышцах (клетчатая полоса, n = 3) по сравнению с мышцами дикого типа (белая полоса, n = 3) и GAA — / — (черная полоса, n). = 3) мышечная активность.
Рис. 1. Активность фермента GAA в мышцах, которым вводили AdGAA. Мышам вводили на 4-й постнатальный день в икроножную мышцу 5 × 10 8 БОЕ AdGAA. Анализ проводили через 2, 4 и 13 недель после инъекции у мышей C57 / B16 дикого типа, необработанных GAA — / — и обработанных AdGAA GAA — / — мышей.Ферментативные анализы выявили высокое восстановление GAA в инъецированных мышцах (клетчатая полоса, n = 3) по сравнению с мышцами дикого типа (белая полоса, n = 3) и GAA — / — (черная полоса, n). = 3) мышечная активность.
Рисунок 2. Характер изоферментов кислой и нейтральной α-глюкозидазы в экстракте скелетных мышц мышей GAA, обработанных AdGAA — / — , полученных с помощью DEAE-целлюлозной хроматографии через 4 недели после инъекции.Белки, удерживаемые колонкой, элюировали серией различных буферов, как описано в разделе «Материалы и методы». Фракции собирали и анализировали на кислую, pH 4,0 (черная точка) и нейтральную, pH 6,5 (белая точка), активность α-глюкозидазы с использованием субстрата 4-метилумбеллиферил-α-d-глюкозида. Представленные образцы мышечных изоферментов соответствовали нормальным мышам C57 / B16 ( A ), GAA — / — необработанной мышце ( B ), GAA — / — инъецированной мышце ( C ) и GAA — / — контралатеральная мышца ( D ).
Рисунок 2. Характер изоферментов кислой и нейтральной α-глюкозидазы в экстракте скелетных мышц мышей GAA, обработанных AdGAA — / — , полученных с помощью DEAE-целлюлозной хроматографии через 4 недели после инъекции. Белки, удерживаемые колонкой, элюировали серией различных буферов, как описано в разделе «Материалы и методы». Фракции собирали и анализировали на кислую, pH 4,0 (черная точка) и нейтральную, pH 6,5 (белая точка), активность α-глюкозидазы с использованием субстрата 4-метилумбеллиферил-α-d-глюкозида.Представленные образцы мышечных изоферментов соответствовали нормальным мышам C57 / B16 ( A ), GAA — / — необработанной мышце ( B ), GAA — / — инъецированной мышце ( C ) и GAA — / — контралатеральная мышца ( D ).
Рисунок 3. Иммунодетекция hGAA в инъецированной мышце и в плазме. ( A ) Инъецированная мышца (Inj.M.) представила четыре формы GAA, включая зрелые формы 70 и 76 кДа, внутриклеточный промежуточный предшественник 95 кДа и предшественник 110 кДа, который был секретируемой формой фермента. .( B ) Для обнаружения в плазме GAA иммунопреципитировали из 100 мкл плазмы, как описано в разделе «Материалы и методы». Положительный контроль состоит из 20 мкг экстракта общего белка из стабильного клона, сверхэкспрессирующего GAA. Никаких специфических сигналов не было обнаружено ни в нормальной плазме мышей C57 / B16 (1), ни в GAA — / — (2). У животных, получавших AdGAA (3), GAA присутствует в виде предшественника 110 кДа, секретируемого мышцами.
Рисунок 3. Иммунодетекция hGAA в инъецированной мышце и в плазме.( A ) Инъецированная мышца (Inj.M.) представила четыре формы GAA, включая зрелые формы 70 и 76 кДа, внутриклеточный промежуточный предшественник 95 кДа и предшественник 110 кДа, который был секретируемой формой фермента. . ( B ) Для обнаружения в плазме GAA иммунопреципитировали из 100 мкл плазмы, как описано в разделе «Материалы и методы». Положительный контроль состоит из 20 мкг экстракта общего белка из стабильного клона, сверхэкспрессирующего GAA. Никаких специфических сигналов не было обнаружено ни в нормальной плазме мышей C57 / B16 (1), ни в GAA — / — (2).У животных, получавших AdGAA (3), GAA присутствует в виде предшественника 110 кДа, секретируемого мышцами.
Рисунок 4. Обнаружение вирусных частиц с помощью ПЦР в печени мышей, которым вводили внутримышечно AdGAA. Тотальную ДНК очищали из печени мышей GAA, — / — : необработанных мышей (1), мыши, инъецированной внутривенно AdGAA (2) и мыши, инъецированной внутримышечно AdGAA (3). Специфические праймеры для вектора AdGAA позволяли амплифицировать полосу длиной 800 п.н. только у мыши с внутривенной инъекцией.
Рис. 4. Обнаружение ПЦР вирусных частиц в печени мышей, которым вводили внутримышечно AdGAA. Тотальную ДНК очищали из печени мышей GAA, — / — : необработанных мышей (1), мыши, инъецированной внутривенно AdGAA (2) и мыши, инъецированной внутримышечно AdGAA (3). Специфические праймеры для вектора AdGAA позволяли амплифицировать полосу длиной 800 п.н. только у мыши с внутривенной инъекцией.
Фиг. 5. Активность GAA в контралатеральной мышце мышей, которым инъецировали GAA — / — AdGAA.Активность фермента в контралатеральной мышце (клетчатая полоса, n = 3) была частично восстановлена по сравнению с ферментом дикого типа (белая полоса, n = 3) и GAA — / — (черная полоса, n ). = 3) мышечная активность через 2, 4 и 13 недель после инъекции.
Фиг. 5. Активность GAA в контралатеральной мышце у мышей, которым вводили GAA — / — AdGAA. Активность фермента в контралатеральной мышце (клетчатая полоса, n = 3) была частично восстановлена по сравнению с ферментом дикого типа (белая полоса, n = 3) и GAA — / — (черная полоса, n ). = 3) мышечная активность через 2, 4 и 13 недель после инъекции.
Рисунок 6. Активность GAA в сердце через 2, 4 и 13 недель после инъекции. Животные, получавшие AdGAA (серая полоса, n = 3), показали максимум примерно на 10% от нормальной активности (белая полоса, n = 3), тогда как в контроле GAA — / — активность не обнаружена. животные (черная полоса, n = 3).
Рисунок 6. Активность GAA в сердце через 2, 4 и 13 недель после инъекции. Животные, получавшие AdGAA (серая полоса, n = 3), показали максимум примерно на 10% от нормальной активности (белая полоса, n = 3), тогда как в контроле GAA — / — активность не обнаружена. животные (черная полоса, n = 3).
Фигура 7. Анализ гликогена в скелетных мышцах после внутримышечного введения AdGAA через 13 недель после инъекции. Базальное содержание гликогена практически не обнаруживалось в нормальных мышцах ( n = 3) ( A ), тогда как его было много в мышцах мышей GAA — / — ( n = 3) ( B ) . Как в инъецированных мышцах ( n = 3) ( C ), так и в контралатеральных мышцах ( n = 3) ( D ) содержание гликогена снизилось приблизительно на 90%.
Рис. 7. Анализ гликогена скелетных мышц после внутримышечного введения AdGAA через 13 недель после инъекции. Базальное содержание гликогена практически не обнаруживалось в нормальных мышцах ( n = 3) ( A ), тогда как его было много в мышцах мышей GAA — / — ( n = 3) ( B ) . Как в инъецированных мышцах ( n = 3) ( C ), так и в контралатеральных мышцах ( n = 3) ( D ) содержание гликогена снизилось приблизительно на 90%.
Рис. 8. PAS-окрашенные срезы сердца и скелетных мышц через 13 недель. ( A – C ) Срезы были представлены при одинаковом увеличении. Очевидно, что содержание гликогена уменьшилось в обработанном AdGAA GAA — / — сердце (C) по сравнению с GAA — / — сердце (B) и с сердцем дикого типа (А). ( D – G ) Gastrocnemius мышцы также показали заметный клиренс внутриклеточного гликогена в инъецированной мышце (F), а также в контралатеральной неинъекционной мышце мыши, обработанной AdGAA (G), по сравнению с количеством, присутствующим в контроле. GAA — / — (E) и мыши дикого типа (D).
Рис. 8. PAS-окрашенные срезы сердца и скелетных мышц через 13 недель. ( A – C ) Срезы были представлены при одинаковом увеличении. Очевидно, что содержание гликогена уменьшилось в обработанном AdGAA GAA — / — сердце (C) по сравнению с GAA — / — сердце (B) и с сердцем дикого типа (А). ( D – G ) Gastrocnemius мышцы также показали заметный клиренс внутриклеточного гликогена в инъецированной мышце (F), а также в контралатеральной неинъекционной мышце мыши, обработанной AdGAA (G), по сравнению с количеством, присутствующим в контроле. GAA — / — (E) и мыши дикого типа (D).
Рисунок 9. Электронно-микроскопический ультраструктурный анализ скелетных мышц через 13 недель. ( A ) Внешний вид нормальной мышцы с регулярным расположением миофибрилл. ( B ) Признаки искажения лизосом (черная стрелка) у мышей GAA — / — с большими очагами деструкции. ( C ) Удаление гликогена и исчезновение расширенных вакуолей в мышцах, инъецированных AdGAA. ( D ) Некоторые вакуоли все еще присутствовали в контралатеральной мышце, но признаки разрушения отсутствовали.(A – D: увеличение × 1700.) ( E ) Большое увеличение очага разрушения, показывающее мультимембранные вакуоли (увеличение × 4550). ( F ) Вид лизосом, заполненных гликогеном, в мышце GAA — / — (увеличение × 9900).
Рисунок 9. Электронно-микроскопический ультраструктурный анализ скелетных мышц через 13 недель. ( A ) Внешний вид нормальной мышцы с регулярным расположением миофибрилл. ( B ) Признаки искажения лизосом (черная стрелка) у мышей GAA — / — с большими очагами деструкции.( C ) Удаление гликогена и исчезновение расширенных вакуолей в мышцах, инъецированных AdGAA. ( D ) Некоторые вакуоли все еще присутствовали в контралатеральной мышце, но признаки разрушения отсутствовали. (A – D: увеличение × 1700.) ( E ) Большое увеличение очага разрушения, показывающее мультимембранные вакуоли (увеличение × 4550). ( F ) Вид лизосом, заполненных гликогеном, в мышце GAA — / — (увеличение × 9900).
Список литературы
1Хефслот, Л.Х., Хогевен-Вестервельд, М., Рейзер, А.Дж. и Остра, Б.А. (
1990
) Характеристика гена лизосомальной альфа-глюкозидазы человека.Biochem. J.
,272
,493
–497. 2Мартинюк, Ф., Бодкин, М., Цалл, С. и Хиршхорн (
1991
) Выделение и частичная характеристика структурного гена кислой альфа-глюкозидазы человека.DNA Cell Biol.
,10
,283
–292. 3Херманс, М.М., Кроос, М.А., Смейтинк, Дж. А., ван дер Плоег, А. Т., Клейер, В. Дж., И Рейзер, А. Дж. (
1998
Болезнь накопления гликогена II типа: генетический и биохимический анализ новых мутаций у младенцев турецкого происхождения.Hum. Мутат.
,11
,209
–215. 4Hoefsloot, L.H., van der Ploeg, A.T., Kroos, M.A., Hoogeveen-Westerveld, M., Oostra, B.A. и Reuser, A.J. (
1990
) Взрослый и младенческий гликогеноз II типа в одной семье, объясняемый аллельным разнообразием.Am. J. Hum. Genet.
,46
,45
–52.5Лафорет П., Николино М., Эймар П. Б., Пуэш Дж. П., Кайо К., Поэнару Л. и Фардо М. (
2000
) Дефицит кислой мальтазы у детей и взрослых во Франции: корреляция генотип-фенотип.Неврология
,55
,1122
–1128. 6Висселаар, Х.А., Кроос, М.А., Херманс, М.М., ван Бьюмен, Дж., И Рейзер, А.Дж. (
1993
) Структурные и функциональные изменения лизосомальной кислой альфа-глюкозидазы во время внутриклеточного транспорта и созревания.J. Biol. Chem.
,268
,2223
–2231. 7Дамс, Н.М., Лобель, П., Корнфельд, С. (
1989
) Нацеливание на маннозо-6-фосфатные рецепторы и лизосомальные ферменты.J. Biol. Chem.
,264
, 12115
–12118. 8Цудзи, А., Омура, К. и Судзуки, Ю. (
1988
) Внутриклеточный транспорт кислой альфа-глюкозидазы в человеческих фибробластах: доказательства участия системы, независимой от рецептора фосфоманнозила.J. Biochem.
,104
, 276.9Bijvoet, A.G., ван де Камп, E.H., Kroos, M.A., Ding, J.H., Yang, B.Z., Visser, P., Bakker, C.E., Verbeet, M.P., Oostra, B.A., Reuser, A.J.
и др.
(1998
) Общее накопление гликогена и кардиомегалия в модели болезни Помпе на мышах с нокаутом.Hum. Мол. Genet.
,7
,53
–62.10Рабен, Н., Нагараджу, К., Ли, Э., Кесслер, П., Бирн, Б., Ли, Л., Ламарка, М., Кинг, К., Уорд, Дж., Зауэр, Б.
и др.
(1998
Целенаправленное нарушение гена кислой альфа-глюкозидазы у мышей вызывает заболевание с критическими характеристиками болезни накопления гликогена у детей и взрослых людей типа II.J. Biol. Chem.
,273
, 19086
–19092.11Бийвоет, А.Г., Кроос, М.А., Пипер, Ф.Р., Ван дер Влит, М., Де Бур, Х.А., Ван дер Плоег, А.Т., Вербет, М.П. и Reuser, A.J. (
1998
) Рекомбинантная кислота альфа-глюкозидаза человека: продукция высокого уровня в молоке мышей, биохимические характеристики, коррекция дефицита ферментов у мышей GSDII KO.Hum. Мол. Genet.
,7
,1815
–1824.12Бийвоет, А.Г., Ван Хиртум, Х., Кроос, М.А., Ван де Камп, Э.Х., Шоневельд, О., Виссер, П., Бракенхофф, Дж.П., Веггеман, М., ван Корвен, Э.Дж., Ван дер Плоег, А.Т.
и др.
(1999
Кислая альфа-глюкозидаза человека из кроличьего молока оказывает терапевтическое действие на мышей с болезнью накопления гликогена II типа.Hum. Мол. Genet.
,8
,2145
–2153.13Амальфитано А., Бенгур А.Р., Морс Р.П., Маджур Дж. М., Кейс, Л.Э., Верлинг, Д.Л., Макки, Дж., Кишнани, П., Смит, В., Макви-Уайли, А.
и др.
(2001
) Терапия рекомбинантной человеческой кислой альфа-глюкозидазой ферментом для инфантильной болезни накопления гликогена типа II: результаты клинических испытаний фазы I / II.Genet. Med.
,3
,132
–138.14Ван ден Хаут, Х., Ройзер, А.Дж., Вулто, А.Г., Лоонен, М.К., Кромме-Дийкхейс, А., и Ван дер Плоег, А.Т. (
2000
) Рекомбинантная человеческая альфа-глюкозидаза из кроличьего молока у пациентов с Помпе.Ланцет
,356
,397
–398. 15Бартон, Н.В., Фербиш, Ф.С., Мюррей, Дж. Дж., Гарфилд, М.и Брэди, Р.О. (
1990
) Терапевтический ответ на внутривенные инфузии глюкоцереброзидазы у пациента с болезнью Гоше.Proc. Natl Acad. Sci. США
,87
,1913
–1916. 16Schiffmann, R., Kopp, J.B., Austin, H.A., 3-й, Sabnis, S., Moore, D.F., Weibel, T., Balow, J.E., Brady, R.O. (
2001
) Заместительная ферментная терапия при болезни Фабри: рандомизированное контролируемое исследование.JAMA
,285
,2743
–2749. 17Eng, C.M., Banikazemi, M., Gordon, R.E., Goldman, M., Phelps, R., Kim, L., Gass, A., Winston, J., Dikman, S., Fallon, J.T.
и др.
(2001
) Фаза 1/2 клинических испытаний замены ферментов при болезни Фабри: исследования фармакокинетики, клиренса субстрата и безопасности.Am. J. Hum. Genet.
,68
,711
–722. 18Casadevall, N., Nataf, J., Viron, B., Kolta, A., Kiladjian, J.J., Martin-Dupont, P., Michaud, P., Papo, T., Ugo, V., Teyssandier, I.
и др.
(2002
) Чистая аплазия эритроцитов и антитела к эритропоэтину у пациентов, получавших рекомбинантный эритропоэтин.New Engl J. Med.
,346
,469
–475. 19Хагстром, Дж. Н., Коуту, Л. Б., Скаллан, К., Бертон, М., Макклеланд, М., Филдс, П. А., Арруда, В. Р., Херцог, Р. В. и Хай, К. А. (
2000
) Улучшенная экспрессия человеческого фактора свертывания IX в мышцах от скелетного актина / гибридного энхансера / промотора CMV.Кровь
,95
,2536
–2542.20Зеппен, Дж., Барри, С.С., Хардер, Б. и Осборн, В.Р. (
2001
) Введение лентивируса в мышцу крысы обеспечивает эффективную устойчивую экспрессию эритропоэтина.Кровь
,98
,594
–596. 21Bordet, T., Schmalbruch, H., Pettmann, B., Hagege, A., Castelnau-Ptakhine, L., Кан, А. и Хаазе, Г. (
1999
) Перенос гена аденовирусного кардиотропина-1 защищает мышей pmn от прогрессирующей двигательной нейронопатии.J. Clin. Вкладывать деньги.
,104
,1077
–1085. 22Guidotti, J.E., Mignon, A., Haase, G., Caillaud, C., McDonell, N., Kahn, A. и Poenaru, L. (
1999
) Аденовирусная генная терапия болезни Тея – Сакса у мышей с нокаутом гексозаминидазы А.Hum. Мол. Genet.
,8
,831
–838. 23Зиглер, Р.Дж., Ю, Н.С., Ли, К., Черри, М., Бертелет, П., Романчук, Х., Иоанну, Ю.А., Зейднер, К.М., Десник, Р.Дж. и Cheng, S.H. (
1999
) Коррекция ферментативных и лизосомных дефектов хранения у мышей Fabry с помощью аденовирусного переноса генов.Hum.Ген. Ther.
,10
,1667
–1682. 24Амальфитано А., Макви-Вайли А.Дж., Ху Х., Доусон Т.Л., Рабен Н., Плотц П. и Чен Ю.Т. (
1999
Системная коррекция мышечной болезни накопления гликогена типа II после нацеливания на печень модифицированного аденовирусного вектора, кодирующего кислотно-альфа-глюкозидазу человека.Proc.Natl Acad. Sci. США
,96
,8861
–8866. 25Николино, М.П., Пуэч, Ж.-П., Кремер, Э.Дж., Реузер, А.Дж., Мбеби, К., Вердьер-Сахуке, М., Кан, А. и Поенару, Л. (
1998
Опосредованный аденовирусом перенос гена кислой альфа-глюкозидазы в фибробласты, миобласты и мышечные трубки от пациентов с болезнью накопления гликогена типа II приводит к высокому уровню экспрессии фермента и корректирует накопление гликогена.Hum. Мол. Genet.
,7
,1695
–1702. 26Хуард, Дж., Лохмюллер, Х., Аксади, Г., Яни, А., Мэсси, Б. и Карпати, Г. (
1995
) Путь введения является основным фактором, определяющим эффективность трансдукции тканей крысы аденовирусными рекомбинантами.Gene Ther.
,2
,107
–115.27Динг, Э.Ю., Ходжес, Б.Л., Ху, Х., Макви-Вайли, А.Дж., Серра, Д., Мигоне, Ф.К., Прессли, Д., Чен, Ю.Т. и Амальфитано А. (
2001
) Долгосрочная эффективность после опосредованного [E1-, полимераза-] аденовирусом переноса гена кислой-альфа-глюкозидазы человека мышам с нокаутом при болезни накопления гликогена II типа.Hum. Gene Ther.
,12
,955
–965.28Acsadi, G., Jani, A., Massie, B., Simoneau, M., Holland, P., Blaschuk, K. и Karpati, G. (
1994
) Дифференциальная эффективность опосредованного аденовирусомin vivo
перенос генов в клетки скелетных мышц разной зрелости.Hum. Мол. Genet.
,3
,579
–584. 29Гильгенкранц, Х., Duboc, D., Juillard, V., Couton, D., Pavirani, A., Guillet, J.G., Briand, P. и Kahn, A. (
1995
) Временная экспрессия генов, перенесенных in vivo в сердце с использованием аденовирусных векторов первого поколения: роль иммунного ответа.Hum. Ген. Ther.
,6
,1265
–1274. 30Уолтер, Г., Бартон, Э. Р. и Суини, Х.Л. (
2000
) Неинвазивное измерение экспрессии генов в скелетных мышцах.Proc. Natl Acad. Sci. США
,97
,5151
–5155. 31Рабен, Н., Лу, Н., Нагараджу, К., Ривера, Ю., Ли, А., Ян, Б., Бирн, Б., Мейкл, П.Дж., Умапатисивам, К., Хопвуд, Д.Дж.
и др.
(2001
) Условная тканеспецифическая экспрессия гена кислой альфа-глюкозидазы (GAA) у мышей с нокаутом GAA: значение для терапии.Hum. Мол. Genet.
,10
,2039
–2047. 32Бол Д., Бош А., Кардона А., Сальветти А. и Херд Дж. М. (
2000
) Улучшение эритропоэза у бета-талассемических мышей за счет непрерывной доставки эритропоэтина из мышц.Кровь
,95
,2793
–2798.33Мир, Л.М., Бюро, М.Ф., Гель, Дж., Рангара, Р., Руи, Д., Кайо, Дж. М., Делер, П., Бранеллек, Д., Шварц, Б. и Шерман, Д. (
1999
) Высокоэффективный перенос генов в скелетные мышцы с помощью электрических импульсов.Proc. Natl Acad. Sci. США
,96
,4262
–4267. 34Беттан, М., Эммануэль, Ф., Дартей, Р., Кайо, Ж.М., Субрие, Ф., Делер, П., Бранелек, Д., Махфуди, А., Дюверже, Н. и Шерман, Д. (
2000
) Высокий уровень секреции белка в кровоток после передачи гена в скелетные мышцы с помощью электрического импульса.Мол. Ther.
,2
,204
–210. 35Риццуто, Г., Каппеллетти, М., Mennuni, C., Wiznerowicz, M., DeMartis, A., Maione, D., Ciliberto, G., La Monica, N., and Fattori, E. (
2000
Электроперенос гена приводит к высокому уровню трансдукции скелетных мышц крысы и корректирует анемию или почечную недостаточность.Hum. Ген. Ther.
,11
,1891
–1900. 36Высокий, К. (
2001
) AAV-опосредованный перенос гена гемофилии.Ann. NY Acad. Sci.
,953
,64
–74. 37Шварце С.Р., Хо А., Воцеро-Акбани А. и Дауди С.Ф. (
1999
)In vivo
белковая трансдукция: доставка биологически активного белка мыши.Наука
,285
,1569
–1572.38Ся, Х., Мао, К. и Дэвидсон, Б.Л. (
2001
Домен трансдукции белка Tat ВИЧ улучшает биораспределение бета-глюкуронидазы, экспрессируемой из рекомбинантных вирусных векторов.Nat. Biotechnol.
,19
,640
–644. 39Мартини, К., Чиана, Г., Бенеттони, А., Катузян, Ф., Северини, Г.М., Буссани, Р. и Бемби, Б. (
2001
Неизлечимая лихорадка и накопление гликогена в корковых нейронах при гликогенозе 2 типа.Неврология
,57
,906
–908. 40Фромс, Ю., Сэлмон, А., Ван, X., Коллин, Х., Руш, А., Хагеге, А., Шварц, К., Фисман, М. (
1999
) Доставка гена в миокард путем внутриперикардиальной инъекции.Gene Ther.
,6
,683
–688. .

