Как устроены мышцы
Не все мышцы в теле человека одинаковы. По типу строения они делятся на три группы — скелетные, гладкие и сердечная мышца (которую также называют “миокард”).
Гладкие мышцы являются составной частью кровеносных сосудов и стенок полых внутренних органов. Эти мышцы сокращаются медленно и ритмично, подчиняясь сигналам вегетативной нервной системы, точно также как и сердечная мышца.
Скелетные же мышцы подконтрольны сознанию человека, с помощью них мы, например, плывем, крутим педали, бежим — совершаем разнообразные движения. В теле более 600 таких мышц. Вместе со скелетом, они образуют скелетно-мышечную ткань.
Скелетно-мышечная ткань, в свою очередь, состоит из двух типов волокон: медленные и быстрые. Каждый тип мышечных волокон отвечает за свой вид работы: в спринте, так же как и в тяжелой атлетике и боевых искусствах, задействованы быстрые волокна.
У спортсменов, выступающих в разных дисциплинах, в разной степен развиты те или иные мышечные волокна. Например, Усейн Болт не пробежал бы Московский Марафон так, как пробежал его Артём Алексеев в 2016 году (с рекордом соревнования! 2:13:40).
От природы у человека могут быть больше развиты те или иные мышцы, но их можно сознательно натренировать.
Длительные пробежки на аэробном пульсе (70-80% от максимального значения частоты сердечных сокращений).
Такие тренировки развивают медленные мышечные волокна, повышая их устойчивость к утомлению. К каждой такой тренировкой всё больше и больше мышечных волокон переходят в разряд медленных. Именно поэтому атлет совершенствуется в беге на длинные дистанции с каждым новым сезоном.
Интервальные тренировки и спринты: традиционные интервалы, например, 12 х 400 м, или спринт в горку задействуют быстрые мышечные волокна. Они обладают взрывной энергией и развиваются при короткой, но интенсивной работе. Но что ещё более важно, интервальный тип тренировок развивает нейромышечную координацию, то есть увеличивает скорость сигнала «Работать!!» от мозга к мышцам. Выполняя интервалы, атлет тренирует свои спринтерские качества. Включая такие тренировки в свою подготовку, спортсмен, в том числе марафонец, сможет бежать быстрее, не затрачивая много усилий.
Участвуете ли вы в соревновании по легкой атлетике в помещении или готовитесь к марафону, ваше тело работает интенсивно, порой на пределе возможностей. Чтобы поддержать мышцы, помочь им справиться с нагрузкой, требуется хорошая экипировка. Для длительных пробежек рекомендуем обратить внимание на компрессионное трико серии ЭЛИТ или на более экономичный вариант — трико серии УНИВЕРСАЛЬНАЯ.
Компрессионная ткань воздействуют именно на все мышцы, которые подвержены наибольшим нагрузкам. Если вы привыкли бегать в шортах, то будет не лишним дополнить их компрессионными гетрами или гольфами для усиления оттока крови и защиты икроножной мышцы.
При интервальных тренировках и спринтах, ваш высокий темп поддержит серия MCS: компрессионные трико, шорты и гетры. Кроме усиленной поддержки работы сердечно-сосудистой системы, экипировка MCS (Muscle Containment Stamping) оказывает направленное компрессионное действие на крупные мышцы, эффективно снижает их колебание, и, соответственно, риск их повреждения.
Гипертрофия скелетных мышц человека — Самсонова А.В.
ВведениеОсновные условные сокращения
Глава 1. Гипертрофия скелетных мышц человека и методы ее оценки
1.1. Классификации скелетных мышц
1.2. Особенности функционирования веретенообразных и перистых мышц
1. 3. Морфологические показатели, характеризующие степень гипертрофии скелетных мышц, и методы их оценки
3. Морфологические показатели, характеризующие степень гипертрофии скелетных мышц, и методы их оценки
1.3.1. Площадь поперечного сечения и объем скелетных мышц
1.3.2. Методы оценки морфологических показателей скелетных мышц
1.3.3. Обхватные размеры тела человека и способы их измерения
1.4. Факторы, влияющие на гипертрофию скелетных мышц
1.4.1. Локализация гипертрофической реакции мышцы
1.4.2. Расположение мышц
1.4.3. Влияние пола на гипертрофию скелетных мышц
1.4.4. Влияние возраста на гипертрофию скелетных мышц
1.5. Влияние силовой тренировки на морфологические характеристики скелетных мышц
Глава 2. Факторы, влияющие на гипертрофию скелетной мышцы
2.1. Скелетная мышца как орган
2.2. Соединение мышечных и сухожильных волокон
2.3. Соединение мышечного волокна и двигательного нерва
2.4. Управление активностью мышцы со стороны ЦНС
2.5. Биохимия процессов сокращения на уровне мышцы
2. 6. Параметры, определяющие объем скелетных мышц
6. Параметры, определяющие объем скелетных мышц
2.7. Методы оценки параметров, определяющих объем скелетных мышц
2.8. Влияние силовой тренировки на параметры, определяющие объем скелетных мышц
Контрольные вопросы
Глава 3. Факторы, определяющие гипертрофию скелетной мышцы с учетом типов мышечных волокон
3.1. Типы мышечных волокон
3.2. Типы двигательных единиц
3.3. Регуляция силы и скорости сокращения мышцы центральной нервной системой
3.4. Параметры, определяющие объем мышцы с учетом типов мышечных волокон
3.6. Влияние силовой тренировки на площадь поперечного сечения мышечных волокон различных типов
3.7. Факторы, определяющие композицию мышечных волокон в скелетных мышцах
3.8. Методы оценки композиции мышечных волокон в скелетных мышцах
3.8.1. Инвазивные методы оценки композиции мышечных волокон в скелетных мышцах
3.8.2. Неинвазивные методы оценки композиции мышечных волокон в скелетных мышцах
Контрольные вопросы
Глава. 4. Факторы, определяющие гипертрофию скелетной мышцы на уровне мышечного волокна
4. Факторы, определяющие гипертрофию скелетной мышцы на уровне мышечного волокна
4.1. Состав мышечного волокна
4.2. Строение мышечного волокна
4.3. Сокращение и расслабление мышечного волокна
4.4. Биохимические процессы, происходящие в мышечном волокне при сокращении и расслаблении мышцы
4.5. Состав, строение и морфофункциональная характеристика мышечных волокон различных типов
4.7. Влияние тренировки на параметры, определяющие гипертрофию мышечного волокна
4.8. Гистогенез мышечных волокон
4.9. Регенерация мышечных волокон
Контрольные вопросы
Глава 5. Факторы, определяющие гипертрофию скелетных мышц на уровне миофибриллы
5.1. Состав и структура миофибриллы
5.2. Состав и структура саркомера
5.2.1. Состав и структура толстого филамента
5.2.2. Состав и структура тонкого филамента
5.2.3. Состав и структура Z-диска
5.2.4. Состав и структура М-диска
5. 3. Модель сокращения мышцы на уровне саркомера
3. Модель сокращения мышцы на уровне саркомера
5.4. Параметры, определяющие объем миофибриллы
5.5. Влияние силовой тренировки на параметры миофибрилл
Контрольные вопросы
Глава 6. Гипертрофия скелетных мышц как проявление долговременной адаптации человека к физическим нагрузкам
6.1. Понятие адаптации организма человека к физическим нагрузкам
6.2. Виды адаптации и тренировочного эффекта
6.3. Условия адаптации
6.4. Виды гипертрофии мышечных волокон
6.5. Гипотезы миофибриллярной гипертрофии мышечных волокон
6.6. Механическое повреждение мышечных волокон как стимул повышенного синтеза белка в мышцах
Контрольные вопросы
Глава 7. Метаболизм белков в организме человека
7.1. Строение и функции нуклеиновых кислот
7.2. Строение молекулы белка
7.3. Переваривание и всасывание белков
7.4. Катаболизм белков в мышечных волокнах
7.5. Синтез белков в мышечных волокнах
7.6. Миофибриллогенез
7. 7. Формирование новых мышечных волокон и их гиперплазия
7. Формирование новых мышечных волокон и их гиперплазия
7.8. Концепции, объясняющие повышенный синтез белка в скелетных мышцах при выполнении силовых тренировок
Глава 8. Влияние различных параметров тренировки на гипертрофию скелетных мышц
8.1. Факторы, сопутствующие миофибриллярной гипертрофии скелетных мышц
8.1.1. Увеличение силы скелетных мышц
8.1.2. Мышечные боли, возникающие при выполнении силовых упражнений
8.2. Влияние силовой тренировки с отягощениями различной массы на гипертрофию скелетных мышц
8.2.1. Характеристика силовой тренировки с отягощениями различной массы
8.2.2. Гипотеза, объясняющая тренировочные эффекты воздействия на скелетные мышцы отягощений различной массы
8.3. Влияние силовой тренировки, выполняемой в различных режимах мышечного сокращения, на гипертрофию скелетных мышц
8.3.1. Тренировочные эффекты воздействия на скелетные мышцы работы в различных режимах
8.3.2. Гипотезы, объясняющие тренировочные эффекты воздействия на скелетные мышцы работы в различных режимах
 4. Влияние тренировки методом «до отказа» на гипертрофию скелетных мышц
4. Влияние тренировки методом «до отказа» на гипертрофию скелетных мышц8.4.1. Характеристика метода «до отказа»
8.4.2. Тренировочные эффекты воздействия на скелетные мышцы тренировки методом «до отказа»
8.4.3. Гипотезы, объясняющие тренировочные эффекты воздействия на скелетные мышцы работы методом «до отказа»
8.5. Влияние прекращения тренировки и последующего ее возобновления на гипертрофию скелетных мышц
8.6. Влияние порядка упражнений, используемых в тренировке, на силу и гипертрофию скелетных мышц
8.7. Влияние различных программ тренировки на силу и гипертрофию скелетных мышц
Контрольные вопросы
Глоссарий
Литература
Analysis of Embryonic and Larval Zebrafish Skeletal Myofibers from Dissociated Preparations
1. Получение поли-L-лизин покрытием Покровные (Время: 1 час)
Лакокрасочные покровные позволяет быстро мышечное волокно расселения и адгезии. Это может быть выполнено при диссоциации шаге выделения миофибрилл (шаг 2 ниже).
- Вырезать и поместить парафильмом на дне 60 мм чашки Петри (любой марки).
- Наведите стеклянные промахи микроскоп крышки (диаметр 12 мм) на парафильмом в 60 мм блюдо культуры ткани или разместить их индивидуально в отдельных скважинах 24-луночных планшетах.
Примечание 1: Эти маленькие круглые покровные помогают сосредоточиться мышечное волокно цифры и уменьшить использование количества антител.
Примечание 2: Другие покровные размер будет работать, однако объемы реагентов и эмбрионов, используемых должны быть соответствующим образом скорректированы.
- Пипетка 50-200 мкл из поли-L-лизин растворе (0,01%) на каждом покровном стекле в чашке Петри.
- Разрешить покровные сидеть по крайней мере один хоур при 37 ° С Более длинные инкубации не будет негативно влиять на результаты.
- Удалить поли-L-лизин решение от покровного стекла и мыть дважды с минимумом 100 мкл 1x PBS.
- Разрешить покровные высохнуть.
- Покровные готовы к мышечных волокон.

Примечание 3: Для обеспечения стерильности, покрытие может быть сделано в капюшоне и на автоклавного покровные.
Примечание 4: Держите 60 мм чашки Петри с парафильмом на дне. Эта установка будет использоваться во время мышечное волокно обшивкой и иммунного (поздние стадии).
Вариант 1: Вместо покрытия покровные непосредственно перед использованием, с покрытием покровное запас может быть использован. Блюдо 60 мм Петри содержащие минимум 2 мл поли-L-лизина можно хранить при температуре 4 ° С, содержащей многочисленные покровные. Этот вариант начинаются от стадии 1.5 для обработки покровные для мышечных волокон.
Вариант 2: Мы также пальто покровные в поли-L-орнитин. Тего более трудоемок, но полезно для долгосрочного культивирования потому поли-L-орнитин покровные покрытием может быть УФ лечение. С УФ лечения и тщательного стерильных живые мышечные волокна, как правило, может поддерживаться в культуре от 4-7 дней.
2. Разобщенность эмбрионов рыбок данио и обшивки мышечных волокон (Time: от 1 до 3 ч)
Примечание: стандартный протокол применяется все возможное, чтобы 3 DPF (дней после оплодотворения) эмбрионов.
- Передача эмбрионов данио рерио в стандартный 1,5 мл центрифужную пробирку и удалить как можно больше избыток рыбы воды, сколько возможно. Как правило, 10-20 эмбрионов на пробирку, хотя и менее могут быть использованы. Использование более чем 20-25 эмбрионов часто приводит к чрезмерной подготовки плотности.
- Удалить хорионов до диссоциации, вручную с помощью # 5 щипцы. Кроме того, удаление химического хориона достигается при 10-15 минутах лечения проназа. Как правило, предыдущее удаление хориона нужен только, когда перед подтверждением на Мутмуравей фенотип или морфология требуется, или при использовании стадий, где эмбрионы естественно вылупился из их хориона.
- Добавить 900 мкл СО 2 независимых СМИ в пробирку, содержащую эмбрионов.
- Добавить 100 мкл коллагеназы типа II, конечная концентрация 3,125 мг / мл (со коллагеназы решение в 31.25 мг / мл разводят в 1x PBS), чтобы начать диссоциации. Коллагеназы IV также могут быть использованы для диссоциации.

- Поворот эмбрионов на орбитальном шейкере и растирают каждые 30 мин при комнатной температуре с использованием P1000 Pipetman для растирания.
Примечание 2: Тщательно контролировать эмбриона диссоциации; над или под диссоциации (особенно старше) являются наиболее распространенными причинами отказа протокола. Времена для переваривания будет варьироваться в зависимости от интенсивности растирание, количества зародышей на пробирку и возраста эмбрионов. Это также часто менее (по сравнению с дикого типа) для эмбрионов из скелетных мутантов мышц.
Примечание3: Среднее время пищеварения за эмбрионов возраста: 1 DPF = 1 час, 2 денье = 1,5 ч, 3 денье = 2 часа и 4 DPF = 2-2,5 часа.
- Остановить пищеварение, когда не видны целые эмбрионы, но твердые кусочки еще видны — это очень важно для предотвращения избытком.
- Пробирки центрифужные с диссоциированных эмбрионов на 0.8-2.3 мкг в течение 3-5 мин для осаждения клеток.
- Удалить супернатант из гранулированных клеток и мыть 2 раза с СО 2 независимых СМИ.
- Добавить свежий CO 2 независимых средств массовой информации, чтобы ресуспендирования клеток. 1 мл обычно используется для Preps 10-20 эмбрионов. Объем можно масштабировать в зависимости от количества эмбрионов.
- Использование P1000 пипетки, пройти эмбриона суспензии через 70 мкм фильтр. Это помогает удалить нежелательные мусора из преп.
Примечание 4: Embryo подвеска могут быть отфильтрованы во второй раз через 40 мкм фильтр для дополнительного удаления нежелательного мусора. С двойной фильтрации, восстановления approximленно 800 мкл из исходного объема 1 мл.
- Добавить приблизительно 50-100 мкл суспензии миофибрилл в каждом покровном стекле с покрытием поли-L-лизина.
Примечание 5: Выполните шаг 2,9 в чашках Петри с Parafilm на дне, подготовлены заранее. Парафильмом держит мышечное волокно отстранение от убегал покровные покрытием. Держите чашки Петри, покрытые для предотвращения испарения.
- Разрешить мышечные волокна урегулировать примерно 1 час на покровные покрытием при комнатной температуре.

Примечание 6: мышечных волокон начнет оседать в пределах 5-10 мин. Тем не менее, для правильного прикладывания мышечное волокно, не менее 1 ч (1-2 ч) рекомендуется. Разрешение мышечные волокна довольствоваться уже не повредит преп. Для более длинных инкубации (в том числе на ночь), антибиотики могут быть добавлены к средствам массовой информации. С антибиотиками и стерильных живые культуры, как правило, может поддерживаться в течение 1-2 дней.
- Онлайн мyofibers можно наблюдать в этой точке. Мышечных волокон из эмбрионов 2 DPF и позже будет рассматриваться как поперечно-полосатых и вытянутых клеток (рис. 1). В этот момент мышечные волокна теперь готовы для анализа живой или иммунного.
Примечание 7: скелетных мышц с 1 DPF эмбрионов не пластины, как удлиненные и четко поперечно-полосатых волокон. Вместо больших myoballs могут. Кроме того, в период после диссоциации гранулирование фазы (шаг 2,6), 1 денье myoballs должны быть центрифугировали в течение как минимум 8 мин при 5000 х г для достижения гранул. Для анализа эмбрионов на этой стадии, рекомендуется использовать трансгенную линию, выражающую EGFP в частности, в скелетных мышцах 23. Это позволит идентифицировать клетки мышц от происхождения по сравнению с другими источниками.
Для анализа эмбрионов на этой стадии, рекомендуется использовать трансгенную линию, выражающую EGFP в частности, в скелетных мышцах 23. Это позволит идентифицировать клетки мышц от происхождения по сравнению с другими источниками.
3. Флуоресценции Иммуноокрашивание диссоциированных рыбок данио мышечных волокон (Время: примерно за 1 день)
3.1. Иммуномечение
- Удалить частьмедиафайлы от мышечных волокон придерживались покровного стекла с покрытием
- Исправить клеток с использованием 4% параформальдегида или метанол. Для PFA, удалить ½ объема средств массовой информации и заменить тем же количеством PFA. Fix в течение 10 мин при комнатной температуре, затем снимите общий объем, заменить 50-100 мкл PFA, и исправить в течение дополнительных 10 мин. Для фиксации спирт, лед холодным метанолом или ацетоном может быть применен при 4 ° С в течение 10 мин или 5 мин, соответственно.
- Вымойте мышечные волокна не менее 3-5x с 1x PBS или 1x PBS плюс 0,1% Твин.
 Средний объем стирки 50-100 мкл на покровное.
Средний объем стирки 50-100 мкл на покровное. - Добавить блокирования решение мышечных волокон (рабочий запас) и инкубировать 20-60 мин при комнатной температуре. Блокирующего раствора будет зависеть от первичных и вторичных антител. Два наиболее распространенных использованы в лаборатории: (1) 1X PBS, 2 мг / мл BSA, 1% овец сыворотки, 0,25% Triton X-100 окончательным и (2) 0,2% Тритон Х-100, 2 мг / мл (0,2 % БСА) и 5% овечьей / козьей сывороткой.
- Удалить блокировании решения и добавить первичного антитела, разбавленного в любом бзамок решение или PBS. Выдержите мышечные волокна в течение ночи при 4 ° С. Убедитесь, что обе парафильмом или заверните в Саран обернуть чашку Петри, содержащую мышечное волокно загружены покровные, покрытые антителами. Небольшие кусочки смоченной бумажной салфеткой могут быть добавлены для создания влажной камере.
- Удалить первичного антитела от покровных и мыть покровные 3-5x в течение 5 мин с PBS или блокирующий раствор.
- Добавить вторичного антитела в соответствующей концентрации, разведенного в 1x PBS или блокирующим раствором в течение 1-2 ч при комнатной температуре.

- Удалить вторичного антитела и мыть мышечных волокон 3-5x в PBS в течение 5 мин каждого при комнатной температуре.
3.2. Монтажные покровные
- Нанесите 1-2 капли antifade реагентом для предметное стекло микроскопа.
- Тщательно пикап с покрытием и immunolabled покровное с помощью щипцов и место (мышечные волокна вниз) покровное на antifade реагента на предметное стекло.
Примечание 1: Внимание к ориентации Coated покровное имеет решающее значение.
- Положите 1-2 Kimwipes на жестком твердой поверхности. Быстро переверните слайд с покрытых покровные опираясь на antifade реагента и поместить его (покровное вниз) на Kimwipes.
- Применить светового давления углах стекло микроскопа, чтобы удалить лишнюю antifade и образуют герметичное уплотнение между горкой и покровного стекла
- Позволить antifade остальные высохнуть в течение 5-10 мин при комнатной температуре, затем мышечные волокна готовы к изображению (фиг.
 2A и B) или хранить при 4 ° С.
2A и B) или хранить при 4 ° С.
4. Живых изображений сотовый Кальций Использование GCaMP3
Эксперименты живая клетка может быть выполнена на мышечных волокон до фиксации (следующий шаг 2,10). Следующий протокол описывает живого изображения в мышечных волокон, экспрессирующих GCaMP3 24, генетически закодированного индикатор кальция, выраженную скелетных мышц конкретного данио α-актин промотора (pSKM) 23. Кроме того,Эта методика может быть легко адаптирован для использования индикатора кальция красители, такие как фура-2.
- Введите эмбрионов с pSKM: GCaMP3 построить на стадии 1-2 клеток
- В 3 денье, собирать личинки и подготовить мышечные волокна, как описано в разделах 1 и 2. Разрешить мышечные волокна придерживаться в течение не менее 1 часа. Для реализации этой технологии, подготовка покровные в блюдах с 24 лунками требуется.
- Тщательно удалите остатки средств массовой информации, и добавить 300 мкл свежей СО 2 независимых СМИ при комнатной температуре.

- Заметим, клетки под инвертированным микроскопом. GCaMP3 положительные мышечные волокна должны быть видны под зеленой флуоресценции.
- Настройка камеры для записи, если это необходимо.
- Подготовьте 30 мм кофеина решение в СО 2 независимых СМИ. Чтобы стимулировать клетки, мягко пипетки 300 мкл кофеина раствора в скважину при увеличении. В 5-10 сек, GCaMP положительные мышечные волокна должны реагировать на кофеин с быстрым увеличением флуоресценции (рис. 3). MyofibERS может также сокращаться. Следует отметить, что кофеин вызывает высвобождение кальция из саркоплазматического ретикулума магазинах 25. Другие агенты, такие как KCl и 26 рианодиновых 4, может быть использован для изучения индуцируемую высвобождение кальция.
Subscription Required. Please recommend JoVE to your librarian.
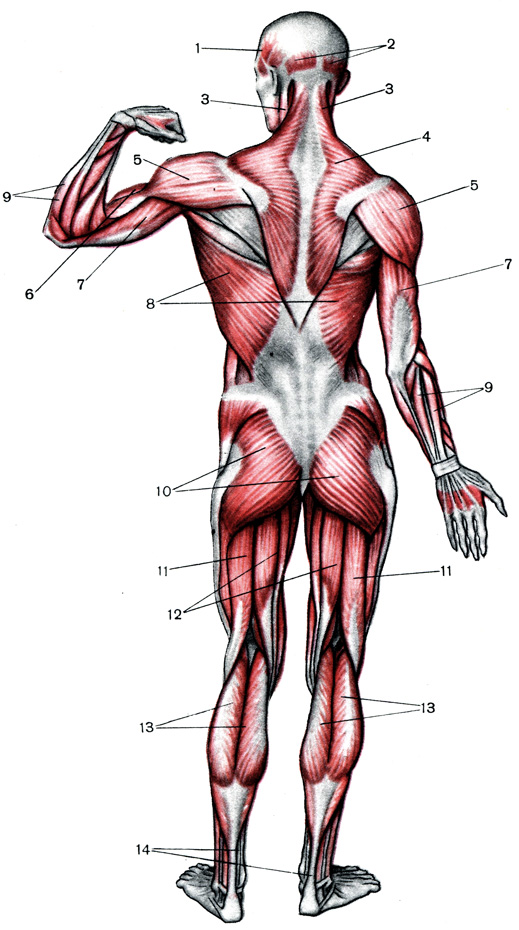
Мышцы человека, строение скелетных мышц, мышечный тонус
Существуют три типа мышечной ткани, поперечнополосатая, сердечная и гладкая. Поперечнополосатые мышцы человека обычно прикреплены к костям скелета. Сердечная мышечная ткань образует сердце, а гладкие мышцы входят в состав стенок внутренних органов различных систем. Все они обладают способностью укорачиваться (сокращаться).
Поперечнополосатые мышцы человека обычно прикреплены к костям скелета. Сердечная мышечная ткань образует сердце, а гладкие мышцы входят в состав стенок внутренних органов различных систем. Все они обладают способностью укорачиваться (сокращаться).
Мышцы человека, функции и строение скелетных мышц, мышечный тонус, условия нормальной работы мышц.
Типичная скелетная мышца прикреплена как минимум к двум костям. Сокращение таких мышц ведет к перемещению костей друг относительно друга. Например к сгибанию конечности в суставе. Скелетные мышцы обеспечивают произвольные движения, человек может сознательно ими управлять. Некоторые мышцы прикреплены таким образом, что двигают не кости, а мягкие ткани. Например, мышцы языка, лицевые мышцы.
Функции скелетных мышц.
Скелетные мышцы вызывают движение в суставах. Например, когда человек встает на цыпочки, движение в голеностопном суставе обусловлено сокращением икроножных мышц с задней стороны голени.
Мышцы обычно работают координированными группами, а не по отдельности, Например, когда рука поднимает пищу со стола и подносит ко рту, в этом движении участвуют все суставы верхней конечности, и несколько групп мышц действуют совместно таким образом, что движение в этих суставах происходит одновременно и плавно.
Часто группы мышц противодействуют друг другу, что позволяет удерживать определенное положение одного сустава относительно другого. Например, в процессе письма одни мышцы фиксируют плечо и локоть, в то время как другие двигают запястье и пальцы.
Скелетные мышцы руки, движущие локтевой сустав. Мышцы в действии, при сокращении двуглавой мышцы плеча рука сгибается.
Скелетные мышцы также поддерживают и защищают внутренние органы. Например, мышцы передней и боковых стенок брюшной полости дают опору органам пищеварительной системы. Важной функцией скелетных мышц является участие в поддержании температуры тела.
Энергия, потребляемая мышцами во время сокращения, превращается в тепло, идущее на достижение оптимальной температуры. Когда температура тела падает ниже нормальной, дрожь — быстрое сокращение и расслабление скелетных мышц, создает тепло, которое согревает кровь в проходящих рядом кровеносных сосудах.
Строение скелетных мышц.
Скелетная мышца состоит из одного или нескольких брюшков, концы которых прикреплены сухожилиями к костям. Мышечное брюшко образовано мышечными клетками, слитыми в целостное мышечное волокно, которое сокращается в результате стимуляции моторным нервом.
Мышечное брюшко образовано мышечными клетками, слитыми в целостное мышечное волокно, которое сокращается в результате стимуляции моторным нервом.
Сухожилие представляет собой прочный волокнистый тяж соединительной ткани, прикрепляющий конец мышечного брюшка к кости. Когда брюшко мышц сокращается, оно тянет за собой сухожилие, а то в свою очередь перемещает кость, к которой прикреплено.
Длинные сухожилия могут быть заключены в соединительнотканную оболочку с синовиальной жидкостью внутри. Это предотвращает повреждение сухожилия от трения в тех местах, где оно проходит над костными выступами.
Перелом плечевой кости ведет к потере нормальной подвижности. При сгибании сломанной руки вероятны деформация, повреждение тканей и боль.
К скелетной мышце подходят нервы, которые несут сигналы от центральной нервной системы, вызывающие мышечное сокращение. По ним также обратно в нервную систему передается сенсорная информация о степени растяжения или сокращения мышц.
Скелетные мышцы редко бывают полностью расслаблены. Даже если движения в суставе нет, в мышце все равно поддерживается состояние слабого сокращения (мышечный тонус). Мышечный тонус исчезает, и мышцы становятся совсем мягкими тогда, когда нервы перестают передавать сигналы мышцам. Вот примеры таких состояний, при которых требуется первая помощь:
Потеря сознания.
У человека, находящегося без сознания, мышечный тонус отсутствует. Не оставляйте пострадавшего лежать на спине, иначе его язык (в нем тоже есть мускулатура) западет назад, перегораживая дыхательные пути.
Инсульт.
Если произошел инсульт с частичным или полным поражением участков мозга, управляющих сокращением мышц, то мышечный тонус исчезнет в некоторых или всех мышцах. Даже если человек в сознании.
Условия нормальной работы мышц.
Для того чтобы мышца функционировала должным образом, необходима интактность подходящих к ней нервов, самого мышечного тяжа, а также сухожилий и костей, к которым она крепится. Кроме того, требуется достаточное снабжение мышц кровью, несущей кислород и питательные вещества. Повреждение нервов ведет к параличу. Костей — к деформации. Разрыв самих мышц или сухожилий — к невозможности движения.
Кроме того, требуется достаточное снабжение мышц кровью, несущей кислород и питательные вещества. Повреждение нервов ведет к параличу. Костей — к деформации. Разрыв самих мышц или сухожилий — к невозможности движения.
По материалам книги «Скорая помощь, домашний справочник неотложных состояний».
Тайлер Э.
Статьи схожей тематики:
- Вариант комплектации и состава медицинской укладки взводного медика, медикаменты, лекарства, перевязочный материал, переноска медицинской укладки взводного медика.
- Кожа человека, строение кожи, ногти, потовые железы, волосы, сальные железы, сосуды, нервы, кожа человека и температура его тела.
- Нервная система человека, нервные клетки, нейроны, центральная и периферическая нервная система, основные функциональные области левого полушария головного мозга.
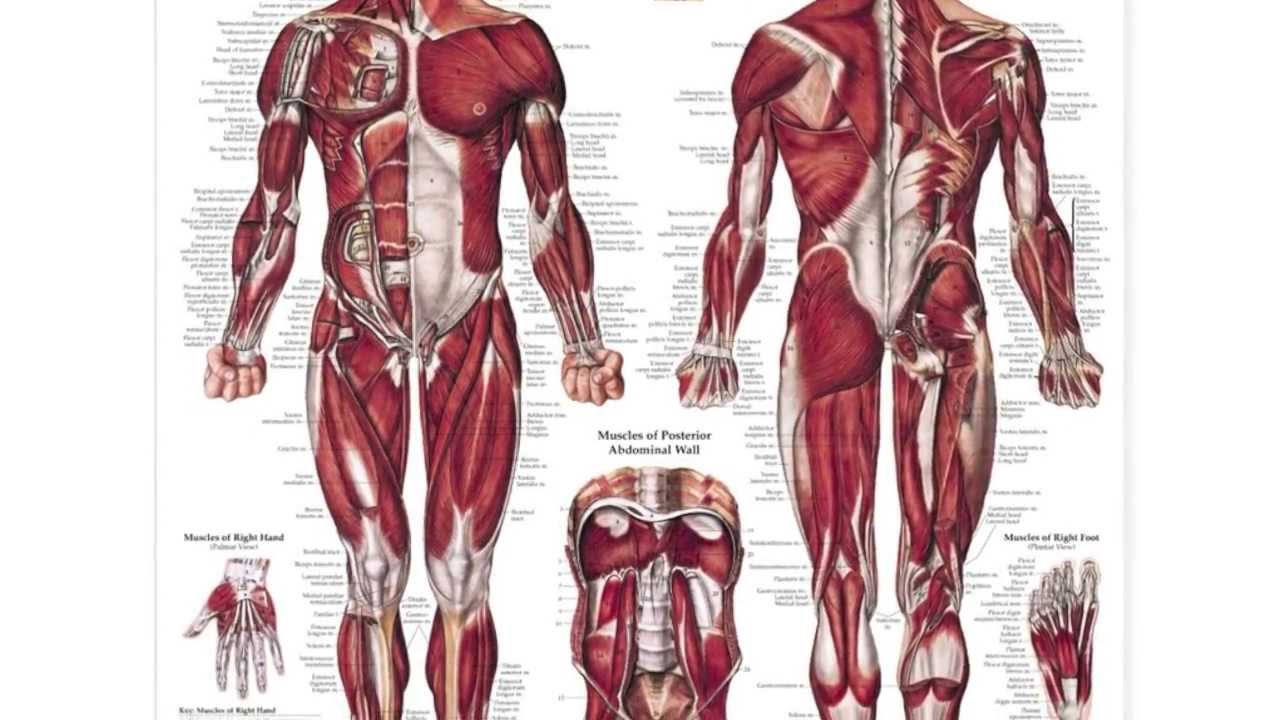
- Строение организма человека и функционирование его важнейших систем, клетки, ткани, органы, системы органов, части тела, полости тела, проявления заболеваний и травм.
- Гинекологические заболевания, менструальный цикл и контрацепция, обследование, особые симптомы и состояния, первая помощь и лечение гинекологических заболеваний в полевых условиях.
- Болезни сердца и легких, обследование, признаки тяжелого заболевания, причины, первая помощь и лечение болезней сердца и легких в полевых условиях.
Игольчатая ЭМГ нижних и верхних конечностей — МЦ «Нейродиагноз»
Игольчатая ЭМГ — метод регистрации спонтанной и произвольной активности мышечных волокон, применяемый для диагностики нервно-мышечных заболеваний
Игольчатая электромиография является одним их самых адекватных ЭМГ методов, дающих наиболее полную информацию и состоянии периферической нервно-мышечной системы. Основоположником метола игольчатой электромиографии является Ф. Бухтал (Вuchthal F., 1957). В нашей стране игольчатая электромиография получила использование и стала развиваться в 60-е годы XX века под руководством профессора Б.М. Гехта. В основе метода игольчатой электромиографии лежит исследование двигательных единиц скелетных мышц. На сегодняшний день игольчатая электромиография (ЭМГ) является неотъемлемым методом исследования не только в неврологии, но и в ревматологии и других областях медицины.
Основоположником метола игольчатой электромиографии является Ф. Бухтал (Вuchthal F., 1957). В нашей стране игольчатая электромиография получила использование и стала развиваться в 60-е годы XX века под руководством профессора Б.М. Гехта. В основе метода игольчатой электромиографии лежит исследование двигательных единиц скелетных мышц. На сегодняшний день игольчатая электромиография (ЭМГ) является неотъемлемым методом исследования не только в неврологии, но и в ревматологии и других областях медицины.
Мышца человека является функциональным целым, но подразделяется на структурно-функциональные элементы – двигательные единицы. Любое, даже минимальное напряжение мышцы связано с активностью двигательных единиц, определяющих все многообразие выполняемых человеком движений. Оценить состояние двигательных единиц скелетных мышц человека можно анализируя параметры генерируемых ими потенциалов (длительность, амплитуду, форму). Регистрация потенциалов двигательных единиц (ПДЕ) производится при минимальном произвольном сокращении мышцы с помощью одноразового игольчатого электрода, введенного в двигательную точку мышцы.
На определении параметров ПДЕ базируется игольчатая электромиография. Параметры ПДЕ отражают размеры и количество двигательных единиц, взаимное расположение мышечных волокон и плотность их распределения в каждой конкретной двигательной единице. Для оценки степени изменения длительности пользуются специальными таблицами, где полученная величина сравнивается со средней величиной соответствующей мышцы здорового человека такого же возраста.
Игольчатая электромиография (ИЭМГ) проводится одноразовыми электродами. Метод ИЭМГ наиболее информативен в диагностике первично-мышечных заболеваний (миопатии, миотонические расстройства, полимиозит, дерматомиозит, миопатические синдромы при эндокринной патологии и др.)
Опровергнуты представления о механизме утраты тонуса мышц
Долгое время физиологи были уверены,
что длительное снижение физической активности или утрата мышечного тонуса в
силу травм, болезней или иных естественных причин приводит к необратимой
атрофии мышц. Профессор Лоуренс М. Шварц (Lawrence M. Schwartz) из Университета Массачусетса опроверг эту
аксиому, сообщается
в журнале Frontiers in Physiology.
Профессор Лоуренс М. Шварц (Lawrence M. Schwartz) из Университета Массачусетса опроверг эту
аксиому, сообщается
в журнале Frontiers in Physiology.
Скелетные мышцы – уникальное формирование, их волокна состоят из наиболее крупных клеток в организме – синцитиев. Это гигантские многоядерные клетки, образующиеся в результате многочисленных слияний одноядерных клеток. Некоторые волокна могут достигать 600 мм в длину и в 100 000 раз превосходить по объему одноядерные клетки. Долгое время бытовала так называемая «гипотеза ядер мышечных клеток», согласно которой каждое ядро в синцитии поддерживало определенный максимальный объем цитоплазмы, а в процессе роста или атрофии волокон количество ядер изменялось соответственно. Но если рост волокна сопровождался включением дополнительных ядер из стволовых клеток, то однозначного ответа о том, что происходит с ядрами клеток мышц при атрофии, не было. Главенствовало представление об их утрате мышцами в результате апоптоза.
Несколько групп исследователей
недавно продемонстрировали, что уменьшение объема мышечной ткани характерное
для атрофии не сопровождается уменьшением числа ядер мышечных клеток. Для этого
Дадди и коллеги
в экспериментах in vitro изолировали мышечные волокна
мышей и содержали их в состоянии покоя в условиях приближенных к
физиологическим в течение 14 дней. Из изолированных волокон выделяли белковую
фракцию и оценивали изменение содержания белка с помощью флуоресцентной микроскопии
по количеству белка f-актина.
Ученые заметили, что его содержание уменьшается на 35 процентов в неделю. Количество
ядер в делящихся и покоящихся клетках проследили с помощью
иммуногистохимического окрашивания мышечных волокон. Оказалось, что при
уменьшении количества белка и, соответственно, объема мышечных волокон утраты
ядер мышечных клеток не происходит.
Для этого
Дадди и коллеги
в экспериментах in vitro изолировали мышечные волокна
мышей и содержали их в состоянии покоя в условиях приближенных к
физиологическим в течение 14 дней. Из изолированных волокон выделяли белковую
фракцию и оценивали изменение содержания белка с помощью флуоресцентной микроскопии
по количеству белка f-актина.
Ученые заметили, что его содержание уменьшается на 35 процентов в неделю. Количество
ядер в делящихся и покоящихся клетках проследили с помощью
иммуногистохимического окрашивания мышечных волокон. Оказалось, что при
уменьшении количества белка и, соответственно, объема мышечных волокон утраты
ядер мышечных клеток не происходит.
В более ранних исследованиях автора статьи, профессора Лоуренса Шварца, показаны аналогичные результаты. В качестве
модели в этих экспериментах использовались межсегментные мышцы табачного
бражника Manduca sexta. Эти гигантские мышцы обеспечивают способность
личинок бабочки ползать, но подвергаются программированной гормональной атрофии
с 15 по 18 день превращения личинки во взрослое насекомое. Проведя измерения
поперечных размеров волокон межсегментных мышц бражника, ученые обнаружили, что
потеря мышечной массы в ходе программируемой атрофии составила 49 процентов, но
количество ядер мышечных клеток осталось неизменным.
Проведя измерения
поперечных размеров волокон межсегментных мышц бражника, ученые обнаружили, что
потеря мышечной массы в ходе программируемой атрофии составила 49 процентов, но
количество ядер мышечных клеток осталось неизменным.
Противоположный процесс – появление дополнительных ядер в процессе роста мышц — был ранее неоднократно доказан. Чаще всего источником дополнительных ядер становится определенный тип стволовых клеток мышц – клетки-спутницы. Их слияние с волокнами скелетных мышц приводит к увеличению количества ядер, необходимому для поддержания метаболических нужд растущей мышцы и ее способности к сокращению.
Недавние наблюдения,
свидетельствующие о том, что даже при уменьшении объема скелетных мышц и их
атрофии, способность мышц к сохранению и восстановлению физической активности «депонируется»
представляют большое значение для здравоохранения. Фактически это обозначает
необходимость формирования новой культуры восприятия физической активности, прививаемой с
раннего детства, когда возможности для создания долговременного мышечного
ресурса оптимальны. Ресурс, приобретенный в детстве, способен продлить физическую
активность человека в зрелом возрасте и даже предотвратить инвалидизацию и
тяжелый ущерб здоровью, вызванный травмами, падениями и переломами.
Ресурс, приобретенный в детстве, способен продлить физическую
активность человека в зрелом возрасте и даже предотвратить инвалидизацию и
тяжелый ущерб здоровью, вызванный травмами, падениями и переломами.
Действие массажа на мышцы
В человеческом организме больше 400 скелетных мышц. На них приходится 30-40% общего веса. Все тело человека покрыто скелетной мускулатурой. Гармонично развитая и правильно расположенная мускулатура делает тело человека красивым. Скелетные мышцы подразделяются на мышцы конечностей (они составляют 80% от массы всех мышц), мышцы головы и мышцы туловища. Мышцы туловища делятся на мышцы затылка и спины (задние) и мышцы живота, груди, шеи (передние).
Состоят мышцы из мышечных волокон. Их главное свойство — сократимость и возбудимость.
Скелетная мышца передает сигналы в центральную нервную систему, поэтому её можно отнести к особенным органам чувств. Проходя через нервно-мышечное окончание на обратном пути нервный импульс вызывает возбуждение мышечного волокна, образуя в нем ацетилхолин.
Проходя через нервно-мышечное окончание на обратном пути нервный импульс вызывает возбуждение мышечного волокна, образуя в нем ацетилхолин.
При массаже образование ацетилхолина усиливается, что повышает общую работоспособность мышц, так как нервное возбуждение из одной клетки в другую передается быстрее. Экспериментальные исследования доказали, что после массажа работоспособность мышц увеличивается в пять — семь раз.
Достаточно сеанса массажа в течение 10 минут после большой физической нагрузки, чтобы не просто восстановить работоспособность мышц, но и повысить её. А все дело в том, что при массаже раздражение получают специальные макетные нервные волокна, которые располагаются в мышечном пучке. Одним из основных факторов является оборудование на котором его делают. Компания US MEDICA предлагает только высококачественные массажные столы.
В мышцах под действием массажа улучшаются окислительно-восстановительные процессы, кровообращение, увеличивается скорость удаления продуктов обмена, скорость доставки кислорода. Поэтому после сеанса массажа исчезает ощущение болезненности, одеревенелости и припухлости в мышцах.
Поэтому после сеанса массажа исчезает ощущение болезненности, одеревенелости и припухлости в мышцах.
Очень эффективен и массаж на массажном кресле. Современные модели позволяют сочетать несколько массажных воздействий, а также обладают такими функциями, как растяжка ножных и бедренных мышц вакуумный массаж воздушными подушками, трехмерный массаж рук, предплечий и плеч.
Такой способ воздействия, как круговой массаж, который предлагают массажные кресла, позволяет растянуть мышцы, которые поддерживают спину, что снижает давление на позвоночные диски. Подобный массаж способствует стимуляции спинномозговых нервов, так как он воздействует на нижнюю и верхнюю часть позвоночника. Благодаря этому существенно уменьшается мышечная боль в спине. Чем больше размер роллеров массажного кресла и шире область охвата, тем полезнее массаж для всего организма.
Такое массажное воздействие, как постукивание, улучшает кровообращение, снабжение клеток кислородом, увеличивается приток крови, уменьшается неподвижность мышц. В мышцах накапливается молочная кислота из-за чрезмерной физической нагрузки, а постукивание на массажном кресле помогает избежать данного накопления. Некоторые массажные кресла имеют режим до 500 постукиваний за минуту.
В мышцах накапливается молочная кислота из-за чрезмерной физической нагрузки, а постукивание на массажном кресле помогает избежать данного накопления. Некоторые массажные кресла имеют режим до 500 постукиваний за минуту.
Делайте регулярный массаж и вы забудете о мышечных болях.
Биоинженерные скелетные мышцы человека, способные к функциональной регенерации | BMC Biology
Ярвинен Т.А., Ярвинен М., Калимо Х. Регенерация поврежденных скелетных мышц после травмы. Мышцы Связки Сухожилия J. 2013; 3: 337–45.
PubMed Статья Google Scholar
Мауро А. Сателлитная клетка волокон скелетных мышц. J Biophys Biochem Cytol. 1961; 9: 493–5.
CAS PubMed PubMed Central Статья Google Scholar
Леппер С, Партридж Т.А., Веер СМ. Абсолютная потребность в pax7-положительных сателлитных клетках при регенерации скелетных мышц, вызванной острым повреждением. Разработка. 2011; 138: 3639–46.
Разработка. 2011; 138: 3639–46.
CAS PubMed PubMed Central Статья Google Scholar
Хинди С.М., Кумар А. TRAF6 регулирует самообновление и функцию сателлитных стволовых клеток во время регенеративного миогенеза. J Clin Invest. 2016; 126: 151–68.
PubMed Статья Google Scholar
Seale P, Sabourin LA, Girgis-Gabardo A, Mansouri A, Gruss P, Rudnicki MA. Pax7 необходим для спецификации миогенных сателлитных клеток. Клетка. 2000; 102: 777–86.
CAS PubMed Статья Google Scholar
Дюмон Н.А., Ван YX, Рудницкий М.А. Внутренние и внешние механизмы, регулирующие функцию сателлитных клеток. Разработка. 2015; 142: 1572–81.
CAS PubMed PubMed Central Статья Google Scholar
Тиан З.Л., Цзян С. К., Чжан М., Ван М., Ли Дж.Й., Чжао Р. и др. Обнаружение сателлитных клеток во время заживления ран скелетных мышц у крыс: зависимые от времени экспрессии Pax7 и MyoD в зависимости от возраста раны. Int J Legal Med. 2016; 130: 163–72.
К., Чжан М., Ван М., Ли Дж.Й., Чжао Р. и др. Обнаружение сателлитных клеток во время заживления ран скелетных мышц у крыс: зависимые от времени экспрессии Pax7 и MyoD в зависимости от возраста раны. Int J Legal Med. 2016; 130: 163–72.
PubMed Статья Google Scholar
Zammit PS. Функция миогенных регуляторных факторов Myf5, MyoD, Myogenin и MRF4 в скелетных мышцах, сателлитных клетках и регенеративном миогенезе.Semin Cell Dev Biol. 2017; 72: 19–32.
CAS PubMed Статья Google Scholar
Би П., Рамирес-Мартинес А., Ли Х., Каннавино Дж., Маканалли Дж. Р., Шелтон Дж. М. и др. Контроль мышечного образования с помощью миомиксера с микропептидами. Наука (80-). 2017; 356: 323–7.
CAS Статья Google Scholar
Quinn ME, Goh Q, Kurosaka M, Gamage DG, Petrany MJ, Prasad V, et al. Миомергер индуцирует слияние нефузогенных клеток и необходим для развития скелетных мышц. Nat Commun. 2017; 8: 1–9.
Миомергер индуцирует слияние нефузогенных клеток и необходим для развития скелетных мышц. Nat Commun. 2017; 8: 1–9.
Артикул CAS Google Scholar
Миллей Д.П., О’Рурк Дж. Р., Сазерленд Л. Б., Безпрозванная С., Шелтон Дж. М., Бассел-Дуби Р. и др. Миомакер — мембранный активатор слияния миобластов и формирования мышц. Природа. 2013; 499: 301–5.
CAS PubMed PubMed Central Статья Google Scholar
Джо А.В., Йи Л., Натараджан А., Ле Гранд Ф, Со Л., Ван Дж. И др. Повреждение мышцы активирует резидентные фибро / адипогенные предшественники, которые способствуют миогенезу. Nat Cell Biol. 2010; 12: 153–63.
CAS PubMed PubMed Central Статья Google Scholar
Уэдзуми А., Фукада С., Ямамото Н., Такеда С., Цучида К. Мезенхимальные предшественники, отличные от сателлитных клеток, способствуют образованию эктопических жировых клеток в скелетных мышцах. Nat Cell Biol. 2010; 12: 143–52.
Nat Cell Biol. 2010; 12: 143–52.
CAS PubMed Статья PubMed Central Google Scholar
Merly F, Lescaudron L, Rouaud T, Crossin F, Gardahaut MF. Макрофаги усиливают пролиферацию мышечных сателлитных клеток и задерживают их дифференцировку. Мышечный нерв. 1999; 22: 724–32.
CAS PubMed Статья PubMed Central Google Scholar
Summan M, Warren GL, Mercer RR, Chapman R, Hulderman T, Van Rooijen N, et al. Макрофаги и регенерация скелетных мышц: исследование истощения липосом, содержащих клодронат. Am J Physiol Regul Integr Comp Physiol. 2006; 290: R1488–95.
CAS PubMed Статья PubMed Central Google Scholar
Сегава М., Фукада Ситиро, Ямамото Ю., Яхаги Х., Канемацу М., Сато М. и др. Подавление функций макрофагов ухудшает регенерацию скелетных мышц с тяжелым фиброзом. Exp Cell Res 2008; 314: 3232–3244.
Exp Cell Res 2008; 314: 3232–3244.
Wosczyna MN, Konishi CT, Perez Carbajal EE, Wang TT, Walsh RA, Gan Q, et al. Мезенхимальные стромальные клетки необходимы для регенерации и поддержания гомеостаза скелетных мышц. Cell Rep. 2019; 27: 2029–2035.e5.
CAS PubMed PubMed Central Статья Google Scholar
Манн С.Дж., Пердигеро Э., Харраз Й., Агилар С., Пессина П., Серрано А.Л. и др.Аберрантное восстановление и развитие фиброза в скелетных мышцах. Скелетная мышца. 2011; 1:21.
PubMed PubMed Central Статья Google Scholar
Олсон Л.Е., Сориано П. Повышенная активация PDGFRalpha нарушает развитие соединительной ткани и вызывает системный фиброз. Dev Cell. 2009. 16: 303–13.
CAS PubMed PubMed Central Статья Google Scholar
Мюллер А. А., Ван Велтховен СТ, Фукумото К.Д., Чунг Т.Х., Рандо Т.А. Интронное полиаденилирование PDGFRα в резидентных стволовых клетках ослабляет мышечный фиброз. Nat Publ Gr. 2016; 540: 276–9.
А., Ван Велтховен СТ, Фукумото К.Д., Чунг Т.Х., Рандо Т.А. Интронное полиаденилирование PDGFRα в резидентных стволовых клетках ослабляет мышечный фиброз. Nat Publ Gr. 2016; 540: 276–9.
CAS Google Scholar
Fournier-Farley C, Lamontagne M, Gendron P, Gagnon DH. Детерминанты возвращения к игре после консервативного лечения травм подколенного сухожилия у спортсменов. Am J Sports Med. 2016; 44: 2166–72.
PubMed Статья Google Scholar
Роза ПЭ. Патология скелетных мышц, 2-е изд .: Карпентер С., Карпати Г. (140,00 фунтов стерлингов) Oxford University Press, 2001. ISBN 0 19 506364 3. Журнал клинической патологии. 2002; 55: 480.
Уэдзуми А., Ито Т., Морикава Д., Симидзу Н., Йонеда Т., Сегава М. и др. Фиброз и адипогенез происходят от общего мезенхимального предшественника в скелетных мышцах. J Cell Sci. 2011; 124 (Pt 21): 3654–64.
CAS PubMed Статья Google Scholar
Belmont PJ, McCriskin BJ, Sieg RN, Burks R, Schoenfeld AJ. Боевые раны в Ираке и Афганистане с 2005 по 2009 год. J Trauma Acute Care Surg. 2012; 73: 3–12.
PubMed Статья Google Scholar
Уитли Б.М., Хэнли М.Г., Вонг В.В., Сабино Д.М., Поттер Б.К., Тинтл С.М. и др. Гетеротопическая оссификация после переноса тканей при околосуставных травмах с боевыми потерями. Plast Reconstr Surg. 2015; 136: 808e – 14e.
CAS PubMed Статья Google Scholar
Wangensteen A, Tol JL, Witvrouw E, Van Linschoten R, Almusa E, Hamilton B и др. Повторные травмы подколенного сухожилия возникают в том же месте и сразу после возвращения в спорт. Am J Sports Med. 2016; 44: 2112–21.
PubMed Статья Google Scholar

Дхарм-Датта С., Макленаган Дж. Медицинские уроки, извлеченные из опыта США и Канады по лечению боевых раненых из Афганистана и Ирака. Армейский медицинский корпус JR. 2013; 159: 102–9.
PubMed Статья Google Scholar
Фреклтон Г., Пиццари Т. Факторы риска травмы подколенного сухожилия в спорте: систематический обзор и метаанализ. Br J Sports Med. 2013; 47: 351–8.
PubMed Статья Google Scholar
Фиоре Д., Джадсон Р.Н., Лоу М., Ли С., Чжан Э., Хопкинс С. и др. Фармакологическая блокировка экспансии фибро / адипогенных предшественников и подавление регенеративного фиброгенеза связаны с нарушением регенерации скелетных мышц.Stem Cell Res. 2016; 17: 161–9.
CAS PubMed Статья PubMed Central Google Scholar
Lemos DR, Babaeijandaghi F, Low M, Chang C-K, Lee ST, Fiore D, et al. Нилотиниб снижает мышечный фиброз при хроническом мышечном повреждении, способствуя TNF-опосредованному апоптозу фибро / адипогенных предшественников. Nat Med. 2015; 21: 786–94.
CAS PubMed Статья Google Scholar
Agarwal S, Cholok D, Loder S, Li J, Breuler C, Chung MT, et al. Ингибирование mTOR и передача сигналов BMP действуют синергетически, уменьшая мышечный фиброз и улучшая регенерацию миофибрилл. JCI Insight. 2016; 1: 1–12.
Артикул Google Scholar
ЕС. Директива 2010/63 / ЕС Европейского парламента и Совета от 22 сентября 2010 г. о защите животных, используемых в научных целях. Off J Eur Union. 2010; Л 276: 20.
Google Scholar
Russell WMS, Burch RL, Hume CW. Принципы гуманной экспериментальной техники; 1959.
Google Scholar
Агилар-Агон К.В., Кейпел А.Дж., Мартин Н.Р.У., игрок DJ, Льюис М.П. Механическая нагрузка стимулирует гипертрофию тканевых скелетных мышц: молекулярные и фенотипические реакции. J. Cell Physiol. 2019; 234: 23547–58.
CAS PubMed PubMed Central Статья Google Scholar
Agrawal G, Aung A, Varghese S. Скелетные мышцы на чипе: модель in vitro для оценки образования тканей и повреждений. Лабораторный чип. 2017; 17: 3447–61.
CAS PubMed PubMed Central Статья Google Scholar
Моримото Ю., Оноэ Х., Такеучи С. Биогибридный робот, питаемый антагонистической парой тканей скелетных мышц. Научный робот. 2018; 3: eaat4440.
Артикул Google Scholar
Хуанг Ю.С., Деннис Р.Г., Ларкин Л., Баар К. Быстрое формирование функциональных мышц in vitro с использованием фибриновых гелей. J Appl Physiol. 2005; 98: 706–13.
PubMed Статья Google Scholar
Ванденбург Х. Х., Карлиш П., Фарр Л. Поддержание высококонтрактильных тканевых культивированных скелетных миотрубок птиц в коллагеновом геле. In vitro Cell Dev Biol. 1988. 24: 166–74.
CAS PubMed Статья PubMed Central Google Scholar
Xu B, Zhang M, Perlingeiro RCR, Shen W. Конструкции скелетных мышц, созданные из миогенных предшественников эмбриональных стволовых клеток человека, демонстрируют повышенные сократительные силы при дифференцировке в среде, содержащей добавки EGM-2. Adv Biosyst. 2019; 1
5: 1–11.
Google Scholar
Maffioletti SM, Sarcar S, Henderson ABH, Mannhardt I., Pinton L, Moyle LA, et al. Трехмерные искусственные скелетные мышцы человека, полученные на основе ИПСК, моделируют мышечные дистрофии и обеспечивают многолинейную тканевую инженерию.Cell Rep. 2018; 23: 899–908.
CAS PubMed PubMed Central Статья Google Scholar
Рао Л., Цянь Ю., Ходабукус А., Рибар Т., Бурзак Н. Конструирование плюрипотентных стволовых клеток человека в функциональную ткань скелетных мышц. Nat Commun. 2018; 9: 1–12.
Артикул CAS Google Scholar
Madden L, Juhas M, Kraus WE, Truskey GA, Bursac N.Биоинженерные человеческие миобондлы имитируют клиническую реакцию скелетных мышц на лекарства. Элиф. 2015; 4: e04885.
PubMed PubMed Central Статья Google Scholar
Кейпел А.Дж., Римингтон Р.П., Флеминг Дж.В., Плеер Диджей, Бейкер Л.А., Тернер М.К. и др. Масштабируемые 3D-печатные формы для скелетных мышц, сконструированных из человеческих тканей. Фронт Bioeng Biotechnol. 2019; 7:20.
PubMed PubMed Central Статья Google Scholar
Ходабукус А., Мэдден Л., Прабху Н.К., Ковес Т.Р., Джекман С.П., Муойо Д.М. и др. Электростимуляция увеличивает гипертрофию и метаболический поток в тканевых скелетных мышцах человека. Биоматериалы. 2018; 2019 (198): 259–69.
Google Scholar
Бакушли М.А., Липпманн Э.С., Малкахи Б., Айер Н., Нгуен С.Т., Тунг К. и др. 3D-модель культуры иннервируемых скелетных мышц человека позволяет исследовать нервно-мышечные соединения взрослых.Элиф. 2019; 8: 1–29.
Google Scholar
Флеминг Дж. У., Кейпел А. Дж., Римингтон Р. П., Плейер DJ, Штолзинг А., Льюис М. П.. Функциональная регенерация тканеинженерных скелетных мышц in vitro зависит от включения белков базальной мембраны. Цитоскелет. 2019; 76: 371–82.
CAS PubMed Статья Google Scholar
Юхас М., Энгельмайр GCJ, Фонтанелла А.Н., Палмер Г.М., Бурзак Н.Биомиметически сконструированные мышцы, способные к интеграции сосудов и функциональному созреванию in vivo. Proc Natl Acad Sci U S. A. 2014; 111: 5508–13.
CAS PubMed PubMed Central Статья Google Scholar
Джухас М., Абуталеб Н., Ван Дж. Т., Йе Дж., Шейх З., Сриворарат С. и др. Включение макрофагов в сконструированные скелетные мышцы способствует усиленной регенерации мышц. Nat Biomed Eng. 2018; 2: 942–54.
CAS PubMed PubMed Central Статья Google Scholar
Tiburcy M, Markov A, Kraemer LK, Christalla P, Rave-Fraenk M, Fischer HJ, et al. Регенерация компетентных ниш сателлитных клеток в скелетных мышцах крыс. FASEB BioAdvances. 2019; 1: 731–46.
CAS PubMed PubMed Central Статья Google Scholar
Джухас М., Абуталеб Н., Ван Дж. Т., Йе Дж., Шейх З., Сриворарат С. и др. Включение макрофагов в сконструированные скелетные мышцы способствует усиленной регенерации мышц.Nat Biomed Eng. 2018; 2: 942-54.
Харди Д., Беснар А., Латиль М., Джувион Дж., Бриан Д., Тепенье С. и др. Сравнительное исследование моделей травм для изучения регенерации мышц у мышей. PLoS One. 2016; 11: e0147198.
PubMed PubMed Central Статья CAS Google Scholar
Раджабиан Н., Асмани М., Шахини А., Видиам К., Чоудхури Д., Нгуен Т. и др. Биоинженерные скелетные мышцы как модель старения и регенерации мышц.Tissue Eng Part A. 2020; впереди печати.
Брэди М.А., Льюис М.П., Мудера В. Синергия между миогенными и немиогенными клетками в трехмерной тканевой конструкции черепно-лицевой скелетной мускулатуры. J Tissue Eng Regen Med. 2008; 2: 408–17.
CAS PubMed Статья PubMed Central Google Scholar
Afshar ME, Abraha HY, Bakooshli MA, Davoudi S, Zandstra PW, Gilbert PM. 96-луночная платформа для культивирования позволяет проводить продольный анализ прочности микротканей скелетных мышц человека.Sci Rep. 2020; 10: 1–16.
Артикул CAS Google Scholar
Мартин НРВ, Пасси С.Л., Плеер Диджей, Мудера В., Баар К., Гринсмит Л. и др. Формирование нервно-мышечных соединений в тканеинженерных скелетных мышцах усиливает сократительную функцию и улучшает организацию цитоскелета. Tissue Eng Часть A. 2015; 21: 2595–604.
CAS PubMed PubMed Central Статья Google Scholar
Jiwlawat S, Lynch E, Glaser J, Smit-Oistad I, Jeffrey J, Van Dyke JM и др. Дифференциация и образование саркомеров в скелетных миоцитах, полученных непосредственно из индуцированных человеком плюрипотентных стволовых клеток с использованием сферической культуры. Дифференциация. 2017; 96: 70–81.
CAS PubMed PubMed Central Статья Google Scholar
Shaban S, El-Husseny MWA, Abushouk AI, Salem AMA, Mamdouh M, Abdel-Daim MM. Влияние антиоксидантных добавок на выживаемость и дифференцировку стволовых клеток.Oxidative Med Cell Longev. 2017, ID статьи 5032102, 16 страниц ..
Сайни А., Руллман Э., Лилия М., Мандич М., Мелин М., Олссон К. и др. Асимметричные клеточные ответы в первичных миобластах человека с использованием сывороток различного происхождения и спецификации. PLoS One. 2018; 13: 1–16.
Google Scholar
Wu YJ, Fang YH, Chi HC, Chang LC, Chung SY, Huang WC, et al. Инсулин и LiCl синергетически спасают миогенную дифференцировку сверхэкспрессированных миобластов FoxO1.PLoS One. 2014; 9, e88450.
Bloise FF, Cordeiro A, Ortiga-Carvalho TM. Роль гормона щитовидной железы в физиологии скелетных мышц. J Endocrinol. 2018; 236: R57–68.
PubMed Статья Google Scholar
Muscat GEO, Mynett-johnson L, Dowhan D, Downes M, Griggs R. Активация транскрипции гена myoD 3,5,3′-трийод-L-тиронином: прямая роль гормона щитовидной железы и рецепторы ретиноидов X. Nucleic Acids Res.1994; 22: 583–91.
CAS PubMed PubMed Central Статья Google Scholar
Доунс М., Григгс Р., Аткинс А., Олсон Э. Н., Маскат ГЕО. Идентификация элемента ответа на гормон щитовидной железы в гене миогенина мыши: характеристика гетеродимерного сайта связывания гормона щитовидной железы и рецептора ретиноида X. Рост клеток различается. 1993; 4: 901–10.
CAS PubMed Google Scholar
Ким Й.Дж., Тамадон А., Пак Х.Т., Ким Х., Ку С-Й. Роль половых стероидных гормонов в патофизиологии и лечении саркопении. Osteoporos Sarcopenia. 2016; 2: 140–55.
PubMed PubMed Central Статья Google Scholar
Браун Т.П., Маркс ДЛ. Регулирование мышечной массы эндогенными глюкокортикоидами. Front Physiol. 2015; 6: 1–12.
Артикул Google Scholar
Das M, Rumsey JW, Bhargava N, Gregory C, Riedel L, Kang JF и др. Разработка новой модели дифференцировки скелетных мышц на бессывороточной культуре клеток путем систематического изучения роли различных факторов роста в формировании мышечной трубки. In vitro Cell Dev Biol Anim. 2009. 45: 378–87.
CAS PubMed PubMed Central Статья Google Scholar
Yablonka-Reuveni Z, Rivera AJ. Временная экспрессия регуляторных и структурных мышечных белков во время миогенеза сателлитных клеток на изолированных волокнах взрослых крыс.Dev Biol. 1994; 164: 588–603.
CAS PubMed PubMed Central Статья Google Scholar
Клегг CH, Linkhart TA, Olwin BB, Hauschka SD. Контроль фактора роста дифференцировки скелетных мышц: обязательство к терминальной дифференцировке происходит в фазе G1 и подавляется фактором роста фибробластов. J Cell Biol. 1987; 105: 949–56.
CAS PubMed Статья Google Scholar
Аллен Р.Э., Додсон М.В., Луитен Л.С. Регулирование пролиферации сателлитных клеток скелетных мышц фактором роста фибробластов гипофиза крупного рогатого скота. Exp Cell Res. 1984; 152: 154–60.
CAS PubMed Статья Google Scholar
Lexell J, Taylor CC. Вариабельность площадей мышечных волокон в четырехглавой мышце человека: эффекты увеличения возраста. J Anat. 1991; 174: 239–49.
CAS PubMed PubMed Central Google Scholar
Snow MH. Распределение сателлитных клеток в камбаловидной мышце взрослой мыши. Анат Рек. 1981; 201: 463–9.
CAS PubMed Статья Google Scholar
Lindström M, Tjust AE, Domellöf FP. Pax7-позитивные клетки / сателлитные клетки в экстраокулярных мышцах человека. Исследование Ophthalmol Vis Sci. 2015; 56: 6132–43.
Артикул Google Scholar
Macaluso F, Brooks NE, Niesler CU, Myburgh KH.На расширение пула сателлитных клеток влияют характеристики скелетных мышц. Мышечный нерв. 2013; 48: 109–16.
CAS PubMed Статья Google Scholar
Moss FP, Leblond CP. Клетки-сателлиты как источник ядер в мышцах растущих крыс. Анат Рек. 1971; 170: 421–35.
CAS PubMed Статья Google Scholar
Куанг С., Курода К., Ле Гранд Ф, Рудницки М.А.Асимметричное самообновление и обязательство сателлитных стволовых клеток в мышцах. Клетка. 2007; 129: 999–1010.
CAS PubMed PubMed Central Статья Google Scholar
Куанг С., Гиллеспи М.А., Рудницки М.А. Регулирование ниши самообновления и дифференцировки мышечных сателлитных клеток. Стволовая клетка клетки. 2008; 2: 22–31.
CAS PubMed Статья Google Scholar
Линь Л., Шен К., Ленг Х, Дуан Х, Фу Х, Ю. С. Синергетическое ингибирование образования эндохондральной кости путем подавления Hif1α и Runx2 при гетеротопической оссификации, вызванной травмой. Mol Ther. 2011; 19: 1426–32.
CAS PubMed PubMed Central Статья Google Scholar
Dammone G, Karaz S, Lukjanenko L, Winkler C, Sizzano F, Jacot G, et al. PPARγ контролирует эктопический адипогенез и перекрестно взаимодействует с миогенезом во время регенерации скелетных мышц.Int J Mol Sci. 2018; 19: 1–17.
Артикул CAS Google Scholar
Сингх Дж., Верма Н.К., Канзагра С.М., Кейт Б.Н., Дей К.С. Измененная экспрессия PPARγ ингибирует миогенную дифференцировку в клетках скелетных мышц C2C12. Mol Cell Biochem. 2007; 294: 163–71.
CAS PubMed Статья Google Scholar
Римингтон Р., Кейпел А.Дж., Флеминг Дж., Игрок Д., Мудера В., Джонс Дж. И др.Съемная вставка 50 мкл FDM. 2018; https://doi.org/10.17028/rd.lboro.6969707.v1.
Google Scholar
Hayot M, Michaud A, Koechlin C, Caron MA, LeBlanc P, Préfaut C, et al. Микробиопсия скелетных мышц: валидационное исследование минимально инвазивной техники. Eur Respir J. 2005; 25: 431–40.
CAS PubMed Статья PubMed Central Google Scholar
Illa I, Леон-Монзон М, Далакас MC. Регенерирующие и денервированные мышечные волокна и сателлитные клетки человека экспрессируют молекулу адгезии нервных клеток, распознаваемую моноклональными антителами к естественным клеткам-киллерам. Энн Нейрол. 1992; 31: 46–52.
CAS PubMed Статья PubMed Central Google Scholar
Римингтон Р.П., Кейпел А.Дж., Кристи СДР, Льюис М.П. Биосовместимые полимеры, напечатанные на 3D-принтере: моделирование методом слитого осаждения, прямой клеточный фенотип C2C12 in vitro.Лабораторный чип. 2017; 17: 2982–93.
CAS Статья Google Scholar
Morton AB, Norton CE, Jacobsen NL, Fernando CA, Cornelison DDW, Segal SS. Хлорид бария повреждает миофибриллы посредством протеолиза, индуцированного кальцием, с фрагментацией двигательных нервов и микрососудов. Скелетная мышца. 2019; 9: 1–10.
Артикул CAS Google Scholar
Schindelin J, Arganda-Carreras I, Frize E, Kaynig V, Longair M, Pietzsch T., et al.Фиджи: платформа с открытым исходным кодом для анализа биологических изображений. Nat Meth. 2012; 9: 676–82.
CAS Статья Google Scholar
Schmittgen TD, Livak KJ. Анализ данных ПЦР в реальном времени методом сравнительной КТ. Nat Protoc. 2008; 3: 1101–8.
CAS PubMed Статья PubMed Central Google Scholar
Клетки скелетных мышц человека (SkMC)
Первичные клетки скелетных мышц человека (SkMC) выделяют из различных скелетных мышц (например,грамм. Musculus pectoralis major) от взрослых одиночных доноров (информация об источниках для конкретной партии предоставляется по запросу). Они положительны для саркомерного миозина и отрицательны для α-актина, специфичного для гладких мышц.
Новые клетки скелетных мышц происходят из покоящихся сателлитных клеток, которые расположены в мышечных волокнах между базальной пластинкой и сарколеммой. Покоящиеся сателлитные клетки активируются такими раздражителями, как повреждение мышц. После активации клетки, которые теперь называются миобластами, начинают размножаться и сливаться с поврежденными мышечными волокнами или друг с другом, образуя новые мышечные трубки.
SkMC оптимальны для исследований мышц in vitro. Они очень хорошо размножаются в богатой митогенами среде для роста клеток скелетных мышц PromoCell. Слияние с мышечными трубками типичных многоядерных синцитий можно вызвать с помощью среды для дифференцировки клеток скелетных мышц PromoCell.
НОВИНКА: наши SkMC теперь также доступны от доноров с типом HLA.
Доступные форматы:
- Криоконсервировано: криогенный флакон, содержащий 500 000 жизнеспособных клеток.
- Распространяется:> 500.000 жизнеспособных клеток отправили в питательную среду (колба Т25).
- Осадок клеток: 1 миллион клеток растворяют в 200 мкл RNAlater © для последующего анализа РНК, ДНК или белка. Клеточные гранулы не могут быть восстановлены.
| Рекомендуемая плотность покрытия | 3500 — 7000 ячеек на см 2 |
|---|---|
| Прохождение после оттаивания | P2 |
| Протестированные маркеры | Положительный саркомерный миозин, испытана способность к дифференцировке многоядерных синцитий |
| Гарантированное удвоение численности населения | > 15 |
3D-модель культуры иннервируемых скелетных мышц человека позволяет проводить исследования нервно-мышечного соединения у взрослых
Рецензентысчитают, что авторы предоставляют убедительные доказательства использования трехмерных мышечных культур.Хотя рукопись вызывает всеобщее восхищение, были подняты два основных вопроса. 1) Насколько легко применить эту технику? Было упомянуто, что читателям будет полезно более прозрачное обсуждение метода, описывающее сложные этапы и подводные камни, которые приводят к его неудачам / успеху. 2) Дополнительные доказательства для описания статуса созревания НМС. Требуется ли активность для созревания мышечных волокон?
Ниже приведены основные моменты, которые следует учитывать. Эти моменты получают больше контекста в отдельных комментариях рецензента.
1) Насколько легко принять этот метод? Предоставьте информацию о простоте адаптации и технических препятствиях, которые имеют решающее значение для успеха.
Мы благодарим рецензентов за возможность предоставить более подробную информацию о нашем личном опыте использования этого метода и платформы совместной культуры. Действительно, эта информация является ключевой для обеспечения широкого внедрения, наряду с нашими активными усилиями по размещению лабораторий со всего мира для практического обучения.Теперь мы предоставляем дополнительную информацию в Материалах и методах, а также подробно останавливаемся на технических препятствиях и указателях адаптации системы в Обсуждении.
См. Также подробный ответ рецензенту №1.
2) Дополнительные данные для определения зрелости НМС:
— Авторы должны окрашивать отдельные НМС в своей 3D-системе антителами против других белков (например, рапсина, MuSK), которые они изучают в массовых культурах. Получают ли они более полно сформированные НСС?
— Есть ли разница в НМС между двумя системами при более подробном исследовании на уровне отдельных НМС (что может быть выполнено с помощью окрашивания антителом вместе с α-бунгаротоксином)?
Для решения этой проблемы мы создали культуры и выполнили иммуноокрашивание на двух- и трехмерных мышечных культурах, а также на двух- и трехмерных совместных культурах нервно-мышечных клеток.Мы не наблюдали каких-либо примеров кластеров AChR, совместно локализующихся с белками рапсина или MuSK в наших 2D мышечных или нервно-мышечных культурах (Рисунок 2 — рисунок в приложении 2C).
Мы наблюдали единичный случай совместной локализации белка MuSK с кластером AChR в наших трехмерных культурах только с мышцами (рис. 2 — приложение к рисунку 2D) и отсутствие случаев совместной локализации рапсина с кластерами AChR в наших трехмерных культурах только с мышцами.
Для сравнения, распространенность рапсина и MuSK, совместно локализующихся с кластерами AChR, окрашенными бунгаротоксином, была значительно выше в совместных культурах нервно-мышечной системы 3D.Показаны два репрезентативных примера, в которых мы наблюдали совместную локализацию белков рапсина (фигура 2D) и MuSK (фигура 2 — приложение к рисунку 2E) с нейритами MN в окрашенных бунгаротоксином кластерных сайтах AChR. Однако мы отмечаем, что не все кластеры AChR совместно локализованы с MuSK и рапсином в трехмерных нейромышечных сокультурах в экспериментальную временную точку, которую мы оценивали (день 12).
— Кураре блокирует всю активность?
Мы используем 25 мкМ d-тубокурарина в нашей системе.При этой концентрации мы наблюдаем более 99% блокирования изменений переходных процессов в мышечных волокнах после глутаматной стимуляции мотонейронов. Это согласуется с результатами Ko et al., 2019, когда они наблюдали полный блок при 50 мкМ. Кроме того, мы не наблюдаем изменения транзиентов кальция в обработанных d-тубокурарином (25 мкМ) миофибриллах, стимулированных 100 мкМ ACh (данные не показаны), что демонстрирует эффективность блокирования d-тубокурарина при этой концентрации. Эти данные согласуются с предыдущими отчетами (Madden et al., 2015) с использованием аналогичной концентрации кураре и недавней работы нашей лаборатории, депонированной на BioRxiv (https://doi.org/10.1101/562819). Теперь мы говорим об этом и ссылаемся на эти цитаты в тексте.
— Увеличение частоты EPP не очевидно. Авторы должны применять TTX к культурам, чтобы хотя бы различать EPP и mEPPS. Видят ли авторы потенциалы действия до применения глутамата?
Как (правильно) упомянули все рецензенты, мы столкнулись с проблемами при выполнении электрофизиологических записей.Мы действительно создали совместные нейромышечные культуры, чтобы решить эту проблему, но в конце концов столкнулись с техническими препятствиями, которые помешали сбору данных. Поскольку протокол требует 5 недель от начала до конца, мы столкнулись с некоторым давлением при сборе данных в двухмесячном окне, но мы все же попытались. Как было предложено всеми рецензентами, теперь мы разъясняем в Обсуждении проблемы, связанные с выполнением электронного физического воспитания в культуре, и предлагаем предложения по адаптации методов для будущих пользователей, которые хотят выполнять электронное физическое лечение в этой системе.
Мы обновили текст, чтобы точно отразить имеющиеся у нас данные. В частности, мы никогда не наблюдали спонтанной активности в трехмерных записях одних мышц (рис. 1 — приложение к рисунку 3E), тогда как было обычным явлением фиксировать спонтанную активность в трехмерных нейромышечных совместных культурах (рис. 3 — приложение к рисунку 2C). Теперь мы предполагаем (а не делаем вывод), что эти спонтанные потенциалы эндогенных концевых пластинок (EPP) вызываются спонтанным высвобождением ACh из окончаний аксонов моторных нейронов в НМС, и в Обсуждении мы подтверждаем, что без проведения исследований блокирования мы не можем сделайте этот вывод окончательно.Хотя наш анализ показал изменение частоты EPP, вызванное глутаматом, мы понимаем, что полученный след был менее чем удовлетворительным. Теперь мы предоставляем более репрезентативные кривые, которые мы собрали в ходе исследований, направленных на регистрацию вызванных потенциалов с помощью e-Phys (Рисунок 3 — приложение к рисунку 2C). В Обсуждении мы признаем, что без проведения блокирующих исследований мы не можем сделать этот вывод окончательно.
События, подобные потенциалу действия, наблюдались только после стимуляции глутаматом.Теперь мы отмечаем это в разделе «Результаты».
3) Есть ли уроки, которые можно извлечь из трехмерных культур, которые могут быть применены для улучшения двухмерных культур? Если у авторов есть данные, которые могут быть включены в двухмесячный период проверки, сделайте это. Если нет, то рукопись выиграет от обсуждения этого вопроса.
Теперь мы рассмотрим этот момент в нашем Обсуждении. См. Соответствующий текст ниже.
Основываясь на нашем сравнительном анализе, основным преимуществом системы трехмерного культивирования является способность поддерживать сократительную способность созревающих миофибрилл, которые затем являются идеальным шаблоном для иннервации двигательных нейронов уже через 12 дней дифференцировки.Кроме того, миофибриллы образуют упакованные и выровненные структуры в 3D-системе, что не наблюдается в стандартных 2D-культурах пластических культур тканей.
Таким образом, мы ожидаем, что сосредоточение усилий на модификации 2D-культур для контроля микросреды способами, которые могут приспособить сократимость миофибрилл и выравнивание миофибрилл, может привести к формированию функциональных НМС in vitro в более ранние моменты времени и, возможно, даже поддержать novo от эмбриона к взрослому переключается в типе субъединицы AChR. Действительно, недавний отчет Ко и его коллег (Ko et al., 2019), работа с миобластами и нервными клетками грызунов подчеркивает роль топографии матрикса и выравнивания миофибрилл, поскольку это связано с эффективностью иннервации в 2D-культуре, хотя требуется более сравнительный анализ, чтобы понять, как этот тип подхода влияет на формирование НМС человека в культуре по сравнению с к трехмерной системе совместного культивирования.
Рецензент № 1:
[…] У меня есть одна просьба к авторам, которая связана с тем, что сообщение на вынос — это простота метода.И хотя данные подтверждают это мнение, я бы попросил рецензентов предоставить дополнительную информацию (в комментариях или данных) о том, в чем заключаются ограничения или трудности в этом методе. Например, какова повседневная изменчивость между нервно-мышечными образцами или разница между блюдами? Есть ли единообразие во времени / образцах / экспериментаторе?
По сути, любому, кто использует этот метод, было бы полезно, если бы они понимали ограничения и возможные препятствия.
Мы благодарим рецензента за выделение этого момента.Здесь мы приводим дополнительные сведения, чтобы решить проблему технических проблем и воспроизводимости. Мы добавили текст в Материалы и методы, чтобы дать советы по успеху. Мы также расширяем технические ограничения и предлагаем модификации, которые повысят удобство использования системы.
1) В то время как протокол мышечной культуры постоянно дает мышечные ткани, использование липучки в качестве опорных точек не является идеальным. Приклеивание липучки к каждой стороне углубления для культивирования занимает много времени и требует некоторой практики.В некоторых случаях, например, если застежки-липучки сломаны и / или ослаблены, трехмерная мышечная ткань может разорваться на ранней стадии. В результате пользователь должен тщательно оценить качество опорных точек, чтобы гарантировать успешное формирование и поддержание мышечной ткани. Чтобы преодолеть эту техническую проблему, мы разработали и изготовили 96-луночный планшет, который обеспечивает воспроизводимое массовое производство мышечных микротканей in vitro, в котором используются отклоняющиеся резиновые штифты, отлитые непосредственно в планшет в качестве опорных точек «сухожилий», а не липучки (BioRxiv ,: https: // doi.org / 10.1101 / 562819).
2) Проблемы, связанные с определением плюрипотентных стволовых клеток к клону моторных нейронов, могут задержать запланированные эксперименты. Это особое препятствие, учитывая, что текущие протоколы спецификации мотонейронов рассчитаны на 2-3 недели. Общие проблемы включают вариабельность от партии к партии и / или ограниченный срок хранения факторов дифференциации двигательных нейронов (ретиноевой кислоты, пурморфамина, звукового ежа и DAPT), которые могут иметь значительное влияние на успех протокола дифференциации двигательных нейронов.Начальная плотность посева клеток-предшественников Olig2 + также влияет на формирование кластеров мотонейронов и выходы дифференцировки. Таким образом, потенциальным адаптерам необходимо тестировать каждую новую партию факторов дифференциации, а также обеспечивать согласованные критерии посева клеток-предшественников для обеспечения высоких выходов дифференцировки. Наконец, следует отметить, что чрезмерный сдвиг клеток Olig2 + при оттаивании и посеве снижает эффективность дифференцировки на последующих этапах.
3) Протокол совместного культивирования основан на сборе отдельных кластеров двигательных нейронов для смешивания с мышечными клетками-предшественниками, как описано в материалах и методах.Это выгодно, так как позволяет пользователю собрать определенное количество кластеров одинакового размера, свободных от любых загрязняющих недифференцированных клеток. Однако этот этап очень трудоемок и ограничивает производительность при совместном культивировании тканей. Таким образом, будущая работа, направленная на определение протоколов для ферментативного сбора кластеров с последующим пошаговым процессом деформации для поддержки высокой пропускной способности сбора кластеров двигательных нейронов одинакового размера, необходима.
4) Чтобы обеспечить легкое изготовление нервно-мышечных тканей для совместного культивирования, кластеры двигательных нейронов смешивают непосредственно с гидрогелевой смесью, содержащей одноядерные мышечные клетки-предшественники.Хотя это позволяет легко изготавливать нервно-мышечные ткани, этот процесс исключает контроль над конечной локализацией кластеров двигательных нейронов по мере формирования нервно-мышечных тканей. Таким образом, близость кластеров двигательных нейронов друг к другу и степень иннервации в тканях совместного культивирования могут немного варьироваться от одной ткани к другой.
5) По сравнению с трехмерными мышечными тканями, мы наблюдали большую сократительную активность в нейромышечных сокультурах, что, как мы ожидаем, связано со спонтанным возбуждением клеток двигательных нейронов, присутствующих в совместных культурах.Основываясь на литературе, мы предполагаем, что более высокая активность мышечных волокон, индуцированная двигательными нейронами, способствует более высокому сократительному созреванию мышечных волокон в наших совместных культурах (в соответствии с предыдущими отчетами Akaaboune et al., 1999; Andreose et al., 1993; Caroni). et al., 1993; Skorpen et al., 1999), но, в свою очередь, также приводили к более высокому уровню разрывов мышц в совместных культурах. Основываясь на недавнем отчете (Cvetkovic et al., 2017), в котором подчеркивается влияние протеаз плазмина, катепсина L, MMP-2 и MMP-9 на продолжительность жизни мышечной ткани in vitro, мы предлагаем дополнительно использовать ряд ингибиторов протеаз. к ACA, может помочь предотвратить спад нервно-мышечной совместной культуры, вызванный сокращением.
6) Как правило, анализ на уровне отдельного волокна требует от пользователя разработки инструментов или адаптации протокола для улучшения выполнимости. Например, электрофизиологические записи в системе совместного культивирования возможны, но очень сложны по ряду причин. Во-первых, спонтанные или индуцированные сокращения мышечной ткани в трехмерных нейромышечных сокультурах часто приводили к потере контакта пипетки с клеточной мембраной во время записи. В результате регистрация того момента, когда глутамат добавляется в культуральную ванну в качестве метода стимуляции, который вызывает движение ткани за счет одновременного сокращения множества мышечных волокон (как показано на видео 7), была чрезвычайно сложной и, как таковая, была успешной только в нескольких случаях, так как сообщается в рукописи.Однако эту проблему можно решить, выполняя целенаправленную стимуляцию одиночных мотонейронов с помощью электрической или нейротрансмиттерной стимуляции, или путем стимуляции синим светом в случае моторных нейронов, генетически модифицированных для экспрессии светочувствительного канала (например, канала родопсина). Кроме того, сложно определить иннервируемые мышечные волокна. Использование флуоресцентно меченных мышечных клеток (например, GCaPM6 +, закрепленный на мембране флуорофор) и клеток двигательного нейрона (например, HB9-GFP, mCherry, нейрофиламент-GFP) значительно повысит вероятность успеха в идентификации иннервируемых мышечных волокон в трехмерных нейромышечных сокультурах.Примечательно, что трехмерная природа системы совместного культивирования снижает частоту поломки пипеток, которая часто встречается при исследованиях мышечных трубок, культивируемых из пластика. Однако, без дополнительного созревания миотрубок посредством режимов сокращения или иным образом, следует отметить, что мышечные трубки в культуре несколько меньше, чем у взрослых животных, что может вызвать некоторые трудности при регистрации. Другие типы анализа отдельных волокон или отдельных молекул, такие как иммуноокрашивание или покадровая микроскопия для отслеживания отдельной субъединицы рецептора ацетилхолина, более сложны в 3D по сравнению с 2D-культивированием, но вполне осуществимы.
Рецензент № 2:
В статье Бакушли и др. представляет новую систему для изучения развития мышц человека, формирования нервно-мышечных соединений (НМС) и, возможно, нервно-мышечных расстройств. Статья довольно обширна и в основном написана довольно хорошо. Я думаю, что он подходит для eLife и должен быть опубликован после соответствующих исправлений.
Мы благодарим рецензента за признание ценности и качества нашей работы.
У меня есть три общих комментария и несколько конкретных вопросов, подробно описанных ниже.
Во-первых, у авторов есть убедительные данные, иллюстрирующие различия в скорости развития мышц. Можно ли извлечь какие-либо уроки (см. Также ниже) из 3D, которые можно было бы применить к 2D-культурам?
Теперь мы рассмотрим этот момент в нашем Обсуждении. См. Соответствующий текст ниже.
Основываясь на нашем сравнительном анализе, основным преимуществом системы трехмерного культивирования является способность поддерживать сократительную способность созревающих миофибрилл, которые затем являются идеальным шаблоном для иннервации двигательных нейронов уже через 12 дней дифференцировки.Кроме того, миофибриллы образуют упакованные и выровненные структуры в 3D-системе, что не наблюдается в стандартных 2D-культурах пластических культур тканей.
Таким образом, мы ожидаем, что сосредоточение усилий на модификации 2D-культур для контроля микросреды способами, которые могут приспособить сократимость миофибрилл и выравнивание миофибрилл, может привести к формированию функциональных НМС in vitro в более ранние моменты времени и, возможно, даже поддержать novo от эмбриона к взрослому переключается в типе субъединицы AChR. Действительно, недавний отчет Ко и его коллег (Ko et al., 2019), работа с миобластами и нервными клетками грызунов подчеркивает роль топографии матрикса и выравнивания миофибрилл, поскольку это связано с эффективностью иннервации в 2D-культуре, хотя требуется более сравнительный анализ, чтобы понять, как этот тип подхода влияет на формирование НМС человека в культуре по сравнению с к трехмерной системе совместного культивирования.
Во-вторых, в то время как авторы проделали замечательную работу по сравнению своих новых 3D-систем с более традиционными 2D-системами (всегда сложно сделать честно, поскольку всегда существует явное предпочтение между одним и другим.автор), они должны попытаться объективно представить преимущества И недостатки 3D. Во-первых, мне не ясно, насколько легко систему, описанную в этой рукописи, можно было бы внедрить в лаборатории, не связанной с инженерией. Было бы полезно получить руководство по ее использованию или план будущих разработок, которые сделают эту систему более рутинной.
Платформа для культивирования системы 3D требует лазерного гравера (резака) для подготовки форм в форме собачьей кости для изготовления резиновых каналов в стандартном 12-луночном планшете.В противном случае не требуется специального оборудования или ноу-хау. Подробная экспериментальная процедура изготовления платформы представлена в разделе «Материалы и методы» раздела «Изготовление пресс-формы PDMS для трехмерной культуры мышечной ткани человека».
Многие из измерений авторов производятся на «массовых» культурах, меньше — на отдельных волокнах или отдельных НМС. Так что, безусловно, одним из недостатков может быть то, что 2D действительно упрощает некоторые из этих задач (многие из моих вопросов, перечисленных ниже, относятся к тому, что можно наблюдать на одном уровне волокна в 3D, а некоторые требуют дополнительных простых экспериментов.)
В то время как мы подчеркиваем преимущества 3D-культуры по сравнению с традиционной 2D-системой в нашей рукописи, рецензент, несомненно, прав в том, что некоторые аспекты исследования мышц более просты, когда они проводятся в 2D-культуре. Например, анализ изображений часто проще выполнять в 2D-системах.
Другой проблемой наших трехмерных исследований совместного культивирования, как мы подробно остановились выше, было определение местоположения отдельных волокон для электрофизиологических записей.Использование флуоресцентно меченых клеток поможет решить эту проблему и упростит анализ отдельных волокон в 3D-системе. Кроме того, локальная стимуляция двигательных нейронов с использованием электрических, химических или оптогенетических методов, в отличие от добавления глутамата непосредственно в ванну (как это сделано в наших исследованиях), смягчит проблемы движения тканей, которые часто сопровождали потерянные возможности записи.
Несмотря на эти проблемы, важно отметить, что развитие образования НМС — это длительный процесс, который, по определению, включает образование сократительных миофибрилл и кластеризацию AChR.Следовательно, для изучения формирования функциональных НМС у взрослых необходима 2D- или 3D-система, способная поддерживать миофибриллы и созревание сократительной способности.
Мой последний общий комментарий заключается в том, что лечение миастении кажется почти ненужным дополнением. Было ли это сделано для сравнения нынешней системы с той, которую использовали Steinbeck et al., 2016?
Мы подтверждаем и понимаем этот комментарий о нашей работе с миастенией. Как и следовало ожидать, эти эксперименты были включены, чтобы успокоить предыдущего рецензента.Мы согласны с тем, что это существенно не добавляет к основному сообщению рукописи, но поскольку он демонстрирует легкость моделирования аутоиммунного заболевания НМС в системе культивирования in vitro уже через 14 дней дифференциации, мы предпочитаем, чтобы работа оставалась в рукописи.
https://doi.org/10.7554/eLife.44530.033Скелетная мышца человека: фазовый тип электростимуляции увеличивает ее сократительную скорость.
Brown, M.D .; Коттер, M.A .; Гудличка, О.; Врбова, Г. Влияние различных моделей мышечной активности на плотность капилляров, механические свойства и структуру медленных и быстрых мышц кролика. Pflugers Arch. 361: 241–250; 1976.
Статья CAS PubMed Google Scholar
Buller, A.J .; Eccles, J.C .; Экклс, Р. Взаимодействия между мотонейронами и мышцами в отношении характерных скоростей их ответов. J. Physiol. (Лондон) 156: 417–439; 1960 г.
Google Scholar
Burke, R.E. Типы моторных единиц: Функциональная специализация в управлении моторами. Trends Neurosci. 3: 255–258; 1980.
Google Scholar
Donselaar, Y .; Eerbeek, O .; Kernell, D .; Верхей, Б.А. Размеры волокон и характеристики гистохимического окрашивания в нормальной и хронически стимулированной быстрой мышце кошки. J. Physiol. (Лондон) 382: 237–254; 1987 г.
CAS Google Scholar
Edgerton, V.R .; Smith, J.L .; Симпсон, Д. Популяции типов мышечных волокон мышц ног человека. Histochem. J. 7: 259–266; 1975.
Статья CAS PubMed Google Scholar
Haekkinen, K .; Коми, П.В .; Ален, М. Влияние силовых тренировок взрывного типа на изометрическую силу и время релаксации, электромиографические характеристики и характеристики мышечных волокон мышц-разгибателей ног.Acta Physiol. Сканд. 125: 587–600; 1985.
Google Scholar
Henatsch, H.D .; Лангер, Х.Х. Основы нейрофизиологии двигательных навыков в спорте: обзор. Int. J. Sports Med. 6: 2–14; 1985.
CAS PubMed Google Scholar
Henneman, E .; Олсон, К. Б. Отношения между структурой и функцией в конструкции скелетных мышц. J. Neurophysiol. 28: 581–598; 1965 г.
CAS PubMed Google Scholar
Hennig, R .; Ломо, Т. Способы активации двигательных единиц у нормальных крыс. Nature 314: 164–166; 1985.
Статья CAS PubMed Google Scholar
Hennig, R .; Ломо, Т. Влияние хронической стимуляции на размер и скорость длительно денервированных и иннервируемых быстрых и медленных скелетных мышц крыс. Acta Physiol.Сканд. 130: 115–131; 1987.
CAS PubMed Google Scholar
Hudlicka, O .; Brown, M .; Коттер, М; Smith, M .; Врбова, Г. Влияние длительной стимуляции быстрых мышц на их кровоток, обмен веществ и способность противостоять утомлению. Pflugers Arch. 369: 141–149; 1977.
CAS PubMed Google Scholar
Kernell, D .; Eerbeek, O .; Верхей, Б.А .; Донселаар, Ю. Влияние физиологических количеств высокоскоростной и низкоскоростной хронической стимуляции на быстро сокращающиеся мышцы задней конечности кошки. I. Скоростные и силовые свойства. J. Neurophysiol. 58: 598–613; 1987.
CAS PubMed Google Scholar
Kernell, D .; Donselaar, Y .; Eerbeek, O. Влияние физиологических количеств высокоскоростной и низкоскоростной хронической стимуляции на быстро сокращающиеся мышцы задней конечности кошки. II. Свойства, связанные с выносливостью.J. Neurophysiol. 58: 614–627; 1987.
CAS PubMed Google Scholar
Ломо, Т .; Вестгаард, Р.Х. Сократительные свойства мышц: контроль по типу мышечной активности у крысы. Proc. R. Soc. Лондон. B187: 99–103; 1974.
CAS PubMed Google Scholar
Pette, D .; Muller, W .; Leisner, E .; Врбова, Г. Зависящие от времени эффекты на сократительные свойства, популяцию волокон, легкие цепи миозина и ферменты энергетического метаболизма в периодически и непрерывно стимулируемых быстро сокращающихся мышцах кролика.Pflugers Arch. 364: 103–112; 1976.
Статья CAS PubMed Google Scholar
Pette, D .; Ramirez, B.U .; Muller, W .; Саймон, Р .; Exner, G.U .; Хильдебранд, Р. Влияние прерывистой долгосрочной стимуляции на сократительные, гистохимические и метаболические свойства популяций волокон в быстрых и медленных мышцах кролика. Pflugers Arch. 361: 1–7; 1975.
Статья CAS PubMed Google Scholar
Pette, D .; Smith, M.E .; Staudte, H.W .; Врбова, Г. Влияние длительной электростимуляции на некоторые сократительные и метаболические характеристики быстрых мышц кролика. Pflugers Arch. 338: 257–272; 1973.
Статья CAS PubMed Google Scholar
Pette, D .; Врбова, Г. Нейронный контроль фенотипической экспрессии в мышечных волокнах млекопитающих. Muscle Nerve 8: 676–689; 1985.
Статья CAS PubMed Google Scholar
Salmons, S. Функциональная адаптация скелетных мышц. Trends Neurosci. 3: 134–137; 1980.
Статья Google Scholar
Лосось, S .; Сретер Ф.А. Значение импульсной активности в преобразовании типа скелетных мышц. Nature 263: 30–34; 1976.
Статья CAS PubMed Google Scholar
Лосось, S .; Врбова, Г. Влияние активности на некоторые сократительные характеристики быстрых и медленных мышц млекопитающих.J. Physiol. (Лондон) 201: 535–549; 1969.
CAS Google Scholar
Staudte, H.W .; Exner, G.U .; Петте, Д. Влияние краткосрочных тренировок высокой интенсивности (спринт) на некоторые сократительные и метаболические характеристики быстрых и медленных мышц крысы. Pflugers Arch. 344: 159–168; 1973.
Статья CAS PubMed Google Scholar
Vrbová, G.Влияние активности двигательных нейронов на скорость сокращения поперечно-полосатой мышцы. J. Physiol. (Лондон) 169: 513–526; 1963.
Google Scholar
Врбова Г. Факторы, определяющие скорость сокращения поперечно-полосатой мышцы. Физиологическое общество 25/26: 17–18; 1966.
Google Scholar
Разработка и применение микрофизиологических систем скелетных мышц человека
К числу основных болезненных состояний относятся скелетные мышцы, включая диабет 2 типа, мышечную дистрофию, саркопению и кахексию, возникающие в результате рака или сердечных заболеваний.Животные не точно представляют многие из этих болезненных состояний. Микрофизиологические системы скелетных мышц человека, полученные из первичных или индуцированных плюрипотентных стволовых клеток (hPSC), могут предоставить in vitro модель генетических и хронических заболеваний и оценить индивидуальные вариации. Системы трехмерных культур более точно представляют функцию скелетных мышц, чем двумерные культуры. В то время как биопсия мышц позволяет культивировать первичные мышечные клетки, чПСК дают возможность взять образцы более широкой популяции доноров.Недавние достижения, способствующие созреванию скелетных мышц, происходящих из PSC, представляют собой альтернативу первичным клеткам. Хотя сократительную функцию часто измеряют в трехмерных культурах, и существует несколько систем для характеристики сокращения небольшого количества мышечных волокон, существует потребность в функциональных измерениях метаболизма, подходящих для микрофизиологических систем. Дальнейшие исследования должны быть направлены на создание хорошо дифференцированных мышечных клеток, производных от hPSC, обеспечивающих восстановление мышц in vitro и улучшение моделей заболеваний.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй еще раз?Количественное определение коллагена в скелетных мышцах человека
AbstractВнутримышечная соединительная ткань обеспечивает структурную стабильность и облегчает передачу силы в скелетных мышцах.Кроме того, он содержит внеклеточный матрикс, который имеет решающее значение для развития и регенерации мышц¹. Изменения содержания коллагена во внутримышечной соединительной ткани были связаны со старением или болезнью мышц ², ³. Данных об исходном содержании коллагена в различных мышцах, чтобы обеспечить более глубокое понимание нормальных мышечных функций, не существует. Следовательно, целью настоящего исследования является количественная оценка содержания коллагена в сотне скелетных мышц, чтобы выяснить внутренние специализированные функциональные роли скелетных мышц.Биопсии мышц были взяты из 6 свежих трупов (n = 599). Анализ гидроксипролина выполняли для определения содержания коллагена в мышечных образцах, измеренного в мкг коллагена на мг мышцы. Различия в среднем содержании коллагена анализировали в мышечных областях и по мышечным функциям. Кроме того, предыдущие данные об архитектуре мышц использовались для изучения корреляции между содержанием коллагена и архитектурными свойствами мышц ⁵⁻¹⁰. Результаты настоящего исследования продемонстрировали значительные различия в среднем содержании коллагена в мышцах в разных регионах, но отсутствие корреляции между содержанием коллагена и архитектурными свойствами мышц.Среднее содержание коллагена было высоким в туловище, а также в верхних и нижних конечностях. В областях, прилегающих к туловищу, было низкое содержание коллагена, а в областях между туловищем и конечностями — промежуточное содержание коллагена.
Основное содержаниеЗагрузить PDF для просмотра Увеличить
Больше информации Меньше информации
Закрывать
Введите пароль, чтобы открыть этот PDF-файл:
Отмена ОК
Подготовка документа к печати…
Отмена
Журнал исследований силы и кондиционирования
Что вы по профессии? Academic MedicineAcute Уход NursingAddiction MedicineAdministrationAdvanced Практика NursingAllergy и ImmunologyAllied здоровьеАльтернативная и комплементарной MedicineAnesthesiologyAnesthesiology NursingAudiology & Ear и HearingBasic ScienceCardiologyCardiothoracic SurgeryCardiovascular NursingCardiovascular SurgeryChild NeurologyChild PsychiatryChiropracticsClinical SciencesColorectal SurgeryCommunity HealthCritical CareCritical Уход NursingDentistryDermatologyEmergency MedicineEmergency NursingEndocrinologyEndoncrinologyForensic MedicineGastroenterologyGeneral SurgeryGeneticsGeriatricsGynecologic OncologyHand SurgeryHead & Neck SurgeryHematology / OncologyHospice & Паллиативная CareHospital MedicineInfectious DiseaseInfusion Сестринское делоВнутренняя / Общая медицинаВнутренняя / Лечебная ординатураБиблиотечное обслуживание Материнское обслуживание ребенкаМедицинская онкологияМедицинские исследованияНеонатальный / перинатальный неонатальный / перинатальный уходНефрологияНеврологияНейрохирургияМедицинско-административное сестринское дело ecialtiesNursing-educationNutrition & DieteticsObstetrics & GynecologyObstetrics & Gynecology NursingOccupational & Environmental MedicineOncology NursingOncology SurgeryOphthalmology / OptometryOral и челюстно SurgeryOrthopedic NursingOrthopedics / Позвоночник / Спорт Медицина SurgeryOtolaryngologyPain MedicinePathologyPediatric SurgeryPediatricsPharmacologyPharmacyPhysical Медицина и RehabilitationPhysical Терапия и женщин Здоровье Физическое TherapyPlastic SurgeryPodiatary-generalPodiatry-generalPrimary Уход / Семейная медицина / Общие PracticePsychiatric Сестринское делоПсихиатрияПсихологияОбщественное здравоохранениеПульмонологияРадиационная онкология / ТерапияРадиологияРевматологияНавыки и процедурыСонотерапияСпорт и упражнения / Тренировки / ФитнесСпортивная медицинаХирургический уходПереходный уходТрансплантационная хирургияТерапия травмТравматическая хирургияУрологияЖенское здоровье Уход за ранами
Что ваша специальность? Addiction MedicineAllergy & Clinical ImmunologyAnesthesiologyAudiology & Speech-Language PathologyCardiologyCardiothoracic SurgeryCritical Уход MedicineDentistry, Oral Surgery & MedicineDermatologyDermatologic SurgeryEmergency MedicineEndocrinology & MetabolismFamily или General PracticeGastroenterology & HepatologyGenetic MedicineGeriatrics & GerontologyHematologyHospitalistImmunologyInfectious DiseasesInternal MedicineLegal / Forensic MedicineNephrologyNeurologyNeurosurgeryNursingNutrition & DieteticsObstetrics & GynecologyOncologyOphthalmologyOrthopedicsOtorhinolaryngologyPain ManagementPathologyPediatricsPlastic / Восстановительная SugeryPharmacology & PharmacyPhysiologyPsychiatryPsychologyPublic, Окружающая среда и гигиена трудаРадиология, ядерная медицина и медицинская визуализацияФизическая медицина и реабилитация Респираторная / легочная медицинаРевматологияСпортивная медицина / наукаХирургия (общая) Хирургия травмТоксикологияТрансплантационная хирургияУрологияСосудистая хирургияВироло у меня нет медицинской специальности
Где вы работаете? Больница на 250 коекБольница на более 250 коекУправление престарелыми или хоспис Психиатрическое или реабилитационное учреждениеЧастная практикаГрупповая практикаКорпорация (фармацевтика, биотехнология, инженерия и т.


